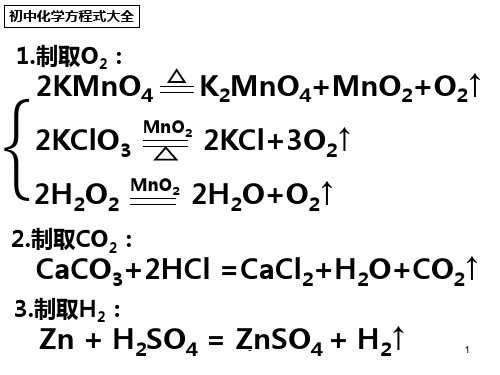
八年级考试必会化学方程式
初中必须掌握的化学方程式90条

2KMnO4=△K2MnO4+MnO2+O2↑2H2O2=MnO22H2O+O2↑2KClO3=△MnO22KCl+3O2↑CaCO3+2HCl=CaCl2+H2O+CO2↑Zn+H2SO4=ZnSO4+H2↑4P+5O2=点燃2P2O5S+O2=点燃SO24Al+3O2=2Al2O33Fe+2O2=点燃Fe3O42Cu+O2=△2CuO2Mg+O2=点燃2MgO2Hg+O2=△2HgO2H2+O2=点燃2H2OS+O2=点燃SO22CO+O2=点燃2CO2C+O2(充足)=点燃CO22C+O2(不充足)=点燃2CO2HgO=△2Hg+O2↑CH4+2O2=点燃CO2+2H2O 252点燃22实验室制取气体有氧气参加的反应H2CO3=H2O+CO2↑NH4HCO3=△NH3↑+H2O+CO2↑2HgO=△2Hg+O2↑Cu2(OH)2CO3=△2CuO+H2O+CO2↑CaCO3=高温CaO+CO2↑2H2O=通电2H2↑+O2↑Fe+H2SO4=FeSO4+H2↑Mg+H2SO4=MgSO4+H2↑2Al+3H2SO4=Al2(SO4)3+3H2↑Zn+2HCl=ZnCl2+H2↑Fe+2HCl=FeCl2+H2↑Mg+2HCl=MgCl2+H2↑2Al+6HCl=2AlCl3+3H2↑2Al+3CuSO4=Al2(SO4)3+3Cu Fe+CuSO4=FeSO4+Cu Zn+CuSO4=ZnSO4+Cu Cu+Hg(NO3)2=Cu(NO3)2+Hg Cu+2AgNO3=Cu(NO3)2+2AgCO2+C=高温2CO3CO+Fe2O3=高温2Fe+3CO24CO+Fe3O4=高温3Fe+4CO2分解反应金属与酸反应置换反应还原反应3C+2Fe 2O 3=高温4Fe+3CO 2↑ 2C+Fe 3O 4=高温3Fe+2CO 2↑ Fe 2O 3+3H 2=△2Fe+3H 2O Fe 3O 4+4H 2=△3Fe+4H 2O 2CuO+C =高温2Cu+CO 2↑ CuO+CO =△Cu+CO 2CuO+H 2=△Cu+H 2O 2Al+Fe 2O 3=高温2Fe+Al 2O 3 2Mg+CO 2=点燃2MgO+C 4Na+3CO 2=点燃2Na 2CO 3+C Fe 2O 3+6HCl =2FeCl 3+3H 2O Fe 2O 3+3H 2SO 4=Fe 2(SO 4)3+3H 2O CuO+2HCl =CuCl 2+H2O CuO+H 2SO 4=CuSO 4+H 2O MgO+H 2SO 4=MgSO 4+H 2O MgO+2HCl =MgCl 2+H 2O CaO+2HCl =CaCl 2+H 2O CaO+H 2SO 4=CaSO 4↓+H 2O CO 2+H 2O =H 2CO 3 2Na+2H 2O =2NaOH+H 2↑ CaO+H 2O =Ca(OH)2 Na 2O+H 2O =2NaOH SO 3+H 2O =H 2SO 4 氧化物与酸反应 还原反应与水化合CuSO4+5H2O=CuSO4·5H2O CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 H2SO4+2NaOH=Na2SO4+2H2O H2SO4+2KOH=K2SO4+2H2OH2SO4+Cu(OH)2=CuSO4+2H2O 3H2SO4+2Fe(OH)3=Fe2(SO4)3+6H2OHNO 3+NaOH=NaNO3+H2O CaCO3+2HCl=CaCl2+H2O+CO2↑Na2CO3+2HCl=2NaCl+H2O+CO2 AgNO3+HCl=AgCl↓+HNO3Na2CO3+H2SO4=Na2SO4+H2O+CO2↑Na2CO3+Ca(OH)2=CaCO3↓+2NaOH3NaOH+FeCl3=Fe(OH)3↓+3NaCl NaCl+AgNO3=AgCl↓+NaNO32NaOH+CO2=Na2CO3+H2O2NaOH+SO2=Na2SO3+H2O2NaOH+SO3=Na2SO4+H2OCa(OH)2+CO2=CaCO3↓+H2OCa(OH)2+SO2=CaSO3↓+H2OHCl+NaOH=NaCl+H2OHCl+KOH=KCl+H2O2HCl+Cu(OH)2=CuCl2+2H2O2HCl+Ca(OH)2=CaCl2+2H2O3HCl+Fe(OH)3=FeCl3+3H2O3HCl+Al(OH)3=AlCl3+3H2O其它酸碱盐反应。
初中必背100个化学方程式

一、必背化学方程式1.红磷燃烧 4P + 5O2 点燃 2P2O52.镁条燃烧 2Mg + O2 点燃 2MgO3.木炭完全燃烧 C + O2 点燃 CO24.木炭不完全燃烧 2C + O2 点燃 2CO5.一氧化碳作燃料2CO + O2 点燃 2CO26.铁丝在氧气中燃烧3Fe + 2O2 点燃 Fe3O47.硫粉燃烧 S + O2 点燃 SO28.氢气燃烧 2H2 + O2 点燃 2H2O9.天然气(甲烷CH4)完全燃烧 CH4 + 2O2 点燃 CO2 + 2H2O10.高锰酸钾制氧气 2KMnO4 △ K2MnO4 + MnO2 + O2↑11.双氧水在二氧化锰催化作用下制氧气 2H2O2 2H2O + O2↑12.氯酸钾制氧气 2KClO3 2KCl + 3O2↑13.实验室制备二氧化碳CaCO3 + 2HCl CaCl2 + H2O + CO2↑14.用澄清石灰水检验二氧化碳 Ca(OH)2 + CO2 CaCO3 ↓+ H2O15.二氧化碳能使紫色石蕊试液变红 H2O + CO2 H2CO316.碳酸不稳定受热易分解 H2CO3 △ H2O + CO2 ↑17.电解水2H2O 通电 2H2↑+ O2↑18.铝的自我保护 4Al + 3O2 2Al2O3(致密)19.铜制炊具加热变黑2Cu + O2 △ 2CuO20.镁和稀盐酸反应 Mg + 2HCl MgCl2 + H2↑21.铝和稀盐酸反应 2Al + 6HCl 2AlCl3 + 3H2↑22.锌和稀盐酸反应 Zn + 2HCl ZnCl2 + H2↑23.铁和稀盐酸反应 Fe + 2HCl FeCl2 + H2↑24.镁和稀硫酸反应 Mg + H2SO4 MgSO4 + H2↑25.铝和稀硫酸反应 2Al + 3H2SO4 Al2(SO4)3 + 3H2↑26.实验室制氢气(锌和稀硫酸反应)Zn + H2SO4 ZnSO4 + H2↑27.铁和稀硫酸反应 Fe + H2SO4 FeSO4 + H2↑28.湿法炼铜(曾青得铁则化为铜) Fe + CuSO4 FeSO4 + Cu29.铜和硝酸银溶液反应 Cu + 2AgNO3 Cu(NO3)2 + 2Ag30.锌和氯化亚铁溶液反应 Zn + FeCl2 ZnCl2 + Fe31.一氧化碳还原氧化铁 3CO + Fe2O3 高温 2Fe +3CO232.一氧化碳还原四氧化三铁4CO + Fe3O4 高温 3Fe +4CO233. 工业炼铁焦炭作用(1)提供热源,维持炉温 C + O2 点燃 CO2(2)制造还原剂 C + CO2 高温 2CO二、化合物与氧气的反应1、一氧化碳在氧气中燃烧:2CO+O2点燃2CO22、甲烷在空气中燃烧:CH4+2O2点燃CO2+2H2O3、酒精在空气中燃烧:C2H5OH+3O2点燃2CO2+3H2O三、金属与氧气反应方程式1、镁在空气中燃烧:2Mg+O2点燃2MgO2、铁在氧气中燃烧:3Fe+2O2点燃Fe3O43、铜在空气中受热:2Cu+O2加热2CuO4、铝在空气中形成氧化膜:4Al+3O2=2Al2O3四、与盐酸有关的化学方程式1、NaOH+HCl==NaCl+H2O现象:不明显。
八年级考试必会化学方程式

MnO 2△MnO 2初中化学方程式大全一、 氧气的性质:(1)单质与氧气的反应:(化合反应) 镁在空气中燃烧:2Mg + O 2点燃2MgO铁在氧气中燃烧:3Fe + 2O 2 点燃Fe 3O 4 铜在空气中受热:2Cu + O 2△2CuO 铝在空气中燃烧:4Al + 3O 2点燃2Al 2O 3 氢气中空气中燃烧:2H 2 + O 2 点燃2H 2O红磷在空气中燃烧 4P + 5O 2 点燃2P 2O 5 硫粉在空气中燃烧: S + O 2点燃SO 2碳在氧气中充分燃烧:C + O 2点燃CO 2碳在氧气中不充分燃烧:2C + O 2 点燃2CO(2)化合物与氧气的反应: 一氧化碳燃烧2CO + O 2 点燃2CO 2甲烷燃烧CH 4 + 2O 2点燃CO 2 + 2H 2O酒精燃烧C 2H 5OH+3O 2 点燃2CO 2+3H 2O(3)氧气的来源:玻义耳研究空气的成分:HgO Hg+ O 2↑ 高锰酸钾制氧气2KMnO4+K2MnO4 MnO2+O2↑过氧化氢制氧气2H 2O 2 2H 2O+ O 2↑氯酸钾制氧气2K ClO 3 2K Cl+3O 2↑电解水 2H 2O通电2H 2↑+O 2 ↑△生石灰溶于水:CaO + H2O == Ca(OH)2二氧化碳可溶于水:H2O + CO2==H2CO3二、质量守恒定律:镁燃烧2Mg + O2点燃 2MgO铁和硫酸铜溶液Fe+CuSO4==FeSO4+Cu 氢气还原氧化铜H2+CuO△Cu+H2O镁还原氧化铜Mg+CuO △ Cu + MgO 三、碳和碳的氧化物:(1)碳的化学性质碳充分燃烧:C + O2点燃CO2炭还原氧化铜C+2CuO高温2Cu + CO2↑炭还原氧化铁3C+2Fe2O3高温4Fe+3CO2↑(2)煤炉中发生的三个反应:(化合反应)煤炉的底层:C + O2点燃 CO2煤炉的中层:CO2 + C 高温 2CO煤炉的上部蓝色火焰2CO+O2点燃2CO2(3)二氧化碳的制法与性质:实验室制二氧化碳CaCO3 + 2HCl == CaCl2 + H2O + CO2↑碳酸分解H2CO3 == H2O + CO2↑二氧化碳溶于水H2O + CO2== H2CO3工业制二氧化碳CaCO3高温CaO + CO2↑石灰水与二氧化碳反应鉴别二氧化碳:Ca(OH)2 + CO2 === CaCO3↓+ H2O(4)一氧化碳的性质:一氧化碳还原氧化铜CO+CuO△Cu+CO2一氧化碳的可燃性2CO+O2点燃2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑四、燃料及其利用:酒精在空气中燃烧C2H5OH+3O2点燃2CO2+3H2O(1)金属与氧气反应:镁在空气中燃烧:2Mg + O2点燃2MgO铁在氧气中燃烧:3Fe + 2O2点燃 Fe3O4铜在空气中受热:2Cu + O2△ 2CuO铝在空气中形成氧化膜4Al+3O2=2Al2O3(标注成红色的必会)三常见混合物的重要成分四常见物质俗称五物质的检验1、氧气:带火星的木条放入瓶中,若木条复燃,燃起火:上红下蓝,则是氧气.2、氢气:在玻璃尖嘴点燃气体,罩一干冷小烧杯,观察杯壁是否有水滴,往烧杯中倒入澄清的石灰水,若不变浑浊,则是氢气.3、二氧化碳:通入澄清的石灰水,若变浑浊则是二氧化碳.但二氧化碳过量浑浊的石灰水又会变回澄清。
八年级化学方程式总汇

八年级化学方程式总汇1.镁在空气中燃烧:2Mg + O 2 点燃 2MgO2.铁在氧气中燃烧:3Fe + 2O 2 点燃 Fe 3O 43.氢气中空气中燃烧:2H 2 + O 2 点燃 2H 2O4.红磷在空气中燃烧:4P + 5O 2 点燃 2P 2O 55.硫粉在空气中燃烧: S + O 2 点燃 SO 26.碳在氧气中充分燃烧:C + O 2 点燃 CO 27.碳在氧气中不充分燃烧:2C + O 2 点燃 2CO8.一氧化碳在氧气中燃烧:2CO + O 2 点燃 2CO 29.甲烷在空气中燃烧:CH 4 + 2O 2 点燃 CO 2 + 2H 2O10.酒精在空气中燃烧:C 2H 5OH + 3O 2 点燃 2CO 2 + 3H 2O11.水在直流电的作用下分解:2H 2O 通电 2H 2↑+ O 2 ↑12.过氧化氢分解:2H 2O 2 二氧化锰 2H 2O+ O 2 ↑13.加热氯酸钾(有少量的二氧化锰):2KClO 3 2 ↑ 14.加热高锰酸钾:2KMnO 4 加热 K 2MnO 4 + MnO 2215.大理石与稀盐酸反应:CaCO 3 + 2HCl === CaCl 2 + H 2O + CO 2↑16.高温煅烧石灰石:CaCO 3 高温 CaO + CO 2↑17.生石灰溶于水:CaO + H 2O === Ca(OH)218.消石灰放在空气中变质:Ca(OH)2 + CO 2 ==== CaCO 3 ↓+ H 2O19.二氧化碳溶解于水:CO 2 + H 2O === H 2CO 320.碳酸不稳定而分解:H2CO3 === H2O + CO2↑八年级化学方程式总汇1.镁在空气中燃烧:2.铁在氧气中燃烧:3.氢气中空气中燃烧:4.红磷在空气中燃烧:5.硫粉在空气中燃烧:6.碳在氧气中充分燃烧:7.碳在氧气中不充分燃烧:8.一氧化碳在氧气中燃烧:9.甲烷在空气中燃烧:10.酒精在空气中燃烧:11.水在直流电的作用下分解:12.过氧化氢分解:13.加热氯酸钾(有少量的二氧化锰):14.加热高锰酸钾:15.大理石与稀盐酸反应:16.高温煅烧石灰石:17.生石灰溶于水:18.消石灰放在空气中变质:19.二氧化碳溶解于水:20.碳酸不稳定而分解:。
初中必背化学方程式汇总(最全)整理

初中必背化学方程式汇总(最全)整理学校必背化学方程式汇总(最全)中学的阶段中,学校生要想学好化学,总是免不得要娴熟的把握化学方程式,为了便利大家学习借鉴,下面我细心预备了学校必背化学方程式汇总内容,欢迎使用学习!学校必背化学方程式汇总1化合反应1、镁在空气中燃烧:2Mg + O2 点燃2MgO现象:(1)发出刺眼的白光(2)放出热量(3)生成白色粉末2、铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O4现象:(1)猛烈燃烧,火星四射(2)放出热量(3)生成一种黑色固体留意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底。
4、铜在空气中受热:2Cu + O2 △ 2CuO现象:铜丝变黑。
6、铝在空气中燃烧:4Al + 3O2 点燃2Al2O3 现象:发出刺眼的白光,放热,有白色固体生成。
7、氢气中空气中燃烧:2H2 + O2 点燃2H2O现象:(1)产生淡蓝色火焰(2)放出热量(3)烧杯内壁消失水雾。
8、红(白)磷在空气中燃烧:4P + 5O2 点燃2P2O5 现象:(1)发出白光(2)放出热量(3)生成大量白烟。
9、硫粉在空气中燃烧:S + O2 点燃SO2现象:A、在纯的氧气中发出光明的蓝紫火焰,放出热量,生成一种有刺激性气味的气体。
B、在空气中燃烧(1)发出淡蓝色火焰(2)放出热量(3)生成一种有刺激性气味的气体。
10、碳在氧气中充分燃烧:C + O2 点燃CO2 现象:(1)发出白光(2)放出热量(3)澄清石灰水变浑浊2复分解反应1、碱性氧化物+酸→盐+H2O Fe2O3+6HCl==2FeCl3+3H2O;Fe2O3+3H2SO4==Fe2(SO4)3+3H2O;CuO+H2SO4==CuSO4+H2O;ZnO+2HNO3==Zn(NO3)3+H2O;2、碱+酸→盐+H2O Cu(OH)2+2HCl==CuCl2+2H2OCu(OH)2+H2SO4==CuSO4+2H2O;NaOH+HCl==NaCl+H2O;2NaOH+H2SO4==Na2SO4+2H2ONaOH+HNO3==NaNO3+H2O;Mg(OH)2+2HNO3==Mg(NO3)2+2H2O; Ba(OH)2+H2SO4==BaSO4↓+2H2O33、酸+盐→新盐+新酸CaCO3+2HCl==CaCl2+H2O+CO2↑Na2CO3+2HCl==2NaCl+H2O+CO 2↑ HCl+AgNO3==AgCl↓+HNO3;H2SO4+BaCl2==BaSO4↓+2HCl;Ba(NO3)2+H2SO4==BaSO4↓+2HNO3NaHCO3+HCl==NaCl+H2O+C O2↑其它反应:1、二氧化碳通入澄清石灰水:CO2+Ca(OH)2==CaCO3↓+ H20现象:澄清石灰水变浑浊。
初中必背100个化学方程式

初中必背100个化学方程式化学方程式是学习化学的重要工具,它能够简洁明了地表达化学反应的本质。
对于初中生来说,掌握一些常见的化学方程式是学好化学的基础。
以下为大家整理了初中必背的 100 个化学方程式。
一、氧气的性质1、镁在空气中燃烧:2Mg + O₂点燃 2MgO现象:发出耀眼的白光,生成白色固体。
2、铁在氧气中燃烧:3Fe + 2O₂点燃 Fe₃O₄现象:剧烈燃烧,火星四射,生成黑色固体。
3、铜在空气中受热:2Cu + O₂加热 2CuO现象:红色固体变黑。
4、铝在空气中燃烧:4Al + 3O₂点燃 2Al₂O₃现象:发出耀眼的白光,生成白色固体。
5、氢气在空气中燃烧:2H₂+ O₂点燃 2H₂O现象:产生淡蓝色火焰,放出热量。
6、红磷在空气中燃烧:4P + 5O₂点燃 2P₂O₅现象:产生大量白烟,放出热量。
7、硫粉在空气中燃烧: S + O₂点燃 SO₂现象:在空气中发出淡蓝色火焰,在氧气中发出蓝紫色火焰,生成有刺激性气味的气体。
8、碳在氧气中充分燃烧:C + O₂点燃 CO₂现象:发出白光,放出热量。
9、碳在氧气中不充分燃烧:2C + O₂点燃 2CO二、制取氧气10、过氧化氢在二氧化锰催化下分解:2H₂O₂二氧化锰 2H₂O +O₂↑现象:有气泡产生,带火星的木条复燃。
11、加热氯酸钾(有少量的二氧化锰):2KClO₃二氧化锰、加热2KCl + 3O₂ ↑12、加热高锰酸钾:2KMnO₄加热 K₂MnO₄+ MnO₂+ O₂↑三、水的相关反应13、水在直流电的作用下分解:2H₂O 通电 2H₂↑ + O₂ ↑14、生石灰和水反应:CaO + H₂O = Ca(OH)₂现象:放出大量的热。
四、碳和碳的氧化物15、碳还原氧化铜:C + 2CuO 高温 2Cu + CO₂↑现象:黑色粉末逐渐变成红色,产生的气体能使澄清石灰水变浑浊。
16、碳还原氧化铁:3C + 2Fe₂O₃高温 4Fe + 3CO₂↑17、二氧化碳通过灼热的碳层:CO₂+ C 高温 2CO18、一氧化碳在氧气中燃烧:2CO + O₂点燃 2CO₂19、二氧化碳和水反应:CO₂+ H₂O = H₂CO₃现象:二氧化碳通入紫色石蕊试液,溶液变红。
初中必背化学方程式汇总(最全)

初中必背化学方程式汇总(最全)下面是初中化学方程式的汇总:1.酸碱中和反应方程式:酸+碱→盐+水例如:HCl+NaOH→NaCl+H₂O2.金属与非金属氧化物的反应方程式:金属+氧气→金属氧化物例如:2Na+O₂→2Na₂O3.酸与金属的反应方程式:酸+金属→盐+氢气例如:2HCl+Zn→ZnCl₂+H₂4.金属与酸的反应方程式:金属+酸→盐+氢气例如:Mg+2HCl→MgCl₂+H₂5.非金属与氧气的反应方程式:非金属+氧气→非金属氧化物例如:C+O₂→CO₂6.金属与非金属的氧化还原反应方程式:金属+非金属氧化物→盐+水例如:Na+Cl₂O→NaCl+H₂O7.非金属与酸的反应方程式:非金属+酸→氧化物+水例如:2H₂SO₃+C→CO₂+2H₂O8.金属与非金属的酸碱中和反应方程式:金属氢氧化物+酸→盐+水例如:NaOH+HCl→NaCl+H₂O9.酸与酸碱指示剂的反应方程式:酸+碱性指示剂→锥色盐例如:HCl+NaOH+碱性指示剂→NaCl+H₂O+锥色盐10.非金属氧化物和水的反应方程式:非金属氧化物+水→酸例如:SO₃+H₂O→H₂SO₄11.非金属酸与金属碱的反应方程式:非金属酸+金属氢氧化物→盐+水例如:HCl+NaOH→NaCl+H₂O12.碱与金属氧化物的反应方程式:碱+金属氧化物→锹色盐+水例如:KOHa+CuO→Cu(OH)₂+K₂O13.铜与稀硫酸反应的反应方程式:Cu+H₂SO₄→CuSO₄+H₂14.金属与水的反应方程式:金属+水→金属氢氧化物+氢气例如:2Na+2H₂O→2NaOH+H₂15.铁与酸的反应方程式:Fe+2HCl→FeCl₂+H₂16.铁与水蒸气的反应方程式:3Fe+4H₂O→Fe₃O₄+4H₂17.碳酸氢盐分解反应方程式:碳酸氢盐→二氧化碳+水+相应金属氧化物例如:NaHCO₃→CO₂+H₂O+Na₂O18.金属氢氧化物分解反应方程式:金属氢氧化物→金属氧化物+水例如:Ca(OH)₂→CaO+H₂O以上是初中化学方程式的汇总,涵盖了酸碱中和、金属与非金属氧化物的反应、金属与酸的反应、非金属与氧气的反应、金属与非金属的氧化还原反应等常见反应类型。
(完整版)八年级化学方程式大全

八年级化学方程式大全1、2Mg+O22MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2、2Hg+O22HgO 银白液体、生成红色固体拉瓦锡实验3、2Cu+O22CuO 红色金属变为黑色固体4、4Al+3O22Al2O3银白金属变为白色固体5、3Fe+2O2 Fe3O4剧烈燃烧、火星四射、生成黑色固体、放热6、C+O2 CO2剧烈燃烧、白光、放热、使石灰水变浑浊7、S+O2SO2剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰8、2H2+O2 2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料9、4P+5O2 2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量10、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O==H2CO311、加热氯酸钾:2 KClO3 2 KCl + 3 O2(加热)12、实验室用双氧水制氧气:2H2O22H2O+O2↑13、加热高锰酸钾:2KMnO4K2MnO4+MnO2+O2↑14、水在直流电的作用下分解:2H2O2H2↑+O2↑15、碳酸不稳定而分解:H2CO3==H2O+CO2↑16.氢氧化钠溶液与硫酸铜溶液反应:2NaOH+CuSO4==Cu(OH)2↓+Na2SO417、甲烷在空气中燃烧:CH4+2O2CO2+2H2O18、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+CO2==CaCO3↓+H2O19、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+CO2==Na2CO3+H2O20、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3+2HCl==CaCl2+H2O+CO2↑。
初中常见50个化学方程式

初中常见50个化学方程式1、2H₂+ O₂→2H₂O(氢气与氧气生成水)2、2Na + Cl₂→2NaCl(钠与氯气生成氯化钠)3CH₄+ 2O₂→CO₂+ 2H₂O(甲烷燃烧生成二氧化碳和水)4、CaCO₃→CaO + CO₂(碳酸钙分解生成氧化钙和二氧化碳)5、HCl + NaOH →NaCl + H₂O(盐酸与氢氧化钠中和生成氯化钠和水)6、Fe + S →FeS(铁与硫化合生成硫化铁)7、2H₂O →2H₂+ O₂(水分解生成氢气和氧气)8、CuSO₄+ Zn →ZnSO₄+ Cu(硫酸铜与锌反应生成硫酸锌和铜)9、C₃H₈+ 5O₂→3CO₂+ 4H₂O(丙烷燃烧生成二氧化碳和水)10、2AgNO₃+ Cu →2Ag + Cu(NO₃)₂(硝酸银与铜反应生成银和硝酸铜)11、2Na + 2H₂O →2NaOH + H₂(钠与水反应生成氢氧化钠和氢气)12、Fe + CuSO₄→FeSO₄+ Cu(铁与硫酸铜反应生成硫酸亚铁和铜)13、H₂SO₄+ 2NaOH →Na₂SO₄+ 2H₂O(硫酸与氢氧化钠中和生成硫酸钠和水)14、Zn + 2HCl →ZnCl₂+ H₂(锌与盐酸反应生成氯化锌和氢气)15、Ca(OH)₂+ 2HCl →CaCl₂+ 2H₂O(氢氧化钙与盐酸反应生成氯化钙和水)16、2Mg + O₂→2MgO(镁与氧气反应生成氧化镁)17、C + O₂→CO₂(碳与氧气反应生成二氧化碳)18、2Al + 6HCl →2AlCl₃+ 3H₂(铝与盐酸反应生成氯化铝和氢气)19、2NaHCO₃→Na₂CO₃+ CO₂+ H₂O(碱式碳酸氢钠分解生成碳酸钠、二氧化碳和水)20、2K + 2H₂O →2KOH + H₂(钾与水反应生成氢氧化钾和氢气)21、2HCl + Ca(OH)₂→CaCl₂+ 2H₂O(盐酸与氢氧化钙反应生成氯化钙和水)22、2Na + 2H₂O →2NaOH + H₂(钠与水反应生成氢氧化钠和氢气)23、CH₃COOH + NaHCO₃→CH₃COONa + CO₂+ H₂O(醋酸与碱式碳酸氢钠反应生成乙酸钠、二氧化碳和水)24、H₂O + CO₂→H₂CO₃(二氧化碳溶解在水中生成碳酸)25、CuO + H₂→Cu + H₂O(氧化亚铜与氢气反应生成铜和水)26、2HgO →2Hg + O₂(氧化汞分解生成汞和氧气)27、4Fe + 3O₂→2Fe₂O₃(铁与氧气反应生成氧化铁)28、2H₂O₂→2H₂O + O₂(过氧化氢分解生成水和氧气)29、Ca + 2H₂O →Ca(OH)₂+ H₂(钙与水反应生成氢氧化钙和氢气)30、2AgNO₃+ Na₂S →Ag₂S + 2NaNO₃(硝酸银与硫化钠反应生成硫化银和硝酸钠)31、Al + Cl₂→AlCl₃(铝与氯气反应生成氯化铝)32、C₃H₈+ 5O₂→3CO₂+ 4H₂O(丙烷燃烧生成二氧化碳和水)33、2HNO₃+ Ba(OH)₂→Ba(NO₃)₂+ 2H₂O(硝酸与氢氧化钡反应生成硝酸钡和水)34、Zn + H₂SO₄→ZnSO₄+ H₂(锌与硫酸反应生成硫酸锌和氢气)35、2Mg + 2HCl →MgCl₂+ H₂(镁与盐酸反应生成氯化镁和氢气)36、2C₄H₁₀+ 13O₂→8CO₂+ 10H₂O(戊烷燃烧生成二氧化碳和水)37、Na₂O + H₂O →2NaOH(氧化钠与水反应生成氢氧化钠)38、CaO + H₂O →Ca(OH)₂(氧化钙与水反应生成氢氧化钙)39、2Fe + 3Cl₂→2FeCl₃(铁与氯气反应生成氯化铁)40、NH₃+ HCl →NH₄Cl(氨气与盐酸反应生成氯化铵)41、Mg + 2H₂O →Mg(OH)₂+ H₂(镁与水反应生成氢氧化镁和氢气)42、C₂H₅OH + O₂→CO₂+ H₂O(乙醇燃烧生成二氧化碳和水)43、2Ag + S →Ag₂S(银与硫反应生成硫化银)44、2Al + 3CuCl₂→2AlCl₃+ 3Cu(铝与氯化亚铜反应生成氯化铝和铜)45、2NH₄NO₃→2N₂+ 4H₂O + O₂(硝酸铵分解生成氮气、水和氧气)46、KClO₃→KCl + O₂(高氯酸钾分解生成氯化钾和氧气)47、C₆H₁₂O₆→2C₂H₅OH + 2CO₂(葡萄糖发酵生成乙醇和二氧化碳)48、Ca + 2HCl →CaCl₂+ H₂(钙与盐酸反应生成氯化钙和氢气)49、2H₂O + O₂→2H₂O₂(水和氧气反应生成过氧化氢)50、4NH₃+ 5O₂→4NO + 6H₂O(氨气与氧气反应生成一氧化氮和水)。
初中化学方程式大全
等等。。。
-
13
15、碱与铵盐反应: Ca(OH)2+2NH4Cl =CaCl2+2NH3↑+2H2O
Ca(OH)2+2NH4NO3=Ca(NO3)2+2NH3↑+2H2O
Ca(OH)2+(NH4)2SO4 =CaSO4+2NH3↑+2H2O Ca(OH)2+(NH4)2CO3 =CaCO3+2NH3↑+2H2O
7、还原反应:(C、CO、H2具有还原性)
Fe2O3+3CO 高温 2Fe +3CO2 (炼铁原理)
2Fe2O3+3C 高温 4Fe +3CO2 Fe2O3+3H2 高温 2Fe +3H2O
CuO+CO △ Cu +CO2 CuO+H2 △ Cu +H2O
2CuO+C 高温 2Cu +CO2 (两种黑色固体反
-
7
活泼金属与稀盐酸或稀硫酸的反应:
Mg+2HCl =MgCl2+H2↑
Zn+2HCl =ZnCl2+H2↑ Fe+2HCl =FeCl2+H2↑ 2Al+6HCl =2AlCl3+3H2↑ Mg+H2SO4 =MgSO4 +H2↑ Zn+H2SO4 =ZnSO4 +H2↑ Fe+H2SO4 =FeSO4 +H2↑ 2Al+3H2SO4 =Al-2(SO4)3+3H2↑ 8
-பைடு நூலகம்
10
(完整版)八年级化学方程式大全

八年级化学方程式大全1、2Mg+O22MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2、2Hg+O22HgO 银白液体、生成红色固体拉瓦锡实验3、2Cu+O22CuO 红色金属变为黑色固体4、4Al+3O22Al2O3银白金属变为白色固体5、3Fe+2O2 Fe3O4剧烈燃烧、火星四射、生成黑色固体、放热6、C+O2 CO2剧烈燃烧、白光、放热、使石灰水变浑浊7、S+O2SO2剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰8、2H2+O2 2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料9、4P+5O2 2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量10、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O==H2CO311、加热氯酸钾: 2 KClO3 2 KCl + 3 O2(加热)12、实验室用双氧水制氧气:2H2O22H2O+O2↑13、加热高锰酸钾:2KMnO4K2MnO4+MnO2+O2↑14、水在直流电的作用下分解:2H2O2H2↑+O2↑ 15、碳酸不稳定而分解:H2CO3==H2O+CO2↑16.氢氧化钠溶液与硫酸铜溶液反应:2NaOH+CuSO4==Cu(OH)2↓+Na2SO417、甲烷在空气中燃烧:CH4+2O2CO2+2H2O18、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+CO2==CaCO3↓+H2O19、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+CO2==Na2CO3+H2O20、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3+2HCl==CaCl2+H2O+CO2↑。
初中必背化学方程式

初中必背100个化学方程式
一、置换反应:
1.镁与稀盐酸反应:Mg + 2HCl = MgCl2 + H2↑
二、酸和碱反应生成盐和水的中和反应
2.盐酸和氢氧化钠反应:HCl + NaOH = NaCl + H2O
三、酸与碱的中和反应
3.硫酸与氢氧化钠反应:H2SO4 + 2NaOH = Na2SO4 + 2H2O
四、金属氧化物与酸反应生成盐和水
4.氧化钙与稀盐酸反应:CaO + 2HCl = CaCl2 + H2O
五、非金属氧化物与碱反应生成盐和水
5.二氧化碳与氢氧化钠反应:CO2 + 2NaOH = Na2CO3 + H2O
六、碱与盐反应生成新碱和新盐
6.氢氧化钠与硫酸铜反应:2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
七、盐与盐反应生成两种新盐
7.氯化钠与硝酸银反应:NaCl + AgNO3 = AgCl↓ + NaNO3
八、金属与酸反应生成盐和氢气
8.铁与稀盐酸反应:Fe + 2HCl = FeCl2 + H2↑
九、非金属与氢气反应生成非金属单质
9.碳与氢气反应:C + H2= CH4↑
十、有沉淀生成的复分解反应
10.硫酸铜溶液与氢氧化钠溶液反应:CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4
十一、中和反应的离子方程式
11.盐酸和氢氧化钠反应:H+ + OH- = H2O。
初中八年化学方程式

初中化学方程式大全(八年级)化合反应1、镁在空气中燃烧:2Mg+O22MgO2、铁在氧气中燃烧:3Fe+2O2Fe3O4银白色固体剧烈燃烧,剧烈燃烧、火星四射、生成黑色固体、放热3、氢气在空气中燃烧:2H2+O22H2O产生淡蓝色火焰、放热、干而冷的烧杯内壁有无色液体出现。
4、红磷在空气中燃烧:4P+5O22P2O5暗红色固体燃烧发光、放热、产生大量白烟、产生黄白色火焰、生成白色固体5、硫粉在空气中燃烧: S+O2SO2黄色固体在空气中产生淡蓝色火焰.在氧气中产生蓝紫色火焰、放热、生成有刺激性气味的气体。
6、碳在氧气中充分燃烧:C+O2CO2在空气中发红光,在氧气中比在空气中燃烧更旺发白光、放热、石灰水变白色浑浊。
7、碳在氧气中不充分燃烧:2C+O22CO8、二氧化碳通过灼热碳层: C+CO22CO9、一氧化碳在氧气中燃烧:2CO+O22CO2产生蓝色火焰,放热、石灰水变白色浑浊。
10、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O==H2CO3(紫色石蕊试液变红色)分解反应11. 加热碱式碳酸铜:Cu2(OH)2CO32CuO+H2O+CO2↑绿色固体变黑色、试管内壁有无色液体产生、石灰水变白色浑浊。
12. 加热氯酸钾(有少量的二氧化锰):2KClO3 2KCl+3O2↑13. 加热高锰酸钾:2KMnO4K2MnO4+MnO2+O2↑14、实验室用双氧水制氧气:2H2O2 2H2O+O2↑15. 碳酸不稳定而分解:H2CO3==H2O+CO2↑(石蕊红色褪去)16、水在直流电的作用下分解:2H2O 2H2↑+O2↑17、高温煅烧石灰石(二氧化碳工业制法):CaCO3 CaO+CO2↑其他:18、铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu银白色固体表面覆盖一层紫红色固体,蓝色溶液逐渐变成浅绿色。
19、氢气还原氧化铜:H2+CuO Cu+H2O20、木炭还原氧化铜:C+2CuO 2Cu+CO2↑黑色固体逐渐变为红色、澄清石灰水变白色浑浊21、焦炭还原氧化铁:3C+2Fe2O34Fe+3CO2↑22、一氧化碳还原氧化铜:CO+CuO Cu+CO2黑色固体逐渐变成光亮红色,澄清石灰水变白色浑浊23、一氧化碳还原氧化铁:3CO+Fe2O32Fe+3CO2红色固体逐渐变成黑色,澄清石灰水变白色浑浊24、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+CO2==CaCO3↓+H2O25、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3+2HCl==CaCl2+H2O+CO2↑26、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3+2HCl==2NaCl+H2O+CO2↑。
八年级化学方程式

八年级化学方程式【文章导读】化学方程式,也称为化学反应方程式,是用化学式表示化学反应的式子。
化学方程式反映的是客观事实。
下面是关于八年级化学方程式,欢迎阅读参考!一.物质与氧气的反应:(1)单质与氧气的反应:1.镁在空气中燃烧:2mg+o22.铁在氧气中燃烧:3fe+2o23.铜在空气中受热:2cu+o24.铝在空气中燃烧:4al+3o25.*气中空气中燃烧:2h2+o26.红*在空气中燃烧:4p+5o27.硫粉在空气中燃烧:s+o28.碳在氧气中充分燃烧:c+o29.碳在氧气中不充分燃烧:2c+o2(2)化合物与氧气的反应:10.一氧化碳在氧气中燃烧:2co+o211.**在空气中燃烧:ch4+2o212.酒精在空气中燃烧:c2h5oh+3o2二.几个分解反应:13.水在直流电的作用下分解:2h2o14.用过氧化*制氧气:2h2o22h2↑+o2↑2mgofe3o42cuo2al2o32h2o2p2o5so2co22co2c o2co2+2h2o2co2+3h2o2h2o+o2↑15.用**钾制取氧气(有少量的二氧化锰):2kclo32kcl+3o2↑16.用高锰*钾制氧气:2kmno4k2mno4+mno2+o2↑17.碳*不稳定而分解:h2co3===h2o+co2↑18.高温煅烧石灰石:caco3三.几个氧化还原反应:19.*气还原氧化铜:h2+cuo20.木炭还原氧化铜:c+2cuocao+co2↑cu+h2o2cu+co2↑21.焦炭还原氧化铁:3c+2fe2o322.焦炭还原四氧化三铁:2c+fe3o423.一氧化碳还原氧化铜:co+cuo4fe+3co2↑3fe+2co2↑cu+co22fe+3co224.一氧化碳还原氧化铁(炼铁):3co+fe2o325.一氧化碳还原四氧化三铁:4co+fe3o43fe+4co2四.单质、氧化物、*、碱、盐的相互关系(1)金属单质+*--------盐+*气(置换反应)26.实验室用锌与稀硫*反应制取*气zn+h2so4=znso4+h2↑27.铁和稀硫*fe+h2so4=feso4+h2↑28.镁和稀硫*mg+h2so4=mgso4+h2↑29.铝和稀硫*2al+3h2so4=al2(so4)3+3h2↑30.锌和稀盐*zn+2hcl=zncl2+h2↑31.铁和稀盐*fe+2hcl=fecl2+h2↑32.镁和稀盐*mg+2hcl===mgcl2+h2↑33.铝和稀盐*2al+6hcl==2alcl3+h2↑(2)金属单质+盐(溶液)-------另一种金属+另一种盐34.铁和硫*铜溶液反应:fe+cuso4====cu+feso435.锌和硫*铜溶液反应:zn+cuso4===znso4+cu36.铜和***溶液反应:cu+hg(no3)2===cu(no3)2+hg铜和**银溶液反应:cu+2agno3===cu(no3)2+2ag(3)碱*氧化物+*--------盐+水37.氧化铁和稀盐*反应(除铁锈):fe2o3+6hcl===2fecl3+3h2o38.氧化铁和稀硫*反应(除铁锈):fe2o3+3h2so4===fe2(so4)3+3h2o39.氧化铜和稀盐*反应:cuo+2hcl====cucl2+h2o40.氧化铜和稀硫*反应:cuo+h2so4====cuso4+h2o41.氧化镁和稀硫*反应:mgo+h2so4====mgso4+h2o42.氧化钙和稀盐*反应:cao+2hcl====cacl2+h2o(4)**氧化物+碱--------盐+水43.*氧化*暴露在空气中变质(除去二氧化碳)2naoh+co2=na2co3+h2o44.苛**吸收二氧化硫气体:2naoh+so2====na2so3+h2o 45.苛**吸收三氧化硫气体:2naoh+so3====na2so4+h2o 46.用石灰水检验二氧化碳/石灰水在空气中变质/用石灰浆粉刷墙壁:ca(oh)2+co2====caco3↓+h2o47.消石灰吸收二氧化硫:ca(oh)2+so2====caso3↓+h2o(5)*+碱--------盐+水48.盐*和烧碱起反应:hcl+naoh====nacl+h2o49.盐*和*氧化铜反应:2hcl+cu(oh)2====cucl2+2h2o50.盐*和*氧化钙反应:2hcl+ca(oh)2====cacl2+2h2o51.盐*和*氧化铁反应:3hcl+fe(oh)3====fecl3+3h2o52.*氧化铝*物治疗胃*过多:3hcl+al(oh)3====alcl3+3h2o53硫*和烧碱反应:h2so4+2naoh====na2so4+2h2o(6)*+盐--------另一种*+另一种盐54.实验室制取二氧化碳(大理石与稀盐*反应):caco3+2hcl===cacl2+h2o+co2↑55.碳**与稀盐*反应:na2co3+2hcl===2nacl+h2o+co2↑56.碳*镁与稀盐*反应:mgco3+2hcl===mgcl2+h2o+co2↑57.盐*和**银溶液反应:hcl+agno3===agcl↓+hno358.硫*和碳**反应:na2co3+h2so4===na2so4+h2o。
八年级化学方程式汇总

化学方程式汇总点燃1.镁在空气中燃烧:2Mg + O2 === 2MgO点燃2. 铁在氧气中燃烧:3Fe + 2O2 === Fe3O4点燃3. 铝在空气中燃烧:4Al + 3O2 === 2Al2O3点燃4. 氢气中空气中燃烧:2H2 + O2 === 2H2O点燃5.磷在空气中燃烧:4P + 5O2 === 2P2O5点燃6. 硫粉在空气中燃烧: S + O2 === SO2点燃7. 木炭在氧气中燃烧:C + O2 === CO2通电8.水的电解:2H2O ==== 2H2↑+ O2↑MnO29.实验室制取氧气:加热氯酸钾:2KClO3 ==== 2KCl + 3O2↑△△加热高锰酸钾:2KMnO4 === K2MnO4 + MnO2 + O2↑(高锰酸钾)(锰酸钾)MnO2分解过氧化氢(双氧水)2H2O2====2H2O+O2↑10.实验室制取二氧化碳:大理石(石灰石)与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑11. 二氧化碳溶解于水:CO2 + H2O === H2CO3△(碳酸)12. 碳酸不稳定而分解:H2CO3 == H2O + CO2↑13.石灰水放在空气中变质:Ca(OH)2 + CO2 == CaCO3↓+ H2O(鉴定CO2的方法)(白色沉淀)高温14.工业上制取 CO2(高温煅烧石灰石):CaCO3 ===CaO + CO2↑酶15.生物呼吸作用:C6H12O6+6O2===6CO2+6H2O+能量(葡萄糖)光16.植物光合作用:6 CO2 + 6 H2O ==== C6H12O6 + 6O2叶绿体化学方程式汇总点燃1.镁在空气中燃烧:2Mg + O2 === 2MgO点燃2. 铁在氧气中燃烧:3Fe + 2O2 === Fe3O4点燃3. 铝在空气中燃烧:4Al + 3O2 === 2Al2O3点燃4. 氢气中空气中燃烧:2H2 + O2 === 2H2O点燃5.磷在空气中燃烧:4P + 5O2 === 2P2O5点燃6. 硫粉在空气中燃烧: S + O2 === SO2点燃7. 木炭在氧气中燃烧:C + O2 === CO2通电8.水的电解:2H2O ==== 2H2↑+ O2↑MnO29.实验室制取氧气:加热氯酸钾:2KClO3 ==== 2KCl + 3O2↑△△加热高锰酸钾:2KMnO4 === K2MnO4 + MnO2 + O2↑(高锰酸钾)(锰酸钾)MnO2分解过氧化氢(双氧水)2H2O2====2H2O+O2↑10.实验室制取二氧化碳:大理石(石灰石)与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑11. 二氧化碳溶解于水:CO2 + H2O === H2CO3△(碳酸)12. 碳酸不稳定而分解:H2CO3 == H2O + CO2↑13.石灰水放在空气中变质:Ca(OH)2 + CO2 == CaCO3↓+ H2O(鉴定CO2的方法)(白色沉淀)高温14.工业上制取 CO2(高温煅烧石灰石):CaCO3 ===CaO + CO2↑酶15.生物呼吸作用:C6H12O6+6O2===6CO2+6H2O+能量(葡萄糖)光16.植物光合作用:6 CO2 + 6 H2O ==== C6H12O6 + 6O2叶绿体。
初二化学方程式大全总结

初二化学方程式的总结一、化合反应1.镁在氧气中燃烧:2Mg+O2=点燃2MgO2.铁和稀盐酸反应:Fe+2HCl=FeCl2+H2↑3.铜和硝酸银反应:Cu+2AgNO3=Cu(NO3)2+2Ag4.氧化钙和水反应:CaO+H2O=Ca(OH)25.二氧化碳和水反应:CO2+H2O=H2CO36.氢氧化钠和二氧化碳反应:2NaOH+CO2=Na2CO3+H2O7.硫酸和氢氧化钠反应:H2SO4+2NaOH=Na2SO4+2H2O8.碳酸钙和稀盐酸反应:CaCO3+2HCl=CaCl2+H2O+CO2↑9.一氧化碳还原氧化铁:3CO+Fe2Fe+3CO210.二氧化碳和氢氧化钙反应:CO2+Ca(OH)2=CaCO3↓+H2O11.二氧化硫和水反应:SO2+H2O=H2SO312.氢氧化钙和二氧化碳反应:Ca(OH)2+CO2=CaCO3↓+H2O13.二氧化碳和氢氧化钠反应:CO2+2NaOH=Na2CO3+H2O14.一氧化碳还原氧化铜:CO+CuOCu+CO215.一氧化碳还原氧化铁:3CO+Fe2Fe+3CO216.一氧化碳还原四氧化三铁:4CO+Fe3Fe+4CO217.金属铝和稀盐酸反应:2Al+6HCl=2AlCl3+3H2↑18.金属铝和稀硫酸反应:2Al+3H2SO4=Al2(SO4)3+3H2↑19.金属铝和稀盐酸反应:2Al+6HCl=2AlCl3+3H2↑二、分解反应1.水在直流电的作用下分解:2H=通电H↑+O↑2.过氧化氢在二氧化锰的催化作用下分解:H=MnOH↑+O↑3.高锰酸钾在加热条件下分解:KMnOK Mn―△+MnO +O4.碳酸不稳定而分解:H=△H↑+CO↑5.碳酸氢铵受热分解:NH=N△+H +CO ↑三、置换反应1.氢气与氧化铜反应:H2+CuO―△Cu+H2O2.实验室用氢气还原氧化铜:H2+CuO―△Cu+H2O3.一氧化碳还原氧化铜:CO+CuO―△Cu+CO24.一氧化碳还原氧化铁:3CO+Fe2Fe+3CO2四、其他反应类型一、中和反应:酸与碱作用生成盐和水的反应。
初中化学必背化学方程式

初中化学必背化学方程式
1. 酸碱反应方程式:酸 + 碱 = 盐 + 水
例如:2HCl + Mg(OH)2 = MgCl2 + 2H2O
2. 金属与非金属的反应方程式:金属 + 非金属 = ionic化合物例如:Mg + Cl2 = MgCl2
3. 碳酸酐解方程式:碳酸酐 = 氧气 + 二氧化碳
例如:CaCO3 = CaO + CO2
4. 氢气和氧气的反应方程式:氢气 + 氧气 = 水
例如:2H2 + O2 = 2H2O
5. 亚硫酸反应方程式:亚硫酸 + 氧气 = 硫酸
例如:2SO2 + O2 = 2SO3
6. 氯气和钠的反应方程式:氯气 + 钠 = 氯化钠
例如:2Na + Cl2 = 2NaCl
7. 铁的氧化反应方程式:铁 + 氧气 = 氧化铁
例如:4Fe + 3O2 = 2Fe2O3
8. 硫酸和钠碱的反应方程式:硫酸 + 钠碱 = 盐 + 水
例如:H2SO4 + 2NaOH = Na2SO4 + 2H2O
9. 碳酸氢钠的分解反应方程式:碳酸氢钠 = 碳酸钠 + 水 + 二氧化碳
例如:NaHCO3 = Na2CO3 + H2O + CO2
10. 镁和盐酸的反应方程式:镁 + 盐酸 = 氯化镁 + 氢气
例如:Mg + 2HCl = MgCl2 + H2。
初中必背化学方程式大全2024

初中必背化学方程式大全2024初中必背化学方程式大全20241.水的电离方程式:H2O⇌H++OH-2.金属与非金属的氧化反应方程式:2Na+Cl2→2NaCl3.金属与酸的反应方程式:Mg+2HCl→MgCl2+H24.金属与水的反应方程式:2Na+2H2O→2NaOH+H25.金属与酸性氧化物的反应方程式:Cu+H2SO4→CuSO4+H2O+SO26.酸与碱的中和反应方程式:HCl+NaOH→NaCl+H2O7.碱与银盐的反应方程式:2AgNO3+2NaOH→Ag2O+2NaNO3+H2O8.金属与非金属的离子交换反应方程式:2AgNO3+Cu→Cu(NO3)2+2Ag9.酸与碳酸盐的反应方程式:2HCl+CaCO3→CaCl2+H2O+CO210.碱与硫酸盐的反应方程式:2NaOH+H2SO4→Na2SO4+2H2O11.燃烧反应方程式:C3H8+5O2→3CO2+4H2O12.还原反应方程式:2Ag++Cu→2Ag+Cu2+13.酸与金属碱式盐的反应方程式:2HNO3+Ca(OH)2→Ca(NO3)2+2H2O14.酸与金属氢碳酸盐的反应方程式:2HCl+Ca(HCO3)2→CaCl2+2CO2+2H2O15.酸与金属碳酸氢盐的反应方程式:2HCl+NaHCO3→NaCl+CO2+H2O16.烧碱与酸的反应方程式:Na2CO3+2HCl→2NaCl+H2O+CO217.石灰水与二氧化碳的反应方程式:Ca(OH)2+CO2→CaCO3+H2O18.碱与气体的反应方程式:2NaOH+CO2→Na2CO3+H2O19.氧化还原反应方程式:2M g+O2→2MgO20.化学平衡反应方程式:N2+3H2⇌2NH3。
八年级化学方程式汇总

1、呼吸作用:C 6H 2G 6 + 602亠6CQ + 6 H 2O +能量八年级化学方程式汇总有关氧气的化学性质的化学方程式:点燃、木炭在氧气中燃烧生成二氧化碳:C+O 2 C02 占桝 、硫在氧气中燃烧生成二氧化硫:S+0 2 -------------------- SQ 点燃 、铁在氧气中燃烧生成四氧化三铁:3Fe+2O 2 Fe 3G 4 点燃 、红磷在氧气中燃烧生成五氧化二磷: 4P+5O 2 2P2Q 点燃 、镁在氧气中燃烧生成氧化镁: 2Mg + 0 2 2Mg0 、铝在氧气中燃烧生成氧化铝: 4AI + 30 2 — 2AI 20点燃 、氢气在氧气中燃烧生成水: 2H 2 + 02 2H 20 、甲烷在空气中燃烧生成二氧化碳和水: CH 4 + 20 2 一— C02 + 2H 20 点燃、蜡烛燃烧的文字表达式:石蜡+氧气 二氧化碳+水 实验室制取氧气的化学方程式:| △ | 、加热高锰酸钾制氧气: 2KMnQ ------------ K 2Mn0+MnQ + 02 f、氯酸钾与二氧化锰共热制氧气: 2KCI0 —- — 2KCI + 30 2 f氧化碳能使澄清石灰水变浑浊(或者是用来鉴定二氧化碳的存在的化学方程式)C02 + Ca (O H) 2 = CaCO J + H 2O1 2 3 456 78 9 _ 、 1 23 三、 1 234 四、 、过氧化氢和二氧化锰混合制氧气: Mn0 22HQ 2H 2O + 02 f 有关二氧化碳的化学方程式:、实验室制取二氧化碳的化学方程式:CaC0+2HCI = CaCl 2 + CQ f + H 2O 、二氧化碳溶于水:CO +、碳酸不稳定受热易分解: HO = H 2C0 2C0CO f + HO光合作用和呼吸作用:1、呼吸作用:C6H2G6 + 602 亠6CQ + 6 H2O +能量2、光合作用:6CO + 6 HaO 叶绿体a C6H1Q + 602光电解五、电解水产生氢气和氧气:2HO •2H T + O a f六、氧气和臭氧的转化:(详见课本第65页)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
MnO 2
△
MnO 2
初中化学方程式大全
一、 氧气的性质:
(1)单质与氧气的反应:(化合反应) 镁在空气中燃烧:2Mg + O 2
点燃
2MgO
铁在氧气中燃烧:3Fe + 2O 2 点燃
Fe 3O 4 铜在空气中受热:2Cu + O 2
△
2CuO 铝在空气中燃烧:4Al + 3O 2
点燃
2Al 2O 3 氢气中空气中燃烧:2H 2 + O 2 点燃
2H 2O
红磷在空气中燃烧 4P + 5O 2 点燃
2P 2O 5 硫粉在空气中燃烧: S + O 2
点燃
SO 2
碳在氧气中充分燃烧:C + O 2
点燃
CO 2
碳在氧气中不充分燃烧:2C + O 2 点燃
2CO
(2)化合物与氧气的反应: 一氧化碳燃烧2CO + O 2 点燃
2CO 2
甲烷燃烧CH 4 + 2O 2
点燃
CO 2 + 2H 2O
酒精燃烧C 2H 5OH+3O 2 点燃
2CO 2+3H 2O
(3)氧气的来源:
玻义耳研究空气的成分:HgO Hg+ O 2↑ 高锰酸钾制氧气
2KMnO4+K2MnO4 MnO2+O2↑
过氧化氢制氧气2H 2O 2 2H 2O+ O 2↑
氯酸钾制氧气2K ClO 3 2K Cl+3O 2↑
电解水 2H 2O
通电
2H 2↑+O 2 ↑
△
生石灰溶于水:CaO + H2O == Ca(OH)2二氧化碳可溶于水:H2O + CO2==H2CO3二、质量守恒定律:
镁燃烧2Mg + O2点燃 2MgO
铁和硫酸铜溶液Fe+CuSO4==FeSO4+Cu 氢气还原氧化铜H2+CuO△Cu+H2O
镁还原氧化铜Mg+CuO △ Cu + MgO 三、碳和碳的氧化物:
(1)碳的化学性质
碳充分燃烧:C + O2点燃CO2
炭还原氧化铜C+2CuO高温2Cu + CO2↑炭还原氧化铁3C+2Fe2O3高温4Fe+3CO2↑(2)煤炉中发生的三个反应:(化合反应)煤炉的底层:C + O2点燃 CO2
煤炉的中层:CO2 + C 高温 2CO
煤炉的上部蓝色火焰2CO+O2点燃2CO2(3)二氧化碳的制法与性质:
实验室制二氧化碳
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑碳酸分解H2CO3 == H2O + CO2↑
二氧化碳溶于水H2O + CO2== H2CO3
工业制二氧化碳CaCO3高温CaO + CO2↑
石灰水与二氧化碳反应鉴别二氧化碳:
Ca(OH)2 + CO2 === CaCO3↓+ H2O
(4)一氧化碳的性质:
一氧化碳还原氧化铜CO+CuO△Cu+CO2
一氧化碳的可燃性2CO+O2点燃2CO2
其它反应:
36.碳酸钠与稀盐酸反应(灭火器的原理):
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
四、燃料及其利用:
酒精在空气中燃烧C2H5OH+3O2点燃2CO2+3H2O
(1)金属与氧气反应:
镁在空气中燃烧:2Mg + O2点燃2MgO
铁在氧气中燃烧:3Fe + 2O2点燃 Fe3O4
铜在空气中受热:2Cu + O2△ 2CuO
铝在空气中形成氧化膜4Al+3O2=2Al2O3
(标注成红色的必会)
三常见混合物的重要成分
四常见物质俗称
五物质的检验
1、氧气:带火星的木条放入瓶中,若木条复燃,燃起火:上红下蓝,则是氧气.
2、氢气:在玻璃尖嘴点燃气体,罩一干冷小烧杯,观察杯壁是否有水滴,往烧杯中倒入澄清的石灰水,若不变浑浊,则是氢气.
3、二氧化碳:通入澄清的石灰水,若变浑浊则是二氧化碳.但二氧化碳过量浑浊的石灰水又会变回澄清。
