化学饱和烃
大学有机化学第二章饱和烃

绿色化学与可持 续发展
随着环保意识的提高,绿色 化学和可持续发展已成为有 机化学的重要发展方向。研 究和发展环境友好、资源节 约的合成方法与技术,对于 实现可持续发展具有重要意 义。
计算机辅助ห้องสมุดไป่ตู้机 合成设计
随着计算机科学的发展,利 用计算机辅助设计工具进行 有机合成已成为可能。这种 方法有助于提高合成效率和 降低成本,为有机化学的发 展开辟了新的途径。
环烷烃的化学性质
01
02
03
加成反应
环烷烃中的碳碳单键可以 被氢气、卤素等试剂加成, 生成相应的烷基卤化物或 醇类。
开环反应
在酸或碱催化下,环烷烃 可以发生开环反应,生成 链状烷烃。
氧化反应
环烷烃在常温下容易被氧 化剂氧化,生成酮、醛等 化合物。
05 不饱和烃
烯烃和炔烃的结构
烯烃结构
烯烃是含有碳碳双键的烃类,双 键连接的两个碳原子为sp2杂化, 双键中的一根键为π键,另一根
命名法
系统命名法
根据国际纯粹与应用化学联合会 (IUPAC)的规定,采用系统命名法 对饱和烃进行命名。主要依据碳链的 长度和取代基的种类、位置来确定烃 的名称。
习惯命名法
对于一些简单的饱和烃,可以采用习 惯命名法,如甲烷、乙烷、丙烷等。
03 烷烃
烷烃的结构
烷烃由碳原子和氢原子组成, 碳原子之间通过单键连接,形 成链状或环状结构。
重要性及应用
01
基础理论
烷烃是学习有机化学的基础,对 于理解其他烃类和有机化合物的 性质至关重要。
工业应用
02
03
科学研究
烷烃是石油工业的主要组成部分, 用于生产燃料、润滑油、溶剂等。
烷烃是合成其他有机化合物的重 要原料,在药物合成、材料科学 等领域有广泛应用。
饱和烃名词解释

饱和烃名词解释
嘿,朋友们!今天咱来唠唠饱和烃。
这饱和烃啊,就像是生活中的老黄牛,勤勤恳恳,实实在在。
你看啊,饱和烃里的碳原子就像一群好兄弟,手牵手紧紧相连,每个碳原子都和其他碳原子形成了牢固的化学键,那关系,铁得很呐!它们组成了各种稳定的结构,就像一个坚固的大家庭。
这饱和烃啊,可没啥花花肠子。
它们结构简单,不玩那些弯弯绕绕的。
就好比一个憨厚老实的人,没啥心眼儿,让人觉得特别靠谱。
不像有些化合物,复杂得让人头疼。
比如说甲烷,这可是饱和烃里的代表人物啊!它就像咱生活中的家常菜,虽然普通,但是必不可少。
甲烷在我们的生活中可有着大用处呢,天然气里就有它呀。
再说说乙烷,这也是饱和烃家族的重要成员。
它就像一个默默无闻但又不可或缺的小角色,在很多地方都发挥着自己的作用。
饱和烃还有很多其他的成员呢,它们都有着自己独特的性格和用途。
它们就像一群低调的实干家,不声不响地为我们的生活做着贡献。
你想想看,如果没有饱和烃,那我们的世界会变成啥样呢?很多东西可能都没法正常运转啦!所以啊,可别小瞧了这些看起来普普通通的饱和烃。
它们稳定可靠,就像我们身边那些值得信赖的朋友。
无论何时何地,都能给我们一种安心的感觉。
饱和烃虽然没有华丽的外表,但它们有着内在的价值。
这不就跟我们很多人一样嘛,也许看起来平平无奇,但只要用心去发现,就能看到我们身上的闪光点。
总之,饱和烃是化学世界里非常重要的一部分。
它们就像一群默默奉献的幕后英雄,为我们的生活带来了很多便利和惊喜。
我们可得好好珍惜它们呀!。
饱和烃的结构和性质

饱和烃的结构和性质饱和烃是指分子中只含有碳和氢,碳原子之间的化学键都是单键的化合物。
饱和烃可分为烷烃和环烷烃两大类,其中烷烃分子中只包含直链或支链的碳链,而环烷烃则包含了一个或多个碳环。
这些化合物在自然界中普遍存在,如石油和天然气中含有大量的饱和烃,其化学性质主要是烷烃和环烷烃之间的分子量差异,长链的分子量会比短链的分子量更大,同时在同一种分子量下,支链烷烃的沸点也比直链烷烃的沸点低。
烷烃的结构和性质烷烃的分子结构是由碳原子链构成的,每个碳原子上都与四个其它原子(其中一个是氢原子)连接。
这种化学键称为单键,通过这种单键链可以形成不同长度的直链链烷烃。
此外,由于碳原子能够在空间上自由旋转,这种链烷烃的分子也可以通过碳原子之间的旋转来改变的,产生的结构就是所谓的支链烷烃。
烷烃分子中每个碳原子上都有2个可能的氢原子位,因此线性烷烃分子的数目很大。
其中,最简单的是甲烷(CH4)和乙烷(C2H6),它们的分子式分别为CH4和C2H6。
甲烷是一种无色、无味的气体,燃烧时能够发生强烈的火焰,而乙烷则具有明显的气味。
此外,随着碳原子数量的增加,烷烃分子的物理和化学性质也在逐渐发生着变化。
长链烷烃分子的熔点和沸点一般比较高,这是因为长链烷烃分子之间的范德华力较强,分子之间吸引力度随分子量的增加而增强,因此大分子量的烷烃会出现固态、液态、气态三态平衡,其沸点逐渐升高。
此外,直链烷烃分子之间的相互作用力会比支链烷烃大,因此支链烷烃往往比直链支链烷烃的沸点低。
环烷烃的结构和性质环烷烃是包含一个或多个碳环的烷烃,是一类由相邻的碳原子单键组成的环状分子。
环烷烃中的环越大,则其相对稳定性越高。
六元环状的烷环烃最为稳定,如正己烷(C6H14)就是一种典型的烷环烃。
同时,环烷烃有一个特点,它们分子内的碳——碳键、碳——氢键倾向于来回转动,从而使环内碳原子的键价能量特别稳定。
环烷烃由于分子内强烈的形成屏障而难于引发反应,因此环烷烃的反应活性比同分子量的非环烷烃要低。
有机化学02第二章饱和烃烷烃

H
H
H H
H
HH
H
H
H
2H之间的距离: 0.250nm 2H原子的范德华半径之和:
H
H
0.229nm
0.24nm
交叉式: 0.250nm > 0.24nm 无范氏张力
重迭式:
0.229nm<0.24nm 有范氏张力
24
乙烷分子的构象稳定性和内能变化
➢扭转能:使构象之间转化所需要的能量。
构象的稳定性与内能有关. 内能低,稳定;内能高,不稳 定。内能最低的稳定构象称优势构象。
➢书写规则:
1)相同取代基合并,数目用汉文数字二、三 ...表示; 2)取代基位号用阿拉伯数字表示; 3)阿拉伯数字与汉字之间必须用短横线分开; 4)阿拉伯数字之间必须用逗号分开。 5) 中文名称按基团次序规则,较小的基团列在前
CH3 C5H3__C4 H___C3 H __2C__C1 H3
CH3 CH2
☺杂化过程:
2p1x 2p1y 2pz 2s2
激发
1s2
2s1 2p1x 2p1y 2p1z
杂化
1s2
2s轨道的能量与 2p较接近,2s上 的1个电子可以 激发到2pz空轨 道上。
激发态的碳原子 有4个单电子,但 轨道能量不等。
2s1 2p1x 2p1y 2p1z
1s2
杂化形成4个能量相 等的新轨道sp3轨道
杂化
19
3 烷烃分子的形成
+
sp3 s
sp3-s
+
sp3
sp3
sp3-sp3
+
+6
20
σ- 键: 形成:由原子轨道头碰头重迭而形成. 特征:电子云沿键轴呈圆柱状对称分布,成键两原子可 围绕键轴自由旋转不会影响电子云密度的分布。
有机化学第2章饱和烃

沸点℃
36
28
9.5
2. 熔点
烷烃熔点(mp)的变化基本上与沸点相似,直链烷烃的熔点变化 也是随着相对分子质量的增减而相应增减。但因在晶体中,分子间 的作用力不仅取决于分子的大小,而且与晶体中晶格排列的对称性 有关,对称性大的烷烃晶格排列比较紧密,熔点相对要高些。
沸点是与分子间的作用力——van der Waals力有关的,烷烃是非极 性分子,van der Waals力主要产生于色散力。
直链烷烃的沸点与分子中所含碳原子数的关系图 一般在常温常压下,四个碳以下的直链烷烃是气体,由戊烷开始 是液体,大于十七个碳的烷烃是固体。
在碳原子数相同的烷烃异构体中,含支链越多的烷烃,相应 沸点越低。
为了使成键电子之间的排斥力最小、最稳定,四个sp3杂化轨 道在空间的排布,是以碳原子为中心,四个轨道分别指向正四面体 的四个顶点,使sp3 杂化轨道具有方向性。同时两个轨道对称轴之 间的夹角 (键角)为109.5°。
1/4s + 3/4p
2. σ键的形成及其特性
原子轨道沿核间联线(键轴)相互交盖,形成对键轴呈圆柱形对称 的轨道,称为σ轨道。σ轨道上的电子称为σ电子。 σ轨道构成的共价 键称为σ键。
当含有不止一个相等的最长碳链可供选择时,一般选取包含支链最多 的最长碳链作为主链。根据主链所含碳原子数称为“某烷”。
“庚烷”
②将主链上的碳原子从靠近支链的一端开始依次用阿拉伯数字编号;
当主链编号有几种可能时,应选定支链具有“最低系号相同时,给小的取代基较小的编号:
异丁烷
为了形象地表示分子的立体形状,常采用立体模型表示。常用 的模型有两种:球棒模型(Kekule模型)和比例模型(Stuart模型,它与
第二章 饱和烃:烷烃和环烷烃

3
5
CH
3
HC CH
4
CH
烷烃:饱和开链烃。 特征:C与C以单键相连,其余价键都为氢原子饱和。 通式为:CnH2n+2
环烷烃:饱和环烃。 特征:C与C以单键相连成环,其余价键都为氢 原子饱和。 通式为:CnH2n (单环烷烃)
烷烃和环烷烃统称为饱和烃
烷烃和环烷烃主要存在于石油和天然气中, 天然气主要由甲烷以及少量的乙烷、丙烷和丁烷 组成。石油是一种复杂混和物,主要是含1到40个 碳原子的烃,通过精馏可以将石油分离成沸点不 同的有用馏分。 天然气: 汽油: 煤油: 柴油: 沥青: CH4~C4H10 C5H12~C12H26 C12H26~16H34 C15H32~C18H38 C20以上
烷基自由基
伯
仲
叔
烷基自由基的类型
烷基自由基的结构
烷基自由基的稳定性:叔〉仲〉伯
烷基自由基的稳定性与C-H的均裂能有关:
CH3CH2CH2-H
离解能 (kJ/mol) 410
(CH3)2CH-H (CH3)3C-H
397 381
在烷烃氯化反应中,产生烷基自由基的步骤 是整个反应中最困难的一步。是控制反应速度的 步骤。生成的烷基自由基越稳定,所需的活化能 越小,反应越容易。
CH3CH2CH2CH2CH2CH3
正己烷
(CH3)2CHCH2CH2CH3
异己烷
(CH3)3CCH2CH3
新己烷
• 系统命名法:
采用IUPAC(International Union of Pure and Applied Chenistry)国际纯粹与应用化学联合会的命 名原则,结合我国文字特点制定的。
键旋转引起的位能变化曲线
饱和烃课件

药物合成
芳香烃在药物合成中扮演重要角色,许多药物都 含有芳香烃。
化学反应介质
芳香烃常被用作化学反应的介质,帮助控制反应 速度和选择性。
05
CATALOGUE
饱和烃的未来发展
新材料开发
新型高分子材料
利用饱和烃的化学性质,开发出性能优异的新型高分子材料,用于制造医疗器械 、航空航天器等高科技领域。
芳香烃通常是高熔点、高 沸点的无色或淡黄色晶体 ,具有特殊的气味和较高 的密度。
芳香烃的化学性质
芳香烃的化学性质较为活 泼,可以发生取代反应、 加成反应和氧化反应等。
03
CATALOGUE
饱和烃的合成与转化
烷烃的合成与转化
烷烃的合成
主要通过石油分馏和裂化反应获 得,也可通过生物发酵法合成。
烷烃的转化
烷烃常作为工业溶剂,用于溶解和 提取其他物质。
塑料生产
烷烃在塑料生产中发挥着重要作用 ,许多塑料是由烷烃制成的。
环烷烃的应用
润滑油
环烷烃是润滑油的重要成分,它 们有助于减少机械摩擦。
橡胶
环烷烃也是橡胶的成分之一,用 于制造各种橡胶产品。
热塑性塑料
某些环烷烃可以用于生产热塑性 塑料。
芳香烃的应用
染料和颜料
烷烃在催化剂作用下可进行裂化 、异构化、烷基化和脱烷基化等 反应,生成更小的烷烃或更复杂 的烃类。
环烷烃的合成与转化
环烷烃的合成
主要通过重整和芳烃的烷基化反应获得,也可通过烯烃的环化反应合成。
环烷烃的转化
环烷烃在催化剂作用下可进行脱烷基化、加氢、氧化等反应,生成更小的环烷 烃或更复杂的烃类。
芳香烃的合成与转化
有机化学第三章饱和烃

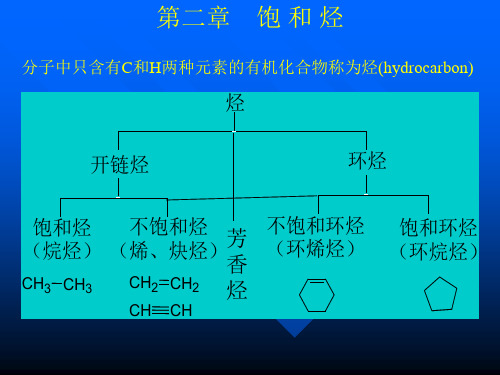
根据烃分子中碳原子间连接方式可分为:
饱和烃:链烷烃 链烃 不饱和烃: 烯烃 炔烃 饱和烃:环烷烃 不饱和烃:环烯烃 环炔烃
芳香烃: 苯,萘,蒽,菲等
烃
环状烃
烃:只由C、H两种元素组成的有机化合物。 烷烃:包括链烷烃和环烷烃
cubane adamantane
甾族化合物:
甾族化合物的结构特征是包含一个四环稠合的碳环骨架, 同时还有三个侧链。 CH
3
甾环结构:
1 2 3
H3C
11 9 B 6
12
H3C
R
17 D 16 15
HO H3C H
H3C H H
CH CH2 CH2 CH2 CH CH3 H CH3
C
13 14
A 10 4 5
0
60
120
180
240
300
360
degrees of rotation
CH 3 H H CH 3 H H
CH3 H3C H H H H
3. 其它烷烃的构象
例:画出化合物
H 3C H Br
2
CH3 Br 的 全 交叉式 和 全重 叠 式 构 象
3
H
H H3C Br
H3C H3C
Br Br
Br H
2、
(CH3CH2)2CHCHCH2CH3
3-甲基-4-乙基己烷
CH3
3、
(CH3)2CHCH2CH2CHCHCH2CH3 CH3
CH3
2,5,6-三甲基辛烷
4、
CH3CH2CHCH2CHCHCH2CH2CH2CH(CH3)2 CH3 CH2CH(CH3)2
饱和烃的定义

饱和烃的定义
饱和烃是一类化合物,它们由氢和碳组成,其化学式为CnH2n+2。
这类化合物又被称为烷烃,是一种非常广泛存在于自然界和工业中的物质。
饱和烃的最显著特征是它们的化学键全部为单键,因此它们的分子结构比较简单。
由于这种单键的存在,饱和烃分子中的碳原子与周围的氢原子之间存在着最大可能的化学键,因此它们的分子结构是最稳定的。
饱和烃是一类非常常见的化合物,它们存在于许多自然界中,如石油、天然气、煤等。
在工业上,饱和烃也是一种非常重要的化学物质,广泛应用于石油加工、化工、制药等领域。
饱和烃的化学性质比较稳定,它们不容易发生化学反应。
这是由于饱和烃的分子结构比较简单,它们的化学键比较强,因此不容易被其他化学物质攻击。
但是,饱和烃也不是完全不发生反应,它们可以在高温高压下发生裂解反应,从而产生更小的碳氢化合物。
饱和烃的物理性质也比较稳定。
它们的熔点和沸点比较高,且随着碳原子数的增加而增加。
这是由于饱和烃分子中的化学键比较强,需要消耗较多的能量才能使它们分离。
因此,饱和烃在常温下一般是液体或固体状态,而不是气体状态。
在实际应用中,饱和烃有许多用途。
例如,石油中的饱和烃可以用于制备汽油、柴油、煤油等燃料,还可以用于制备塑料、橡胶、合成纤维等化学品。
此外,饱和烃还被广泛用于烹饪、加热和照明等方
面。
总之,饱和烃是一类非常重要的化合物,它们广泛存在于自然界和工业中,具有稳定的化学和物理性质,被广泛应用于石油加工、化工、制药等领域。
饱和烃的定义

饱和烃的定义饱和烃是一类由碳和氢组成的有机化合物,其分子中的碳原子数量和氢原子数量的比值为2:2n+2。
它们通常具有直链、分支链或环状结构,因此也被称为烷烃、烷基化合物或脂肪烃。
饱和烃的主要特点是与空气中的氧气不发生化学反应,不易燃烧,且在常温下呈气态、液态或固态。
这些特性使得饱和烃广泛应用于石油工业、化工工业、医药工业等领域。
饱和烃可以根据其碳链的长度、结构和性质分为以下几种:1. 甲烷(CH4):由单个碳原子和四个氢原子组成的最简单的饱和烃,常见于天然气和沼气中。
2. 乙烷(C2H6):由两个碳原子和六个氢原子组成,具有较低的沸点和比重,通常用于同类化合物的制备。
3. 丙烷(C3H8):由三个碳原子和八个氢原子组成,是石油和天然气中较常见的饱和烷烃之一,也被用作热源和燃料。
4. 正丁烷(C4H10):由四个碳原子和十个氢原子组成,因其分子结构简单而广泛应用于合成其他有机化合物的原料。
5. 异戊烷(C5H12):是一种有机溶剂和石油清洁剂,由五个碳原子和十二个氢原子组成,含有一根分支链。
6. 六碳烷:指由六个碳原子和2n+2个氢原子组成的烷基化合物,如正己烷、异己烷、环己烷等。
它们具有较高的沸点和比重,广泛用于燃料、润滑油和有机合成。
7. 高级饱和烃:指由七个或更多碳原子组成的烷基化合物,如正庚烷、正十二烷等,这些化合物具有更高的沸点和密度,通常用于合成润滑油、燃料和引发剂。
总之,饱和烃在现代工农业生产中发挥着重要的作用,同时也对环境和人类健康造成着一定的影响和挑战。
因此,需要加强饱和烃的研究和管理,从而更好地利用其优点,减少其不利影响,为人类创造更美好的生活。
有机化学第04章 饱和烃

CH3Cl + Cl.
生成的氯自由基可进攻一氯甲烷,再生成新的自由基。
Cl. + CH3Cl
.CH2Cl + HCl
新的自由基与氯分子碰撞生成二氯甲烷和氯自由基。
.CH2Cl + Cl:Cl ......... + CH2Cl2 Cl.
.CHCl3 CCl3
+ +
Cl.
Cl2
..........
CCHl4C+l +l3
甲烷的氯代反应一般包括以下几个步骤:
(1)氯分子在光照或高温条件下,吸收能量发生均裂生成氯自由基,
光
Cl:Cl
Cl. + Cl.
(2)当氯自由基与甲烷分子发生碰撞时,则生成甲基自由基。
Cl. + CH4
CH3. + HCl
(3)生成的甲基自由基也非常活泼,当它与氯分子碰撞时,又生成
新的氯自由基。
CH3. + Cl:Cl
五、溶解度
符合“相似相溶原理”,非极性或极性较弱的烷烃不 易溶于极性较强的水中,而易溶于有机溶剂中。
§4.2 烷烃的化学性质
学习有机反应2点最重要:首先要认清反应物的官能团; 其次要知道这类官能团怎样发生反应
一、烷烃的结构
结构特征:C为sp3杂化,各原子间以单键相连(键)。
如:
H
CH4 , H C H
课后作业:P126 1,2, 3, 5
4)伯、仲、叔、季——表示链异构或碳原子不同取代程 度的形容词:
5
4CH3 3
2CH3
季 1
(4°) 伯、仲、叔碳上的氢原子
CH3 CH CH2 C CH3 分别叫伯氢、仲氢、叔氢
高教版 有机化学 第二章 饱和烃
-ane 烷 -ene 烯 -yne 炔 -ol 醇或酚 benzene 苯 aldehyde 醛 -one 酮 ester 酯 ether 醚 phenol 酚
butane 丁烷 butene butyne butanol benzol 苯甲醇 butanal butanone yl 基 R-(radical) 有机基团 phenyl 苯基(Ph-)
CH3CH2CH2CHCH 2CH3 CH3
CH3CHCH 2CH2CHCH 2CH3 CH2CH3 CH2CH2CH3
B编号:对主链碳原子编号,以便与确定取代基的位置。 原则:小的取代基位次最小为宜(劣势基团优先原则)。
例3
1 2 3 4 5 6 6 5 4 3 2 1 CH3CH2CH2CHCH 2CH3 CH3
C C C C C C
(1)
2. 写出少一个碳原子的直链式作为主链。如:比己烷少一 个碳的直链烃为正戊烷。把那一个碳当作支链(即甲基), 依次取代直链上的各个碳原子的氢,就能写出可能的同分 异构体的构造式。用一个碳原子取代这个碳链中五个碳原 子上的氢原子,有三个可能的异构体,
C
C C (2)
C
C
C
CH3CH2CH2CH2CH2CH2CH3
普通命名为: IUPAC命名为: 正庚烷 庚烷
(2)含有支链的烷烃,把它当作直链烷烃的衍生物。
例1
CH3CH2CH2CHCH 2CH3 CH3
命名为: 取代基 主链 3-甲基己烷
具体命名步骤为: A选择主链(母体)。 原则:含碳原子数最多,不一定要写成直型。碳原子数相同时, 取代基最多的作为主链。 例2
3-甲基-6-乙基壬烷
饱和烃

裂化反应是大分子烃在高温、高压或有催化剂的条件下,分裂成小分子烃的过程。裂化反应属于消除反应,因此烷烃的裂化总是生成烯烃。如十六烷(C16H34)经裂化可得到辛烷(C8H18)和辛烯(C8H16)。
由于每个键的环境不同,断裂的机率也就不同,下面以丁烷的裂化为例讨论这一点:
CH3-CH2-CH2-CH3 → CH4 + CH2=CH-CH3
4.烷烃都不溶于水,易溶于有机溶剂。
CH3
|
注意:新戊烷(C(CH3)4)(也称2,2-二甲基丙烷)由于支链较多,常温常压下也是气体。
新戊烷结构式|
CH3
[编辑本段]化学性质
烷烃性质很稳定,在烷烃的分子里,碳原子之间都以碳碳单键相结合成链关,同甲烷一样,碳原子剩余的价键全部跟氢原子相结合.因为C-H键和C-C单键相对稳定,难以断裂。除了下面三种反应,烷烃几乎不能进行其他反应。(在通常情况下,与强酸.强碱.强氧化剂都不反应)
理论上说,由于烷烃的稳定结构,所有的烷烃都能稳定存在。但自然界中存在的烷烃最多不超过50个碳,最丰富的烷烃还是甲烷。
由于烷烃中的碳原子可以按规律随意排列,所以烷烃的结构可以写出无数种。直链烷烃是最基本的结构,理论上这个链可以无限延长。在直链上有可能生出支链,这无疑增加了烷烃的种类。所以,从4个碳的烷烃开始,同一种烷烃的分子式能代表多种结构,这种现象叫同分异构现象。随着碳数的增多,异构体的数目会迅速增长,烷烃的熔沸点增加,但相同数目的碳原子,支链越多,熔沸点越低。
烷烃的作用主要是做燃料。天然气和沼气(主要成分为甲烷)是近来广泛使用的清洁能源。石油分馏得到的各种馏分适用于各种发动机:
C1~C4(40℃以下时的馏分)是石油气,可作为燃料;
有机化学 饱和烃

二、热裂解反应
1. 热裂:在高温及无氧条件下发生键断裂的分解反应。
CH3 CH CH2 H H CH3 CH2 CH2 H
交叉式
重叠式
①画一个圆圈表示离眼睛较远的碳原子,圆圈上三 等份圆周的短线表示这个碳原子上的三根σ键; ②圆心表示离眼睛较近的碳原子,由圆心到圆周三 等份的延长线表示这个碳上的 三根σ键。
4. 烷烃的构象(Conformation)
• 构象:由单键旋转所产生的分子中原子或基团在空 间的特定排列形式。 • 构象异构体(Conformers):由单键旋转而产生的异 构体。 • 单键旋转会产生无数个构象,它们互为构象异构 体。
R
R
2 1
2
H
C H
1
2
H H
C C
2
H H
2
H
2
H
所以乙基和甲基相比,乙基为“较优”基 团,因此乙基应排在甲基之后
CH2CH3
<
CHCH3
1
2
3
CH3
CH2
CH CH2 CH3
4 CH CH3
5 CH2
6 CH2
7 CH3
4-甲基-3-乙基庚烷 ( ) 3-乙基-4-甲基庚烷(× )
课堂练习 1.
一、氧化反应
1. 燃烧
用途:用作燃料(重要能源之一) 当体积比CH4∶O2(空气)= 1∶2(10)瓦斯爆炸 低级烷烃的蒸气和空气混合至一定比例时,遇到火花 会发生爆炸,这是煤矿中瓦斯爆炸。甲烷的爆炸极限 是5.53%—14%。
2.部分氧化(控制氧化)
R:C20~C30 代替动植物油脂制造肥皂
生产各种含氧衍生物:醇、醛、酸等
CH 次甲基 C CH3 次乙基
高二化学饱和烃知识点总结

高二化学饱和烃知识点总结饱和烃是有机化合物的一种,其中所有碳碳键都是单键,并且碳原子与氢原子饱和连接。
在化学中,饱和烃的理解对于学习有机化学以及石油化工等领域具有重要意义。
本文将对高二化学中的饱和烃进行知识点总结,以帮助读者更好地理解和掌握该概念。
一、饱和烃的命名法饱和烃的命名法主要有以下几种:直链烷烃、支链烷烃、环烷烃等。
1. 直链烷烃是指所有碳原子按照一条直链排列的烷烃。
例如,甲烷(CH4)、乙烷(C2H6)等。
2. 支链烷烃是指其中存在一些支链的烷烃。
支链通常由取代基(alkyl group)表示,例如,异丙基(isopropyl)、叔丁基(tert-butyl)等。
支链烷烃的命名需要确定主链、编号、选择取代基位置等。
3. 环烷烃是指具有环状结构的烷烃,环烷烃也可以存在支链。
例如,环己烷(C6H12)。
二、饱和烃的物理性质1. 饱和烃的密度较小,大多数饱和烃是气体或液体,少数是固体,例如甲烷是无色无臭的气体,蜡烷是白色固体。
2. 饱和烃的沸点随着碳原子数的增加而增加,烷烃的沸点比相应的烯烃和炔烃高。
3. 饱和烃通常不溶于水,但可以溶于非极性溶剂,如非极性有机溶剂和石油醚。
三、饱和烃的化学性质1. 碳碳单键的特性使得饱和烃相对稳定,不容易发生化学反应。
饱和烃通常只参与燃烧反应,燃烧反应是指饱和烃与氧气反应,产生二氧化碳和水,并释放大量能量。
2. 饱和烃可以通过加氢反应与氢气反应,例如,烯烃可以加氢生成相应的饱和烃。
3. 饱和烃在适当条件下可发生取代反应,取代反应是指饱和烃中的一个氢原子被其他原子或基团取代的反应。
例如,甲烷可以与氯气发生取代反应,生成氯代甲烷(CH3Cl)。
四、应用与实际意义1. 饱和烃是石油和天然气的主要成分之一,研究饱和烃有助于研究石油和天然气的产生、提取和利用。
2. 饱和烃是化学工业中的重要原料,广泛应用于制造塑料、合成纤维、燃料等领域。
3. 饱和烃的燃烧反应是我们日常生活中炉灶、汽车等燃烧设备的基础,研究饱和烃的燃烧有助于提高能源利用效率和环境保护。
有机化学第2章饱和烃

反-1,4-二甲基环己烷
饱和烃 的结构
第二章 饱和烃:烷烃和环烷烃 2.3 烷烃和环烷烃的结构
2.3.1 σ键的形成及其特性 2.3.2 环烷烃的结构与环的稳定性
第二章 饱和烃:烷烃和环烷烃
2.3 烷烃和环烷烃的结构
2.3.1 σ键的形成及其特性
C: 2s2 2p2
两个成单电子, 呈2价?
实验事实:
第二章 饱和烃:烷烃和环烷烃
2.2.1 伯、仲、叔、季碳及伯、仲、叔氢
与三个氢原子相连的碳原子,叫伯碳原子(第一碳原子、一级碳原子),用1°表示 与二个氢原子相连的碳原子,叫仲碳原子(第二碳原子、二级碳原子),用2°表示 与一个氢原子相连的碳原子,叫叔碳原子(第三碳原子、三级碳原子),用3°表示 与四个碳原子相连的碳原子,叫季碳原子(第四碳原子、四级碳原子),用4°表示
第二章 饱和烃:烷烃和环烷烃
一些环烷烃的燃烧热如下所示:
环烷烃的环张力越大,说明分子的能量越高,稳定性越差,越容易开环 加成。
为什么环的稳定性顺序有:环丙烷<环丁烷<环戊烷<环己烷? 结构所致!!
环烷烃的结构与环的稳定性
环丙烷的结构:
物理方法测得,环丙烷分子中三个碳原子共平面。 显然,环丙烷中没有正常的C-C键,而是形成“弯曲键〞:
H HH
H HH H
HC CC H
HC CC C H
H
H
H HH H
HC H
m.p b.p
--103.85。。CC
H。 m.p -159 。C
b.p 11.7 C
这两种不同的丁烷,具有相同的分子式和不同的结构式,互为同分异 构体。
同分异构体——分子式相同,结构式不同的化合物。 同分异构现象——分子式相同,结构式不同的现象。
饱和烃的定义

饱和烃的定义饱和烃是一类化合物,其分子中只含有碳和氢原子,并且所有碳-碳键都是单键。
这意味着饱和烃分子中的所有碳原子都已经与最大数量的氢原子结合,并且没有空余的键位。
饱和烃也被称为烷烃,它们是碳氢化合物的一种。
本文将介绍饱和烃的定义、结构、性质和应用。
一、饱和烃的结构饱和烃分子的结构非常简单,由一系列碳原子和氢原子组成,它们之间只有单键。
饱和烃的分子式为CnH2n+2,其中n表示碳原子数。
例如,乙烷的分子式为C2H6,丙烷的分子式为C3H8,正戊烷的分子式为C5H12,依此类推。
饱和烃分子的结构可以用结构式或简化式表示。
例如,乙烷的结构式为CH3-CH3,其简化式为CH3CH3。
丙烷的结构式为CH3-CH2-CH3,其简化式为CH3CH2CH3。
二、饱和烃的性质1. 物理性质饱和烃是无色、无味、无毒的液体或气体,具有较低的密度和比重。
它们在常温下为气体或液体,但在高压下可以变为固体。
饱和烃的沸点和熔点随着碳原子数的增加而增加。
2. 化学性质饱和烃的化学稳定性很高,与大多数化学物质不发生反应。
它们不易燃烧,但在高温下可以与氧气反应,产生二氧化碳和水。
饱和烃可以通过加氢反应转化为不饱和烃,例如,丙烷可以转化为丙烯。
三、饱和烃的应用饱和烃在工业和日常生活中有广泛的应用。
以下是一些主要的应用:1. 燃料饱和烃是石油和天然气中的主要成分,它们是燃料的主要来源。
燃料可以用于发电、加热和运输等方面。
2. 化工原料饱和烃可以用作化工原料,例如,乙烷可以用于生产聚乙烯和乙醇,正丁烷可以用于生产丁二酸和丁醇。
3. 医药饱和烃可以用作药物的成分,例如,某些饱和烃可以用于制造皮肤软化剂和药膏基质。
4. 润滑油饱和烃可以用作润滑油的成分,例如,矿物油就是一种饱和烃。
四、结论饱和烃是一类简单的化合物,其分子中只含有碳和氢原子,并且所有碳-碳键都是单键。
它们具有较高的化学稳定性和低的反应性,广泛应用于燃料、化工原料、医药和润滑油等领域。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
单键的旋转并不是完全自由的,但是在 室温下,分之热运动即可越过此能垒, 而使各种构象迅速互变,所以在室温想 乙烷是无数构象组成的平衡混合物
(1) 重叠式构象中,两个碳原子上的H原子相互重叠,无论C-H键上的σ电子 对之间,或H原子之间的距离均最近,相互排斥力最大,因此能量最高, 是最不稳定的构象
(2) 在交叉式构象中,两个H原子相互交错,无论C-H键上的б电子对之间, 或H原子之间的距离均最远,相互排斥力最小,因此能量最低,是最稳定 的构象
1,1—二甲基—3—异丙基环己烷
(2) 二环环烷烃的命名
二环脂环烃根据环的连接方式可分为以下四种类型:
联环烃:两个环彼此以单键(或双键)直接相连。 螺环烃:两个环共用一个碳原子。 稠环烃:两个环共用两个相邻的碳原子。 桥环烃:两个环共用两个不直接相连的碳原子。
(1) 桥环烃 的命名 结构特点:是都有两个桥头碳原子和三条连在桥头上的“桥” 编号:先编最长的桥,从桥头碳原子开始编号。 命名:根据组成环的碳原于总数命名为“某烷”,加上词头“双环”。再把 各“桥”所含的碳原子的数目,按由大到小的次序写在“双环”和“某 烷”之间的方括号里,数字用圆点分开。环上碳原子编号则从一个 桥头碳原子开始,先编最长的桥至第二个桥头;再编余下的较长的 桥,回到第一个桥头,最后编最短的桥。而编号的顺序以取代基位 置号码加和数较小为原则。
第二章、饱和烃:烷烃和环烷烃
分子中仅仅含有碳氢两种元素的有机化合物称为碳氢化合
物(简称烃),是最简单的有机化合物。根据分子的碳架,可以
分为:
烷烃
脂肪烃 烃 芳香烃
脂环烃
烯烃 炔烃
饱和脂环烃(环烷烃) 不饱和脂环烃
一、烷烃和环烷烃的通式和构造异构
1. 烷烃和环烷烃的通式
a. 烷烃中,C原子的四个共价键除了以单键与C原子相互结合
CH3
CH3CH2CH2CH2CH3
正戊烷
H3C C CH3
CH3
新戊烷
CH3 CH3CHCH2CH3
异戊烷
CH3 CH3CCH2CH3
CH3
新己烷
(2). 衍生物命名法
将烷烃看作是甲烷的烷基衍生物。适用于简单、含碳原子较少的烷烃。文
献中极少使用。 原则:1、选择连有烷基最多的C原子作为甲烷的C原子,而把与此C原子相
原则:1、直链烷烃以C原子数目命名,十以内以天干名称表示(与习惯命 名相似,只是去掉“正”字),十以上以中文数字(十一、十二等) 表示。
CH3CH2CH2CH2CH3
戊烷
CH3(CH2)10CH3
十二烷
2、带有支链的烷烃 a. 选主链:选择支链最多的,最长的碳链作为母体,按碳链数目, 称为某烷。
b. 编号:将主链上的碳原子从靠近支链的一端开始依次用阿拉伯数字编号; 当主链编号有几种可能时,应选定支链具有“最低系列‘的编号 “最低系列”是指当碳链以不同方向编号,得到两种或两种以上不同
∴烷烃的通式:CnH2n+2
b. 由碳和氢两种元素组成而性质与烷烃相似的饱和碳环化合物 称为环烷烃。
环丙烷 环丁烷 环戊烷 环己烷
C3H6
C4H8
C5H10
C6H12
∴环烷烃的通式:CnH2n
凡是具有同一通式,在组成上相差一个或多个CH2的一系列化 合物,称为同系列, 同系列中化合物称为同系物。
同系物具有类似的化学性质,为学习和研究提供了方便
成碳链外,其余的共价键都和H原子结合(被H原子所饱和)
因此称为饱和烃。
烷 烃分子中所有化学键均为σ 键,即
CSP3 CSP3
CSP3 H1S
烷烃广泛存在于自然界,从天然气和石油中分离出来的烷烃
有甲烷、乙烷、丙烷、丁烷和戊烷等。从CH4、CH3CH3、 CH3CH2CH3可以看出,每增加1个C原子,就增加2个H原子。
CH2
亚甲基
CHCH3
亚乙基
CH2CH2
1,2-亚乙基
3. 烷烃的命名 (1). 普通命名法 适用于简单的有机化合物
根据C原子的数目来命名,十个C以内的用十个天干名称来表示:甲、乙、 丙、丁、戊、己、庚、辛、壬、癸(gui )。
为了区分同分异构体,通常采用一些词头来表示: 正(n)——表示直链烷 异(i)——表示链端第二位C原子上带有一个甲基。 新(neo)——表示链端第二位C原子上带有两个甲基
如果烷烃比较复杂,在支链上还连有取代基时,可用带撇的数字标明取代 基在支链中的位次或把带有取代基的支链的全名放在括号中。
练习:
CH3
CH3CH2CHCHCH2CH2CH2CH2CHCH3
CH3
CH3
2,7,8—三甲基癸烷
H3C H2C CH CH CH CH CH3 CH3 CH2 CH3 CH3 CH2 CH3
(3) 重叠式的能量比交叉式能量约高12.6kj/mol,这种能量差叫做能垒。
(2) 丁烷的构象
CH3
H
H
H
H
CH3
反位交叉
CH3 H
CH3
CH3
H
H CH3
H HH
H H
部分重叠
顺位交叉
CH3CH3 H
H H
H HH
CH3 CH3
H CH3
HH
CH3 H
H
H
全重叠式
顺位交叉
部分重叠
E 能量
H3C C H3
三、 烷烃和环烷烃的结构
1. σ键的形成及其特性
原子轨道沿核间联线(键轴)相互交盖,形成对键轴呈圆柱形对称的轨道,
称为σ轨道。σ轨道上的电子称为σ电子。 σ轨道的共价键称为σ键。
在甲烷分于中,已知碳原子为sp3杂化,C—Hσ键是由 碳原子的sp3杂 化轨道与氢原子的1s轨道在对称轴的方向交盖而成。
sp3 杂化碳原子形成的甲烷 四个C—Hσ键
C原子称为:伯、仲、叔、季碳原子(1°、 2°、3°、 4°)。 与伯、仲、叔碳原子相连的H原子相应地称为:伯、仲、叔氢
H H CH3 CH3
H C C C C CH3 H H H CH3
1° 2° 3° 4°
H3C
CH3
3°
C
H
C
4°
CH3
2°
C
H H 1°
2. 烷基和环烷基 烷烃和环烷烃分子从形式上去掉一个氢原子后剩余的部分
CH3CH2CH2 H
CH3CH2CH H CH3
CH3 CH3 C H
CH3
CH3CH H CH3
CH3CHCH2 H CH3
CH3CH2CH2
CH3CH2CH CH3
CH3 CH3 C
CH3
CH3CH CH3
CH3CHCH2 CH3
环丙基 环丁基 环戊基
烷烃分子从形式上去掉两个氢原子后剩余的基团称为亚烷基
连的基团作为甲烷H原子的取代基。 2、取代的烷基按大小排列,简单在前,复杂在后。
CH3
H3C
CH CH2CH3 CH3
CH3CH2
C CHCH3 CH3 CH3
二甲基乙基甲烷
二甲基乙基异丙基甲烷
(3). 系统命名法
目前有机化合物最常用的命名法是IUPAC(Internationl Union of Pure and Applied Chemistry,国际纯粹化学和应用化学联合会)系统命名法。 我国现用的系统命名法是根据IUPAC规定的原则,再结合我国文字上的特点 而制订的。
(b)重叠式构象引起的张力
3. 烷烃和环烷烃的构象
构象:由于围绕单键旋转而引起的分子中各原子在空间的不同排列方式 称为构象。
(1) 乙烷的构象 乙烷的的构象是是无穷多的,其中有典型意义的两种构象是重叠式
和交叉式的构象
乙烷分子绕C-C单键360 o时要经过三个重叠式和三个交叉式构象。这 两种构象可分别用透视式和纽曼(M.S.Newman)投影式表示:
C H3 C H3
H C H3 H C H3
分别称为烷基和环烷基。烷基的通式为CnH2n+1,通常用R— 表示. 环烷基的通式为CnH2n-1
•正烷基:去掉直链烷烃末端氢原子所得的原子团叫正烷基。命名时用“正” 或 “normal”的第一个字母“n”表示。
•仲烷基:去掉一个仲氢原子所得烷基叫仲烷基。用“仲”或 “secondary”的 前三个字母“sec”表示。
2. 烷烃和环烷烃的构造异构
a. 烷烃: 碳骨架不同引起的构造异构又称碳架异构
CH3 CH2 CH2 CH3
CH3 CH3 CH CH3
正丁烷 b.p. = - 0.5°C
异丁烷 b.p. = - 11.73°C
分子式相同,而结构不同的化合物称为同分异构体。
随着C原子的增加,异构体的数目增加,例如,戊烷有三种 异构体,己烷有五种异构体。
1. 环烷烃比开链烷烃具有较高的能量 2. 环越小,张力能越大,分子越不稳定 3. 环己烷是个无张力环 4. 环己烷和C12以上的大环化合物都是很稳定的化合物。
(2). 环烷烃不稳定的原因
环丙烷
60。 109.5。
环丁烷
90。 109.5。
环戊烷
108。 109.5。
(a)键角偏离正常键角, 环烷烃中碳原子的成键轨道为SP3 , 正常键角应为109.5°
sp3 杂化碳原子形成的乙烷 六个C—Hσ键和一个C—Cσ键
由两个和两个以上碳原子组成的烷烃,其C—Hσ键也是由碳原子的sp3 杂化轨道与氢原于的1s轨道在对称轴的方向交盖而成。不同之处是,C—C σ键是由两个碳原子各以一个sp3杂化轨道在对称轴的方向交盖而成
其他烷烃上碳原子所连接的四个原子或原子团并不完全相同,因此每个碳 上的键角并不完全相同。除乙烷外,烷烃分子的碳链并不排布在同一条直线上, 而是曲折地排布在空间。为了书写的方便,碳链仍然写成直链的形式。
