大鼠灌注固定取脑审批稿
大鼠灌注固定的方法

大鼠灌注固定的方法大鼠灌注固定是一种用于研究大鼠生理和药理学的常见实验方法。
它可以用于评估药物的药代动力学、药效学和毒理学,并用于研究器官功能和疾病模型。
在进行大鼠灌注固定实验之前,需要仔细准备并按照以下步骤进行操作。
1.前期准备:- 选择适合实验目的的动物品种,通常是Sprague Dawley大鼠。
-清洁并消毒手术工具、试剂和仪器。
-准备一个有固定台架和支撑物的工作台,以便于操作。
2.动物处理:-使用静脉麻醉剂如七氟烷麻醉大鼠,确保其无感知和无痛苦。
-在动物体表部位使用剃刀去除毛发,以便于手术操作。
-放置大鼠在手术台上,用皮质骨钳或其他固定工具固定体位。
3.外周血管穿刺:-在大鼠的尾静脉或股静脉使用微注射针或导管进行外周血管穿刺。
通常选择尾静脉作为血液采集和药物给予的通路。
-确保穿刺位置干燥,避免出血和感染。
4.心脏灌注固定:-使用手术剪刀或手术刀在胸部进行中线切口,暴露出心脏。
-使用心脏夹固定心脏,并通过房室瓣作为固定点固定心脏。
-使用注射器注入适量的生理盐水或磷酸盐缓冲液,从主动脉穿刺注射,确保整个循环系统都能被灌注。
-如果需要,可以在注射液中加入药物或药物浓缩液以达到特定的实验目的。
5.清洗循环系统:-使用注射器缓慢注入生理盐水或磷酸盐缓冲液,并通过主动脉灌注整个循环系统。
-可以通过下腔静脉引流口清洗肝脏和肾脏,通过上腔静脉引流口清洗心脏,确保器官内的血液和残留物被冲洗干净。
6.完成实验:-在实验完成后,停止灌注并拔除总动脉穿刺点和外周血管穿刺点的引流器。
-使用生理盐水清洁手术切口,确保干燥和消毒。
-给予大鼠恢复期,通常是放置在恢复笼中,并观察其情况。
大鼠灌注固定是一种常见的实验方法,但它需要仔细的准备和操作。
在进行实验之前,需要评估和控制许多因素,如固定时间、注射液的成分和浓度,以及动物的恢复期。
此外,需要遵守相关的伦理和法律规定,确保动物的福利和保护。
通过正确使用和解释大鼠灌注固定实验的结果,可以为人类疾病的研究和治疗提供重要的信息。
大鼠灌注固定实验报告

一、实验目的1. 掌握大鼠灌注固定技术操作步骤。
2. 观察灌注固定后大鼠组织器官的结构变化。
3. 分析灌注固定过程中可能出现的问题及解决方法。
二、实验材料1. 实验动物:健康成年大鼠,体重200-250g。
2. 实验仪器:手术器械、手术显微镜、注射器、输液器、灌注针、剪刀、血管钳等。
3. 实验试剂:4%多聚甲醛固定液、生理盐水、注射用无菌注射用水等。
三、实验方法1. 动物处死:采用过量麻醉剂使大鼠处死,确保动物在处死过程中无痛苦。
2. 灌注固定:按照以下步骤进行大鼠灌注固定:(1)准备灌注液:将4%多聚甲醛固定液加入500ml输液用玻璃瓶中,加入适量生理盐水,搅拌均匀。
(2)解剖:在手术显微镜下解剖大鼠,暴露心脏。
(3)穿刺心脏:用灌注针从心脏穿刺,插入主动脉。
(4)灌注固定:将注射器连接到灌注针,缓慢注入固定液,直至大鼠肝脏逐渐变为白色。
(5)继续灌注:待肝脏变白后,继续灌注固定液,直至大鼠全身变白。
(6)终止灌注:观察大鼠四肢抽动,表明灌注液进入大脑,待抽动完全停止,全身组织器官固定良好。
3. 取材:将固定好的大鼠组织器官取出,放入4%多聚甲醛固定液中浸泡。
四、实验结果1. 灌注固定后,大鼠组织器官结构清晰,细胞形态良好。
2. 部分大鼠在灌注固定过程中出现心脏破裂,导致灌注失败。
3. 部分大鼠在灌注固定过程中出现血压下降,需及时调整灌注速度。
五、实验讨论1. 灌注固定是研究组织器官形态结构的重要技术手段,操作过程中需严格按照步骤进行,确保固定效果。
2. 动物处死时,应避免过度麻醉,以免影响固定效果。
3. 灌注固定过程中,要注意观察动物的生命体征,及时发现并解决可能出现的问题。
4. 灌注固定液的选择应根据实验需求进行,如需观察细胞形态,可选择4%多聚甲醛固定液。
5. 实验过程中,要注意无菌操作,避免污染。
六、实验结论本次实验成功完成了大鼠灌注固定,取得了良好的固定效果。
通过观察灌注固定后大鼠组织器官的结构变化,为后续实验研究提供了良好的基础。
鼠类动物的固定(固定器)和灌胃操作说明书

灌胃法
分两步操作(以大小鼠为例):
(1)固定:(小鼠)右手抓住其尾,放在鼠笼铁纱网上,然后用左手拇指及食指沿其背向前抓住其颈部,并以左手的小拇指和掌部夹住其尾固定在手上;(大鼠)实验者应戴帆布手套,用右手将鼠尾抓住提起,放在粗糙的台面或鼠笼上,抓住鼠尾向后轻拉,左手抓紧两耳和头颈部皮肤,余下三指紧捏鼠背部皮肤,如果大鼠后肢挣扎厉害,可将鼠尾放在小指和无名指之间夹住,将整个鼠固定在左手中;
(2)灌胃:左手固定好动物以后,右手持灌胃器,将灌胃针从鼠的口腔插入,压迫鼠的头部,使口腔与食道成一直线,将灌胃针沿咽后壁慢慢插入食道,可感到轻微的阻力,此时可略改变一下灌胃针方向,以刺激引起吞咽动作,顺势将药液注入。
一般灌胃针插入小鼠深度为3~4cm,大鼠或豚鼠为4~6cm。
常用灌胃量小鼠为0.2~1ml,大鼠1~4ml,豚鼠1~5ml。
图3 大小鼠的灌胃方法
鼠类动物固定方法(固定器)
以大鼠为例(固定小鼠的操作和大鼠一样):
第一步:准备好固定器
第二步:将固定器和大鼠平放,动物很容易进入固定器
第三步:动物进入固定器以后,将后端盖上
第四步:将前端盖上,以免大鼠往前跑
第五步:将前端盖往后推,锁紧,固定动物完毕。
第六步:大鼠固定后,可进行尾静脉注射、血压测量等
注意事项:
(1)勿将动物垂直放入,否则动物会抓固定器(如下图所示)
(2)固定鼻锥时保证动物舒适,呼吸顺畅,不会大幅度移动;不能使头部向旁侧弯曲,也不能使动物身体紧贴固定器尾部窗口受到挤压;整个过程保证动物舒适、轻松。
丹红注射液改善神经干细胞移植治疗脑缺血损伤效果的机制研究
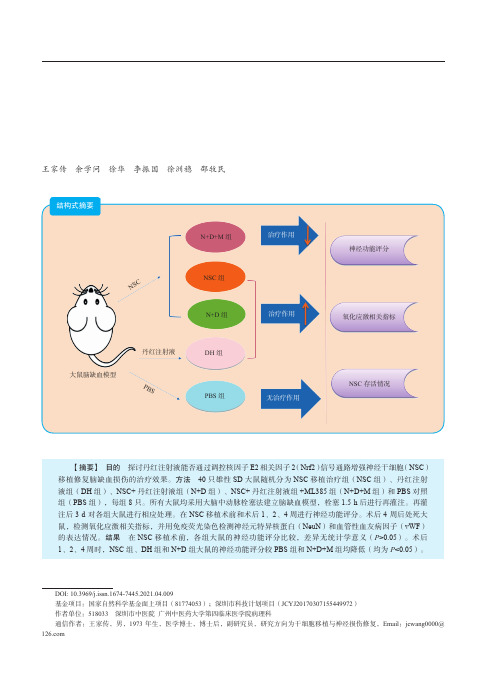
N+D+M 组
治疗作用
ห้องสมุดไป่ตู้
NSC 组 N+D 组
治疗作用
神经功能评分 氧化应激相关指标
大鼠脑缺血模型
丹红注射液 PBS
DH 组 PBS 组
无治疗作用
NSC 存活情况
【摘要】 目的 探讨丹红注射液能否通过调控核因子 E2 相关因子 2(Nrf2)信号通路增强神经干细胞(NSC) 移植修复脑缺血损伤的治疗效果。方法 40 只雄性 SD 大鼠随机分为 NSC 移植治疗组(NSC 组)、丹红注射 液组(DH 组)、NSC+ 丹红注射液组(N+D 组)、NSC+ 丹红注射液组 +ML385 组(N+D+M 组)和 PBS 对照 组(PBS 组),每组 8 只。所有大鼠均采用大脑中动脉栓塞法建立脑缺血模型,栓塞 1.5 h 后进行再灌注。再灌 注后 3 d 对各组大鼠进行相应处理。在 NSC 移植术前和术后 1、2、4 周进行神经功能评分。术后 4 周后处死大 鼠,检测氧化应激相关指标,并用免疫荧光染色检测神经元特异核蛋白(NeuN)和血管性血友病因子(vWF) 的表达情况。结果 在 NSC 移植术前,各组大鼠的神经功能评分比较,差异无统计学意义(P>0.05)。术后 1、2、4 周时,NSC 组、DH 组和 N+D 组大鼠的神经功能评分较 PBS 组和 N+D+M 组均降低(均为 P<0.05)。
丹红注射液是一种广泛用于脑梗死、冠状动脉粥 样硬化性心脏病、肺源性心脏病、糖尿病周围神经病 变治疗的中药制剂 [12-16],具有改善血液循环、保护血 管内皮、抗炎、抗氧化应激损伤、抗神经元凋亡、保 护神经、促进神经元突触重塑、降低血清同型半胱氨 酸水平等作用。为了确定丹红注射液是否能通过调控 Nrf2 信号通路改变移植微环境,增强干细胞移植治疗 脑缺血损伤的效果,本研究建立大鼠脑缺血模型,探 讨丹红注射液协同干细胞移植治疗在脑缺血损伤中的 治疗作用。
大鼠灌注固定的方法
大、小鼠灌注固定的方法准备物品:1、灌注针(灌注用的针可以是临床上的静脉套管针,便于穿刺)2、医用输液器3、500ml输液用玻璃瓶4、血管钳5、剪刀6、生理盐水7、4%多聚甲醛(4℃),0.1M的PB配制大鼠深度麻醉,迅速打开胸腔,暴露心脏,此时注意用血管钳钝性分离心包及周围软组织以便充分暴露心脏。
左手持镊子捏住心脏,右手持套管针从心尖部位插入,向上进针到升主动脉。
取出套管针内芯,连接生理盐水,打开输液开关,快速灌注,同时用剪刀在右心耳处剪一小口,待流出的液体无色后(约60ml即可)更换为多聚甲醛。
多聚甲醛灌注速度为先快后慢,快速灌注50ml后放慢速度,缓慢滴注维持即可,每只大鼠约需100ml。
如果多聚甲醛灌注充分,则动物四肢和全身肌肉会不停抽动。
如此灌注约需1小时时间。
充分暴露升主动脉套管针从心尖部位插入,向上进针到升主动脉1、暴露心脏时要小心,速度要快,但不可损伤心脏及大血管,如果出现血液凝固或大血管损伤,灌流将失败。
2、最好是剖开右心室,但是因为暴露的问题,有误剪到左心室的可能。
相对来说,剪开右心耳更为方便。
我们就是这样做的。
3、灌流的效果:PBS或NS灌流时,血流丰富的脏器如肝脾肾等的颜色会迅速转为灰白,此为灌流正常。
另外,大鼠耳尖,口唇,四肢掌部也会变苍白。
4、PBS或NS灌流需缓慢而持续,防止血液血管内凝固。
有条件的话可加点肝素。
5、先主动脉插管,再右心耳放血,这样插管容易些。
先剪右心耳的话,心脏会瘪下去的。
小鼠灌注固定方法:采用水合氯醛麻醉后剪开胸腔,动作要快,经左心室插入头皮针连接的20 mL注射器(头皮针磨钝,从与身体纵轴成45°角的方向进针,针尖插入升主动脉内,可以看见,动作要轻柔),同时剪开右心耳,推入20 mL 生理盐水。
推完以后迅速换4 ℃多聚甲醛20 mL,灌完以后取材基本就可以了。
大鼠灌注固定取脑

优点:可用单人用注射器直接完成,不用输液管架,而且平均每只仅需5~10ml固定液,时间也仅为5~10min。
注意事项:1)开胸时不要伤到心脏 2)心脏穿刺最好用留置针,软,不宜穿通室间隔,见血即退针芯.插针部位是心尖部,方向向中线.3)生理盐水冲血管,到右心耳流出无色液体.4)多基甲醛固定成功的表现是SD鼠四肢抽搐.5)先断头再一步一步取脑6)根据你实验设计,需要切片的部位,有重点的取,常见的体表标志是前囟和外耳道.7)去颅骨后脑表面有一层硬脑膜,要去掉.
5 灌流:缓慢灌注PBS 10ml,见到老鼠两前肢及两肺变白可改灌注多聚甲醛,多聚甲醛的灌流也同PBS。
6 灌注成功的标志:刚开始灌注时老鼠剧烈抽动;成功后老鼠后肢绷直,尾部竖起成一直线;所灌注的脑组织白而硬。
7 取脑:分离除去后颈部肌肉 ,用弯镊小心取出脑组织。
8 后固定:灌流后的脑组织置于4%PFA置4度冰箱内进行后固定,时间>2h,过夜最好。
3.制作灌注装置,用两瓶塑料包装的生理盐水,一瓶底部开口,倒出盐水,倒置灌入多聚甲醛,悬挂,输液器链接,远端结一个三通后到一个输液器粗针头端
2. 经心脏行灌注固定:麻醉,剪开胸廓,见到搏动的心脏,心尖插入灌注针头,止血钳固定,剪开右心耳,开放静脉血,首先快速滴入生理盐水100-200ml,再注入4%多聚甲醛300-350ml固定液
大鼠灌注固定取脑科研实验
具体方法:
1. 配好4%多聚甲醛PBS缓冲液,配法:称取40g PFA溶于装有500ml DEPC水的玻璃容器(烧杯或烧瓶)中,持续加热磁力搅拌至60~65℃,使成乳白色悬液。用1.0mol/L的NaOH直至7.0,使呈清亮状(滴加),再加入约500ml PBS,充分混匀(在冰浴或冷水浴中),可再检测一下pH,过滤后定容至1000ml,室温或4℃保存备用。
大脑中动脉缺血再灌注大鼠脑组织PAR

大脑中动脉缺血再灌注大鼠脑组织PAR拟1表达与炎症反应的关系(作者:_________ 单位:___________ 邮编:___________ )作者:周青珍,王华梅,吴家幕【摘要】目的:研究脑缺血再灌注(CIR)后脑组织中蛋白酶激活受体拟1(PAR拟1)的表达及其与炎症反应的关系。
方法:40只雄性SD大鼠线栓法建立大脑中动脉栓塞(MCAO模型,再灌注后于3、6、12 h及1、2、3、7 d取脑,免疫组化法和脑组织匀浆法检测PAR 拟1、超氧化物歧化酶(SOD和丙二醛(MDA的含量。
结果:缺血再灌注后脑组织PAR拟1表达增加(P V 0.01 ), MDA含量增多(P V 0.01 ), SOD舌性降低(P v0.01 ); PAR拟1表达与MDA含量正相关(r1=0.844,P v 0.05 ),与SOD含量负相关(r2=-0.901,P v 0.01 )。
结论:CIR后PAR11 1表达增多可加重脑组织炎性反应。
【关键词】大脑中动脉;栓塞;蛋白酶激活受体拟1Abstract: Objective To inv estigate the correlati on betwee n protease 拟activated receptor 拟1(PAR 拟1) expression and inflammatory reaction of brain tissue after cerebral ischemiareperfusion(CIR).Methods Fourty SDrats were randomly dividedinto eight groups:sham group,CIR3 h,CIR6 h,CIR12 h,CIR1 d,CIR2 d, CIR3 d,a nd CIR7 d group( n=5).To establish middle cerebral artery occlusion(MCAO) model with Longa' methods.At the indicated timepoint,the rat was sacrificed and its brain was removed.PAR 扌以 1 wasdetected with immunohistochemistry,SOD and MDA contents in brain homogenate were measured.Results Compared with sham group,PAR 拟1 expressi on was in creased obviously (P v 0.01 ) .Con te nts of MDA were in creased with the time of CIR prolonged ( P v0.01 ) ,and there was positive correlation between PAR 拟1 expression and MDA content(r1=0.844,P v 0.05 ) ,but SODactivity was decreased ( P v 0.01 ) ,and negatively correlated with PAR 勘:1 expression(r2=-0.901,P v 0.01 ) . Con clusi on In creased PAR); 1 expression may aggravate in flammatory reacti on of brain tissue in rats after CIR with MCAO.Key words: Middle cerebral artery;Occlusi on ;Protease 拟, activated receptor 拟1近年来研究发现中性粒细胞的聚集、黏附和浸润,以及炎性因子的大量产生是缺血再灌注损伤的重要因素[2]。
大鼠脑组织灌注固定方法的改进

大鼠脑组织灌注固定方法的改进卢文朋;栗世方【摘要】Objective Effective tissue perfusion fixation plays an important role in immunofluorescence experiments and other studies .The aim of this study was to modify the method for perfusion fixation of rat brain tissues and improve the efficiency of the procedure . Methods Conventional thoracotomy was modified by cutting the skin from the xiphoid along the mediventral line to the lower jaw to expose both sides of the thorax and then freeing the chest wall .The tip of the infusion needle was cut off and the needle in-serted into the left ventricle , pushed to the ascending aorta , and fixed there to prevent sliding .Perfusion and fixation began after tho-racic aortic occlusion.The regulatory valve was opened , followed by infusion of 0.9%physiological saline and cutting the right atrial appendage .When the perfusate became clear , the infusion tube was replaced , without removal of the needle , and fixed with4%paraformaldehyde .The fixation process was slowed down gradually till the neck became stiff , which indicated its completion . Results The head, neck and upper limbs were all fixed desirably by this method , which shortened the operation time , saved 4%paraformalde-hyde, and achieved satisfactory immunofluorescence results as compared with conventional procedures . Conclusion The modified method is simple , obviously improves the results of perfusion fixation of rat brain tissue , and therefore deserves to be popularized .%目的:免疫荧光等实验研究中良好的组织灌注固定效果对实验结果至关重要。
大鼠脑缺血再灌注后catheps...

大鼠脑缺血再灌注后Cathepsin B介导的细胞凋亡与Caspase-8-Caspase-3凋亡信号通路的关系摘要目的建立大鼠大脑中动脉缺血再灌注损伤模型,通过TTC染色观察不同实验组动物模型脑梗死体积变化,TUNEL检测各实验组不同时间点凋亡细胞数,Western Blot检测Cathepsin B、Caspase-8、Caspase-3在不同时间点蛋白的表达水平,通过分析其各种蛋白表达水平的变化规律,判断Cathepsin B与Caspase-8-Caspase-3信号通路之间的关系。
使用Cathepsin B、caspase-8特异性抑制剂进行干预,从而推断Cathepsin B与Caspase-8-Caspase-3信号通路之间可能存在的关系。
通过电镜酶组织细胞化学法观察各信号通路关键蛋白的特异性抑制剂干预前后的各个时相溶酶体超微结构变化,进一步从微观方面探讨Cathepsin B 与Caspase-8-Caspase-3信号通路和溶酶体之间相互关系。
探讨Cathepsin B介导的细胞凋亡与Caspase-8-Caspase-3凋亡信号通路在神经细胞凋亡中的相互关系。
方法本实验选用健康清洁级雄性SD(Sprague-Dawley)大鼠制备MCAO模型,共成功造模262只,鼠龄10~12周左右,体重约240~280g。
采用完全随机设计,随机将大鼠分为四大组:将大鼠分为脑缺血再灌注组(简称模型组,IRI组82只)及假手术组(16只),抑制剂CA-074Me组(简称CBI组82只),抑制剂Z-IETD-FMK(简称C8I组82只),以上四组大鼠按再灌注后0min、15min、30min、2h、6h、12h及24h再分成7个亚组(除24h时间点为16只大鼠外,其余每个时间点亚组为11只)。
假手术对照组除了插线较短,不阻塞右侧大脑中动脉外,其他手术流程与其他三组一样。
本实验使用改良Longa线栓法制备右侧大脑中动脉局灶性梗死模型(MCAO),选择在大鼠脑缺血2h后拔除线栓,形成再灌注模型。
灌注取脑

大鼠灌注取脑流程一、麻醉10%水合氯醛(0.4ml/100g)腹腔注射二、开胸1、沿两侧肋弓剪开皮肤,打开腹腔,用一血管钳夹持剑突并向上提拉。
2、用弯剪在膈肌与胸骨柄相连处剪一小口,造成人工气胸,然后向两侧顺延,剪断膈肌及肋骨,夹持剑突的血管钳将剑突连带胸廓上翻固定,充分暴露心脏。
三、穿刺将灌注针插入主动脉内是灌注固定的关键,也是难点。
1、首先准确找到主动脉,这是此步骤的要点。
可用温生理盐水将胸腔内的血液冲洗干净,用眼科镊子轻轻夹住心外膜(夹的越少越好,以免影响取材)将心脏向左上方提起(剪开心包壁层的前壁,暴露升主动脉和肺动脉干的根部)。
2、穿刺之前要用适当大小的血管钳夹住心室以固定心脏,但不要夹得过紧,要让心腔内留有一定的间隙。
用小剪刀在心尖处先剪开一个小口,再插入穿刺针。
3、插入时动作要慢,针尖方向不要偏向右侧,以免刺入右心房,如果感到有阻力,则将针退后、调整方向重新进针,直到进入主动脉,灌注针进入主动脉后可在心脏的上方看到其位置,灌注针进入主动脉的长度最好为3~5毫米,然后用丝线扎紧。
4、灌注针插入成功后,用小剪刀剪开右心耳。
四、灌注1、用量(夹闭腹主动脉)4℃生理盐水(50-100ml/只),4℃的4%多聚甲醛(50-100ml/只)2、速度先快后慢,共用30分钟左右3、成功标志生理盐水:右心耳流出液体血色较浅基本澄清,肺脏、眼珠、爪子迅速变白是排出血液的有效观察指标。
多聚甲醛:刚开始灌注时老鼠前肢剧烈抽动(下肢不抽动证明腹主动脉夹闭完全);前肢及颈部僵硬;所灌注的脑组织白而硬。
五、取脑1、枕骨大孔处用剪刀横断,小心地于枕骨大孔斜插入剪刀剪开顶骨。
2、用止血钳掰断两边地顶骨,注意嗅球上地顶骨也要仔细去掉。
3、用剪刀于一侧剪断视神经并探到颅底,就可以将整块的脑组织翘起。
六、保存取出的整个脑组织块再置于4%多聚甲醛4℃保存。
大鼠脑干缺血再灌注模型制备—脑干缺血再灌注损伤病理和脑干血流变化的开题报告

大鼠脑干缺血再灌注模型制备—脑干缺血再灌注损伤病理和脑干血流变化的开题报告
一、研究背景
脑干缺血是指由于脑干区域的缺血缺氧所引起的一系列病变和生理功能障碍,其病理机制复杂,临床常常导致患者死亡或重度残疾。
为了探究脑干缺血的发生机制及治疗方法,建立动物模型来模拟临床情况已成为研究该领域的重要手段。
二、研究目的
本研究目的是通过建立大鼠脑干缺血再灌注模型,观察脑干缺血再灌注损伤病理和脑干血流变化,为进一步研究脑干缺血的发生机制及治疗方法提供实验依据。
三、研究内容
1. 建立大鼠脑干缺血再灌注模型:选用健康雄性Sprague-Dawley 大鼠,按照常规的手术操作方法,暴露脑干,通过中颅窝钻孔或颅骨钻孔将大鼠脑干缺血1小时,再进行再灌注,模拟临床脑干缺血再灌注的情况。
2. 观察脑干缺血再灌注损伤病理:取出大鼠脑干,对组织进行病理切片,HE染色,观察神经元坏死和炎症细胞浸润情况。
3. 检测脑干血流变化:采用多普勒超声技术,对大鼠脑干血流变化进行监测和记录,观察在脑干缺血再灌注过程中血流的变化情况。
四、研究意义
本研究的建立大鼠脑干缺血再灌注模型,可以模拟临床脑干缺血再灌注损伤的情况,为这类疾病的研究提供实验依据。
观察脑干缺血再灌
注损伤病理和脑干血流变化,有助于了解脑干缺血再灌注的病理机制,为进一步寻找治疗方法提供理论依据。
大鼠灌注固定取脑解剖取材

大鼠脑组织取材步骤
1.剪开皮肤
• 2.用钩镊再眼眶处固定大鼠颅骨,用组织剪 再颅骨和颈椎连接处剪断
• 3.组织剪头部伸入枕骨大孔,尽量贴着骨头(不能插太深伤到脑组织)。
• 4.组织剪从枕骨大孔处伸入,朝向同侧眼眶 方向,贴着骨头剪,剪到眼眶
5.从大鼠眼眶之间剪断
6.左手持钩镊插入大鼠的眼眶固定颅 骨,用弯钳直接夹住枕骨大孔处的骨 头直接就掀起来了
• 简便方法:先配好PBS,称好相应的多聚甲醛,37℃水浴或温箱 • 密封放置2天,就能全溶。若是很急,55℃水浴一天,期间不时 • 震荡。注意,4%的多聚甲醛需临用前配制,配制后需过滤去除小
的杂质,避免心脏灌流时造成栓塞影响灌流效果。
• 也可用10%福尔马林溶液,甲醛1:10稀释 甲醛100ml 磷酸二氢钠4g 磷酸氢二钠6.5g 蒸馏水900ml 或甲醛100ml加900mlPBS缓冲液。
常见问题
1.灌注取脑不可用于Western blot及PCR的原因
• 多聚甲醛使组织蛋白发生交联,以保持蛋白的原位和表 面结构不变,从而能使其对应的抗体,准确检测其表达 的位置和量。
• Western中,要用去污剂使各种蛋白发生变性、解聚, 并变成统一的线性肽链,从而能够用凝胶电泳进行分子 量的梯度分离。多聚甲醛会影响蛋白的解聚,从而使其 无法用凝胶分离。 另外,WB和免疫组化所使用抗体的 抗原表位也不同,WB的抗体一般识别蛋白的一级结构, 所以可能也无法识别甲醛处理的蛋白。
生理盐水冲洗
4%多基甲醛固定
取脑
保存或切片.
具体过程
大鼠经深度麻醉后,固定于自制的手术木
板置于解剖盘中,开胸暴露并游离出心脏,经 左心室插入灌流针并固定, 切开右心耳,先灌 注冰冻无菌生理盐水(4℃)XmL,直到肝和肺 脏颜色转白及右心房流出液澄清,后再灌注 冰冻(4℃)4%多聚甲醛XmL,断头取脑,多聚甲 醛浸泡固定24小时。
灌注固定大鼠的技术操作及常见问题

灌注固定大鼠的技术操作及常见问题刘海燕 在组织学取材和科研活动中常常要用到大鼠,取材时组织材料一要尽量保持活体时的状态,二要尽量避免使动物长时间处于痛苦和濒死状态,引起病理假象,干扰科研结果。
灌注固定是使动物在麻醉状态下,先灌入生理盐水,再灌入固定液,即组织材料还是活体的时候即被初步固定,这样能够最大限度地保持组织细胞活体时的状态,避免抗原的丢失。
动物在被处死时没有痛苦,组织器官的结构更加清晰。
现将多年来进行灌注固定大鼠的技术操作和常见问题分析如下。
1 灌注固定的方法和步骤1.1 准备物品 每只大鼠需要准备37℃的温生理盐水500 ml;10%的中性甲醛或4%的多聚甲醛固定液500ml;500ml 的输液瓶2个;输液管2副;三通1个,镊子、剪刀、止血钳各2把;灌注针(将12号注射用针头的针尖掐断磨钝圆、光滑即可)1个。
1.2 步骤 1)将两个输液瓶中分别装满生理盐水和固定液并将输液管安装在生理盐水瓶上并调整好,使管内没有气泡。
2)将动物麻醉,数分钟后,待动物前后肢放松,即可准备灌注。
3)将已麻醉的动物仰卧在解剖台上,固定四肢,用左手持镊子夹起腹部皮肤,右手持剪刀自腹部剪一小口,由此沿腹中线和胸骨剑突中线向上将皮肤剪至下颌,分离皮下组织,将皮肤翻向两侧,再沿腹中线和胸骨中线向上剪开胸骨,沿膈肌向两侧剪开,并用止血钳将胸骨和胸部的皮肤钳紧,将止血钳翻向外侧以充分暴露心脏。
小心用镊子将心包打开,滴一些生理盐作者单位:齐齐哈尔医学院微形态实验室邮 编 161042 收稿日期 2005-09-20水保持湿润。
4)分离出主动脉,穿一根丝线,准备结扎灌注针。
5)将左心室尖用眼科剪刀剪开一小口,将灌注针插入左心室并送至主动脉内,用丝线结扎牢固,使之不能退出,打开调节阀,灌注生理盐水,灌注时的灌流量约20ml/分钟。
同时,剪开右心耳,使血液排出。
观察肝脏逐渐变为白色为止。
6)旋转三通使之对准灌注液,开始灌注固定液。
大鼠灌注取脑培训资料

大鼠灌注取脑大鼠灌注取脑用途:1.用于常规HE染色,免疫组化分析。
2.冰冻切片可以不做脑组织固定。
3.不可用于western blot和PCR。
4.如果观察脑组织的缺血、损伤或其它病变时,不作灌注固定,而是在取出脑组织后作固定,将大大影响效果。
原理:心脏灌流术能够快速冲净血液并在动物死亡前进行组织的前固定,避免了组织的自溶现象,是脑组织切片观察的常用方法。
多聚甲醛使组织蛋白发生交联,以保持蛋白的原位和表面结构不变,从而能使其对应的抗体准确检测其表达位置和量。
必要性:1.脑组织较软,且细胞成分不易保留,脑组织是较易软化的组织之一,血供也较为丰富,所以最好是在取脑组织前用4%多聚甲醛灌注固。
2.经前固定后,取脑操作时,可减少脑组织损伤。
3.脑内血液都在,HE染色后,可去除红细胞背景影响。
大鼠灌注取脑标准操作规程(SOP):流程:1)麻醉 2)开胸 3)心脏左心室穿针,剪开右心耳 4)生理盐水冲水 5)4%多基甲醛固定 6)取脑 7)保存或切片.具体过程:大鼠经深度麻醉后,固定于自制的手术木板上,置于解剖盘中,开胸暴露并游离出心脏,经左心室插入灌流针并固定, 切开右心耳,先灌注冰冻无菌生理盐水(4℃)XmL,直到肝和肺脏颜色转白及右心房流出液澄清,后再灌注冰冻(4℃)4%多聚甲醛XmL,断头取脑,多聚甲醛浸泡固定24小时。
Tips:1.多聚甲醛的配置:一般方法为:4%多聚甲醛PBS缓冲液配法:称取40g PFA溶于装有500mlDEPC水的玻璃容器(烧杯或烧瓶)中,持续加热磁力搅拌至60~65℃,使成乳白色悬液。
用1.0mol/L的NaOH值至7.4,使呈清亮状(滴加),再加入约500ml PBS,充分混匀(在冰浴或冷水浴中),可再检测一下pH,过滤后定容至1000ml,室温或4℃保存备用。
简便方法:先配好PBS,称好相应的多聚甲醛,37℃水浴或温箱密封放置2天,就能全溶。
若是很急,55℃水浴一天,期间不时震荡。
灌注取脑实验报告

一、实验目的1. 掌握动物解剖技术,熟悉小鼠心脏灌流及取脑的方法。
2. 了解脑组织在生理学、病理学等研究中的重要性。
3. 提高实验操作技能,培养严谨的科学态度。
二、实验原理灌注取脑实验是研究脑组织生理、生化及病理变化的重要方法。
通过心脏灌流,将生理盐水或特定试剂注入动物体内,达到清除脑组织中的血液、细胞等杂质,便于后续实验研究。
本实验采用小鼠作为实验动物,通过心脏灌流及取脑,获取脑组织样本。
三、实验材料1. 实验动物:成年小鼠2. 仪器:解剖显微镜、手术器械、灌流装置、剪刀、镊子、注射器、注射针、泡沫板、生理盐水、固定液等3. 药品:戊巴比妥钠、肾上腺素、生理盐水、固定液等四、实验步骤1. 麻醉:将小鼠放入戊巴比妥钠溶液中,待小鼠失去意识后,立即用针头固定在泡沫板上。
2. 解剖:扯起小鼠胸部皮肤,用剪刀剪开胸部肌肉,暴露心脏。
3. 心脏灌流:用注射针连接灌流装置,将生理盐水注入小鼠心脏,使血液流向脑部。
4. 取脑:待生理盐水灌流完成后,将小鼠头部朝下,用剪刀剪开颅骨,暴露脑组织。
5. 固定:将脑组织取出,放入固定液中固定,以便后续实验研究。
6. 清洗:将固定好的脑组织用生理盐水清洗,去除杂质。
7. 标本保存:将清洗后的脑组织放入装有固定液的容器中,密封保存。
五、实验结果与分析1. 实验结果:通过心脏灌流及取脑,成功获取了小鼠脑组织样本。
2. 结果分析:本次实验操作规范,脑组织样本质量良好,为后续实验研究提供了有力支持。
六、实验讨论1. 实验过程中,应注意操作规范,避免损伤脑组织。
2. 灌流速度不宜过快,以免损伤脑组织。
3. 固定液的选择对脑组织样本质量有重要影响,应选用合适的固定液。
4. 实验过程中,应注意动物福利,尽量避免动物痛苦。
七、实验总结本次实验成功进行了小鼠心脏灌流及取脑操作,掌握了动物解剖技术,为后续实验研究奠定了基础。
在实验过程中,我们应注重操作规范,确保实验结果的准确性。
同时,本次实验也使我们认识到动物福利的重要性,为今后实验研究提供了有益经验。
脑灌注报告模板范文

脑灌注报告模板范文一、引言脑灌注是指血液通过脑血管系统,将氧、营养物质和代谢产物输送到脑组织中,为脑细胞提供必需的物质和能量。
脑灌注的变化与脑功能密切相关,因此研究脑灌注对于了解脑功能以及诸如中风、脑肿瘤等与脑灌注异常相关的疾病具有重要意义。
本报告将介绍脑灌注的研究方法、结果和讨论,为进一步的相关研究提供基础。
二、方法1. 实验对象实验对象为20只成年雌性小鼠,体重20~25g,随机分为两组。
2. 手术准备使用逆行灌注技术进行实验,雌性小鼠在麻醉状态下进行手术,先行暴露颅骨,然后将临时支架固定在颅骨上,插入计量在0.99±0.03mm的导管。
3. 灌注仪器设置安装逆行灌注仪器,在动脉灌注部分设定灌注压力为80~100mmHg,初始脑灌注速率为1.5ml/min。
4. 灌注过程观察记录逆行灌注过程中的压力、速率以及颅内压力的变化。
三、结果1. 脑灌注速率与压力的变化在实验过程中,脑灌注速率与压力均表现出了随时间的变化。
在初始阶段,脑灌注速率和压力呈上升趋势,随后逐渐趋于平稳并维持在一定水平。
灌注过程中,灌注速率和压力的变化趋势较为一致。
2. 脑灌注速率与颅内压力的关系通过记录脑灌注速率和颅内压力的变化,发现二者之间存在一定的相关性。
当脑灌注速率上升时,颅内压力也相应上升;当脑灌注速率下降时,颅内压力也随之下降。
表明脑灌注速率与颅内压力之间存在相互影响的关系。
四、讨论本实验采用逆行灌注技术对小鼠进行脑灌注实验,并观察到脑灌注速率、压力和颅内压力的变化趋势。
结果显示脑灌注速率与压力呈上升-平稳变化趋势,同时脑灌注速率与颅内压力之间存在相关性。
这些结果提示灌注速率可以通过调节脑灌注压力来影响颅内压力。
进一步开展研究,可以探究不同灌注速率对颅内压力及脑功能的具体影响。
总结:本报告提供了一份,通过实验方法、结果和讨论对脑灌注进行了研究。
通过对小鼠的实验观察,发现脑灌注速率与压力以及颅内压力之间存在相关性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大鼠灌注固定取脑 YKK standardization office【 YKK5AB- YKK08- YKK2C- YKK18】
大鼠灌注固定取脑
具体方法:
1. 配4%多聚甲醛PBS缓冲液。
配法:称取40g PFA溶于装有900ml PB或PBS 的玻璃容器(烧杯或烧瓶)中,持续加热磁力搅拌至60~65℃,搅拌子速度从低到高,慢慢增加,至充分溶解。
定容至1000ml,边搅拌边滴加L的NaOH直至,过滤后室温或4℃保存备用。
2.制作灌注装置,一瓶生理盐水,一瓶灌入多聚甲醛,悬挂,输液器链接,远端结一个三通后到一个输液器粗针头端。
3.经心脏行灌注固定:麻醉,充分显露心脏(插针)和肝脏(判断),尽可能多暴露心脏,利于操作。
首先快速滴入生理盐水或PBS,用止血钳(选把好的很关键)预夹住心尖少部,持针从心尖略偏左下进,插入有突破感即停(小鼠室壁厚约1mm),大头针或止血钳固定,若正确进入,右房充盈,剪破右房,此时液体较快下滴(调整针头朝向),红色血液从右房流出,快速冲尽全身血液(否则影响免疫反应),时间约4-5min,约40ml/只小鼠,80ml/只大鼠(取水冲洗切口,防血液凝固)。
流出液变白即可,盐水过多细胞死亡多。
正确的标志:右房充盈(但不是迅速充盈),肝脏逐渐变白,口鼻干燥。
再注入4%多聚甲醛灌注30min左右,多聚甲醛要偏快,100ml/只小鼠,200ml/只大鼠。
大鼠不建议用灌注机(先排空管中空气,再行灌注。
)它的灌流速度达不到。
灌注正确标准:换多聚甲醛后身体反应,尤其尾巴竖起、四肢伸直变硬。
PBS或NS灌流时,血流丰富的脏器如肝脾肾等的颜色会迅速转为灰白,此为灌流正常;另外,大鼠耳尖,口唇,四肢掌部也会变苍白。
4.取脑:枕骨大孔处用剪刀横断,小心地于枕骨大孔斜插入剪刀剪开顶骨,用止血钳掰断两边的顶骨,注意嗅球上地顶骨也要仔细去掉,用剪刀于一侧剪断视神经并探到颅底,就可以将整块的脑组织翘起。
灌注成功则脑变白,无红色血管。
5. 最后在同样固定液中4℃固定12小时(包新民做的是一周),沉糖切片。
有几点体会:①.4%多聚甲醛的配制:加热至60~65℃固然融解的快,不过容易挥发,气味难闻,不是好的选者。
在此强烈推荐:先配好PBS,称好相应的多聚甲醛,37℃水浴或温箱密封放置2天,就能全溶。
②.灌注时夹上腹主动脉只灌注上肢及头脑,固定的好又快,又省多聚甲醛。
多聚甲醛用100ml以下即可。
③.灌注时注意排空输液管中的气泡不然容易气栓,影响灌注效果。
一定要看到大鼠较剧烈抽搐,不然证明灌注不好。
个人体会:1、多聚甲醛加热溶解很快,只需要15分钟左右,需配置的量比较大的时候是较合适的方法。
如果有通风厨的可在通风厨内配置。
在通风较好的地方配置也可以,但配置的时候配溶液的人一定要注意自我防护,味道确实很刺激!2、开胸时不要伤到心脏。
3、心脏穿刺最好用留置针,软,不宜穿通室间隔,见血即退针芯。
插针部位是心尖部,方向向中线(先主动脉插管,再右心耳放血,这样插管容易些。
先剪右心耳的话,心脏会瘪下去的)。
4、生理盐水冲血管,到右心耳流出无色液体。
5、多基甲醛固定成功的表现是刚开始灌注时老鼠剧烈抽动;成功后老鼠后肢绷直,尾部竖起成一直线;所灌注的脑组织白而硬。
5、根据你实验设计,,需要切片的部位,有重点的取,常见的体表标志是前囟和外耳道。
6、去颅骨后脑表面有一层硬脑膜,要去掉。
7、后固定:灌流后的脑组织置于4%PFA置4度冰箱内进行后固定,时间>2h,过夜最好。
恒流泵的方法
在心尖搏动明显的部位,朝向主动脉插入灌流针即从心尖插入灌流针,通过左心室直至主动脉;打开腹腔,结扎腹主动脉;剪开右心耳,插人聚乙烯管,用以液体回流。
打开恒流泵以10 ml/min的速度开始从心脏灌注温生理盐水,以清除血液,并开始计时,直至回流管流出晶莹明亮的液体,记录时间和生理盐水的使用量。
然后用4 % 多聚甲醛以5ml/min的速度灌流15min,并分别在第5 min 、第10 min、第15min夹闭前腔静脉,暂停灌流1 min,让固定液在大鼠的脑组织中充分作用;最后打开颅腔,切取其脑组织,并置于固定剂(4 % 多聚甲醛和30 % 蔗糖溶液) 中,4 ℃保存直至切片。
所获得的脑组织呈乳白色,质地较硬,且所需灌注时间和生理盐水使用量均为最少。
