化学反应动力学基础-学生.doc
第7章 化学动力学基础

例:有一化学反应aA+bB=C在298K时,将AB溶液按
不同浓度混合。得到下列数据。
A的初始浓度 B的初始浓度 1.0 1.0 2.0 1.0 4.0 1.0 1.0 1.0 1.0 2.0 1.0 4.0 求其速率方程? 初始速度(mol/l· s) 1.2×10-2 2.3×10-2 4.9×10-2 1.2×10-2 4.8×10-2 1.9×10-1
( H O ) C (H O ) C (H O ) v t t
2 2 2 2 2 1 2 2
作出H2O2的 c — t 的曲线,得到 0 — 40
min的平均速率:
v 0.20 0.80 0.20 0.80 0.015mol dm 3 min 1 t 40
求该反应的反应级数m+n和速度常数k?
解:由速度方程v=k[CO]m· 2]n [Cl 得:v1=k[CO]m· 2]1n v2=k[CO]m· 2]2n [Cl [Cl
n v1 [Cl 2 ]1 v2 [Cl 2 ]n 2
2 v1 1.2 10 lg lg v2 4.26 10 3 0.45 1.5 n [Cl 2 ]1 0.10 0.30 lg lg [Cl 2 ]2 0.050 v1 1.2 10 2 lg lg v3 6.0 10 3 1 m [CO ]1 0.10 lg lg [CO ]3 0.050
解:由v=k[A]m· n [B] v1=k×1m×1n=k=1.2×10-2
v2=k×2m×1n=k×2m=2.3×10-2
v1 1 1.2 10 2 1 m 2 v2 2 2.3 10 2
v4=k×1m×1n=1.2×10来自2 v5=k×1m×2n=4.8×10-2 ∴k×2n=4.8×10-2 2n=4.8×10-2/k=4=22 ∴n=2
化工-第七章 化学反应动力学基础

反应速率与转化率:
设A组分:n A0 初始量、t反应时间、n At时刻瞬时量 x At时刻瞬时转化率 反应消耗的A的量 n A0 n A xA 反应初始时A的量 n A0 即: n A n A0 (1 x A ) 若反应前后体积变化不大:c A c A0 (1 xA ) 1 dnA 1 nA0 dx A 则: rA V dt V dt nA0 x A
转化为目的产物的反应物的物质的量 选择性()= 反应物被转化掉的物质的量 收率:
收率()= 转化为目的产物的反应物的物质的量 进入反应器的反应物的物质的量
二、复杂反应的速率方程式
1、平行反应:
k2 A B S dcS dcP a1 b1 a b 则:rp k1c A cB rS k2c A2 cB2 dt dt rp k1 a1 a2 b1 b2 平行反应速率之比为: = c A cB rS k2 k1 A B P
第七章 化学反应动力学基础
内容: 2、简单反应的速率方程式 4、本征动力学和宏观动力学
1、化学动力学基本概念 3、简单反应和复杂反应
重点: 2、简单反应和复杂反应
1、简单反应的速率方程式
§7-1 化学动力学基本概念
一、化学计量方程式
复杂的化学计量方程式: 0= i Bi
n
i : 为组分Bi的计量系数。反应物为负、产物为正。
r f (c, T ) r f (T ) (c) f (T ):反应速率的温度效应、 (c):反应速率的浓度效应 f (T )常表示为反应速率常数k : k A exp( E 对于均相反应:aA bB sS
( c) c cB A
化学反应动力学--第一、二章

i
i
Δni是反应体系中某种组分的物质的量的
产物。 特点:欲测的物理量不随空间位置而变化, 但却随时间而变化。
开放体系流动体系:反应过程中有物质的交 换,即不断补充作用物和取走产物。
特点:体系中某物理量随空间位置而变化, 但流动中某位置的物理量却不随时间而变 化。
流动体系示例图
2. 按参加反应的物质状态分类: 均相反应体系单相反应体系:只有一个相。
上述历程反应的组合为:
H2 + Br2→2HBr
还要注意:有些总反应也是基元反应。
如已知反应:2NO+O2→2NO2是基元反 应。也即该反应从历程上说:是一步完成 的,符合基元反应的定义,是基元反应。
因历程反应的组合构成总包反应。所以 该反应也是总反应。
因此,为了区分,人们引进了简单反应 和复杂反应的概念。
我们说:上述反应满足了热力学条件, 但未满足动力学条件。
如果点火或加催化剂(如铂黑),加热到 800℃以上,则上述反应能在瞬时完成,以 至于发生爆炸。
可见,改变反应条件,可改变了动力学 上的不利情况。
所以从控制化学反应过程而言,化学动 力学的研究是非常重要的。
另外,化学动力学须考虑过程和途径。 化学反应方程式只表示:
(2) 简单反应和复杂反应 描述的对象:总(包)反应。 如果总反应是一步完成的,即是基元反 应的话,则该反应称为简单反应。 如: 2NO+O2→2NO2 如果总反应是分步完成的,即是由若干 个基元反应构成,则该反应为复杂反应。 如:H2 + Br2→2HBr
几个注意点: ✓ 从反应方程式是无法判定一个总包反应
即反应的机理或历程是如何的? 目的:能使我们较好的控制反应的进行。
二、动力学和热力学的关系 研究化学反应,必须考虑二方面的因素: 一是热力学方面的因素;(方向与程度) 二是动力学因素。(反应速率)
第二章 反应动力学基础

深入理解:
反应进度的意义。
反应网络的概念和应用背景。 真实吸附和吸附等温式的联系与区别。 动力学参数的确定和建立速率方程的一般步骤。 动力学参数的确定和建立速率方程的一般步骤。
7
da S g dW S g ( b dVr ) aV dVr
2.2 反应速率方程
在溶剂、催化剂和压力等因素一定的情况下,描述反应速 率与温度和浓度的定量关系,即速率方程或动力学方程:
r f (c, T )
A A B B R R
若为基元反应,可根据质 量作用定律直接写出:
Top
RT E 1 e n E E E
因此,存在一个最佳反应温度,此温度下 的反应速率最大。
Te为反应体系中 实际组成对应的 平衡温度,为转 化率XA的函数, 因此, Top是XA的 函数。 22
平衡曲线
最佳温度曲线
XA
可逆吸热反应的反应速率与温度 及转化率的关系图 可逆放热反应的反应速率与温 度及转化率的关系图
kc ( RT ) k p ( RT / p) k y
13
2.3 温度对反应速率的影响
k Ae
E RT
E 1 ln k ln A ( ) R T
K
T , k A T 0, k 0
lnK
E 斜率=- R
T
1/T
14
化学反应动力学基础(一)-学生

5202 反应 2O 3→ 3O 2的速率方程为 - d[O 3]/d t = k [O 3]2[O 2]-1 ,或者 d[O 2]/d t = k '[O 3]2[O 2]-1,则速率常数 k 和 k ' 的关系是: ( )(A) 2k = 3k ' (B) k = k ' (C) 3k = 2k ' (D) -k /2 = k '/3 5203 气相反应 A + 2B ─→ 2C ,A 和 B 的初始压力分别为 p A 和 p B ,反应开始时并无 C ,若 p 为体系的总压力,当时间为 t 时,A 的分压为: ( )(A) p A - p B (B) p - 2p A (C) p - p B (D) 2(p - p A ) - p B 5204 对于反应 2NO 2= 2NO + O 2,当选用不同的反应物和产物来表示反应速率时,其相互关系为:( )(A) -2d[NO 2]/d t = 2d[NO]/d t = d[O 2]/d t (B) - d[NO 2]/2d t = d[NO]/2d t = d[O 2]/d t = d ξ /d t (C) - d[NO 2]/d t = d[NO]/d t = d[O 2]/d t (D) - d[NO 2]/2d t = d[NO]/2d t = d[O 2]/d t = 1/V d ξ /d t 5207 气相基元反应 2Ak 1B 在一恒容的容器中进行,p 0为 A 的初始压力, p t 为时间 t 时反应体系总压,此反应速率方程 d p t / d t = 。
- k (2p t - p 0)25208 有一反应 mA → nB 是一简单反应,其动力学方程为 -d c A / d t = kc A m, c A 的单位为 mol ·dm -3,时间单位为 s ,则:(1) k 的单位为 ___________ mol 1- m ·dm 3( m -1)·s -1 (2) 以d c B /d t 表达的反应速率方程和题中给的速率方程关系为B A A A 1d 1d 'd d m mc c k c k c n t m t m=-== 5209 反应 2N 2O 5─→ 4NO 2+ O 2 在328 K 时,O 2(g)的生成速率为0.75×10-4 mol ·dm -3·s -1。
化学反应动力学基础N

3.5910 4 3.6010
3.62 10 4 3.6110
4
3.61104 3.68104
N2O5的分解速率与N2O5浓度的比值是恒定的,
即反应速率 r 与 c(N2O5) 成正比。
即:
r kc( N2O5 )
对于一般的化学反应:
aA bB yY zZ
到达一定的温度,速率反而下降。如多相催化 反应和酶催化反应。 (4)速率在随温度升到某一高度时下降,再升高温 度,速率又迅速增加,可能发生了副反应。 (5)温度升高,速率反而下降。这种类型很少, 如一氧化氮氧化成二氧化氮。
T
T
T
T
T
一、 范特霍夫规则
1884年 Van' t Hoff 提出:
kT 10K 2~4 kT
c-t图
r-c图
40℃,CCl4中N2O5分解反应的r:c( N2O5 )
t /s
0 300 600 900 1200
r : c N 2 O5 / s1
t /s
1800 2400 3000 4200 5400
r : c N 2 O5 / s
1
3.6510
4
4
3.64104 3.6210 3.6910
2
1 k kA 0
仅适用于只有一种反应物的纯U-238就
有0.257mg的Pb-206。试计算此岩石的年
龄。已知U-238的半率期为4.5109年。
解:假设分析时U-238的量为1mg ,岩石中原来铀
的总量应为1mg加上衰变为Pb-206的量。
238 m(U 238 ) 1.000 mg 0.257 mg 1.297 mg 206
反应动力学基础

一氧化氮氧化动力学方程建立
由于第二步为速率的控制步骤因此有:
r k2C( NO ) 2Co2
2 C K C 1 NO 第一步达到平衡,则 有: ( NO) 2
代入上式得
r k2 K1C Co2 k2C Co2
2 NO 2 NO
因此,当得到的速率方程与由质量作用定律得到的形
r dW
8
空速与接触时间
空速:单位反应体积所处理的混合物的体积流量。因
次为时间的倒数(1/h)。
VS 0 VSP VR
计算空速时的体积流量一般使用标态体积,特殊说明
时可使用操作状态流量。也有使用摩尔流量的,称为 摩尔空速。 是衡量反应器生产强度的重要操作参数。例如:氨合 成反应,压力为10Mpa时,空速为10000(1/h);而当压 力为30Mpa时,空速则为28000-30000(1/h)。
例:NO氧化反应速率方程
对于反应 2 NO O2 2 NO2 得到的速率方程为: r kC 2 C NO O 2 该动力学方程并非是由基元反应的质量
作用定律得出.有学者认为该反应由下列 两步组成 :
NO NO ( NO) 2 ( NO) 2 O2 2 NO2
并且第二步为速率的控制步骤.
式中 A为指前因子,其因次与k相同;E为活化 能;R为气体常数。
30
反应速率常数因次
反应速率常数的因次与反应速率的表示方式,速率方
程的形式以及反应物系组成的表示方式有关。 反应级数(一级、二级)、反应速率的因次(以反应 体积计、以催化剂质量计、以相界面计的反应速率)、 对于气相反应,常用分压、 浓度和摩尔分率 来表示 反应物系的组成, 则 之间有下列关系 k ,k ,k
化学反应动力学基础(一)-学生答案

物理化学试卷答案一、选择题( 共62题108分)1. 1 分(5202)5202[答] (C)2. 2 分(5203)5203[答] (C)3. 2 分(5204)5204[答] (D)4. 1 分(5222)5222[答] (D)5. 2 分(5223)5223[答] (A) k C= k p(RT)6. 2 分(5224)5224[答] (D)7. 1 分(5251)5251[答] (A)8. 1 分(5252)5252[答] (C)9. 1 分(5253)5253[答] (C)*. 2 分(5254)525411. 2 分(5255) 5255[答] (D)12. 2 分(5256) 5256[答] (D)13. 2 分(5257) 5257[答] (C)14. 2 分(5258) 5258[答] (B)15. 2 分(5259) 5259[答] (C)16. 2 分(5260) 5260[答] (D)17. 1 分(5261) 5261[答] (B)18. 1 分(5262) 5262[答] (D)19. 2 分(5263) 5263[答] (B)根据1120()1(1)nncctn k c---=-20. 2 分(5264) 526421. 1 分(5265) 5265[答] (B)22. 2 分(5266) 5266[答] (A)23. 2 分(5267) 5267[答] (C)24. 2 分(5268) 5268[答] (A)25. 2 分(5271) 5271[答] (C)26. 2 分(5273) 5273[答] (B)27. 2 分(5275) 5275[答] (A)28. 2 分(5276) 5276[答] (A)29. 2 分(5277) 5277[答] (C)30. 2 分(5278) 5278[答] (B)31. 1 分(5279) 527932. 2 分(5281)5281[答] (B)33. 2 分(5285)5285[答] (C)34. 2 分(5286)5286[答] (C)设r = k[X]0 n[Y]0 mr2/r1= k (0.2 mol·dm-3/0.1 mol·dm-3) (0.1 mol·dm-3/0.1 mol·dm-3) = 72/18 = 42 n = 4 n = 2同理:2 m = 2 m = 135. 2 分(5288)5288[答] (B)36. 1 分(5289)5289[答] (D)37. 2 分(5290)5290[答] (B)38. 2 分(5291)5291[答] (A)39. 1 分(5294)5294[答] (C)40. 2 分(5296)5296[答] (D)41. 2 分(5297)[答] (B)42. 2 分(5301) 5301[答] (C)43. 2 分(5302) 5302[答] (D)44. 1 分(5303) 5303[答] (C)45. 1 分(5304) 5304[答] (C)46. 1 分(5305) 5305[答] (B)47. 1 分(5306) 5306[答] (C)48. 2 分(5308) 5308[答] (B)49. 1 分(5309) 5309[答] (A)50. 2 分(5426) 5426[答] (D)51. 2 分(5428) 5428[答] (C)52. 2 分(5552)[答] (D)53. 2 分(5553)5553[答] (C)54. 2 分(5554)5554[答] (C) ∵平行反应E总= (k1E1+ k2E2)/(k1+ k2)55. 2 分(5555)5555[答] (A)56. 2 分(5558)5558[答] (D)57. 2 分(5559)5559[答] (C)58. 2 分(5560)5560[答] (C) k1/k2= exp[-(E1-E2)/RT] 将数据代入即得59. 2 分(5561)5561[答] (A)60. 2 分(5562)5562[答] (B)61. 2 分(5651)5651[答] (A)62. 2 分(5652)5652[答] (D)二、填空题( 共36题70分)5207[答] - k (2p t - p 0)264. 2 分 (5208)5208[答] (1) mol 1- m ·dm 3( m -1)·s -1 (2)B A A A 1d 1d 'd d mmc c k c k c n tm tm=-==65. 2 分 (5209) 5209[答] 0.75×10-4, 1.50×10-4, 3.00×10-4 (1分) (0.5分) (0.5分)66. 2 分 (5210)5210[答] 0.75×10-2, 2.25×10-2, 1.50×10-2. (0.5分) (0.5分) (1分)67. 2 分 (5211)5211[答] r B =6.36 mol ·dm -3·h -1, r C =12.72 mol ·dm -3·h -168. 2 分 (5212) 5212 [答] r A =13r B =12r C69. 2 分 (5227) 5227[答] k a =12k70. 2 分 (5228)5228[答] k 1 = k71. 2 分 (5229)5229[答] 总包反应对 O 2 是一 级 对 NO 是 二 级5231[答] 一级 ; s -173. 2 分 (5238)5238[答] 因为化学计量关系式不应该影响速率方程, 所以此反应的速率方 程不变. (2分)74. 1 分 (5243)5243[答] 正整数 375. 2 分 (5310)5310[答] 11212l n (1)l n (1)t t θθθθ-=-76. 2 分 (5311)5311[答] 一级77. 2 分 (5313)5313[答] t = c 0 / k = 104 s78. 2 分 (5314)5314[答] k = 1/t ln(c 0/c ) = 1.7×10-4 s -1ln 1/(1-x ) = kt x = 0.95 = 95%79. 2 分 (5315)5315[答] (1) 与初始浓度无关 (2) 等于 33.3%80. 2 分 (5431)5431[答] 143 d t = -t N t N 1202/ln[()/]ln81. 2 分(5432) 5432[答] k =0.1318 a-1lgx20=-kt23030693102303526....=-⨯⨯=-0.57 x =5.4 mg82. 2 分(5433)5433[答] t1/2 =0.693/ k =2310 s83. 2 分(5450)5450[答] t = (1/k) ln(c0/c) = 48.78 min84. 2 分(5451)5451[答] 1/385. 1 分(5453)5453[答] 不是86. 2 分(5454)5454[答] t = 455 s87. 2 分(5464)5464[答] 级数为1, t12=ln2/k=1.87×104 s88. 2 分(5564)5564[答] k1k3[A][B]/k289. 2 分(5629)5629[答] k1/k2 或[B]/[C]90. 2 分(5630)5630[答] K=k1/k-1K(热)=Kν(动) ν为正整数91. 2 分(5631)5631[答] 加和, 快。
大学无机化学第五版第三章化学动力学基础

aA(aq) + bB(aq)
yY(aq) + zZ(aq)
r dcA dcB dcY dcZ adt bdt ydt zdt
对于定容的气相反应:
r 1 dpB
B dt
§3.2 浓度对反应速率的影响 —速率方程
3.2.1 化学反应速率方程
3.2.2 由实验确定反应速率方程的 简单方法——初始速率法
反应速率—— mol·L-1·s-1等 分类:平均速率( r )、瞬时速率( r )
若以C1、C2代表时间t1、t2时,某反应物或生成物的 浓度则:
平均速率:化学反应在某一有限时段内浓度的变化量。
_
r= ±
C2 - C1 t2 - t1
△C =±
△t
为使反应速率为正值:若用反应物浓度表示 C2﹤C1,△C为负,则前面加负号;若用生成物浓度表 示 C2﹥C1,△C为正,则前面取正号。
答:各物质的系数不同;各数值除以系数后相等。
对于一般的化学反应: 0 BB
B
定容条件下,定义:r d
Vdt
r——定容条件下的反应速率(mol·L-1·s-1)
d dnB dt Bdt r d dnB 1 dcB Vdt V Bdt Bdt
溶液中的化学反应:
反应 级数
2
1+1
2NOg O2 g 2NO2 g r k[c(NO)]2c(O2) 2+1
2+1 2NOg 2H2 g N2 g H2Og r k[c(NO)]2 c(H2 )
S2O82 aq 3I aq 2SO24 aq I3 aq
t/ s
VSTP O2 /mL cN2O5 / mol L1
化学反应工程 第二章 均相反应动力学基础

2 等温恒容过程
3 等温变容过程
化学反应工程
2.1 概述
1
化学反应速率及其表示
2
反应速率常数k
化学反应工程
2.1 概述
均相反应是指在均一的液相或气相中进行的反应,这 一类反应包含很广泛的范围。 研究均相反应过程,首先要掌握均相反应的动力学。
它是不计过程物理因素的影响,仅仅研究化学反应本身的
反应速率规律,也就是研究物料的浓度、温度以及催化剂 等因素对化学反应速率的影响。
2.2.1单一反应动力学方程的建立
(3)将步骤(2)所得到的各 对 作图,若得到的
为一条通过原点的直线,说明所假定的机理与实验数据相符合
。否则,需重新假定动力学方程并加以检验,此步骤如图2-6 (b)所示。
化学反应工程
2.2.1单一反应动力学方程的建立
例2-1 在恒容下的液相反应, ,实验测得
如下的数据,试用微分法和积分法建立动力学方程。
化学反应工程
2.1.1 化学反应速率及其表示
对于气相反应,由于分压与浓度成正比,也常常使用分 压来表示:
双曲线型动力学方程型式,如合成溴化氢的反应是一 个链反应,其动力学方程为:
化学反应工程
2.1.1 化学反应速率及其表示
化学反应工程
2.1.1 化学反应速率及其表示
常见的复合反应有:
连串反应
平行反应 平行-连串反应
化学反应工程
2.1.1 化学反应速率及其表示
化学反应速率的定义,是以在单位空间(体积)、单
位时间内物料(反应物或产物)数量的变化来表达的,用
数学形式表示即为:
化学反应工程
2.1.1 化学反应速率及其表示
化学反应工程
化学反应动力学的基础原理

化学反应动力学的基础原理化学反应是一种物质之间的相互作用过程,它决定了我们日常生活中很多事物的性质及其表现形式。
反应速率的大小不仅影响着化学工艺的效率,更关系到环境保护和能源的使用,因此,对化学反应动力学的研究具有十分重要的意义。
本文将介绍化学反应动力学的基本原理,从反应速率、反应机理到能量和温度等方面进行探讨。
1. 反应速率反应速率是描述反应进行情况的参数之一,它定义为单位时间内基元化学反应所消耗反应物的量或生成产物的量。
正常情况下,反应速率与反应进程的进展程度之间有密切关系,通俗的讲,就是反应速率随着化学反应的进行而不断变化。
反应速率的单位是摩尔/秒(mol/s)。
对于一般的化学反应,其反应速率可以描述为一下公式:在此方程式中,k是反应速率常数,它是由反应物的特性和反应条件的影响所确定的常数;A 是反应物的反应物浓度;Ea 是活化能,即反应物转化为生成物的必要能量,和温度存在可测量的关系;R 是气体常数;T 是绝对温度。
从这个公式不难看出,反应速率常数的值及其相关参数对反应速率的大小有着决定性的影响。
因此,了解这些参数的变化及其对反应速率的影响是非常重要的。
2. 反应机理在讨论反应速率方面时,我们提到了反应速率常数的值由反应物的特性和反应条件的影响所确定,这其中涉及到反应机理的问题。
反应机理是指化学反应按照一定的规律和顺序进行的过程。
了解反应机理是推导反应速率公式的重要步骤之一,在此过程中,通常先从分子层次上对反应物的相互作用进行分析,然后通过量化的方法推导出反应速率公式和反应机理的详细过程。
反应机理通常是基于实验数据以及理论计算来确定的。
3. 能量和温度对于化学反应来说,能量和温度的影响也是十分重要的。
化学反应是通过在反应物之间转移和释放能量的过程来进行的,因此反应物的能量状态是决定反应速率和反应机理的重要因素之一。
化学反应中最常见的能量是势能和动能,因此研究势能和动能的变化过程,对于预测反应速率常数和反应机理的变化有着重要的意义。
4第四章 化学动力学基础-2007

2NO(g) + O2 (g) → 2NO2 (g)
r = kc ( NO
)
2
c(O2 )
2+1 2+1 2+1 2+2 1+1 1+3
( 2NO g) + 2H2 (g) → N2 (g) + H2O(g) r = kc2 ( NO) c ( H2 )
2 S2 O 8 (aq ) + 3I (aq ) →
B
2. 化学反应速率方程
r = k∏c
B
nB B
k ---反应速率系数,比速常数,其物理意义是 反应速率系数, 反应速率系数 比速常数, 各反应物的浓度均等于单位浓度时的反应速率。 各反应物的浓度均等于单位浓度时的反应速率。 k的量纲与反应级数有关,为[浓度1-n 时间-1]。 的量纲与反应级数有关, 浓度 的量纲与反应级数有关 。
t/s p / kPa 0 20 50 80 100 120 150 180 200 50.65 46.60 41.03 35.43 33.43 30.39 26.85 23.81 21.78
作图, 作 ln p~ t 作图, k1 = - m = 4.2×10-3 s-1 ×
t1/ 2
ln 2 = = 165 s k1
S2 O + 3I → 2SO + I k1 2 ① S2 O8 + I 2S2 O8 I3 (慢 ) → 3 2 ② 2S2 O8 I + I → 2SO 4 + I 2 (快) ③ I + I 2 → I3 (快)
2 8
2 4
3
二、化学反应速率的表示
1. 反应速率:——单位体积反应体系中反应进度 反应速率: 单位体积反应体系中反应进度
第2章 反应动力学基础

温度一定:转化率↑ 可逆放热反应的速率↓ 温度一定:转化率↑,可逆放热反应的速率↓ 可逆放热反应按最佳温度曲线操作, 可逆放热反应按最佳温度曲线操作,反应速率最大
N2+3H2=2NH3 (A) 是在高温高压下采用熔融铁催化剂进行的。 是在高温高压下采用熔融铁催化剂进行的。合成氨反应为可逆 放热反应,故过程应尽可能按佳温度曲线进行。 放热反应,故过程应尽可能按佳温度曲线进行。现拟计算下列 条件下的最佳温度: 25.33MPa下 3:1的氢氮混合气进 条件下的最佳温度:(1)在25.33MPa下,以3:1的氢氮混合气进 行反应, 17%, %,(2) 但氨含量为12 12%, 行反应,氨含量为17%,(2)其他条件同(1),但氨含量为12%, (3)把压力改为32.42MPa,其他条件同(1)。 把压力改为3 MPa, 已知该催化剂的正反应活化能为58 618× J/mol, 58. 已知该催化剂的正反应活化能为58.618×103J/mol,逆 反应的活化能为167.48 167.48× J/mol。平衡常数K 与温度T(K) 反应的活化能为167.48×103J/mol。平衡常数K,与温度T(K) 及总压P(MPa)的关系如下: P(MPa)的关系如下 及总压P(MPa)的关系如下: logKp=(2172.26+19.6478p)/TlogKp=(2172.26+19.6478p)/T-(4.2405+0.02149p) (B) 解:(1)首先求出氨含量为17%时混合气体组成,再利用平衡 (1)首先求出氨含量为17%时混合气体组成, 首先求出氨含量为17 关系式算出Kp Kp值 利用式(B)求得平衡温度Te (B)求得平衡温度Te, 关系式算出Kp值,利用式(B)求得平衡温度Te,最后代入式 (2.37),即为所求。 (2.37),即为所求。
第2章 化学反应动力学基础
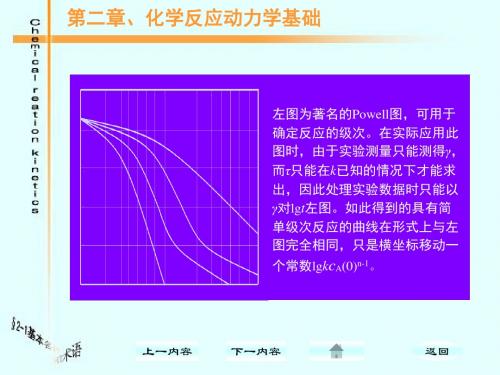
1.3.2 活化能因素: 对于基元反应来说,如果体系中一个组分有两 个以上的基元反应发生,则以活化能最低的发生反 应几率最大,这也是探索历程的一个重要线索依 据,由此因素,我们可以确定基元反应那些反应可 以发生,那些反应的发生可能性最小。
1.3.3 中间物和分子结构因素: 如果能从反应中检验某种中间物,则对反应历 程的确定将起重要作用,某些物质容易捕捉自由 基,反应体系加入这些物质,观察反应速率是否 下降,以判断体系中是否有自由基存在,而自由 基的存在常能导致链反应,此外,所设想的中间 物应与结构化学规律相符合,这就是需要考虑的 结构因素。
cCH3CHO(0)为乙醛的初始浓度。 式中,
上一内容 下一内容 返回
反应级数 当固定乙醛的初始浓度,可见在不同反应时间 测量反应速率时,r与
cCH3CHO 的平方成正比,
即称其时间级数为二级。如果以不同的初始浓
度进行试验,测定反应的初始反应速率,则与 乙醛的初始浓度的一次方成正比,即称为反应 级数为一级。许多反应的时间级数与浓度级数 是相同的,但也有一些不同。
在我们通过考虑三因素后,则基本上对反应的历 程有了某些线索和启发,然后可以进行初步探索 拟定历程,当初步拟定历程后,如何检验所草拟 的历程有一定的正确性和认为可以接受呢? 这就要求我们必须记住服从下面两个一致性:由 拟定的反应历程所得到的反应动力学方程应该和 由实验得到的动力学方程相一致。由拟定的反应 历程所得到的表观活化能应该和由实验测得的活 化能相一致。
t1/2 =
1 n-1-1 ] [ (2) (n-1)αkcA(0)n-1
上一内容 下一内容
[n(≠1)级反应]
返回
八、收率、转化率和选择收率 收率是指一个反应过程的产物量占反应物量的 百分数
第二章反应动力学基础

ri KC A1CA2
1
2
• (2)非基元反应:大多数化学反应由 若干个基元反应综合而成的,称非基 元反应。 αi≠νi,动力学方程由实 验来定。
2.可逆反应的动力学方程 aA bB lL m M 则反应速率等于正逆反 应速率之差 ri ri正 ri逆
k 1C A C B C L CM k 1C A C B C L CM 总级数n 1 2 3 4, n 1 2 3 4
2.2化学反应速率方程 一、单一反应的反应速率 影响化学反应速率的因素很多,对均相反 应来说,主要是T、P、C,对气固相催 化反应来说,还与催化剂性质有关。 对一定的反应来说,反应物系的性质是相 同的,当催化剂一定,反应物系的压力 一定,则ri=f(T,C)= Ψ(T) Φ(C),称动力 学或速率方程。
1.不可逆反应的动力学方程 1 A1 2 A2 3 A3
ri f (T , C ) K 1C A1C A2 C A3
1 2 3
αi是组分A的反应级数,n= α1+α2+α3 (1)基元反应αi=νi α1=ν1 α2=ν2 α3=0,即反应速率与 产物无关。由质量作用定律直接写出:
Fi:kmol/s
dFi ri dSR
dFi ri dW
Sr:表示单位堆体积固体或催化剂所具有的 反应表面积m2/m3 ρb:固体或催化剂的堆密度kg/m3
dW bdV , ds SrdVR dFi dFi dFi b( ) Sr( ) dVR dW dS
CA一定,温度对S的影响取决于主副反应活 化能的相对大小 当E1>E2时,T↑S↑ 当E1<E2时,T↑S↓ 除了正确选择反应物系的浓度和温度以提高 反应选择性外,选择合适的催化剂,既可 加速,又具有选择性(主反应快,副反应 慢)。
反应动力学基础

v1 j A1 v2 j A2 v( n1) j An1 vnj An 0 v1m A1 v2m A2 v( n1)m An1 vnm An 0
v11 v12 v1 j v 1m
v 21 v( n1)1 v n1 v 22 v( n 1) 2 v n 2 v 2 j v( n1) j v nj v 2 m v( n1) m v nm
v1 j A1 v2 j A2 v( n1) j An1 vnj An 0
或
( j 1, 2, ,m)
v11A1 v21A2 v( n1)1An1 vn1An 0
v12 A1 v22 A2 v( n1)2 An1 vn2 An 0
A1 A 2 An 1 A n
0 0 0 0
2.1 基本概念
无论反应数目多少,只需记录一个系数矩阵即可记录
整个反应系统,便于计算机对复合反应进行记录和计
算。 非独立反应:某些反应可以通过其他反应进行代数加 和得到。
2.1 基本概念
(ii) 多个连续式反应器串联:
FA 0 FA 1 FA2 FA3
以体系入口为基准
X A1 FA0 FA1 FA0 X A2 FA0 FA2 FA0
X A3
FA0 FA3 FA0
每个转化率反映的是多个反应器的转化累计量,便于 反应器串联时的计算和设计
各个反应各自有自己的反应进度,设为ξj ,则任一 反应组分 i 的反应量等于各个反应所作贡献的代数 和,即:
ni ni 0 vij j
化学反应动力学的基础知识

化学反应动力学的基础知识化学反应动力学是研究化学反应速率、反应机理以及反应难易程度的重要分支学科。
它通过实验方法、理论分析以及计算机模拟等手段,探究化学反应中的原子、分子之间的物质转化过程及机理。
化学反应动力学的发展史也与人们对化学反应认识的深化和加强密不可分。
以下从反应速率、速率常数、反应级数、速率方程、温度效应等方面介绍一些化学反应动力学的基础知识。
一、反应速率化学反应速率是指单位时间内反应物消失量或产物生成的量。
反应速率的大小在很大程度上决定着化学反应的快慢。
为了研究反应速率,通常要对反应物的浓度进行监测,以便得出反应速率随时间变化的规律,并在当中寻找反应速率的影响因素。
二、速率常数速率常数是定义在特定的温度下,各相同级数的反应物在单位时间内消失(或生成)的物质数与各反应物浓度乘积的积的比值。
在一定的反应条件下,速率常数是不随反应进行而改变的,与反应物的浓度及反应温度有关,在化学反应的机理研究中具有重要的地位。
三、反应级数反应级数是指一个反应中某一物质浓度与反应速率之间的关系。
简单来说,就是反应速率随着反应物浓度的变化而变化的趋势。
反应级数可以分为单级反应、双级反应、多级反应等。
对于不同类型的反应,反应级数的表达式也不同。
四、速率方程速率方程是指通过实验手段所测得的反应速率与各反应物浓度之间的关系式。
速率方程的表达式可以通过实验方法或理论研究的手段得出,在化学反应过程的研究中具有重要的意义。
通常情况下,速率方程可以分为一级反应、二级反应及其他级数反应。
在一些具有明显反应机理的反应当中,通过理论分析可以得到该反应的速率方程,从而加深对该反应的理解。
五、温度效应温度是影响化学反应速率的一个重要因素,它对反应速率的影响可以通过理论或实验方法进行研究。
实验表明,恒定压力下,反应速率大致随温度升高而增加,且不同反应速率的温度变化趋势可能不同。
根据阿累尼乌斯方程以及各分子在温度变化下的动能变化规律,可以得出“油滴实验”式、光化学反应式等与温度效应相关的化学反应机制。
化学反应动力学基础(二)-学生打印稿

化学反应动力学基础(二)6001 根据碰撞理论,温度增加反应速率提高的主要原因是:( )(A) 活化能降低(B) 碰撞频率提高(C) 活化分子所占比例增加(D) 碰撞数增加6005 在简单碰撞理论中,有效碰撞的定义是:( )(A) 互撞分子的总动能超过E c(B) 互撞分子的相对总动能超过E c(C) 互撞分子联心线上的相对平动能超过E c(D) 互撞分子的内部动能超过E c6039简单碰撞理论属基元反应速率理论,以下说法不正确的是:( )(A) 反应物分子是无相互作用的刚性硬球(B) 反应速率与分子的有效碰撞频率成正比(C) 从理论上完全解决了速率常数的计算问题(D) 反应的判据之一是联线上的相对平动能大于某临界值6102对于一个简单化学反应来说,在其它条件相同时,下列说法中的哪一种是正确的?(A) ∆r S越负,反应速率越快(B) ∆r H越负,反应速率越快(C) 活化能越大,反应速率越快(D) 活化能越小,反应速率越快6351 对于水溶液中的反应[ Co(NH3)5Br]2+ + OH-→[Co(NH3)5OH]2+ + Br-如果增加离子强度,此反应的速率将:(A) 不变(B) 降低(C) 达到爆炸极限(D) 增大6352 稀溶液反应CH2ICOOH + SCN-→CH2(SCN)COOH + I-属动力学控制反应,按照原盐效应,反应速率k与离子强度I的关系为下述哪一种?(A) I增大k变小(B) I增大k不变(C) I增大k变大(D) 无法确定关系6365 水溶液中过氧化氢催化分解反应历程为:H2O2(aq)+I-(aq)k1H20(l)+IO-(aq)H2O2(aq)+IO-(aq)k2H2O(l)+O2(g)+I-(aq)当k2>>k1时,该反应的速率方程为_________________________________。
6367 电解质溶液中的反应速率受离子强度影响的规律,下述说法中正确的应是:(A) 离子强度I越大,反应速率越大(B) I越大,反应速率越小(C) 同号离子间反应,原盐效应为正(D) 电解质与中性反应物作用,原盐效应为负6386 溶液中扩散控制反应速率与溶剂粘度有关,当溶剂粘度增大时,反应速率应:(A)提高(B)降低(C)相等(D)不一定6393水溶液中至今发现最快的化学反应是________________________,正反应速率常数的数量级(以mol-1·dm3·s-1为量纲)约为_______,其主要原因为_____________________。
(完整版)化学反应动力学..

(2)流---固相反应
ri 1 dni W dt
5
W--固体质量
a. 对流固相非催化反应,W为固体反应物质量 b. 对流固相催化反应,W为固体催化剂质量
二、连续流动系统反应速率表示方式 6
流动系统: 反应物料处于连续稳定流动状态,物料在反应器 内没有积累,物系参数随空间位置变化
表示方式:
ri
Ri — 为“-”时表示转化速率,为“+”时表示生成
9
§2 化学反应速率方程(幂函数型)
ri f T、C、P、催化剂或溶剂
对特定反应,且 P 10% 时可忽略P对ri的影响
P
则: ri f T、C (反应动力学模型)
型式: a. 幂函数型----经验模型 b. 双曲函数型----机理模型 c. 级数型----经验模型
r
,,, A
k C r 1
1A
1
A
rQ
2
k C 2U
,,,r2
rQ
Q
R r r r k C A转化速率:
m
A
A
Aj j
A
A
1A
j 1
A
m
R r r r k C Q生成速率:
1
第二章 化学反应动力学
§1 化学反应速率的工程表示 §2 化学反应速率方程(幂函数型) §3 动力学方程的转换 §4 多相催化反应的表面反应动力学
(双曲型动力学方程)
§1 化学反应速率的工程表示 2
一、间歇系统反应速率表示方式
间歇系统:非定态过程,反应器内物系参数随t变化
1.均相反应速率表示方式
一、单一反应动力学方程
10
简单反应、并列反应、自催化反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5202 反应 2O 3→ 3O 2的速率方程为 - d[O 3]/d t = k [O 3]2[O 2]-1 ,或者 d[O 2]/d t = k '[O 3]2[O 2]-1,则速率常数 k 和 k ' 的关系是: ( )(A) 2k = 3k ' (B) k = k ' (C) 3k = 2k ' (D) -k /2 = k '/3 5203 气相反应 A + 2B ─→ 2C ,A 和 B 的初始压力分别为 p A 和 p B ,反应开始时并无 C ,若 p 为体系的总压力,当时间为 t 时,A 的分压为: ( )(A) p A - p B (B) p - 2p A (C) p - p B (D) 2(p - p A ) - p B 5204 对于反应 2NO 2= 2NO + O 2,当选用不同的反应物和产物来表示反应速率时,其相互关系为:( )(A) -2d[NO 2]/d t = 2d[NO]/d t = d[O 2]/d t (B) - d[NO 2]/2d t = d[NO]/2d t = d[O 2]/d t = d ξ /d t (C) - d[NO 2]/d t = d[NO]/d t = d[O 2]/d t (D) - d[NO 2]/2d t = d[NO]/2d t = d[O 2]/d t = 1/V d ξ /d t 5207 气相基元反应 2Ak 1B 在一恒容的容器中进行,p 0为 A 的初始压力, p t 为时间 t 时反应体系总压,此反应速率方程 d p t / d t = 。
- k (2p t - p 0)25208 有一反应 mA → nB 是一简单反应,其动力学方程为 -d c A / d t = kc A m, c A 的单位为 mol ·dm -3,时间单位为 s ,则:(1) k 的单位为 ___________ mol 1- m ·dm 3( m -1)·s -1 (2) 以d c B /d t 表达的反应速率方程和题中给的速率方程关系为B A A A1d 1d 'd d m mc c k c k c n t m t m=-== 5209 反应 2N 2O 5─→ 4NO 2+ O 2 在328 K 时,O 2(g)的生成速率为0.75×10-4 mol ·dm -3·s -1。
如其间任一中间物浓度极低, 难以测出, 则该反应的总包反应速率为 _______________mol ·dm -3·s -1, N 2O 5之消耗速率为__________ mol ·dm -3·s -1,NO 2之生成速率为_______________mol ·dm -3·s -1 。
0.75×10-4, 1.50×10-4, 3.00×10-45210 O 3分解反应为 2O 3─→3O 2 ,在一定温度下, 2.0 dm 3容器中反应。
实验测出O 3每秒消耗1.50×10-2 mol, 则反应速率为_______________mol ·dm -3·s -1氧的生成速率为_______________mol ·dm -3·s -1, d ξ/d t 为_______________ 0.75×10-2, 2.25×10-2, 1.50×10-2.。
5211 2A +B =2C 已知反应某一瞬间, r A =12.72 mol ·dm -3·h -1, 则 r B = , r C =_____________r B =6.36 mol ·dm -3·h -1, r C =12.72mol ·dm -3·h -1 5212分别用反应物和生成物表示反应A +3B =2C 的反应速率, 并写出它们间关系为: 。
r A =13r B =12r C 5222 有关基元反应的描述在下列诸说法中哪一个是不正确的: ( ) (A) 基元反应的级数一定是整数 (B) 基元反应是“态-态”反应的统计平均结果 (C) 基元反应进行时无中间产物,一步完成 (D) 基元反应不一定符合质量作用定律5223 400 K 时,某气相反应的速率常数k p = 10-3(kPa)-1·s -1,如速率常数用 k C 表示,则 k C 应为:(A) 3.326 (mol ·dm -3)-1·s -1 k C = k p (RT ) (B) 3.0×10-4 (mol ·dm -3)-1·s -1 (C) 3326 (mol ·dm -3)-1·s -1 (D) 3.0×10-7 (mol ·dm -3)-1·s -15224 如果反应 2A + B = 2D 的速率可表示为:r = -12d c A/d t = - d c B/d t =12d c D/d t则其反应分子数为:( )(A) 单分子(B) 双分子(C) 三分子(D) 不能确定5227 实验测得反应:2A + B ─→2C + D 的速率方程为:r= k[A][B],以[A]0= 2[B] 0 开始实验,可将方程式改写成r= k a[A]2,则则k a与k的关系为____________ 。
k a= 12k5228 实验测得反应:2A + B ─→2C + D 的速率方程为:r = k [A][B],反应历程为:A +B k1C + F (慢)A + F k2C +D (快)则k1与k的关系为__________ k a= 12k5229 2NO + O2=2NO2的反应机理拟定为:2NO ⇄N2O2(达到平衡,平衡常数为K1)N2O2+ O2=2NO2(慢,速率常数为k2)总包反应对O2是一级;对NO 是二级。
5231 反应A + B →C 的速率方程为:-d c A/d t = k A c A c B/c C,则该反应的总级数是____ 级。
若浓度为mol·dm-3,时间以s 为单位,则速率常数k A的单位是________一级; s-15232 一个二级反应的速率常数为k =1.54×10-4 mol-1·cm3·min-1,若浓度以mol ·dm-3为单位,时间以s 为单位,此常数k值为。
k = 2.57×10-9 dm3·mol-1·s-15238某反应的化学计量方程式为12A+B=D+12S, 其速率方程为:-d[B]/d t =2k[A]1/2[B],假如化学计量式写成A+2B=2D+S, 问这反应的速率方程为。
因为化学计量关系式不应该影响速率方程, 所以此反应的速率方程不变.5243 反应分子数只能是____________,一般不会大于_______________。
正整数 35251 某反应,当反应物反应掉5/9 所需时间是它反应掉1/3 所需时间的2 倍,则该反应是:(A) 一级反应(B) 零级反应(C) 二级反应(D) 3/2 级反应5252 某反应进行完全所需时间是有限的,且等于c0/k,则该反应是:( )(A) 一级反应(B) 二级反应(C) 零级反应(D) 三级反应5253 反应2A →P 为二级反应,其半衰期:( )(A) 与[A]0无关(B) 与[A]0成正比(C) 与[A]0成反比(D) 与[A]成反比[A]0为反应物A 的起始浓度。
5254 对于一个一级反应,如其半衰期t12在0.01 s 以下,即称为快速反应,此时它的速率常数k值在:( )(A) 69.32 s-1以上(B) 6.932 s-1以上(C) 0.06932 s -1 以上 (D) 6.932 s -1 以下 5255 某反应 A → B ,反应物消耗 3/4 所需时间是其半衰期的 5 倍,此反应为: ( )(A) 零级反应 (B) 一级反应 (C) 二级反应 (D) 三级反应 5256 二级反应的速率常数的单位是: ( )(A) s -1 (B) dm 6·mol -2·s -1 (C) s -1·mol -1 (D) dm 3·s -1·mol -1 5257 当一反应物的初始浓度为 0.04 mol ·dm -3时,反应的半衰期为 360 s ,初始浓度 为 0.024 mol ·dm -3时,半衰期为 600 s ,此反应为: ( )(A) 0 级反应 (B) 1.5 级反应 (C) 2 级反应 (D) 1 级反应 5258 如果臭氧 (O 3) 分解反应 2O 3→ 3O 2的反应机理是: O 3→ O + O 2 (1) O + O 3→ 2O 2 (2)请你指出这个反应对 O 3而言可能是: ( )(A) 0 级反应 (B) 1 级反应 (C) 2 级反应 (D) 1.5 级反应 5259 反应 A →产物 为一级反应,2B → 产物 为二级反应,t 12(A) 和 t 12(B) 分别表示两反应的半衰期,设 A 和 B 的初始浓度相等,当两反应分别进行的时间为 t = 2t 12(A) 和 t = 2t 12(B) 时,A ,B 物质的浓度 c A ,c B 的大小关系为: ( )(A) c A > c B (B) c A = c B (C) c A < c B (D) 两者无一定关系 5260此反应的速率方程为: ( ) (A) r = k c B (B) r = k c A c B(C) r = k c A (c B )2 (D) r = k c A5261 某反应无论反应物的起始浓度如何,完成 65% 反应的时间都相同,则反应的级数为: ( )(A) 0 级反应 (B) 1 级反应 (C) 2 级反应 (D) 3 级反应 5262 半衰期为 10 d 的某放射性元素净重 8 g ,40 d 后其净重为: ( )(A) 4 g (B) 2 g (C) 1 g (D) 0.5 g 5263 已知二级反应半衰期 t 12为 1/(k 2c 0),则反应掉1/4所需时间 t 14应为: ( )10120()1(1)n n c c t n k c ---=- (A) 2/(k 2c 0) (B) 1/(3k 2c 0)(C) 3/(k2c0) (D) 4/(k2c0)5264 放射性Pb201的半衰期为8 h,1 g 放射性Pb201在24 h 后还剩下:( )(A) 1/8 g (B) 1/4 g(C) 1/3 g (D) 1/2 g5265 一级反应,反应物反应掉1/n所需要的时间是:( )(A) -0.6932/k(B) (2.303/k) lg[n/(n-1)](C) (2.303/k) lg n(D) (2.303/k) lg(1/n)5266 一个反应的活化能是33 kJ·mol-1, 当T = 300 K 时,温度每增加1K,反应速率常数增加的百分数约是:( )(A) 4.5% (B) 90%(C) 11% (D) 50%5267 某二级反应,反应物消耗1/3 需时间10 min,若再消耗1/3 还需时间为:( )(A) 10 min (B) 20 min(C) 30 min (D) 40 min5268 某反应物起始浓度相等的二级反应,k = 0.1 dm3·mol-1·s-1,c0= 0.1 mol·dm-3,当反应率降低9 倍所需时间为:( )(A) 200 s (B) 100 s(C) 30 s (D) 3.3 s5271 一级反应完成99.9% 所需时间是完成50% 所需时间的:( )(A) 2 倍(B) 5 倍(C) 10 倍(D) 20 倍5273 某反应的反应物消耗一半的时间正好是反应物消耗1/4 的时间的2 倍,则该反应的级数是:( )(A) 0.5 级反应(B) 0 级反应(C) 1 级反应(D) 2 级反应5275 某一同位素的半衰期为12 h,则48 h 后,它的浓度为起始浓度的:( )(A) 1/16 (B) 1/8(C) 1/4 (D) 1/22++ Tl3+─→2Hg2+ + Tl+的速率方程为5276 水溶液反应Hg22+][Tl3+]/[Hg2+]。
