反相高效液相色谱法同时分离测定杜仲雄花及其产品中的 京尼平苷酸和绿原酸
反相液相色谱法测定杜仲叶中绿原酸

反相液相色谱法测定杜仲叶中绿原酸
万春花;倪永年;龙洲雄;胡海山;鄢兵
【期刊名称】《食品科学》
【年(卷),期】2007(028)001
【摘要】通过正交试验选择杜仲叶中绿原酸的最佳提取条件:30%甲醇回流20min,用反相液相色谱法测定绿原酸含量:色谱柱为Kromasil C18柱,流动相为甲醇-0.02%磷酸溶液(体积比22:78),波长327nm,流速1.0ml/min.绿原酸在9.68~242μg/ml 呈良好线性关系,相关系数r为0.9999,本法快速、简单、准确、分离度好、回收率大于95.9%.
【总页数】3页(P255-257)
【作者】万春花;倪永年;龙洲雄;胡海山;鄢兵
【作者单位】南昌大学化学系,江西,南昌,330047;江西省分析测试研究所,江西,南昌,330029;南昌大学化学系,江西,南昌,330047;江西省分析测试研究所,江西,南
昌,330029;江西省分析测试研究所,江西,南昌,330029;江西省分析测试研究所,江西,南昌,330029
【正文语种】中文
【中图分类】R284.1
【相关文献】
1.RP-HPLC法测定杜仲叶中京尼平苷酸与绿原酸的累积含量 [J], 冯攀;马养民;朱
军峰;陈立红
2.杜仲叶中绿原酸的协同增敏荧光光谱法测定 [J], 刘媚;林颖云;苏艳;吴颖;杨秀培
3.可见分光光度法测定杜仲叶中的绿原酸 [J], 袁华;邓良;孙炎彬;杨小俊;闫志国;吴元欣
4.络合显色法测定杜仲叶中的绿原酸(英文) [J], 袁华;孙炎彬;池汝安;吴元欣
5.高效液相色谱法测定杜仲叶中绿原酸含量方法学研究 [J], 熊建斌
因版权原因,仅展示原文概要,查看原文内容请购买。
响应面法优化超声提取杜仲雄花中黄酮类化合物的工艺参数

响应面法优化超声提取杜仲雄花中黄酮类化合物的工艺参数董发明1,白喜婷2(1.河南科技大学动物科技学院,河南 洛阳 471003;2.河南科技大学食品与生物工程学院,河南 洛阳 471003)摘 要:在单因素试验的基础上,对乙醇浓度、提取时间和超声功率三因素进行二次通用旋转组合试验设计并通过响应面分析,优化杜仲雄花中黄铜类化合物的超声波提取工艺。
结果表明:超声辅助提取杜仲雄花中黄酮类化合物的最佳工艺参数为乙醇浓度60%、提取时间34min、超声功率320W。
在此条件下,黄酮类化合物的实际提取率为13.13mg/g,与预测值基本一致。
在三个因素中,乙醇浓度对提取率影响最大,其次是超声功率,提取时间对黄酮类化合物的提取率影响较小,并且三因素之间无交互作用。
关键词:杜仲雄花;超声提取;黄酮类化合物;响应面优化Optimization of Ultrasound-assisted Extraction Process Parameters of Flavonoids fromEucommia ulmoides Staminate Flower by Response Surface MethodologyDONG Fa-ming1,BAI Xi-ting2(1.College of Animal Science and Technology, Henan University of Science and Technology, Luoyang 471003, China;2.College of Food and Bioengineering, Henain University of Science and Technology, Luoyang 471003, China)Abstract :On the basis of single-factor test, the ultrasound-assisted extraction process parameters of flavonoids from Eucommiaulmoides staminate flower were optimized by the quadratic general spinning design on ethanol concentration, extraction time andultrasonic power. The results showed that the optimal parameters are as follows: the ethanol concentration 60%, the extractiontime 34 min and the ultrasonic power 320 W. Under these conditions, the actual extraction rate of the flavonoids is 13.13 mg/g,consistent with the prediction value. Among the three factors, the alcohol concentration most significantly affects on the extractionrate, followed by the ultrasonic power and the extraction time, and no interaction exists among them.Key words:Eucommia ulmoides staminate flower;ultrasound-assisted extraction;flavonoids;response surface meth-odology中图分类号:O623.54 文献标识码:A 文章编号:1002-6630(2008)08-227-05收稿日期:2008-05-21基金项目:河南省教育厅自然科学基金项目(2006550001);河南科技大学博士科研启动基金项目作者简介:董发明(1964-),男,副教授,博士,主要从事中药研究与开发。
高效液相色谱法测定不同产地杜仲叶的绿原酸含量
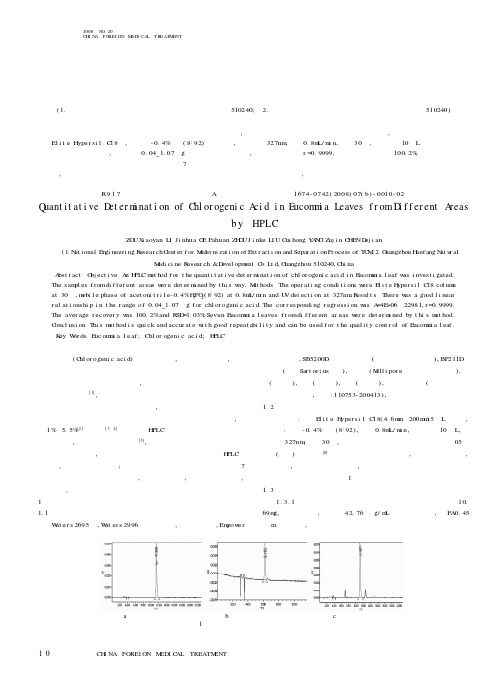
中外医疗中外医疗I N FOR I GN M DI L TR TM NT2008N O.20C HI N A FO REI GN M ED I CA L TR EATM ENT论著绿原酸(C hl or ogeni c aci d)又名咖啡鞣酸,属酚酸类化合物,是植物体在有氧呼吸过程中经莽草酸途径形成的一种苯丙素类物质。
绿原酸具有利胆、抗菌、抗病毒、降压,升高白细胞及兴奋中枢神经系统等多种药理作用[1],是保健品、食品、药品、化妆品等工业的重要原料。
纯的绿原酸还是重要的化学试剂,在生理生化分析和化学工业中具有广泛的应用。
近年来的研究表明杜仲叶中绿原酸含量较高,可达1%~5.5%[2]。
文献[3~4]报道了用H PLC 法测定杜仲中绿原酸的含量测定方法,但杜仲叶中成分复杂[5],用已有的色谱方法都不能使绿原酸得到很好的分离,本文系统地研究了杜仲叶的绿原酸含量H PLC 测定方法,以找出理想的方法;同时本文采用该高效液相色谱法测定了7个不同产地的杜仲叶绿原酸含量,该法操作简单,准确度、灵敏度高,精密度好,易于采用。
1实验部分1.1仪器与试剂W at e r s 2695泵,W at er s 2996紫外检测器,自动进样器,Em pow e r色谱工作站,SB5200D 超声波清洗器(宁波新芝生物科技),BP211D 电子天平(德国Sar t or i us 公司),超纯水(M i ll i por e 公司超纯水器自制),甲醇(色谱纯),乙腈(色谱纯),磷酸(分析纯),绿原酸对照品(购自中国药品生物制品检定所,批号:110753-200413),杜仲叶购于各地药材公司。
1.2色谱条件色谱柱:大连E l i t e H yper si l C 18(4.6m m ×200m m )5μL 色谱柱,流动相:乙腈-0.4%磷酸(8:92),流速0.8m L/m i n,进样体积10μL,检测波长327nm ,柱温30℃,各组分达到基线分离。
uplc-ms测定杜仲的3种成分及其药代动力学研究

作用是由哪些具体的成分发挥的功效,同时这些药 理成分的药代动力学是如何变化的,因此课题组将 杜仲提取物注射入大鼠尾静脉后,研究杜仲的 3个 指标性成分(分别是京尼平苷酸、绿原酸、松脂醇二 葡萄糖苷)在大鼠体内的具体经时过程和药代动力 学参数特征,为临床上使用杜仲这味药物的前药动 学研究提供实验依据。本课题研究主要采用 UPLC MS的技术手段,超高效液相色谱(UltraPerformance LiquidChromatography,UPLC)是分离科学中的一个 全新类别,UPLC是 在 高 效 液 相 色 法 (HighPerform
Determinationof3ComponentsandPharmacokineticsofCortexEucommiaebyUPLCMS BenJingjing,GeJianbin,QinQingqing
(PharmaceuticalDepartment,NantongSecondPeople′sHospital,Nantong226002,China) Abstract Objective:Todeterminethe3componentsofCortexEucommiaebyultrahighperformanceliquidchromatographycom binedwithmassspectrometryandtheirpharmacokinetics.Methods:Electrosprayionizationsource(ESI)wasusedtomonitorthe monitoringionsofgeniposidechlorogenicacidandterpineoldiglucoside,andinternalstandardsforquantitativeanalysisofgenipo sidechlorogenicacidandterpineoldiglucoside.Results:1)The3indexcomponentsofCortexEucommiaesuchasgeniposide,chlo rogenicacidandterpineoldiglucoside,werewellseparatedandhadnointerferenceofendogenoussubstances,withgoodspecificity. 2)TheUPLCmethodwasrigorous,anditsprecision,stabilitytest,repeatabilitytestandsamplerecoveryratewereallgood.3)The pharmacokineticsofgeniposideandturpentinediglucosideinratswasnonlinear,butonlychlorogenicacidwaslinear.However, thereweresignificantdifferencesinthe2parametersofCLzandVz,indicatingthatthepharmacokineticmetabolismofthe3com ponentsofCortexEucommiaeextractinratplasmawasinconsistent.Conclusion:TheoperationofUPLCMS/MSissimple,andthe resultshavegoodprecision,stabilityandreproducibility.Itcanbeusedasareliablemethodforthestudyofeffectivecomponents andpharmacokineticsofCortexEucommiae. KeyWords Ultrahighperformanceliquidchromatography;Massspectrometry;CortexEucommiae;Geniposide;Chlorogenic acid;Turpentinediglucoside;Pharmacokinetics;Study 中图分类号:R2841 文献标识码:A doi:10.3969/j.issn.1673-7202.2019.12.011
RP-HPLC测定杜仲叶京尼平苷的含量

RP-HPLC测定杜仲叶京尼平苷的含量【摘要】目的建立反相高效液相色谱法同时测定杜仲叶京尼平苷含量的方法。
方法高效液相色谱法。
结果杜仲叶京尼平苷在0.26~2.60 μg范围内线形关系良好(r=0.999 9),平均加样回收率99.94%,RSD=0.6%(n=6)。
结论成分的峰分离效果好,其测定方法操作简便、准确、重复性良好,可作为杜仲叶中京尼平苷的质量控制方法。
【Abstract】Objective To establish a new RP-HPLC method for simultaneous determination of geniposide in folium cortex eucommia.Methods HPLC method.Results The standard geniposide(showed a good linear correlation within the concentration of 0.26~2.60 μg,(r=0.999 9),the average recovery of the sample was 99.94%,RSD=0.6%(n=6).Conclusion The peaks of the components were separated effectly,the method is simple,accurate and reproducible and can be used for the quality control of geniposide in folium cortex eucommia.【Key words】RP-HPLC;Eucommia ulmoides oliv.leaf;Geniposide杜仲(Eucommia uimoides Oliv.)具有消炎抑菌、补肾降压、增强免疫功能及抗癌、抗疲劳、抗衰老、止痛镇静、补肝肾、强筋骨和安胎等作用[1,2],是我国珍稀濒危二级保护植物,传统以皮入药。
反相高效液相色谱法测定杜仲绿原酸的含量_王巧

·临床研究·反相高效液相色谱法测定杜仲绿原酸的含量王 巧 毕开顺 田 菁** 蒋午峻***河北医科大学药学院药物分析教研室(石家庄050017) 主题词 杜仲/中草药;绿原酸/分析;色谱法,高压液相/方法 中图号 R932.11 杜仲为杜仲科植物杜仲(Eucommia ulmoides Oliv.)的药用干燥树皮,为我国名贵滋补药材,具补肝肾、强筋骨、安胎、轻身耐老之功效。
现代药理研究证明,杜仲有降压、利尿、抗衰老、抗炎、镇静镇痛等作用[1]。
杜仲的化学成分主要有杜仲胶、木脂素类、环烯醚萜类、有机酸类等[2]。
绿原酸属有机酸的一种,是杜仲起抗炎、降压作用的有效成分之一,其定量分析方法主要有薄层色谱-分光光度法、纸色谱-紫外分光光度法、毛细管区带电泳法和高效液相色谱法等[3~6]。
为寻找更科学的杜仲质量评价方法,采用反相高效液相色谱法对其所含绿原酸的含量进行了测定。
1 材料与方法1.1 仪器、试剂与药品:250型高效液相色谱仪, LC-295紫外检测器,1022LC plus色谱工作站(均为美国PE公司);HHS-112型恒温水浴箱(江苏省医疗器械厂),ZFQ85A型旋转蒸发仪(上海医械专机厂)。
绿原酸对照品购于中国药品生物制品检定所,乙腈为色谱纯,丁香酸、甲醇、冰醋酸、氯仿均为分析纯。
32个杜仲样品(均由沈阳药科大学许春泉高工进行生药学鉴定)的产地和收集地见表1,将各样品除碎叶、砂石及粗皮后,阴凉处干燥,经粉碎机粉碎,置广口瓶中,密塞,备用。
1.2 方法与结果1.2.1 色谱条件:色谱柱,Hypersil ODS2柱(250 mm×4.6m m ID,5μm,中国科学院大连化学物理研究所);流动相,乙腈-2%冰醋酸溶液(5∶95);流速,1.0ml/min;检测波长,310nm;柱温,23℃;进样量,20μl;内标,丁香酸。
1.2.2 系统适用性试验:理论板数按绿原酸峰计算为2138,绿原酸峰与相邻峰及内标峰的分离度均>1.5,峰形对称。
HPLC法测定杜仲雄花中绿原酸含量

黑龙江农业科学2023(10):63G67H e i l o n g j i a n g A gr i c u l t u r a l S c i e n c e s h t t p ://h l j n y k x .h a a s e p.c n D O I :10.11942/j.i s s n 1002G2767.2023.10.0063朱艳,李先芝,毛琼丽,等.H P L C 法测定杜仲雄花中绿原酸含量[J ].黑龙江农业科学,2023(10):63G67.H P L C 法测定杜仲雄花中绿原酸含量朱㊀艳1,李先芝1,2,毛琼丽1,严㊀玲1,石㊀豪1,刘㊀洋1,胡㊀杨1,陈彦和1(1.劲牌有限公司,湖北黄石435100;2.中药保健食品质量与安全湖北省重点实验室,湖北黄石435100)摘要:为建立一种快速简便测定杜仲雄花中绿原酸含量的方法,采用A g i l e n t GC 18色谱柱(4.6m mˑ250.0m m ,5μm ),乙腈G0.4%醋酸(10ʒ90)等度洗脱,流速1.0m L m i n -1,柱温箱温度35ħ,327n m 单波长检测,通过试验对该方法的稳定性㊁精密度等进行优化.结果表明,杜仲雄花绿原酸在测定范围内呈良好的线性关系(R 2=0.9998),平均回收率为97.30%.供试品溶液处理方法为环境友好型方法,能更好地减少环境污染,对实验人员安全性更高,且该方法具有较高的精密度和重复性,可用作杜仲雄花中绿原酸含量的测定.关键词:杜仲雄花;绿原酸;高效液相色谱法收稿日期:2023G04G07第一作者:朱艳(1987-),女,学士,工程师,从事药材质量控制研究.E Gm a i l :339526006@q q.c o m .通信作者:李先芝(1978-),女,硕士,高级工程师,从事药材质量控制研究.E Gm a i l :838097968@q q.c o m .㊀㊀杜仲是我国常用的特有药材,在我国已有两千年的历史,由于其生长周期较长,传统药用部位以皮部为主,所以导致大量野生杜仲遭到破坏,且具有不可再生性质,导致其资源紧缺[1].近年来研究发现,杜仲皮㊁叶㊁花其药理作用相似,但还是有一定的差异[2G4],如杜仲不同部位水提取物的镇痛作用㊁抑菌作用效果中杜仲雄花明显优于其他部位[2].同时也有研究表明杜仲皮㊁叶㊁花等不同部位成分含量不同,如杜仲皮中松脂醇二葡萄糖苷和京尼平含量较高,杜仲叶中绿原酸含量较其它部位高,杜仲雄花中桃叶珊瑚苷㊁京尼平苷酸㊁等含量较高,导致这些含量差异的原因除了药用部位不同外还与其具体采收㊁提取方式也有较大关系[5G6].杜仲是一类雌雄双株的植物,雄花就是杜仲雄树开的花,其花粉是我国珍贵的药用资源[7].根据杜仲雄花调节阴虚证㊁阳虚证动物模型,推测出其可能具有补肾及改善生殖的功能[8].杜仲雄花含有丰富的蛋白质㊁氨基酸㊁矿质元素及多种维生素等,是一类营养丰富的保健饮品,不但可以改善睡眠㊁调节雌激素㊁镇痛等,而且其主要成分中绿原酸具有显著的药理活性[9G10].绿原酸对血液系统㊁消化系统等均有疗效,其抗菌消炎作用最为突出[10G11].近年来随着研究的深入,学者发现杜仲雄花茶中绿原酸对肿瘤预防也有着重要的意义[9],而且对I I G型糖尿病及与衰老相关的疾病也有一定的治疗作用[9G10].不同区域的杜仲雄花中绿原酸含量也有较大差别,如南北地域差异,海拔高度差异等影响,均会导致杜仲花中品质的差异[12].不同的加工方式会使杜仲雄花茶呈现不同的绿色,更严重的是不当的加工提取方式会造成绿原酸等物质的损失.由于其本身含热敏性功能而导致绿原酸含量发生差异,另外在杜仲雄花处理杀青过程中,可能导致绿原酸在多酚氧化酶的作用下被氧化分解[13],使其无法更有效地发挥其自身有效价值,降低杜仲雄花中绿原酸的利用率.作为判断杜仲雄花中重要功能成分之一的绿原酸,如何快速检测杜仲雄花中绿原酸含量至关重要,除可提高提取速度㊁保证提取率外,还可以减少实验过程试剂用量及试剂污染[14G15].本研究通过试验对其稳定性㊁精密度等进行优化,为快速检测杜仲雄花中绿原酸含量提供参考.1㊀材料与方法1.1㊀仪器及材料仪器设备:高效液相色谱仪(配紫外检测器或二极管阵列检测器,1260I n f i n i t y ⅡB i n a r y LC ,美国安捷伦科技有限公司)㊁十万分之一电子天平(A B 135GS ,上海精密科学仪器有限公司).材料及试剂:2022年5月采于陕西汉中偏深绿色杜仲雄花㊁绿原酸对照(中国食品药品检定研究院)㊁乙腈(色谱纯,弗顿科技有限公司)㊁醋酸(分析纯,默克公司)㊁乙醇(分析纯,国药).1.2㊀方法1.2.1㊀色谱条件㊀色谱柱选用A g i l e n tC 18柱(4 6m m ˑ250.0m m ,5μm );流动相:乙腈G0 4%醋酸(10ʒ90)等度洗脱,流速1.0m L m i n -1;36Copyright ©博看网. All Rights Reserved.㊀㊀㊀㊀㊀黑㊀龙㊀江㊀农㊀业㊀科㊀学10期柱温箱温度35ħ;检测波长327n m ;进样量10μL [15].1.2.2㊀供试品溶液制备㊀精密称定1.00g 左右粉碎试样于25m L 棕色容量瓶中,加入20m L50%乙醇,超声提取45m i n ,用50%乙醇定容至刻度,混匀,过0.22μm 滤膜,滤液作为待测样品备用[10G11].1.2.3㊀对照品溶液制备㊀精密称取绿原酸标准品13.0m g 至10m L 容量瓶中,加流动相溶解[0.4%醋酸G乙腈(90ʒ10)]定容,摇匀,得到绿原酸标准溶液母液(浓度1330m gL -1);分别精密量取绿原酸标准溶液母液0.10,0.40,0.80,1.25和2.50m L 至5m L 容量瓶中,加流动相溶解定容,摇匀,得到绿原酸标准样品26.6m gL -1(2#)㊁106.4m g L -1(3#)㊁212.8m g L -1(4#)㊁332.5m g L -1(5#)㊁665.0m g L -1(6#),再取26.6m gL -1(2#)标准溶液1.0m L 至10m L 容量瓶中,加流动相溶解定容,摇匀,得到绿原酸标准溶液2.66m gL -1(1#).1.2.4㊀提取时间的确定㊀分别精密称定1.00g 左右粉碎试样于25m L 棕色容量瓶中,分别加入50%乙醇按15,30,45和60m i n 时间进行超声提取.超声冷却后,使用提取溶剂定容至刻度,混匀,过0.22μm 滤膜,按1.2.1色谱条件进行色谱分析,比较不同提取时间的绿原酸浓度差异.1.2.5㊀提取溶剂的筛选㊀分别精密称定1.00g 左右粉碎试样于25m L 棕色容量瓶中,分别加入20m L 纯水㊁50%乙醇㊁70%甲醇超声提取30m i n,超声冷却后,分别使用提取溶剂定容至刻度,混匀,过0.22μm 滤膜,按1.2.1色谱条件进行色谱分析,比较不同提取溶剂处理的绿原酸浓度差异.1.2.6㊀色谱峰面积与绿原酸浓度的关系㊀将上述标准溶液1#~6#,在上述色谱条件下进行分析,得到各浓度的绿原酸色谱峰的峰面积,以浓度为横坐标,相对应的色谱峰面积为纵坐标建立曲线.1.2.7㊀精密度试验㊀取某批次陕西汉中偏深绿色杜仲雄花按照1.2.2方法制备供试品溶液,并按1.2.1中色谱条件连续进样分析6次,得到各次分析时测得的绿原酸浓度,计算浓度的R S D 值.1.2.8㊀稳定性试验㊀取1.2.3中供试品溶液进行稳定性试验考察,按照1.2.1中液相色谱条件分别在0.75,1.50,3.00,4.50,7.50和9.75h 对供试品溶液中绿原酸进行检测,得到各次分析时绿原酸浓度,计算浓度的R S D 值.1.2.9㊀重复性试验㊀取某批次陕西汉中偏深绿色杜仲雄花进行重复性试验,分别称取6份供试品1.0011,1.0103,1.0056,1.0037,1.0043和1.0093g ,以1.2.2中样品制备方法,按照1.2.1中色谱方法进行分析,利用已建立的标准曲线计算样品中各目标成分的含量.1.2.10㊀加标回收试验㊀标准溶液制备:精密称取绿原酸25.73m g,绿原酸含量100%,用流动相定容到20m L 容量瓶中,摇匀,得到绿原酸标准溶液1286.5000m gL -1.加标回收试验供试品制备:分别称取9份供试品(原则取样品量1/2进行加标试验,由于此样品含量较高,故取样品量约1/4进行加标试验)0 1004,0.1009,0.1072,0.1008,0.1008,0 1003,0.1061,0.1000和0.1056g ,分别加入0.5,1.0和1.5m L 浓度为1286.5000m gL -1标准溶液,按1.2.2进行样品前处理定容至10m L ,再按照1.2.1中色谱方法进行色谱分析,利用已建立的标准曲线计算加标回收样品中绿原酸的加标量,与实际加入量进行比较,计算回收率.2㊀结果与分析2.1㊀供试品溶液制备考察2.1.1㊀提取时间的确定㊀由表1可知,在提取15,30,45和60m i n 4个时间段所测得浓度相近,而30m i n 提取浓度略高,综合考虑选择提取时间30m i n 较为合适.表1㊀不同提取时间对绿原酸浓度的影响时间/m i n 溶液浓度/(m gL -1)15309.710530312.731345309.711960310.98232.1.2㊀提取溶剂的筛选㊀由表2可知,纯水超声提取所测得浓度略低,50%乙醇与70%甲醇超声提取所测得浓度无明显差异,考虑到实验人员及环境污染等原因,选择50%乙醇进行超声提取.表2㊀不同提取溶剂对绿原酸浓度的影响提取溶剂溶液浓度/(m gL -1)纯水278.896250%乙醇293.202570%甲醇294.200546Copyright ©博看网. All Rights Reserved.10期㊀㊀朱㊀艳等:H P L C 法测定杜仲雄花中绿原酸含量㊀㊀㊀㊀㊀㊀2.2㊀检出限试验精密称取绿原酸标准物质适量,加流动相溶解至适当浓度,在1.2.1色谱条件下进行色谱分析,使得绿原酸的色谱峰高与基线噪音的比值约为3,经试验,确定绿原酸浓度为0.0266m gL -1时为最低检出浓度,最低检出浓度标准溶液色谱图见图1.图1㊀最低检出浓度的标准溶液色谱图2.3㊀线性范围试验不同浓度标准品与对应的色谱峰峰面积数据如表3所示,相关标准曲线为绿原酸(y )=29.95x -140.02,R 2=0 9999(图2).表3㊀标准曲线建立相关数据序号浓度/(m gL -1)峰面积/(m A U )12.6661.171226.60691.8563106.402959.8974212.806184.5135332.509720.6946665.0019853.015图2㊀绿原酸标准曲线2.4㊀精密度试验由表4可知,绿原酸精密度试验R S D 值均ɤ5%,满足G B /T27404-2008«实验室质量控制规范食品理化检测»精密度试验要求,表明仪器方法性能稳定,检测结果的随机误差较小.表4㊀绿原酸精密度试验数据及R S D 值序号测得浓度/(m gL -1)1305.01402306.11223306.73034306.78415306.71346307.3930R S D/%0.272.5㊀稳定性试验由表5可知,绿原酸稳定性试验R S D 值均ɤ5%,满足G B /T27404-2008«实验室质量控制规范食品理化检测»稳定性试验要求,绿原酸在9.75h 内稳定性良好.表5㊀绿原酸稳定性试验数据及R S D 值序号稳定性时间/h测得浓度/(m gL -1)10.75306.112221.50306.730333.00306.713444.50307.267757.50307.728169.75307.9984R S D/%-0.2356Copyright ©博看网. All Rights Reserved.㊀㊀㊀㊀㊀黑㊀龙㊀江㊀农㊀业㊀科㊀学10期2.6㊀重复性试验由表6可知,绿原酸重复性试验R S D 值均ɤ5%,满足G B /T27404-2008«实验室质量控制规范食品理化检测»稳定性试验要求,表明绿原酸检测方法重复性良好.2.7㊀加标回收试验由表7可知,绿原酸加标回收收率在97.35%~101.35%,满足G B /T27404-2008«实验室质量控制规范食品理化检测»中回收率试验的技术要求,表明方法准确可靠.表6㊀重复性试验数据及R S D 值序号样品质量/g 测得浓度/(m gL -1)样品含量/%11.0011307.33160.767521.0103309.39320.765631.0056308.49100.766941.0037306.81880.764251.0043307.08080.764461.0093309.82350.7674R S D/%--0.19表7㊀杜仲雄花中绿原酸加标回收率及R S D 值称样量/g 实际测得浓度/(m g L -1)样品理论含量/m g加标后含量/m g加标含量/m g 回收率/%平均值/%R S D/%0.1004139.53510.76911.39540.643397.350.1009142.49180.77291.4249101.350.1072146.38260.82121.463899.900.1008205.62640.77212.05631.286599.820.1008205.40450.77212.054099.6497.303.120.1003203.66700.76832.036798.590.1061271.25330.81272.71251.929898.450.1000271.10850.76602.7111100.790.1056273.37680.80892.733899.742.8㊀不同采收批次成品杜仲雄花中绿原酸含量由表8可知,不同采收批次杜仲雄花中绿原酸含量存在明显差异,同区域杜仲雄花中绿原酸含量无明显差异.表8㊀不同批次仲杜雄花中绿原酸含量样品样品含量/%陕西汉中深色杜仲雄花茶7.0452陕西汉中绿色杜仲雄花茶7.3687杜仲雄花茶1#6.3823杜仲雄花茶2#4.7384张家界杜仲雄花茶3.77163㊀讨论杜仲雄花中绿原酸含量检测过程中,提取方式主要参考杜仲叶的提取方式,且方式也较为多样化,如以水为溶剂,可进行煎煮㊁热回流㊁超声㊁酶法提取等方法,其中热回流法绿原酸提取率高于其他提取方法[16G19],通过水提法对提取过程中温度等参数进行了控制,其提取率可超过80%,其他方法绿原酸提取率在90%以上[18G19].在医药㊁食品等其他行业中对原料有极高要求,或从提取步骤㊁耗时及提取有效成分的差异等各方面进行综合考虑,可以根据需要选用更加合适的方法进行提取.任小宁等[20]在提取杜仲叶粉的时候选择使用不同工艺的酶提取法,可以提高提取效率且无污染.胡小祥等[21]在与芦丁同时提取时选择采用70%甲醇作为提取溶剂.王燕等[22]从金银花粗产品中一次分离得到高纯度绿原酸时,选择采用微波辅助乙醇提取方法.目前,研究提取金银花中绿原酸的报道较多,对杜仲雄花及杜仲叶中单一绿原酸的提取分离较少,且提取分离步骤较为繁琐,使用有毒有害试剂较多,试验过程可能会造成环境污染等.本实验室前期通过相关试验分析证明,不同溶剂对杜仲雄花进行提取后绿原酸含量差异性较小,纯水超声提取所得绿原酸浓度略低,50%乙醇与70%甲醇超声提取所得绿原酸浓度无明显差异,故在无特殊含量要求的情况下可以选择50%乙醇作为提取溶液更加安全可靠.本试验已通过方法学考察,验证该试验方法具有良好的精密度㊁稳定性和重复性.对单一研究杜仲雄花茶中绿原酸含量有较高的专属性,可以更加有效地分析研究不同品种杜仲雄花茶的品质.另外也有文献记载同产地不同批次杜仲雄花茶绿原酸含量存在较大差异,如魏媛媛等[5]研究66Copyright ©博看网. All Rights Reserved.10期㊀㊀朱㊀艳等:H P L C法测定杜仲雄花中绿原酸含量㊀㊀㊀㊀㊀㊀表明,张家界不同采样点的绿原酸含量存在较大波动.而本试验主要采用陕西地区杜仲雄花茶,其绿原酸含量相较于文献报道的张家界产区中的绿原酸含量高[5].本研究中绿原酸含量较高的原因可能是供试品溶液处理过程参数影响了最终绿原酸的含量.因此后续研究中应采用较为方便快捷的方法,分析研究不同品种杜仲雄花茶生产㊁采摘等方面的品质控制.4㊀结论研究结果表明本试验条件下H P L C法测定杜仲雄化中绿原酸含量最佳提取时间为30m i n,考虑实验室环境污染及实验人员安全,选择较为实用的50%乙醇作为提取溶液.经过方法学考察,该试验方法具有良好的精密度㊁稳定性和重复性,可快速简便测定杜仲雄花中绿原酸含量.参考文献:[1]㊀刘锟,王健英,魏莉,等.H P L C法测定杜仲皮㊁叶㊁雄花中8种成分[J].中成药,2021,43(3):686G691.[2]㊀陈晓俊,王凤琛,袁颖,等.杜仲皮㊁杜仲叶㊁杜仲雄花的药效学比较研究[J].甘肃中医药大学学报,2016,33(5):5G8.[3]㊀刘星.杜仲不同药用部位化学成分和含量的比较研究及在中成药中的应用[D].南京:南京中医药大学,2022.[4]㊀张威鹏.杜仲主要活性成分的时空分布特征及其血管舒张作用差异分析[D].哈尔滨:东北林业大学,2020.[5]㊀魏媛媛,李伟业,温晓,等.H P L C法同时测定不同产地杜仲雄花茶中3种活性成分含量[J].安徽农业科学,2019,47(8):192G194,197.[6]㊀郭洋静,丁艳霞,许兰波,等.H P L C法同时测定杜仲雄花中5种活性成分[J].中成药,2014,36(10):2131G2134.[7]㊀白喜婷,朱文学,罗磊,等.杜仲雄花及花茶中绿原酸含量分析[J].食品工业科技,2007(6):216G217,127.[8]㊀谭丹,曾丹,唐利东,等.基于阴虚证㊁阳虚证及卵巢功能减退小鼠模型探讨杜仲雄花的补肾功效[J].时珍国医国药,2022,33(12):2875G2878.[9]㊀魏媛媛.杜仲雄花茶质量评价及其破壁咀嚼片的研制[D].吉首:吉首大学,2019.[10]㊀郭佩佩.杜仲叶中绿原酸的分离及其生物活性研究[D].杨凌:西北农林科技大学,2021.[11]㊀王玲娜,姚佳欢,马超美.绿原酸的研究进展[J].食品与生物技术学报,2017,36(11):1121G1130.[12]㊀魏媛媛,于华忠,温晓.破壁技术及其在杜仲雄花茶中的应用进展[J].贵州农业科学,2018,46(10):109G111.[13]㊀徐文泱,唐小兰,宋阳,等.基于响应面法优化杜仲雄花茶中活性成分及加工工艺[J].食品安全质量检测学报,2021,12(7):2561G2568.[14]㊀雷燕妮,张小斌,李多伟.杜仲叶提取绿原酸的工业化生产工艺优化[J].商洛学院学报,2022,36(2):14G19.[15]㊀中国林业产业联合会.杜仲雄花茶:T L Y C Y010-2020[S].北京:中国林业产业联合会,2020.[16]㊀黄广君,梁锦添,蒋小云.金银花有效成分绿原酸的提取工艺研究[J].山东化工,2017,46(10):9G11.[17]㊀李辉,逯桃桃,陈佳,等.金银花绿原酸提取方法研究[J].分析测试技术与仪器,2022,28(4):416G421.[18]㊀丁敏,王丽玲,秦玉川,等.金银花中绿原酸的水提取工艺研究[J].浙江林业科技,2022,42(2):15G20.[19]㊀黄琛斐,张哲,王茁,等.不同采收时间下杜仲叶绿原酸含量的差异及绿原酸提取工艺的优化研究[J].饲料研究,2022,45(15):84G87.[20]㊀任小宁,杨伟东.正交试验优化杜仲叶中绿原酸酶法提取工艺研究[J].食品与发酵科技,2019,55(5):1G4,9.[21]㊀胡小祥,何艳,张霞,等.高效液相色谱变波长法同时测定杜仲平压片中绿原酸和芦丁的含量[J].甘肃中医药大学学报,2020,37(4):10G14.[22]㊀王燕,卢恒,邹晓菊,等.金银花中绿原酸提取分离纯化方法研究进展[J].中华中医药学刊,2022,40(8):186G189.D e t e r m i n a t i o no fC h l o r o g e n i cA c i d i nE u c o m m i a M a l eF l o w e r s b y H P L CZ H UY a n1,L I X i a n z h i1,2,M A O Q i o n g l i1,Y A NL i n g1,S H IH a o1,L I UY a n g1,H UY a n g1,C H E NY a n h e1(1.J i n g B r a n dC o.,L t d.,H u a n g s h i435100,C h i n a;2.H u b e iK e y L a b o r a t o r y o fQ u a l i t y a n dS a f e t y o fT r a d i t i o n a l C h i n e s eM e d i c i n eH e a l t hF o o d,H u a n g s h i435100,C h i n a)A b s t r a c t:I n o r d e r t o e s t a b l i s h a r a p i d a n d s i m p l em e t h o d f o r t h e d e t e r m i n a t i o n o f c h l o r o g e n i c a c i d i nm a l e f l o w e r s o f E u c o m m i a u l m o i d e s,t h e c h r o m a t o g r a p h y w a s p e r f o r m e d o nA g i l e n tGC18c o l u m n(4.6m mˑ250.0m m,5μm) w i t h i s o m e t r i c e l u t i o no f a c e t o n i t r i l eG0.4%a c e t i c a c i d(10ʒ90)a t t h e f l o wr a t e o f1.0m L m i n-1a t35ħ,s i n g l e w a v e l e n g t hd e t e c t i o n327n m.T h e s t a b i l i t y a n d p r e c i s i o no f t h em e t h o dw e r e o p t i m i z e d t h r o u g he x p e r i m e n t s.T h e r e s u l t s s h o w e d t h a t t h e c h l o r o g e n i c a c i d s h o w e d a g o o d l i n e a r r e l a t i o n s h i p(R2=0.9998)a n d t h e a v e r a g e r e c o v e r y w a s97.30%.T h e t r e a t m e n tm e t h o do f t h e t e s t s o l u t i o n i se n v i r o n m e n tGf r i e n d l y,w h i c hc a nb e t t e r r e d u c e e n v i r o n m e n t a l p o l l u t i o n a n d p r o t e c t t h e e x p e r i m e n t e r s.T h em e t h o dh a s h i g h p r e c i s i o n a n d r e p e a t a b i l i t y,a n d c a nb eu s e da s t h e d e t e r m i n a t i o no f c h l o r o g e n i c a c i d c o n t e n t i n E u c o m m i a m a l e f l o w e r s.K e y w o r d s:E u c o m m i a m a l e f l o w e r;c h l o r o g e n i c a c i d;H i g hP e r f o r m a n c eL i q u i dC h r o m a t o g r a p h y(H P L C)76Copyright©博看网. All Rights Reserved.。
高效液相色谱法测定杜仲中绿原酸的含量

高效液相色谱法测定杜仲中绿原酸的含量刘圣金;狄留庆;吴德康;宋燕【期刊名称】《中国中医药信息杂志》【年(卷),期】2006(013)001【摘要】目的研究杜仲原药材中绿原酸的含量测定方法.方法采用高效液相色谱(HPLC)法,对杜仲中绿原酸提取时的提取溶剂、方法、时间和次数进行了优选.以Lichrospher C18(4.6 mm × 250mm ,5μm)为分析柱,流动相为乙腈-水-磷酸溶液(1 3:86.5:0.5);柱温:25℃;检测波长:327 nm;流速:0.8 mL/min,采用面积外标法.结果杜仲粉用体积分数为60%甲醇水溶液回流提取2次(每次1 00 mL,第1次1.5 h,第2次0.5 h),可提出杜仲原药材中绿原酸总量的95.68%.线性范围2.22×10-2~55.40×10-2 μg,平均回收率为99.55%,RSD=1.98%(n=6).结论本法简便、灵敏、重现性好,可用于测定杜仲中绿原酸的含量.【总页数】2页(P44-45)【作者】刘圣金;狄留庆;吴德康;宋燕【作者单位】南京中医药大学,江苏,南京,210029;南京中医药大学,江苏,南京,210029;南京中医药大学,江苏,南京,210029;上海华宇药业有限公司,上海,200002【正文语种】中文【中图分类】R284.1【相关文献】1.反相高效液相色谱-光电二极管阵列检测器法测定杜仲叶发酵液中绿原酸的含量[J], 方传代;刘传安;邹盛勤2.高效液相色谱法测定杜仲黑茶中绿原酸和咖啡因的含量 [J], 朱冰3.高效液相色谱法测定杜仲缓释滴丸中绿原酸含量 [J], 王柏强;刘福4.高效液相色谱法测定不同生长年限杜仲皮中绿原酸的含量 [J], 王丽楠;杨美华5.高效液相色谱法测定杜仲皮中绿原酸的含量 [J], 石少澜;王祝举;邵爱娟;黄璐琦因版权原因,仅展示原文概要,查看原文内容请购买。
HSCCC法分离京尼平苷及京尼平的显色反应

HSCCC法分离京尼平苷及京尼平的显色反应
杨丹;周敏;朱红霖;樊希望;韦万兴
【期刊名称】《广西大学学报(自然科学版)》
【年(卷),期】2010(035)003
【摘要】用高速逆流(HSCCC)的方法,从栀子中分离得到高纯度的京尼平苷.京尼平苷在酶作用下水解,水解产物经溶剂萃取及重结晶,制备得到京尼平晶体,京尼平与氨基酸反应合成栀子蓝色素.京尼平与氨基酸反应的最佳工艺条件:料液比为1:30,蒸馏水作溶剂,pH呈中性,京尼平与氨基酸物质量比为1:1,60℃恒温水浴.反应48 h.【总页数】5页(P493-496,501)
【作者】杨丹;周敏;朱红霖;樊希望;韦万兴
【作者单位】广西大学,化学化工学院,广西,南宁530004;广西大学,化学化工学院,广西,南宁530004;广西大学,化学化工学院,广西,南宁530004;广西大学,化学化工学院,广西,南宁530004;广西大学,化学化工学院,广西,南宁530004
【正文语种】中文
【中图分类】TQ041
【相关文献】
1.反相高效液相色谱法同时分离测定杜仲雄花及其产品中的京尼平苷酸和绿原酸[J], 董娟娥;马希汉
2.超快速液相色谱法同时测定栀子厚朴汤中京尼平苷和京尼平1-β-D龙胆双糖苷的含量 [J], 史健艺;冯波;曹庆贺;潘旭;朴慧顺;朱鹤云;关皎
3.活性炭联合大孔树脂分离纯化京尼平苷的研究 [J], 梁华正;李威威;彭玲西;李媛;
乐长高
4.正交试验法优选杜仲叶中桃叶珊瑚苷和京尼平苷酸的提取工艺研究 [J], 刘静;吕海涛
5.高纯度京尼平苷的分离纯化 [J], 李国平;陈剑锋;许明塔;陈浩;郭养浩
因版权原因,仅展示原文概要,查看原文内容请购买。
反相高效液相色谱法测定杜仲胶囊中绿原酸的含量

反相高效液相色谱法测定杜仲胶囊中绿原酸的含量
周兰;王丽
【期刊名称】《贵州医药》
【年(卷),期】2001(025)006
【摘要】@@ 杜仲胶囊系以我省名贵中药杜仲(Eucommia ulmoidesOliv)叶为原料,采用现代方法,经提取加工制成的胶囊剂,具有补肝肾,强筋骨,降血压,安胎的功能.因原质量标准方法较为简单,无含量测定指标,为控制产品的质量,本文采用反相高效液相色谱法对杜仲胶囊中绿原酸的含量测定方法进行了实验研究,结果表明,该法操作简便,快速,重现性好,可用于杜仲胶囊的质量控制.
【总页数】2页(P553-554)
【作者】周兰;王丽
【作者单位】贵州省药品检验所,;贵州益康制药有限公司,
【正文语种】中文
【中图分类】R28
【相关文献】
1.反相高效液相色谱法测定乌金胶囊中绿原酸的含量 [J], 费扬;王慧;凌水花;张国庆;张祖艳
2.反相高效液相色谱法同时测定香菊胶囊中绿原酸和咖啡酸含量 [J], 孙菲;孙欣;金荣
3.反相高效液相色谱法测定杜仲绿原酸的含量 [J], 王巧;毕开顺;田菁;蒋午峻
4.反相高效液相色谱法测定杜仲中京尼平苷、京尼平苷酸及绿原酸的含量 [J], 戚
向阳;陈维军;张声华
5.反相高效液相色谱法测定双黄连胶囊中绿原酸的含量 [J], 陈继英;赵辉;单振顺因版权原因,仅展示原文概要,查看原文内容请购买。
杜仲资源多级高效利用新工艺

杜仲资源多级高效利用新工艺在我国,杜仲具有丰富的资源优势,但其资源利用率比较低,大部分原料处于自生自灭状态,造成了其药用、食用价值和资源的极大浪费。
论文以我国特色植物资源杜仲为物质基础,围绕国家林业经济和社会发展重大需求,以获得目的组分——杜仲胶、种子油、绿原酸和京尼平等成分的高值化产品为研究目标,提出了植物资源的多级化高效利用理念,其涵盖内容如下:以植株中可续再生资源为主要利用部位;实现对植物中活性成分的多极性连续提取;注重提取分离技术的创新;完善针对目的成分的生态分离及转化工艺。
在论文中对杜仲不同部位有效成分的绿色分离工艺进行了创新设计,为合理高效地利用杜仲资源提供了科学依据。
确定了 HPLC同时分离检测杜仲中四种目标成分桃叶珊瑚苷、绿原酸、京尼平和京尼平苷的条件:Waters高效液相色谱仪;HiQ sil-C18反相色谱柱(4.6 mm × 250 mm × 5μm);柱温:30 ℃;检测波长:205 nm,240 nm;流动相:0.04%磷酸水溶液(A)-甲醇(B);梯度洗脱:0-10 min,5%(B);10-20 min,5-20%(B);20-35 min,20-25%(B);35-40 min,25-5%(B);进样量:10μL;流速:1 mL/min。
该检测方法精密度高、重现性好,适用于杜仲目标成分的分析检测,通过HPLC检测,杜仲皮、叶和翅果中的含量较高的成分分别为京尼平苷、绿原酸、桃叶珊瑚苷。
1.创新发展了离子液体-酶辅助提取技术,将其应用于杜仲叶中的绿原酸提取过程。
以0.5mol/L[C6mim]Br-纤维素酶为提取介质,优化的最佳工艺条件为:孵化提取时间2 h,提取温度50 ℃、pH值为3、酶浓度2 mg/mL。
通过比较四种溶剂体系下绿原酸提取动力学,[C6mim]Br溶液作为绿原酸的提取溶剂具有明显的优势,而且纤维素酶的添加有效地提高了提取溶剂穿透细胞的能力,有效的改善了离子液体溶液作提取溶剂对植物固体基质渗透性差的问题。
高效液相色谱法同时测定杜仲降压片中绿原酸和芦丁的含量

m n 6 % ) 流 速 1m / i , 温 3 i 、0 ; lm n 柱 / 5℃ , 测 波 长 检
30n , 5 m 进样量 l 1 0 。在该色谱条件下 , 绿原酸、 芦 丁分离良好 , 且不受杜仲降压片中杂质的干扰。 分别精密 量取对 照品溶液依 次 进样 2581、 、 、 。按上述色谱条件分析 , 、、 、 l 1 2 l4 7 0 以 Y为峰面积 , x为进样量 , 酸 、 绿原 芦丁的线性方程
照 品 ( 号 7 32 0 l ) 芦 丁 对 照 品 ( 号 0 6 批 5 _ 31 、 0 批 8—
筛 ) , 1om 锥形瓶中, 4g 于 o l 加人 6%乙醇溶液 3 0 0 m1称定质 量后冷浸 4h 超声 提 取 15h 冷 却 后用 , 、 . , 相应浓度 的 乙醇 补 足 质 量 。经 0 4 m 的滤 膜 滤 .5
wa r 55泵 , 96 电二极 管检测 器 ( A , ts l e 29 光 P D) 72 i 75 手动 进样器 , pe sr B SC 846m × 5 shrob D 1 (. m 20 i 舢 , 1 色谱柱 , m oe 色谱工作 站 。绿原 酸对 5 1 J) E pW r
杜仲降压片是 以杜仲叶为基础原料 , 加上益母
草、 夏枯草 等组 成 的复 方 制剂 , 有补 肾平 肝 、 具 降压
清热等功效。近年来 , 已有文献 报道用高效液 相色谱法 ( P c 测定杜仲中绿原 酸的含 量, 同 HL) 但 时 测定杜 仲 降压 片 中绿原 酸 、 丁两 种 有效 成 分 的 芦 研究鲜见报道 。本文首次采用 H L P c法同时测定杜 仲降压片中绿原酸、 芦丁的含量 , 在为制订该品种 旨 的质量标准提供依据 。 1 仪器与试 药
反相高效液相色谱法同时分离测定杜仲雄花及其产品中的京尼平苷酸和绿原酸

20 0 7年 3月
Ma c 2 7 r h 00
色
谱
Vo . 5 1 2 No. 2 2l ~2 0 7 2
C ieeJ u n l f C rmao rp y hn s o r a ho t a h o g
反 相 高效 液相 色谱 法 同时分 离测 定 杜仲 雄 花 及 其产 品 中的
Reor anc q d Chr s gh Pe f m e Li ui om at r og aphy
DO NG u ne 一 ,M A h n J a Xi a
( 、 rh s &F U ie st h yLa oao y o x ot t n a tl ain o ln s u c si h a x J No twet A n v riy,teKe b r tr fE pliai nd U i z to Pa t o i f Re o re n S a n i
测 波 长 为 2 0n 。在 该 色 谱 条 件 下 , 尼 平 苷 酸 的 含 量 在 0 0 5~ . 0 / 、 原 酸 的 含 量 在 0 0 5~1 2 0 g L 4 m 京 .2 0 4 0g L 绿 .7 . 0 /
范 围 内 线性 关 系 良好 , 关 系数 分 别 为0 997 .9 ; 标 回 收 率 分 别 为 10 2 和 1 05 相 、 9 和0 9 9 加 9 0 .% 0 . %。 该 法 适 用 于 杜 仲
D e e m i t on t r na i of Geni pos di c d a i c A i nd Chl og or eni c d i M a e c A n i l
Fl w e s a o r nd Rel e Pr at d oduc s ofE uc t om m i ul oi s by a m de
RP-HPLC测定杜仲平压片中京尼平苷酸、绿原酸、京尼平苷的含量

RP-HPLC测定杜仲平压片中京尼平苷酸、绿原酸、京尼平苷的含量马凤仙;赫锦锦;李钦【期刊名称】《中成药》【年(卷),期】2008(030)001【摘要】目的:建立杜仲平压片(杜仲叶)中京尼平苷酸、绿原酸、京尼平苷含量测定方法.方法:采用反相高效液相色谱法,Diamonsil(钻石)C18色谱柱(5 μm,150 mm ×4.6 mm),甲醇-水-冰醋酸(15∶85∶1.5)为流动相,检测波长237 nm.结果:该方法线性关系良好.京尼平苷酸、绿原酸、京尼平苷的精密度分别为1.93%、1.50%、1.66%,n=5.加样回收率分别为97.3%、97.2%、96.7%.结论:本方法简便快捷、重现性好;可用于同时测定杜仲平压片中3种有效成分含量.【总页数】4页(P86-89)【作者】马凤仙;赫锦锦;李钦【作者单位】河南大学中药研究所,河南,开封,475004;河南大学中药研究所,河南,开封,475004;河南大学中药研究所,河南,开封,475004【正文语种】中文【中图分类】R927.2【相关文献】1.RP-HPLC法测定杜仲叶中京尼平苷酸与绿原酸的累积含量 [J], 冯攀;马养民;朱军峰;陈立红2.RP-HPLC测定杜仲叶中京尼平苷酸、绿原酸、京尼平苷的含量 [J], 孙彦超;李钦;杜红岩;付建敏;杜兰英3.车前子超微速溶饮片中京尼平苷酸与毛蕊花糖苷的含量测定 [J], 陈乐;谢玲;熊学敏4.车前子超微速溶饮片中京尼平苷酸与毛蕊花糖苷的含量测定 [J], 邱倬星;熊学敏;胡晓艳;熊犇;陈乐;谢玲5.反相高效液相色谱法测定杜仲中京尼平苷、京尼平苷酸及绿原酸的含量 [J], 戚向阳;陈维军;张声华因版权原因,仅展示原文概要,查看原文内容请购买。
杜仲叶中3种主要活性成分的动态变化

杜仲叶中3种主要活性成分的动态变化杨春霞;黄丽莉;朱培林;龚斌【摘要】采用高效液相色谱法(HPLC)测得江西栽培杜仲叶中绿原酸、京尼平苷和桃叶珊瑚苷3种活性成分在不同月份之间呈动态变化,绿原酸在6月含量最高(10817.91μg/g),在12月含量最低(2179.938μg/g);京尼平苷和桃叶珊瑚苷含量均在6月和10月出现2次积累高峰期,暗示与杜仲树体生长具有一定的相关性。
6月杜仲生长较慢、3种活性成分含量相对较高、叶面积较大,6月采收杜仲叶既减少了对树体的损伤,又保证了杜仲叶的产量和质量,故杜仲叶6月采收最佳。
【期刊名称】《南方林业科学》【年(卷),期】2015(043)001【总页数】3页(P8-10)【关键词】杜仲;绿原酸;京尼平苷;桃叶珊瑚苷;动态变化【作者】杨春霞;黄丽莉;朱培林;龚斌【作者单位】江西省林业科学院,江西南昌330013;;;;【正文语种】中文【中图分类】S792.99杜仲(Eucommia ulmoides)为我国特有的单科、单属、单种植物,是国家二类重点保护植物,也是我国名贵中药材,以皮入药早在2000多年前的《神农本草经》中就有记载[1]。
传统上以皮入药,不仅产量低,而且树皮环剥后容易致死。
近年来研究证实,杜仲叶与皮中含有相同的化学成分和具有相似的药理作用,在降压、抗菌、抗肿瘤、利尿、止咳等方面具有同等功效,杜仲叶资源丰富,以叶入药减少了对树体的伤害,以叶代皮完全可行[2]。
绿原酸、京尼平苷和桃叶珊瑚苷是杜仲叶中3种主要活性成分,绿原酸具有清除自由基、抗菌消炎、抗病毒、降压及保肝利胆等多种功能,京尼平苷和桃叶珊瑚苷属于环烯醚萜类活性物质,在抗肿瘤、降压、镇痛、消炎利胆等方面具有很好功效[3]。
绿原酸在杜仲叶中含量相对较高,是其主要活性成分之一,研究者对其含量的动态变化研究较多,张万峰[4]对陕西安康的杜仲试验林中不同月份叶中绿原酸变化进行了研究,茹建永等[5]以河南义马杜仲为材料研究了叶中绿原酸在不同采收期的变化情况,但杜仲叶中以一种活性指标为参照确定其最佳采收期存在很大片面性,不能代表杜仲叶的质量,因此,有的研究者对杜仲叶中几种活性成分同时分析其动态变化,如张康健等[6]研究了杜仲叶中绿原酸、总黄酮、京尼平苷酸和桃叶珊瑚苷的动态变化规律,张鞍灵等[7]采用反向液相色谱法分析了杜仲叶中京尼平苷酸、绿原酸和京尼平苷的动态变化情况,杜红岩等[8]也对杜仲叶中绿原酸、京尼平苷和京尼平苷酸动态变化进行了研究,综合分析确定杜仲叶的最佳采收期为6月。
双波长HPLC同时测定氮沉降处理下杜仲皮和叶中的5种成分

双波长HPLC同时测定氮沉降处理下杜仲皮和叶中的5种成分哀建国;杜江丽;周爱存;金松恒;宋新章【摘要】建立双波长高效液相色谱法(HPLC)同时测定模拟氮沉降处理下杜仲Eucommia uimoides皮和叶中松脂醇二葡萄糖苷、桃叶珊瑚苷、绿原酸、京尼平苷酸和京尼平苷等5种活性成分含量的方法.采用Agilent ZORBAX SB-C18柱(250.0 mm×4.6 mm,5μm),以乙腈(A)-2.0 g·kg-1磷酸水溶液(B)进行梯度洗脱(0~12 min,10%A; 12~25 min,13%A; 25~50 min,30%A;50~65 min,60%A);流速为0.8 mL·min-1;检测波长203 nm,240 nm;柱温30℃.结果表明:松脂醇二葡萄糖苷、桃叶珊瑚苷、绿原酸、京尼平苷酸、京尼平苷等在各自的线性范围内与其峰面积积分值呈良好的线性关系.整个实验期间,杜仲皮和叶中5种成分含量对施氮处理产生了不同的响应,且随季节在变动.该方法能准确、快速地对杜仲皮和叶中多种有效成分同时进行测定,可较好反映浙江高氮沉降区特色名贵药材杜仲皮和叶中多种有效成分的变化.【期刊名称】《浙江农林大学学报》【年(卷),期】2015(032)001【总页数】7页(P60-66)【关键词】经济林学;杜仲;模拟氮沉降;药用成分;双波长高效液相色谱法【作者】哀建国;杜江丽;周爱存;金松恒;宋新章【作者单位】浙江农林大学信息工程学院,浙江临安311300;浙江农林大学林业与生物技术学院,浙江临安311300;浙江农林大学林业与生物技术学院,浙江临安311300;浙江农林大学林业与生物技术学院,浙江临安311300;浙江农林大学林业与生物技术学院,浙江临安311300【正文语种】中文【中图分类】S759.3杜仲Eucommia ulmoides又名思仙、思仲、木棉等,是中国特有的贵重中药材和工业提胶原料树种。
hplc波长切换法同时测定杜仲双降袋泡剂中7种成分的含量

Traditional Chinese Medicineꎬ Shenyang 110032ꎬ Chinaꎻ2 Suicheng Pharmaceutical Co ꎬ LTDꎬ Zhengzhou 451150ꎬ
绿原酸、京尼平苷、松脂醇二葡萄糖苷、芦丁及槲皮素 7 种成分含量的方法ꎮ 方法 以 80% 甲醇为溶剂ꎬ加热回
流提取ꎻ色谱柱:Hydrosphere C18 (4 6 mm × 200 mmꎬ5 μm) ꎻ柱温:30 ℃ ꎻ流动相:乙腈 - 0 1% 磷酸溶液ꎬ梯度洗
脱ꎻ检测波长:208 nm( 桃叶珊瑚苷) 、235 nm( 京尼平苷酸、绿原酸、京尼平苷、松脂醇二葡萄糖苷) 、270 nm( 芦丁、
平苷、松脂醇二葡萄糖苷、芦丁和槲皮素的含量ꎬ方法简便准确、灵敏度高ꎬ可用于杜仲双降袋泡剂的质量控制ꎮ
[ 关键词] 杜仲双降袋泡剂ꎻ桃叶珊瑚苷ꎻ京尼平苷酸ꎻ绿原酸ꎻ京尼平苷ꎻ松脂醇二葡萄糖苷ꎻ芦丁ꎻ槲皮
素ꎻ波长切换法
Simultaneous determination of seven ingredients in Duzhong Shuangjiang Daipaoji
69
实用药物与临床 2020 年第 23 卷第 1 期 Practical Pharmacy And Clinical Remediesꎬ2020ꎬVol. 23ꎬNo. 1
药学研究
HPLC 波长切换法同时测定杜仲双降袋泡剂中 7 种成分的含量
李黎丽1∗ ꎬ何胜利2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
测液。 & & 取待测液 " ! & , 在选定的色谱条件下注入高效 液相色谱仪 (! 0 #) , 积 分 求 色 谱 峰 面 积, 以标准曲 线计算样品中 "$# 和 !"# 的含量。
!" 实验部分
! ! !" 仪器、 试剂和材料 ! ! ! ! !" 材料 & & 杜 仲 雄 花 和 杜 仲 叶 于 !$$" 年 采 自 西 北 农 林 科 技大学林学院杜仲优树汇集圃。杜仲雄花于盛花期 采集后立即杀青, 阴 干, 封 袋 保 存; 杜仲叶于 ’ 月中 旬采集后立即杀青, 阴干, 封袋保存。杜仲雄花茶来 自陕 西 杨 凌、 陕 西 略 阳、 河 南 汝 阳、 河 南 灵 宝 等 地。 杜仲叶绿茶为市售。 & & 使用前将上述各样品粉碎过 + 号筛, 在 ’$ ’ 真 空干燥箱中烘至恒重, 备用。 ! ! ! ! #" 仪器与试剂 & & (!&)+$ #*+ 型 %$&! 系 统 ( (,-./012 ) , 包括 ($3)+$ #*+ 紫 外 检 测 器、&!)+$ #4*+ 输 液 泵 和 ((!" - 手动进 样 器。 56)+($$ 型 $,/7./ (+89 紫 外 分光光 度 计 ( (,-./012 ) ; :;02<8+$ 型 超 声 波 提 取 机 ( 天津科贝 尔 公 司 ) ; 超纯水发生器 ( 陕西超达公 司) 。 !"# 标 准 品 ( 德 国 =/7<>72,8 公 司 ) ; "$# 标 准品 ( 日本和 光 纯 药 业 株 式 会 社 ) ; 色谱纯甲醇 (美 国 ?->,87 公司) ; 水 为 双 重 蒸 馏 水; 乙 酸、 乙醇为国 产分析纯。
区) , 栽种面 积 有 $( 万 公 顷。 《中华人民共和国药 典》 ( !""" 版 )规 定 其 药 用 部 位 为 杜 仲 皮[ & ]。 研Biblioteka ・ !+/・色
谱 ! ! #" 实验方法 ! ! # ! !" 标准品溶液的配制
第 !" 卷
#] 究[ ! , 发现, 杜仲叶含 有 与 杜 仲 皮 相 类 似 的 成 分, 并
["]
;京 尼 平 苷 酸
( "$# ) 具有消炎利胆 等 功 能, 在临床上降压作用明 显, 日本 健 康 卫 生 部 已 将 它 作 为 一 种 保 健 品 添 加 剂
[’]
。目前, 对 杜 仲 皮 和 叶 中 "$# 和 !"# 单 一 成
[( ) *]
分的含量测定 方 法 已 有 文 献 报 道 道
收稿日期: !""( +") +!& 第一作者: 董娟娥, 女, 博士研究生, 副教授, ,+-".( : /01""*+ &!( ) $’-) 通讯联系人: 马希汉, 男, 教授, ,+-".( : -" , 2. , %"3 + 4"%’’) $’-) $3) 基金项目: 中国科学院 “ 西部之光” ( !""% ) 人才培养计划 ( !""% 56"! ) 和西北农林科技大学青年专项基金资助 )
[ +$ , ++ ]
, 同时测定杜
仲颗粒和杜仲皮中 "$# 和 !"# 的方法也有文献报 , 按文献 [ +$ ] 和 [ ++ ] 方法完成整个测定工作 需 时 较 长。 为 此,本 文 对 利 用 高 效 液 相 色 谱 ( %$&! ) 同时分离测定 杜 仲 雄 花 中 "$# 和 !"# 含 量的方法进行了研 究, 并对来自不同产地的杜仲雄 花茶中这两种成分 的 含 量 进 行 了 分 析, 为杜仲雄花 及以杜仲雄花为原料的产品的质量控制和质量标准 的制定提供了简便、 可靠的含量分析方法。
0;-#$(/# :C H.-=(1 "3/ #"=./ %.@% =1#I’#-"3$1 (.JF./ $%#’-"K’@#"=%.$ -1K%’/ %"H L113 /1M1(+ ’=1/ I’# K%1 /1K1#-.3"K.’3 ’I @13.=’H./.$ "$./ "3/ $%(’#’@13.$ "$./ .3 K%1 -"(1 I(’N1#H "3/ #1+ ("K1/ =#’/F$KH ’I 7?@#HH/4 ?:H#/;() ) ON’ $’-=’313KH N1#1 H1="#"K1/ L4 " <%.-+="$> &8+ ?5< $’(F-3( &%" -- . /0 ( -- , % ! - )N.K% " -’L.(1 =%"H1 ’I -1K%"3’(+N"K1#+"$1K.$ "$./( !/ 1 #%1 & ,M A M )"K " I(’N #"K1 ’I & -: A -.3 ,$’(F-3 K1-=1#"KF#1 ’I $" P "3/ /1K1$K.’3 N"M1(13@K% ’I !/" 3-) Q3/1# K%1 $%#’-"K’@#"=%.$ $’3/.K.’3H -13K.’31/ "L’M1 ,K%1 -1K%’/ =1#I’#-"3$1 , HF$% "H K%1 3F-L1# ’I K%1’#1K.$"( =("K1 ,#1H’(FK.’3 ,K#".(.3@ (%@ %"M1 "(( #1"$%1/ #1JF.#1/ (1M1() O%1 (.31"# #"3@1H N1#1 "0 "!% 2 "0 /"" @ A : I’# @13.=’H./.$ "$./ "3/ "0 "#% 2 &0 !"" @ A : I’# $%(’#’+ @13.$ "$./ ,N.K% K%1 $’##1("K.’3 $’1II.$.13KH ’I "0 *** # "3/ "0 *** * ,#1H=1$K.M1(4) O%1 "M1#"@1 #1$’M1#.1H N1#1 &""0 ! B "3/ &""0 % B ,"3/ K%1 #1("K.M1 HK"3/"#/ /1M."K.’3H( 7<5H )N1#1 &0 /# B "3/ &0 /* B #1H=1$K.M1(4) O%1 -.3.-F- /1K1$K.’3 (.-.KH N1#1 "0 "! ! @ A : I’# @13.=’H./.$ "$./ , "3/ "0 "( ! @ A : I’# $%(’#’@13.$ "$./) O%1 -1K%’/ /1M1(’=1/ %"H /1-’3HK#"K1/ K%1 $%"#"$K1#.H+ K.$H ’I H.-=(1 -’L.(1 =%"H1 $’-=’H.K.’3 ,H%’#K #1K13K.’3 ,@’’/ #1H’(FK.’3 ,%.@% #1=1"K"L.(.K4 "3/ =#1$.H.’3) RK .H HF.K"L(1 I’# K%1 /1K1#-.3"K.’3 ’I K%1 KN’ $’-=’F3/H .3 K%1 -"(1 I(’N1#H ’I 7! ?:H#/;() "3/ #1("K1/ =#’/F$KH) B"< 7)$.- :#1M1#H1/+=%"H1 %.@% =1#I’#-"3$1 (.JF./ $%#’-"K’@#"=%4 ( 78+98:; ) ;@13.=’H./.$ "$./ ;$%(’#’@13.$ "$./ ;7?@#HH/4 ?:H#/;() ;-"(1 I(’N1# ;-"(1 I(’N1# K1" - - 杜仲 ( 7?@#HH/4 ?:H#/;() ?(.M1# ) 为我国特 有的 名 贵 中 药 材, 分 布 在 全 国 !" 多 个 省 ( 市、 自治
提出 “ 以叶代皮” 的观点, 因而杜仲叶 被列 入 了 !$$" 版 《 中华人民共和国药典》 , 并以绿原酸作为其指标 成分
[%]
& & 准 确 称 取 "$# 标 准 品 +$, $ .@ 、 !"# 标 准 品 #$, $ .@ , 分 别 用 甲 醇 溶 解 并 定 容 至 +$ .& , 得到 +, $$$ @ A & 的 "$# 和 #, $$$ @ A & 的 !"# 标 准 品 贮 备液, 保存于 % ’ 冰箱中, 待分析时可按需要稀释成 不同的浓度。 & & 取上述 "$# 和 !"# 标准品贮备液各 % .& , 置 于 +$ .& 容量 瓶 中 混 合, 用 甲 醇 定 容 到 刻 度, 即得 $, %$$ @ A & 的 "$# 和 +, !$$ @ A & 的 !"# 混 合 储 备 液, 于 % ’ 冰箱中冷藏保存备用。 ! ! # ! #" 色谱条件 & & 色 谱 柱: (,-.)+/9B 6$)C3( ( +"$ .. - %, ’ .. , " !.) ; 流动相: 甲醇 ) 水 ) 乙酸 ( 体积比为 !%. (" . +) ; 流速: + .& A .-D ; 进 样 量: " !&; 检 测 波 长: !%$ D. ; 柱温: #$ ’ 。 ! ! # ! $" 样品处理和含量检测 & & 分别称取经 ’$ ’ 真 空 干 燥 的 样 品 $, "$$ @ , 加 入 / 倍量的 水, 在 超 声 波 提 取 器 中 提 取 #$ .-D , 定
