高考化学压题无机框图推断题答案
2020-2021高考化学高无机综合推断-经典压轴题及详细答案

2020-2021高考化学高无机综合推断-经典压轴题及详细答案一、无机综合推断1.A、B、C、W均为中学常见的物质,它们之间有如图所示的转化关系(其他产物及反应条件已略去,反应可以在水溶液中进行)。
(1)若A、B、C三种物质的焰色反应均为黄色,A俗称苛性钠,W为无色无味气体,C受热分解可转化为B。
①向B溶液中通入W生成C的离子方程式为__________________________________。
②A溶液与C溶液反应的化学方程式为______________________________________。
(2)若A、B、C三种物质都含有一种金属元素,且B为两性物质,W俗称苛性钠。
①A、B、C三种物质中所含有的金属元素单质与W反应的化学方程式为_____________。
②A溶液一步转化为C溶液的反应离子方程式为________________________________。
(3)若A、B、C、W四种物质均为气体,其中A、W为单质,C的摩尔质量为46g·mol-1。
①B的化学式为________________。
②实验室制取B时,_____________(填“能”或“不能”)用向上排空气法收集B。
③一定条件下B与CO反应的化学方程式为_____________________________。
(4)若A为淡黄色固体单质,W为气体单质,B、C均为酸性氧化物。
则C溶于水形成化合物D,在加热的情况下,D的浓溶液与A反应的化学方程式为________________________。
【答案】CO32-+H2O+CO2=2HCO3- NaOH+NaHCO3=Na2CO3+H2O 2Al+2NaOH+2H2O =2NaAlO2 +3H2↑ Al3-+ 4OH- =AlO2- + 2H2O NO 不能 2NO+2CO2CO2+N2S+2H2SO4(浓)3SO2↑+2H2O【解析】【分析】(1) 若A、B、C 三种物质的焰色反应均为黄色,均含Na元素,A俗称苛性钠,则A为NaOH,W为无色无味气体,C受热分解可转化为B,则W为CO2、B为Na2CO3,C为NaHCO3;(2)若A、B、C三种物质都含有一种金属元素,且B为两性物质,W俗称苛性钠,则B为Al(OH)3,A为AlCl3、C为NaAlO2;(3) 若A、B、C、W四种物质均为气体,其中A、W为单质,C的摩尔质量为46g•mol-1,则A为N2、W为O2、B为NO、C为NO2;(4) 若A 为淡黄色固体单质,W 为气体单质,B、C均为酸性氧化物,则A为S,W为O2、B为SO2、C为SO3 。
高考化学高无机综合推断-经典压轴题附答案

高考化学高无机综合推断-经典压轴题附答案一、无机综合推断1.已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末。
其转化关系如图。
请回答:(1)工业上制C用A不用H的原因______________________。
(2)写出C与K反应的化学方程式_________________,该反应的反应物总能量___________(填“大于”或“小于”)生成物总能量。
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式___________________。
(4)写出E物质的电子式___________________。
(5)J与H反应的离子方程式为________________________。
(6)写出G与熟石灰反应制取漂白粉的化学方程式_______________________。
【答案】氯化铝是共价化合物,熔融状态下不导电 2Al+Fe2O3高温Al2O3+2Fe 大于2KCl+2H2O2KOH+H2↑+Cl2↑ Al3++3AlO2-+6H2O=4Al(OH)3↓2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O【解析】【分析】【详解】形成D的元素的原子最外层电子数是次外层的3倍,原子只能有2个电子层,最外层电子数为6,则D为O2;K为红棕色固体粉末,K为Fe2O3;由于电解A得到C与D,则C与K 生成A的反应为铝热反应,故A为Al2O3,L为Fe,C为Al;黄绿色气体G为Cl2,与C反应得到H为AlCl3;B的焰色反应呈紫色(透过蓝色钴玻璃),B中含有K元素,B在催化剂、加热条件下反应生成氧气,则B为KClO3,E为KCl,电解KCl溶液生成KOH、H2和Cl2,过量的F与氯化铝反应得到J,则I为H2,F为KOH,J为KAlO2;(1)H为AlCl3,氯化铝是共价化合物,熔融状态下不导电,故工业上制Al用氧化铝不用氯化铝,故答案为氯化铝是共价化合物,熔融状态下不导电;(2)C与K反应的化学方程式为:2Al+Fe2O3高温Al2O3+2Fe,该反应为放热反应,故该反应的反应物总能量大于生成物总能量,故答案为2Al+Fe2O3高温Al2O3+2Fe;大于;(3)Fe是目前应用最广泛的金属,用碳棒作阳极,Fe作阴极,接通电源(短时间)电解KCl水溶液的化学方程式为:2KCl+2H2O 电解2KOH+H2↑+Cl2↑,故答案为2KCl+2H2O 电解2KOH+H2↑+Cl2↑;(4)E为KCl,KCl的电子式为,故答案为;(5)J与H反应的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为Al3++3AlO2-+6H2O=4Al(OH)3↓;(6)G为Cl2,G与熟石灰反应制取漂白粉的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
高中化学无机框图推断(含答案经典)

无机推断练习1.(2007年四川卷)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。
其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。
请填写下列空白:(1)在周期表中,组成单质G的元素位于第__________周期_________族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为___________________。
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是_(填写序号)。
(4)反应④的离子方程式是:_______________________________________(5)将化合物D 与KNO3、KOH 共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾).同时还生成KNO2和H2O 。
该反应的化学方程式是:。
思路解析:本题的突破口是“I是由第三周期元素组成的单质中熔点最高的金属”和“K是一种红棕色气体”,可先确定I为Al,K为NO2;第一条线索由反应①入手可知:A 是SO2、B是SO3、C是H2SO4,D是Fe2O3,反应⑦为铝热反应,则产物G是Fe。
第二条线索是由K 是NO2入手,推出L是NO,J为HNO3,M是Fe和HNO3反应得到的产物,可能是Fe(NO3)3或Fe(NO3)2,而根据M与C溶液反应可生成NO气体,可断定发生了氧化还原反应,故M只能为Fe(NO3)2溶液;第三条线索是Fe(NO3)2(M)与H2SO4(C)反应得F为Fe(NO3)3,E为Fe(OH)3,到此框图中的物质全部推出。
[答案]( l )四(或4 ) 、VIII;( 2 ) l :2 ;( 3 )③;( 4 ) 3Fe2++NO3-+4H++=3Fe3++NO↑+2H2O( 5 ) Fe2O3+3KNO3+4KOH高温2K2FeO4+3KNO2+2H2O2. 由短周期元素组成的A、B、C、D、E、F六种粒子,其中只有C、D是分子,其余四种均是离子,且每个微粒中都含有10个电子。
高考化学压题无机框图推断题答案

无机框图推断题高考化学压题-题目主要来源于北京、浙江、江苏、湖南、湖北等地区最新模拟试题图中部分反应物或生成物及反应(1.(14分)中学化学中几种常见物质的转化关系如图所示。
条件未列出)的元素属是常见金属,且组成B是单质,其余是化合物。
其中B、DC已知:A、B、、D溶液。
请既可溶于盐酸又可溶于NaOH在C中点燃有苍白色火焰,M于过渡元素。
又知A 回答下列问题:_______________。
)W的电子式是(1的主要用途的化学式。
N(2)写出,并任写一种N )写出下列反应的离子方程式:(3 ,反应①,反应③__________________________________________________________ 。
K溶液和过量氨水反应__________________________________________________分)(141.分)(2(1)1可用作催化剂、净水剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(2分),N((2)FeCl3分)--3+4Al(OH)Al+ Cl↑,+ 3AlO+6HO === 2OH + HO3()2Cl+2H↑322222+3+-↓,分)(方程式各3O === Al(OH)↓+ 3NHAl+ 3NH·H4332是中学化学常见单质,构成它们的元素的原子.E.C.D.27分).(14分).AB.2(12、、M、Y、ZX(a+c)3 (a+b = 2 () = 3 d-a);.е;且..α、序数分别为b cd的化合产物,它们之间有如下转化关系(图中反和CX、K是常见化合物,是BHWN、、:已略去)O应物和产物中的H29/ - 1 -周 D 单质的元素在周期表中位于的电子式为( 1)Y ,构成族期)反应③的离子方程式2 (为在一定条件下反应的化学方程式的氧化物与D E。
为:中,据此判断℃升华,几乎溶于所有的有机溶剂和HO183 (3)固体N常温下即挥发,2型晶体 N为+离子浓度之比电离出来的H和WN的水溶液中由HO (4)25℃时,PH=5的2为A⑴;三;Ⅲ(12分).2-3+ OH)+3AlOO = 4Al+6H⑵Al(3222Fe + AlO(FeO若写成FeOFeO+2Al 或FeO并配平也可以)433 32322410∶⑶分子⑷ 1G、D、B、A七种物质间存在如图所示的转化关系,其中G、F、E、D、C、B、A、分)14(3. 含有同种元素。
高考化学高无机综合推断-经典压轴题附答案解析
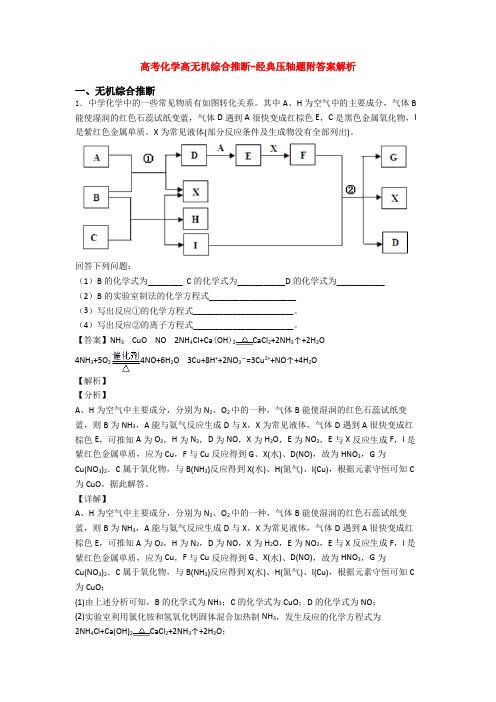
高考化学高无机综合推断-经典压轴题附答案解析一、无机综合推断1.中学化学中的一些常见物质有如图转化关系。
其中A、H为空气中的主要成分,气体B 能使湿润的红色石蕊试纸变蓝,气体D遇到A很快变成红棕色E,C是黑色金属氧化物,I 是紫红色金属单质。
X为常见液体(部分反应条件及生成物没有全部列出)。
回答下列问题:(1)B的化学式为________ C的化学式为___________D的化学式为___________(2)B的实验室制法的化学方程式____________________(3)写出反应①的化学方程式_______________________。
(4)写出反应②的离子方程式_______________________。
【答案】NH3 CuO NO 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O4NH3+5O24NO+6H2O 3Cu+8H++2NO3—=3Cu2++NO↑+4H2O【解析】【分析】A、H为空气中主要成分,分别为N2、O2中的一种,气体B能使湿润的红色石蕊试纸变蓝,则B为NH3,A能与氨气反应生成D与X,X为常见液体,气体D遇到A很快变成红棕色E,可推知A为O2,H为N2,D为NO,X为H2O,E为NO2,E与X反应生成F,I是紫红色金属单质,应为Cu,F与Cu反应得到G、X(水)、D(NO),故为HNO3,G为Cu(NO3)2.C属于氧化物,与B(NH3)反应得到X(水)、H(氮气)、I(Cu),根据元素守恒可知C 为CuO,据此解答。
【详解】A、H为空气中主要成分,分别为N2、O2中的一种,气体B能使湿润的红色石蕊试纸变蓝,则B为NH3,A能与氨气反应生成D与X,X为常见液体,气体D遇到A很快变成红棕色E,可推知A为O2,H为N2,D为NO,X为H2O,E为NO2,E与X反应生成F,I是紫红色金属单质,应为Cu,F与Cu反应得到G、X(水)、D(NO),故为HNO3,G为Cu(NO3)2.C属于氧化物,与B(NH3)反应得到X(水)、H(氮气)、I(Cu),根据元素守恒可知C 为CuO;(1)由上述分析可知,B的化学式为NH3;C的化学式为CuO;D的化学式为NO;(2)实验室利用氯化铵和氢氧化钙固体混合加热制NH3,发生反应的化学方程式为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O;(3)反应①为氨的催化氧化,发生反应的化学方程式为4NH3+5O24NO+6H2O;(4)反应②为Cu溶于稀硝酸生成NO,发生反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
高考化学压轴题专题复习—无机非金属材料的推断题综合含答案

高考化学压轴题专题复习—无机非金属材料的推断题综合含答案一、无机非金属材料练习题(含详细答案解析)1.某一固体粉末含有SiO2、Fe2O3、Al2O3,加入足量NaOH溶液充分反应后,过滤,向所得溶液中加入过量盐酸,过滤,将所得滤渣洗涤并灼烧至恒重,最终固体成份为A.SiO2B.Fe2O3、SiO2C.SiO2、Al2O3D.Fe2O3【答案】A【解析】SiO2、Fe2O3、Al2O3,加入足量NaOH溶液充分反应后,过滤,向所得溶液中含有硅酸钠、偏铝酸钠,加入过量盐酸,生成硅酸沉淀,将所得滤渣洗涤并灼烧生成二氧化硅,故A正确。
2.X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物。
下表各组物质之间通过一步反应不能实现如图所示转化的是()A.A B.B C.C D.D【答案】C【解析】【分析】【详解】A.X为H2,Z为Cl2,氢气与氯气可以一步反应生成化合物乙HCl;Y为Si,硅与氯气可以一步反应生成化合物甲SiCl4;氢气与SiCl4可以一步反应生成化合物乙(HCl)与单质Y(Si),故A正确;B.X为Mg,Z为O2,镁与氧气可以一步反应生成化合物乙MgO;Y为C,碳与氧气可以一步反应生成化合物甲CO2;镁与二氧化碳可以一步反应生成化合物乙(MgO)与单质Y(C),故B正确;C.X为Zn,Z为Cl2,锌与氯气可以一步反应生成化合物乙ZnCl2;Y为Fe,铁与氯气可以一步反应生成化合物甲FeCl3;锌与氯化铁不能一步反应生成化合物乙(ZnCl2)与单质Y(Fe),二者反应首先生成ZnCl2和FeCl2,然后锌再与FeCl2反应置换出铁,故C错误;D.X为O2,Z为H2,氧气与氢气可以一步反应生成化合物乙H2O;Y为N2,氮气与氢气可以一步反应生成化合物甲NH3;O2与NH3可以一步反应生成化合物乙(H2O)与单质Y(N2),故D正确;故答案为C。
3.下列关于硅单质及其化合物的说法正确的是()①硅是构成一些岩石和矿物的基本元素②水泥、玻璃、陶瓷都是硅酸盐产品③高纯度的硅单质广泛用于制作光导纤维④普通玻璃是氧化物,成分可表示为SiO2⑤粗硅制备单晶硅不涉及氧化还原反应⑥硅酸铜钡( BaCuSiO x,铜为+2价),x等于6,可用氧化物形式表示为 BaO·CuO·2SiO2 A.①②⑥B.①②③C.①②③④D.②③④⑤【答案】A【解析】【分析】【详解】①硅元素在自然界以化合态存在,主要是硅酸盐和二氧化硅,是构成一些岩石和矿物的基本元素,①正确;②水泥、玻璃、陶瓷都是传统无机非金属材料,主要是硅酸盐产品,制备原料都要用到含硅元素的物质,②正确;③光导纤维的成分是二氧化硅,高纯度的硅单质广泛用于制作硅能电池,③错误;④玻璃是混合物不是氧化物,主要成分是硅酸钠、硅酸钙、石英的混合物,成分可用氧化物的形式表示为:Na2O•CaO•6SiO2,④错误;⑤粗硅制备单晶硅的反应是:Si+2Cl2ΔSiCl4、SiCl4+2H2ΔSi+4HCl,在这个过程中涉及到的反应为氧化还原反应,⑤错误;⑥硅酸盐改写成氧化物形式时,活泼的金属氧化物写在前面,再写SiO2,含有氢元素的H2O最后写,所以硅酸铜钡用氧化物形式表示:BaO•CuO•2SiO2,⑥正确。
高考化学与高无机综合推断有关的压轴题及答案

高考化学与高无机综合推断有关的压轴题及答案一、无机综合推断1.某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如下图所示:已知①A、B、C、D、G含有同种元素。
②纯A(单质)B溶液D固体G溶液颜色银白色黄色红棕色浅绿色③E是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,也能将一种氧化物氧化为F,F是含有三种元素的化合物,与A反应生成E、G。
依据以上信息填空:(1)写出D的化学式:___________________________________________。
(2)G生成C的过程中所出现的现象为_________________________。
(3)写出反应A→B的化学方程式:_________________________________。
(4)B→F的离子方程式为________;G与次氯酸反应的离子方程式为________________________________。
【答案】Fe2O3先产生白色沉淀,迅速变为灰绿色,最后变为红褐色 2Fe+3Cl22FeCl3 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ H++2Fe2++HClO=2Fe3++Cl-+H2O【解析】【分析】结合框图,D固体呈红棕色,则其为Fe2O3;A、B、C、D、G含有同种元素,B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,则B为FeCl3,G中含有Fe2+,A为Fe。
由“B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,也能将一种氧化物氧化为F,F是含有三种元素的化合物,与A反应生成E、G”,则F为H2SO4,G为FeSO4;E是通常情况下密度最小的气体,则E为H2。
由B→C→D的转化可推知,C为Fe(OH)3。
【详解】(1)由以上分析可知,D为氧化铁,其化学式:Fe2O3。
答案为:Fe2O3;(2)FeSO4生成Fe(OH)3,可先加碱、后氧化,所出现的现象为先产生白色沉淀,迅速变为灰绿色,最后变为红褐色。
高中化学无机推断框图题精选(附答案)

1.下图为某些物质之间的变化关系(未注明用量的物质间均按恰好充分反应处理)已知A的焰色反应呈黄色,常温下,甲为能使湿润的红色石蕊试纸变蓝的气体,乙为可燃性气体,甲、乙分子中质子数相等。
(1) A的化学式是;乙的化学式是。
(2) X是一种纯净物,X的化学式是;C中含有、。
(填化学式)(3)能否确定B为何种物质?如果能,写出B的化学式;如果不能,请说明理由。
2.甲、乙、丙为短周期元素形成的常见单质,A、B、C、D、E、F、G、X均为常见的化合物。
B、X的式量(分子量)相同,E的式量比D大16,在一定条件下各物质之间相互转化如下图所示:(1) X的电子式是,G的化学式是。
(2)上述物质中能与水发生反应(不考虑单纯的盐的水解)且反应中水既不是氧化剂也不是还原剂的物质的代号是。
(3)反应“D+丙”的化学方程式是。
(4)写出X与D在稀硫酸中反应的离子方程式。
3.甲、乙、丙三种常见的单质,X、Y、Z三种常见的化合物,它们在一定条件下的相互转化关系如下:请填写以下空白:(1)在X、Y、Z三种化合物中肯定含有乙、丙两种元素的化合物是。
(2)在X、Z两种化合物的正价元素的化合价中,是。
A.前者高B.后者高C.不一定原因是。
(3)当X为两种非金属元素组成的化合物时,写出X跟甲反应的化学方程式。
写出丙跟乙反应的化学方程式。
(4)当X为金属元素与非金属元素组成的化合物时,写出X跟甲反应的化学方程式。
写出丙跟乙反应的化学方程式。
4.有X、Y、Z三种单质,常温下X是固体,Y是液体,Z是气体。
它们之间的反应关系如下图所示:请填写下列空白:(1)据此推断X、Y、Z的化学式:X 、Y 、Z 。
(2) X是常见的单质,它是主族元素,还是副族元素,其理由是:。
(3)写出C+Y → A的离子方程式:。
5.根据以下反应关系图,回答下列问题:(1) A溶液所含溶质是:________________________;(2) A溶液跟B溶液反应的化学方程式是:_______________________________;(3) G转变为E的离子方程式是:__________________________________________。
高考化学压轴题之高无机综合推断(高考题型整理,突破提升)含答案

高考化学压轴题之高无机综合推断(高考题型整理,突破提升)含答案一、无机综合推断1.A、B、C、W均为中学常见的物质,它们之间有如图所示的转化关系(其他产物及反应条件已略去,反应可以在水溶液中进行)。
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系:(1)若A、B、C三种物质都含有一种金属元素,且B为两性物质,W俗称苛性钠。
①A、B、C三种物质中所含有的金属元素单质与W反应的化学方程式为_______________。
②A溶液一步转化为C溶液的反应离子方程式为________________。
(2)若X是一种黄绿色的气体,Y的饱和溶液滴入沸水中能生成红褐色胶体。
①检验溶液Z是否变质最灵敏的一种试剂是____________________(名称);②一定条件下W与水反应的化学方程式_______________________________。
(3)X常温下为气体化合物,Z是一种红棕色气体,X气体的检验方法____________________,X转化为Y的化学方程式为______________________;(4)X为一元强碱溶液,W是形成酸雨的主要气体。
①则Y到Z的离子方程式为________________________________________;②请画出向含0.01molX和0.01molY的溶液中逐滴加入0.1mol/L稀盐酸的体积和生成气体的物质的量的关系的图像___________。
【答案】2Al+2NaOH+2H2O =2NaAlO2 +H2 Al3-+ 4OH- =AlO2- + 2H2O 硫氰化钾溶液 3Fe + 4H2O(g) === Fe3O4 + 4H2使湿润的红色石蕊试纸变蓝(或遇蘸有浓盐酸的玻璃棒产生白烟)4NH3+5O24NO+6H2O SO32-+SO2+H2O=2HSO3-【解析】【分析】W为NaOH。
B为两性物质且含有一种金属元素,确定该金属元素为铝元素,因在溶液中产生了B,所以B为Al(OH)3。
高考化学与高无机综合推断有关的压轴题及详细答案

高考化学与高无机综合推断有关的压轴题及详细答案一、无机综合推断1.X、Y、Z三种主族元素,原子序数依次增大且原子序数小于10,它们的单质在常温下都是常见的无色气体,在适当条件下,三者之间可以两两发生反应生成分别是双原子、三原子和四原子的甲、乙、丙三种分子,且乙、丙分子中含有X元素的原子个数比为2∶3。
请回答下列问题:(1)元素X的名称是______,丙分子的电子式为______。
(2)若甲与Y单质在常温下混合就有明显现象,则甲的化学式为________。
丙在一定条件下转化为甲和乙的反应方程式为____________________________________________。
(3)化合物丁含X、Y、Z三种元素,丁是一种常见的强酸,将丁与丙按物质的量之比1∶1混合后所得物质戊的晶体结构中含有的化学键为________(选填序号)。
a.只含共价键 b.只含离子键 c.既含离子键,又含共价键【答案】氢 NO 4NH3+5O24NO+6H2O C【解析】【分析】由X、Y、Z三种主族元素,原子序数依次增大且原子序数小于10,它们的单质在常温下都是常见的无色气体可知,三种气体单质为氢气、氮气、氧气,X为H元素、Y为N元素、Z 为O元素,由在适当条件下,三者之间可以两两发生反应生成分别是双原子、三原子和四原子的甲、乙、丙三种分子,且乙、丙分子中含有X元素的原子个数比为2∶3可知,甲为NO、乙为H2O、丙为NH3。
【详解】(1)元素X为H元素,名称为氢;丙为共价化合物NH3,电子式为,故答案为氢;;(2)甲为无色气体NO,NO与氧气反应生成红棕色的二氧化氮;氨气与氧气发生催化氧化反应生成一氧化氮和水,反应的化学方程式为4NH3+5O2 4NO+6H2O,故答案为4NH3+5O24NO+6H2O;(3)由化合物丁是一种含H、O、N三种元素的强酸可知,丁为HNO3,HNO3与NH3按物质的量之比1:1混合反应生成NH4NO3,NH4NO3为离子化合物,含有离子键和共价键,故答案为C。
无机推断题含答案

二、无机推断题 标准答案 (1)极性(1分) (2)2Na 2O 2+2H 2O===4NaOH +O 2↑(2分) (3)NH 4HCO 3+2NaOH=====△Na 2CO 3+NH 3↑+2H 2O(2分) CO 2-3+H 2O HCO -3+OH -(2分)(4)2NH 3+6OH --6e -===N 2+6H 2O(2分) 减小(1分)(5) mol·L -1·min -1(2分) (2分) (6)ace(2分) 评分细那么 (1)按标准答案评分。
(2)不标“↑〞扣1分。
(3)少写条件或少写“↑〞均扣1分,把“〞写成“===〞不得分。
(4)写成最简形式不扣分。
(5)漏掉单位或写错扣1分,有效数字保存错不得分。
(6)对一个或两个得1分,有错不得分。
题型特点 无机推断题,集元素化合物知识、根本概念与根本理论知识于一体,考察面广,综合性强,思维容量大。
无机推断题层次清楚,区分度高。
由于此类题目具有较强的学科特色,考察知识点较多,是高考命题中一种重要的命题形式。
该题有四种命题类型:一是以阴、阳离子判断为中心的物质推断,二是以原子构造、元素周期律为中心的元素推断,三是以元素化合物知识为根底的无机框图推断,四是实验探究无机化合物成分类。
得分技巧 审题时要做到:迅速浏览全题―→找准突破口―→看准物质联系―→大胆假设认定―→全面进展分析―→最后验证确认。
答题时要细心:看准要求,标准书写。
类型一 以阴、阳离子判断为中心的物质推断1.(12分)饮水平安在人们生活中占有极为重要的地位,某研究小组提取三处被污染的水源进展了分析,给出了如下实验信息:其中一处被污染的水源含有A 、B 两种物质,一处含有C 、D 两种物质,一处含有E 物质,A 、B 、C 、D 、E 是五种常见化合物,都是由下表中的离子形成: 阳离子K + Na + Cu 2+ Al 3+ 阴离子 SO 2-4 HCO -3 NO -3 OH -①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;③进展焰色反响,只有B、C为紫色(透过蓝色钴玻璃片);④在各溶液中参加硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;⑤将B、D两溶液混合,未见沉淀或气体生成。
高三化学无机推断试题答案及解析

高三化学无机推断试题答案及解析1.A、J是日常生活中常见的两种金属,这两种金属和NaOH溶液组成原电池,A作负极;F常温下是气体,各物质有以下的转化关系(部分产物及条件略去)。
回答以下问题:(1)A的原子结构示意图为,M的化学式为。
(2)A与NaOH溶液反应的离子方程式为。
(3)写出②的化学方程式。
(4)含A元素的某盐X常做净水剂,X做焰色反应时,透过蓝色钴玻璃观察火焰呈紫色。
X的水溶液与NaHCO3溶液混合,反应的离子方程式为。
【答案】(1),FeS;(2)2Al + 2OH- + 6H2O=2[Al(OH)4]- + 3H2↑;(3)4NH3+5O24NO+6H2O;(4)Al3+ + 3HCO3-= Al(OH)3↓ + 3CO2↑。
【解析】根据题意知,A、J是日常生活中常见的两种金属,这两种金属和NaOH溶液组成原电池,A作负极,则A为铝;结合流程图知,C为偏铝酸钠,E为氢氧化铝,H为氧化铝,J为铁,M为硫化亚铁,D为氢气,F为氮气,G为氨气,I为一氧化氮,K为二氧化氮,L为硝酸。
(1)A为铝,原子结构示意图为,M为硫化亚铁,化学式为FeS;(2)铝与NaOH溶液反应生成四羟基合铝酸钠和氢气,离子方程式为2Al + 2OH- + 6H2O==2[Al(OH)4]- + 3H2↑;(3)反应②为氨的催化氧化,化学方程式4NH3+5O24NO+6H2O;(4)含A元素的某盐X常做净水剂,X做焰色反应时,透过蓝色钴玻璃观察火焰呈紫色。
X为明矾,其水溶液与NaHCO3溶液混合,反应的离子方程式为Al3+ + 3HCO3-="=" Al(OH)3↓ + 3CO2↑。
【考点】考查无机推断,涉及铝和氮元素单质及其化合物的性质及相互转化关系、化学方程式的书写。
2.A、B、C分别是元素甲、乙、丙的单质,它们都是常见的金属或非金属,D、E、F是常见的三种氧化物,且有如图所示转化关系,则下列说法不正确的是()A.D、E中一定都含有甲元素B.单质B肯定是氧化剂C.A、B、C中一定有一种是氧元素的单质D.若A是非金属,则B一定为金属【答案】B【解析】A是甲的单质,根据图示,E中必含甲元素,B是乙元素单质,与D反应生成A,该反应是置换反应,所以D中必含甲元素,A项正确;B项,D是氧化物,与B单质反应,一般B是还原剂,错误;C项,A与C单质反应生成氧化物E,所以必有一种是氧气,正确;D项,若A是非金属,则D与B的反应一般是类似于水与钠间的置换,即D项正确。
2020-2021高考化学高无机综合推断-经典压轴题及答案

2020-2021高考化学高无机综合推断-经典压轴题及答案一、无机综合推断1.某强酸性溶液X,含有Ba2+、Al3+、SiO32-、NH4+、Fe2+、Fe3+、CO32-、SO42-、NO3-中的一种或几种离子,取溶液进行连续实验,能实现如下转化:依据以上信息,回答下列问题:(1)上述离子中,溶液X中肯定含有的是:________________;不能肯定的是:_______________。
对不能确定是否存在的离子,可以另取X溶液于一支试管中,选择下列试剂中的一种加入X溶液中,根据现象就可判断,则该试剂是:_________。
(选填:①NaOH溶液,②酚酞试剂,③石蕊试剂,④pH试纸,⑤KSCN溶液,⑥KMnO4溶液)(2)气体F的电子式为:_______________,实验中,可以观察到反应②的现象是:__________________。
(3)写出步骤①所有发生反应的离子方程式________________________、___________________。
【答案】SO42-、Al3+、Fe2+、NH4+ Fe3+⑤气体由无色变成红棕色 Ba2++SO42-=BaSO4↓ 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O【解析】【详解】(1)在强酸性溶液中氢离子和碳酸根离子反应生成二氧化碳和水,硅酸根离子和氢离子反应生成硅酸沉淀,所以一定不会存在CO32-和SiO32-离子;加入过量硝酸钡生成沉淀,钡离子和硫酸根离子反应生成硫酸钡沉淀,说明一定含有SO42-,含有SO42-离子就一定不含Ba2+离子;气体A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+,一定不含NO3-离子;溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+;溶液H中溶于CO2气体,生成沉淀K,则K为Al (OH)3,L为NaOH和NaAlO2,说明溶液中含有Al3+;不能确定是否含有的离子Fe3+,检验用硫氰化钾溶液,取少量X溶液放在试管中,加入几滴KSCN,溶液变红色说明有Fe3+,反之无Fe3+;(2)溶液B中加入过量NaOH溶液,生成气体F:NH4++OH-=NH3↑+H2O,氨气电子式为;一氧化氮易被氧化为二氧化氮,则实验中,可以观察到反应②的现象是无色一氧化氮变为红棕色二氧化氮气体;(3)步骤①在强酸性溶液中加入过量硝酸钡,钡离子和硫酸根离子反应生成硫酸钡沉淀,Ba2++SO42-=BaSO4↓,二价铁离子具有还原性,硝酸具有氧化性,二价铁离子被硝酸氧化生成三价铁离子,硝酸被还原成一氧化氮,一氧化氮在空气中被氧化成红棕色的二氧化氮,离子反应方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学压题- 无机框图推断题题目主要来源于北京、浙江、江苏、湖南、湖北等地区最新模拟试题1.( 14分)中学化学中几种常见物质的转化关系如图所示(图中部分反应物或生成物及反应条件未列出)。
已知: A、B、C、 D是单质,其余是化合物。
其中 B、D是常见金属,且组成 B 的元素属于过渡元素。
又知 A在 C中点燃有苍白色火焰, M既可溶于盐酸又可溶于 NaOH溶液。
请回答下列问题:(1)W的电子式是__________ 。
(2)写出 N 的化学式,并任写一种 N的主要用途。
(3)写出下列反应的离子方程式:反应①,反应③ ___________________________________________________ ,K溶液和过量氨水反应____________________________________________ 。
1.(14 分)(1)(2 分)(2)FeCl3(2 分), N可用作催化剂、净水剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1 分)(3)2Cl -+2H2O 2OH - + H2↑+ Cl 2↑, Al 3+ + 3AlO 2-+6H2O === 4Al(OH)3↓,Al3+ + 3NH3·H2O === Al(OH)3↓+ 3NH4+(方程式各 3 分)2.(12 分) 27.( 14 分).A.B.C.D.E是中学化学常见单质,构成它们的元素的原子序数分别为α、b. c .d.е;且 3 (a+b) = 2 (a+c) = 3 (d-a);X、Y、Z、M、 N、W、H、K是常见化合物, X 是 B和 C的化合产物,它们之间有如下转化关系(图中反应物和产物中的 H2O已略去):(2)反应③的离子方程式为E 的氧化物与 D 在一定条件下反应的化学方程式为: 。
(3)固体 N 常温下即挥发, 183℃升华,几乎溶于所有的有机溶剂和 H 2O 中,据此判断N 为 型晶体(4)25℃时, PH =5 的 W 和 N 的水溶液中由 H 2O 电离出来的 H +离子浓度之比为2.(12 分) ⑴ ;三;Ⅲ A⑵ Al 3++3AlO 2-+6H 2O = 4Al (OH )3 Fe 2O 3+2Al2Fe + Al 2O 3 ( Fe 2O 3若写成 FeO 或 Fe 3O 4并配平也可以)⑶分子 ⑷ 1 ∶ 104 含有同种元素。
已知:(Ⅰ) A 为金属单质; B 为 红褐色固体; E 为密度最小的气 体; G 为浅绿色溶液。
(Ⅱ) D 为黄色溶液, 能与 硝酸银溶液反应生成不溶于稀硝 酸的白色沉淀。
(Ⅲ)D 能将某种氧化物氧 化为 F ,F 是含有三种元素的化合 物。
请回答下列问题:1)上述反应中属于置换反应的是(填序号) 。
G 的溶液中加入与 G 等物质的量的 Na 2O 2,恰好使3. (14分)、A 、B 、C 、D 、 E 、F 、G 七种物质间存在如图所示的转化关系,其中2)G 生成 B 有多种途径。
若在 周A 、B 、 D 、G 转化为B ,写出该反应的离子方程式:反应③(即 D 将某种氧化物氧化为 F )的离子方程式 3)D 的水溶液显酸性,请用离子方程式解释原因 4)实验室制取 C 的化学方程式为对气体 C 进行如下实验。
已知整个反应过程中,每消耗 0.1mol KI, 转移的电子数约为3.612 ×10 23 个。
请按照要求填空:3.(本题 14 分) 1) ②⑤( 2 分) ( 2) 4Fe 2++ 4Na 2O 2+ 6H 2O = 4Fe (OH )3↓+ O 2↑+ 8Na +( 2 分)2Fe 3++SO 2+2 H 2O =2Fe 2++SO 42-+4 H + (2 分 )3)Fe 3++3 H 2O Fe (OH ) 3+3 H +(2分)4)MnO 2 + 4 HCl (浓) Mn Cl 2+Cl2↑ +2 H 2O(2分)4.( 14分)短周期元素组成的单质 X 2、Y ,标准状况下 X 2的密度为3.17g ·L -1,;常温下, Y 为浅黄色固体。
Z 是一种化合物,焰色反应呈浅紫色(透过钴玻璃);0.1mol ·L -1 Z 的水 溶液 pH=13 。
X 2、Y 和 Z 之间有如下转化关系(其他无关物质已略去)2)已知 16g 单质 Y 完全燃烧放出 148kJ 热量。
写出热化学方程式: (3)已知 C 能与硫酸反应生成能使品红溶液褪色的气体①D 的化学式是: ;D 的水溶液 pH>7,原因是(用离子方程式表示) :;D 的水溶液中离子浓度大小顺序为② 将 20mL 0.5mol ·L -1 C 溶液逐滴加入到 20 mL 0.2mol ·L -1 KMnO 4溶液(硫酸酸化)中, 溶液恰好褪为无色。
写出反应的离子方程式:(4)石墨和铁做电极,用隔膜电解槽电解 A 的溶液,阳极产生 X 2 。
写出电解 A 溶液的离子方程式: 4.(14 分)1)写出单质(1)Cl 2+2OH-==Cl -+ClO-+H2O(2)S(s)+O2(g)==SO2(g);△ H=-296KJ/mol2- - - + 2- - - +(3)○1 K 2S 、 S 2-+H2O HS- +OH-, c(K +)>c(S2-)>c(OH-)>c(HS-)>c(H +)2- - + 2- 2+○2 5SO 32-+2MnO4-+6H+==5SO42-+2Mn2++3H2O(4)2Cl -+2H2O==Cl2↑+H2↑+2OH-(每空 2 分)5. (16 分)下列 16 种物质之间有如下转化关系,部分产物已省略:己知: (a) W 、P、N、X、F 是单质,其中 F 是金属单质,其它均是化合物。
(b)A是金黄色矿物。
M是浅绿色的晶体。
K与 Y均是 10 电子分子。
(c) B 与 C两种化合物均由同主族的两种短周期元素组成。
(d)W 元素的原子最外层电子数是次外层的两倍。
( e)反应②、③、④分别是工业制K、 D、 F 的重要反应。
反应⑤是实验室制 M 的重要反应。
请回答下列问题:(1)元素 F 在周期表中的位置是▲ 。
(2)写出 M的化学式▲ 。
要从 M的溶液中得到 M晶体,其操作方法是▲ 。
(3)下列说法正确的是▲①M 是离子晶体。
②稳定性: K<Y ③构成 X、P、W、N 的原子半径依次减小④K 气体易液化是由于液态 K 分子间存在氢键(4)仿照过氧化钠的电子式写出 A 的电子式▲ ,(5)写出实验室制 K 的化学方程式:▲(6)写出反应④的化学方程式▲(7)H 的酸性溶液在空气中很容易变质,写出其变质过程的离子方程式:▲ 。
(8 己知1 - 1F s + O 2(g)=FO(s) △H=-272.0KJ·mol-1223 - 12Al(s)+ O2(g)=Al2O3(s) △H=-1675.7KJ ·mol-12写出 Al 的单质和 FO反应的热化学方程式▲ 。
5.(16分)(各 2分)(1)第四周期第Ⅷ族(2)(NH4) 2SO4·FeSO4· 6H2O 蒸发浓缩、冷却结晶、抽滤(3) ①②④ (4) 略(5)2NH 4Cl+Ca(OH)2 CaCl2+2NH3 ↑+2H2O2+ + 3+(6)Fe 2O3+2CO 2Fe+3CO2 (7)4Fe 2++O2+4H+ =4 Fe3++2H2O(8)(8)3FeO(s) + 2Al(s)Al 2O3(s) + 3Fe (s)△H =-859.7KJ·mol-6.( 16 分)已知化合物 A 与 B、丙与丁的元素组成相同,且四种物质中都含有同一种元素。
A与 B在常温下均呈液态。
D与 F都为固体单质,且 D、 F 与甲的浓溶液在常温作用都无明显现象,加热时有大量气体产生。
(相关转化部分反应条件和生成物未标出)。
( I )A 的结构式, E 与 F 的反应是(填反应名称),在工业生产中此反应有什么用途?、。
(II )若反应①除生成甲外,还生成丙,回答(1)、( 2)小题:( 1)写出过量 D 与甲稀溶液反应的离子方程式:( 2)以 D、F 为电极, NaOH溶液为电解质溶液可以组成原电池,原电池正极的电极反应为:(III )若 A 与丙可以化合生成甲;甲与 D加热条件下可以生成三种化合物乙、丙、B,乙、丙、 B 常温下又可以反应生成甲和另一化合物 X。
回答( 2)、( 3)小题:( 3)写出下列方程式②:③:( 4)将含有 1.2molX 的水溶液调至中性,通入足量C充分反应,生成红褐色沉淀且溶液呈黄色,经过滤、洗涤、灼烧至恒重,称量所得固体的质量为。
6.(16 分)(I )H-O-O-H(2 分),铝热反应( 2分),焊接铁轨、冶炼金属( 2分);+ — 2+(II )( 1)3Fe+8H++2NO3—=3Fe2++2NO↑+4H2O( 2 分)(2)6H2O +6e - =3H2↑+6OH-(2分)(III )( 3)②: 2SO2+O2 2SO3( 2 分)③: 2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2↑+6H2O(2 分)(3)32g(2 分)7.(14 分) A、B、C、D、E均为中学化学的常见单质或化合物,它们之间的反应关系如图所示:(1)若 A 是短周期中原子半径最大的元素构成的单质,E既可溶于盐酸又可溶于NaOH溶液,E 溶于 NaOH溶液的离子方程式是;工业上冶炼 A 的化学反应方程式是。
2)若 C 是既含有极性键又含有非极性键的四原子分子,则实验室制取 C 的化学方程式 是 ;1 mol C 完全燃烧生成液态水时1300 kJ · mol -1,则 C 完全燃烧的热化学方程式是 。
A 与盐 B 的溶液 反应时只生成气体 C 、碳酸钙沉淀和水,则B 的化学式是 。
7.(14 分)电解(1)Al (OH ) 3 + OH-= AlO 2- + 2 H 2O 2 NaCl (熔融)2 Na + Cl( 3(2)CaC 2 + 2 H 2O → C 2H 2↑+ Ca (OH ) 2( 3 分);-12 C 2H 2(g ) +5 O 2(g ) = 4 CO 2(g ) + 2 H 2O (l ) ΔH = - 2600 kJ ·mol -1(3分);Ca (HCO 3) 2(2 分)8.(15 分) A —J 是中学化学中常见的几种物质,它们之间的转化关系如图所示。
已知常温下 A 为固体单质, B 为淡黄色粉末, F 合成, J 可用作杀菌消毒剂。
