紫甘薯花青素分析测定方法概述
微波辅助法提取紫甘薯中的原花青素及含量的测定

微波辅助法提取紫甘薯中的原花青素及含量的测定蔡吉清;李秀玲【摘要】研究了以紫甘薯为原料,利用微波辅助法提取原花青素时提取剂浓度、料液比、微波处理时间等因素对提取率的影响.结果表明,在此最佳实验条件下,即以盐酸的乙醇溶液为提取液,在乙醇的体积分数为50%,料液比(g:mL)为1:70,微波处理70 s,所得的原花青素浸提量为0.96 mg/g.【期刊名称】《浙江化工》【年(卷),期】2011(042)002【总页数】3页(P29-30,26)【关键词】紫甘薯;原花青素含量;微波辅助法【作者】蔡吉清;李秀玲【作者单位】浙江大学化学系,浙江,杭州,310058;浙江大学化学系,浙江,杭州,310058【正文语种】中文食用色素是用于食品工业,以改善色泽,促进食欲,提高商品价值的一类食品添加剂。
近年来,随着人们对人工合成色素危害性的认识,许可使用的人工合成色素种类趋于减少。
与合成色素相比,天然色素一般从植物组织中提取出来的,因而它比较安全,色泽浅淡。
植物食用天然色素分为脂溶性和非脂溶性两类,其中仅植物非脂溶性天然色素就达10余种。
紫甘薯中所含有的紫甘薯色素是一种天然食用非脂溶性红色素。
[1~3]许多天然色素本身就是人体需要的物质并兼有营养的效果,有的还有一定的药理作用。
国外研究表明,原花青素有强抗氧化能力,对心血管疾病疗效显著。
原花青素还具有预防高血压、防止动脉粥样硬化、抗血栓、抗菌、抗炎、抗肿瘤、抗突变,保护肾脏及皮肤保健及美容等功能,对糖尿病及视网膜病也有一定疗效,是一种颇具开发前景的保健品[4~5]。
微波提取具有设备简单、适用范围广、萃取效率高、重现性好、节省时间、节省试剂、污染小等特点。
而用微波辅助法提取的紫甘薯花青素作为一种天然食用色素,安全、无毒、无异味、色彩鲜艳、资源丰富,与其它同类色素相比性质较稳定,而且具有一定的营养和药理作用,在食品、饮料、化妆品、医药方面有着较大的应用潜力[5]。
本实验采取微波辅助法提取紫甘薯中的原花青素,并对其含量进行了测定。
紫薯中花青素的测定

可见分光光度法测定紫甘薯总花青素含量花青素的作用:花青素是一类在自然界广泛存在的水溶性天然色素,不但可作为食用色素,还具有多种保健和医药功能.紫甘薯色素具有清除自由基、抗氧化、抗突变、降血压,改善肝机能等多种生理功能,在食品、化妆品及医药等行业有着广阔的应用前景
花青素的结构式:
常见的花青素:
目前紫薯花青素的检测方法大都仅是定性分析,主要有色谱法和紫外可见分光光度法。
花青素的测定---以紫薯中花青素之一矢车菊素为标准品绘制标准曲线
一:材料与试剂:
1,材料:市面上买的紫薯
2,试剂:(按两人做一次计算)
仪器:
操作方法:
1.式样的处理:
紫薯干粉的处理(提前)→称取2g干粉→锥形瓶→加进100ml0.1mol柠檬酸水溶液→超声30min(待定) →取澄清滤液
2.操作步骤:
弱光下称取1.35g矢车菊样品→用0.1mol柠檬酸分次定容到25ml容量瓶→移取
5ml、2ml、0ml标准溶液→在波长518nm处测定吸光值→绘制标准曲线→计算→分析结果。
可见分光光度法测定紫甘薯总花青素含量

De e m i a i n o t lAn h c a i i si u p e S e o a o b t r n to fTo a t o y n d n P r l we tP t t y n Vi p c r p o o t y s S e t o h t me r
d i 1. 6  ̄i n17 — 0 X2 1.2 0 6 o: 03 9 .s.64 56 . 0 — 2 9 s 0 0
花青 素是 一类在 自然界 广 泛存 在 的水溶 性 天然
少 有游 离花 青素 ,大 多 以糖 苷化 和 酰基化 的形 式存 在, 统称 花 色苷 。 已知紫 色甘薯 花青 素 的主要 成分是 矢 车菊 素 和芍药 素及 极少 量 的天 竺葵 色 素 ,以糖苷 化 后 的酰基 化 衍生 物形 式 存在【 由于 酰 基化 有利 1 。 于 花青 素 的稳 定 ,紫 薯 中花 色苷 比同类 天 然色 素更
d tr ie y U V s s e t p o me y u ig c a i n a s n ad c mbn i h l c ig o a 0 . y ndn eem n d b V— i p c o h t t s y nd s t d r o ig w t te be h fN 2 3 C a i r o r n i a h a n S i
me h d i c l n c u a e w ih s o l e a l o g i e t e c l v t g a d pa t g o u p e s e o ao t o sf i a d a c r t , h c h u d b b et u d ut ai n ln i f r l we t t t. a e h i n n p p Ke r s u l w e oa o a t o y n d n ; n h c a is c a i i ; s s e t p oo t y wo d :p r e s e t tt ; n h e a i is a t o y n n ; y n dn Vi p cr h tmer p p o y
花青素在紫薯块根中的动态分布研究

花青素在紫薯块根中的动态分布研究摘要以渝紫7号为试验材料,研究了花青素在紫薯块根中的分布。
结果表明:紫薯花青素开始时集中在薯皮(周皮和韧皮部薄壁组织)和薯芯(木质部薄壁组织),在这两者之间即初生形成层出现白斑,随着薯龄的递增,花青素逐渐向薯块方向扩散并最终布满整个薯块,初生形成层处的白斑逐渐减少直至消失。
通过花青素在紫薯块根中的动态分布研究,使人们能了解花青素在紫薯块根中的主要集中部位,并且能更好地掌握花青素的最佳提取部位和提取时间,从而为以后进行紫薯花青素的研究提供理论依据。
关键词渝紫7号;紫薯;花青素;动态分布紫色甘薯(Ipomoea.batatas Lam.)因其块根内部呈深紫色而得名,俗称“黑红薯”,也有人称之为紫心甘薯或紫肉甘薯[1-2],属旋花科一年生草本植物,是近年来开发出的一类具优良特异性的甘薯新品种,因其肉质呈现紫红,外观诱人,并且具有营养、药理和保健多重作用,尤其是紫色甘薯富含硒元素,因此其抗癌能力优于普通甘薯,同时又因其含有大量的花青素,提取后可用于食品加工业,因此具有极佳的市场潜力[3],从而引起国内外的重视与广泛关注[4]。
紫色甘薯具有很强的抗氧化性,对保护肝功能和降低血清转氨酶具有积极的作用;紫色甘薯中的花青素和绿原酸还具有抑制诱癌物质的产生及减少基因突变的作用,尤其是其中的甲基花青素对癌变基因有很强的抑制作用,紫色甘薯对高血压等心血管疾病也有很好的预防作用。
从国内外的研究状况[4-8]可知,紫薯花青素动态分布方面的研究还处于起步阶段,而了解花青素在紫薯块根的动态分布对提取花青素有着至关重要的作用。
因此,该文对渝紫7号紫薯块根中花青素的动态变化进行探索,了解花青素的产生机制与环境条件变化之间的相互关系,旨在阐明紫薯种内变异与生态环境的关系,并为紫薯功能食品开发提供参考和依据。
1 材料与方法1.1 供试材料、试剂与器材供试材料为渝紫7号新鲜紫薯(来自西南大学甘薯研究中心);试剂有盐酸溶液(AR)、蒸馏水;器材有大烧杯、小烧杯、玻璃棒、小刀、直尺、手表、相机、水浴锅、吸水纸、量筒、容量瓶。
紫甘薯花青素的提取纯化、稳定性及抗氧化活性研究

采用HPLC-ESI-MS联用技术对紫甘薯花青素构成成分进行分析,结合紫甘 薯花青素化学成分的相关文献报道,得出紫甘薯(烟176)花青素主要构成成分为 3-O-(6-O-trans-caffeyl-2-O-β-glucopyranosyl-β-glucopyranoside)-5-O-β-glucoside peonidin。
(保密的学位论文在解密后应遵守此协议)
学位论文作者签名:
1
The study on the extraction and purification and stability and antioxidant activitiesof anthocyanins from purple sweet potato
Author: Yao Yu-rong Adviser: Prof. Zhang Wei Researcher.Mu Tai-hua Specialty: Processing and Storage of Agriculture Products
采用 AB-8 大孔树脂对花青素粗提液进行纯化。通过静态吸附、解吸和动态 吸附、解吸等试验来考察 AB-8 大孔树脂的纯化性能。结果显示:AB-8 大孔树脂 对紫甘薯花青素具有较强的吸附能力,其饱和吸附量为 0.06g/mL 湿树脂。pH 值 在 1.0~3.0 范围内对树脂吸附效果的影响差异不显著(p<0.05)。乙醇浓度对 解吸效果有影响,70%的乙醇水溶液解吸效果最好。
3
英文缩写 FDA FAO WHO SOD MDA Tris MPa µg mg mol mm g mL h s min cm Vc nm
紫甘薯花青素的提取纯化研究进展

紫甘薯花青素的提取纯化研究进展*乔景宇(徐州市第一中学 江苏 221000)摘要:紫甘薯花青素,属于黄酮类物质,是一种水溶性天然色素,较合成色素而言安全性更高,可食用,具有抗突变、抗氧化、抑制肿瘤细胞发生、缓解肝功能障碍等药用价值,是一种理想的天然抗氧化剂资源。
本文对国内外紫甘薯花青素的提取、纯化工艺进行综述,并对其进一步研究开发进行展望。
关键词:紫甘薯花青素;提取纯化;遗传改良;花青素生物合成;分子水平调控中图分类号:T 文献标识码:AResearch Progress on Extraction and Purification of Purple Sweet Potato AnthocyaninQiao Jingyu(No.1 Middle School of Xuzhou City, Jiangsu, 221000)Abstract :Purple sweet potato anthocyanin belongs to flavonoids and is a kind of water-soluble natural pigment. Compared with syntheticpigment, it is safer and edible. It has the medicinal values of anti - mutation, anti - oxidation, inhibiting the occurrence of tumor cells, relieving liver dysfunction and so on. It is an ideal natural antioxidant resource. In this paper, the extraction and purification technology of purple sweet potato anthocyanin at home and abroad are reviewed, and the further research and development of purple sweet potato anthocyanins are prospected.Key words :purple sweet potato anthocyanin ;extraction and purification ;genetic improvement ;anthocyanin biosynthesis ;molecular level regulation1.引言紫甘薯又称紫薯(旋花科番薯属),薯肉呈紫至深紫色, 除具有普通甘薯的营养成分外,富含花青素。
紫甘薯色素检测方法技术标准
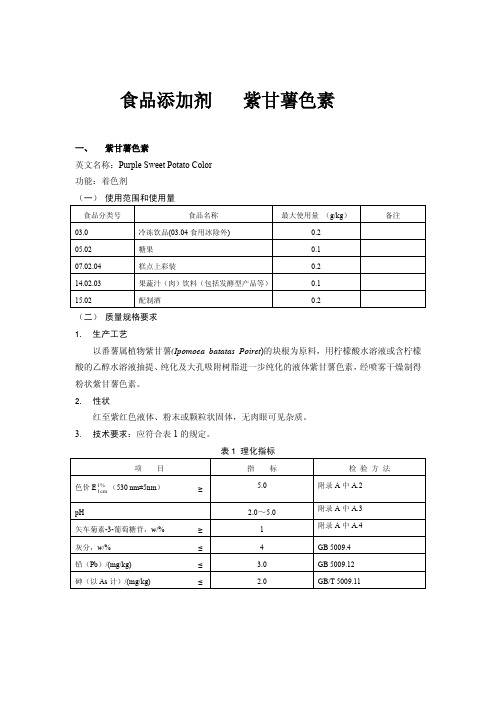
食品添加剂紫甘薯色素一、紫甘薯色素英文名称:Purple Sweet Potato Color功能:着色剂(一)使用范围和使用量(二)质量规格要求1.生产工艺以番薯属植物紫甘薯(Ipomoea batatas Poiret)的块根为原料,用柠檬酸水溶液或含柠檬酸的乙醇水溶液抽提、纯化及大孔吸附树脂进一步纯化的液体紫甘薯色素,经喷雾干燥制得粉状紫甘薯色素。
2.性状红至紫红色液体、粉末或颗粒状固体,无肉眼可见杂质。
3.技术要求:应符合表1的规定。
表1 理化指标附录 A检验方法A.1 一般规定除非另有说明,在分析中仅使用确认为分析纯的试剂和GB/T 6682中规定的三级水。
试验方法中所用标准滴定溶液、杂质测定用标准溶液、制剂及制品,在没有注明其他要求时,均按GB/T 601、GB/T 602和GB/T 603之规定制备。
A.2 色价的测定A.2.1 pH 3.0柠檬酸-磷酸氢二钠缓冲溶液配制A.2.1.1 0.2 mol/L 磷酸氢二钠溶液:精确称取磷酸氢二钠(Na2HPO4·2H2O)35.60 g,用蒸馏水定容至1000 mL。
A.2.1.2 0.1 mol/L 柠檬酸溶液:精确称取柠檬酸(C6H8O7·H2O)21.0140 g,用蒸馏水定容至1000 mL。
A.2.1.3 pH 3.0 柠檬酸-磷酸氢二钠缓冲溶液:取0.2 mol/L 磷酸氢二钠溶液4.11 mL与0.1 mol/L 柠檬酸溶液15.89 mL混合。
用pH计测pH值有误差时,应将pH值准确调整至3.00。
A.2.2 测定精确称取样品0.1 g~0.2 g,用pH 3.0 柠檬酸-磷酸氢二钠缓冲溶液稀释至100 mL(吸光度应控制在0.3~0.7之间),用1cm比色皿以缓冲溶液作空白,在530 nm±5 nm下测定吸光度。
A.2.3 结果计算(530±5) nm = A/mE%1cm1式中:A——吸光度;m——样品的质量,g;——色价,即在被测样品浓度为1 %、1 cm比色皿、在530 nm±5 nm 范围内的最大E%11cm吸收峰的吸光度。
紫甘薯中花青素的提取及含量的测定

紫甘薯中花青素的提取及含量的测定山东农业大学化学学院09级材化2班赵林静152********山东农业大学化学学院09级材化2班李新152********摘要用乙醇酸溶液从紫甘薯中提取花青素。
用PH示差法对提取液中花青素含量进行测定。
关键字:紫甘薯花青素PH示差法1前言:花青素又称花色素,是一种广泛存在于植物中的水溶性天然色素。
属黄酮类化合物,多以糖苷的形式存在,也称花色苷。
花色苷是一种以黄酮核为基础的一类糖苷,天然花色苷配糖体的基本结构为3、5、7-三羟基-2-苯基并呋喃。
最早且最丰富的花青素的花青素是从后葡萄渣中提取的葡萄皮红,花青素作为一种天然食用色素,安全,无毒,资源丰富,而且具有一定的营养和药用价值,在视屏、化妆、医药等方面有着巨大的应用潜力。
有实验证明,花青素是迄今为止所发展的最强效的自由基清除剂。
目前对花青素的定量没有较好的方法,常用的方法是以色价或吸光度表示其相对含量,也有用花青素纯品配置不同浓度梯度制作标准曲线测定色素的含量但由于花青素的标准品很不稳定,限制了这种方法的使用。
本实验用PH示差法对紫甘薯中花青素的提取液中花青素的含量进行测定。
2 实验目的2.1掌握花青素的提取方法及其PH示差法测量花青素含量的原理2.2熟练掌握分离提纯操作方法步骤。
3 实验原理紫甘薯中含有花青素,用乙醇的酸溶液作为提取液在离心机的作用下即可得到粗的花青素提取液。
PH示差法的原理为花青素的色调和色度随PH值的不同而发生改变。
PH为1.0时,花青素以红色的2-苯基并呋喃的形式存在。
结合朗伯比尔定律可得出在两个不同PH值下,花青素溶液的吸光度差值与花青素含量成正比。
4实验仪器及试剂仪器:电子天平;钥匙;精密PH试纸;PH计;表面皿、玻璃棒;烧杯;干燥的带塞子的锥形瓶250ml(4支);100ml容量瓶(4支);胶头滴管;500ml试剂瓶(3支);高速离心机、离心管(6支);分光光度计;10ml小量筒(3支);摇床;烧杯3支试剂:粉末状紫甘薯30g(自备);分析纯的乙醇试剂500 ml 氯化钾20g 醋酸钠30g 去离子水1000ml 分析纯的盐酸50ml5 实验步骤5.1乙醇的酸溶液按85:15的比例将分析纯的乙醇溶液与去离子水混合,再用浓盐酸调节PH至1.0左右。
甘薯茎叶中花青素的定位及含量测定

类型 食用紫薯 食用紫薯 食用紫薯 食用紫薯 食用紫薯 食用紫薯 食用紫薯 食用淀粉 胡萝卜素 高胡萝卜素
亲本组合 日紫 13 开放授粉 糊薯 1 号 × 广薯 104 徐薯 18 × 徐薯 27 烟紫薯 176 放任授粉 浙紫薯 3 号 × 浙薯 13 龙薯 14 号开放授粉 宁紫薯 1 号开放授粉 徐 P616-23 放任授粉 徐薯 55-2 × 红东 渝 06-2-9 × 渝 04-3-218
1 2
College of Life Science, Jiangsu Normal University, Xuzhou Jiangsu School of Electronic Information Engineering, Soochow University, Suzhou Jiangsu 3 Xuzhou Institute of Agricultural Science, Xuhuai District, Xuzhou Jiangsu Received: Feb. 27 , 2017; accepted: Mar. 17 , 2017; published: Mar. 20 , 2017
Table 1. Overview of tested sweetpotato 表 1. 供试甘薯材料概况
品种名称 徐紫薯 3 号 商徐 Z30-1 秦紫薯 2 号 冀紫 7-9 烟紫薯 10310 济 08365 漯紫薯 3 号 阜薯 0713-6 广紫薯 9 号 泉薯 9-6 金薯 13 号
*
类型* 食用紫薯 高花青素 食用紫薯 食用紫薯 食用紫薯 食用紫薯 食用紫薯 食用紫薯 高花青素 食用紫薯 食用紫薯
马小磊 等
收稿日期:2017年2月27日;录用日期:2017年3月17日;发布日期:2017年3月20日
高效液相色谱法分析不同品种紫甘薯中花青素组分及其含量

紫甘薯是甘薯特有品种类型,它不仅营养丰富,而且还富含具有显著生理功能作用的花青素类物质。
花青素,又称花色素,是自然界一类广泛存在于植物中的水溶性天然色素,属多酚类黄酮化合物[1]。
花青素的基本结构单元是2-苯基苯并吡喃型阳离子,即花色基元。
现已知的花青素有20多种,主要存在于植物中的有:天竺葵色素(Pelargonidin)、矢车菊色素或芙蓉花色素(Cyanidin)、翠雀素或飞燕草色素(Delphindin)、甲基花青素或芍药色素(Peonidin)、牵牛花色素(Petunidin)及锦葵色素(Malvidin)。
它具有抗氧化性[2],清除自由基[3],抗突变及抗肿瘤[4],减轻肝机能障碍[5,6],预防心血管疾病和Ⅱ型糖尿病[7]等功能。
高效液相色谱法分析不同品种紫甘薯中花青素组分及其含量*刘超,王征,李鑫,贺炜(湖南农业大学生物科学技术学院,长沙410128)摘要:利用高效液相色谱法分析不同品种紫甘薯中花青素组分及其含量。
结果表明,除川山紫不含C、E、F三种组分外,其它品种紫甘薯均含十种花青素组分;在各个品种紫甘薯中,紫A4,浙紫及京薯6号花青素产率相对较高,川山紫和鄂紫花青素产率较低,紫A1居中。
花青素总含量中,E、F、G、H、I、J六个组分的含量占89%以上,对花青素总含量起主导作用。
关键词:紫甘薯;花青素;高效液相色谱*项目资助:湖南省教育厅青年基金(07B035)和湖南农业大学稳定人才基金(05WD11)资助课题。
作者简介:刘超(1982~),男,湖南长沙人,在校硕士研究生,研究方向为天然产物开发与应用。
通讯作者:王征中国食物与营养Food and Nutrition in ChinaNo.8,20082008年第8期法进行油脂氧化的评价是不全面和不可靠的。
因此,常常采用多种方法检测、分析,从不同的角度进行油脂氧化程度的评价。
◇参考文献[1]姚妙爱.油脂的饲用价值及其氧化酸败的防止措施.粮食加工,2004,1: 68-71.[2]王宪青,余善鸣,刘妍妍.油脂的氧化稳定性与抗氧化剂.肉类研究,2003,3:18-21.[3]中华人民共和国国家标准,GB2716-88,GB9848-88,GB9849-88,GB9850—88,GB8937-88.[4]刘一军,俞晔.进口油脂游离脂肪酸产生及影响测定因素分析.粮食与油脂,2001,12:43-415.[5]孙丽芹,董新伟,刘玉鹏.脂类自动氧化机理.中国油脂,1998,23(5):56-57.[6]谢守华.油脂的自动氧化和氧化稳定性及检测方法.四川粮油科技,1998,4:53-55.[7]周华龙,等.不饱和油脂氧化机理的研究与技术开发(II).中国皮革,2003,32(13):4-8.[8]韩玉莲.油脂氧化常用检测方法及其评价.中国食品卫生杂志,1994,6(1):57-60.[9]Isbell TA.Oxidatie stability index of vegetable oilsin binary mixture with meadow foamoil.Industrialcrops and products,1999,9:115-123.[10]王新芳,朱沛华,孙同山,等.差示扫描量热法测定食用油脂的热氧化稳定性及氧化寿命.化学分析与计量,2001,10(4):17-19.[11]李久盛,王大璞,杜上鉴.油脂氧化安定性几种分析方法的比较.分析测试学报,1999,18(5):24-27.目前对Ⅱ型糖尿病的治疗研究也引起了世界各国的广泛关注。
微波消解_可见分光光度法测定紫甘薯中花青素_陈长应

2016年2月第37卷第4期微波消解-可见分光光度法测定紫甘薯中花青素陈长应(江苏省徐州医药高等职业学校科研处,江苏徐州221116)摘要:讨论紫甘薯中花青素的微波辅助提取及可见分光光度法定量检测方法。
结果表明:在520nm 下测定样品中花青素的吸光度,相对标准偏差为5.26%(n=6),加标平均回收率为97.8%,最低检测浓度为0.835μg/mL 。
该方法简便准确,可用于紫甘薯中花青素含量的测定。
关键词:紫甘薯;花青素;微波消解;可见分光光度法Determination of Anthocyanins in Purple Sweet Potato by Microwave Digestion and VisibleSpectrophotometric CHEN Chang-ying(Scientific Research Department ,Xuzhou High Medical Vocational School ,Xuzhou 221116,Jiangsu ,China )Abstract :This article discuses the microwave-assisted extraction of anthocyanin from purple sweet potato and the way to quantitatively detect anthocyanin under visible spectrophotometer measure system.The result demonstrates that the determination of absrbance of anthocyanins in the sample at the 520nm ,the relative standard deviation is 5.26%(n=6),average recovery at the spiked level is 97.8%,the minimum detectable concentration of anthocyanin is 0.835μg /mL.The present invention provides a quick easy way to quantitatively detect anthocyanin in purple sweet potatoes.Key words :purple sweet potato ;anthocyanins ;microwave digestion ;visible spectrophotometric食品研究与开发F ood Research And DevelopmentDOI :10.3969/j.issn.1005-6521.2016.04.039作者简介:陈长应(1965—),男(汉),副教授,硕士,从事化学教学工作。
夏小伟-紫甘薯红色素提取、纯化实验设计报告

好埠孝配食品与生物工程学院食品科学研究训练报告题目:紫甘薯红色素的制备指导教师孙晓侠班级13级食品工程本3班姓名夏小伟学号51306023026紫甘薯红色素的提取、纯化研究一.课题的目的及意义食用色素不仅影响食品的品质,而且与人类的营养和健康密切相关。
食用色素按来源分为天然和合成色素2大类。
随着现代科学的发展,人们发现合成色素对人体有不同程度的毒性甚至致癌性,因此各国对允许使用的合成色素的种类及用量要求越来越严格。
与合成色素相比,天然食用色素不仅种类繁多,色泽自然,而且安全可靠,无毒副作用,许多品种还具有药理功能。
因此,从天然产物中提取和分离各种食用天然色素替代人工合成色素已成为食品科学领域研究的热点之一。
我国是世界上最大的甘薯生产国,紫甘薯品质独特,抗病、抗旱涝性强,产量高,易贮存,价格低廉。
最主要的是其含有丰富的天然色素,紫甘薯色素具有抗氧化、抗突变、预防心脑血管疾病、保护肝脏、抑制肿瘤细胞发生等多种生理功能。
而且,紫甘薯色素属于对光、热都比较稳定的水溶性色素,对金属离子的耐受性明显强于其他天然色素,同时还具有较强的抗还原性,在食品中较稳定,可以广泛用作食品着色剂,在加工和贮藏过程中有很大的优势。
二.实验方法紫甘薯红色素的提取:称取适量的紫甘薯一加入提取剂(盐酸)—取上清液一吸附、洗脱一色素粗提液一旋转蒸发浓缩一冷冻干燥一色素粗提物。
选取提取液浓度,提取时间,提取温度,料液比进行单因素及正交实验。
三.实验材料紫甘薯、盐酸、X-5 大孔树脂、S-8 大孔树脂、95%的乙醇、旋转蒸发器、分光光度计四.实施方案和技术路线1. 最大吸收波长的确定根据检索资料知最大吸收波长为528nm 。
(李新华, 林琳, 鄂巍. 紫甘薯红色素提取技术的研究[J]. 沈阳农业大学学报, 2007, 38(4):556-559. )2. 最佳提取盐酸浓度的确定称取 2.0g 紫甘薯,分成五组,分别在0.1%、0.2%、0.3%、0.4%、0.5%的盐酸浓度下浸提1h,在波长528nm下测吸光值,得到最佳盐酸溶液浓度。
速煮紫薯中花青素的测定方法研究

管架 , 容量瓶 等 。
1 2 材 料 与 试 剂 .
紫薯 , 市售 , 产地 为 成 都 , 经测 定 鲜 紫薯 的水 分 为 6. 8 ; 5 1 速煮紫 薯 的制 备 : 紫薯 经 清洗 、 皮 、 鲜 削 切 丁 、 色 处理 后 ,0 护 6 ℃热 风 干燥 , 经测 定 水分 约 为 8 ;. 6g L盐 酸一 化 钾 缓 冲液 的配 制 : . 6g 1 8 / 氯 1 8 KC 溶 于 9 0ml 馏 水 中 , 浓 盐 酸 调 p 值 至 1 8 蒸 用 H
粗 油 深 加 工 及 畏 品
2
, №
e
工 搏铷 饲 科
CE AL FEE ND C E AL& FEED I USTR RE NDUSTR Y 、 — Y -
速 煮 紫薯 中花 青 素 的测 定 方 法研 究
莫 丽 春 , 馨 , 里 , 凡骏 卢 曾 曾
的配制 :4 4 5 . 3g结 晶 乙酸钠 溶 于 9 0ml 馏水 中 , 6 蒸 用 浓盐 酸调 p 值 至4 5 定容 10 0ml盐 酸一 H ., 0 ; 乙醇 溶 液 的配 制 : 体 积 分 数 9 乙 醇 和 5 . 9g L盐 取 5 4 6 / 酸, 按体 积 比 8 1 5: 5混 合 ; 坏血 酸 、 化 镁 , 为 抗 氯 均 分 析纯 。
加 工后 , 常温 的静置浸 提对 花青素 的提取 率并不 高 。 因此 , 文优化 速煮 紫薯 中花青 素 的提取 工艺 , 照 本 参 该 方法 测定花 青素 的 含量 , 算 产 品 中花 青 素 的保 计
留率 。 1 材 料 与 方 法
1 1 仪 器 与 设 备 .
益气 、 润肺 、 养颜 之功 效 , 日本被 誉为 “ 在 太空 保健食 品”2。紫薯 约含 6 的水 分 , 易 保 藏 。速 煮 紫 l ] 5 不
万景 摘要

紫色甘薯花青素具有很强的抗氧化性,在食品和医药上都有很重要的应用。
为了解紫色甘薯中花青素含量,本实验选择以酸化乙醇为缓冲液,在pH为2的环境下,采用色价法对紫薯中花青素进行测定。
实验结果表明:所选取的三种紫薯品种中花青素含量各有不同,渝紫263的花青素含量品均值为:0.91×10-2,南紫薯008的花青素含量品均值为:0.36×10-2,广紫薯1号的花青素含量品均值为:0.62×10-2。
Purple sweet potato anthocyanins has very strong antioxidant ability, it has very important applications in food and pharmaceutical. In order to understand the content of anthocyanin of purple sweet potato, this experiment chooses to acidified ethanol as buffer solution, in the condition of pH 2 , the anthocyanins in purple sweet potato were determined by colorimetry method. The experimental results show that: the three kinds of Purple Sweet Potato Anthocyanin Content in different varieties, Chongqing purple 263 anthocyanin content goods mean: 0.91 ×10-2, south Purple Sweet Potato 008 Anthocyanin content was : 0.36 ×10-2, Guang purple potato number 1 anthocyanin content goods mean: 0.62 x 10-2.。
紫甘薯中花青素提取工艺及测定方法研究

如 p . H 6 0的最大吸 收峰 移 到 了 5 0n 而 p . 6 m, H7 0
称取一定 量的紫 甘薯粉末 , 加入 3% 酸溶液 , 置
于安装好 的微 波萃 取 仪 中进行 萃 取 , 却 后进 行 下 冷
9 0年代 国 内外 学者 就 开 始 了对 紫 甘 薯 色 素 的
常规 提取 、 纯化 和稳定 性 的研 究 , 是 常规提取 通常 但 存 在 时间 长 、 动强 度 大 、 料 预处 理 能 耗 大 、 劳 原 热敏
性 组分 易破 坏等 缺点 . 波 作 为一 种 新 兴 的应 用 微 技术 , 近年在 植物 化学领 域得 到广 泛应用 .
厂 ) F 0高速 万 能 粉 碎 机 ( 津 市 泰 斯 特仪 器 有 ; W8 天
限公 司 ) .
无 水 乙醇 、 氯化 钠 、 化 钾 、 酸 钠 、 酸 , 酸 氯 醋 醋 盐 ( R, A. 国药 集 团 )
收稿 日期 : 1 0 2 2 0— 8— 5 0 修 回 日期 :0 0—1 —1 21 0 0
0 H
青素 的定 量测定 提供 参考依 据 .
表 1 自然 界 常见 六 种 花青 素 的 具体 结构 信 息
1 材 料 与 方 法
1 1 仪 器 与 试 剂 .
பைடு நூலகம்
微 波萃 取仪 ( D 6, 海 新 仪 ) p 计 ( H M S一 上 ;H pS
一
3 上海 雷磁 ) 分光 光度 计 ( 2 S 上 海光 谱仪 器 C, ; 72 ,
作者简介 : 陈新( 7一 )女, 16 9 , 江西南昌人, 硕士, 南京晓庄学院生物化工与环境工程学院教师, 研究方向: 有机分析及天然产物.
测定紫甘薯花青素含量(pdfX页)

文章编号:1001-4829(2012)01-0123-05收稿日期:2011-06-20基金项目:四川省地方标准“紫甘薯中花青素的测定”作者简介:毛建霏(1983-),男,硕士学位,主要研究方向液相色谱分析,*为通讯作者。
高效液相色谱法测定紫甘薯花青素含量毛建霏,周虹,雷绍荣*,郭灵安,欧阳华学,代晓航(四川省农业科学院分析测试中心,农业部食品质量监督检验测试中心,四川成都610066)摘要:本文建立了紫甘薯中花青素的高效液相色谱-紫外定量检测方法。
使用盐酸水溶液超声提取紫甘薯花色苷,沸水浴将多种花色苷水解为花青素单体。
采用高效液相色谱-紫外可见检测器对紫甘薯中主要花青素矢车菊和芍药素进行定量检测。
结果表明:矢车菊素线性范围0.0454 90.8μg /mL ,仪器定量限26.7ng /mL ,仪器检出限8.0ng /mL ,方法检出限0.80mg /kg ,日内RSD 1.8%,回收率97.8% 100.7%;芍药素线性范围0.0420 80.4μg /mL ,仪器定量限24.7ng /mL ,仪器检出限7.4ng /mL ,方法检出限0.74mg /kg ,日内RSD 2.4%回收率93.7% 95.5%。
该方法便捷准确,可将紫甘薯及其他作物中复杂花色苷水解为花青素单体进行定量测定。
关键词:高效液相色谱;紫甘薯;花色苷;花青素;矢车菊;芍药素;提取;水解中图分类号:S531文献标识码:ADetection of Anthocyanins Content in Purple Sweet Potatoby High Performance Liquid ChromatographicMAO Jian-fei ,ZHOU Hong ,LEI Shao-rong *,GUO Ling-an ,OUYANG Hua-xue ,DAI Xiao-hang(Analysis and Testing Center of Sichuan Academy of Agricultural Sciences ,Food Quality Inspection and Supervision Center of Agricultural Ministry ,Sichuan Chengdu 610066,China )Abstract :In this paper ,a high performance liquid chromatographic method was estabolished for the quantification of anthocyanins in purple sweet potato.After extracted under the ultrasonic irradiation in HCl aqueous solution ,the anthocyanins were directly hydrolyzed into major anthocyanidins ,of which cyanidin and peonidin were quantified by HPLC-UV /VIS.The result showed that Cyanidin had excellent linear rela-tionship in the studied range of 0.0454-90.8μg /mL ,with the instrument quantification and detection limits of 26.7and 8.0ng /mL ,the recovery rate of 97.8%-100.7%,the method detection limit of 0.80mg /kg and intra day RSD of 1.8%.Peonidin indicated excellent linear relationship in the studied range of 0.0420-80.4μg /mL ,with the instrument quantification and detection limits of 24.7and 7.4ng /mL ,the recovery rate of 93.7%-95.5%,the method detection limit of 0.74mg /kg ,and intra day RSD of 2.4%.The method was feasi-ble and accurate ,thus it was able to routinely determine the anthocyanidins hydrolyzed from various anthocyanins in purple sweet potato and other plants.Key words :HPLC ;Purple sweet potato ;Anthocyanins ;Anthocyanidins ;Cyanidin ;Peonidin ;Extraction ;Hydrolysis花青素是一类自然界广泛存在的水溶性天然色素,多以糖苷化和酰基化的形式存在,称为花色苷,已鉴定出上千种[1 2]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
紫甘薯花青素分析测定方法概述李乾坤;韦璐阳;梁立娟;邓友展【摘要】紫甘薯花青素具有抗氧化、抗突变、预防心脑血管疾病、抑制肿瘤细胞生长等生理功能,因此,紫甘薯花青素的分析测定成了品种选育、原材料质量控制及产品评价的必要手段.文章阐述了紫甘薯花青素的性质、分析方法,重点对样品的前处理、仪器手段进行综述.【期刊名称】《农业研究与应用》【年(卷),期】2013(000)006【总页数】5页(P47-51)【关键词】紫甘薯;花青素;分析;测定【作者】李乾坤;韦璐阳;梁立娟;邓友展【作者单位】广西壮族自治区亚热带作物研究所,南宁 530001;广西壮族自治区亚热带作物研究所,南宁 530001;广西壮族自治区亚热带作物研究所,南宁 530001;广西壮族自治区亚热带作物研究所,南宁 530001【正文语种】中文花青素类物质包括花青素、花色苷、原花青素,是一类结构相似的化合物,三者在结构上存在显著的差异,但也存在一定的联系。
花青素(anthocyanidins)又称花色素,是构成自然界花草、果实颜色的一类水溶性天然色素,常见的有18种。
花色苷(anthocyanins)又称花青素苷,是一类以花青素为配基,与一个或多个葡萄糖、半乳糖、鼠李糖、阿拉伯糖等分子通过糖苷键形成的化合物,即是以花色素为配基的糖苷类化合物。
而原花青素(proanthocyanidins)又称前花青素、原花色素,是自然界中广泛存在的聚多酚类物质,主要由儿茶素的单体、二聚体、三聚体等组合而成[1]。
是以花青素为单体的聚合体的统称。
紫甘薯富含花青素类色素,紫甘薯花青素的主要成分是矢车菊素和芍药素及少量的天竺葵素,以糖苷化后的酰基化衍生物形式存在[2-3]。
也就是说紫甘薯花青素主要为花色苷类型及少量的花青素单体。
研究表明,紫甘薯花青素具有抗氧化、抗突变、预防心脑血管疾病、抑制肿瘤细胞生长等生理功能[4-5],具有广泛的应用前景。
测定紫甘薯及制品中的花青素成了品种选育、原材料质量控制及产品评价的必要手段。
文章对紫薯及制品中花青素的测定分析进行综述,为合理评价甘薯原料及产品提供参考。
1 紫甘薯花青素的理化性质甘薯中的花青素属于类黄酮类化合物,具有很强的抗氧化活性,易溶于水、甲醇等,不溶于丙酮、乙酸乙酯、菜油、乙醚和石油醚等有机溶剂[6]。
紫甘薯花青素溶液颜色会随着pH值的变化而变化,酸性条件下呈稳定的红色,在可见光区530 nm处可出现特征吸收峰,随着pH值的升高,花色苷由红色的黄钅羊盐阳离子向无色的醇型假碱变化[7],高pH值时,花色苷向着深蓝色转变。
有研究表明紫甘薯色素在pH3时热稳定性、光稳定性均较高,98℃条件下热降解的半衰期为4.6 h,光照条件下半衰期为6.5 d[8]。
常用食品添加剂及大多数金属离子对其影响较小,Fe3+对色素具有破坏作用,Al3+和Zn2+对紫甘薯色素具有护色作用,NaCl可以提高紫甘薯色素溶液的吸光强度[9-11]。
总之,由于具有咖啡酸、阿魏酸或对羟基苯甲酸构成的酰基及配糖基,紫薯花色苷具有比一般花色苷较高的稳定性[5]。
2 样品处理方式紫甘薯除了用于鲜食,还可加工成块、丁、粉等加工原料,还被开发成饮料或用于酿酒和醋,这些样品的差异,在进行花青素含量测定时,所要进行的前处理方式会有差异。
甘薯活体细胞中存在能够分解花青素的酶类物质,它们具有可溶于水、不耐酸、不耐加热、能够被高浓度乙醇钝化的特点[12]。
有研究指出这些酶类会造成花色苷降解及脱酰作用而分解,其中多酚氧化酶和β-葡萄糖苷酶是最主要的酶[13]。
研究者在用紫薯研制开发成饮料时还发现采用pH3.0的柠檬酸酸化无法抑制β-葡萄糖苷酶的活性,导致饮料中酰化花色苷的含量减少,乳酸对于β-葡萄糖苷酶的抑制效果要好些,不过产品风味不如加柠檬酸的效果[14]。
基于这些活性物质的存在,在对新鲜样品进行处理时,提取过程中应先钝化这些酶(如煮沸处理、酸化或乙醇处理),还要避免花青素与鲜薯汁混合。
已发表的研究方法中,大多使用酸化溶液(有时加一定比列的乙醇或甲醇)进行提取[15-25]。
不同的提取方法会影响紫甘薯花青素的提取效率及稳定性,进而影响含量的测定。
刘桂玲[17]在试验中发现1%盐酸溶液作提取液比柠檬酸-磷酸氢二钠缓冲液更有利于保持紫甘薯花青素的稳定性,同时发现经过高温烘烤后的甘薯干粉花青素的含量比鲜薯降低了16.30%~33.86%不等,说明紫甘薯花青素经高温处理可引起一定程度的降解。
陈香颖等[18]的研究结果也验证了这一点。
他们将样品分别于30、40、50、60、40→60(即先在40℃下烘10 h后转60℃)、70、80℃下烘干(不同温度下的烘干时间不同,约48 h)成干粉后进行含量测定。
与鲜样比较,试验的8个紫甘薯品种中,除万紫56和1028-18外,其余6份材料在烘干温度为30℃时测得花青素含量最高,与鲜样相当。
而万紫56和1028-18测得最高含量为60℃、70℃烘干的干粉。
在40℃~60℃烘干温度时,干粉的花青素含量降低,且供试紫色甘薯干粉花青素含量品种间的差异变小,材料之间难以进行比较和鉴别。
而在烘干温度为60℃之后花青素含量测定值出现了回升的趋势,于60℃~80℃烘干时含量维持在一个较高的稳定水平。
因此,鲜样测定值更适于紫色甘薯品种间进行比较鉴别,如受条件所制,可于60℃~80℃烘干后再进行比较。
紫薯干样中花青素的提取方式与鲜样类似,大多使用乙醇酸化溶剂提取。
但溶剂提取具有提取不完全且耗时长的缺点,因此相继有学者在酸醇溶剂提取的基础上,附加采用微波、超声波、冻结-溶解细胞破壁法甚至溶剂加速萃取法(ASE)等使得紫甘薯色素的提取效率提高,具有很好的应用前景[24-28]。
液体样品的处理相对简单些,直接以酸化醇溶液稀释即可。
样品在进行仪器分析之前,会根据仪器要求或实验目的进行过滤,甚至纯化分离,目前业内大多使用AB-8大孔树脂进行纯化[29]。
3 仪器分析方法紫甘薯花青素的检测方法主要有紫外-可见光谱法、液相色谱法及液相色谱-质谱联用法,分别给予论述。
3.1 紫外-可见光谱法紫外-可见光谱法主要基于官能团对光的吸收,依据朗伯比尔定律进行定量,同时还可借助吸收光谱对化合物进行定性鉴别,具有操作简单、仪器设备低廉等优点。
紫甘薯花青素在酸性条件下呈现稳定的红色,随着pH的变化结构在无色假碱、半缩醛及查尔酮形式之间变化,因而呈现出不同的颜色变化。
根据不同pH条件下花青素结构不同,可见光谱发生变化来测定花青素色素含量,即为pH示差法。
目前测定紫甘薯花青素的研究方式大多为该法[13,15-18],利用花青素的光吸收特性和多羟基特性,定量分析方法主要以经验系数法测定花青素相对量或以单一化合物定量分析花青素总量。
花青素物质是多羟基的酚类物质,在弱酸条件下与亚硫酸盐反应后,亚硫酸根离子在花青素核的C-4位与花青素核生成无色化合物后[30],花青素核在可见光区的特征吸收消失,而紫外区的吸收基本不变,利用该特性,可以用亚硫酸盐漂白法进行花青素含量的测定。
涂宗财等[21]以苋菜红作为标准品,利用亚硫酸盐的漂白作用,在527 nm下对花色苷进行了分析,同时考察了pH、亚硫酸盐用量对测定结果的影响。
毛建霏等[25]也根据该原理,以矢车菊素为对照品,使用柠檬酸水溶液超声提取样品,结合亚硫酸钠漂白,采用可见分光光度法建立了一种紫薯总花青素含量的定量检测方法。
该法方便准确,且成本较低,但因紫甘薯中花青素糖苷化、酰化和辅色剂、金属离子等的影响未明。
同时亚硫酸钠漂白选择性不好,测得结果可能会比实际偏高。
3.2 液相色谱法高效液相色谱法(HPLC)具有高分离度及高灵敏度的特点,该法在紫甘薯花青素分析方面的运用主要在于分离和成分分析,同时用于比较不同甘薯品种中花青素的含量和组成。
国内较早有陆国权[31]采用高效液相色谱法分析了玫瑰薯和徐薯18杂交后代中筛选出的紫心品系鲜薯中花青素的组分。
鉴定出该品种甘薯含有12个花色苷组分,其中含量较大的4个组分占总花青素含量的80%以上。
刘超等[20]以矢车菊素为对照品,C18柱分离梯度洗脱,液相色谱法分析了紫甘薯中的10种花青素并以归一化法进行了定量分析。
由于紫甘薯色素成苷方式和酰基化的多样性,目前报道的紫甘薯花色苷已超过20种,要想获得构成组分的准确含量,必须使用这二十多种化合物作为对照,在实际检测工作不太现实。
毛建霏等[24]利用盐酸超声快速提取紫甘薯中花青素并直接将多种紫甘薯花色苷直接水解为少数花青素单体,仅用矢车菊素和芍药素2种花青素对照品就可以方便准确的对花青素含量进行定量分析,从而降低检测成本,简化了检测步骤。
3.3 液相色谱-质谱联用法液相色谱-质谱联用法(HPLC-MS/MS)将高效液相色谱的高效分离和质谱的高灵敏度,尤其是获取质谱信息进行定性的功能结合起来,是分析活性组分结构的重要手段。
HPLC-MS/MS在紫甘薯花青素分析上的应用主要用于品种间内含花色苷种类的比较确定。
Truong V D[2]用酸化甲醇作提取液,经戴安ASE 200加速溶剂萃取仪提取了3个紫薯品种原料和经蒸煮后原材料的冻干粉内的花色苷。
经液相色谱-紫外/质谱联用法(HPLC-DAD/ESI-MS/MS)分离确定了Stokes Purple和NC 415有17个花色苷组分,并确定了含量较大的前5种花色苷为:cyanidin 3-caffeoylsophoroside-5-glucoside矢车菊素3-咖啡酰槐糖苷-5-葡糖苷,peonidin 3-caffeoylsophoroside-5-glucoside芍药素3-咖啡酰槐糖苷-5-葡糖苷,cyanidin 3-caffeoyl-p-hydroxybenzoylsophoroside-5-glucoside矢车菊素3-咖啡酰-对-羟基苯甲酰槐糖苷-5-葡糖苷,peonidin 3-caffeoyl-p-hydroxybenzoyl-sophoroside-5-glucoside芍药素3-咖啡酰-对-羟基苯甲酰槐糖苷-5葡糖苷,and peonidin-caffeoyl-feruloylsophoroside-5-glucoside芍药素3-咖啡酰-阿魏酰槐糖苷-5-葡糖苷;Okinawa品种有12个花色苷成分,含量较大的3个为:cyanidin 3-caffeoylsophoroside-5-glucoside矢车菊素3-咖啡酰槐糖苷-5-葡糖苷, cyanidin 3-(6'', 6'''-dicaffeoylsophoroside)-5-glucoside矢车菊素-3-(6'',6'''-双咖啡酰槐糖苷) -5-葡糖苷 and cyanidin 3-(6''-caffeoyl-6'''-feruloylsophoroside) -5-glucoside矢车菊素3-(6''-咖啡酰-6'''-阿魏酰槐糖苷)-5-葡糖苷;同时知道蒸煮对花青素的含量及组成影响不大。
