海水资源的综合利用专题二十五
高考化学复习海水资源及其综合利用训练题(含答案)
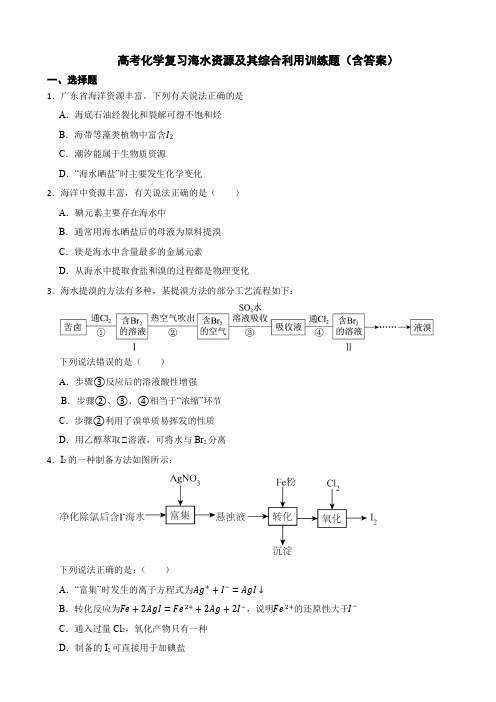
高考化学复习海水资源及其综合利用训练题(含答案)一、选择题1.广东省海洋资源丰富。
下列有关说法正确的是A.海底石油经裂化和裂解可得不饱和烃B.海带等藻类植物中富含I2C.潮汐能属于生物质资源D.“海水晒盐”时主要发生化学变化2.海洋中资源丰富,有关说法正确的是()A.碘元素主要存在海水中B.通常用海水晒盐后的母液为原料提溴C.镁是海水中含量最多的金属元素D.从海水中提取食盐和溴的过程都是物理变化3.海水提溴的方法有多种,某提溴方法的部分工艺流程如下:下列说法错误的是()A.步骤③反应后的溶液酸性增强B.步骤②、③、④相当于“浓缩”环节C.步骤②利用了溴单质易挥发的性质D.用乙醇萃取Ⅱ溶液,可将水与Br2分离4.I2的一种制备方法如图所示:下列说法正确的是:()A.“富集”时发生的离子方程式为Ag++I−=AgI↓B.转化反应为Fe+2AgI=Fe2++2Ag+2I−,说明Fe2+的还原性大于I−C.通入过量Cl2,氧化产物只有一种D.制备的I2可直接用于加碘盐5.化学创造美好生活。
下列生产活动中,没有运用相应化学原理的是( )A .AB .BC .CD .D6.一种工业制备无水氯化镁的工艺流程如下:下列说法错误的是( ) A .物质X 常选用生石灰B .工业上常用电解熔融 MgCl 2 制备金属镁C .“氯化”过程中发生的反应为 MgO +C +Cl2高温__MgCl 2+COD .“煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水 MgCl 27.用下图装置进行实验,能达到相应实验目的的是( )A .AB .BC .CD .D8.化学与社会、生产、生活密切相关。
下列说法正确的是( )A.食品中的抗氧化剂对人体无害且均具有氧化性B.从海水提取物质都必须通过化学反应才能实现C.我国发射的“北斗组网卫星”所使用的光导纤维是一种有机高分子材料D.“地沟油”禁止食用,但可以用来制肥皂9.下列说法错误的...是()A.某些胶态金属氧化物分散于玻璃中可制造有色玻璃B.通常以海水提取粗食盐后的母液为原料制取溴C.生物炼铜中通常利用某些细菌把不溶性的硫化铜转化为可溶性铜盐D.工业制备硝酸的主要设备为沸腾炉、接触室和吸收塔10.关于海水提溴和海带提碘的说法错误的是()A.都经过浓缩、氧化、提取三个步骤B.氧化步骤都可以通入氯气来实现C.提取时利用了溴和碘的物理性质D.实验室模拟时都用到了蒸发皿11.下列变化中,只涉及物理变化的是()A.盐酸除锈B.石油分馏C.海水提溴D.煤干馏12.“吹出法”是工业上常用的一种海水提溴技术,该技术主要流程如下:下列有关说法错误的...是()A.氧化1所用的氯气可通过电解饱和NaCl溶液制得B.吹出后剩余溶液中可能大量存在的离子有Na+、Mg2+、Cl−、Br−C.吸收过程发生反应的离子方程式为SO2+Br2+2H2O═4H++2Br−+SO42−D.氧化2所得溶液可通过萃取分离出溴13.海洋具有十分巨大的开发潜力。
海水资源的综合利用

②氧化:向浓缩的海水中通入适量的 Cl2 ,将Br -氧化为 Br2,反
应的离子方程式为Cl2+2Br-===Br2+2Cl-;
③富集:利用溴的挥发性,通入热空气和水蒸气,吹出的溴蒸气
用 SO2 吸收。反应的化学方程式为 Br2 + SO2 + 2H2O===2HBr +
H2SO4;
④提取:再用Cl2将HBr氧化得到产品溴。
③MgCl2+Ca(OH)2===Mg(OH)2↓+CaCl2 ④Mg(OH)2+2HCl===MgCl2+2H2O HCl ⑤MgCl2· 6H2O=====MgCl2+6H2O △ 电解 ⑥MgCl2(熔融)=====Mg+Cl2↑
(3)海水提溴
①浓缩:海水晒盐和海水淡化的过程中副产物Br-得到浓缩;
蒸馏法历史最久,技术、工艺比较完善,是目前海水淡化的主要
方法。蒸馏淡化过程的实质如同水蒸气的形成,使海水受热蒸发
形成水蒸气,水蒸气在一定条件下遇冷形成不带咸味的水,但蒸
馏法的弊端是消耗能量多并在仪器里产生大量的锅垢。
(2)冷冻法
冷冻法,即冷冻海水使之结冰,在液态水变成固态冰的同时盐被
分离出去。冷冻法与蒸馏法相比,耗能低、结垢轻,但得到的淡
特别提示
SO4-等杂 海水晒盐得到的是粗盐,含有Ca2+、Mg2+、
2
质,精制后得到 NaCl 饱和溶液,精制时通常在其中依次加入过
量的 BaCl2 溶液、过量的 NaOH 溶液和过量的 Na2CO3 溶液,过滤 后,再加适量盐酸调节至中性即可。
(2)海水提镁 反应流程:
有关反应的化学方程式: 高温 ①CaCO3=====CaO+CO2↑ ②CaO+H2O===Ca(OH)2
+ 2H2O 。 ________
海水的综合利用(原创)

海水中资源的分类:
水资源
化学资源 海水资源 生物资源
能源 ……….
海水资源的分布特点:
1、海水资源的广阔性 2、海水资源的多样性 3、海水资源的分散性
总之,海洋是一个远未完全开发的 巨大化学资源宝库!!!
海水的淡化:
其他淡化技术:
电渗析法
MgCl2 (aq) MgCl2(s)
CaCO3 (贝壳)
CaO
熔 Cl2
海带中碘的存在形式:有机碘化物
干海带中含碘量: 0.3%--0.5%,有的高达 1%,约比海水中的碘 浓度提高了10万倍!
3.海洋植物,如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。 实验室里从海带中提取碘的流程如下:
MgCl2 (aq) MgCl2(s)
CaCO3 (贝壳)
CaO
熔 解槽 氯气
海 水
蒸发
母液 贝壳 烧成 石灰 Mg(OH)2 盐酸 浓缩 MgCl26H2O 脱水 MgCl2 电解 Mg
↑ 步骤Ⅲ
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42- 等杂质离子,欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42- NaOH BaCl2 Na2CO3 离子,请从提供的试剂中选出a所代表的试剂,按滴加顺序 BaCl2 NaOH Na 依次是________________ 2CO3 BaCl2 Na2CO3 NaOH (提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH 溶液 BaCl2溶液 Ba(NO3)2溶液)
灼烧
溶解
过滤
浸取I-
验证
实验过程
先氧化 后检验
海水资源的综合利用

1.海水中的化学资源是指海水中所含具有经济价 值的化学物质。海水的主要成分有Na+、Mg2+、 Ca2+、K+、Cl-、SO42-,这6种成分占海水成分的 99.5%以上。通常所说的海盐主要指钠盐、镁盐、 钾盐和钙盐,钠盐在海盐中产量最大,应用最广 泛,人们把氯化钠称为百味之王,化工之母,其 次还有硫酸钠、碳酸氢钠和碳酸钠;镁的含量仅 次于氯化钠,海水中的镁总量约2000×10t;
氯化钠的应用: 1.含氯化钠0.9%的水称为生理盐水,因为它与血浆 有相同的渗透压。 2.食品业和渔业用于盐腌,在烹调菜肴中加入食盐 可以除掉原料的一些异味,增加美味,这就是食 盐的提鲜作用。 3.氯碱工业:电解饱和食盐水。 4.候氏联合制碱法。 5.电解熔融氯化钠和氯化钙的混合物制取金属钠。 氯化钙用作助熔剂,可将氯化钠的熔点降低至 700℃以下。钙的还原性不及钠,不会引进杂质。
2.溴是海水中重要的非金属元素.地球上 99%的溴元素以Br-的形式存在于海水中, 所以人们也把溴称为“海洋元素”。 3.碘在自然界中含量稀少,在地壳的含量 位居第47位。除在海水中含量较高(海带、 贝类)以外,在大部分土壤、岩石、水 的含量都很低。
4.氯化钠主要来自海水,由海水(平均含2.4% 氯化钠)引入盐田,经日晒干燥 ,浓缩结晶, 制得粗品,然后精制。
4.离子交换法:用阴阳离子交换树脂除去海水中的 多余盐分的方法。 5.反渗透淡化法:该法在压力推动下使薄膜脱盐, 除用于海水脱盐外,还广泛用于苦咸水的淡化。 反渗透淡化发展迅速,其装机容量仅次于海水蒸 馏而居第二位。
二、海水中化学资源的提取
海水中蕴含着几乎所有的化学元素,总储量很大, 但是很多元素富集程度却很低。例如,金的储量 约为5×107吨,但是1吨海水中仅有4×10-6克。
高三化学课件:Mg Br I 海水资源的综合利用

特别提醒: 1贝壳原料在海边就可获取; 2不用电解熔融 MgO 的方法是因为 MgO 的熔点很高。
2.溴的提取 (1)原料:海水晒盐后的母液。 (2)基本流程
(3)有关反应的离子方程式 - - ① 2Br + Cl2===2Cl +Br2 ② SO2+ Br2+2H2O===4H +2Br + SO2 4
即时应用 1.海水是一个巨大的化学( )
A.从海水中提取镁得到氯气直接用 NaOH 溶液吸收 B.海水蒸发制海盐的过程中也发生化学变化 C.海水提溴过程中有两处用到氯气做氧化剂 D. 海水提镁过程中加热 MgCl2· 6H2O 晶体时须在 HCl 氛围内, 是为了抑制 Mg2 的水解
(2)下列关于提取镁的说法中,不 正确的是________(填序号 )。 . A.此法的优点之一是原料来自大海 B.进行①②③步骤的目的是富集 MgCl2 C.可用电解熔融氧化镁的方法制取镁 D.电解冶炼镁要消耗大量电能
+
2. (2013· 西安十校联考 )海水是镁的主要来源之一。从海水中 提取镁可按如下步骤进行:①把贝壳制成石灰乳;②向引入的 海水中加入石灰乳,沉降、洗涤、过滤沉淀物;③将沉淀物与 盐酸反应,结晶、过滤、干燥;④电解得到产物。 (1) 以 上 提 取 镁 的 全 过 程 中 , 没 有 涉 及 的 化 学 反 应 类 型 是 ________(填序号 )。 A.分解反应 C.置换反应 B.化合反应 D.复分解反应
+ - -
特别提醒: 1MgCl2· 6H2O 脱水过程中,为防止 Mg2 水解生
+
成 MgOH2,需要在 HCl 气流中使 MgCl2· 6H2O 脱水生成无 水 MgCl2。 2为了提高溶液中 Br2 的浓度,先用热空气吹出,后用 SO2 吸收、再氯化、蒸馏。
精品:2015届高考化学大一轮课件:4-14海水资源的综合利用 环境保护与绿色化学

【解析】
由物质的转化图,逐一分析讨论可知甲为
AgI,乙是由铁和碘化银反应生成的产物,由于铁在该反应 中只能被氧化为+2价,故乙是FeI2,而Cl2将FeI2氧化为I2和 FeCl3:3Cl2+2FeI2===2I2+2FeCl3。上述生产流程中,可利 用步骤③生成的Ag来制取AgNO3,以循环利用,但步骤③得 到的Ag中含有过量的铁,可先加稀H2SO4将铁除去,再溶于 稀HNO3制得AgNO3。AgI不稳定,见光易分解生成单质碘和 银,银不是晶体而为粉末状,显黑色;由于I2单质易升华, 易溶于有机溶剂,提纯I2可用升华法或萃取的方法。
(3)原子经济性:原子经济性可用原子利用率来衡量,其 期望产品的总质量 定义可表示为原子利用率= ×100%。 生成物的总质量 ①
光 ②CH4+Cl2――→CH3Cl+HCl
25 ① 上述两反应的原子利用率为100%的是 □
,其特点
26 全部转化为期望的最终产物 。原子 为:反应物中的原子□ 经济性的反应有两个显著优点:一是最大限度地利用了原 料,二是最大限度地减少了废物的排放。
3.电解氯化钠、氯化镁的水溶液,可以制得钠和镁。 (×) 解析:钠、镁的冶炼是通过电解熔融盐(氯化物)来完成 的。 4.理想的原子经济性的合成反应仅需要催化剂。(√) 解析:理想的原子经济性的合成反应应该是原料分子中 的原子百分之百地转变成产物,仅需要无损耗的催化剂。
5.提取海水中的镁、钾、溴、碘等化工产品需要解决 物质的富集问题。(√) 解析:海水中含有的各种元素的特点:种类多,总储量 大,富集程度低。因此,从海水中提取物质需要解决物质的 富集问题。 6.绿色化学的核心是应用化学原理对环境污染进行治 理。(×) 解析:绿色化学的核心是从源头上减少和消除工业生产 对环境的污染。
海水的综合利用归纳

海水的综合利用归纳南靖一中沈建忠2010、09、15海水中平均含盐3.5%,含多种矿物质,如钠、钙、钾、溴、碘、锶等。
海水资源包括:能量、生物、化学、矿物、及空间资源。
利用潮汐能量发电,各种化学物质被综合利用,海水还是人类未来重要的淡水来源、新的能源和人类的空间资源。
问题1:海水的综合利用有哪些方面?(1)海水的直接利用;(2)海水的淡化;(3)制盐和以盐为原料的盐化工;(4)提取海水中溶存的有用元素。
一、海水中水资源的利用——获取淡水1、途径:通过海水中提取淡水或从海水中把盐分离出去,都可以达到淡化海水的目的。
2、海水淡化的方法及其特点:海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等。
原理:蒸溜法分离海水;优点:蒸馏法的历史最久,技术和工艺也比较完善;缺点:成本较高,难推广应用。
二、海水中的化学资源1、特点:种类多、总储量大、富集程度低含80多种元素,以氢、氧、氯、钠、镁、硫、钙、钾等较多。
被称为“元素的故乡”。
海水中铀多达45亿吨是已知陆地铀矿储量的4500倍。
氘有50亿吨足够人类用上千万年2、从海水中提取物质的方法(1)从海水中提取食盐如何制盐?NaCl、海水晒盐A 、粗盐的成份及精制:a 、粗盐:含较多的氯化镁和氯化钙及泥沙b 、提纯实验步骤:溶解、过滤、结晶。
(请说说:过滤操作的要点;玻璃棒的使用;结晶操作要点;)c 、请设计实验室除去NaCl 中混有的Ca 2+、Mg 2+离子的方法(需要仪器及实验步骤):(答案:溶解,加稍过量的氢氧化钙,再加入稍过量的碳酸钠溶液,过滤;在滤液中加入稍过量的盐酸,蒸发结晶。
)B 、海水晒盐后的“卤水”中还有哪些盐含量较高?氯化镁 碘化钾 溴化钾 (2)海水提取镁试剂①溶液Mg(OH)2沉淀试剂②MgCl 2溶液Mg无水MgCl 2熔融电解(1)Ca(OH)2(2)过滤(3)盐酸(4)MgCl 2(熔融)电解Mg + Cl 2 ↑海水(含Mg 2+)过量(3)、海带中提取碘的实验 原理: I - —— I 2 检验I 2: 用淀粉溶液检验,看它是否变蓝。
海水资源综合利用-精品文档28页

鱼骨为核心,把其它物质聚集在周围。生长速度很
缓慢,大约 1000 年生长 1 毫米,有的 100 万年才
生长 4 毫米。锰结核含有锰、铁、镍、铜、钴、钛
等 20 多种元素。其经济价值很高,估计在太平洋
的分布面积约为 1800 万平方公里。这样就含有炼
锰钢用的锰有 4000 亿吨,炼不锈钢的镍有 164 亿
在缺水状态中。有一份权
威研究报告说:“除非我们
改进淡水供给政策,否则
我们将可能因缺水而引起
大规模冲突,发生大灾难。”
返回原处
海水中的化学资源
海水中铀多达45亿吨 是已知陆地铀矿储量 的4500倍。氘有50亿 吨足够人类用上千万 年
含80多种元素,以氢、氧、 氯、钠、镁、硫、钙、钾等 较多。被称为“元素的故乡”。
(4)蒸发结晶(得纯NaCl晶体)
导读思考题(二):
人类提取海水中的各种元素,来大量制备对我们有用 的物质。(1) 如何从海水中提取金属镁? (2) 其工艺流程是什么?涉及到哪些重要化学反应?
海水 石灰乳
氢氧
盐酸
通电
氯化镁
镁
或卤水
化镁
MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2
Mg(OH)2+2HCl=MgCl2+2H2O
吨,炼超硬度钢的钴有 58 亿吨,用途广泛的铜有
返回原处
88 亿吨锰…结…核 。
煮 海
为 盐
返回原处
谢谢你的阅读
知识就是财富 丰富你的人生
作业:
就海水的综合利用前景写一篇小论文或调查报告
设问与质疑: 1、地球上的水资源很丰富,为什么淡水资源日益短缺? 2、人们采用什么方法解决淡水资源危机问题? 海水淡化 3、用什么方法能除去海水中的盐得到淡水? 常用蒸馏法
人教版高中化学必修2课件 海水资源的综合利用

海水资源的综合利用一、海水中盐的开与利用蒸发池结晶池
海水资源的综合利用 盐是人类日常生活中的必需品,也 是很多工业部门的原料之一,而海盐又 是盐的主要来源之一。 海水制盐的方法主要有三种,即 :盐田法、电渗析法和冷冻法。盐田法 历史最悠久,而且也是最简便和经济有 效的方法,现在还在广泛采用。
海水资源的综合利用 二.镁的提取
- SO2+Br2+2H2O===4H++2Br-+SO2 4 - -
海水资源的综合利用 四.碘的提取
(1)流程:
(2)有关反应的离子方程式: 2I-+Cl2===I2+2Cl-
海水资源的综合利用
例2 海带中含有丰富的碘。为了从海带中 提取碘,某研究性学习小组设计并进行了 以下实验:
海水资源的综合利用
(5) 请设计一种检验提取碘后的水溶液中是否 还含有单质碘的简单方法:___________________。 取少量提取碘后的水溶液于试管中,加 入几滴淀粉试液,观察是否出现蓝色(如 果变蓝,说明还有单质碘
海水资源的综合利用
(2)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤:
2 ______________________________________ 。
加入MgCl 溶液,充分搅拌,过滤,沉淀用水洗涤
海水资源的综合利用
三.溴的提取
(1)流程:
(2)有关反应的离子方程式: 2Br +Cl2===2Cl +Br2
流程:
海水资源的综合利用
例1 镁是一种用途很广的金属材料,目前世界上60%的镁从海
水中提取,海水的综合利用可以制备金属镁,其流程如下图所示:
海水资源的综合利用
(1)用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中
高中化学 海水资源的综合利用

①
②
Cl2 空气和水蒸气
含浓Br的溶液
④ Cl2
浓Br2 溶液
① 2NaBr + Cl2== Br2+2NaCl
③ 2H2O + Br2+SO2== H2SO4+2HBr ④ 2HBr + Cl2== Br2+2HCl
海水提溴的实验室模拟装
海洋具有丰富资源,我们 在研究和开发海洋资源时,不 能以牺牲环境为代价,也绝不 应违背可持续发展的原则,不 能重蹈开发陆地资源的覆辙,
海水化学资源的开发利用
思考:
如何通过实验证明海水中存在碘元素?
已知:海水中碘元素的含量6×10-4mg/L 干海带中含碘量达0.3%--0.5%,有的高达1%。 约比海水中的碘浓度提高了10万倍!
海水化学资源的开发利用
思考:
如何通过实验证明海带中存在碘元素?
如何通过实验证明海带中存在碘元素?
=
3Br2 + 6OH- = 5Br- + BrO3- + 3H2O
5Br- + BrO3- + 6H+ = 3Br2 + 3H2O
富集
2.酒精湿润,灼烧成灰,停止加热,冷却
3.取1药匙海带灰放入小烧杯中,加10mL蒸馏水
4.搅拌,煮沸2-3分钟,
除杂
5.冷却3分钟
6.过滤
7.在滤液中滴入4滴稀硫酸和1mL双氧水 转化
8.分别取1mL滤液于两支试管中
提纯
9.一支试管中加入1mLCCl4,另一试管加入4滴淀粉溶液
海水化学资源的开发利用
8.分别取1mL滤液于两支试管中 9.一支试管中加入1mLCCl4,另一试管加入4滴淀粉溶液
海水资源的开发利用)

海带中碘元素的检验
1、用剪刀剪碎海带,用酒精润湿,放入坩埚中
2、灼烧海带至完全生成灰,停止加热,冷却 3、将海带灰移至小烧杯中,加蒸馏水,搅拌,煮沸,过滤 4、在滤液中滴加稀H2SO4及H2O2,然后加几滴淀粉溶液。 方程式为:2KI+H2O2+H2SO4 = I2+2H2O+K2SO4
海带灼烧
(3).海带中提碘 a\海带中含有碘元素的检验。
①反应原理:
酸性条件下H2O2氧化I-的离子方程式为
2H++2I-+H2O2===I2+2H2O
②操作步骤:
。
b\海带中提碘。 ①反应原理: Cl2氧化I-的离子方程式
为
Cl2+2I-===I2+2Cl-
。
②工艺流程:
(4).海水中提取溴
(1)基本操作:
①浓缩:海水晒盐和海水淡化的过程中副产物Br-得
海水蒸馏原理示意图
(1)海水蒸馏实验装置中需要注意的问题:
②冷凝管内水流方向是“下口进,上口出”。
①圆底烧瓶内要加入碎瓷片(沸石),目的是防止液体暴沸。
(2)海水蒸馏法制淡水的优缺点:
①优点是设备简单,易操作,淡水质量好,技术和工艺 也比较成熟。 ②缺点是耗能大,成本较高。将海水淡化与化工生产和 能源技术结合,是海水综合利用的重要方向。
海水综合利用联合工业体系一例
课堂检测:
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘 离子的形式存在。实验室从海藻中提取碘的流程如下:
(1)指出提取碘的过程中有关实验操作名称 ① 过滤 ③ 萃取 。写出过程②中有关反应的离子 方程式: 2I-+Cl2=2Cl-+I2 。 (2)提取碘③过程中,可用的有机试剂是 BC 。 A.酒精 B.四氯化碳 C.苯 D.乙酸 (3) ③过程后得到含碘的有机溶液,可用 蒸馏 把 碘和有机溶剂分离开来。(分离方法)
高中课件 海水资源的综合利用

海水中化学资源的开发利用 海水提溴(Br2)
如何将溴单质从苦卤中提取出来?
阅读教材P101图8-4海水提溴工艺流程示意图, 1、写出吸收塔中反应的离子方程式; 2、将图8-4转化成简单流程图; 3、分析对比两种流程,找出相似性和差异性,解释差异产生的可能原因。
海水中化学资源的开发利用 为什么不用四氯化碳萃取分液后再蒸馏?
海水的成分
说说蒸馏法淡化海水的原理,观察装置图, 和标准的蒸馏装置有什么区别?
海水中水的沸点 最低,首先被汽 化并随之冷凝, 从而使水与其它 组分分离。
海水中化学资源的开发利用 海水制盐
浓缩海水 蒸发池 结晶池
具体是什么结晶方法?
海水的成分
粗盐
母液
也叫“苦卤”,含有高浓度的 Mg2+、K+、SO42-、Br-可从 中提取多种化工原料
蒸发浓缩
海水 含Br -
含Br2 空气吹出 的海水
冷凝
液溴
分离
含Br2 SO2和水 的空气 吸收
含HBr的 吸收液
溴蒸汽
Cl2氯化
水蒸气 含Br2的
蒸馏
酸液
海水中化学资源的开发利用 海水提镁
关键问题: 此流程的目的是什么? 流程中涉及哪些步骤? 每一步的作用是什么? 流程中涉及哪些化学知识? 涉及的主要反应有哪些? 用到了哪些分离和提纯的操作?
海水资源的特点: 海水的成分
广阔性
海水中水的储量约为 1.3×109 亿吨,占地 球总水量 97%
多样性
分散性
元素种类很多,总 计含有80多种元素
许多元素的富 集程度很低
海水资源的综合利用
海和其它化学资源 海水水资源主要如何利用? 海水淡化和海水循环冷却 海水淡化的方法有哪些? 蒸馏法、反渗析法和离子交换法
化学海水的综合利用2222222222

思考与交流
2I- + H2O2 + 2H+ = I2 + 2H2O 2I- + Cl2 = 2Cl- + I2
注意: 若氯水过量,则Cl2能进一步将碘单质氧化。
I- + 3Cl2+ 3H2O= 6Cl- + IO3-+6H+
氯气应适量
氯水、双氧水等
思考与交流
注意热坩埚不能放在桌面上!!!
3、水浸时常常要将悬浊液煮沸2~3min,目的是什么?
思考与交流
加快碘化物在水中的溶解,以使灰烬中的I- 尽可能多的进入溶液。
4、酸化作用是什么?
思考与交流
海带灰的浸出液中含有碳酸钠(碳酸钾)等使溶液显碱性的物质,酸化的目的是使溶液呈弱酸性,有利于氧化剂把I-氧化为I2。
4.工业生产中平衡原理的应用 (1)沉淀溶解平衡原理的应用 ①向海水中加入沉淀剂Ca(OH)2,由于c(OH-)增大,Mg(OH)2的溶解度小于Ca(OH)2,则最大程度地将Mg2+转化为Mg(OH)2沉淀。 ②向Mg(OH)2沉淀中加入盐酸,使沉淀溶解平衡右移。 (2)水解平衡原理的应用 在MgCl2·6H2O脱水变为MgCl2时,由于MgCl2+2H2O Mg(OH)2+2HCl水解平衡的存在,在HCl气体环境中,增大c(HCl),抑制了MgCl2的水解,避免了Mg(OH)2的生成。
特别提醒:①为提高反应中Mg2+的浓度,将海水浓缩或用提取食盐后的盐卤。 ②电解熔融MgCl2生成的Cl2可用于制盐酸,循环使用,节省成本。 ③所得Mg(OH)2沉淀中含有的CaSO4杂质在加盐酸前应除去,以保证MgCl2的纯度。
干海带
灰 烬
海水资源的综合利用

(4)电解无水MgCl2所得的镁蒸气可以在下列___A____气体中冷却。
A.H2 B.N2 C.CO2
D.O2
3.溴的提取 (1)流程:
(2)有关反应的离子方程式: 2Br-+Cl2===2Cl-+Br2 SO2+Br2+2H2O===4H++2Br-+SO24-
4.碘的提取 (1)流程:
(2)有关反应的离子方程式: 2I-+Cl2===I2+2Cl-
骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒
的目的。 溶解时:____搅__拌__,__加_速__溶__解_______________________。
过滤时:___使__待__滤__液_体__沿__玻__璃__棒_流__入__漏__斗_,__防__止__外__洒_____。
蒸发时:___搅_拌__,__防__止__因_局__部__过__热__引_起__液__滴__或_晶__体__飞__溅____。
试回答下列问题: (1)粗盐中含有 Ca2+、Mg2+、SO24-等杂质,精制时所用试 剂为:A.盐酸;B.BaCl2 溶液;C.NaOH 溶液;D.Na2CO3 溶液。加入试剂的顺序是__B__C__D_A__或_C__B__D_A__或__B_D__C_A_。 (2)电解饱和食盐水时,与电源正极相连的电极上发生的 反应为__2C__l-_-_2_e_-=_C_l_2↑_____。与电源负极相连的电极附近 溶液pH__变__大____(填“变大”、“不变”或“变小”)。若欲将 电解后饱和食盐水恢复至电解前,则可采取的方法是 _______加__入__一__定__量__的__H_C__l气__体_____________________。
2Cl- -2e-=Cl2↑ _______________________________________________。 (2)电解饱和食盐水时,与电源正极相连的电极上发生的反应为________________。 加入MgCl2溶液,充分搅拌,过滤,沉淀用水洗涤 用电解法制取金属镁时,需要无水氯化镁。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
海水资源的综合利用专题二十五1.海水是重要的资源,可以制备一系列物质。
下列说法正确的是()A.步骤②中,应先通CO2,再通NH3B.除去粗盐中的SO2-4、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸C.步骤③中可将MgCl2·6H2O晶体直接进行灼烧制得无水MgCl2D.步骤④⑤⑥反应中,溴元素均被氧化2.(2018·凯里一中高三月考)NaCl既是一种调味品,又是一种重要的化工原料,用NaCl可制备一系列物质(如图)。
下列说法正确的是()A.上述转化关系中所涉及物质都属于电解质B.实际生产中操作X是向NaCl饱和溶液中先通入NH3,再通入CO2C.工业上制备K利用了金属性:Na<KD.常温下,Cl2与Ca(OH)2反应制取漂白粉体现了Cl2的酸性3.(2018·合肥市第一中学月考)实验室中,从海带中提取I2的实验流程如下图所示,下列说法中不正确的是()A.操作①用到的玻璃仪器有烧杯、玻璃棒、漏斗B.操作②中需加入氧化剂C.可以用四氯化碳或酒精代替苯作萃取剂D.蒸馏I2的苯溶液可获取I2并回收苯4.碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示转化关系,根据图示转化关系推测下列说法中不正确的是()A.可用KI-淀粉试纸和食醋检验加碘盐中是否含有碘B.由图可知氧化性的强弱顺序为Cl2>I2>IO-3C.足量Cl2能使湿润的KI-淀粉试纸变白,其原因可能是5Cl2+I2+6H2O===2HIO3+10HCl D.途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10N A5.在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采取下面的工艺流程生产单质碘。
根据以上转化关系,下列说法正确的是()A.根据流程,可知甲为AgI,乙为FeI3,丙为Ag2SO4,丁为FeCl2B.第③步操作中,Fe屑和甲反应的离子方程式为2Ag++Fe===Fe2++2AgC.第④步操作用稀H2SO4浸洗的目的是除去Ag中未反应的FeD.第⑦步提纯操作为过滤、洗涤、干燥6.实验室从含Br-的废液中提取溴单质,下列说法中能达到实验目的的是()A.用装置甲氧化废液中的Br-B.用装置乙分离CCl4层和水层C.用装置丙分离CCl4和液溴D.用仪器丁长期贮存液溴7.实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:(1)向含碘废液中加入稍过量的Na 2SO 3溶液,将废液中的I 2还原为I -,其离子方程式为________________________________________________________________________ ________________________________________________________________________; 该操作将I 2还原为I -的目的是________________________________________________。
(2)操作X 的名称为____________。
(3)氧化时,在三颈烧瓶中将含I -的水溶液用盐酸调至pH 约为2,缓慢通入Cl 2,在40 ℃左右反应(实验装置如图所示)。
实验控制在较低温度下进行的原因是_________________________________________ ________________________________________________________________________; 锥形瓶里盛放的溶液为____________。
(4)已知:5SO 2-3+2IO -3+2H +===I 2+5SO 2-4+H 2O 某含碘废水(pH 约为8)中一定存在I 2,可能存在I -、IO -3中的一种或两种。
请补充完整检验含碘废水中是否含有I -、IO -3的实验方案:取适量含碘废水用CCl 4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;_________________________________________ ________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________。
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl 3溶液、Na 2SO 3溶液。
8.(2019·河北衡水中学调研)查阅资料知:Br 2的沸点为58.8 ℃,密度为3.119 g·cm -3,微溶于水,有毒。
Ⅰ.(1)常温下,单质溴通常呈________态,保存时通常在盛溴的试剂瓶中加入少量________。
Ⅱ.工业生产中,海水提取溴常用热空气吹出法。
其生产流程如下: 淡化海水――→通入Cl 2低浓度溴水―――――――→通入热空气吹出Br 2用X 吸收含Br -的溶液――→通入Cl 2Br 2的浓溶液―→液溴 某化学实验小组模拟该法设计了如下实验装置(夹持装置略去)从浓缩的海水中提取液溴。
实验步骤如下:①关闭活塞b、d,打开活塞a、c,向A中缓慢通入Cl2至反应结束;②关闭a、c,打开b、d,向A中鼓入足量热空气;③关闭b,打开a,再通过A向B中通入足量的Cl2;④将B中所得液体进行蒸馏,收集液溴。
(2)当观察到A中液面上方出现____________(实验现象)时即可判断步骤①中反应已经结束。
(3)X试剂可以是________(填字母,下同),尾气处理选用________。
a.H2O b.饱和食盐水c.氢氧化钠溶液d.饱和Na2SO3溶液B中X试剂发生反应的离子方程式为_______________________________________________________________________________________________________________。
(4)蒸馏时应该选择______________________(填序号),操作中应控制的关键实验条件为________________________________________________________________________。
Ⅲ.该实验小组利用制得的单质溴研究H2与Br2生成HBr的反应,实验装置如下:(5)E装置可用来检验反应产物HBr,则D装置的作用是____________________。
若要检验E 中收集的HBr,图示装置检验HBr还不够完善,请结合原有实验装置予以改进:________________________________________________________________________。
答案精析1.B2.B[向NaCl饱和溶液中先通氨气才能吸收更多的CO2形成HCO-3,B项正确;转化关系中所涉及的物质有单质、混合物,这些都不属于电解质,A项错误;工业上制备K利用的是平衡移动原理,K的沸点低于Na,易形成K蒸气而使平衡正向移动,C项错误;体现的是Cl2的氧化性、还原性,D项错误。
]3.C4.B[加碘盐中含有IO-3,在酸性条件下可被I-还原成I2,KI-淀粉试纸会变蓝,A项正确;根据途径Ⅰ可知氧化性Cl2>I2,根据途径Ⅱ可知氧化性IO-3>I2,根据途径Ⅲ可知氧化性Cl2>IO-3,B项错误;根据图示转化关系可知,其原因可能是5Cl2+I2+6H2O===2HIO3+10HCl,C项正确;根据关系式2IO-3~I2~10e-可知,若生成1 mol I2,反应中转移的电子数为10N A,D项正确。
]5.C[依据流程,向卤水中加入AgNO3生成的甲应为AgI,AgI和Fe反应的离子方程式为2AgI+Fe===2Ag+Fe2++2I-,在此反应中AgI为沉淀,不能拆分,生成的乙应为FeI2,故A、B项错误;第③步反应生成的Ag中可能混有未反应的Fe,加稀H2SO4是除去未反应的Fe,故C项正确;从碘水中提取单质I2可采取有机溶剂萃取法、升华法提纯,而不能用过滤法,故D项错误。
]6.B[利用Cl2氧化废液中的Br-,应将Cl2从长导管通入废液中,A项错误;Br2易溶于CCl4,利用CCl4萃取溶液中的Br2后,利用分液漏斗进行分液来分离CCl4层和水层,B项正确;利用蒸馏法分离CCl4和液溴时,温度计的水银球应放在蒸馏烧瓶的支管口处,C项错误;液溴具有较强的挥发性和氧化性,易腐蚀橡胶塞,应用带玻璃塞的试剂瓶贮存,D项错误。
] 7.(1)SO2-3+I2+H2O===2I-+SO2-4+2H+使CCl4中的碘进入水层(2)分液(3)使氯气在溶液中有较大的溶解度(或防止I2升华或防止I2进一步被氧化)NaOH溶液(4)从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加FeCl3溶液,若溶液变蓝,说明废水中含有I-,若溶液不变蓝,说明废水中不含有I-;另从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝,说明废水中含有IO-3,若溶液不变蓝,说明废水中不含有IO-38.(1)液水(2)黄绿色(3)d c Br2+SO2-3+H2O===SO2-4+2Br-+2H+(4)①③⑤⑥⑦控制温度在59 ℃(或58.8 ℃)(5)除去未反应完的溴蒸气在D与E之间增加一盛有CCl4的洗气装置解析(1)Br2易挥发,密度大于水,微溶于水,所以保存时通常在盛溴的试剂瓶中加入少量水进行水封。
(2)当反应完成时,多余Cl2逸出,使A液面上方出现黄绿色。
(3)Br2能与Na2SO3反应生成Br-,可以用饱和Na2SO3溶液吸收Br2;溴蒸气、Cl2均有毒,可以用NaOH溶液吸收。
(4)Br2的沸点为58.8 ℃,则应控制温度在59 ℃(或58.8 ℃)。
(5)生成的HBr中混有溴蒸气,由于Br2的沸点较低,通过D装置可以除去溴化氢中的溴蒸气;由于D装置无法完全除去HBr中的Br2,所以该方案不够完善,应该在D和E之间增加一盛有CCl4的洗气装置,确保将HBr中的Br2完全除去。
