氨基酸、多肽、蛋白质
第17章氨基酸和蛋白质-新(4)

(一)两性电离和等电点
分子内部酸性基团和碱性基团所形成的盐称 为内盐。内盐分子中包含正、负离子两部分, 所以又称为两性离子(zwitter-ion)或偶极 离子。偶极离子即可与较强的酸反应,又可 与较强的碱反应,表现出两性化合物的特性。
(二)蛋白质的高级结构
蛋白质分子的多肽链并不是以完全伸展的线 状形式存在,而是通过分子中Cα —H、Cα — N单键的旋转而盘曲、折叠形成特定的三维 空间结构,这种空间结构称为蛋白质的高级 结构。
1.蛋白质的二级结构
蛋白质的二级结构主要指的是多肽链中 原子的空间排布。
N原子上的孤电子对与羰基之间形成共 轭体系,使得C—N单键具有部分双键性质, 限制了肽键的自由旋转。实际上,肽键具有 平面结构,称为肽键平面。其中Cα 1、羰基 碳和氧、氮和氢以及Cα 2共六个原子在同一 平面上,氧原子和氢原子呈反式。
中性氨基酸的pI在5.1~6.5之间
(二)显色反应
α -氨基酸与水合茚三酮在水溶液中加热时, 能放出二氧化碳,并生成紫色的化合物,称 为罗曼氏紫。
O OH
-
R-CH-COO
2
+ OH
N+ H3
O
ONH4 O
N=
O
O
+ RCHO + CO2
水合茚三酮
罗曼氏紫
此反应灵敏度高,是鉴定α -氨基酸简 便而迅速的方法,常用于层析时显色。还可 根据颜色的深浅程度及放出的二氧化碳的量 测定α -氨基酸的含量。
a- 螺旋(b)
(2)β—折叠 又称为β—片层结构。β—折 叠指多肽链呈一种铺开的折扇形状,相邻两 个氨基酸残基的距离约700pm。若干条多肽 链或一条多肽链的若干片段平行排列,维系 和固定β—折叠的作用力仍然是氢键。 β-折叠有两种类型,一种是多肽链从N-末端 到C-末端的排列是同方向的,称为平行β-折 叠,另一种是从N-末端到C-末端的排列是反 方向的叫反平行β-折叠。
氨基酸、多肽与蛋白质

形成一级结构的化学键:
•肽键(主要化学键) •二硫键
目录
一级结构是蛋白质空间构象和特异生物学功能 的基础,但不是决定蛋白质空间构象的唯一因素。
目 目录 录
三、多肽链中的局部特殊构象是 蛋白质的二级结构
Genome Project) 。
21世纪,蛋白质组学 (Proteomic) 。
目录
一、蛋白质的生物学重要性
1. 蛋白质是生物体重要组成成分 分布广:所有器官、组织都含有蛋白质;细胞的 各个部分都含有蛋白质。 含量高:蛋白质是细胞内最丰富的有机分子,占 人体干重的 45%,某些组织含量更高, 例如脾、肺及横纹肌等高达80%。
目录
O NH2-CH-C H
甘氨酸
+
OH
O NH-CH-C H
甘氨酸
H
OH
-HOH
O O NH2-CH-C-N-CH-C H HH OH
甘氨酰甘氨酸
目录
肽键
* 肽是由氨基酸通过肽键缩合而形成的化合
物。 * 两分子氨基酸缩合形成二肽,三分子氨基
酸缩合则形成三肽……
* 由十个以内氨基酸相连而成的肽称为寡肽
目录
1951年, Pauling采用X(射)线晶体衍射发现了蛋
白质的二级结构——α-螺旋(α-helix)。
1953年,Frederick Sanger完成胰岛素一级序列测定。
1962年,John Kendrew和Max Perutz确定了血红蛋
白的四级结构。
20世纪90年代以后,后基因组计划(Post-Human
下公式推算出蛋白质的大致含量: 100克样品中蛋白质的含量 ( g % ) = 每克样品含氮克数× 6.25×100 1/16%
第16章 氨基酸、肽和蛋白质

茚三酮
C C O OH C OH O NH2 + RCHCOOH
水合茚三酮
C C O C O N O C C C HO + RCHO + CO2
蓝色或紫红色
是鉴别α-氨基酸的灵敏的方法——既可定性,又可定量。
8
若为亚氨基,与茚三酮作用,则呈黄色。 例: O C C OH C OH O + NH2 C COO C
的由 排基 列因 顺上 序的 决遗 定传 的密 。码 猪胰岛素分子的一级结构
17
二、蛋白质的二级结构(高级结构) 指多肽链主链在一级结构的基础上进一步的盘旋或折叠的方式 ——局部空间排列。 二级结构的主要形式 α-螺旋、β-折叠、β-转角、γ-转角、无规卷曲 1、α-螺旋 各肽键平面通过α-碳原子的旋转,围绕中心轴形成的一种紧密 螺旋盘曲构象。它是最常见、含量最丰富的二级结构。
OH R CH COOH NH3 H R CH COO NH3 H OH R CH COO NH2
pH<pI
pH=pI
pH>pI
注意点: 等电点为氨基酸分子呈电中性,而不是溶液的pH为中性。 例: 丙氨酸(中性) 谷氨酸(酸性) 赖氨酸(碱性) pI = 6.02 pI = 3.22 pI = 9.74
+
O 弱碱 + N H 2 -C H -C R NO2 O 2N O OH +
NO2
O
F
肽链
O 2N
N H -C H -C R
肽链
N H -C H -C R
混合氨基酸
黄色
二、C-端分析(羧酸多肽酶法) 用羧酸多肽酶水解多肽,只有靠近游离羧基的一个肽键可被水 解,再分离鉴定。
氨基酸_多肽

肽键的平面特征
15
15.5 蛋白质的结构 蛋白质也是由氨基酸以酰胺键形成的大分子化合物。 蛋白质与多肽并无严格的界线,通常是将相对分子量在 10000以上的多肽称为蛋白质。在10000以下的称为多肽。 蛋白质的结构可分为四级: 一级结构:氨基酸的连接顺序。 二级结构:肽链的的构象及通过链内或链间的氢键形 成的α-螺旋、β-折叠等结构。 三级结构:是指在二级结构基础上,肽链相互扭在一 起或卷曲成其他形状。
∆ R CH2NH2 + CO2 R CH COOH 或脱羧酶 NH2
8 脱羧和脱氨基反应
(CH3)2CHCH2CHCOOH + H2O NH2 酶 (CH3)2CHCH2CH2OH + CO2 + NH3
11
二 多肽和蛋白质
一个氨基酸分子的氨基与另一个氨基酸的羧基之间失 水形成的酰胺键称为肽键。
16
四级结构:是指由多条具有一、二、三级结构的肽链 通过非共价键连接起来的结构形式。
一 級 结 构
二 級 结 构
三 級 结 构
四 級 结 构
17
α-螺旋 多肽链中的各个肽平面围绕同一 轴旋转,形成螺旋结构,螺旋一 周,沿轴上升的距离即螺距为 0.54nm,含3.6个氨基酸残基;两 个氨基酸之间的距离为0.15nm; 肽链内形成氢键,氢键的取向几 乎与轴平行,第一个氨基酸残基 的酰胺基团的-CO基与第四个氨 基酸残基酰胺基团的-NH基形成 氢键。 蛋白质分子为右手α-螺旋。
6
2 与亚硝酸反应
R CH COOH + HNO2 NH2 R CH COOH + N2 + H2O OH
反应是定量进行的,可以根据放出氮气的量计算分子 中氨基的量。(范斯来克氨基测定法) 3 与醛反应
第十六章 氨基酸、多肽和蛋白质

OH R CH COOH +N2
+ H2O
若定量测定反应中所释放的N2的体积,即可计算出 氨基酸的含量,此方法称为van Slyke氨基氮测定法,常
用于氨基酸和多肽的定量分析。
第二节 肽
一、肽的结构和命名
肽是氨基酸残基之间彼此通过酰胺键相连而成的一 类化合物。 肽分子中的酰胺键又称为肽键(peptide bond)。 二肽可视为一分子氨基酸中的-COO―与另一分子氨基 酸中的NH3+脱水二成的。肽也是以两性离子的形式存在。
OH
H+
等电点 脱水
OH
H+
- - 带负电荷 脱水
OH
H
+
- - - -
(五)蛋白质的颜色反应 蛋白质分子内含有许多肽键和某些带有特殊基团的 氨基酸残基,可以与不同试剂产生特有的颜色反应,利 用此性质可鉴别蛋白质。
反应名称 试剂 颜色 作用基团 缩二脲反应 强碱、稀硫酸铜溶液 紫色或紫红色 肽键 茚三酮反应 稀茚三酮溶液 蓝紫色 氨基 蛋白黄反应 浓硝酸、再加碱 深黄色或橙红色 苯环 亚硝酰铁氢化钠 亚硝酰铁氢化钠溶液 红色 巯基
(五)氧化脱氨反应 氨基酸中的氨基能被 H2O2 或 KMnO4 等强氧化剂所氧 化,脱氨而生成α―酮酸。
[O]
R CH COOH NH2
R CH COOH + H2O NH
R C COOH + NH3 O
(六)氨基酸与亚硝酸的反应 氨基酸与亚硝酸作用,可定量释放氮气
+ NH3 R CH COO
+ H2NO2
使蛋白质发生沉淀的现象称为盐析(saltingout)。常用
的盐析剂有(NH4)2SO4、Na2SO4、NaCl和MgSO4等。
有机化学氨基酸
氨基酸、多肽与蛋白质
Ⅰ、氨基酸
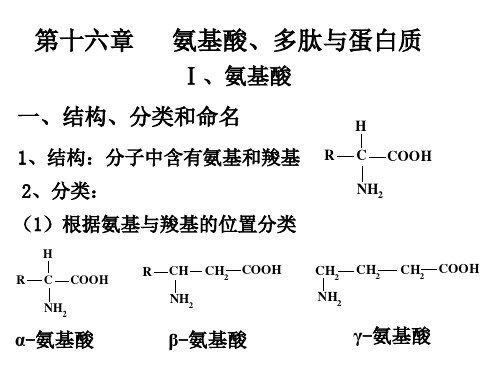
一、结构、分类和命名
1、结构:分子中含有氨基和羧基
R
H C NH2 COOH
2、分类:
(1)根据氨基与羧基的位置分类
H R C NH2 COOH
R
CH NH2
CH2 COOH
CH2 NH2
CH2
CH2 COOH
α-氨基酸
β-氨基酸
γ-氨基酸
中性氨基酸
(2) 碱性氨基酸
水蛭素多肽——抗血栓分子药理 1884年Haycraft首先发现新鲜医用水蛭Hirud medicinalis提取物含抗凝血物质,但直至1955年Mark wardt等从医用水蛭中才分离出水蛭素(hirudin,HV),共有 7种异构体。1984年Dodt首先测出其一级结构,确认HV是 一条含65个左右氨基酸的多肽。HV酶是血液凝固、止血过程 和血栓形成的中心酶之一。它专一性地水解纤维蛋白原上的 Agr-Gly键,使之转变成纤维蛋白;纤维蛋白相互作用会进一 步形成血栓。HV的2个结构域通过不同的机制分别和凝血酶 相互作用,抑制其活性。其C端长链通过和凝血酶的纤维蛋白 原识别部位结合,拮抗凝血酶对纤维蛋白原的识别。而HV的N 末端核心结构域通过和凝血酶的活性部位结合而抑制它的催 化活性。临床实验结果也表明,HV的抗栓作用不需要其它因 子的作用;又不会引起出血等副作用。其效果超过小分子肝 素。因此被认为是2010年前最强的可逆性凝血酶直接抑制剂。 全球约有20亿美元市场销售量。
+
O
C O
内盐(偶极离子或两性离子)
-
+
HC l
RCH
+
COOH
+
Cl
NH3
不同分子量肽的氨基酸组分

不同分子量肽的氨基酸组分
肽是由氨基酸通过肽键连接而形成的一类化合物,其分子量大小不同,可以分为小肽、寡肽、多肽和蛋白质。
以下是这些不同分子量肽的氨基酸组分特点:
1. 小肽:通常指的是由2-4个氨基酸组成的高活性肽。
这类肽的氨基酸组分相对较少,但它们在生物体内具有重要的生理功能,如调节代谢、促进生长等。
2. 寡肽:由2-10个氨基酸组成的肽,分子量一般在1000道尔顿以下。
寡肽的氨基酸组分相对较为简单,但它们在生物体内同样发挥着重要的生理作用,如抗菌、抗氧化等。
3. 多肽:由10-50个氨基酸组成的肽。
多肽的氨基酸组分相对较为复杂,可以包含多种不同的氨基酸。
这些多肽在生物体内具有广泛的生理功能,如激素、酶、抗体等。
4. 蛋白质:一般由51个以上氨基酸组成的肽。
蛋白质的氨基酸组分非常复杂,可以包含20种不同的氨基酸,且每种氨基酸的数量和排列顺序都不同。
蛋白质是生物体内最重要的分子之一,它们参与生物体的各种生理和生化过程,如酶催化、结构支撑、物质运输等。
植物蛋白的组成 球蛋白

植物蛋白的组成球蛋白
植物蛋白是指从植物中提取的蛋白质,它们的组成可以因植物
种类而异。
一般来说,植物蛋白的主要组成成分包括氨基酸、多肽
和蛋白质结构。
氨基酸是蛋白质的基本组成单位,植物蛋白中所含的氨基酸种
类和含量因植物种类而异。
一些植物蛋白质含有全部人体必需的氨
基酸,称为完全蛋白质,例如大豆蛋白和藜麦蛋白,而一些植物蛋
白质可能缺乏一些必需氨基酸,如赖氨酸或色氨酸,这些被称为不
完全蛋白质。
因此,植物蛋白的氨基酸组成对其营养价值非常重要。
多肽是由氨基酸通过肽键连接而成的较小的蛋白质分子,它们
也是植物蛋白的重要组成部分。
多肽的种类和含量因植物种类和提
取方法而异。
球蛋白是一种主要的蛋白质结构,它在植物蛋白中起着重要作用。
球蛋白具有特定的空间结构和功能,它们可以影响植物蛋白的
可溶性、稳定性和功能性。
不同的植物蛋白中球蛋白的含量和类型
也会有所不同。
总的来说,植物蛋白的组成包括氨基酸、多肽和蛋白质结构,它们的种类和含量因植物种类而异,这也决定了植物蛋白的营养价值和功能特性。
对于球蛋白的了解,可以帮助我们更好地理解植物蛋白的特点和应用。
氨基酸,多肽,蛋白质的关系

氨基酸,多肽,蛋白质的关系
氨基酸是构成蛋白质的基本单元,是一类含有羧基(-COOH)和氨
基(-NH2)的有机分子。
它们通过共价键结合形成多肽,多个多肽之
间再形成蛋白质。
氨基酸在蛋白质中的序列是非常重要的,因为它们决定了蛋白质
的结构和功能。
蛋白质的结构包含着四个层次:一级结构、二级结构、三级结构和四级结构。
一级结构是氨基酸序列的线性排列;二级结构
包括α螺旋和β折叠;三级结构是主链的三维摆动,使得氨基酸侧
链在空间上排列成为蛋白质的特定形状;四级结构是由两个或多个链
相互作用而形成的复杂蛋白质结构。
蛋白质的功能非常广泛,包括结构支持、酶催化、信号传导和免
疫保护等。
每个蛋白质的功能都与它的结构密切相关,因此对于蛋白
质的结构和功能的研究非常关键。
一种具有特定功能的蛋白质的序列通常由数百个甚至上千个氨基
酸组成。
不同的氨基酸组成不同的序列,则产生不同的蛋白质结构和
功能。
在人体中,氨基酸可以由体内合成或外源性摄取获得。
不同种类
的氨基酸在人体中的相对含量不同,因此也影响了蛋白质的合成和功能。
总之,氨基酸、多肽和蛋白质之间是密不可分的关系。
氨基酸是
构成蛋白质的基本单元,而多个氨基酸结合形成多肽,多个多肽之间
再形成蛋白质。
蛋白质的序列和结构决定了其功能,因此研究氨基酸、多肽和蛋白质的相互关系对于解决人类健康问题具有重要意义。
16 氨基酸、多肽、蛋白质

氨基酸、多肽、蛋白质
内容
第一节 氨基酸 第二节 多肽 第三节 蛋白质简介
第十六章 氨基酸、多肽、蛋白质
1
蛋白质:
含氮的天然高聚物,生物体内一切组织的基本组成部分。 除水外,细胞内80%都是蛋白质。在生命现象中起重要的作 用。人类的主要营养物质之一。
如:
酶(球蛋白)——机体内起催化作用 激素(蛋白质及其衍生物)——调解代谢 血红蛋白——运输O2和CO2 抗原抗体——免疫作用
CH2 O C Cl + NH2 CH COOH
O
R
CH2 O C NH CH COOH
苄氧甲酰氯的酰基易引入,对以后应用的种种试剂较稳定,同时 还能用多种方法把它脱下来。
(2)氨基的烃基化: (与RX作用)
NO2
NO2
R
F + NH2 CH COOH
NO2
NO2 R NH CH COOH
氟代二硝基苯在多肽结构分析中用作测定N端的试剂。
丝胺酸 Ser
COOH N
H
NH2
HO
CH2CH COOH
脯胺酸 酪胺酸
pro Tyr
NH2 CH2CH COOH
N H
*色胺酸 Trp
第十六章 氨基酸、多肽、蛋白质
等电点 5.47 5.68 6.30 5.66 5.89
7
结构 II 酸性
NH2 HOOC CH2CH COOH
NH2 HOOC (CH2)2CH COOH
COOH
H2N
H
第十六章 氨基酸、多肽、蛋白质
CH2SH 4
下列19种氨基酸可组成无数蛋白质:
结构
名称
缩写
等电点
十五 氨基酸、多肽、蛋白质、核酸

DNA OH H OH H 核糖 核苷酸 H OH H 核苷 O NH2 N N HN N 碱基 N N H2N N N H H
磷酸 腺嘌呤(A)
HO
NH2 N O N H
O HN O N H
CH3
鸟嘌呤(G) 胞嘧啶(C) 胸腺嘧啶(T)
二 核酸的结构
HO
A O H H O P O H H O O P O H H O O P O OOO H H H OO H H H C H H H G
(3) 变性 蛋白质受热、紫外线及某些化学试剂(如HNO3、 Cl3CCOOH、苦味酸、单宁酸、重金属盐Cr3+、Hg2+、As3+等) 作用时,蛋白质的结构、性质发生变化,失去生理活性。如煮鸡 蛋、生皮鞣制等。蛋白质的变性一般为不可逆的。
第三节
一 核酸的组成
核酸
根据所含糖不同,将核酸分核糖核酸(RNA)和脱氧核糖核酸(DNA)
3
CH2CH2-NH2 N NH 组胺
组氨酸
4
氨基和羧基的反应
A 脱水反应 -氨基酸失水
O H3C H2N CH3 H3C HN O O NH CH3
C OH HC CH + HO C NH2 O
-氨基酸失水
环状交酰胺
R CH CH2 COOH NH2
R CH CH COOH + NH3
, -不饱和酸
1 定义
多肽与蛋白质
由氨基酸相互脱水形成的聚酰胺称为肽(peptides)或蛋白质
肽键
N端
H O H O O H O H + NH3 C C N C C N C C N C C H R2 H R3 H R4 OR1
四肽
氨基酸多肽及蛋白质

O
N H 2
O O+R C H 2C H C O O H
荧 光 胺
C O O H
RC H
N
+H 2 O
O O
*
食品化学 第六章 食品中的氨基酸、多肽及蛋白质类物质
生物活性肽也称作功能肽,是近年来非常活泼的研究领域,其应用涉及 到生物学、医药学、化学等多种学科,在食品科学研究及功能食品开发中 也显示出美好的前景。
去除正电荷
琥珀酸酐
O R NHCCH3
在Lys上引入正电荷
硫代仲康酸**
O C O O H 在Lys残基引入巯基
R N H C C H 2C H C H 2SH
*
食品化学 第六章 食品中的氨基酸、多肽及蛋白质类物质
官能团及反应
试剂及条件
产物
评价
6.芳基化
FDNB***
NO2
R NH
NO2
氨基酸序列测定
官能团及反应
氨基酸和蛋白质中官能团的化学反响性
试剂和条件
产物
评论
A.非α氨基 1.还原甲基化 2.胍基化 3.乙酰化 4.琥珀酰化 5.巯基化
甲醛、NaBH4 邻甲基异脲*,pH10.6,4℃,4d
+
R NHCH 32
+
NH2
R NHCNH2 O
蛋白放射性标记 Lys转换成Arg
乙酸酐
R NHCCH3
感染性疾病曾一度是人类生存所面临的最大威胁。随着抗生素的创造 和广泛使用,感染性疾病得到了一定程度的控制,但仍然是人类死亡的 一个重要原因。据WHO报告,2000年全球死亡人数5570万,其中 1440万由感染性疾病引起,占总死亡人数的15.9%。过去的几十年里, 耐药性微生物的不断产生和生物耐药性问题的日益恶化,开发新的抗感 染药物已成为治疗感染疾病的必由之路。昆虫抗菌肽因其独特的抗菌、 杀菌效果和良好的应用前景近来成为抗感染新药开发的热点。*目前国外
氨基酸、多肽和蛋白质

氨基酸、多肽和蛋白质1氨基酸1.1结构特征标准氨基酸:至少有一羧基(carboxyl )和一氨基连接在同一个碳原子上(该碳原子称为α-碳原子)。
注意,脯氨酸含亚氨基。
构成蛋白质的氨基酸是 20 种标准氨基酸(可能含有非标准氨基酸,标准氨基酸经修饰而形成的)。
最近又发现了两种标准氨基酸。
标准氨基酸中, 1806 年发现第一种氨基酸——天冬酰胺,1938年发现最后一种——苏氨酸。
3α-碳是手性中心(大多数情况下,只有α-碳是手性中心;甘氨酸无手性,因R 基为 H)。
其绝对构型采用 D,L 系统,建立在L- 甘油醛( L-glyceraldehydes)和 D- 甘油醛的结构之上。
D 、 L 构型与其实际的旋光性无关。
到目前为止在蛋白质中发现的氨基酸都是L 的(酶的活性位点是不对称的,即酶促反应是在手性环境下进行的), D 仅存在于细菌细胞壁上的短肽和抗生素小肽。
1.2分类非标准氨基酸是标准氨基酸的衍生物(derivative )。
根据 R 基的不同性质将氨基酸进行分类,按其极性或在生理pH (近 7.0 )下与水相互作用的趋势分为 5 类:非极性脂肪族、芳香族、极性不带电、带正电(碱性)、带负电(酸性)。
非极性脂肪族:甘氨酸、丙氨酸、缬氨酸、亮氨酸、甲硫氨酸、异亮氨酸。
(衣架凉鞋饼干=异亮、甲硫、亮、缬、丙、甘)芳香族:苯丙氨酸、酪氨酸、色氨酸。
(食老本(粤语)=色、酪、苯丙)极性不带电:丝氨酸、苏氨酸、半胱氨酸、脯氨酸、天冬酰胺、谷胺酰胺。
(诗书伴琴谱=丝、书、半胱、脯;天冻先安谷=天冬、酰胺、谷)带正电:赖氨酸、精氨酸、组氨酸。
(组队来京晋见=组、赖、精、碱性)带负电:天冬氨酸、谷氨酸。
(天上的谷子很酸=天、谷、酸性、都是氨酸)酪氨酸苯环上有羟基;丝氨酸和苏氨酸有羟基;半胱氨酸有巯基可成对形成二硫键;组氨酸是唯一一个具接近的 pK a值电离侧链的氨基酸,常作为质子供体和受体;天冬氨酸和谷氨酸都有两个羧基。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
37
Peptide Bonds
肽键的平面特征
38
二硫键( Disulfide bond )
2 R SH 氧化 RS SR
硫醇
二硫化物
RS SR 还原 2 R SH 巯基
39
Disulfide Bonds(二硫键)
苯丙氨酸 脯氨酸 门冬氨酸 赖氨酸
(1)pH=7.0 (2)pH=6.0 (3)pH=5.0 (4)pH=2.0
负 阳极 负 阳极 负 阳极 正 阴极
负 阳极 正 阴极 负 阳极 正 阴极 正 阴极 正 阴极 负 阳极 正 阴极 正 阴极 正 阴极 正 阴极 正 阴极
31
第十七章 氨基酸、多肽和蛋白质 第二节 肽
肽链骨架: 所有链状多肽都有一个共同的骨架
上页 下页 首页 35
❖ 命名:以C-末端的氨基酸为母体,其它 氨基酸残基称氨酰依次命出。
H3N+ CH CONH CH CONH CH COO -
❖ 三肽C(trHip3eptide)。
CH2SH
CH2CH(CH3)2
❖ 丙氨酰半胱氨酰亮氨酸
❖ 缩写成:丙-半胱-亮 或 Ala-Cys-Leu
❖ 体内不能合成,必需由食物提供的氨基酸。
13
修饰氨基酸的结构
+NH3
COOC H +NH3 CH2 S S
COOCH CH2
L-胱氨酸
L-羟脯氨酸
HO
N+ HH
COO-
H3N+CH2CHCH2CH2CHCOO-
OH
NH2
NH2 H2N+ CH2CH2CH2CH2CH CO2-
CH3
L-羟赖氨酸
L-甲赖氨酸
H
H2C
imidazole HN
NH
Histidine 组氨酸
Basic amino acids —— containing two amino groups 12
必需氨基酸( 8种)
❖ 三字符:Val,Leu,Ile, Thr, Met,Trp, Lys, Phe ❖ 中文名:缬、亮、异亮、苏、蛋、色、赖、苯丙
17
(一)物理性质
1) 酸碱性 (acid-base properties) 氨基酸既是酸又是碱
2) 易于水,不溶于非极性溶剂。 3) 固体熔点高(200-300℃) 4) 旋光性 (optical activity)
COO+H3N C H
R
氨基酸的结构
存在形式:
氨基酸在结晶状态或在接近中性的溶液中是以两性离 子 (dipolar ion) 的形式存在的,是一种内盐 (inner salt)
10
4. Negatively charged R groups (2)
COO-
+H3N
H
CH2 COO-
Aspartate (Asp) 门冬氨酸
COO-
+H3N
H
CH2 CH2 COO-
Glutamate(Glu)
谷氨酸
Acidic amino acids—containing two carboxylic groups
重庆医科大学
有机化学
( 第六版 倪沛洲)
杨晓兰
1
第十六章 氨基酸、多肽 和蛋白质
Amino Acids, Peptides and Protein
2021/3/7
2
主要内容
❖第一节 氨基酸(Amino Acid) ❖第二节 多肽(Peptides) ❖第三节 蛋白质(Proteins)
3
第一节 氨基酸(Amino Acids)
CHO
HO
H
CH2OH
COOH
H2N
H
R
L-甘油醛 ❖ L-氨基酸
(对照标准)
S-
COOH
H2N
H
CH2SH
L-半胱氨酸
R-半胱氨酸
6
(二)分类
分
类
酸性氨基酸
中性氨基酸
碱性氨基酸
- COOH 2个 1个 1个
-NH2
氨基酸(数)
1个
2个
1个
15个
2个
3个
7
(二)结构和命名
1. Nonpolar, aliphalic R groups (6)
酪氨酸
N H Tryptophan (Try) 色氨酸
UV 特征吸收:l = 280 nm
9
3. Polar, uncharged R groups (6)
COO-
+H3N
H
CH2OH
Serine (Ser) 丝氨酸
COO-
+H3N
H
CHOH
CH3 Threonine (Thr)
苏氨酸
COO-
+H3N
Isoleucine (Ile) 异亮氨酸
*
COO-
骨
架
变 化
+H2N
Proline (Pro) 脯氨酸 8
2. Aromatic R groups (3)
COO-
+H3N
H
CH2
COO-
+H3N
H
CH2
COO-
+H3N
H
CH2
Phenylalanine (Phe) 苯丙氨酸
OH Tyrosine (Tyr)
❖ 简写成:A-C-L 思考题: Ser-Gly-Tyr-Ala-Leu 与 Leu-Ala-Tyr-Gly-Ser 相同吗?
36
肽键平面
❖ 肽单元(-C-CO-NH-C-) ❖ 特征: ❖ (1)肽单元是平面结构。 ❖ (2)肽键具有局部双键性质。 ❖ (3)肽键呈反式构型 与C-N键相连的O与H或两个C原子之间一般呈较稳定的
24
氨基酸的电泳示意图
PH
精氨酸 丙氨酸 天冬氨酸
2
正电荷/负级 正电荷/负级 正电荷/负级
7
正电荷/负级 负电荷/正级 负电荷/正级
8.5
正电荷/负级 负电荷/正级 负电荷/正级
25
2、脱羧反应(decarboxylation)
R
NH3+ CH COO-
OH-
R CH2 NH2 CO2
CH2 CH CO2-
COO-
+H3N
H
H
Glycine (Gly) 甘氨酸
COO-
+H3N
H
CH3
Alanine (Ala) 丙氨酸
COO-
+H3N
H
CH(CH3)2
Valine (Val) 缬氨酸
COO-
+H3N
H
CH2 CH(CH3)2
Leucine (Leu) 亮氨酸
COO-
+H3N
H
CH(CH3) CH2CH3
(肽键) 连接而成的一类化合物。其通式为:
RO
R’ O
H2N C-C-OH + H N C-C-OH
H
HH
A氨m基ino酸acid
A氨m基ino酸acid
R O R’ O H2N-C-C-N-C-C-OH + H2O
H HH 二肽
多肽分子中的酰胺键称为肽键(peptide bond), 一般为 α-COOH 与 α-NH2 脱水缩合而成。
❖ 一、结构、分类与命名 ❖ 二、性质 ❖ (一)物理性质 ❖ (二)化学性质
4
一、结构、分类与命名 (一) 氨基酸的结构
COOH H2N H
R
L--amino acid
COOH H NH2
R
D--amino acid
• 20 standard amino acids in proteins
5
2、结构表示
一、肽的结构和命名
虽有环肽存在, 但绝大多数的肽呈链状, 称为多肽链
H3N+ CH CO NH CH CO NH CH CO
R1
R2
R3
NH CH CO2H Rn
N-末端(N-terminal end):保留游离α-NH2 的一端, 也叫氨基末端,一般写在肽链的左边。
C-末端(N-terminal end) : 保留有 α-CO2H 的一端, 也叫羧基末端, 通常写在肽链的右边。
定义:在某一pH 值下,氨基酸所带正电荷的数 目与负电荷的数目正好相等,即净电荷为零, 该 pH 值为该氨基酸的等电点 (pI)。
等电点时 ❖ 1、amino acids 几乎全部以两性离子 I 的形式存在
(并伴以极少量的阳性离子 和阴性离子 ) ❖ 2、氨基酸的溶解度最小
22
(1)氨基酸结构的影响
R3
R4
肽
十肽以下的称为寡肽(oligopeptide) 大于十肽的称为多肽(polypeptide) 肽中的氨基酸单位称为氨基酸残基(amino acid residue)
上页 下页 首页 33
自然界存在多种肽类物质
L-Val L-Orn
L-Val HOOC
H
S
NR
O N
O D-Cys
Penicilline
L-Pro
L-Leu
L-Phe
D-Phe
L-Lue
L-pro
D-Orn L-Val
▪ 青霉素
gramicidin S
短杆菌肽S
脑啡肽 Tyr-Gly-Gly-Phe-Leu leucine enkephalin Tyr-Gly-Gly-Phe-Met methionine enkephalin 34
