化工热力学实验指导书
北京石油化工学院热能与动力工程专业实验指导书(第一版)

实验一温度测量温度测量是热能与动力工程测试技术的基本实验之一。
本实验目的是用热电偶测温仪和红外线测温仪分别测量高温、中温、低温物体的温度。
分析其测量结果的异同。
并了解热电偶测温和红外线测温原理异同。
【实验目的和要求】1、熟悉表面温度计、HI98701热电偶测温仪(打印式)、雷泰红外线测温仪LRL3、时代红外线测温仪的使用方法,以及热电偶测温和红外线测温原理异同。
2、使用表面温度计、HI98701热电偶测温仪的四种探头、雷泰红外线测温仪LRL3、时代红外线测温仪测量人体表面温度、过热蒸汽温度、锅炉炉膛温度、分析测量结果的异同。
【实验原理及装置】1、实验原理热电偶测温工作原理:参照《热能与动力工程测试技术》课本热电偶测温一节。
红外测温原理:红外测温仪与人眼很接近,红外测温仪中有一组透镜,该透镜将物体发射出的红外辐射汇聚到探测器上,探测器被汇聚光线照射便产生信号,该信号被传到后面电路;而人眼是将光线汇聚到视网膜上,视网膜受到阳光的刺激向大脑发出信号。
后面电路在对其进行处理并计算出物体的温度。
物体所发出的红外辐射能量的强度与其温度呈正比例,物体温度越高,所发出的辐射能量越强。
一般用黑体来标定非接触式温度测量仪器。
黑体是极好辐射源,它可发射或接收所有的辐射能量而无反射或透射,黑体的辐射率为1.00。
下图为黑体的辐射能量随温度及波长的变化曲线。
许多物体的发射率小于1,但在红外波段中的所有波长处的发射率值是非常一致的,此类物体称为灰体。
测量时应调节发射率值使之与所测物体的发射率相一致,这样测得的温度为真实温度。
附录3列出了常见物体(金属和非金属)的发射率值。
便携式红外测温仪无需接触物体即可测量物体表面温度。
它接受所测目标辐射的红外波段能量,然后计算其表面温度。
也可计算出测量过程中的平均温度、最高温度、和差值,并将其在显示板上显示出来,单位为摄氏度或华氏度。
其数字/模拟输出可用于数据记录、调节其他仪器设备或工艺控制器,也可实现温度测量值和发射值的远程显示。
工程热力学实验指导书讲解

实验一 空气定压比热容测定一、实验目的1.增强热物性实验研究方面的感性认识,促进理论联系实际,了解气体比热容测定的基本原理和构思。
2.学习本实验中所涉及的各种参数的测量方法,掌握由实验数据计算出比热容数值和比热容关系式的方法。
3.学会实验中所用各种仪表的正确使用方法。
二、实验原理由热力学可知,气体定压比热容的定义式为()p p hc T∂=∂ (1) 在没有对外界作功的气体定压流动过程中,p dQ dh M=, 此时气体的定压比热容可表示为p p TQM c )(1∂∂=(2) 当气体在此定压过程中由温度t 1被加热至t 2时,气体在此温度范围内的平均定压比热容可由下式确定)(1221t t M Q c p t t pm-=(kJ/kg ℃) (3)式中,M —气体的质量流量,kg/s;Q p —气体在定压流动过程中吸收的热量,kJ/s 。
大气是含有水蒸汽的湿空气。
当湿空气由温度t 1被加热至t 2时,其中的水蒸汽也要吸收热量,这部分热量要根据湿空气的相对湿度来确定。
如果计算干空气的比热容,必须从加热给湿空气的热量中扣除这部分热量,剩余的才是干空气的吸热量。
低压气体的比热容通常用温度的多项式表示,例如空气比热容的实验关系式为3162741087268.41002402.41076019.102319.1T T T c p ---⨯-⨯+⨯-=(kJ/kgK)式中T 为绝对温度,单位为K 。
该式可用于250~600K 范围的空气,平均偏差为0.03%,最大偏差为0.28%。
在距室温不远的温度范围内,空气的定压比热容与温度的关系可近似认为是线性的,即可近似的表示为Bt A c p += (4)由t 1加热到t 2的平均定压比热容则为m t t t t pm Bt A tt B A dt t t Bt A c+=++=-+=⎰221122121(5) 这说明,此时气体的平均比热容等于平均温度t m = ( t 1 + t 2 ) / 2时的定压比热容。
工程热力学实验指导书(三个实验)

工程热力学课程实验指导书兰州理工大学2006年6月实验1空气定压比热测定实验指导书一、实验目的1.掌握气体比定压热容的测量原理及其操作方法;2.掌握本实验中测温、测压、测热、测流量的方法;3.掌握由基本数据计算比热值的方法;4.分析实验产生误差的原因及减小误差的可能途径。
二、实验装置如图1.1所示,本实验装置由风机、流量计、比热仪主体、调压器和功率表等组成。
实验时,被测空气由风机经流量计送入比热仪主体,经加热、均流、旋流、混流后流出。
比热仪主体构造如图1.2所示,由多层杜瓦瓶、电热器、均流阀、绝缘垫、旋流片、混流网、出口温度计等组成。
气体的流量由节流阀调节,比热仪出口温度由电加热器输入功率来控制。
比热仪可测200℃以下气体的定压比热。
图1.1 比热仪全套装置图1.2 比热仪主体三、实验原理根据气体平均定压比热定义,当气体在定压加热过程中温度由t1升到t2时,其平均定压比热可以由下式确定:21,21|()ptp m tmQcq t t=-J/(kg.℃)式中:Q p-湿空气在定压加热过程中的吸热量J/sq m-湿空气的质量流量kg/s湿空气是干空气和水蒸气的混合物,当湿空气中水蒸气含量较少,分压力较低时,水蒸气可以当作理想气体处理。
显然,当已知湿空气中水蒸气的吸热量Q v时,干空气的定压比热可由下式确定:21,,21|()p v t pm a t m a Q Q c q t t -=- J /(kg.℃)式中: Q p -湿空气在定压加热过程中的吸热量 J /s Q v -水蒸气的吸热量 J /s q m ,a -干空气的质量流量 kg /s由1t 加热到2t 的平均定压比热则可表示为:()212112,212t t t p m t a bt dt t t ca bt t ++==+-⎰ 若以(t 1+t 2)/2为横坐标,21,t p mt c 为纵坐标,如图3所示,则可根据不同温度范围的平均比热确定截距a 和斜率b,从而得出比热随温度变化的计算式。
热工实验指导书(2009.2)

热工实验指导书唐慕萱王素美姜慧娟东南大学能源与环境学院二O O九年二月目录实验一空气定压比热容测定 (2)实验二空气绝热指数的测定 (7)实验三喷管实验—气体在喷管中流动性能的测定 (11)实验四管道沿程阻力测定 (19)实验五圆柱、机翼等物体的绕流流动显示观察 (24)实验六绕圆柱体压力分布的测定 (26)实验七稳态双平板法测定非金属材料的导热系数 (30)实验八恒热流准稳态平板法测定材料热物性 (34)实验九空气横掠圆柱体时局部换热系数的测定 (39)实验十辐射换热角系数的测定 (49)实验十一材料表面法向热发射率(黑度)的测定 (52)附录 (56)实验一空气定压比热容测定一、实验目的1.增强热物性实验研究方面的感性认识,促进理论联系实际,了解气体比热容测定的基本原理和构思。
2.学习本实验中所涉及的各种参数的测量方法,掌握由实验数据计算出比热容数值和比热容关系式的方法。
3.学会实验中所用各种仪表的正确使用方法。
二、实验原理由热力学可知,气体定压比热容的定义式为()p p hc T∂=∂ (1) 在没有对外界作功的气体定压流动过程中,p dQ dh M=, 此时气体的定压比热容可表示为p p TQM c )(1∂∂=(2) 当气体在此定压过程中由温度t 1被加热至t 2时,气体在此温度范围内的平均定压比热容可由下式确定)(1221t t M Q c p t t pm-=(kJ/kg ℃) (3)式中,M —气体的质量流量,kg/s;Q p —气体在定压流动过程中吸收的热量,kJ/s 。
大气是含有水蒸汽的湿空气。
当湿空气由温度t 1被加热至t 2时,其中的水蒸汽也要吸收热量,这部分热量要根据湿空气的相对湿度来确定。
如果计算干空气的比热容,必须从加热给湿空气的热量中扣除这部分热量,剩余的才是干空气的吸热量。
低压气体的比热容通常用温度的多项式表示,例如空气比热容的实验关系式为3162741087268.41002402.41076019.102319.1T T T c p ---⨯-⨯+⨯-=(kJ/kgK)式中T 为绝对温度,单位为K 。
热力学-实验指导书

实验一 气体定压比热容测定实验一、实验目的1、了解气体比热容测定装置的基本原理和构思;2、掌握本实验热工参数温度、压力、湿度、热量、流量的测量方法。
二、实验原理可将本实验装置的本体部分简化为一开口稳定流动系统,本体部分保温非常好,近似无散热损失,且系统对外并无功的输出,当系统达到平衡时,工质的焓变等于电热器的放热量。
即:()Q t t c q P m =-12()[]12t t q Q c m P -=式中:c p 为空气的定压比热容,kJ/(kg ·℃)t 1为空气在本体部分的入口温度,℃ t 2为空气在本体部分的出口温度,℃ Q 为电加热器的放热量,kW q m 为空气的质量流量,kg/s本实验测定干空气的定压比热容,因此需额外测定湿空气的参数。
将水蒸气的影响从总量中除去,则利用上式可计算干空气的热容。
实验过程中要求测定三个不同温度下的定压比热容值。
测量与计算过程涉及参数较多,具体过程如下:1、根据流量计出口空气的干球温度和湿球温度,从湿度空气的焓湿图查出含湿量(d,g/kg 干空气),并根据下式计算出水蒸气的容积成分:622/1622/d d r w +=(1)2、电热器消耗的功率可由功率表读出,则单位时间电热器的放热量为:Q=kW IV 310⨯ (2)3、干空气流量为:s kg t h P r T R q p q b w og v g mg /)15.273(06.872100010)81.9)(1(0+⨯∆+-==τ (3)4、水蒸汽流量为:s kg to h P r T R q P q b w w vw mw /)15.273(51.614100010)81.9(0+⨯∆+==τ (4)5、水蒸汽吸收的热量为:()()[]kWt t t t q dtt q Q mw mw w 2122122100021.0850.1)00042.0850.1(-+-=+=⎰ (5)6、干空气的定压比热容为:⋅--=-=kg kJ t t q Q Q t t q Q cmg wmg g t t pm ()()(121221℃) (6)三、实验设备1、整个装置由风机、流量计、比热仪本体、电功率调测量系统组成,如图1所示。
工程热力学——实验指导书样本

《工程热力学》课程实验指导书实验一空气绝热指数测定一、实验目的1、测定空气的绝热指数K和空气的比热C P和G2、熟悉以绝热膨胀、定容加热基本热力过程为工作原理的测定绝热指数实验方法;3、演示刚性容器充放气过程的热过程现象二、实验装置及原理空气绝热指数测定装置如图所示,利用气囊往有机玻璃容器内充气,经过U 型压力计测出容器内压力P i,压力稳定后,突然打开阀门5并迅速关闭。
在此过程中,空气绝热膨胀,在U型压力计上显示出膨胀后容器内的空气压力P2;然后,持续一小时左右,使容器中的空气与实验环境的空气进行热交换,最后达到平衡,即容器中的空气温度与环境温度相等。
此时,U型压力计显示出温度平衡后容器中空气压力P3三、实验方法与步骤1、测试前的准备1) 将阀门5 的锥形塞拔出, 抹上一些真空油, 以改进阀门的密封性能。
抹油后安装就位并拧紧。
2) 在阀门5开放的情况下( 即容器与大气相通) , 用医用注射器将蒸馏水注入U型压力计120〜150mn左右的水柱高。
水柱内应不含气泡。
如有气泡,应设法排除。
3) 调整装置的水平位置,使U型压力计两水管中的水柱高在一个水平线上。
2、测试步骤1) 记录U 型空压计初始读数h0。
2) 关闭阀门5, 把容器拧紧。
3) 用气囊往有机玻璃容器内缓慢充气,容器内的压力由U型压力计的水柱差显示。
此时的压差150〜200mn水柱为宜。
待压力稳定后,记录下此时的压差值厶h。
4) 突然打开阀门5并迅速关闭。
空气绝热膨胀后,在U型管内显示出膨胀后容器的气压。
记录此时的压差值△ h2.5) 持续1〜2小时后, 待容器内空气的温度与测试现场的大气温度一致时, 记下此时容器内空气压力的压力差△ h a6) 一般要求重复三次测试, 取其测试结果的平均值。
四、实验注意事项1 、气囊往往要漏气, 充气后必须用夹子将胶皮管夹紧。
2、在测试过程, 测试现场的温度要求保持基本恒定。
不然, 很难测出可靠的数据。
2012《工程热力学》实验指导书

2012《⼯程热⼒学》实验指导书《⼯程热⼒学实验》指导书福州⼤学化学化⼯学院2012年11⽉实验1 ⽓体定压⽐热容测定实验⼀、实验⽬的1、了解⽓体⽐热测定装置的基本原理和构思;2、熟悉本实验中温度、压⼒、电加热功率、流量的测量⽅法;3、掌握由基本数据计算出定压⽐热容值和拟合⽐热容公式的⽅法;4、分析本实验产⽣误差的原因及减⼩误差的可能途径。
⼆、实验原理根据⽓体平均⽐定压热容的定义,当⽓体在定压加热过程中温度由t 1升为t 2时,⽓体的定压⽐热容可以表⽰为:()1221t t m Q c p t t p-=kJ/kg ?℃(1)式中:m ——湿空⽓的质量流量,kg/s ;p Q ——湿空⽓在定压加热过程中的吸热量,kJ/s 。
由于⽓体的实际定压⽐热是随温度的升⾼⽽增⼤,它是温度的复杂函数。
实验表明,理想⽓体的⽐热与温度之间的函数关系甚为复杂,但总可表达为:+++=2et bt a c p(2)式中a 、b 、e 等是与⽓体性质有关的常数。
例如空⽓的定压⽐热容的实验关系式:3102741087268.41002402.41076019.102319.1T T T c p ---?-?+?-=kJ/kg ?K式中:T ——绝对温度,K 。
该式适⽤于250~600K ,平均偏差为0.03%,最⼤偏差为0.28%。
由于⽐热随温度的升⾼⽽增⼤,所以在给出⽐热的数值时,必须同时指明是那个温度下的⽐热。
根据定压⽐热的定义,⽓体在t ℃时的定压⽐热等于⽓体⾃温度t 升⾼到dt t +时所需热量dq 除以dt ,即:dtdq c p =当温度间隔dt 为⽆限⼩时,即为某⼀温度t 时⽓体的真实⽐热。
如果已得出()t f c =的函数关系,温度由1t ⾄2t 的过程中所需要的热量即可按下式求得:()d t et bt a dt c q p ??+++==21221⽤逐项积分来求热量⼗分繁复。
但在离开室温不很远的温度范围内,空⽓的定压⽐热容与温度的关系可近似认为是线形的,即可近似表⽰为:bt a c p +=(3)则温度由1t ⾄2t 的过程中所需要的热量可表⽰为:()dt bt a q t t ?+=21(4)由1t 加热到2t 的平均定压⽐热容则可表⽰为:()221122121t t ba t t dt bt a ct t t t p ++=-+=? (5)⼤⽓是含有⽔蒸⽓的湿空⽓。
热力学实验设计与操作指南

热力学实验设计与操作指南引言:热力学实验是研究物质的热力学性质和相变规律的重要手段之一。
本指南旨在提供热力学实验设计与操作的指导,以确保实验过程准确可靠,并获得可靠的实验数据和结论。
一、实验目的热力学实验的目的是通过测量和分析物质在不同温度、压力和状态下的热力学性质,以验证热力学理论,并探索物质的相变规律和热力学参数。
具体实验目的根据不同的研究对象和目标而定。
二、实验器材与药品1. 实验器材:- 温度控制设备(热源、冷源等)- 压力计(压力传感器、压力传递装置等)- 热量测量仪器(热容计、热电偶等)- 混合设备(搅拌器等)- 数据记录仪器(计算机、数据采集器等)2. 实验药品:- 目标物质(研究对象,如液体、气体等)- 标定样品(已知热力学性质的样品)- 辅助试剂(溶剂、催化剂等)三、实验步骤1. 实验准备:- 检查实验器材的工作状态和准确度,确保设备正常运行; - 校准实验仪器,以获得准确的测量数据。
2. 样品制备:- 准备目标物质样品并确保其纯度和浓度;- 选择合适的浓度范围,并根据实验目的进行稀释或浓缩。
3. 实验操作:- 设定实验温度、压力等条件,并保持稳定;- 开始数据记录,包括温度、压强、热量等参数的测量; - 进行相变实验,记录相变温度、热容等数据。
4. 结果分析:- 进行数据处理和统计分析;- 绘制曲线图或热力学图谱,以便观察和比较实验结果; - 根据实验数据,计算热力学参数如焓变、熵变等。
5. 实验总结与结论:- 总结实验过程中的关键问题和挑战,并提出改进建议;- 根据实验结果得出结论,并与热力学理论进行对比;- 讨论实验的不确定度和误差来源。
四、实验注意事项1. 实验操作应遵循实验室安全规范,确保个人和环境安全;2. 实验器材应经过校准和检修,确保精度和可靠性;3. 实验样品的准备应遵循正确的操作步骤和配比;4. 实验环境应保持稳定,防止外界因素对实验结果的干扰;5. 实验数据记录和处理应精确和细致,避免误差和遗漏。
《工程热力学》试验指导书

《工程热力学》实验指导书赵文彬实验一 气体定压比热容测定实验一、实验目的1、了解气体比热测定装置的基本原理和构思。
2、熟悉实验中测温、测压、测热、测流量的方法。
3、掌握由基本数据计算出比热值和比热公式的方法。
4、分析本实验产生误差的原因及减小误差的可能途径。
二、实验原理引用热力学第一定律解析式,对可逆过程有:pdv du q +=δ 和 vdp dh q -=δ 定压时0=dppp T h dT vdp dh dT q c ⎪⎭⎫ ⎝⎛∂∂=⎪⎭⎫ ⎝⎛-=⎪⎭⎫ ⎝⎛=δ 此式直接由p c 的定义导出,故适用于一切工质。
在没有对外界作功的气体的等压流动过程中:p Q mdh δ1=则气体的定压比热容可以表示为:()1221t t m Q c p t t pm-=kJ/kg •℃式中:m ——气体的质量流量,kg/s ;p Q ——气体在等压流动过程中的吸热量,kJ/s 。
由于气体的实际定压比热是随温度的升高而增大,它是温度的复杂函数。
实验表明,理想气体的比热与温度之间的函数关系甚为复杂,但总可表达为:+++=2et bt a c p式中a 、b 、e 等是与气体性质有关的常数。
在离开室温不很远的温度范围内,空气的定压比热容与温度的关系可近似认为是线形的,假定在0-300℃之间,空气真实定压比热与温度之间进似地有线性关系:bt a c p +=则温度由1t 至2t 的过程中所需要的热量可表示为:()dt bt a q t t ⎰+=21由1t 加热到2t 的平均定压比热容则可表示为:()221122121t t ba t t dtbt a ct t t t pm ++=-+=⎰ 若以(t 1+t 2)/2为横坐标,21t t pmc 为纵坐标(如下图所示),则可根据不同温度范围的平均比热确定截距a 和斜率b,从而得出比热随温度变化的计算式bt a +。
大气是含有水蒸气的湿空气。
当湿空气气流由温度1t 加热到2t 时,其中水蒸气的吸热量可用式下式计算:()dt t m Q t t w w ⎰+=210001172.0844.1式中:w m ——气流中水蒸气质量,kg/s 。
化工热力学实验

测定CO2的p-V-T关系
实验装置 压力台 恒温器 试验本体及其防护罩
实验设备及原理
对简单可压缩热力系统,当工质处于平衡状态时,其状态参效p、V、T之间有:
f(p,V,T)=0
或 T=f(p,V) (1)
本试验就是根据式(1),采用定温方法来测定CO2 p-V之间的关系,从而找出CO2的p-V-T的关系。
01
实验中取h时,水银柱液面高度的读数要注意,应使视线与水银柱半圆形液面的中间对齐。
02
注意以下几点:
简述实验原理及过程。
1
各种数据的原始记录。
2
计算及在p-V图上画出等温线。
3
将实验测得的饱和温度与饱和压力的对应值与有关资料上数据进行比较,p-T图。
4
将实验测得的临界比容Vc与理论计算值列表比较其差异及原因。
5
实验讨论。
6
五、实验报告
03
04
实验原理:
装好实验设备,开启试验台本体上的日光灯
使用恒温器调定温度
加压前的准备
做好实验的原始记录
测定低于临界温度t=25℃时的定温线
测定临界等温线和临界参数,观察临界现象
测定高于临界温度t=40℃时的等温线
四、实验步骤
已知CO2液体在25℃,7.8MPa时的比容 ν(25℃,7.8MPa )=0.00124m3/kg 如前操作实地测出本试验台CO2在25℃,7.8MPa时的CO2液柱高度Δh*(m)
二氧化碳临界状态观测 及p-V-T关系测定
单击此处添加副标题
单击此处添加正文,文字是您思想的提炼,请尽量言简意赅的阐述观点。
了解CO2临界状态的观测方法,增加对临界状态概念的感性认识。
工程热力学实验指导书

《工程热力学》实验指导书工程热物理教研室编华北电力大学(北京)二 00六年十月前言1.实验总体目标通过实验能更好地理解工程热力学的一些现象和结论。
学习一些实验仪器的使用方法。
学习实验数据的处理方法。
⒉适用专业热能与动力工程、建筑环境与设备工程、核科学与核工程⒊先修课程高等数学、大学物理⒋实验课时分配⒌实验环境实验室环境干净整洁,水电齐全,能够满足实验的要求。
在醒目的地方有实验原理的说明,便于教师讲解和学生熟悉实验的步骤。
⒍实验总体要求通过实验能够帮助学生更好地理解工程热力学的一些基本原理。
指导教师要提前做好准备,提高实验的效率。
学生要提前预习实验的内容和要求(特别是注意事项),以免发生危险和损坏实验设备。
按指导教师的要求书写实验报告,及时上交。
⒎本实验的重点、难点及教案方法建议本实验的重点是气体定压比热容实验、二氧化碳压缩综合实验和喷管实验,这三个实验都是综合性实验,涉及到水浴的使用,真空泵的使用,表压力及真空度和绝对压力的关系,等等,需要大家对工程热力学的基本内容有清楚的了解。
难点是在临界温度下定温压缩二氧化碳时不好把握,绘出来的图和理想压缩有较大的差别,另外,如何通过间接方法求出二氧化碳的比体积也有一些技巧。
教案方法:学生提前预习,做实验之前老师提问;学生仔细观察指导教师的演示;实验室对学生开放,一次没有做成功,或者想更好地掌握实验技巧的学生,可以跟指导教师预约时间另做。
目录实验一、气体定压比热容实验 (3)实验二二氧化碳综合实验 (8)实验三喷管特性实验 (14)…实验一气体定压比热容实验一、实验目的1.了解气体比热容测定装置的基本原理和构思。
2.熟悉本实验中测温、测压、测热、测流量的方法。
3.掌握由基本数据计算出比热值和比热公式的方法。
4.分析本实验产生误差的原因及减小误差的可能途径。
二、实验类型综合性实验三、实验仪器实验所用的设备和仪器仪表由风机、流量计、比热仪本体、电工率调节测量系统共四部分组成,实验装置系统如图1-1所示。
化工原理实验指导书

化工原理实验指导书实验目的本实验旨在通过实验操作,加深对化工原理的理解,掌握化工实验的基本操作技能,培养实验分析和数据处理能力。
实验原理化工原理实验主要涉及到以下几个方面的内容: 1. 反应平衡和化学动力学 2. 热力学计算 3. 流体力学和传质过程 4. 反应器与过程控制 5. 传热过程实验器材和试剂1.实验器材:反应器、加热器、冷却器、分离仪器、计量仪器等。
2.试剂:根据实验要求使用不同的化学试剂。
实验步骤实验一:反应平衡和化学动力学1.准备反应器和试剂。
2.将试剂按照给定的比例加入反应器中。
3.根据实验要求设置反应温度。
4.开始反应,并记录实验过程中的温度、压力等数据。
5.根据实验结果分析反应平衡和化学动力学。
实验二:热力学计算1.准备热力学计算所需的实验数据。
2.计算化学反应的焓变、熵变和自由能变化。
3.根据计算结果分析反应的热力学性质。
实验三:流体力学和传质过程1.准备流体力学和传质实验所需的设备和试剂。
2.将试剂按照给定的比例注入传质设备中。
3.通过设备控制流体的流速和压力,并记录实验过程中的数据。
4.根据实验结果分析流体力学和传质过程的特性。
实验四:反应器与过程控制1.准备反应器与过程控制实验所需的设备和试剂。
2.将试剂按照给定的比例加入反应器中。
3.通过过程控制设备调节反应的温度、压力、流速等参数。
4.记录实验过程中的数据,并根据数据分析反应过程的控制效果。
实验五:传热过程1.准备传热实验所需的设备和试剂。
2.将试剂加热并通过设备控制传热过程的温度和压力。
3.记录实验过程中的数据,并根据数据分析传热过程的特性。
数据处理和实验分析在实验过程中,要认真记录实验数据,并根据数据进行分析和处理。
对于实验中的问题,要及时进行实验探讨和解决,并得出实验结论。
安全注意事项1.在实验操作过程中,要注意个人安全,避免直接接触危险试剂。
2.注意实验室卫生,保持实验环境整洁。
3.遵守实验室的操作规程,正确使用实验器材和试剂。
化工热力学实验指导书
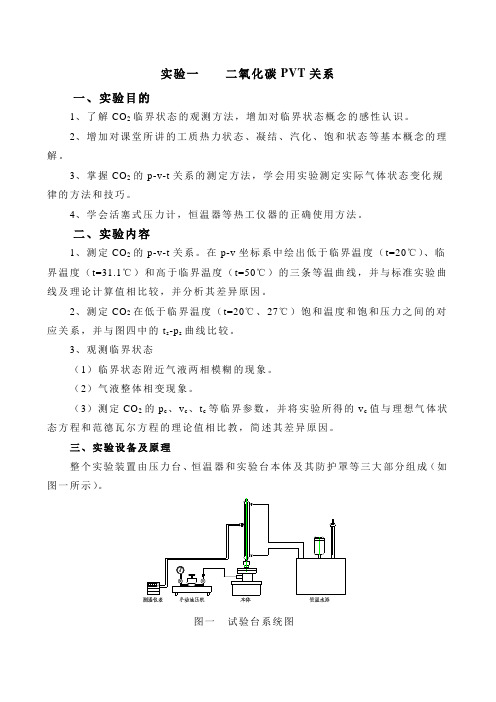
实验一二氧化碳PVT关系一、实验目的1、了解CO2临界状态的观测方法,增加对临界状态概念的感性认识。
2、增加对课堂所讲的工质热力状态、凝结、汽化、饱和状态等基本概念的理解。
3、掌握CO2的p-v-t关系的测定方法,学会用实验测定实际气体状态变化规律的方法和技巧。
4、学会活塞式压力计,恒温器等热工仪器的正确使用方法。
二、实验内容1、测定CO2的p-v-t关系。
在p-v坐标系中绘出低于临界温度(t=20℃)、临界温度(t=31.1℃)和高于临界温度(t=50℃)的三条等温曲线,并与标准实验曲线及理论计算值相比较,并分析其差异原因。
2、测定CO2在低于临界温度(t=20℃、27℃)饱和温度和饱和压力之间的对应关系,并与图四中的t s-p s曲线比较。
3、观测临界状态(1)临界状态附近气液两相模糊的现象。
(2)气液整体相变现象。
(3)测定CO2的p c、v c、t c等临界参数,并将实验所得的v c值与理想气体状态方程和范德瓦尔方程的理论值相比教,简述其差异原因。
三、实验设备及原理整个实验装置由压力台、恒温器和实验台本体及其防护罩等三大部分组成(如图一所示)。
图一试验台系统图图二试验台本体试验台本体如图二所示。
其中1—高压容器;2—玻璃杯;3—压力机;4—水银;5—密封填料;6—填料压盖;7—恒温水套;8—承压玻璃杯;9—CO2空间;10—温度计。
、对简单可压缩热力系统,当工质处于平衡状态时,其状态参数p、v、t之间有:F(p,v,t)=0 或t=f(p,v) (1)本实验就是根据式(1),采用定温方法来测定CO2的p-v-t关系,从而找出CO2的p-v-t关系。
实验中,压力台油缸送来的压力由压力油传入高压容器和玻璃杯上半部,迫使水银进入预先装了CO2气体的承压玻璃管容器,CO2被压缩,其压力通过压力台上的活塞杆的进、退来调节。
温度由恒温器供给的水套里的水温来调节。
实验工质二氧化碳的压力值,由装在压力台上的压力表读出。
化工专业实验指导书

化工专业实验指导书1. 实验目的本实验旨在让化工专业学生掌握某一化工实验的操作步骤、实验仪器的使用方法、实验数据的采集与处理以及实验结果的分析与讨论。
2. 实验原理在此部分,需要详细介绍该化工实验的基本原理和相关理论知识。
包括实验涉及到的化学反应机理、反应条件、实验所采用的试剂、实验仪器的工作原理等内容。
同时,需要引用相关参考文献,并在文末列出参考文献的引用格式。
3. 实验步骤在此部分,需要详细描述每个实验步骤的操作过程,要求层次清晰、流程明确。
对于涉及到使用实验仪器的步骤,需要给出相应的仪器操作说明和注意事项。
1.准备实验所需试剂和仪器,确保实验条件符合要求。
2.根据实验原理,按照实验设计要求,将试剂溶液配制至指定浓度。
3.使用洁净的容器,按照实验设计要求,将试剂溶液按照指定体积加入反应容器中。
4.根据实验要求调节反应条件,如温度、pH值、反应时间等。
5.在反应过程中,按照实验要求定时采样,并记录相应的实验数据。
6.完成反应后,根据实验要求对反应产物进行处理,如过滤、洗涤、烘干等。
7.对实验数据进行整理、处理和分析,得出实验结果。
8.根据实验结果,进行实验结果的讨论和分析。
4. 实验数据记录和处理在此部分,要求学生按照实验要求,对实验数据进行准确记录,并对数据进行处理和分析。
可以采用表格、图形等形式对数据进行展示。
数据处理的方法和步骤也需要相应说明。
5. 结果与讨论在此部分,要求学生对实验结果进行分析和讨论。
可以分析实验数据的意义和结果的合理性,探讨实验可能存在的误差和改进方法,以及对实验原理和技术等方面进行讨论。
6. 实验注意事项在此部分,需要列举实验中可能出现的安全风险和注意事项,以确保学生在实验过程中的安全和顺利进行实验。
•实验前需穿戴好实验服、鞋套、手套和护目镜。
•注意实验区域的通风情况,避免有害气体的有害吸入。
•注意使用化学试剂时的防护措施,避免接触皮肤和吸入有害气体。
•注意操作仪器时的安全操作步骤,避免意外发生。
《化工热力学实验》教学大纲

2、 掌握工质在循环过程的流动中的变化情况,并于理想循环进行比较; 3、 通过实验绘制出该工质的热力学工作曲线(T-S图); 4、 计算出不同实验条件下,该装置的制冷系数、制冷量、耗功量以及工质的循环量。 5、 能够用热力学的观点分析过程中工质的变化现象。 以上实验皆在化工实验楼化工热力学实验室(三楼)
1Hale Waihona Puke 实验三 用气相色谱法测定无限稀释溶液的活度系数 实验目的: 无限稀释活度系数是重要的热力学基础数据。通过无限稀释活度系数可以计算任意浓 度的活度系数、溶解热、混合热及混合熵等热力学参数。通过实验了解气相色谱的基本原 理以及测定无限稀释活度系数的基本过程。 实验内容: 1、 了解气相色谱的基本原理,熟悉其操作技术; 2、 测定溶质的比保留体积及无限稀释下的活度系数; 3、 测定两溶质的相对挥发度。
实验四 蒸汽压缩制冷循环 实验目的:
热力循环由若干个子过程所组成,各个子过程通常是在工业能量系统的不同装置中进 行的,这些装置连接起来就构成了整个能量系统。通过该实验了解工质在能量系统中通常 是在不断流动的过程中实现其热力循环,实际的热力循环不可避免的存在着各种不可逆性 因素,掌握热力学第一定律和热力学第二定律在实际中的应用。 实验内容: 1、 了解蒸气压缩制冷循环的基本原理,熟悉蒸气压缩制冷循环装置的结构及其每个组成 部件的作用;
《化工热力学实验》教学大纲
郑州大学化工学院
化工热力学实验教学大纲
课程名称:化工热力学实验 实验指导书名称:化工热力学实验指导 一、 对象、学时、学分 实验对象:本科生、专科生 (必修)总学时:20 总学分:1.5 (选修)总学时:5 总学分:0.5 二、 课程简介
本课程为化学工程与工艺、制药工程专业的必修实验和选修实验,主要面向三年级 本科生开设,内容涉及到热力学基础数据的测定与关联;热力学第一定律、热力学第二定 律的应用;溶液热力学性质的测定与预测;相平衡数据的测定;过程热力学分析等。实验 类型有验证型、综合性、开发型和设计性。必修实验主要根据《化工热力学》课程的教学 大纲并结合生产和科研技术的发展,开设3~4个较高水平的实验,使学生掌握在化工生 产、生物化工、精细化工、化学制药、生物制药各领域方向的能量的转化和合理地利用能 量。实验中同时学习热力学基础数据的的测定方法及理论预测模型的正确选型和验证,并 熟悉气相色谱分析的原理和定性、定量分析,了解气相色谱仪在热力学数据测定方面的重 要性。 三、 实验的地位、作用和目的 化工热力学实验课是专业基础技术课,是对学生所学《物理化学》、《化工原理 》和《化工热力学》等课程知识的综合运用与实践,让学生理论联系实际,明确热力学在 工业生产中、科学研究和工程设计中的重要性,有一个比较完整的感性认识和理性认识, 也是进行产品生产和科研开发的必要准备。通过专业技术基础课实验,使学生掌握一些基 本的操作技能,学习一些实验中所必需的测试技术、检测方法,学习简单的数据采集、数 据记录及分析处理等,学习如何将实验方案变成实际可操作的实践过程。
(教材)工程热力学实验指导书

内容简介本书主要是工程热力学实验,分2章。
第一章介绍具体的工程热力学实验,对每个实验,着重于阐明其实验原理、实验装置、实验操作方法和实验数据处理等内容。
每一实验均附有思考问题,以帮助读者进一步分析实验中的问题。
第二章是测量误差与数据处理,介绍了误差分析及数据处理方面的知识和方法。
本书可供高等院校动力类相关专业的本科生或研究生使用,亦可供有关教师、实验技术人员在编写工程热力学实验指导书、安排热力学实验时参考。
工程热力学实验教程是依据《工程热力学》本科生课程的教学大纲编写的。
它可供开设实验课、编写实验指导书的教师参考,亦可作为高等院校本科生、研究生的实验参考用书,也可供有关工程技术人员参考。
本实验教程以工程热力学实验为主,并据此编写了测量误差与数据处理。
书中每一项实验的内容着重于阐明她的基本原理、实验装置结构系统、基本测试方法、数据整理以及某些技术问题等。
每项实验都附有思考问题,以期使读者能进一步分析实验中的一些问题。
本书由朱强编写。
在本书编写过程中,得到了汪健生教授许多有意义的指导,在此表示衷心的感谢。
此外,感谢为本书提供各种资料和帮助的其他专家教授们以及参与修改和校对工作的人员。
在编写过程中,参考了国内外一些教材和文献的内容,在此一并致谢!由于受时间和作者水平的限制,书中难免疏漏和错误,可能还存在许多不尽如人意的地方,恳请读者们批评指正!以后将更加努力的学习和工作,以使本书的修订趋于完善。
第一章工程热力学实验1.1饱和蒸汽p-T关系曲线测量实验 (1)1.2CO2临界现象观测及p-v-t关系测定实验 (6)1.3绝热节流效应的测定实验 (15)1.4 喷管中气体流动实验 (22)1.5 压气机性能实验 (31)第二章测量误差与数据处理2.1 误差 (40)2.2 测量不确定度 (44)2.3 实验数据处理方法 (45)第一章工程热力学实验1.1饱和蒸汽p-T关系曲线测量实验一、实验目的1、通过观察饱和蒸汽压力和温度变化的关系,加深对饱和状态的理解,从而树立液体温度达到对应于液面压力的饱和温度时,沸腾便会发生的基本概念。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验一二氧化碳PVT关系一、实验目的1、了解CO2临界状态的观测方法,增加对临界状态概念的感性认识。
2、增加对课堂所讲的工质热力状态、凝结、汽化、饱和状态等基本概念的理解。
3、掌握CO2的p-v-t关系的测定方法,学会用实验测定实际气体状态变化规律的方法和技巧。
4、学会活塞式压力计,恒温器等热工仪器的正确使用方法。
二、实验内容1、测定CO2的p-v-t关系。
在p-v坐标系中绘出低于临界温度(t=20℃)、临界温度(t=31.1℃)和高于临界温度(t=50℃)的三条等温曲线,并与标准实验曲线及理论计算值相比较,并分析其差异原因。
2、测定CO2在低于临界温度(t=20℃、27℃)饱和温度和饱和压力之间的对应关系,并与图四中的t s-p s曲线比较。
3、观测临界状态(1)临界状态附近气液两相模糊的现象。
(2)气液整体相变现象。
(3)测定CO2的p c、v c、t c等临界参数,并将实验所得的v c值与理想气体状态方程和范德瓦尔方程的理论值相比教,简述其差异原因。
三、实验设备及原理整个实验装置由压力台、恒温器和实验台本体及其防护罩等三大部分组成(如图一所示)。
图一试验台系统图图二试验台本体试验台本体如图二所示。
其中1—高压容器;2—玻璃杯;3—压力机;4—水银;5—密封填料;6—填料压盖;7—恒温水套;8—承压玻璃杯;9—CO2空间;10—温度计。
、对简单可压缩热力系统,当工质处于平衡状态时,其状态参数p、v、t之间有:F(p,v,t)=0 或t=f(p,v) (1)本实验就是根据式(1),采用定温方法来测定CO2的p-v-t关系,从而找出CO2的p-v-t关系。
实验中,压力台油缸送来的压力由压力油传入高压容器和玻璃杯上半部,迫使水银进入预先装了CO2气体的承压玻璃管容器,CO2被压缩,其压力通过压力台上的活塞杆的进、退来调节。
温度由恒温器供给的水套里的水温来调节。
实验工质二氧化碳的压力值,由装在压力台上的压力表读出。
温度由插在恒温水套中的温度计读出。
比容首先由承压玻璃管内二氧化碳柱的高度来测量,而后再根据承压玻璃管内径截面不变等条件来换算得出。
四、实验步骤1、按图一装好实验设备,并开启实验本体上的日光灯(目的是易于观察)。
2、恒温器准备及温度调节:(1)、把水注入恒温器内,至离盖30~50mm。
检查并接通电路,启动水泵,使水循环对流。
(2)、把温度调节仪波段开关拨向调节,调节温度旋扭设置所要调定的温度,再将温度调节仪波段开关拨向显示。
(3)、视水温情况,开、关加热器,当水温未达到要调定的温度时,恒温器指示灯是亮的,当指示灯时亮时灭闪动时,说明温度已达到所需要恒温。
(4)、观察温度,其读数的温度点温度设定的温度一致时(或基本一致),则可(近似)认为承压玻璃管内的CO2的温度处于设定的温度。
(5)、当所需要改变实验温度时,重复(2)~(4)即可。
注:当初使水温高于实验设定温度时,应加冰进行调节。
3、加压前的准备:因为压力台的油缸容量比容器容量小,需要多次从油杯里抽油,再向主容器管充油,才能在压力表显示压力读数。
压力台抽油、充油的操作过程非常重要,若操作失误,不但加不上压力,还会损坏试验设备。
所以,务必认真掌握,其步骤如下:(1)关压力表及其进入本体油路的两个阀门,开启压力台油杯上的进油阀。
(2)摇退压力台上的活塞螺杆,直至螺杆全部退出。
这时,压力台油缸中抽满了油。
(3)先关闭油杯阀门,然后开启压力表和进入本体油路的两个阀门。
(4)摇进活塞螺杆,使本体充油。
如此交复,直至压力表上有压力读数为止。
(5)再次检查油杯阀门是否关好,压力表及本体油路阀门是否开启。
若均已调定后,即可进行实验。
4、作好实验的原始记录:(1)设备数据记录:仪器、仪表名称、型号、规格、量程、等。
(2)常规数据记录:室温、大气压、实验环境情况等。
(3)测定承压玻璃管内CO 2质量不便测量,而玻璃管内径或截面积(A )又不易测准,因而实验中采用间接办法来确定CO 2的比容,认为CO 2的比容ν与其高度是一种线性关系。
具体方法如下:a )已知CO 2液体在20℃,9.8MPa 时的比容ν(20℃,9.8Mpa )=0.00117M 3·㎏。
b )实际测定实验台在20℃,9.8Mpa 时的CO 2液柱高度Δh 0(m )。
(注意玻璃管水套上刻度的标记方法)c )∵ν(20℃,9.8Mpa )=kg m mAh /00117.030=∆ ∴)/(00117.020m kg K h A m =∆= 其中:K ——即为玻璃管内CO 2的质面比常数。
所以,任意温度、压力下CO 2的比容为:K hA m h ∆=∆=/ν (m 3/kg )式中,Δh=h-h 0h ——任意温度、压力下水银柱高度。
h 0——承压玻璃管内径顶端刻度。
5、测定低于临界温度t=20℃时的等温线。
(1)将恒温器调定在t=20℃,并保持恒温。
(2)压力从4.41Mpa 开始,当玻璃管内水银柱升起来后,应足够缓慢地摇进活塞螺杆,以保证等温条件。
否则,将来不及平衡,使读数不准。
(3)按照适当的压力间隔取h 值,直至压力p=9.8MPa 。
(4)注意加压后C O 2的变化,特别是注意饱和压力和饱和温度之间的对应关系以及液化、汽化等现象。
要将测得的实验数据及观察到的现象一并填入表1。
(5)测定t=25℃、27℃时其饱和温度和饱和压力的对应关系。
6、测定临界参数,并观察临界现象。
(1)按上述方法和步骤测出临界等温线,并在该曲线的拐点处找出临界压力p c 和临界比容νc ,并将数据填入表1。
(2)观察临界现象。
a)整体相变现象由于在临界点时,汽化潜热等于零,饱和汽线和饱和液线合于一点,所以这时汽液的相互转变不是象临界温度以下时那样逐渐积累,需要一定的时间,表现为渐变过程,而这时当压力稍在变化时,汽、液是以突变的形式相互转化。
b)汽、液两相模糊不清的现象处于临界点的CO2具有共同参数(p,v,t),因而不能区别此时CO2是气态还是液态。
如果说它是气体,那么,这个气体是接近液态的气体;如果说它是液体,那么,这个液体又是接近气态的液体。
下面就来用实验证明这个结论。
因为这时处于临界温度下,如果按等温线过程进行,使CO2压缩或膨胀,那么,管内是什么也看不到的。
现在,我们按绝热过程来进行。
首先在压力等于7.64Mpa附近,突然降压CO2状态点由等温线沿绝热线降到液区,管内CO2出现明显的液面。
这就是说,如果这时管内的CO2是气体的话,那么,这种气体离液区很接近,可以说是接近液态的气体;当我们在膨胀之后,突然压缩CO2时,这个液面又立即消失了。
这就告诉我们,这时CO2液体离气区也是非常接近的,可以说是接近气态的液体。
既然,此时的CO2既接近气态,又接近液态,所以能处于临界点附近。
可以这样说:临界状态究竟如何,就是饱和汽、液分不清。
这就是临界点附近,饱和汽、液模糊不清的现象。
7、测定高于临界温度t=50℃时的定温线。
将数据填入原始记录表1。
五、实验结果处理和分析1、按表1的数据,如图三在p-v坐标系中画出三条等温线。
2、将实验测得得等温线与图三所示的标准等温线比较,并分析它们之间的差异及原因。
3、将实验测得的饱和温度与压力的对应值与图四给出的t s-p s曲线相比较。
表1CO2等温实验原始记录图三标准曲线4、将实验测定的临界比容νc 与理论计算值一并填入表2,并分析它们之间的差异及其原因。
表2临界比容V c [m 3/Kg]5、应用RK 状态方程:()b v v T ab v RT P +--=5.0 (1-5)cc c c P RTb P T R a 0867.0,4278.05.22==(1-6)进行体积数据推算并与相应的实验值比较。
CO2的临界参数为:T C=304.2 K ;P C=7.376 Mpa六、仪器参数尺寸:1000×400×800电源:220V 功率:1.5KW测定二氧化碳的P-V-T关系,测定其临界参数PVT/测定二氧化碳在不同压力下饱和蒸汽和饱和液体的比容,如测定二氧化碳和温度和饱和压力的对应关系七、参考文献1Vargaftic N B. Tables on the Thermophysical Properties of Liquids and Gases. 2nd Ed. New York: Hemisphere Publishing Corp., 1975. 167~1682Neindre B L E, Vodar B. Experimental Thermodynamics. Vol II. London: Butterworths, 1968.347~3583童景山. 分子聚集理论及其应用. 北京: 科学出版社,1999. 32~36,209~2164童景山. CO2气、液、固三相饱和态下PVT的计算. 工程热物理学报,2001,22(6): 668~670。
