荧光条形码标记的单分子检测技术
荧光单分子检测技术

荧光单分子检测技术嘿,朋友们!今天咱来聊聊这个超厉害的荧光单分子检测技术呀!你说这荧光单分子检测技术啊,就好像是一个超级敏锐的小侦探!它能在茫茫的分子海洋里,精准地找到那一个它要找的“小目标”。
这可太神奇啦!想象一下,就像你在一个超级大的游乐场里,一下子就能找到你最喜欢的那个游乐设施一样。
这技术啊,可不是随随便便就能做到的。
它需要一系列高精尖的设备和手段呢!那些仪器就像是小侦探的各种神奇道具,帮助它完成任务。
而且啊,操作这个技术的科研人员们,那可都得是高手,就像武林高手一样,得有深厚的内力和精湛的技艺。
它的应用那可广泛啦!在生物学领域,能帮助我们更好地了解细胞的奥秘,看看那些小小的分子在细胞里是怎么活动的。
这不就像是给细胞拍了一部超级清晰的纪录片嘛!在医学上呢,说不定就能检测到那些隐藏得很深的疾病标志物,提前给我们发出警报。
哇,这可真是救命的本事呀!你说这技术这么厉害,要是没有它,我们得错过多少重要的发现呀!就好比你没有了眼镜,看什么都模模糊糊的,那多难受呀。
荧光单分子检测技术就是让我们能看清分子世界的那副“眼镜”。
它的精度高得吓人,能检测到极其微小的变化。
这就像你能察觉到别人脸上最细微的表情变化一样,厉害吧!而且它还在不断发展进步呢,就像我们人会不断学习成长一样。
以后它肯定还会有更多更牛的应用,给我们带来更多的惊喜。
咱再想想,要是没有这么厉害的技术,我们对很多疾病的研究可能就会停滞不前,对很多生物现象也没法弄明白。
那我们的科学进步不就慢了好多嘛!所以说呀,荧光单分子检测技术真的是太重要啦!它就像是科学世界里的一颗璀璨明珠,照亮着我们探索未知的道路。
让我们一起为这个了不起的技术点赞吧!我相信,它在未来一定会给我们带来更多的精彩和奇迹!这就是荧光单分子检测技术,一个超级厉害的存在!。
NanoString数字基因定量技术原理及应用简介

NanoString数字基因定量技术原理及应⽤简介作者:胡东王芳周围段家玺范灵灵黄⼠昂导读数字化基因分析系统是最新的多重基因定量检测技术。
此技术可直接检测条形码探针标记的单个mRNA转录⼦,并通过数字计数进⾏定量;它仅需NanoString数字化基因分析系统是最新的多重基因定量检测技术。
100 ng的RNA即可对逾⼋百个特异的mRNA转录⼦进⾏准确的定量;它⽆需酶促和扩增过程,其检测的敏感性和准确性与实时荧光定量PCR(RQ—PCR)技术相当。
近年来,NanoStfing技术的特点及优势使其被越来越⼴泛地应⽤到⽣物医学前沿领域,包括⾼通量基因表达结果验证、基因表达谱研究、基因调控⽹络研究、临床疾病分⼦分型及诊断预后等领域。
随着后基因组学和系统⽣物学的发展,在特定⽣物学过程或疾病状态中对转录⽔平RNA表达的⾼通量研究越来越受到关注,并成为⼈们深⼊了解⽣物学过程中转录调控、信号转导机制、疾病分⼦病理分型等的重要⼯具。
基因芯⽚、RNA测序等技术应⽤于⾼通量基因表达谱研究,产⽣了⼤量基于各种⽣物过程及疾病模型的信息;但由于其检测敏感性和准确性不⾜,往往需要对结果中⼤量的信息进⾏进⼀步的筛选和验证。
传统的实时荧光定量PCR(real—time quantitative PCR,RQ.PCR)⽅法敏感性⾼,准确性好,是⾼通量研究最常⽤的验证⽅法;但其通量不⾜,在需要对多个基因定量的情况下,实验设计及操作步骤繁琐。
NanoString数字化基因检测技术(NanoString nCounter Analysis)是新⼀代的多重核酸定量技术,在基因表达谱的验证、研究和临床应⽤中扮演了越来越重要的⾓⾊。
NanoString技术在⼀个体系中可进⾏逾⼋百个的颜⾊条码探针和特异性序列的杂交反应,最后直接以数字化输出的形式读取定量结果。
此技术⾃动化程度⾼,反应中⽆需酶逆转及扩增的过程,避免了相关偏差,其检测敏感性、准确性和实时荧光定量PCR技术相当。
单分子检测与荧光相关光谱

概述
根据荧光寿命和分子在激光束中停留时间,可算出单 个分子发射的最大光子数为105~106。目前光学检测 系统收集、检测光子的效率约为1%或0.5%~5%,故单 个分子仍可被检测到数千光子信号。 检出限约为10-13mol/L
分子发光分析
概述
3.两个基本要求:
在被照射的体积中只有一个分 子与光子发生相互作用,可以 通过调整体系的浓度或密度来
单分子酶催化反 23.6.2单分子ATP酶活性研究
肌球蛋白的S1亚基通过白蛋白-生物素卵蛋白涂层结合到玻璃表面,在S1片段 上有一个ATP酶活性,能切割Cy3标记 的ATP。蛋白质也有Cy3标记,使得单 一酶分子位于滑道上,ATP酶标签定位 后,绑定在S1片段上的Cy3被光漂白, 以消除其散射光的影响。当Cy3-ATP / ADP酶固定化之后,会发生荧光强度的
在高光照条件下检测室会发生荧 光闪烁现象,这种单一荧光团的闪烁 可以简单的光物理模型进行解释,荧 光团闪烁的主要来源是系统的交叉三 重态。 如果背景信号来自自发荧光,那 么入射强度的增强不会引起信噪比的 增加。 在开始时,随着如射强度的增加 ,光子计数率呈直线增加,并很快达 到最大值。
四甲基罗丹明标记的脂质分子的光子计数率
F.分子信 标 F.分子马 达
荧光单分子检测的应用领域
分子发光分析
分子发光分析
荧光偏振
单分子荧光分子具有唯一的固有荧光和吸收跃迁偶极矩,分 子只吸收偏正方向与其偶极矩方向一致的光子。因此在偏振
激光的激发下,通过测量单个分子的吸收和荧光的偏振方向
,可以确定单个荧光分子的空间取向。
分子发光分析
23.1单分子的可检测能力
影响分子检测能力的因素: 由于样品中杂质产生的背景干扰;
单分子荧光检测技术

单分子荧光检测技术涂熹娟B200425010【摘要】单分子检测技术有别与一般的常规检测技术,观测到的是单个分子的个体行为,而不是大量分子的综合平均效应。
近年来随着相关学科的技术进步,单分子研究已经在从分子生物学到细胞生物学等生命科学领域有了迅速的发展和应用。
本文简要介绍了单分子荧光检测技术的研究背景、意义、原理,以及该项技术进展和应用。
【关键词】单分子荧光寿命荧光偏振单分子FRET1. 单分子检测技术的意义和发展背景1.1单分子检测技术的意义在统计力学的各态遍历假设中,系综个体物理量轨迹的时间平均等于该物理量在给定时间的系综平均[1]。
在一个包含完全相同个体的系综,当测量时间足够长的时候,系综测量和单分子测量结果相同(例如对于稀溶液中小分子的核磁共振谱线的测定,由于测量时间远大于小分子的翻滚时间,这时体系就可以看成是一个均匀的体系,并看作静态);但是即使在均相体系中,分子本身并不是处于静态,而是在不断地运动,测量的参数具有涨落现象,而测量时间可能会小于分子的涨落时间;另一种情况是在非均相体系中,个体轨迹平均本来就不等于系综平均(实际上几乎所有生物体系都不是均相体系)。
这以上考虑到的两点都导致系综测量结果和单分子测量结果不等。
一般系综测量结果表示的是大量由一种或多种对象组成的一个整体所表现出来的平均效应和平均值。
这一平均效应掩盖了许多特殊的信息。
而这些特殊的信息有时是非常重要的,尤其在研究具有非均匀特性的凝聚相物质和生物大分子结构时。
而相比之下,单分子检测就可做到对体系中单个分子的行为进行研究,可以得到在特定时刻,特定分子的特殊位置和行为,因为在某一时刻,集团中的任何成员只能处于一种状态。
将此再与时间相关,还可得到单个分子的行为的分布状况。
这样我们就可以同时得到所研究的对象的整体行为和个体行为了,然后将数据综合处理,得到更为全面的信息。
1.2单分子检测技术的意义和发展背景既然单分子检测技术有这么多的好处,为什么直到近年来才逐渐发展起来呢?这与光学系统的进展有很大的关系。
单分子荧光检测技术

Absorption 10-15 s hA hA
S0 3210 Jablonski Diagram
3.单分子荧光的特征
量子跳跃特性 发射-暗态交替的量子跳跃过程是单分子荧 光的主要特征之一,取决于单分子的周围环境 和猝灭途径,是实验中单分子荧光光谱和荧光 强度涨落现象的原因 荧光偏振特性 单分子荧光分子具有唯一的固定吸收和发 射偶极矩,因此在偏振激光的激发下,通过测 量单个分子的吸收和荧光的偏振方向,可以完 全确定单个荧光分子的空间取向。这是单分子 荧光的主要特征之二
单分子的荧光特性及其在生物学上的应用. 物理,29(11):657,2000
3.单分子荧光共振能量转移
荧光共振能量转移原理
当能量给体分子(D)和受体分子(A)相隔的距 离远大于D –A碰撞直径时,如若D的发射谱与A的 吸收光谱发生重叠,且距离在有效范围内,能量就 可以从短波长的荧光基团D传递到长波长的荧光基 团A,这个过程称为荧光共振能量转移,实际相当 于将短波长荧光基团D释放的荧光屏蔽 这是一种通 过偶极-偶极耦 合作用的能量转 移过程。
在包含完全相同个体的系综,测量时间足够长 系综测量和单分子测量结果相同 在均相体系:测量时间可能小于涨落时间 非均相体系:个体轨迹平均不等于系综平均 系综测量和单分子测量果不等
显微镜的发展 光 学 显 微 镜
电 子 显 微 镜 扫 描 隧 道 显 微 镜
扫描探针显微技术和光学技术连用
近代,随着各个学科的发展,科学研究达到了微观分 子水平,使得我们可以看清单个分子与时间相关的行 为,排除测量中的平均效应
单分子荧光检测原理
1. 单分子荧光检测是单分子检测最常用的 方法
标记在生物大分子上各个荧光基团的各种特 性的变化反映了有关分子间相互作用、酶活 性、反应动力学、构象动力学、分子运动自 由度及在化学和静电环境下活性改变的信息
NanoString 基因表达谱
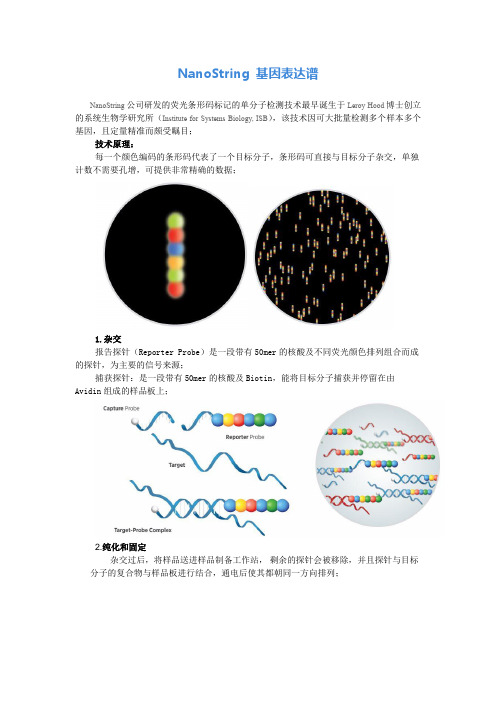
NanoString 基因表达谱NanoString公司研发的荧光条形码标记的单分子检测技术最早诞生于Leroy Hood博士创立的系统生物学研究所(Institute for Systems Biology, ISB),该技术因可大批量检测多个样本多个基因,且定量精准而颇受瞩目;技术原理:每一个颜色编码的条形码代表了一个目标分子,条形码可直接与目标分子杂交,单独计数不需要孔增,可提供非常精确的数据;1.杂交报告探针(Reporter Probe)是一段带有50mer的核酸及不同荧光颜色排列组合而成的探针,为主要的信号来源;捕获探针:是一段带有50mer的核酸及Biotin,能将目标分子捕获并停留在由Avidin 组成的样品板上;2.纯化和固定杂交过后,将样品送进样品制备工作站,剩余的探针会被移除,并且探针与目标分子的复合物与样品板进行结合,通电后使其都朝同一方向排列;3.计数将处理好的样品板放入数据分析仪进行信号数据采集,仪器会自动统计在样品板表面的荧光编码探针,并将其列表表示出来;NanoString技术应用:Nanostring技术的特点及优势使其被越来越广泛地应用到生物医学前沿领域,包括高通量基因表达结果验证、基因表达谱研究、基因调控机理、基因调控网络研究、临床疾病分子分型及诊断预后等领域;其研究涉及动植物发育、炎症、免疫、干细胞、肿瘤、药物耐药、信号转导等各个领域。
基因表达分析NanoString技术的基因表达条形码提供了一个高质量低成本的检测方式,可同时分析超过800个基因的表达水平,并且精准性与qPCR相当这项技术的实验方法简单,每个反应只需15分钟的人工操作,可直接测定组织和血液裂解产物和FFPE提取物。
检测特点:∙可同时分析超过800个基因;∙不需要荧光定量反应,不需要扩增和逆转录;∙可直接检测包括总RNA,细胞和全血裂解产物以及石蜡包埋组织(FFPE)等样品;∙采用单分子计数使数据误差最小化;灵敏度高,重现性好,动力学范围广;自定义条形码:提供了最大限度的灵活性,可自主设计特定的基因、组织和很难实现的目标序列;仪器分析性能:具体应用:1.Northcott PA, et al., “Rapid, reliable, and reproducible molecular sub-grouping of clinical medulloblastoma samples”Acta Neuropathologica123(4): 615-26. November 06, 20112. Sun Z, et al.,“Integrated Analysis of Gene Expression, CpG Island Methylation, and Gene Copy Number in Breast Cancer Cells by Deep Sequencing”PLoS ONE Vol 6-2, e17490. February 25, 20113. Reis PP, et al.,“mRNA transcript quantification in archival samples using multiplexed, color-coded probes.”BMC Biotechnol vol. 108 no. 19 7956-7961. May 09, 2011。
单个分子荧光技术在生物研究中的应用

单个分子荧光技术在生物研究中的应用生命科学中,单个分子荧光技术已成为一种重要的研究手段,它通过对单分子的荧光强度、寿命、偏振等现象的监测,可以研究细胞信号转导、分子间相互作用等生命科学中各种细胞过程的细节。
本文将从单个分子荧光技术的基本原理、测量方法、适用范围以及具体应用等四个方面简要介绍它在生物研究中的应用。
一、基本原理单个分子荧光技术利用单个荧光染料分子在光激发下产生的荧光信号对其进行标记和检测。
其基本原理是氧化型的荧光染料吸收外部光在某个波长范围内产生的激发态,随后退火到它的基态并通过放出光子的方式发出瞬时的发光。
其中有些荧光染料的亚基可以被某些生物分子特定结合,成为荧光探针,用于标记细胞蛋白的分子。
二、测量方法单个分子荧光技术的测量方法包括单分子荧光分辨率、时间分辨的荧光共振能量传递、偏振时间分辨等多种测量方法。
三、适用范围单个分子荧光技术广泛应用于动态分子 (如DNA, RNA, 代谢物、单个蛋白质等)、细胞器受体、细胞器组装成分、酶和底物等的发光性检测。
这种方法对于准确测量生物分子的数量和状态、摄取、转移等生物过程的动态过程的数据是必不可少的。
四、具体应用在实际研究中,单个分子荧光技术已经成为了生物学家的重要工具。
以下几个方面就是最常见的应用:1、单个分子免疫荧光技术单个分子免疫荧光技术是应用单个分子荧光技术在细胞免疫学实验中的重要手段之一,它对于研究健康或疾病细胞的免疫反应有着重要的作用。
2、单分子荧光共振能量过渡技术单分子荧光共振能量过渡允许研究者在单molecules层面上分析单个分子间的相互作用。
使用此技术,研究者可以了解从抗体免疫盈亏到酶活性,都可以通过测量单个分子间的距离来获得信息。
3、单个分子重要生物过程的研究早期的生物检测主要集中在细胞或组织级别上,无法对单个分子的运动、功能、构象以及分子间关系进行掌握。
而单个分子荧光技术能够允许对生命界中单个分子特征的连续检测。
比如细胞内蛋白质的单分子监测,了解蛋白质的精确折叠,掌握蛋白质间相互作用以及发现蛋白质结构变化等都是例子。
单分子荧光检测的原理、方法及应用

0 前言
随着生命科学的迅速发展,人们对生命现象 的研究已深入到单细胞、单分子层次,许多传统的 分析方法与手段面临极大的挑战。单分子检测是 近十年来迅速发展起来的一种超灵敏的检测技 术,为分析化学工作者打开了一扇新的大门。现 在,人们不仅可以在溶液中对单个分子进行检测 和成像,而且可以通过对单分子的光谱性质进行 测量,从而对化学反应的途径进行实时监测,特别 是能对生物大分子进行探测并提供分子结构与功 能之间的信息。单分子检测有电化学法与光学 法,本文仅就单分子荧光检测的原理、方法及应用 作一简单阐述。
分子荧光检测的原理、方法及其在生命科学中的应用。
关键词:单分子检测;荧光;评述
中图分类号:06 - 1
文献标识码:A
Fluorescence Detection of Single Molecule and Its Applications
WANG Yi-iin
( COiiege Of Chemistry and Chemicai Engineering,Guangxi University,Guangxi Nanning 530004 PRC)
从单分子水平上研究蛋白质与核酸的相互作 用可为人类基因组的研究提供许多新机会。实时 观察单个酶分子在 DNA 上的结合和运动可揭示 许多新问题,如 DNA 结合蛋白在许多非特异性结 合位点中如何找到特异性位点的,RNA 聚合酶在 转录时是如何运动的。单分子检测技术已用于直 接观察基因表达过程[24]。研究表明,荧光标记的 RNA 聚合酶分子沿 DNA 链作直线滑行,为滑动 是寻找启动子的机制提供了直接证据。研究表 明,在转录过程中 RNA 聚合酶分子沿 DNA 链移
图 1 分子能级图
2 方法
单分子荧光检测的技术关键在于确保被照射 的体积中只有一个分子与激光发生作用以及消除 杂质荧光的背景干扰。采用高效滤光片,利用共 焦、近场和消失波激发,可达此目的。根据所用仪 器及对样品激发方式的不同,单分子荧光检测大 体可分为以下 4 种。 2. 1 近场扫描光学显微镜
单分子荧光检测技术

单分子检测实验的重要性:
对非均相体系,可给出分子性质的分布 信息 对均相和非均相体系,单分子轨迹即是 分子性质涨落的直接记录,蕴涵丰富的 动力学知识
单分子检测技术
扫描隧道显微技术(STM) 扫描探针显微技术 (Scanning Probe Microscopy) 原子力显微技术(AFM) 扫描离子电导显微技术(SICM) 扫描近场光学显微技术(SNOM) 光学和光谱技术 光钳技术(Optical Tweezer) 荧光技术(Fluorescence)
单分子荧光检测原理
1. 单分子荧光检测是单分子检测最常用的 方法
标记在生物大分子上各个荧光基团的各种特 性的变化反映了有关分子间相互作用、酶活 性、反应动力学、构象动力学、分子运动自 由度及在化学和静电环境下活性改变的信息
对宿主影响小 稀溶液中荧光发射检测较为灵敏,背景值较 低,信噪比高
2.单分子荧光产生原理
Chem. Commun., 2004, 496-497
小
结
• 单分子荧光检测可提供有别于分子聚积 态的单个分子的特殊局域环境、分子涨 落、生物大分子的柔性及其运动等有价 值的信息 • 该技术在实现和应用上投入相对较少 单分子荧光检测是研究单分子最灵敏、最 简便的方法之一
1.单分子荧光寿命
单分子的荧光寿命在由 非辐射弛豫决定时对局 域环境非常敏感,因此 可以通过荧光标记生物 大分子的某一特殊位置, 检测生物大分子的构象 运动。
虚线:单指数曲线拟合
实线:双指数曲线拟合
2.单分子荧光偏振
分子只吸收偏振方向与其跃迁偶极矩方向一致的 光子,并发出具有一定偏振方向的荧光 如果固定激发光的偏振方向,对于标记于生物单 分子的某一特殊位置的荧光分子,其荧光强度就 分子的荧光强度受到偏振方 会随着生物单分子在生化 向连续变化的激发光调制 反应过程中构象的涨落 (旋转、扩散)的变化而 变化
ROS1融合基因突变在非小细胞肺癌诊断与治疗中的研究进展_江薇

Role of ROS1fusion gene mutations in diagnosis and treatment of non-small cell lungcancerWei Jiang,Yina WangCorrespondence to:Yina Wang;E-mail:1503099@Department of Oncology,The First Affiliated Hospital,College of Medicine,Zhejiang University,Hangzhou 310000,China This work was supported by the Natural Science Foundation of Zhejiang Province (No.LY16H160006)AbstractThe incidence of ROS1gene rearrangement/fusion in non-small cell lung cancer (NSCLC)is about 1%-2%.The advent of tar-geted drugs for ROS1gene fusion has significantly improved the quality of life and total survival of NSCLC patients with ROS1fusion;however,acquired drug resistance is still present in most patients after continuous treatment.This review has summarized the back-ground of the ROS1fusion gene,detection method,clinical efficacy of ROS1-targeted therapy,and strategy and prospect of drug resis-tance.Keywords:ROS1gene,non-small cell lung cancer (NSCLC),crizotinib,drug resistanceROS1融合基因突变在非小细胞肺癌诊断与治疗中的研究进展*江薇综述王懿娜审校摘要ROS1基因重排/融合在非小细胞肺癌(non-small cell lung cancer ,NSCLC )中的发生率约为1%~2%。
生物分子的单分子检测与操纵技术研究

生物分子的单分子检测与操纵技术研究在今天的生命科学领域中,了解单个分子的行为和性质变得越来越重要。
单分子技术已经成为了研究生物分子的重要方法,因为它使得生物分子能够被单独观察和操作。
其中最重要的技术之一是单分子检测和操纵技术。
这些技术使得实验室能够在细胞层面对一些分子进行更仔细的研究,这种研究不仅有助于我们更好地理解生物过程,还为药物和医疗设备的开发提供了重要支持。
单分子检测技术的一种方法是利用荧光标记的分子来研究它们在水溶液中的行为。
通过使用激光来激发荧光标记,可以精确地跟踪分子的运动轨迹并了解它们的行为。
这种技术可以被用来研究大量的生物分子,包括蛋白质、核酸和多糖等。
例如,这种技术已经被用来研究蛋白质折叠的动力学过程,即蛋白质如何在水溶液中折叠成特定的空间结构来释放能量。
这些研究的结果已经被应用在制药工业中,有助于设计更有效的药物和对抗疾病。
单分子操纵技术是另一种单分子技术。
它可以被用来操纵特定的生物分子,并研究它们的性质和功能。
这种技术通常需要使用高精度的力传感器,并将生物分子放在环形化的DNA或RNA链上。
通过这种方法,可以将蛋白质和核酸等生物分子拉伸和弯曲,这有助于研究它们的结构和功能。
例如,单分子操纵技术已经被用来研究DNA分子的拉伸行为,以帮助科学家更好地了解DNA的结构和功能。
这种技术还被用来研究一些特殊的分子,如酶和分子马达等。
单分子技术可以为许多医疗应用提供支持。
例如,在医疗设备的开发中,单分子技术可以被用来研究蛋白质和核酸等生物分子在设备表面的行为,以确定哪些材料最适合制造医疗设备。
此外,这种技术还可以被用来研究药物如何与生物分子相互作用,从而帮助制定更有效的药物。
细胞治疗也可以从单分子技术中受益。
单分子技术可以帮助科学家更好地了解人体内的分子途径和网络,并研究如何干预这些途径和网络来治疗疾病。
例如,单分子技术已经被用来研究肿瘤细胞的行为,并发现了新的治疗方法。
总之,单分子检测和操纵技术是研究生物分子的重要手段,其应用范围非常广泛。
荧光标识生物分子检测系统研究及性能分析

荧光标识生物分子检测系统研究及性能分析倪原;刘凯涛;倪中辰;赵阳;王红娟;魏静【摘要】In order to determine whether there is specific gene or protein in the sample,a fluorescent polarization system for detecting biomolecules was designed.This paper analyzes the disadvantages of the spectrophotometry and resonance light scattering analytical methods,deseribes the advantages and characteristics of the fluorescence polarization detection,studies the principle of fluorescence polarization detection system,and designs the optical path and the control system.A large number of biological testings were conducted with the new system.Experimental results show that the detection system is able to determine whether there is substance to be detected in the sample.The repeatability error is less than 3%,the accuracy rate is up to 100% and the unevenness of the holes test is less than 2%.%为了确定待测样品中是否存在某种特定的基因、蛋白质,设计了一种能够对荧光探针标识的生物分子进行检测的荧光偏振系统。
第三代测序技术原理及应用

SMRT cell
Sequel (2015年)
1,000,000 ZMWs /SMRT cell SMRT cell 的通量提高 7 倍 1/3体积
Oxford Nanopore Technologies 纳米孔单分子测序技术
• 优势:仪器构造简单使用成本低廉,因为它不需要对核苷酸进行标记, 也不需要复杂的光学探测系统 。能直接对 RNA 分子进行测序。同时 由于它是直接检测每一个碱基的特征性电流, 因而能对修饰过的碱基 进行测序, 这一点对于表观遗传学研究具有极高的价值。
第三代测序技术的基本原理及应用
baby诺安
目录
1. 简介 2. 基本原理 3. 应用
简介
第三代测序技术是指单分子测序技术。不同于二代测序依赖片段化 DNA的克隆性扩增,三代测序技术不需要经过PCR扩增,直接对模板中 的每条DNA分子单独测序,避免了潜在的PCR扩增错误和偏好性。同时 超长读长使得一条read可以横跨基因组上的复杂区段或者重复序列,为 基因组组装及准确挖掘与疾病、进化相关的重复原件、拷贝数变异、结 构性变异提供了技术支持。
成像定位 模板位置
洗涤
合成 检测
全内反射显微镜(TIRM)单色成像
Helico BioScience SMS技术
• 测序仪:HeliScope(2008年上市,$1,350,000)
• 优势:样本通量非常高,2 个流动槽可同时运行,每个流动槽有 25 个独立通道,每个通道又可以运行最多 96 个标记分子条形码的样本, 这样每次运行的样本数可高达 4 800 个。把 DNA 聚合酶用逆转录酶 代替还可以进行 RNA 直接测序。
荧光及其荧光单分子跟踪技术

荧光及其荧光单分子跟踪技术
鄢志丹 2011.11
主要内容:
1. 荧光
什么是荧光;分子荧光的主要特性有那些;
2. 荧光显微技术
荧光显微镜;探测传感器;荧光显微技术的应用领域;
3. 荧光单分子检测技术
单分子检测意义;荧光单分子检测特点、应用范围和关键技术;
4. 一种高精度快速的荧光单分子跟踪算法
目前的主要方法:
近场方法:STM,AFM等; 远场方法:荧光显微镜; 其他方法:微流体、磁镊、光镊、超快振动谱等。
扫描隧道显微镜
中国石油大学信息与控制工程学院
原子力显微镜
3/5:荧光单分子检测技术(Fluorescence Single Molecule Detection)
荧光单分子检测:
450
550
650
波长 (nm)
1050 900 750 600 450 300 150 0 350
第00分钟 第20分钟 第40分钟 第60分钟 第80分钟 第100分钟 第200分钟 第300分钟
450
550
650
波长 (nm)
真空中的p-6P分子连续荧光光谱 p-6P分子荧光光谱淬灭
荧光低温特性: 在低温环境下,由于分子的转动能、振动能 及其多普勒效应大大减少,其荧光量子产量 和荧光强度增大,荧光寿命增加,荧光发射 光谱半峰全宽(FWHM)变窄。
2/5:荧光显微技术(Fluorescence Microscopy)
探测传感器:
光 图谱强像探测:光 电谱 电 荷仪 倍 耦( 增 合管 元Sp件e(cP(throotCmohematurelgrtei)pCloiueprleTdubDe,viPcMeT,)CCD)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
荧光条形码标记的单分子检测技术是一种全新的高通量检测基因表达谱、miRNA等分子的技术,其定量结果可与real-time PCR相媲美。
由于它的高通量和高精确性填补了基因芯片和real-time PCR之间的技术空白,一经问世大受欢迎,其检测结果频频登载在nature、science、cell等顶级杂志上。
NanoString公司研发的荧光条形码标记的单分子检测技术最早诞生于Leroy Hood博士创立的系统生物学研究所(Institute for Systems Biology, ISB),该技术因可大批量检测多个样本多个基因,且定量精准而颇受瞩目,2008年被《Nature Technology》杂志以封面文章的形式报道,报道如下:基因表达谱的检测目前有两种方法:基因芯片和real-time PCR。
但它们都需要逆转录或其它的酶促反应,这在一定程度上增加了人为操作及实验反应的误差。
因此,Geiss等人研发了全新的直接测定读取mRNA表达量的NanostringnCounter 分析系统,无须逆转录及其它酶促反应,只需100ng的总RNA即可检测,具有极高的灵敏度和可重复性,它的出现成为科研工作者除基因芯片和real-time PCR 之外的新选择。
NanostringnCounter仪器的实验原理是设计出捕捉探针和报告探针两种探针,分别与靶mRNA结合。
其中捕捉探针标有生物素,用于将杂交复合物固定在cartridge板上;报告探针则带有四色荧光集团,其不同的排列组合方式代表不同的基因。
将总RNA与这两种探针进行杂交、纯化、固定,扫描报告探针尾部的荧光集团确定其捕获的基因及其表达量。
由于基因表达量的鉴定是由荧光集团的排列组合决定的,背景噪音不会影响基因的定量,因此该方法与基因芯片相比具有极高的灵敏度,可用来检测极低丰度的mRNA,即使每个细胞只表达单个mRNA也能够被检测出来,且其精确性与real-time PCR相当,但通量则比real-time PCR高得多。
在NanostringnCounter仪器中设计的探针长约35-50个碱基,且mRNA要与捕捉探针和报告探针两条探针同时结合才能被检测到,从而降低了实验的假阳性率。
其中,标有生物素的捕捉探针会与cartridge板上的亲和链霉素结合,为杂交复合物的荧光扫描做准备;报告探针之后则有6个荧光探针位点,用于四色荧光标记,根据不同的排列组合,他们最多可标记46,即4096个探针。
排除容易混淆的荧光探针和需要做阳性对照和阴性对照的荧光探针,该仪器一次可标记800个荧光探针做目标mRNA的检测。
NanostringnCounter仪器已和Affymetrix芯片进行比较。
经过检测一系列宽动态范围的mRNA表达,结果显示两者之间变异系数<20%,并且有些低丰度mRNA 可在nanostringnCounter仪器中检出而在Affymetrix芯片中检测不出来。
NanostringnCounter仪器和基因表达串联分析(serial analysis of gene expression, SAGE)技术相似,但nanostring有更多优势,例如液相杂交,高通量检测,靶mRNA无须扩增。
与real-time PCR相比,nanostring只需单步反应,比real-time PCR操作更简便,且通量也比real-time PCR更高。
总之,NanostringnCounter仪器所需样本更少、无需酶反应、操作更简便,是现有的表达谱检测手段的重要补充。
NanostringnCounter仪器一经问世大受欢迎,并已在nature、science、cell等顶级杂志发表多篇文章,目前已将应用扩展至miRNA、IncRNA、CNV和融合基因的检测。
我们会就一系列经典应用进行后续报道。
Nanostring近年来发表的文章2012∙Passalacqua K.D. et al.,Strand-Specific RNA-Seq Reveals Ordered Patterns of Sense and Antisense Transcription in Bacillus anthracis.PloS One. Volume 7, Issue 8, e43350. August 22, 2012∙Cataisson C. et al.,IL-1R–MyD88 signaling in keratinocyte transformation and carcinogenesis.J. Exp. Med [Epub ahead of print]. August 20, 2012 ∙Deardorff M.A. et al.,HDAC8 mutations in Cornelia de Lange syndrome affect the cohesin acetylation cycle.Nature [Epub ahead of print]. August 12, 2012∙Monaghan J.R. et al.,Gene expression patterns specific to the regenerating limb of the Mexican axolotl.Biology Open[Epub ahead of publication].August 08, 2012∙Eloy N.B. et al.,SAMBA, a plant-specific anaphase-promoting complex/cyclosome regulator is involved in early development and A-type cyclin stabilization.PNAS [Epub ahead of print]. August 07, 2012 ∙Butovsky O. et al.,Modulating inflammatory monocytes with a unique microRNA gene signature ameliorates murine ALS.JCI [Epub ahead of print].August 06, 2012∙Rueckert E.H. et al.,Cis-acting regulation of brain-specific ANK3 gene expression by a genetic variant associated with bipolar disorder.Mol.Psychiatry [Epub ahead of print]. July 31, 2012∙Weiner A. et al.,Systematic Dissection of Roles for Chromatin Regulators in a Yeast Stress Response.PLoS Biology 10(7): e1001369 July 31, 2012 ∙Northcott P.A. et al.,Subgroup-specific structural variation across 1,000 medulloblastoma genomes.Nature. [Epub ahead of print]. July 25, 2012 ∙Zhang CC. et al.,Biomarker and pharmacological evaluation of the γ-secretase inhibitor PF-03084014 in breast cancer models.Clin Cancer Res. [Epub ahead of print]. July 17, 2012∙Holm C.K. et al.,Virus-cell fusion as a trigger of innate immunity dependent on the adaptor STING.Nat. Immunol. 13(8):737-43. July 17, 2012 ∙Iskow R.C. et al.,Regulatory element copy number differences shape primate expression profiles.PNAS [Epub ahead of print]. July 13, 2012 ∙Smith KM. et al.,miR-29ab1 deficiency identifies a negative feedback loop controlling Th1 bias that is dysregulated in multiple sclerosis.J. Immunol.[Epub ahead of print]. July 06, 2012∙Li E. et al.,Direct and indirect control of oral ectoderm regulatory gene expression by Nodal signaling in the sea urchin embryo.Dev Biol. [Epub ahead of print]. July 05, 2012∙Fass D.M. et al.,Crebinostat: A novel cognitive enhancer that inhibits histone deacetylase activity and modulates chromatin-mediated neuroplasticity.Neuropharmacology [Epub ahead of print]. July 04, 2012∙Zhang M. et al.,A new approach to simultaneously quantify both TCR α- and β-chain diversity after adoptive immunotherapy.Clin Cancer Res.[Epub ahead of print]. July 03, 2012∙Grisanzio C. et al.,Genetic and functional analyses implicate the NUDT11, HNF1B, and SLC22A3 genes in prostate cancer pathogenesis.PNAS[Epub ahead of print]. June 22, 2012∙Wu J. et al.,The Pro-inflammatory Myeloid Cell Receptor TREM-1 Controls Kupffer Cell Activation and Development of Hepatocellular Carcinoma.Cancer Res. [Epub ahead of print]. June 19, 2012∙Oishi N. et al., Transcriptomic profiling reveals hepatic stem-like gene signatures and interplay of mir-200c and EMT in intrahepatic cholangiocarcinoma.Hepatology [Epub ahead of print]. June 18, 2012∙Nuovo G.J. et al.,Reovirus-associated reduction of microRNA-let-7d is related to the increased apoptotic death of cancer cells in clinical samples.Mod Pathol [Epub ahead of print] June 15, 2012∙Balko J.M. et al.,Profiling of residual breast cancers after neoadjuvant chemotherapy identifies DUSP4 deficiency as a mechanism of drug resistance.Nat Med [Epub ahead of print]. June 10, 2012∙Alder H. et al.,Dysregulation of miR-31 and miR-21 induced by zinc deficiency promotes esophageal cancer.Carcinogenesis [Epub ahead of print].June 10, 2012∙Larsson O, et al.,Distinct perturbation of the translatome by the antidiabetic drug metformin.PNAS [Epub ahead of print]. May 18, 2012∙Schulz T.C. et al.,A scalable system for production of functional pancreatic progenitors from human embryonic stem cells.PLoS ONE7(5):e37004.[Epub]. May 18, 2012∙Huang Y. et al.miR-146a regulates mechanotransduction and pressure-induced inflammation in small airway epithelium.FASEB J[Epub ahead of print].May 16, 2012∙Cajigas IJ, et al.,The Local Transcriptome in the Synaptic Neuropil Revealed by Deep Sequencing and High-Resolution Imaging.Neuron 74:453-466. May 10, 2012∙Wenemoser D, et al.,A molecular wound response program associated with regeneration initiation in planarians.Genes and Dev. 26: 988-1002. May 01, 2012∙Heiss BL, et al., MicroRNA Targeting of Neurotropic Flavivirus: Effective Control of Virus Escape and Reversion to Neurovirulent Phenotype.J Virology 86(10): 5647-5659. May 01, 2012∙Fanning S, et al., Divergent targets of Candida albicans biofilm regulator Bcr1 in vitro and in vivo.Eukaryot Cell [Epub ahead or print]. April 27, 2012∙Nam J, et al., Barcoded DNA-Tag Reporters for Multiplex Cis-Regulatory Analysis.PLoS One 7(4): e35934. April 26, 2012∙Ramadoss J, et al.,Multiplexed digital quantification of binge-like alcohol-mediated alterations in maternal uterine angiogenic mRNA transcriptome Physiol Genomics [Epub ahead of print]. April 24, 2012∙Neusiedler J et. al.,INT6 interacts with MIF4GD/SLIP1 and is necessary for efficient histone mRNA translation.RNA[Epub ahead of print]. April 24, 2012∙Hammer C, et al.,Replication of functional serotonin receptor type 3A and B variants in bipolar affective disorder: a European multicenter study Translational Psychiatry [Epub ahead of print]. April 17, 2012∙Morris C, et al., INT6/EIF3E interacts with ATM and is required for proper execution of the DNA damage response in human cells Cancer Res.72(8):2006-16. April 15, 2012∙Frantz AL, et al., Targeted deletion of MyD88 in intestinal epithelial cells results in compromised antibacterial immunity associated with downregulation of polymeric immunoglobulin receptor, mucin-2, and antibacterial peptides Mucosal Immunol. [Epub ahead of print]. April 11, 2012∙Barczak AK, et al., RNA signatures allow rapid identification of pathogens and antibiotic susceptibilities PNAS [Epub ahead of print]. April 02, 2012∙Santoni de Sio FR, et al., KAP1 regulates gene networks controlling mouse B lymphoid cell differentiation and function Blood [Epub ahead of print]. March 27, 2012∙Brankatschk B, et al., Regulation of the EGF Transcriptional Response by Endocytic Sorting Sci Signal 5(215), ra21. March 13, 2012∙Ranganathan R, et al., Regulation of acute graft-versus-host disease by microRNA-155Blood [Epub ahead of print]. March 09, 2012∙Wang S, et al., Genetic Dissection of the Canq1 Locus Governing Variation in Extent of the Collateral Circulation PLoS ONE 7(3): e31910.doi:10.1371/journal.pone.0031910 (2012). March 06, 2012∙Laborde RR, et al., Transcriptional Profiling by Sequencing of Oropharyngeal Cancer Mayo Clin Proc. 87(3):226-232. (2012).doi:10.1016/j.mayocp.2011.10.008. March 01, 2012∙Tsai YC, et al., Characterization of genes involved in cytokinin signaling and metabolism from rice Plant Physiology 158:1666-1684. March 01, 2012∙Donker RB, et al., The expression profile of C19MC microRNAs in primary human trophoblast cells and exosomes Mol. Hum. Repro [Epub ahead of print]. (2012). February 29, 2012∙Sullivan RP, et al., MicroRNA-Deficient NK Cells Exhibit Decreased Survival but Enhanced Function J Immunol 188(7):3019-30. February 29, 2012∙Gama L, et al., Expansion of a subset of CD14highCD16negCCR2low/neg monocytes functionally similar to myeloid-derived suppressor cells during SIV and HIV infection JLB [Epub ahead of print]. February 24, 2012∙Lai YS, et al., SRY (sex determining region Y)-box2 (Sox2)/poly ADP-ribose polymerase 1 (Parp1) complexes regulate pluripotency Proc Natl Acad Sci USA109(10):3772-7. (2012). doi/10.1073/pnas.1108595109. February 23, 2012∙van Schooneveld E, et al., Expression profiling of cancerous and normal breast tissues identifies microRNAs that are differentially expressed in serum from patients with (metastatic) breast cancer and healthy volunteers Breast Cancer Res. 14(1):R34. (2012). [Epub ahead of print].doi:10.1186/bcr3127. February 21, 2012∙Yuan J, et al., Lin28b Reprograms Adult Bone Marrow Hematopoietic Progenitors to Mediate Fetal-Like Lymphopoiesis Science 335(6073):1195-200. (2012.) DOI: 10.1126/science.1216557. February 16, 2012∙Finkel JS, et al., Portrait of Candida albicans Adherence Regulators PLoS Pathog 8(2): e1002525. (2012). doi:10.1371/journal.ppat.1002525. February 16, 2012∙Suh SS, et al., MicroRNAs/TP53 feedback circuitry in glioblastoma multiforme PNAS [Epub ahead of print]. February 14, 2012∙O’Connor CM, et al., Adoptive T-cell therapy improves treatment of canine non–Hodgkin lymphoma post chemotherapy Sci Rep2:249. Epub Feb 13.(2012). February 13, 2012∙Materna SC and Davidson EH, A comprehensive analysis of Delta signaling in pre-gastrular sea urchin embryos Developmental Biology364(1):77-87.January 27, 2012∙Denman CJ, et al., Membrane-Bound IL-21 Promotes Sustained Ex Vivo Proliferation of Human Natural Killer Cells PLoS One7 :Issue 1, e30264.January 18, 2012∙Chiappinelli KB, et al., Reduced DICER1 Elicits an Interferon Response in Endometrial Cancer Cells Mol Cancer Res 10(3):316-25. January 17, 2012∙Witwer KW, et al., Relationships of PBMC microRNA expression, plasma viral load, and CD4+ T-cell count in HIV-1-infected elite suppressors and viremic patients Retrovirology9:5 (2012). doi:10.1186/1742-4690-9-5.January 12, 20122011∙Ram O, et al., Combinatorial Patterning of Chromatin Regulators Uncovered by Genome-wide Location Analysis in Human Cells Cell147(7): 1628-39.December 23, 2011∙Ziller MJ, et al., Genomic Distribution and Inter-Sample Variation of Non-CpG Methylation Across Human Cell Types PLoS Genetics7(12):e 1002389. December 08, 2011∙Gupta RK, et al., Identifying Novel Transcriptional Components Controlling Energy Metabolism Cell 14(6):739-45. December 07, 2011∙Janus JR, et al., Linking Expression of FOXM1, CEP55 and HELLS to Tumorigenesis in Oropharyngeal Squamous Cell Carcinoma The Laryngoscope 121(12): 2598-603. December 01, 2011∙Wang W, et al., MicroRNA profiling of follicular lymphoma identifies microRNAs related to cell proliferation and tumor response Haematologica Nov 18. [Epub ahead of print]. (2011). November 18, 2011∙Guerau-de-Arellano M, et al., Micro-RNA dysregulation in multiple sclerosis favours pro-inflammatory T-cell-mediated autoimmunity Brain134(Pt12):3575-86. November 15, 2011∙Khan M, et al., Regulation of the Probability of Mouse Odorant Receptor Gene Choice Cell 147(4): 907-21. November 11, 2011∙Chevrier N, et al., Systematic Discovery of TLR Signaling Components Delineates Viral-Sensing Circuits Cell 147(4)853-67. November 11, 2011∙Northcott PA, et al., Rapid, reliable, and reproducible molecular sub-grouping of clinical medulloblastoma samples Acta Neuropathologica 123(4): 615-26.November 06, 2011∙Santagata S, et al., Using the Heat-Shock Response To Discover Anticancer Compounds that Target Protein Homeostasis ACS Chem Biol. 17;7(2):340-9.(2012). November 03, 2011∙Ioffe YJ, et al., Phosphatase and tensin homolog (PTEN) pseudogene expression in endometrial cancer: a conserved regulatory mechanism important in tumorigenesis?Gynecol Oncol 124(2):340-6. October 15, 2011 ∙Di Tullio A, et al., CCAAT/enhancer binding protein α (C/EBPα)-induced transdifferentiation of pre-B cells into macrophages involves no overt retrodifferentiation PNAS 108(41):17016-21. October 03, 2011∙Martin S.E. et al.,RNAi screening identifies TAK1 as a potential target for the enhanced efficacy of topoisomerase inhibitors.Curr Cancer Drug Targets 11(8): 976–986. October 01, 2011∙Delmore JE, et al., BET Bromodomain Inhibition as a Therapeutic Strategy to Target c-Myc Cell 146(6):904-17. September 16, 2011∙Guttman M, et al., lincRNAs act in the circuitry controlling pluripotency and differentiation Nature 477(7364):295-300. August 28, 2011∙Gamer LW, et al., BMPR-II is dispensable for formation of the limb skeleton Genesis 49(9):719-24. August 19, 2011∙Wyman SK, et al., Post-transcriptional generation of miRNA variants by multiple nucleotidyl transferases contributes to miRNA transcriptome complexity Genome Res 21(9):1450-61. August 03, 2011∙Welch JS, et al., Combination decitabine, arsenic trioxide, and ascorbic acid for the treatment of myelodysplastic syndrome and acute myeloid leukemia: A phase I study Am J Hematol 86(9):796-800. August 03, 2011∙Kulkarni MM. Digital Multiplexed Gene Expression Analysis Using the NanoString nCounter System Current Protocols in Molecular Biology [Epub]. August 01, 2011∙Textoris J, et al., An Evaluation of the Role of Gene Expression in the Prediction and Diagnosis of Ventilator-associated Pneumonia Anesthesiology 115(2):344-52 (2011). August 01, 2011∙Fresneau B, et al., Vinblastine in the treatment of children and adolescents with refractory immune thrombocytopenia Am J Hematol86(9):785-7. July 28, 2011∙Novikov A, et al., Mycobacterium tuberculosis Triggers Host Type I IFN Signaling To Regulate IL-1b Production in Human Macrophages J Immunol 187(5): 2540-7. July 22, 2011∙Zhang W, et al., Type-A response regulators are required for proper root apical meristem function through post-transcriptional regulation of PIN auxin efflux carriers The Plant Journal Volume 68, Issue 1, Pages 1-10. July 21, 2011∙Hochbaum D, et al., DAF-12 Regulates a Connected Network of Genes to Ensure Robust Developmental Decisions PLoS Genetics 7(7):e1002179. July 21, 2011∙Lebedeva S, et al., Transcriptome-wide Analysis of Regulatory Interactions of the RNA-Binding Protein HuR Cell 43:1-13. June 30, 2011∙Haynes K, Silver P, Synthetic Reversal Of Epigenetic Silencing J. Biol. Chem.jbc.C111.229567. June 12, 2011∙Baker K, et al., Neonatal Fc receptor for IgG (FcRn) regulates cross-presentation of IgG immune complexes by CD8?CD11b+ dendritic cells PNAS 108(24):9227-32. May 31, 2011∙McNab FW, et al., Programmed death ligand 1 is over-expressed by neutrophils in the blood of patients with active Tuberculosis Eur. J. Immunol.41: 1941?1947. May 27, 2011∙Schwanhausser B, et al., Global quantification of mammalian gene expression control Nature 473:337-342. May 18, 2011∙Manning G, et al., Assessing a new gene expression analysis technique for radiation biodosimetry applications Radiation Measurements [Epub ahead of print]. May 11, 2011∙Skirycz A, et al., Pause-and-Stop: The Effects of Osmotic Stress on Cell Proliferation during Early Leaf Development in Arabidopsis and a Role for Ethylene Signaling in Cell Plant Cell 23(5):1876-88. May 10, 2011∙Orlovsky K, et al., Down-regulation of homeobox genes MEIS1 and HOXA in MLL-rearranged acute leukemia impairs engraftment and reduces proliferation PNAS vol. 108 no. 19 7956-7961. May 10, 2011∙Singh H, et al., Reprogramming CD19-specific T cells with IL-21 signaling can improve adoptive immunotherapy of B-lineage malignancies Cancer Res 71(10):3516-27. May 10, 2011∙Reis PP, et al., mRNA transcript quantification in archival samples using multiplexed, color-coded probes.BMC Biotechnol vol. 108 no. 19 7956-7961.May 09, 2011∙Rabani M, et al., Metabolic labeling of RNA uncovers principles of RNA production and degradation dynamics in mammalian cells Nature Biotechnology 29: 436-442. April 24, 2011∙Lin Y, et al., Effective posttransplant antitumor immunity is associated with TLR-stimulating nucleic acid?immunoglobulin complexes in humans J Clin Invest doi:10.1172/JCI44581. April 01, 2011∙Cools T, et al., The Arabidopsis thaliana Checkpoint Kinase WEE1 Protects against Premature Vascular Differentiation during Replication Stress.Plant Cell 23(4): 1435-48. April 01, 2011∙Baugh LR, et al., Sensitive and Precise Quantification of Insulin-Like mRNA Expression in Caenorhabditis elegans.PLoS ONE 6(3). March 22, 2011∙Sun Z, et al., Integrated Analysis of Gene Expression, CpG Island Methylation, and Gene Copy Number in Breast Cancer Cells by Deep Sequencing PLoS ONE Vol 6-2, e17490. February 25, 2011∙Bock C, et al., Reference Maps of Human ES and iPS Cell Variation Enable High-Throughput Characterization of Pluripotent Cell Lines Cell 144, 439-452.February 04, 2011∙Wurbel MA, et al., CCL25/CCR9 Interactions Regulate Large Intestinal Inflammation in a Murine Model of Acute Colitis PLoS ONE6(1):e16442.January 25, 20112010∙Beaume M, et al., Orientation and expression of methicillin-resistant Staphylococcus aureus small RNAs by direct multiplexed measurements using the nCounter of NanoString technology.J Microbiol Methods 84(2):327-34.December 31, 2010∙Anakk S, et al., Combined deletion of Fxr and Shp in mice induces Cyp17a1 and results in juvenile onset cholestasis The Journal of Clinical Investigation.10.1172. December 01, 2010∙Kabacik S, et al., Gene expression following ionising radiation: Identification of biomarkers for dose estimation and prediction of individual response Int. J.Radiat. Biol. Vol. 87; 1-15. November 10, 2010∙Chaussabel D, et al., Blood Transcriptional Fingerprints to Assess the Immune Status of Human Subjects Immunologic Signatures of Rejection Part 3, 105-125. November 03, 2010∙Cools T, et al., A replication stress-induced synchronization method for Arabidopsis thaliana root meristems Plant J. October 26, 2010∙Andersen J, et al., An integrated genomic and epigenomic approach predicts therapeutic response to zebularine in human liver cancer Sci. Transl. Med. 2, 54ra77. October 20, 2010∙Strobl-Mazzulla PH, et al., Histone Demethylase JmjD2A Regulates Neural Crest Specification Developmental Cell 19(3):460-8. September 14, 2010∙Yassour M, et al., Strand-specific RNA Sequencing Reveals Extensive Regulated Long Antisense Transcripts that are Conserved Across Yeast Species Genome Biology 11:R87. August 26, 2010∙D’Angelo J, et al., The Cystine/Glutamate Antiporter Regulates Dendritic Cell Differentiation and Antigen Presentation The Journal of Immunology 185:3217-3226. August 23, 2010∙Garay J, et al., Crosstalk Between PKA and Epac Regulates the Phenotypic Maturation and Function of Human Dendritic Cells The Journal of Immunology 185:3227-3238. August 20, 2010∙Guiducci C, et al., TLR recognition of self nucleic acids hampers glucocorticoid activity in lupus Nature 465, 937?941. June 17, 2010∙Kim C, et al., Gene-expression-based prognostic assays for breast cancer Nature Reviews Clinical Oncology 7, 340-347. June 07, 2010∙Dixit E, et al., Peroxisomes Are Signaling Platforms for Antiviral Innate Immunity Cell Vol. 141, Issue 4, 668-681. May 06, 2010∙Materna S, et al., High accuracy, high-resolution prevalence measurement for the majority of locally expressed regulatory genes in early sea urchin development Gene Expression Patterns doi:10.1016/j.gep.2010.04.002. April 14, 2010∙Nam J, et al., Functional cis-regulatory genomics for systems biology Proc Natl Acad Sci USA 107(8):3930-5. February 23, 2010∙Smith ER, et al., Nuclear entry of activated MAPK is restricted in primary ovarian and mammary epithelial cells PLoS One5(2):e9295. February 18, 20102009∙Ouellet M, et al., A rapid and inexpensive labeling method for microarray gene expression analysis BMC Biotechnology 9(1):97. November 25, 2009∙Peter IS and Davidson EH, The endoderm gene regulatory network in sea urchin embryos up to mid-blastula stage Developmental Biology Special Section: Gene Regulatory Networks for Development (340)(2), 188-199.November 09, 2009∙Amit I, et al., Unbiased Reconstruction of a Mammalian Transcriptional Network Mediating Pathogen Responses Science Vol. 326. no. 5950, 257-263.October 09, 2009∙Palamanda JR, et al., Evaluation of CYP1A1 and CYP2B1/2 m-RNA Induction in Rat Liver Slices Using the NanoString Technology: A Novel Tool for Drug Discovery Lead Optimization Drug Metabolism Letters(3):171-5. August 01, 2009∙Payton J, et al., High throughput digital quantification of mRNA abundance in primary human acute myeloid leukemia samples The Journal of Clinical Investigation 119(6): 1714-1726. May 18, 2009∙Vladislav MA, et al., Multiplexed measurements of gene signatures in different analytes using the Nanostring nCounter? Assay System BMC Research Notes 2: 80 (2009). May 09, 2009∙Birtwell S, et al., Microparticle encoding technologies for high-throughput multiplexed suspension assays Integrative Biology 1: 227‐436 (2009). May 07, 2009∙Su YH, et al., A perturbation model of the gene regulatory network for oral and aboral ectoderm specification in the sea urchin embryo Developmental Biology 329: 410-421. March 04, 20092008∙Geiss G, et al., Direct multiplexed measurement of gene expression with color-coded probe pairs Nature Biotechnology26: 317-25 (2008). February 08, 2008。
