醛和酮(二)
第11章_醛和酮-2
与RMgX的1,2加成后水解:
产物形式上:R-H与羰基的加成(R带负电)
δ-
δ+ C 4
Cδ-3δ+OC2 1
① R- L+i 或
δ- δ+
① RMgX
δ- δ+
①R2CuLi
δ- δ+ RH
②H3O+ 1,4-加成
HO CCC R
1,4加成后水解产物形式上:RH与双键的加成。
δ+ C 4
δCδ-3δ+OC2
Nu
R
L
L:大, M:中, S:小。
优势构象:L与C=O反式共平面;
亲核试剂易从S的一边进攻羰基。
O
S
M
Nu- + ·
RL
O-
S
M
·
Nu
R
Br
L
O
SH
M
Et
δMg H3δC H O
CH3MgBr
Et H2O H H H3C
OH Et
H
H Ph L
H Ph
Ph
主要产物
亲核试剂易从S的一边进攻羰基。
2. 亲核试剂的体积大小对加成方向的影响
C2H5 H
B. 4 位上位阻大,以1,2-加成为主。
Oδ-
C6H5CH=CHCδ+H
C2H5MgBr δ- δ+
H2O
C6H5CH
C2H5 H
OH CHCH
C2H5
2. 与强亲核试剂RLi反应,以1,2-加成为主.
δ-O
δ+
(1)PhLi
OH Ph
(2δ-)H2δO+ Ph H
课堂_第十二章_醛和酮 (2)

CH3CH2MgX
CH2CH3 CH3 C CH2CH3
OMgBr
CH2CH3 CH3 C OH CH 2CH 3
所有的格氏试剂均需自制。
空间位阻的影响
O (CH3)3CCC(CH3)3 =
OH (CH3)3CCC(CH3)3 80% C2H5
+ C2H5MgBr
= =
O (CH3)3CCC(CH3)3 + CH3CH2CH2MgBr O (CH3)3CCC(CH3)3 + (CH3)2CHMgBr
第十二章
醛和酮
本章提纲
一、 醛酮的定义和分类 二、 醛酮的结构 三、 醛酮的物理性质 四、 醛酮的反应 五、 醛酮的制备
第一节 醛酮的定义和分类
一、定义:羰基和烃基(或氢原子)相连的烃 的衍生物
羰基: 酮: 醛: 醛基:
O C
O R C R'
O R C H
O C H
(甲酰基)
对应的醛和酮是同分异构体
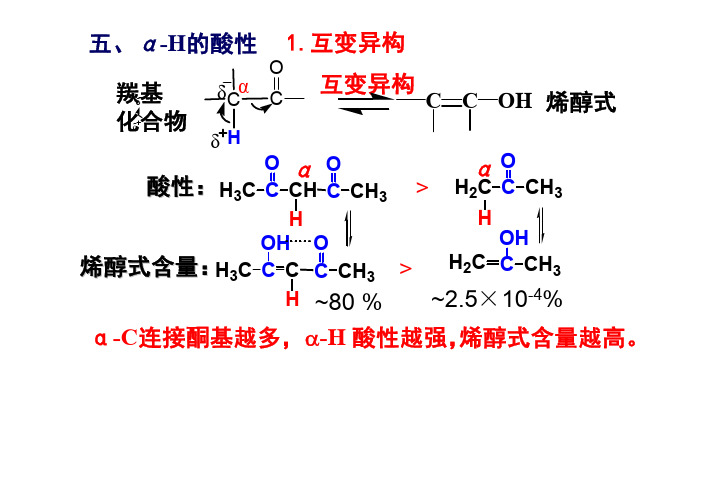
C=C C OH R
(CH3)2CHCH2MgX + CH2O 无水醚 (CH3)2CHCH2CH2OMgX H2O (CH3)2CHCH2CH2OH
用甲醛在分子中引入羟甲基
解二
O
(CH3)2CHMgX + 无水醚 (CH3)2CHCH2CH2OMgX H2O (CH3)2CHCH2CH2OH
用环氧乙烷在分子中引入羟乙基
R C=O
+
R HC(OC2H5)3 C
OC2H5
+
R R
R
C=O
+
HC(OC2H5)3
OC2H5 R R OC2H5 + HCOOC2H5 C OC2H5 R
有机化学 第9章 醛和酮(2)

2020/8/3
11
2. 炔烃和胞二卤代物的水解
3. 烯烃的臭氧化
2020/8/3
12
4.烯烃的羰基化法 烯烃的羰基化法是制备醛的重要方法。反应一般需要高压和过渡金属催化,最常用的 催化剂为羰基钴
5. 傅-克酰基化
2020/8/3
13
6. 瑞默-梯曼(Reimer-Tiemann)反应
2020/8/3
2.酮也能与醇生成半缩酮或缩酮,反应相对困难;常用原甲酸酯在酸催化下与酮反 应来制备缩酮,例如:
2020/8/3
20
3. 环状缩醛或酮——有机合成中的保护基团
缩醛或酮结构特征,醚,对碱性条件、亲核 试剂稳定;将醛/酮羰基转换为缩醛或酮, 对碱性条件、亲核试剂稳定
2020/8/3
21
4. 亲核试剂的亲核能力,例如:氢氧根代替水做亲核试剂
第9章 醛和酮
2020/8/3
1
2020/8/3
2
1. 醛和酮的结构及命名 2. 羰基的结构、亲核加成反应概述,底物对亲核加成反应的影响 3. 羰基与含碳亲核试剂的加成,包括:与氢氰酸、格式试剂、炔负离子的反应
4. 羰基与含氧亲核试剂的加成,包括半缩醛(酮)、缩醛(酮),有机合成中的 保护和去保护
最常用的氧化剂: (1) 高锰酸钾 (2) 铬氧化剂
铬酸(适合于将仲醇氧化为酮 ) Collins试剂 [C5H5N] 2CrO3 in CH2Cl2 氯铬酸吡啶盐(PCC) 重铬酸吡啶盐(PDC) [C5H5NH] 2[Cr2O7]
2020/8/3
10
Swern氧化 Swern氧化的反应活性高,特别适合于有立体位阻的醇的氧化,但通常都需要在低 温下进行。 二甲基亚砜-二环己基碳二亚胺(DMSO-DCC);二甲基亚砜-乙酸酐 (DMSO-Ac2O); 二甲基亚砜-三氟乙酸酐[DMSO-(CF3CO)2O]; 二甲基亚砜-草酰氯
醛、酮习题(二)
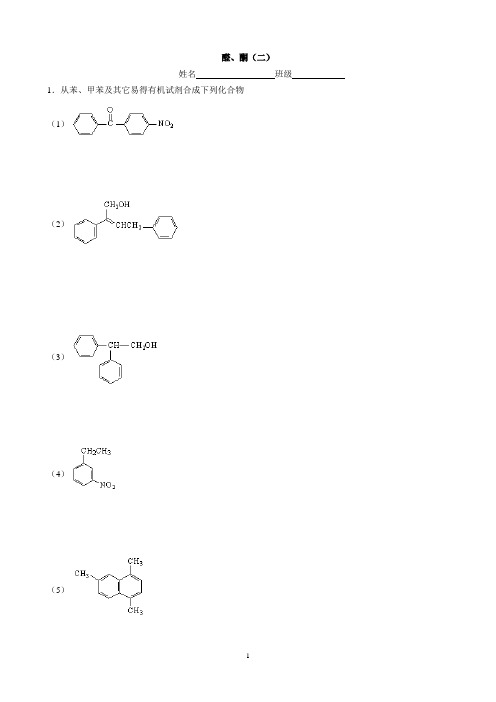
醛、酮(二)姓名班级1.从苯、甲苯及其它易得有机试剂合成下列化合物(1)(2)(3)(4)(5)2.化合物(A ),分子式为C 10H 16O ,与吐伦试剂作用生成银镜,(A )经Ni 催化加氢可先后得到化合物(B ),分子式为C 10H 20O 和化合物(C ),分子式为C 10H 22O ,(A )经O 3,Zn/H 2O 处理得到乙二醛、丙酮和化合物(D ),(D )被AgNO 3的氨水溶液氧化为化合物(E ),分子式为C 5H 8O 3,(E )经I 2—NaOH 溶液作用生成碘仿,(A )与H 2SO 4共热可得到对异丙基甲苯,请推测(A )的结构式,并写出各步反应。
3.化合物(A ),分子式为C 9H 14O ,可以和氨基脲( )或羟胺(NH 2OH )反应,能使Br 2/CCl 4或冷稀KMnO 4溶液褪色,与吐伦试剂不反应。
(A )被选择性还原得到(B ),分子式为C 9H 16O ,(B )与羟胺反应得到一个固体。
但(B )不能使Br 2/CCl 4或冷稀KMnO 4溶液褪色。
(A )还可被还原到(C ),分子式为C 9H 18O ,(C )不与羟胺反应,也不能使Br 2/CCl 4或冷稀KMnO 4溶液褪色,但可以使CrO 3/H +溶液变绿。
化合物(A )被强氧化剂氧化时可分别得到:(CH 3)2CHCOOH CH 2COOH+CH 3COCOOH 及(CH 3)2CHCH 2COOH CH 2COOH+CH 3COOH推测(A )、(B )、(C )的构造式,并写出其反应式。
NH 2C NH NH 2O4.化合物(A),分子式为C8H14O,能使Br2/CCl4溶液褪色,并与苯肼反应生成相应的腙。
(A)经KMnO4氧化得到丙酮和化合物(B),(B)具酸性,(B)与NaOH—I2反应生成CHI3黄色沉淀和丁二酸,试推测(A)的可能构造式,并写出相应反应式。
5.某不饱和化合物A(C16H16)与稀、冷的KMnO4作用后得产物B(C16H18O2)。
第三节烃的含氧衍生物考点(二)醛、酮-课件新高考化学一轮复习

2.最简单的酮——丙酮 (1)物理性质:无色透明的液体,沸点 56.2 ℃,易挥发,能与水、乙醇等互 溶。 (2)化学性质:丙酮不能被银氨溶液,新制的 Cu(OH)2 等弱氧化剂氧化,在 催化剂条件下,可与 H2 发生加成 反应,生成 2-丙醇,反应的方程式为
3.酮的应用 酮是重要的有机溶剂和化工原料。如丙酮可以做化学纤维等的溶剂,还用 于生产有机玻璃、农药和涂料等。 [微点拨] 酮和同碳原子数的醛属于同分异构体,如丙酮和丙醛互为同分异构体。
式
CH3COONa+Cu2O↓+3H2O
[微点拨] 乙醛与银氨溶液或者新制氢氧化铜反应均在碱性环境中,所以乙 醛被氧化后的乙酸均以羧酸盐的形式存在。
③催化氧化 乙醛在有催化剂并加热的条件下,能被氧气氧化为乙酸,反应的化学方程式
催化剂 为 2CH3CHO+O2 ―△―→ 2CH3COOH 。
[微点拨] —CHO 具有明显的还原性,能被酸性高锰酸钾溶液等强氧化剂氧 化为—COOH,故能使酸性高锰酸钾溶液褪色。
[题点全盘查] 1.判断正误(正确的打“√”,错误的打“×”)。
(1)
属于饱和一元醛
(2)乙醛是无色体,不溶于水
(3)乙醛既能发生氧化反应又能发生还原反应
(4)能发生银镜反应的有机物都属于醛类有机物
(5)甲醛常温下为气体,其水溶液可用于浸制生物标本
答案:(1)× (2)× (3)√ (4)× (5)√
⑥银镜可用稀 HNO3 浸泡洗涤除去
色沉淀,这是 Cu(OH)2 受热分解生 成 CuO 所致
【解析】
A. O
B. P
C. Mn
D. Cr
D. 自由电子受外力作用时能迅速传递能量
谢 谢观
【答案】D
《醛和酮 糖类》 课件2

新 课 标 资 源 网
1.与极性试剂的加成
, (R )H
老 师 都 说 好 !
R
C O +A B
d+ d -
d+ d -
(R )H
,
R
C
B
OA
新 课 标 资 源 网
老 师 都 说 好 !
请写出乙醛分别与氢 氰酸、氨气、甲醇的反应 方程式。
乙醛与几种试剂的加成反应过程
6 10 5 n 2
△
6 12 6
淀粉或纤维素
葡萄糖
新 课 标 资 源 网
淀粉是植物的主要能量储备形式,也是人类 膳食中糖类的主要来源。淀粉遇到碘溶液时会显 蓝色是淀粉的一种特殊性质,利用这一性质可以 鉴定淀粉的存在。
老 师 都 说 好 !
新 课 标 资 源 网
B.CH2=CH–CHO O || D.CH3–O–C–H
新 课 标 资 源 网
2. 醛、酮的命名 选主链 选择含有羰基的最长的碳链为 主链,并根据主链上的碳原子个数,确定 为“某醛”或“某酮”。 编号码 从靠近羰基一端开始编号。
老 师 都 说 好 !
写名称 与烷烃类似,不同的是要用阿 拉伯数字表明酮羰基的位置。
O
||
⑤ CH3–C–CH2–CH2–CH3 ⑦
CH3–CH2–C–CH2–CH3
O CH3 || CH3–C–CH–CH 3
新 课 标 资 源 网
同分异构体异构类型
官能团类型异构 官能团位置异构 碳骨架异构
老 师 都 说 好 !
3. 常见简单醛、酮的物理性质
老 师 都 说 好 !
新 课 标 资 源 网
第二章第三节醛和酮糖类 (第二课时)

多
糖
多糖是一个分子能水解成多个单糖分子的糖 类。多糖广泛存在于自然界中,是一类天然有机 高分子化合物。常见的多糖有淀粉和纤维素,它 们的分子都是由数目巨大的葡萄糖单元相互连接 得到的,组成通式为(C6H10O5)n。它们在性质上与 单糖、双糖有很大的区别,没有甜味且不溶于水。 它们水解的最终产物相同,都是葡萄糖: H+ nC H O (C H O ) +nH O
单糖 糖 二糖 多糖
葡萄糖、果糖 蔗糖、麦芽糖 淀粉 纤维素
单
糖
单糖是不能水解为更小糖分子的糖类。 葡萄糖和果糖是两种重要的单糖,二者互为 同分异构体,分子式为C6H12O6。葡萄糖和果 糖的结构简式分别为:
CH2OH C=O HO-C-H H-C-OH H-C-OH CH2OH CH2OH 果糖 葡萄糖 葡萄糖分子中有一个醛基和五个羟基,是一 种六碳醛糖。
RCHO+H2 高温、高压 RCH2OH R R Ni
高温、高压
Ni
C=O+H2
R R
CHOH
在特定的条件下醛、酮还能被还原为烃,这 个反应在有机合成中有重要的应用价值。
随堂检测
1.与银氨溶液反应
CH3CHO+2[Ag(NH3)2]++2OH - → CH3COO-+NH4++2Ag+3NH3+H2O CH3CH2OH 催化剂 2CH3COOH 催化剂
淀粉发酵制酒 纤维素硝酸酯 纤维素乙酸酯
4.糖类和生命活动
阅读课本P78结合生物知识体会相关知识
糖的分类、代表物、特征: 分类 代表物
特征 不水解,有还原性
无还原性,能水解 有还原性,能水解
单糖 葡萄糖
第八章 醛和酮(一)醛和酮的命名(二)醛和酮的结构(三)醛和

N
六亚甲基四胺(乌咯托品)
(己)与Wittig试剂加成
Ph3P + CH3CH2Br C6H6
PhLi
Ph3PCH2CH3 Br
Ph3P=CHCH3 + C6H6+LiBr
Ph3P CHCH3
O CH3 C CH3 + Ph3P=CHCH3
O PPh3 CH3 C CHCH3
CH3
O PPh3 CH3 C CHCH3 0oC CH3 C CHCH3 + Ph3P O
C
O
92%
(4)羧酸衍生物的还原
COCl
LiAl(OBu-t)3H OCH3 乙醚,-78 oC
CH3
H+/H2O
CHO
OCH3 CH3
60%
CH3(CH2)10
COOC2H5
Al(Bu-n)2H 己烷,-78 oC
H+/H2O CH3(CH2)10 CHO 88%
(5)芳烃的氧化
V2O5 CH3 + O2(air) 350-360oC
CH CCOOH CH3
(丙)Mannich反应
O CCH3 HCHO
HN(CH3)2 HCl
O CCH2CH2N(CH3)2
H3C
CO +HCl AlCl3_ CuCl, 20oC
H3C
CHO
(四)醛和酮的物理性质
沸点:介于烃、醚与醇、酚之间。
CH3CH2CH2CH3 CH3OCH2CH3 CH3CH2CHO CH3COCH3 CH3CH2CH2OH
沸点/ oC -0.5
8
49
56
97
CH2CH3
CHO
有机化学第09章 醛酮(2)

2)用化学还原剂还原 ——还原产物均为醇 常用的化学还原剂:
NaBH4 , Al[OCH(CH3)2]3/(CH3)2CHOH,
LiAlH4
特点 ①NaBH4在水/醇中是一种非常缓和的还原剂,
O
选择性高,一般只还原醛酮的 C ,不还原
C C , C C , NO2
CN
COOH, COOR
可用此还原剂合成不饱和醇。
+ CH3(CH2)2COCl
CO(CH2)2CH3
Zn-Hg ,HCl
( CH2)3 CH3
②沃尔夫—凯息纳(L.Wolff-N·M·Kishner)—黄鸣龙法
C O NH2 NH2 , KOH 三 甘醇
CH2
CH2-CH2 CH2-CH2 CH2-CH2 OH OH OH OH OH OH
原来Wolff-Kishner的方法是将醛或酮与肼和金属钠或钾 在高温(约200 °C)下加热反应,需要在封管或高压釜中 进行,操作不方便。 黄鸣龙改进不用封管而在高沸点溶剂如一缩二乙二醇 (二甘醇,b.p.245 °C)中,用氢氧化钠或氢氧化钾代替 金属钠反应
H2O2 OH-
3 RCH=CHOH
重 排 RCH2CHO
2、从芳烃制备 1)F – C 酰基化反应
+
COCl
2)伽特曼 – 科赫反应
苯环上有强吸电子取代基不反应
O
AlCl3
82
C
CH3+ CO + HCl AlCl3-CuCl2
反应条件:
H3C
CHO
只有苯、烷基苯、烷氧基苯可反应,产物多为对位,
O
OH
RCH=CHCCH3 NaBH4 RCH=CHCHCH3
第四章 醛和酮

,有微弱的甲醛气味。沸点
187-189℃,溶于水和乙醇。
戊二醛是一种新型消毒剂,具有广谱、高效的灭菌作用, 具有对金属腐蚀性小、受有机物影响小等优点,常用于医 疗器械,尤其是金属器械的消毒。
第三节 重要的醛和酮
5、丙酮
最简单的酮,无色液体,易挥发,易燃,具有令人愉 快的气味(辛辣甜味)。
丙酮是糖类物质的分解产物,在 糖尿病人尿液中含量高,故尿检 丙酮可用于诊断糖尿病。
1、甲醛(蚁醛) 无色、有强烈刺激性气味的气体,易溶
于水,有较高的毒性。
40%的甲醛水溶液(福尔马林) 有杀菌和防腐能力。
甲醛
白血病
第三节 重要的醛和酮
2、乙醛 无色、有刺激性气味的液体,密度比水小,易挥
发、易燃烧,能和水、乙醇、乙醚、氯仿互溶 。
乙醛 水合氯醛
聚合
三聚乙醛(副醛) 催眠作用
临床常用10%的水溶液为长时间作用的催眠药 ,用于失眠、烦躁、不安和惊厥
课堂互动 1、既能与氢加成又能与希夫试剂反应的是( B )
A:丙烯
B:丙醛
C:丙酮
D:苯
2、检查糖尿病病人尿液中的丙酮,可采用( A ) A:斐林试剂 C: 氢氧化钠和硫酸铜 B:希夫试剂 D:碘溶液和氢氧化钠溶液
3、如何鉴别苯酚、乙醛、甲醛和丙酮 ???
目录
节目录上一页下一页 Nhomakorabea返回
第三节 重要的醛和酮
写出丙酮的结构 式,说出丙酮的 官能团。
临床上检查糖尿病患者血液及尿
液中的丙酮时,可用亚硝酰铁氰 化钠的碱溶液,若有丙酮则尿液
呈现鲜红色。
第一节 醛和酮的结构、分类和命名
一、乙醛和丙酮 二、醛和酮的结构 三、醛和酮的分类和命名
醛和酮 (2)优秀课件

一. 醛酮的性质(II)
复习:醛酮与负离子型亲核试剂的加成
OH
R C CCR
OH RC R
H(R)
(R)H
1. M C C R
OH
1. RMgX 2. H2O
R
2. H2O
RC H
1. LiAlH4
H(R)
O
or NaBH4
C
2. H2O
H (R )
ONa R C SO3H
NuH
可逆
O C NuH
较易离去
•结论:
分子型亲核 试剂难直接 与羰基加成
•预测: H+存在下与羰基加成
H+ O C
羰基亲电 性增强
O H 易加成 C
HNu
结论:酸性条件有助分子型亲
核试剂向羰基的加成
O H C NuH
- H H
O H C Nu
O H C N u
O H C O H 偕二醇
O H C O R 半缩醛(酮)
O H C N H R a羟基胺
不稳定,可进一步转变
1.1 醛酮与 H2O 加成
O C
+ H 2O
H +
例
O
HCH
O H3C C H
O
H3C C CH3
•给电子基 •位阻
H2O H2O H2O
O H C O H
偕二醇
H2C(OH)2
100%
CH3CH(OH)2
~ 58%
(CH3)2C(OH)2
0%
CH3
(2) H2O
OO
C
R
(CH2)2
H2O H+
O
有机化学03醛酮2

有吸电子基团可以形成稳定水合物。 水合物在酸性介质中不稳定。
与ROH的加成
半缩醛(酮)、缩醛(酮)的生成
H+
CH3CH=O + CH3CH2OH
OCH2CH3 CH3CH OH
反应要在无水条件下进行,一般
采用无水条件下通入HCl气体来 催化反应。
半缩醛
CH3CH2OH, H+
CH3CH
OCH2CH3 OCH2CH3 缩醛
特点
只有醛、脂肪族的甲基酮、环酮能发生此反应。
乙醛(89%) 己酮(~35%)
O
>
丙酮(56.2%) 3-戊酮(2%)
O O
丁酮(36.4%) 苯乙酮(1%)
O
>
>
反应体系须维持弱酸性
NaHSO3 + HCl 2NaHSO3 + Na2CO3
NaCl + H2SO3
H2O + SO2
2Na2SO3 + H2CO3 H2O + CO2
? OHC
+ CH3CH2OH CHO
缩酮在稀酸中水解,生成原来的醇和酮。
O
+ H2O H+
O
O + HOCH2CH2OH
形成缩醛或缩酮在合成中的应用
A 保护羟基
O
BrCH2CH2CH2CH2OH H+
BrCH2CH2CH2CH2O+H O
-H+
BrCH2CH2CH2CH2O O
Mg
无水乙醚 BrMgCH2CH2CH2CH2O
2.0 10-2
OO CH3CCH2CCF3
最多
烯醇化的反应机理
第八章醛酮和羧酸总结

(四)乙二酸HOOC-COOH 俗称草酸,常以盐的形式广泛存在于草本植物及藻类的 细胞中。为无色晶体,通常含有2个结晶水,加热至 100℃,失去结晶水称为无水草酸,草酸易溶于水和乙醇。 草酸容易与钙质反应生成难溶的草酸钙,在体内可影响 人体对钙质的吸收。在体内累积可形成结石。
酮体
β-丁酮酸、β-羟基丁酸、丙酮三者合称为酮体。 检查酮体的方法是向尿液中加入几滴5%的亚硝酰铁 氰化钠及氢氧化钠溶液,若尿液呈现红色,表明有 酮体存在。
(二)乙醛CH3CHO
为无色、具有刺激性气味、易挥发的液体,能溶于水、乙醇 和乙醚。 乙醛中通入氯气可得三氯乙醛,三氯乙醛与水作用生成水合 三氯乙醛,简称水合氯醛。是比较安全的催眠药和镇静药。
(三)丙酮CH3COCH3
无色、易挥发、易燃、有特殊香味的液体,易溶于 水,能溶解多种有机物质,是常用的有机溶剂。 糖尿病患者中,丙酮可过量排出,可向尿液中滴加 亚硝酰铁氰化钠溶液和氢氧化钠溶液,如有丙酮存 在,尿液即呈鲜红色。
2.酯化反应 在强酸的催化下,羧酸与醇作用生成酯和水的反应称为 酯化反应。
浓硫酸
CH3-COOH + HO-CH2-CH3
CH3-COO-CH2-CH3 +H2O
O ‖ 羧酸分子中去掉羧基上的羟基,剩下的部分称为酰基 R- C – , O ‖ 如乙酸分子中去掉羟基剩下的部分称为乙酰基 CH3- C –
Thanks for listening!
(二)醛和酮的命名
简单的脂肪醛、酮的命名是根据碳原子的个数称为某 醛或某酮。
O ‖ H - C –H 甲醛
O ‖ CH3 - C –H 乙醛
O ‖ CH3 - C –CH3 丙酮
复杂的脂肪醛、酮的命名则采用系统命名法。 命名时,选择含羰基碳原子在内的最长碳链作为主 链,支链作为取代基,根据主链碳原子数称为某醛或某酮。 从靠近羰基较近的一端开始给主链碳原子编号,取代基的 位次、数目和名称写在醛或酮名称的前面。醛基因位于碳 链的首端,其位次不必标示;酮基的位次标在某酮前面, 中间用短线隔开。 O H3 C O ‖ ︱ ‖ CH3 - C –CH2-CH2-CH3 CH3-CH - C –H 2-戊酮 2-甲基丙醛
第十二章 醛和酮

二.醛酮的化学性质
醛酮的化学性质主要取决于羰基,因为醛、 酮都含有羰基,但醛和酮的结构并不完全相同, 醛基中的羰基与氢原子相连,而酮基则没有与氢 原子相连。因此醛和酮的化学性质上又存在着明 显的差异。醛和酮的主要反应部位如下:
HO
R C CH (R')
H
化学工业出版社
思考:分析醛基的结构,推测其 在化学反应中的断裂方式
化学工业出版社
O R C H(CH3) + HCN
O
OH
R C H(CH3) CN OH
CH3 C H + HCN
CH3 C H
CN
醛、酮与氢氰酸的加成反应是有机合成中增
长碳链的一种方法 。但由于氢氰酸和氰化钾均有
剧毒,实际上很少使用这一方法。α-羟基腈在酸
性条件下可以水解生成α-羟基酸或不饱和烯酸。
CHO
O
化学工业出版社
三、醛、酮的命名
简单的醛、酮使用普通命名法。结构复 杂的醛、酮则使用系统命名法
(一)普通命名法
醛的普通命名法与醇相似,只需根据碳原子数 称为“某醛”。例如:
HCHO CH3CHO CH3CH2CHO
甲醛
乙醛
丙醛
化学工业出版社
酮的普通命名法与醚相似,按酮基所连的 两个烃基来命名。例如:
O CH3 C CH2CH3
O CH3CH2 C CH2CH3
甲(基)乙(基)酮 二乙(基)酮
O
O
C CH2CH3
C
苯(基)乙(基)酮
二苯(基)酮
化学工业出版社
(二)系统命名法
1.脂肪醛、酮命名:
(1).选主链:选择含有羰基的最长碳链为主链,根据 主链碳原子数目称为“某醛”或“某酮”.
有机化学:第十章 醛、酮类羰基化合物 (2)

C N OH 肟
H2N-NH2 肼
C N NH2 腙
H2N NH
苯肼
NO2
H2N NH
NO2
2,4-二硝基苯肼
C N NH
苯腙
C N NH
NO2
NO2
2,4-二硝基苯腙
羰基化合物胺类加成产物多数为晶体,有固定的熔点,与稀 酸作用,可水解成原来的醛或酮,常用来鉴定(熔点)、分离和 提纯醛或酮。
如苯腙衍生物的应用
C
O
δ+
δ-
CO
羰基化合物电子云结构
2 羰基化合物分类
2.1 按羰基连接的烃基分类 O
脂肪族: CH3 CHO CH3 C CH3 (饱和)
O
CH2 CH CHO CH2 CH C CH3(不饱和)
O
芳香族:
CHO
C
2.2 按羰基数目
一
CH3CH2CH2 CHO
元
O
O
CH3 C CH3 CH3 C C2H5
反应通式:
H2N Y
反应机理:
席呋碱类
C O + H2N Y
OH H C NY
OH CN Y
H
H2O C N Y
加成-消除机理。
反应特点: 反应种类多,大多数羰基化合物都能反应。
H2N-H 氨 H2N-R(Ar) 伯胺
C NH
亚胺
C
N R (Ar)
取代亚胺 西佛(Schiff)碱
H2N-OH 羟胺
C: 醛、酮与炔化钠的加成
R-CC-Na+ + C=O NH3(液)
或乙醚
NaNH2 (-NH3)
R-CCH
C CR H2O C
第九章醛和酮-2

维生素D2 18%
2
O ph3P=CHCH=Pph3
CHCH
NR2 O CHO
CH3
O NR2
O O Pph3Br NaOC2H5, DMF
H3+O
NR2 O
CH3
O NR2
NR2 O OO
CH3
O NR2
HO
CHO
N C6H13
S CH2Pph3Br (CH3)3COK
OH CH3CH R
a. 鉴别:
卤仿反应的用途:
CH2CHO
O
NaOI
C-CH3
无黄色沉淀 CHI(3 黄 )
CH3CH2OH
NaOI CHI(3 黄 )
CH3CH2CH2CH2OH
无黄色沉淀
b. 合成:制备不易得到的羧酸类化合物。例:
O C-CH3 NaOCl
O C-ONa H+
O C-CH3 NaOCl
R2
R1 R2 CH-S(CH3)2 X
生成叔锍盐
O
CH3SCH2Na R2 C-S(CH3)2
CH3SOCH3
R1
DMSO钠盐作为强碱消除HX
R
R2
C=S(CH3)2
C=O R'(H)
R1
R'(H) R1
-(CH3)2S
R-C C S(CH3)2
O R2
R'(H) R1
R-C C R2 O
二甲亚砜(DMSO) CH3SOCH3
反应。
O
O
+ Cl2 H2O
Autocatalysis Cl
+ HCl Induction period
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CHO
KCN
OH O CH C
OC H CN
O- OH C C H CN
OH CCN
OH OC C H CN
OH O C C H
第三节 醛、酮的制备
一、官能团转化法
1.醇的氧化
CH3 CH3 CH3 CH3 CH2OH
MnO2/C5H12 25℃,7d
HIO4
CH3 CH3 CH3
CH3 CHO
OH OH
C O
R R' C . O Mg
R
R .C O R'
H3O+
R' R' R C C OH OH
完成下列反应:
1. CH3COCH3
Na C6H6 H3O+
CH3
CH3 CH3 C C CH3 OH OH
H2SO4
2.
O
Mg C6H6
H3O+
OH OH
O
(4) Meerwein-Ponndorf还原
(- )
Cu2O
(二)还原反应
1.
C O
CH2
O CCH2CH3
(1) Clemmensen还原
CH3CH2COCl AlCl3 Zn-Hg, HCl
CH2CH2CH3
条件:Zn-Hg, HCl(锌汞齐加浓盐酸);适用于对 酸稳定的化合物。
(2) Wolff-Kishner-黄鸣龙还原
C6H5COCH2CH3
H + H COOC2H5 COOC2H5 COOC2H5 H COOC2H5 H
H + HOOC
COOH H
COOH H + H COOH
H COOH COOH H
内型产物为主:
+
H H
O O O O
H H O
O O + H O H O
(主产物)
自学内容:乙烯酮
HOH ROH
CH2
CH2
CH2 C O
CH3CH2CH2CHO
CH3CH
CHCHO
H2/Ni 控制条件
(2) LiAlH4(氢化铝锂)、NaBH4(硼氢化钠)还原
CH3CH CHCH2CH2CHO
LiAlH4 H3O+
CH3CH CHCH2CH2CH2OH
Note: A 反应有选择性;
CH3 C O C2H5
(1) LiAlH4 (2) H3O+
Note:银镜反应,鉴别醛和酮
RCHO
Cu
2+
OH
-
RCOO- + Cu2O
Note:鉴别脂肪醛和芳香醛
常见的弱氧化剂
名称
组成 现象 适用范围
Tollens试剂
AgNO3 的氨 水溶液
Fehling试剂
CuSO4、NaOH和酒 石酸钾钠的混合液
Benedict试剂
CuSO4、Na2CO3 和柠檬酸钠的混合液
R: CH3 CH3 (CH2CH CCH2)3CH2CH CCH3
维生素K2(由肠道细菌合成)
CH3O CH3O
O
CH3 CH2CH
CH3 C CH2 n H
+
2H+
CH3 CH2CH
+2e-2e-
O
(氧化型)
CH3O CH3O
OH
CH3 CCH2 n H
OH
(还原型)
辅酶Q(泛醌): 脂溶性的苯醌类化合物, 完成人体内的 电子传递体。
完成下列反应:
CH3CHO + 3 HCHO
浓 NaOH HCHO
NaOH/H2O
CH2OH HOH2C C CHO CH2OH
CH2OH HOH2C C CH2OH + HCOONa CH2OH
NH2NH2 / NaOH (HOCH2CH2)2O /
C6H5CH2CH2CH3
Note: 适用于对酸不 稳定的化合物。
H2NNH2 , NaOH
?
O
CHO
(HOCH2CH2)2O ,
O
CH3
C OH H (1) 催化氢化 [H2/ Pt (Ni、Pd)] RCHO
2.
C O
RCH2OH
R CHOH R'
O + HCl O
1,4-加成
OH
互变异构
OH
氧化
O
Cl O OH
Cl
Cl O
4. Diels-Alder Reaction
O O O
O
O
O
2H - 2H
O
OH
5、还原反应
O
OH
医药学中常见的醌类化合物
O CH3 R O
R:
CH3 CH3 CH2CH C(CH2CH2CH2CH)3CH3
维生素K1(存在于绿叶蔬菜中)
(四)Michael 加成
O CH3 O O O + CH2 CH CCH3
KOH MeOH
CH3
O
CH2CH2CCH3 O
O CH 3
O OH
Note:碳负离子与α、β-不饱和醛酮的1,4-加成
(五)Diels-Alder 反应
CH2 CHCH CH2 + CH2 CH2
CHO
CHO +
顺式加成,构型保持:
Ag(银镜) 所有醛
CHO
Cu2O(砖红) 脂肪醛
Ag2O/H2O THF, 25 C
o
Cu2O(砖红) 脂肪醛
COOH
Note: 双键不受影响
3. 酮的氧化
环己酮的氧化:
O
HNO3 V2O5
HOOCCH2CH2CH2CH2COOH
如何鉴别苯甲醛和苯乙醛?
CHO Fehling reagent CH2CHO
NaOH/H2O H+
OH CHO +
OH
CHO
第四节 α,β-不饱和醛、酮
一、结构特点
π-π共轭体系:
C
C
C
O
O
C C
C
二、化学性质 (一)亲核加成反应
1,2-加成:
C C C O + NuC C C Nu
C C C Nu
O-
A+
1,4-加成:
C C C O +
A=H 互变异构
C C C OA Nu
(膦叶立德)R'
PhLi Ph3P+ CHX -
R C
R
C R'
R Ph3P C R'
R
Ph3P+ C R'
(鏻盐)
R C O + Ph3P+ C R' R
R'
C OC P+Ph3 R'
C
O
C PPh3 R R'
R Ph3P C R' + Ph3P O
三苯氧膦
2.安息香缩合反应
机理:
O C H + CNO OH C H + -C CN
C C C OA Nu
Nu-
O-
A+
C C C O Nu H
O PhCH CH C H
(1) PhMgBr (2) H3O+
OH PhCH CH CH Ph 100% O Ph2CH CH2 C CH3 88%
O PhCH CH C CH3
(1) PhMgBr (2) H3O+
Note: 加成方式与亲核试剂性质及不饱和醛酮结构有关
HCHO + HCHO
CHO + HCHO
浓 NaOH
HCOONa + CH3OH
浓 NaOH
CH2OH + HCOONa
Note: A 反应条件:不含-H的醛;浓碱
B交叉歧化反应中 HCHO 转化为 HCOOH
四、其他反应
1.Wittig反应:
R Ph3P + R' CH X
R C O + Ph3P C
NH3 RCOOH
CH2
CH2
OH C OH OH C OR OH C NH2 OH C OCOR
O CH3C OH O CH3C OR O CH3C NH2 O CH3C OCOR
O CH3C X
HX
OH CH2 C X
Note:乙烯酮为酰化试剂。
第五节 醌
一、醌的结构和命名
O
O
O
O
O
O
1,4-苯醌(对苯醌)
CH3 CH3 CH3 64%
OH
CH3
H OH
H + CH3 CH3 36%
Note: A 产物稳定性;
B 空间位阻
(3) 酮的双分子还原
机理:
R' C O
R R' C O
R
C O
R& R
C6H6
R'
C
OH OH
R + . Mg .
R R' C . O Mg .
R C O Mg R'
O
1,2-苯醌(邻苯醌)
O
1,2-萘醌
O
1,4-萘醌
O
9,10-蒽醌
二、对苯醌的反应
1. 亲核加成(羰基的反应)
O
NH2OH
N OH
NH2OH
N OH
O
O
N OH
对苯醌单肟
对苯醌二肟
2. 亲电加成(碳碳双键的反应)
