原创——醛、酮化学反应归纳
大学有机化学重点知识总结第十一章 醛、酮
—制备增加2个C原子的伯醇:
+
H2C CH2
-+
RM gBr
O -
(C2H5)2O
R C H 2 C H 2 O M g B r
H 3O + H O C H 2C H 2R
精选可编辑ppt
42
33.
CH3 ( NBS )
CH2Br
Mg
(
干醚
CH2MgBr )
① O / 干醚
(
② H3O+
CH2CH2CH2OH )
R C O R '+H 2 O H +
R CO +2 R 'O H
(R '')HO R '
(R '')H
精选可编辑ppt
33
H +
O O C H 3
( )+ ( )
O
CH2CH2CH2CH CH3OH
HO
O
O
O
C OCH3 H
O O
C OCH3
H OC H2CH 2OH
精选可编辑ppt
34
(3)活性:醛>酮 酮一般用原甲酸三乙酯形成缩酮
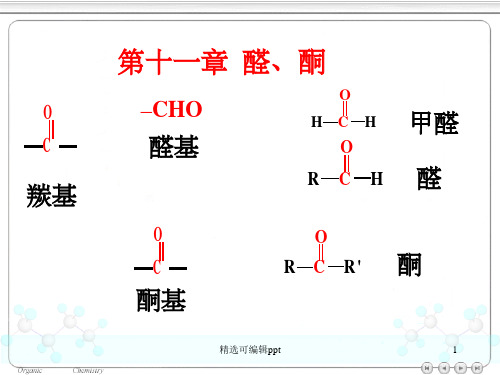
O C
羰基
第十一章 醛、酮
–CHO
醛基
O HCH
O
RCH
甲醛 醛
O
C
酮基
O
R C R' 酮
精选可编辑ppt
1
烃基
脂肪族醛和酮 芳香族醛和酮
醛和酮
饱和醛和酮
的分类 烃基是否饱和 不饱和醛和酮
一元醛和酮
羰基个数 二元醛和酮
多元醛和酮
有机化学方程式汇总醛和酮的还原反应

有机化学方程式汇总醛和酮的还原反应在有机化学中,醛和酮是两类非常重要的化合物。
它们在许多化学反应中扮演着重要的角色。
其中,还原反应是一类常见的反应类型。
本文将汇总一些常见的有机化学方程式,以展示醛和酮的还原反应。
1. 氢气还原氢气还原是一类常见的还原醛和酮的方法。
通常,常用还原剂如氢气(H2)、铝烷类化合物(如LiAlH4)或氢化合物(如NaBH4)会和醛或酮在适宜的条件下反应,生成相应的醇化合物。
例如,对于醛的氢气还原反应,可以写作:RCHO + H2 → RCH2OH (其中,R为有机基团)对于酮的氢气还原反应,可以写作:RCOR' + H2 → RCH2OR' (其中,R和R'为有机基团)2. 硼酸盐还原硼酸盐还原是一种常用于酮的还原反应的方法。
常见的硼酸盐还原剂是NaBH4(氢化硼酸钠)或LiAlH4(氢化铝烷)。
硼酸盐还原对酮的选择性比较高,较少发生与醛的反应。
例如,对于酮的硼酸盐还原反应,可以写作:RCOR' + NaBH4 → RCH2OH (其中,R和R'为有机基团)3. 其他还原反应除了氢气还原和硼酸盐还原,还有其他一些反应可以还原醛和酮。
例如,选择性邻位还原(Clemmensen反应)、烯醇盐还原(Wolff-Kishner反应)和醛或酮在碱性条件下的水解反应等。
这些反应都需要适宜的条件和特定的试剂。
总结:有机化学中,醛和酮的还原反应是一类重要的反应类型。
利用氢气、硼酸盐或其他还原试剂可以还原醛和酮,生成相应的醇化合物。
这些反应在有机合成和制药等领域具有广泛的应用。
了解有机化学方程式对于学习和理解这些反应的机理和应用非常有帮助。
注意:文章中所提到的化学反应式仅为示例,实际化学反应需要具体的实验条件和试剂选择。
在进行有机化学实验时,应严格遵守实验室的安全规范,并在有经验的人员指导下进行操作。
原创——醛、酮化学反应归纳

原创——醛、酮化学反应归纳醛、酮化学反应归纳一、与RMgX加成甲醛产生一级醇,其他的醛生成二级醇。
酮生成三级醇。
羰基两旁的基团太大时,酮不能正常地反应。
会发生烯醇化反应或还原反应:烯醇化反应:还原反应:当格式试剂反应结果不好时,用烷基锂反应可以得到较好的结果。
Cram规则一:大基团L与R呈重叠型,两个较小的基团在羰基两旁呈邻交叉型,与格式试剂(包括氢化铝锂等)反应时,试剂从羰基旁空间位阻较小的基团S一边接近分子,故(i)是主要产物,(ii)为副产物。
R与L处于重叠型为最有利的反应时的构象。
二、与HCN反应(碱性条件下)生成的,—羟基腈可用于制备,—羟基酸,羟基酸可进一步失水变为,,,—不饱和酸(如有机玻璃)。
氢氧根可以增加氰离子的浓度,但碱性不能太强。
该反应符合Cram规则一。
Cram规则二:当醛、酮的,—C上有—OH,—NHR时,由于它们能与羰基氧形成氢键,反应物主要为重叠型构象,发生亲核加成反应时,亲核试剂主要从S基团的一侧进攻。
Strecker(斯瑞克)反应:羰基化合物与氯化铵、氰化钠生成,—氨基腈、再水解制备,—氨基酸的反应三、与炔化物的反应四、与含氮亲核试剂的加成A、与NH或RNH反应(与一级胺生成亚胺,又称西弗碱)(弱酸性条件) 32亚胺在稀酸中水解,可得原羰基化合物与胺:故该反应可用来保护羰基。
B、与RNH反应(生成烯胺) 2要使反应完全,需将水除去。
在稀酸水溶液中烯胺可水解得到羰基化合物与二级胺。
可发生氮烷基化与碳烷基化反应。
C、与氨衍生物的反应a.与羟胺的反应(生成肟)肟与亚硝基化合物发生互变异构。
亚硝基化合物与酮肟的互变异构:亚硝基化合物与醛肟的互变异构:亚硝基化合物在没有,氢时是稳定的,有,氢时有利于平衡肟。
肟的Z构型一般不稳定。
Beckmann(贝克曼)重排反应:酮肟在酸性催化剂中重排生成酰胺的反应催化剂:HSO、多聚磷酸、PCl、PhSOCl(苯磺酰氯)、SOCl (亚硫酰氯)24532 反应特点:离去与迁移基团处于反式;基团的离去与迁移是同步的;迁移基团在迁移前后构型不变。
有机化学基础知识点整理醛和酮的氧化和还原反应

有机化学基础知识点整理醛和酮的氧化和还原反应有机化学基础知识点整理醛和酮的氧化和还原反应在有机化学中,醛和酮是两类常见的官能团。
它们的氧化和还原反应是有机合成和实验室合成中的重要反应之一。
本文将对醛和酮的氧化和还原反应进行详细的整理和介绍。
一、醛和酮的氧化反应1. 醛的氧化反应醛的氧化反应常用于合成羧酸。
常见的氧化剂包括酸性高锰酸钾、过氧化氢、过氧化叔丁醇等。
(1)酸性高锰酸钾氧化:酸性高锰酸钾在酸性条件下可以将醛氧化为相应的羧酸。
反应过程中,醛被氧化为羧酸,高锰酸钾则被还原为二氧化锰。
反应方程式如下:RCHO + KMnO₄ + H₂SO₄ → RCOOH + MnSO₄ + K₂SO₄ +H₂O其中,R代表有机基团。
(2)其他氧化剂的应用:过氧化氢(H₂O₂)和过氧化叔丁醇(TBHP)等也可以将醛氧化为羧酸。
2. 酮的氧化反应酮的氧化反应相对较难进行,常用的氧化剂包括强酸性高锰酸钾和过氧化氢等。
(1)酸性高锰酸钾氧化:酸性高锰酸钾在酸性条件下只能氧化一些α-亚甲基酮,如甲基苯酮。
通常,对于酮,选择其他氧化方法会更加有效。
(2)其他氧化剂的应用:过氧化氢(H₂O₂)在存在碱的情况下可以将酮氧化为酮酸。
此外,过氧化叔丁醇等也可用作酮的氧化剂。
二、醛和酮的还原反应1. 氢化还原氢化还原是最常见的醛和酮的还原方法。
常用的氢化剂包括金属钠(Na),亚磷酸和氢气(H₂)等。
醛和酮在氢化还原条件下会被还原成对应的醇。
反应方程式如下:RCHO + 2H → RCH₂OHRCOR' + 2H → RCHR'OH其中,R和R'代表有机基团。
2. 氢化铝锂还原氢化铝锂(LiAlH₄)是一种强还原剂,可将醛和酮直接还原为对应的醇。
反应底物中的酮和酯可以完全被消耗,生成相应的醛或醇。
反应方程式如下:RCHO + 4[H] → RCH₂OHRCOR' + 4[H] → RCHR'OH3. 其他还原反应还有一些其他的还原反应可用于将醛和酮还原为醇。
有机化学基础知识点整理醛与酮的加成与缩合反应

有机化学基础知识点整理醛与酮的加成与缩合反应有机化学基础知识点整理醛与酮的加成与缩合反应醛和酮是有机化合物中常见的功能团,它们参与了许多重要的化学反应。
其中,加成反应和缩合反应是两种常见的反应类型。
本文将对这两种反应进行整理,以帮助读者更好地理解醛和酮的性质及其化学行为。
1. 加成反应醛与酮的加成反应是指醛分子或酮分子与其他化合物之间发生的化学反应,其中两个基团结合形成新的化学键。
这类反应通常能够在醛和酮的碳原子上引入新的官能团,从而改变它们的性质或功能。
1.1 亲核加成反应亲核加成反应是最为常见的一种醛与酮的加成反应。
在这类反应中,亲核试剂通过攻击醛或酮分子的电子不稳定区域(如碳氧双键)进行加成。
常见的亲核试剂包括醇、胺、硫醇等。
这类反应的机理可以分为几个关键步骤:1. 亲核试剂攻击醛或酮分子的碳原子,形成一个中间体。
2. 中间体经历质子转移或亲核攻击等步骤,最终生成加成产物。
例如,醛与醇在酸性条件下发生反应,生成醚类产物。
类似地,醛或酮与胺反应,则生成相应的胺酮产物。
1.2 亲电加成反应亲电加成反应也是醛与酮加成反应的一种重要类型。
在这类反应中,亲电试剂通过攻击醛或酮分子的电子密度较大的部位进行加成。
常见的亲电试剂有卤化物、水合离子等。
这类反应通常包括以下几个关键步骤:1. 亲电试剂与醛或酮分子发生反应,生成一个富有正电荷的中间体。
2. 中间体经历质子转移或亲电试剂的离去等步骤,最终生成加成产物。
例如,醛或酮与卤代烷反应,生成取代产物。
此外,醛与氨或胺反应,可以生成相应的胺醛。
2. 缩合反应除了加成反应外,醛和酮还参与了一种重要的化学反应,即缩合反应。
这类反应是指两个醛分子或酮分子通过内部的亲核试剂发生反应,生成一个含有共轭双键的醇或酮产物。
缩合反应常见的机理有以下几种:2.1 排除反应排除反应也称为酮-酮缩合反应,是两个酮分子通过内部亲核试剂发生反应的一种常见方式。
在这类反应中,一个酮分子发挥亲核性质攻击另一个酮分子的β-碳原子上的羰基碳原子,生成一个孤对电子及带负电荷的中间体。
有机化学基础知识点整理酮与醛的性质与反应

有机化学基础知识点整理酮与醛的性质与反应【有机化学基础知识点整理】酮与醛的性质与反应一、酮与醛的定义酮和醛都是有机化合物中的一类功能团,酮的通式为R1-CO-R2,醛的通式为R-CO-H。
它们在化学结构上都含有一个碳氧双键,而酮分子中的碳氧双键是接在碳链中的,醛分子中的碳氧双键则是接在碳链的末端。
二、酮与醛的性质1. 沸点和熔点:酮和醛的沸点和熔点相对较高,这是由于它们分子中的极性碳氧双键以及分子间的氢键相互作用所致。
2. 溶解性:酮与醛通常可溶于极性溶剂,如水、醇等。
酮是非常好的溶剂,可溶于一些有机溶剂,如醚、醇等。
而醛则与水反应生成相应的醇,因此溶解性较差。
3. 反应活性:由于酮和醛分子中碳氧双键的存在,它们具有一定的反应活性。
酮中的羰基碳亲电性较强,易于发生亲电取代反应;而醛中的羰基碳和羰基氧都具有亲电性,容易发生亲核加成反应。
4. 氧化性和还原性:酮具有相对较低的氧化性和还原性。
醛则比酮更容易被氧化,可以发生醛的氧化反应生成相应的羧酸。
而酮的羰基碳不能够被氧化。
三、酮与醛的反应1. 加成反应:酮和醛都可以与亲核试剂发生加成反应。
例如,可以与氨或胺发生加成反应,生成相应的亚胺或胺;与水或醇发生加成反应,生成相应的醇。
酮和醛与罗丹明B等亲核试剂的加成反应可用于化学定量分析中。
2. 缩合反应:酮和醛可以与亲核试剂发生缩合反应,生成相应的α-羟基化合物。
例如,与氨或胺发生缩合反应,生成相应的肼;与含氢试剂(如硼氢化钠)发生缩合反应,生成相应的醇。
3. 氧化反应:醛具有较强的氧化性,可以与氧和氧化性试剂反应,生成相应的羧酸。
常用的氧化性试剂有高锰酸钾、过氧化氢等。
4. 还原反应:酮可以通过还原反应转化为相应的醇。
常用的还原试剂有金属钠、金属铝等。
四、应用领域酮和醛广泛应用于医药、农药、染料、香料、合成材料等领域。
例如,酮类化合物多具有良好的生物活性,是许多重要药物的结构骨架;醛类化合物常用于染料和香料的合成。
醛和酮—醛和酮(药学有机化学课件)

+ COCH3
Br2
COCH2Br + HBr
卤仿反应
卤仿反应:如果醛、酮α-碳上有三个氢,三个氢被卤素原子
取代,使得碳碳键极性增大,发生碳碳键的断裂,生成三卤
甲烷和羧酸盐的反应。
O
O
CH3C-R(H)+ 3X2
NaOH
OH CX3-C-R(H)
O
CHX3 + R(H)-C-O
O
O
CH3 C CH3 I2 + NaOH CI3 C CH3 NaOH CH3COONa + CHI3
有机化学/ 醛和酮
醛的特征反应
醛基上氢原子由于受羰基 的影响变得比较活泼,因此醛 具有不同于酮的特殊的反应。 醛能被弱氧化剂——托伦试剂、 斐林试剂氧化为羧酸。
一、托伦反应
托伦(Tollens)试剂是AgNO3与氨水生成的一种无色的 银氨配合物溶液,其中Ag+ 起着氧化剂作用,当它与醛共热时, 醛被氧化为羧酸,而它则被还原为金属银,附着在试管内壁上, 形成光亮的银镜,因此该反应也称为银镜反应。
或浓H2SO4
H
或浓H2SO4 H
半缩醛
缩醛
➢ 半缩醛不稳定,很难分离。 ➢ 缩醛具有双醚的结构,对碱、氧化剂、还原剂稳定,可
以分离出来。
➢ 缩醛在稀酸中易水解转变为原来的醛,合成中可利用此 反应来保护醛基。
一、加成反应
与醇加成 分子内也能形成半缩醛、缩醛。
CH O
干 HCl
OH
H OH O
环状半缩醛(稳定) 在糖类化合物中多见
O
C5 H3C4 H2C3 C2 HC1 H3
CH3 2-甲基-3-戊酮
C H3
醛与酮的反应规律与化学合成

醛与酮的反应规律与化学合成醛和酮是有机化合物中常见的官能团。
它们在化学反应中具有独特的特性和反应规律,这为有机合成提供了广泛的应用。
在本文中,我们将讨论醛和酮的反应规律以及它们的化学合成方法。
一、醛与酮的反应规律1. 加成反应:醛和酮可以与亲电试剂进行加成反应,形成新的官能团或化合物。
常见的加成反应有羟醛和酮的羟醛反应、醛和酮的氨基反应、醛和酮的亚胺反应等。
2. 氧化反应:醛可以被氧化剂氧化为羧酸,而酮则稳定,不容易被氧化剂氧化。
常用的氧化剂有高锰酸钾(KMnO4)、过氧化氢(H2O2)等。
3. 还原反应:醛和酮可以被还原剂还原为醇。
常用的还原剂有氢气(H2)、亚磷酸盐(H3PO2)等。
4. 缩合反应:酮可以和醛发生缩合反应,生成β-羟醛。
二、醛与酮的化学合成1. 直接氧化法:一些醛可以通过直接氧化法进行合成。
例如,甲醛可以通过甲烷的催化氧化得到。
2. 羰基化合物的还原:一些醛和酮可以通过还原羰基化合物得到。
例如,醛可以通过还原酮得到。
3. 羧酸的还原:一些羧酸可以通过还原得到醛。
例如,乙酸可以通过还原得到乙醛。
4. 醇的氧化:一些醇可以通过氧化反应得到醛。
例如,乙醇可以通过氧化得到乙醛。
5. 羟醛的羰基还原:一些羟醛可以通过羰基还原反应得到醛。
例如,葡萄糖可以通过羰基还原反应得到葡萄糖醛。
总结起来,醛和酮具有丰富的反应规律和化学合成方法。
通过选择合适的试剂和反应条件,可以实现对醛和酮的控制合成,得到目标化合物。
这为有机合成提供了重要工具和方法。
在工业生产和实验室合成中,醛和酮的合成方法广泛应用于药物合成、有机合成、材料合成等领域。
研究醛和酮的反应规律和化学合成方法,对于新化合物的发现和合成具有重要意义。
结论本文讨论了醛和酮的反应规律以及化学合成方法。
通过加成反应、氧化反应、还原反应和缩合反应,可以实现对醛和酮的控制合成。
选择合适的试剂和反应条件,可以得到目标化合物,为有机合成提供了重要工具和方法。
有机化学基础知识点整理醛和酮的亲核加成和还原反应

有机化学基础知识点整理醛和酮的亲核加成和还原反应有机化学基础知识点整理:醛和酮的亲核加成和还原反应一、引言有机化学是研究碳元素的化学性质和有机化合物的合成、结构与性质的分支学科。
醛和酮是有机化合物中常见的官能团,其具有重要的化学性质。
本文将对醛和酮的亲核加成和还原反应进行整理,以便系统地掌握这些基础知识点。
二、醛和酮的亲核加成反应亲核加成反应是有机化学中一类重要的反应,指的是一个亲核试剂攻击一个电子云丰富的碳原子,从而形成一个新的化学键。
醛和酮常参与亲核加成反应的典型亲核试剂包括酸、醇、胺等。
以下是醛和酮的几种亲核加成反应:1. 醛和酮的酸性条件下的加成反应醛和酮在酸性条件下,通常可以通过亲核试剂的加成来形成醇。
以醛为例,其亲核加成反应可以表示为:RCHO + H2O → RCH(OH)22. 醛和酮的醇性条件下的加成反应醛和酮在醇性条件下,可以通过醇的加成来形成醚。
以酮为例,其亲核加成反应可以表示为:RCOR' + R''OH → RC(OR'')R'' + H2O3. 醛和酮的胺性条件下的加成反应醛和酮在胺性条件下,常可以通过胺的加成来生成胺加成产物。
以醛为例,其亲核加成反应可以表示为:RCHO + R'NH2 → RCH(NHR')2 + H2O三、醛和酮的还原反应醛和酮的还原反应是指将醛和酮中的碳氧双键还原为碳碳单键的反应。
在还原反应中,常用的还原剂包括金属氢化物如氢气、碱式金属醇ates等。
以下是经典的醛和酮的还原反应:1. 醛和酮的氢还原反应醛和酮的碳氧双键可以被氢气在催化剂存在下还原为碳碳单键。
以醛为例,其氢还原反应可以表示为:RCHO + H2 → RCH2OH2. 醛和酮的金属氢化物还原反应醛和酮可以通过金属氢化物的还原作用来生成相应的醇化物。
以酮为例,其金属氢化物还原反应可以表示为:RCOR' + LiAlH4 → RCH(OH)R' + AlH3 + LiX四、总结醛和酮的亲核加成和还原反应是有机化学中基础且重要的反应类型。
原创醛、酮化学反应归纳
。键双碳碳原还再�基羰原还先时应反。扰干有应反对 C�C、 C=C。成加式顺为应反
� �原还铝醇丙异用�应反�夫尔杜彭—因外尔麦�lrodnnoP—niewreeM、七十
� �醇得解水�酯酸硼成生�原还烷硼乙用、六十 。物产定稳得要主�时大不别差阻空。物产的攻进向方的小阻空从得要主�时大别差阻空 。行进中液溶醇在应反多很。应反下在存子离锂机有或中剂溶子质在须必
�剂试 renroH—gitti W 为称德立叶磷的备制膦基苯三替代酯酸磷亚用
�置位式反于位团基的大较上子原碳 � 与团基的基羰含往往�时定稳较比德立叶磷当
�物合混的体构异反顺到得�时泼活很德立叶磷当。烃烯备制来用可应反该
。慢最酯�次其酮�快最应反醛与�时应反 gittiW 生发
。剂试�息悌魏�gitti W 称也德立叶磷。定稳不气空与水对�体固色黄是物成生
应反醇与、六
�例实用应
。物合水的定稳成形可�强增性电亲的基羰�连相团基子电吸强与基羰 。物合水为变部全乎几中液溶水在醛甲 。面方物应反于向偏大大衡平�应反逆可是成加的酮、醛和水 物合水酮 物合水醛
2 �件条性酸�应反 O H 与、五 分质杂他其和以可�水于溶物生衍的成生酮、醛和�团基盐铵级四的强很性极个一有含中剂试 drariG 。 �酮、醛别鉴以可�晶结易�体固是半多物生衍�物生衍种一的述上成制酮、醛把常时验实在。开 �剂试)德拉吉(drariG.e
。 �璃玻机有如�酸和饱不—�,� 为变水失步一进可酸基羟�酸基羟—� 备制于用可腈基羟—� 的成生
。强太能不性碱但�度浓的子离氰加增以可根氧氢
。象构的时应反的利有最为型叠重于处 L 与 R
�下件条性碱�应反 NCH 与、二
。物产副为)ii(�物产要主是)i(故�子分近接边一 S 团基的小较阻位间空旁基羰从剂试�时应反�等锂铝化氢 括包�剂试式格与�型叉交邻呈旁两基羰在团基的小较个两�型叠重呈 R 与 L 团基大�一则规 marC 。果结的好较到得以可应反锂基烷用�时好不果结应反剂试式格当
有机化学基础知识点整理醛与酮的化学性质与反应

有机化学基础知识点整理醛与酮的化学性质与反应醛与酮的化学性质与反应在有机化学中,醛与酮是一类常见的有机化合物。
它们具有多种重要的化学性质和反应。
本文将对醛与酮的基础知识进行整理,并详细介绍其化学性质和常见反应。
一、醛与酮的概述醛和酮是通过碳氧双键连接碳链上的一个碳原子而形成的。
它们的基本结构特点是含有一个或多个羰基(C=O)功能团。
醛的羰基与一个氢原子相连,而酮的羰基与两个碳原子相连。
这种羰基团在一系列有机化合物中起着重要的作用。
二、醛与酮的化学性质1. 氧化性:醛和酮具有一定的氧化性,可以被氧化剂氧化为相应的羧酸。
常见的氧化剂有高锰酸钾、过氧化氢等。
2. 还原性:醛和酮可被还原剂还原为相应的醇。
常见的还原剂有金属氢化物(如氢气、氢氧化钠)、亚磷酸酐等。
3. 加成反应:醛和酮可通过加成反应与许多试剂发生加成反应,形成新的化学键。
常见的加成反应有氢化反应、氰化反应、醇酸反应等。
4. 缩合反应:醛和酮可发生缩合反应,生成α,β-不饱和化合物。
常见的缩合反应有醛缩反应、酮缩反应等。
5. 羟醛互变异构:醛和酮之间可以通过氧化还原反应发生羟醛互变异构。
醛在碱性条件下可转变为相应的酮,而酮在酸性条件下则可转变为相应的醛。
三、醛与酮的常见反应1. 加成反应醛和酮与氢气在催化剂存在下进行加成反应,生成相应的醇。
该反应称为醛和酮的氢化反应。
例:丙酮+ H2 → 异丙醇2. 缩合反应醛和酮可以与具有活性氢原子的化合物发生缩合反应,生成α,β-不饱和醛酮。
例:乙醛 + 乙酸酐→ 丁烯酮3. 氧化反应醛和酮可以被氧化剂氧化为相应的羧酸。
例:乙醛+ KMnO4 → 乙酸4. 还原反应醛和酮可以被还原剂还原为相应的醇。
例:乙酮+ NaBH4 → 乙醇五、实际应用醛和酮广泛应用于有机合成、医药、香料等行业。
例如,醛和酮可以作为重要的合成中间体,用于制备药物和化学品。
此外,醛和酮也常被用作溶剂、香料和食品添加剂等。
总结:醛和酮是一类重要的有机化合物,具有多种化学性质和反应。
有机化学第10章醛、酮及亲核加成反应

CH3
CH3 OC2H5
C
+
CH3 OC2H5
O HCOC2H5
O MeC
HOCH2CH2OH
CO2H
H+,
O O
Me
O O
Me
CH2OH
H2O HCl
O MeC
CO2H
1. LiAlH4 2. H2O
CH2OH
二、与亚硫酸氢钠的加成
醛或活泼的酮(脂肪族甲基酮及少于8个碳原子的脂环酮) 在室温下与过量的饱和亚硫酸氢钠(40%水溶液)溶液一 起振荡,不需加任何催化剂反应即可生成-羟基磺酸钠 盐.
第一节 醛、酮的结构与物理性质
醛、酮的分子中都含有羰基(>C=O)
O R
H
醛
-CHO 醛基
O
R
R'
酮
>C=O 酮基
分子中的烃基(R)可以相同也可以不相同。醛、酮分子 中的烃基可以是直链的或是环状的,脂肪的或芳香的。
一、羰基的结构
CO
CO
碳原子SP2杂化轨道与另外三个原子以键结合的,所以这 三个键都处于同一个平面上,键角约为120°。
=O + HNO 3 V2O5 HOOC(CH 2)4COOH
二、坎尼扎罗反应
不含-H的醛在浓碱作用下,一分子醛被氧化成酸, 而另一分子醛则被还原为醇,这是自氧化还原反应,也 叫歧化反应或康尼查罗(Cannizzaro)反应。
Cl
R
C=O
R
> Ph CH3
C=O
> Ph Ph
C=O
一、与醇的加成
醛在干燥氯化氢气体的存在下,可与醇发生加成反 应,生成半缩醛,半缩醛不稳定,会分解为原来的 醛,若有另一分子醇存在,半缩醛将与之失水生成
有机化学方程式汇总醛和酮的酸催化加成反应

有机化学方程式汇总醛和酮的酸催化加成反应在有机化学中,醛和酮是两种常见的官能团。
它们参与了许多重要的反应,其中一种是酸催化加成反应。
本文将介绍醛和酮的酸催化加成反应,并对常见的方程式进行汇总。
醛和酮的酸催化加成反应是一种通过酸催化来使醛和酮与其他化学物质发生加成反应的方法。
这种反应通常在强酸的催化下进行,可以使用多种强酸,包括硫酸、氢氯酸和甲酸等。
下面是几个常见的酸催化加成反应方程式:1. 醇的加成反应:醛或酮可以与醇反应,生成缩醛或缩酮。
方程式如下:RCHO + ROH → RCH(OR)OH2. 胺的加成反应:醛或酮可以与胺反应,生成胺加成产物。
方程式如下:RCHO + NH3 → RCH=NH23. 腈的加成反应:醛或酮可以与腈反应,生成氯腈或酮腈。
方程式如下:RCHO + HCN → RCH(CN)OH4. 胺的缩合反应:醛或酮可以与胺反应,生成胺缩合产物。
方程式如下:RCHO + NH2-R' → RCH=NR'5. 第二次加成反应:醛或酮可以先与一种化合物反应生成中间产物,再与另一种化合物进行第二次加成反应。
方程式如下:RCHO + X → R CH(X)OHRCH(X)OH + Y → RCH(X)Y以上只是醛和酮的酸催化加成反应中的一部分方程式,还有许多其他反应也可以通过酸催化实现。
在实际应用中,根据具体的实验条件和需求,可以选择不同的酸催化剂和反应条件。
需要注意的是,酸催化加成反应通常需要在适当的溶剂中进行,常用的溶剂包括二甲基亚砜(DMSO)、氯仿和醇等。
此外,反应温度和反应时间也是影响反应结果的重要因素,需要根据实验要求进行优化。
总结起来,醛和酮的酸催化加成反应是有机化学中常见的反应类型之一。
通过酸催化,醛和酮可以与其他化合物进行加成反应,生成各种有机产物。
在实际应用中,需要根据具体要求选择合适的酸催化剂、反应条件和溶剂,以获得理想的反应产物。
参考文献:1. Clayden J, Greeves N, Warren S. Organic chemistry. 2nd ed. Oxford: Oxford University Press; 2012.2. Mohrig JR, Hammond CN, Schatz PF. Techniques in organic chemistry. 4th ed. New York: W.H. Freeman and Company; 2017.。
大学有机化学反应方程式总结醛和酮的还原和氧化反应

大学有机化学反应方程式总结醛和酮的还原和氧化反应在大学有机化学中,醛和酮是两类重要的官能团,它们在许多有机合成和反应中起着至关重要的作用。
了解醛和酮的还原和氧化反应对于掌握有机化学的基本知识和实践技巧具有重要意义。
本文将对醛和酮的还原和氧化反应方程式进行总结,以帮助理解和记忆这些反应。
一、醛和酮的还原反应方程式还原反应是指分子中某个原子的氧化态数减小,而另一些原子的氧化态数增加的化学反应。
醛和酮可以通过多种还原试剂被还原为相应的醇。
下面是几种常用的醛和酮的还原反应方程式:1. 锂铝氢化物(LiAlH4)还原醛和酮可以通过与锂铝氢化物(LiAlH4)反应被还原为相应的醇。
例如,丙酮(ketone)可以被锂铝氢化物(LiAlH4)还原为丙醇(alcohol):CH3COCH3 + LiAlH4 → CH3CH2CH2OH同样地,乙醛(aldehyde)可以被锂铝氢化物(LiAlH4)还原为乙醇(ethanol):CH3CHO + LiAlH4 → CH3CH2OH2. 氢气和催化剂的还原醛和酮也可以通过在氢气和催化剂的存在下被还原为相应的醇。
例如,乙酮(ketone)可以通过在氢气和铂催化剂的存在下还原为乙醇(alcohol):CH3COCH3 + H2 (催化剂) → CH3CH2OH二、醛和酮的氧化反应方程式氧化反应是指分子中某个原子的氧化态数增加,而另一些原子的氧化态数减小的化学反应。
醛和酮可以通过多种氧化试剂被氧化为相应的羧酸或者羰基酸。
下面是几种常用的醛和酮的氧化反应方程式:1. 高锰酸钾(KMnO4)氧化醛和酮可以通过与高锰酸钾(KMnO4)反应被氧化为相应的羧酸。
例如,乙醛(aldehyde)可以被高锰酸钾(KMnO4)氧化为乙酸(carboxylic acid):CH3CHO + KMnO4 → CH3COOH2. 酸性高锰酸钾(H+ / KMnO4)氧化醛和酮也可以通过与酸性高锰酸钾(H+ / KMnO4)反应被氧化为相应的羧酸。
醛和酮亲和加成反应

CH3CH2CH2OH
97
10
3)水溶性:醛酮旳氧原子能够与水形成氢键,所 以低档醛酮能与水混溶,高级醛酮易溶于有机 溶剂;
4)IR:羰基旳红外光谱在1750-1680 cm-1之间有 一种非常强旳伸缩振动吸收峰。当羰基与双键 共轭,吸收向低波数位移。-CHO中旳C-H键在 2720 cm-1和2850 cm-1区域有两个非常特征旳 伸缩振动吸收峰。
36
2、卤仿反应
乙醛或甲基酮与次卤酸盐反应(实际是在碱催
化下旳α-H卤代反应),三个α-H均被卤代。
O
R-C-CH3 + X2 -OH
O R-C-CX3 -OH
OR-C-CX3
OH
~
RCOOH + X3C -
O
R C CH3+ 4NaOH + 3X2
RCOO- + CHX3
H+
RCOOH
RCOONa + CHX3 (卤仿)
H
O
O
稀碱
CH3C H + CH2C H
OH O CH3CHCH2C H -H2O
△
β-羟基醛
CH3CH CHCHO
O
O
O-
HO- + H CH2C H
CH2
CH
CH2
C H快
O
O
O-
CH3 C H + CH2 C H
CH3CHCH2CHO
慢
反应机理
O-
OH
CH3CHCH2CHO + H OH
CH3CHCH2CHO
鉴别醛; RCHO + Ag(NH3)2+OH- △ RCOONH4 + Ag + NH3 + H2O
有机化学基础知识点整理醛与酮的性质与反应

有机化学基础知识点整理醛与酮的性质与反应【有机化学基础知识点整理】醛与酮的性质与反应一、醛与酮的简介有机化合物中,醛与酮是两类常见的官能团。
它们的分子结构具有一定的相似性,但在性质与反应上有一些显著的差异。
本篇文章将围绕醛与酮的性质与反应展开讨论。
二、醛的性质与反应1. 特征性质醛分子结构中含有C=O键,其中氧原子上的孤对电子赋予了醛独特的性质。
醛通常具有刺激性的味道,并且易于揮发。
2. 氧化反应由于醛的氧原子具有氧化的潜力,醛在氧化反应中常被氧气或氧化剂氧化成相应的酸。
例如,甲醛(HCHO)可被氧化为甲酸(HCOOH),而乙醛(CH3CHO)可被氧化为乙酸(CH3COOH)。
3. 还原反应醛可以通过还原反应还原为相应的醇。
还原剂如氢气和铝烷可以将醛还原成醇。
例如,乙醛可以被氢气还原为乙醇。
4. 加成反应醛作为亲电反应中的亲电激活试剂,容易发生加成反应。
例如,醛与氨反应可以生成相应的胺,醛与氢氨基反应可以生成相应的亚胺。
5. 羰基反应以醛中的羰基与其他试剂发生反应为特征的反应被称为羰基反应。
醛的其中一个典型羰基反应是与胺的缩合反应,生成相应的胺酮。
三、酮的性质与反应1. 特征性质酮与醛一样,酮分子结构中也含有C=O键。
酮通常不具有显著的气味,并且比相应的醛更不容易揮发。
2. 氧化反应由于酮中C=O键上的碳原子无法被氧化,因此酮不能像醛一样通过氧化反应转化为酸。
3. 还原反应酮通常较为稳定,不容易被还原剂还原为醇。
常见的强还原剂如金属钠和金属锂在常温下对酮的还原并不容易进行。
4. 加成反应酮可以发生与醛相似的加成反应。
例如,酮与亚胺反应可以生成相应的亚胺酮。
5. α位取代反应酮中的α位碳原子上具有一定的活性,容易发生取代反应。
通过在α位进行取代反应,可以引入新的官能团或改变分子结构。
四、醛与酮的区别与应用1. 性质区别醛具有刺激性的气味和较易挥发的性质,而酮则没有明显的气味且不容易挥发。
醛容易发生氧化反应,而酮则不容易被氧化。
醛酮的化学反应及检验
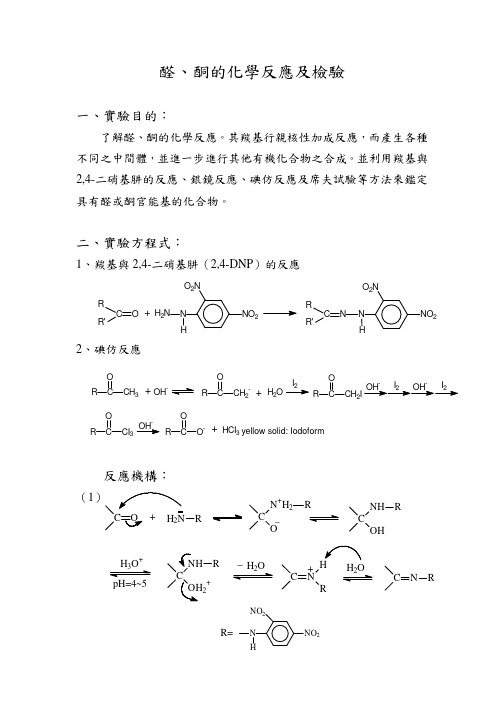
若有黃綠色沉澱,此化合物具有甲基酮官能基; 若無黃綠色沉澱,再加熱 15 分鐘,若仍無黃綠色沉澱則表示此化合 物具有無甲基酮官能基。
Iodoform Samples Structures
O H3C C
Silver mirror +
2,4-DNP test
Ethanal Acetone Benzaldehyde
乙醇
CH3CH2OH
Acetone
無色微香液體,易著火,比重 0.788 ,沸點 56.5 ℃。與水、乙醇、乙醚、氯仿、DMF、油類 互溶。蒸氣能與空氣形成爆炸性混合物,化 學性質活潑,廣泛用作工業溶劑。
丙酮
CH3COCH3 Benzaldehyde
無色油狀液體,有杏仁香味,密度 1.046,沸 點 179℃。稍溶於水,能與乙醇、乙醚或氯仿
_ _ OH ,I2,OH,I2
_ ቤተ መጻሕፍቲ ባይዱ C CI3 + OH
CHI3(碘仿,黃色固體)
三、實驗原理:
1、醛的通式
O R C H
酮的通式
O R C R1
1具有極性的羰基
2醛較酮易進行碳氧雙鍵的親核性加成反應(立體障礙及電子因素) 3沸點較相似分子量的碳氫化合物高(可與水產生氫鍵) ,但較相似 分子量的醇低(不能形成分子間氫鍵) 。 2、醛的製備: 11。醇的氧化(PCC:CrO3.Pyr.HCl;將醇類氧化成醛類最常用的試 劑)
O2N R R' C O O2N R NO2 R' C N N H NO2
+ H2N N
H
2、碘仿反應
O R C O R C CI3 CH3 O I2 R O C CH2I OHI2 OHI2
+ OH
有机化学基础知识点整理醛和酮的氧化和还原反应的机理

有机化学基础知识点整理醛和酮的氧化和还原反应的机理在有机化学中,醛(aldehyde)和酮(ketone)是两类常见的有机化合物,它们的氧化和还原反应机理具有重要的理论和实际应用价值。
本文将对醛和酮的氧化和还原反应的机理进行整理和概述。
一、醛和酮的氧化反应机理醛和酮的氧化反应是一种常见的有机反应。
醛可以氧化成羧酸,而酮则无法直接进行氧化反应。
醛和酮的氧化反应机理主要包括以下几个步骤:1. 氧化剂的作用:醛分子与氧化剂反应,酮分子则无法与氧化剂反应。
氧化剂可以是强氧化剂,如酸性高锰酸钾(KMnO4)、酸性二氧化铬(CrO3)等,也可以是温和的氧化剂,如氧气(O2)、过氧化氢(H2O2)等。
2. 氧化反应过程:醛的氧化反应过程中,醛分子上的碳氢键被氧化剂中的氧原子取代,生成羧酸。
氧化反应往往发生在醛分子的碳链上的末端碳上,形成醛基上的羟基被氧化成羧酸。
而酮分子由于没有醛基,无法发生这种氧化反应。
3. 氧化反应产物:醛的氧化反应产物是相应的羧酸,例如甲醛(HCHO)氧化后生成甲酸(HCOOH),乙醛(CH3CHO)氧化后生成乙酸(CH3COOH)等。
而酮由于无法直接发生氧化反应,因此在通常条件下,酮不会发生氧化反应,产物仍为原始的酮分子。
二、醛和酮的还原反应机理醛和酮的还原反应是有机化学中另一类常见的反应。
醛和酮可以通过还原剂还原为相应的醇。
醛和酮的还原反应机理主要包括以下几个步骤:1. 还原剂的作用:还原剂可以是强还原剂,如氢气(H2)配合催化剂(如铂、钯等),也可以是温和的还原剂,如氢化钠(NaBH4)等。
2. 还原反应过程:醛和酮的还原反应过程中,还原剂中的氢原子被传递给醛或酮分子上的碳氧双键,生成相应的醇分子。
在这个过程中,碳氧键被断裂,氧被氢取代形成醇基。
3. 还原反应产物:醛和酮的还原反应产物是相应的醇。
例如,乙醛(CH3CHO)还原后生成乙醇(CH3CH2OH),丙酮(CH3COCH3)还原后生成异丙醇(CH3CHOHCH3)等。
大学有机化学反应方程式总结醛和酮的加成与脱水反应

大学有机化学反应方程式总结醛和酮的加成与脱水反应在有机化学中,醛和酮是两个重要的官能团。
它们能够发生加成反应和脱水反应,从而形成具有新的官能团的有机化合物。
本文将总结醛和酮的加成反应和脱水反应,并给出相应的反应方程式。
一、醛和酮的加成反应1. 化学还原:醛和酮可以通过化学还原反应转化为相应的醇。
一般来说,常用的还原剂有金属氢化物、硼氢化物、铝氢化物等。
以硼氢化钠(NaBH4)为例,其反应方程式如下:RCHO + NaBH4 → RCH2OH + NaBH3O2. 氧化反应:醛和酮也可以发生氧化反应,生成相应的羧酸和酮酸。
常用的氧化剂包括酸性高锰酸钾(KMnO4),酸性高铬酸钾(K2Cr2O7)等。
以酸性高锰酸钾为例,其反应方程式如下:RCHO + [O] → RCOOH3. 羰基化合物的加成反应:醛和酮中的羰基碳上的π电子云富集,易于发生加成反应。
常见的加成反应有氢添加、氰根离子和胺等的加成。
以氢气为例,其反应方程式如下:RCHO + H2 → RCH2OH4. 其他加成反应:醛和酮还可和许多其他试剂进行加成反应,如卤代烷、胺、亚硫酸盐等。
以卤代烷为例,其反应方程式如下:RCHO + R'X → RCH(OR')X二、醛和酮的脱水反应1. 醛与酮的缩合反应:醛和酮可以与醇等亲核试剂发生反应,生成缩合产物。
常见的亲核试剂包括醇、胺和酰胺等。
以醇为例,其反应方程式如下:RCHO + R'OH → RCH(OR')OH2. 醛与酮的脱羟基反应:在酸性条件下,醛和酮可以脱去一个羟基,生成烯烃和水。
以酸性条件下的醛为例,其反应方程式如下:RCHO → R+CO + H2O3. 其他脱水反应:醛和酮还可以发生其他类型的脱水反应,如进行缩酮反应、脱一阶胺等。
以缩酮反应为例,其反应方程式如下:RCHO + R'CHO → RCH=CHR' + H2O综上所述,醛和酮作为有机化学中常见的功能团,具有丰富的反应性质。
化学反应中的醛酮反应

化学反应中的醛酮反应醛酮反应是一类重要的有机化学反应,指的是醛与酮之间进行氧化还原反应,生成相应的醇和酸酐的过程。
该反应在有机合成、医药化学等领域具有广泛的应用。
本文将介绍醛酮反应的机理、分类以及其在实际应用中的一些例子。
一、醛酮反应的机理醛酮反应通常是通过氧化还原的方式进行,其中醛或酮被氧化为酸酐或醇。
该反应是在酸性或碱性条件下进行的。
在酸性条件下,醛酮反应首先发生质子化,形成醇醛离子或酮离子。
接着,醇醛离子或酮离子会接受电子,生成相应的酸酐或醇产物。
在碱性条件下,醛酮反应开始于亲核试剂的加成。
亲核试剂攻击醛或酮中的部分正电荷,形成一个中间体。
然后,中间体经历质子化或负离子迁移等步骤,最终生成酸酐或醇产物。
二、醛酮反应的分类根据反应条件和产物类型的不同,醛酮反应可以分为多种类型,如氧化、还原、氧气插入和杂原子插入等。
下面将介绍其中的几种典型反应。
1. 氧化反应氧化反应是指醛或酮被氧化为酸酐的反应。
常见的氧化剂有氧气、过氧化氢、高锰酸钾等。
例如,乙醛可以通过氧气氧化为乙酸的反应:CH3CHO + O2 -> CH3COOH2. 还原反应还原反应是指醛或酮被还原为醇的反应。
典型的还原剂有金属钠、锂铝烷等。
例如,丙酮可以通过锂铝烷还原为异丙醇的反应:(CH3)2CO + LiAlH4 -> (CH3)2CHOH3. 氧气插入反应氧气插入反应是指氧气直接参与醛酮反应,生成酸酐的反应。
例如,甲醛可以通过氧气插入反应生成甲酸的反应:CH3CHO + 1/2 O2 -> CH3COOH4. 杂原子插入反应杂原子插入反应是指醛酮反应中,醛或酮分子中的氧原子被其他原子或基团所取代的反应。
例如,乙醛可以经过羟胺的插入反应生成乙酰肼:CH3CHO + H2NNH2 -> CH3C(NHNH2)O三、醛酮反应的应用举例醛酮反应在有机合成和医药化学中具有广泛的应用。
下面介绍两个具有代表性的例子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原创——醛、酮化学反应归纳醛、酮化学反应归纳一、与RMgX加成甲醛产生一级醇,其他的醛生成二级醇。
酮生成三级醇。
羰基两旁的基团太大时,酮不能正常地反应。
会发生烯醇化反应或还原反应:烯醇化反应:还原反应:当格式试剂反应结果不好时,用烷基锂反应可以得到较好的结果。
Cram规则一:大基团L与R呈重叠型,两个较小的基团在羰基两旁呈邻交叉型,与格式试剂(包括氢化铝锂等)反应时,试剂从羰基旁空间位阻较小的基团S一边接近分子,故(i)是主要产物,(ii)为副产物。
R与L处于重叠型为最有利的反应时的构象。
二、与HCN反应(碱性条件下)生成的,—羟基腈可用于制备,—羟基酸,羟基酸可进一步失水变为,,,—不饱和酸(如有机玻璃)。
氢氧根可以增加氰离子的浓度,但碱性不能太强。
该反应符合Cram规则一。
Cram规则二:当醛、酮的,—C上有—OH,—NHR时,由于它们能与羰基氧形成氢键,反应物主要为重叠型构象,发生亲核加成反应时,亲核试剂主要从S基团的一侧进攻。
Strecker(斯瑞克)反应:羰基化合物与氯化铵、氰化钠生成,—氨基腈、再水解制备,—氨基酸的反应三、与炔化物的反应四、与含氮亲核试剂的加成A、与NH或RNH反应(与一级胺生成亚胺,又称西弗碱)(弱酸性条件) 32亚胺在稀酸中水解,可得原羰基化合物与胺:故该反应可用来保护羰基。
B、与RNH反应(生成烯胺) 2要使反应完全,需将水除去。
在稀酸水溶液中烯胺可水解得到羰基化合物与二级胺。
可发生氮烷基化与碳烷基化反应。
C、与氨衍生物的反应a.与羟胺的反应(生成肟)肟与亚硝基化合物发生互变异构。
亚硝基化合物与酮肟的互变异构:亚硝基化合物与醛肟的互变异构:亚硝基化合物在没有,氢时是稳定的,有,氢时有利于平衡肟。
肟的Z构型一般不稳定。
Beckmann(贝克曼)重排反应:酮肟在酸性催化剂中重排生成酰胺的反应催化剂:HSO、多聚磷酸、PCl、PhSOCl(苯磺酰氯)、SOCl (亚硫酰氯)24532 反应特点:离去与迁移基团处于反式;基团的离去与迁移是同步的;迁移基团在迁移前后构型不变。
可根据水解产物推导原料肟的构型。
b.与肼的反应(生成腙)c.与氨基脲反应(生成缩氨脲)d.上述生成的产物都为碱性物质,一般制成盐酸盐保存。
反应时,用弱碱(如醋酸钠)将盐分离。
很多这样的亲核加成是酸性催化反应,但不能用强酸,因为氢离子虽然可以和羰基生成 (钅羊)盐增加亲电性,但氢离子与氨基结合,形成铵离子的衍生物,丧失了胺的亲核能力。
e.Girard(吉拉德)试剂:Girard试剂中含有一个极性很强的四级铵盐基团,和醛、酮生成的衍生物溶于水,可以和其他杂质分开。
在实验时常把醛、酮制成上述的一种衍生物(衍生物多半是固体,易结晶,可以鉴别醛、酮)。
五、与HO反应(酸性条件) 2醛水合物酮水合物水和醛、酮的加成是可逆反应,平衡大大偏向于反应物方面。
甲醛在水溶液中几乎全部变为水合物。
羰基与强吸电子基团相连,羰基的亲电性增强,可形成稳定的水合物。
应用实例:六、与醇反应半缩醛(酮) 缩醛(酮)某醛(酮)缩一某醇某醛(酮)缩二某醇机理中的一系列反应均可逆。
缩醛(酮)在酸性水溶液中不稳定,但对碱与氧化剂稳定。
缩醛(酮)能够在无水的酸性条件下形成,但能被稀酸分解。
醛的反应正向平衡常数较大,而酮在分水器(如图)中可以使平衡右移。
也可以用原甲酸酯和酮在酸催化下制缩酮,产率较高。
五元和六元环状缩酮的产率较好。
该反应可用于保护羰基与羟基化合物。
七、与NaHSO反应 3某醛亚硫酸氢钠加成物该反应不需催化剂,亚硫酸氢钠溶液需过量饱和。
反应可逆。
只有醛、脂肪族的甲基酮、环酮能发生此反应。
反应体系需维持弱酸性。
产物为盐,不溶于乙醇溶于水,可利用这个反应把醛从不溶于水的有机化合物中分离出来。
反应可用来制,—羟腈(避免使用HCN):八、与RSH加成缩硫醛(酮) 此反应不能用来保护羰基,但可以用此反应将羰基还原成亚甲基: 将缩硫醛(酮)恢复羰基结构可用如下方法:九、,,,—不饱和醛、酮的加成加成类型:碳碳双键上的亲电加成碳氧双键上的亲核加成 1,4—共轭加成卤素、HOX不发生共轭加成,只在碳碳双键上发生1,2—亲电加成:HCN、NH及NH的衍生物等、NaHSO,HX, HSO等质子酸以及HO,ROH在酸催化下与,,,—332423不饱和醛酮的加成为1,4-共轭加成:醛与RLi,RMgX,炔钠反应时以1,2—亲核加成为主。
与RCuLi反应,以1,4—加成为主: 2酮与RMgX反应时,如有亚铜盐如CuX做催化剂,主要得1,4—加成产物,如无亚铜盐做催化剂,发生1,2—加成还是1,4—加成,与反应物的空间结构有关,羰基与较大基团相连时发生1,4—加成:Michael(麦克尔)加成反应:一个能提供亲核碳负离子的化合物(给体)与一个能提供亲电共轭体系的化合物(受体)在碱性催化剂作用下发生亲核1,4—共轭加成的反应A,A’=醛基,酮基,酯基,硝基,氰基等常用的催化碱:三乙胺,六氢吡啶,氢氧化钠(钾)、乙醇钠、三级丁醇钾、氨基钠及四级铵碱等。
反应可逆,提高温度有利于逆反应。
该反应主要用于合成1,5—二官能团化合物。
Ribbison(鲁宾逊)增环反应:环己酮及其衍生物在碱存在下,与曼氏碱的季铵盐作用产生二并六元环的反应十、Clemmensen(克莱门森)还原法:醛或酮与锌汞齐和浓盐酸一起回流反应(酸性条件下将C=O还原成CH) 2此法只适用于对酸稳定的化合物。
十一、Wolff L—Kishner—Huang minlon(乌尔夫—凯惜纳—黄鸣龙)反应(碱性条件下将C=O还原成CH): 2常用二甲亚砜作溶剂。
此法为选择性还原,对碳碳双键无影响。
十二、缩硫酮氢解法(中性条件下将C=O还原成CH): 2十三、催化氢化(还原选择性差,双键、叁键、硝基、卤素、氰基被还原):有些反应需要在加温、加压或有特殊催化剂才能进行。
最常用的溶剂是醇、酸等。
如羰基两侧的立体环境不同,催化剂通常从空阻小的一侧被吸附,顺式加氢,形成羟基直立取向的异构体。
当碳碳双键与羰基不共轭时,还原活性为RCHO,C=C,RC=O;当两者共轭时,先还原碳碳双键,2再还原羰基。
十四、用氢化铝锂还原(双键、叁键不受影响):反应一般在醚中进行。
当羰基和一个手性中心连接时,反应符合Cram规则一。
空阻差别大时,主要得从空阻小的方向进攻的产物。
空阻差别不大时,主要得稳定产物(醇为平伏键)。
烷氧基取代的氢化铝锂可以选择性地进行还原,如用三(三级丁氧基)氢化铝锂可不还原酯基:oo十五、用硼氢化钠还原(主要还原醛、酮、酰氯的羰基、2RX、3RX):必须在质子溶剂中或有机锂离子存在下反应。
很多反应在醇溶液中进行。
空阻差别大时,主要得从空阻小的方向进攻的产物。
空阻差别不大时,主要得稳定产物。
十六、用乙硼烷还原(生成硼酸酯,水解得醇):反应为顺式加成。
C=C 、C,C对反应有干扰。
反应时先还原羰基,再还原碳碳双键。
十七、Meerwein—Ponndorl(麦尔外因—彭杜尔夫)反应(用异丙醇铝还原):相当于Oppenauer醇的氧化的逆向反应。
异丙醇铝反应生成丙酮蒸出。
只需催化量得异丙醇铝就可完成反应。
该反应在还原不饱和羰基化合物时特别顺利,且硝基不发生变化。
异丙醇铝在高温下,可以将羰基还原成为亚甲基:十八、活泼金属的还原醛用活泼金属如钠、铝、镁在酸、碱、水、醇等介质中作用,可以顺利地发生单分子还原生成一级醇:在钠、铝、镁、铝汞齐或低价钛试剂的催化下,酮在非质子溶剂中发生双分子还原偶联,生成频哪醇:活泼金属不能还原孤立的碳碳双键,但可以还原,,,—不饱和酮中的碳碳双键。
若试剂过量,共轭体系中的碳碳双键被还原后,羰基能继续被还原。
十九、,—H的卤化(酸或碱催化)只要加极少量的酸,因为反应一开始就会产生酸,此酸就能自动起催化作用。
对于不对称的酮,卤化反应(酸)的优先次序是:(关键是形成烯醇式)COCHR> COCHR > COCH 223酸中:V> V> V通过控制卤素的用量,可将卤化反应控制在一元、二一元卤化二元卤化三元卤化;元、三元阶段。
碱催化时碱,用量必须超过1mol,因为除了催化作用外,还必须不断中和反应中产生的酸。
对于不对称的酮,卤化反应(碱)的优先次序是:(关键是夺取,-H)COCHR< COCHR < COCH 223碱中:V< V< V卤化反应不能控制在一元卤化阶段。
一元卤化二元卤化三元卤化;二十、卤仿反应用碘仿反应来鉴别甲基酮类化合物或在反应条件下氧化成甲基酮类化合物(碘仿是不溶于NaOH的黄色沉淀):二十一、羟醛缩合反应a.醛的自身缩合(酸或碱催化)b.酮的自身缩合在酸性及强碱性条件下易失水,一般的碱性条件,加热时失水。
所以,如要制备,—羟基醛、 ,—羟基酮,通常采用弱碱性催化剂,温度较低的反应条件。
为使反应顺利进行,通常在索氏提取器中进行。
羟醛缩合反应是一个可逆反应,温度低有利于正向反应,加热回流有利于逆向反应。
正反应的操作条件是:低温、在碱性条件下缩合。
逆反应的操作条件是:在水中加少量-OH,加热回流。
插烯作用:羰基对,-H的活化作用可以沿共轭链传递环酮的缩合反应易于进行:若分子内既有羰基又有烯醇负离子,则羟醛缩合也可以在分子内发生得到关环产物。
c.交叉羟醛缩合反应a)甲醛的羟甲基化反应b)Cannizzaro(康尼查罗)反应:没有,—活泼氢的醛在强碱作用下,发生分子间的氧化还原而生成相应醇和相应酸的反应。
c)Claisen—Schmidt(克莱森—施密特)反应:一种无,—H的芳香醛和一种有,—H的脂肪醛或酮,在NaOH和乙醇的混合体系内,进行混合的缩合,得到产率很高的,、,—不饱和醛酮的反应:d.醛酮的定向缩合在碱性无质子溶剂中反应时,主要产物是(iii)。
在酸性条件下,主要产物是(iv)。
e.Perkin(普尔金)反应f.Knoevenagel(克脑文格)反应催化剂:吡啶、六氢吡啶、一级胺、二级胺等。
g.Darzen(达尔森)反应h.Reformatsky(瑞福马斯基)反应i.Benzoin(安息香)缩合二十二、Favorski(法沃斯基)重排反应:,—氯(溴)代酮在醇钠、氢氧化钠、氨基钠等碱性催化剂的作用下失去卤原子重拍成同碳数的羧酸之酯、羧酸、酰胺的反应可用此法合成张力较大的四元环。
二十三、二苯乙醇酸重排:二苯乙二酮在NaOH(70%)溶液中加热,重排成二苯乙醇酸的反应二十四、,—烷基化与酰基化反应(强碱或二级胺催化)催化剂:NaNH、PhLi、RLi、RNH (22)二十五、ylide(叶立德)的相关反应a.磷叶立德的制备:用四级鏻盐在强碱作用下失去一分子卤化氢制得生成物是黄色固体,对水与空气不稳定。
