有机合成化学 王玉炉 第三版 第2章
有机合成化学基本概念-王玉炉

1、理想的有机合成定义:一种理想的(最终是实效的)合成是指用简单的、安全的、环境友好的、资源有效的操作,快速定量地把价廉、易得的起始原料转化为天然或设计的目标分子2、有机合成反应总的来说可以分为两类:碳-碳键的形成、断裂和重组以及官能团的转换3、寻找高选择性试剂和反应已成为有机合成化学中最主要的研究课题之一,其中包括化学和区域(位置)选择性控制、立体选择性控制等。
4、有机合成反应的选择性有机反应的选择性包括化学选择,区域(位置)选择性控制、立体选择性控制三种;化学选择:分子中的官能团,不需要加以保护和特殊的活化,某一官能团本身就有选择性的反应。
位置选择:位置选择是指在反应中,反应试剂定向地进攻反应物的某一位置,或定向地发生在作用物的某一位置,而生成指定结构的产物。
立体选择反应:凡是在一个反应中,一个立体异构体的产生超过或是大大超过另外其他可能的立体异构体,就叫做立体选择反应。
这种反应常与作用物的位阻,过渡状态的立体化学要求以及反应条件有关。
5、烯烃进行官能团化集中表现在碳碳双键及双键的邻位——烯丙位这两个位置上。
6、烯烃与卡宾的加成反应是合成环丙烷衍生物的重要方法7、烯烃的亲电加成是―马尔科夫尼科夫‖产物,而自由基加成一般得―反-马尔科夫尼科夫‖产物;亲电加成的立体化学除硼氢化-氧化为顺式加成外,其余均为反式加成8、N-溴代丁二酰亚胺(NBS)在光催化反应条件下,可使多种甾烯的亚甲基发生氧化,具有良好的区域选择性9、取代苯衍生物的官能团化应注意的问题:取代苯衍生物的反应通常是亲电取代反应,该反应有两点要注意:第一,环上已有一个以上的取代基时,最强的供电子基团控制进一步取代的位置;第二,为了尽量减少在氮原子上取代的可能性,在进行取代之前,把芳胺转变成乙酰苯胺。
10.在有机合成中,通过官能团之间的转换实现目标分子的合成是具有普遍意义的。
11.缩合反应是指两个或两个以上分子经由失去某一简单分子(如H2O, HX, ROH, NH3, N2等)形成较大的单一分子的反应。
2_取代苯并噻唑的合成进展

并噻唑是一个较为直接的合成思路. Samat 等[20]以苯并噻唑和取代苯甲醛为原料合成 α-
羟基苄基苯并噻唑, 再还原得到取代的 2-苄基苯并噻唑 (Scheme 3). 该反应需要在氮气保护下低温进行, 条件 苛刻.
生产的要求, 而且产率很好, 即使在回收的离子液体(2 次或 3 次回收)中产率降低仍不明显. 3.3 以 2-卤代苯并噻唑为原料
Janda 等[41]通过邻氨基硫酚(邻氨基酚或邻苯二胺)
2 通过硫代酰胺或硫脲环化
由硫代酰胺或硫脲以及相应衍生物经环化生成 2取代苯并噻唑也是一种较常用的合成路线. 硫代酰胺或 硫脲可以根据实际需要自行设计合成, 因而产物中苯环 和 2 位的取代基可选择范围更大、更灵活. 只是反应需 多步完成, 反应时间通常比较长. 2.1 Jacobson 合成反应
* E-mail: yulu_wang889@ Received July 7, 2005; revised October 20, 2005; accept December 5, 2005.
No. 6
李焱等:2-取代苯并噻唑的合成进展
879
1.1 邻氨基硫酚与醛的反应
Kulenovic 等[22]用邻氨基硫酚与相应的醛在吡啶中 加热合成了 2-(5-芳基-2-呋喃基)苯并噻唑(Eq. 1). 该方 法由于使用有机溶剂, 会造成环境污染.
1.3 邻氨基硫酚与羧酸衍生物的反应
Srinivasan 等[38]研究了邻苯二胺与苯甲酰氯在多种 离子液体中的反应情况, 从中选出两种离子液体—— [Hbim]+BF4- (1-butylimidazolium tetrafluoroborate) 和 [bbim]+BF4- (1,3-di-n-butylimidazolium tetrafluoroborate), 并在其中进行了邻氨基硫酚(以及邻氨基酚、邻苯 二胺)与多种酰氯的反应(Eq. 11).
对甲苯磺酰氯催化的meso-四芳基卟啉的合成

收 稿 日期 :0 10 —7 修 回 日期 :0 10 -0 2 1 -21 : 2 1 -33
基 金 资 助 :7 家重 点 基 础研 究发 展 计 划 项 目资助 ( 05 B 23 6 9 3国 2 0 C 74 0 ) 联 系 人简 介 : 玉 炉 ( 9 5) 男 , 授 , 事 有 机合 成 化 学 研 究 。 E i yl_ ag8 @ 13 Cr; 瑾 哗 ( 9 5) 女 , 授 , 究 方 向 : 控 王 13・, 教 从 mal uu w n8 9 6 。O 王 : n 16 一 , 教 研 光 药物 释 放 化 合 物 的合 成 。 E ij yw n@ s ueu c ma :ne ag j _d . n li I
rg so i t o cu e e u e o e p n i ea d e sl v lb e c tl s , v ia c fh a y c n u t n o ih o o t — a e ft sme d i l d d t s i x e sv n a i a a a l aay t a od n e o e v o s mp o fdc lr me h h n h f n y i i h a e i n c o s o i a t a d g o il. n ,n o u u x d , o d y ed n n
P— CH3 H4 O2 C6 S CI
Z A G Q a WA G Y . ‘ D A e LU F n .u WA G J .e H N i , N u1 , U N L , I e gh a , N i y ‘ n u n
( . oeeo hmi n ni n et c ne K yLb rt yo re hmcl daadR at n , 1 Cl g f e c adE v m n l i c , e aoa r f enC e i i n ec os l C l a o r aSe o G a Me i
《有机化学-结构和性质相关分析与功能》第三版_课本答案全

第一章绪 论问题一部分参考答案μ=0。
1. (1) sp 3 (2) sp (3) sp 2 (4) sp(5) sp 3 (6)sp 22. (1),(3),(6)互为同分异构体;(2),(4),(5),(7)互为同分异构体。
3. (1)醇类 (2)酚类 (3)环烷烃 (4)醛类 (5)醚类 (6)胺类4.π键的成键方式:成键两原子的p 轨道沿着与连接两个原子的轴垂直的方向“肩并肩”重叠而形成。
π键特点:①电子云平面对称;②与σ键相比,其轨道重叠程度小,对外暴露的态势大,因而π键的可极化度大,在化学反应中易受到亲电试剂的进攻而发生共价键的异裂;③由于总是与σ键一起形成双键或叁键,所以其成键方式必然限制σ键单键的相对旋转。
5. (1) (2) (5)易溶于水;(5) (4) (6)难溶于水。
6.C 6H 67.C 3H 6F 2第三章开链烃问题三参考答案3-1(1) 3,3-二甲基己烷(2) 2,2,4,9-四甲基癸烷3-4 (1) 2,4,4-三甲基-1-戊烯(2) 4,6-二甲基-3-庚烯3-5 2-己烯有顺反异构:3-8 在较高温度和极性溶剂条件下,1,3-戊二烯同溴化氢主要发生1,4加成:习题三参考答案1.(1) 2-甲基-4,5-二乙基庚烷(2) 3-甲基戊烷(3) 2,4-二甲基-3-乙基戊烷(4) (顺)-3-甲基-3-己烯or Z-3-甲基-3-己烯(6) (Z)-3,5-二甲基-3-庚烯(7) 2,3-己二烯(8) 3-甲基-2-乙基-1-丁烯(9) 2,5,6-三甲基-3-庚炔(10)1-丁炔银(11)3-甲基-1,4-戊二炔(12) 3-甲基-1-庚烯-5-炔2.3.4.(Z)-2-戊烯(E)-2-戊烯(Z)-3-甲基-3-己烯(E)-3-甲基-3-己烯(Z)-3-甲基-4-乙基-3-庚烯(E)-3-甲基-4-乙基-3-庚烯(Z)-5-甲基-3-乙基-2-己烯(E)-5-甲基-3-乙基-2-己烯(Z)3-甲基-1,3-戊二烯(E)3-甲基-1,3-戊二烯5.2,3,3-三甲基戊烷2,3-二甲基-3-乙基戊烷2,3-二甲基-1-戊烯6-甲基-5-乙基-2-庚炔二乙基-1-己烯-4-炔6. (1)和(3) (2)和(4) (5)和(6)7.8.1-庚烯2-庚烯3-庚烯2-甲基-1-己烯3-甲基-1-己烯4-甲基-1-己烯5-甲基-1-己烯2-甲基-2-己烯3-甲基3-甲基-3-己烯2,3-二甲基-1-戊烯2,4-二甲基-1-戊烯3,5-二甲基-1-戊烯3,3-二甲基-1-戊烯2-乙基-1-戊烯3-乙基-1-戊烯2,3-二甲基-2-戊烯2,4-二甲基-2-戊烯3,4-二甲基-2-戊烯3-乙基-2-戊烯3-甲基-2-乙基-1-丁烯9.(1) 官能团位置异构(2) 顺反异构(3) 碳胳异构(4) 官能团异构(5) 碳胳异构(6) 碳胳异构10.该化合物的分子式为C14H3011.12.13. (CH 3)22CH 3 > CH 3CH 3 >C(CH 3)4 > CH 4烷烃的卤代反应机理为自由基取代反应。
有机合成 PPT课件

• 共51步
自问世以来,有机合成为人类的发展、文明的 进步起到了巨大的推动作用。
1.2 有机合成的发展简介
• 阶段1 产生
• 1828年 Wohler 合成尿素
HOCN + NH3 H2O
OO
• 香豆素的合成开创了香料工业
• 阶段2 初期阶段的复杂天然产物的全合成 E. Fischer完成的(+)-葡萄糖的合成
• 官能团的复杂性, 立体化学控制 • 代表19世纪末有机合成的最高水平 • 获得1902年诺贝尔化学奖
(+)-葡萄糖
• 托品酮的合成
1) 1903年,德国化学家 Willstatter 合成了托品酮
如果说Woodward 一生奋斗的成就是将有机合 成作为一种艺术展现在世人面前,那么Corey 则是 将有机合成从艺术转变成为科学的一个关键人物。 他的逆合成分析是现代有机合成化学的重要基石, 推动了20世纪70年代以最难的合成 海葵毒素的合成
分子式:C129H223N3O54,分子量2680,64 个手性中心 •哈佛大学Kishi 小组于1989年合成成功 •“有机合成的珠穆朗玛峰” --------20世纪有机合成工作的标志
He was awarded the Nobel Prize in Chemistry in 1990 ‘for development of the theory and methodology of organic synthesis’.
Selected Synthesis by the Corey Group
2 C10H13N + 3 "O" K2CrO4
有机合成的部位控制

有机合成中的部位控制一、控制选择的重要性众所周知有机合成在化学、生物、药物等学科乃至国民经济中都起着十分重要的作用。
一个有机分子的特殊功能和生理活性往往与本身特定结构和专一的立体化学有关。
任何的结构差异、构型的差异都会引起理化性质的变化有时甚至会起相反的作用[1]。
例如:羟基醛具有顺反异构,順式(1)具有强烈的愉快的气味,可作为一种香料使用,而反式(2)毫无气味。
又例震惊动世界的十九世纪海豹婴儿事件其悲剧的根源在于厂家没有把“反应停”药中的两个旋光异构体分开而是作为外消旋体来出售,而其中一个旋光异构体具有致畸作用导致了可怕的事件。
上述两例都充分说明了有机合成中各种选择控制是十分重要的,我们只有掌握各种选择控制的策略和方法才能使化学反应在我们所需的部位上发生,以保证目标分子的顺利合成。
二、控制选择的方法和策略有机合成中涉及到的各种选择控制可分为化学控制、区域控制及立体化学控制。
要想有效地实现这些控制,首先依赖于对有机反应理论、各类反应类型及机理的透彻理解和掌握;依赖于对分子结构的电性分析,亲电性、亲核性、亲电试剂、亲核试剂之间的辩证关系;充分利用电性效应和空间效应去预测反应发生的活性大小以及反应的可能位置尽可能多地掌握有机反应中的立体化学问题。
1、利用基团的反应活性的差异选择控制通常在使用逆合成法或合成子法设计有机化合物的合成路线时,常常因反应体系中各共存官能团或受官能影响的反应部位之间的相互影响,得不到预期的合成产物,这种现象我们称之为干扰。
而在复杂的有机物合成过程中,这样的干扰因素是经常存在的,只有借助有效的反应部位控制方法,排除干扰,才能实现复杂有机化合物的合成。
有机合成中的干扰因素,有的来自于同种分子的不同部位,有的则来自于合成体系中共存的其它化合物分子( 诸如反应物,产物、溶剂、催化剂等)。
根据希望反应部位和干扰部位的活性差异,可将干扰分成如下三种类型。
第一类、两者活性一致。
例如,我们希望的是A和B反应生成C,但由于C分子中受羧基影响的α位活性和A 近,也可以进一步和B发生反应生成D和E,在此C对A行成干扰。
2-取代苯并咪唑合成方法改进

效改进 .
实 验表 明 : 入 碘 可 以有 效 促 进 邻 苯 二胺 与 醛 加
参考 文献 :
[ ] 李焱 , 1 马会 强, 王玉炉. 并咪 唑及 其衍 生物合 成与应 苯 用研 究进展 [ ] 有机化学 ,0 82 ( )2 0 J. 2 0 ,8 2 :1 .
[ ] B ua hN, e i A, lo aoJe 1Ef i t i o 2 of a G ls Ma n d ,ta fce c — t l d . i nm r
缩合产物的环化和脱氢 , 有利于 目标产物 的生成.
然而 , 的加入 量太 多 时 会 因产 生较 多 的 副 产 物而 碘 令 产 率降 低. 0 5 m l 故 .0m o 的碘 ( 邻苯 二胺 和醛 均为
10 mo) .0m 1 为最 佳用量 .
2 2 反应 底 物对反 应 的影响 .
m l o d in , w rrat nt ea dgo il 7 7 % ) i cn io sl e ci m n ody d(3~ 8 d t o e o i e .
Ke r s: e zmi a o e; 2- h n l n d a n ad h de;y t e i ;o n y wo d b n i d z l 1, p e ye e imie; l e y s n h ss idie
w v s i e y t e i f n w s l n le zmia oe , a e a ss d s n h ss o e u f yb n i d z l4 t o 7 d o e : h t r c ci q i o e t p tn il n i mo - in s e eo y l c un n s wi h oe t a t u r a t
生物化学王镜岩第三版生化第二章糖课件

差向异构体
糖的旋光性(Optical Rotation)
葡萄糖及绝大多数糖都有使平面 偏振光发生偏转的能力,即糖的 旋光性,是因为糖都具有手性碳。 糖的旋光性和旋光度由糖分子中 的所有手性碳上的羟基方向所决 定.糖的旋光性以右旋(以+表 示)或左旋(以-表示)。
•结论:葡萄糖的六个碳是连成直链结构的 分子。
同分异构现象
碳链异构(如:丁烷/异丁烷)
构造异构
官能团异构(如:醚/醇)
constitutional
位置异构(如:辛醇/仲辛醇)
同分异构
顺反,Z、E异构
isomerism
构型异构 configurational 对映非对映异构
立体异构
Stereo- 构象异构
•异[杂]多糖[heteroglycans, heteropolysaccharides]
水解产物不止一种单糖或单糖衍生物[透明 质酸、肝素、硫酸软骨素、硫酸皮肤素等]。
糖的分类 IV
糖的衍生物 指糖的氧化产物、还原产物、氨基 取代物及糖苷化合物等,如,氨基葡萄糖、N-乙 酰氨基葡萄糖、糖的硫酸酯等; 多糖复合物[polysaccharides complex]糖与脂、 蛋白等共价相连组成:
单糖分子中的-OH,特别是异 头碳上的半缩醛羟基能与磷酸、 硫酸、乙酸酐等脱水生成酯。
• 碳水化合物的磷酸脂在生命活动中有特殊的重要性。 • 它们是许多代谢过程的中间体,在肝糖的生物合成和 降解过程中
2-乙酰基环己酮的合成与表征

2-乙酰基环己酮的合成与表征韩峰,徐崇福,李贞奇,周柳怡(江苏工业学院化学化工学院,江苏常州213164)摘要 研究了2-乙酰基环己酮的合成方法,结果表明,环己酮和吗啡啉以有机溶剂甲苯为共沸剂,以对甲苯磺酸为催化剂,进行缩合反应生成烯胺,然后加入缚酸剂三乙胺,滴加乙酰氯和有机溶剂的混合物,烯胺与乙酰氯发生亲核加成反应,生成亚胺正离子,最后加入浓盐酸对亚胺正离子进行水解,可生成研究产物2-乙酰基环己酮。
产物结构经红外光谱、核磁共振氢谱分析验证与目标化合物的结构一致。
关键词 2-乙酰基环己酮;缩合反应;酰基化中图分类号 TQ224.1 文献标识码 A 文章编号 0517-6611(2009)17-07816-02S yn th e s is an d C h a ra c te riz t ion o f 2-A c e ty lc y c lo h e x an on e HAN F en g e t a l (C o lle ge o f C h em istry and C h em ica l E n g in ee r in g ,J ian gsu P o ly tech n ic U n ive rsity ,C h an gzh ou,J ian g su 213164)A b s tra c t T h e syn th es is m e th od o f 2-ace ty lcycloh e xan on e w a s stu died .W ithto lu en e a s a zeo trop ic agen t and to lu en e -p -su lfon ic a ci d as ca ta lys t cy clo-h e xan on e ,en am in e w a s g en era ted th ou ghcon den sa tion re action.T h en de acid reagen t tr ie th y lam i n e w a s added andth e m ix tu re o f ace ty lch lo r ide an d o rgan ic so lven ts w a s added .T h e n u cleoph ilic add itionreaction w a s ca rr ied on en am in e an d ace ty lch lo r i de to g en e ra te i m in e ca tion s.T h e con cen tra ted h yd ro ch lor ic acid w a s added to h yd ro lyze i m in e ca tion s to gen e ra te th e targ e t p rodu c t 2-a ce ty lcycloh ex an on e.S tru ctu re o f th e com pou nd w as con firm ed by bo th IR and NM R spectroscopy.K e y w o rd s 2-a ce ty lcycloh e xan on e ;C onden sa tion;A cy la tion基金项目 江苏工业学院科技基金[ZM F 05020022]。
有机合成化学王玉炉第三版第
RCO3H
KMnO4 (稀、冷) H3C HC HO CH2 OH
② H2O/Zn CH3CHO + HCHO
CH3CH O
CH2
主讲人:刘环宇
2.1 官能团化
2.1.2 烯烃的官能团化
亲电加成是“Markovnikov”产物,而自由基加成一般得“反-Markovnikov”产物。
H3C C CH2 + V-W+ H
RCl RCOCl AlCl3 AlCl3 Friedel-Carefts Friedel-Carefts
CH2R COR [H] Zn-Hg/HCl
Ar
ArN2+ClOHSO3, H2SO4 X2 FeX3 (X=Cl, Br) 气相接触 催化水解 X
HNO3, H2SO4
NO2
SO3H NaOH
SeO2
CH2CH3 OH
CH3 CH3CH2C CHCH3
SeO2
CH3 CH3CHC CHCH3 HO
H3C C CHCH3 CH3
SeO2
H3C C CHCH3 CH2OH
二氧化硒氧化烯丙位氢时,通常发生在取代基较多的双键碳原子的-位,其顺序为:
C H CH2 CH3
|
主讲人:刘环宇
H H3C C CH2 OH Br HOBr
CH3CHVCH2W
ICl H H3C C CH2 Cl I
H3C C CH2 H
H H3C C CH2 H Br
HBr
过氧化物
HBr H3C C CH2 无过氧化物 H
硼氢化—氧化
H3C
H C
CH2
Br H
H2 H3C C CH2 OH
基础有机化学(邢其毅、第三版)第2章PPT

§2. 烷烃§2.1 烷烃的结构及同分异构B、σ键的特点a, 沿键轴方向重叠b, 电子云成筒型分布c, 可以任意旋转C、化学键的有关概念a,键角: 键与键之间的夹角, 甲烷C-H键角109.5°b,键长: 成键原子核之间的距离, C-H 0.11nmc,键能: 断裂(形成)一个化学键所需要(放出)的能量, C-H 439.3 kJ/mol2.烷烃的结构A. 甲烷的结构B. 烷烃的结构每个碳都以四面体形式存在如:CH COCH与CH CH CHOB.同系物与同系列CH4中的H被-CH3取代CH3CH3CH3CH3中的H被-CH3取代CH3CH2CH3形成一个可以用C n H2n+2表示的系列 这样一系列的化合物称为同系列。
同系列中每个化合物之间互称同系物。
§2.2 烷烃的命名1.普通命名法:正-异-表示在第二个碳上有一个甲基支链。
新-把所有的烷烃都看作是甲烷的衍生物,选级别最高的碳作为甲烷的母碳,称为某某甲烷。
碳的分级及烷基的命名碳的分级:1级碳(伯碳)-与一个碳相连2级碳(仲碳)-与两个碳相连3级碳(叔碳)-与三个碳相连4级碳(季碳)-与四个碳相连C, H原子的分类与一个碳相连的碳称为一级碳,伯碳,1°C, 上面的氢为1°H;与两个碳相连的碳称为二级碳,仲碳,2°C, 上面的氢为2°H;与三个碳相连的碳称为三级碳,叔碳,3°C, 上面的氢为3°H;与四个碳相连的碳称为四级碳,季碳,4°C如:烷基的命名烷基:烷烃去掉一个氢所剩的含一个自由价的部分3.系统命名法(C.最小§2.3 烷烃的异构现象1、碳链异构C6H142. 构象异构b,锯架式:D,构象与分子能量的关系b,丁烷:§2.4 烷烃的物理性质感官性质物理性质物理常数烷烃状态C1~C4 气体C5~C16 液态各种油汽油C17以上固态煤油柴油润滑油§2.5 化学键的断裂与有机反应类型§2.6 烷烃的化学性质2.裂解:A.热裂解:>750℃R -R’→R -H + R’-HB.催化裂解:在催化剂作用下,在<450 ℃3.卤代:烷烃与卤素(重点是Cl2和Br2)在光或热作用下反应生成卤代烃的反应A.卤代反应选择性:氯代-1°:2°:3°H=1 : 3.8 : 5溴代-1°:2°:3°H=1 : 82 : 1600事实:a,丙烷卤代:CHB,活性及选择性1)活性:反应的难易程度对于烷烃:3°H > 2°H > 1°H > CH4; 对于卤素: F2>>Cl2>Br2>>I22)选择性: 反应部位的专一程度Br > Cl为什么?应用:C.机理:room temperature CH.4.烷烃的其它反应A,硝化R-H + HNO3→R -NO2+ H2O B,磺化R -H + H2SO4→RSO3H + H2O§2.7 卤代反应选择性的理论解释1) 过渡态: 反应历程中能量最高的状态2)活化能: 反应物到过渡态的能量(山有多高)活化能高反应速率小(山高爬的慢) 3) Hammond假设:过渡态的结构与近的一边类似2,溴代及氯代反应的过渡态a,过渡态更接近于左侧中间体的性质; b,CH3CH2CH3中1°H : 2°H = 6 : 2; 取代1°H更为有利;c,但CH3CH.CH3比CH3CH2CH2.稳定, 取代2°H有利。
有机与药物合成化学知到章节答案智慧树2023年山东理工大学

有机与药物合成化学知到章节测试答案智慧树2023年最新山东理工大学第一章测试1.有机物大多数易溶于水参考答案:错2.具有相同分子式但结构不同的化合物称为同分异构体参考答案:对3.化学键是相邻原子间强烈的相互作用参考答案:对4.甲基碳正离子的碳是sp2杂化参考答案:对5.强酸的共轭碱是弱碱,强碱的共轭酸是弱酸参考答案:对6.乙醇是有机化合物参考答案:对7.乙醇和二甲醚的分子式相同,所以是同一化合物参考答案:错8.有极性键的分子一定是极性分子参考答案:错9.键能可以衡量键的牢固程度参考答案:对10.分子中正电荷中心和负电荷中心不重合,形成了偶极参考答案:对第二章测试1.烷烃是一种比较清洁的燃料参考答案:对2.烷烃是一种饱和烃参考答案:对3.烷烃的通式是C n H2n参考答案:错4.的系统命名是2,7,8-三甲基癸烷参考答案:对5.同一个化合物用系统命名法和习惯命名法命出的名字一定相同参考答案:错6.一个反应的活化能越高,反应速率越慢参考答案:对7.参考答案:对8.常温下四氯化碳是一种气体参考答案:错9.常温下氯仿是一种气体参考答案:错10.的系统命名是2,2,4-三甲基戊烷参考答案:对第三章测试1.CH3CH2CH2CH2+ (I),CH3CH+CH2CH3 (II),(CH3)3C+ (III)三种碳正离子稳定性顺序如何()参考答案:III>II>I2.下列化合物中哪些可能有异构体()参考答案:2-戊烯3.实验室中常用溴的四氯化碳溶液鉴定烯键,其反应历程是()参考答案:亲电加成反应4.烯烃与卤素在高温或光照下进行反应,卤素进攻主要位置是()参考答案:双键碳原子5.烯烃一定含有的官能团为()参考答案:双键6.丙烯无烯烃异构体。
参考答案:对7.丁烯有多个异构体。
参考答案:对8.乙烯中碳碳双键的结构为四面体构型。
参考答案:错9.烯烃可与水发生加成反应制备醇。
参考答案:对10.烯烃不能发生氧化反应。
有机化学(第三版马祥志主编)课后习题答案

第一章 绪论习题参考答案1. 某化合物的分子量为60,含碳40.1%、含氮6.7%、含氧53.2%,确定该化合物的分子式。
解:① 由各元素的百分含量,根据下列计算求得实验式1:2:133.3:7.6:34.3162.53:17.6:121.40== 该化合物实验式为:CH 2O② 由分子量计算出该化合物的分子式216121260=+⨯+该化合物的分子式应为实验式的2倍,即:C 2H 4O 22. 在C —H 、C —O 、O —H 、C —Br 、C —N 等共价键中,极性最强的是哪一个? 解:由表1-4可以查得上述共价键极性最强的是O —H 键。
3. 将共价键⑴ C —H ⑵ N —H ⑶ F —H ⑷ O —H 按极性由大到小的顺序进行排列。
解:根据电负性顺序F > O > N > C ,可推知共价键的极性顺序为: F —H > O —H > N —H > C —H4. 化合物CH 3Cl 、CH 4、CHBr 3、HCl 、CH 3OCH 3中,哪个是非极性分子?解:CH 4分子为高度对称的正四面体空间结构,4个C —H 的向量之和为零,因此是非极性分子。
5. 指出下列化合物所含官能团的名称和该化合物所属类型。
CH 3OH(2)碳碳三键,炔烃 羟基 ,酚(4)COOH酮基 ,酮 羧基 ,羧酸(6) CH 3CH 2CHCH 3OH (1) CH 3CH 2C CH(3) CH 3COCH 3(5) CH 3CH 2CHO醛基,醛羟基,醇(7) CH3CH2NH2氨基,胺6. 甲醚(CH3OCH3)分子中,两个O—C键的夹角为111.7°。
甲醚是否为极性分子?若是,用表示偶极矩的方向。
37. 什么叫诱导效应?什么叫共轭效应?各举一例说明之。
(研读教材第11~12页有关内容)8. 有机化学中的离子型反应与无机化学中的离子反应有何区别?解:无机化学中的离子反应是指有离子参加的反应,反应物中必须有离子。
有机合成发展简史

有机合成化学发展简史专业:精细化工学号:10姓名:***目录有机合成发展简史有机合成化学是有机化学的核心组成部分,是人类改造世界,创造美好未来的强有力工具.一个国家有机化学研究水平高低在很大程度上取决于有机合成化学发展状况.有机合成是推动有机学发展的永恒动力.1.有机合成是有机化学中永不枯竭研究资源生命科学:生物大分子、生物活性分子、生化分析试剂等;医药学:药物、药理、病理分析试剂等;农业:农药、农用化学品等;石油:石油化工产品等材料科学:高分子化合物、功能材料等;食品:食品添加剂等;日用化工:燃料、涂料、化妆品等.2.有机合成的发展史早期的合成化学1900年以前:简单化合物的制备1824年德国化学家维勒Wohler首次从无机物人工合成有机物--尿素.1845年德国化学家Kolbe合成醋酸1854年法国化学家Bezthelot合成油脂1890年德国化学家Emil Fisher合成六个碳原子的糖的各种异构体,由于他在糖化学和嘌呤等杂环化合物合成的功绩获得1902年的诺贝尔化学奖.合成化学的发展1900~1960年:生物活性的化合物被合成1902年德国化学家Willstatter合成托品酮1915年获得诺贝尔化学奖颠茄酮1917年英国化学家Robinson 全新、简捷地合成托品酮Mannich反应1947年获诺贝尔化学奖1929年德国化学家Hans Fisher 合成血红素通过对其分解产物的合成并最后加以装配美国化学家R.B.Woodward1917~19791965年获得诺贝尔化学奖现代有机化学之父复杂结构的生物碱的合成:1944年金鸡纳碱的合成,1954年马钱子碱的合成,1956年麦角新碱的合成,利血平的合成甾体化合物的合成:1951年胆甾醇等的合成1957年羊毛甾醇的合成抗生素的合成:青霉素V、四环素、VB12等Woodward与瑞士有机化学家Albert Eschenmoser合作,率领100多位科学家经过12年的努力,终于于1973年完成了VB12的全合成.有机合成的新发展60年代以后:有机合成化学形成了以反应机制为线索的体系E.J.Corey 美国化学家1967年提出具有严密逻辑的逆合成分析法,并合成血红素、前列腺素、白三烯等天然产物;1990年获得诺贝尔化学奖在60年代中期,科里创造了逆合成分析的原理,并提出了合成子和切断这两个基本概念.科里的合成方法和理论开创了计算机辅助有机合成的新纪元.1967年科里等人编写了第一个OCSSOrganic Chemical Simulation of Synthesis程序LHASA程序的前身逆合成分析法Retrosynthesis:即从需要合成的目标分子Target Molecule —TM出发,向回推出原料.即使一个简单的分子得合成也可以逆推出许多不同的中间体,组成不同的合成路线,结果得到一个所谓的“合成树”.20世纪60年代,Merrifield 美国生物化学家发展了固相合成技术.20世纪70年代,Corey 美国化学家发展了手性合成理论和方法.1989年,Kishi 美国化学家合成了海葵毒素分子式:C129H223N3O54,分子量2680,64个手性中心,7个骨架内双键,被称为是世纪工程.20世纪90年代,发展了组合化学合成理论和技术.3.中国有机合成发展概况在新中国成立后,中国的自然科学,包括有机合成化学,进入了一个崭新的发展时代.尽管当时的工业基础非常薄弱,又无强大的国力支持,但新中国的有机化学家在抗菌素,染料和甾体药物等的合成方面开展了相当出色的工作,尤其是甾体的半合成工作取得了极大成功,为当时世界上正在发展的甾体抗炎药和甾体避孕药工业打下了坚实的基础.从70年代起国际上的有机化学的发展出现了新的高潮,有机化学成为化学中最大的一个分支,有机合成则成为有机化学中最令人注目的一个领域.1965年9月,我国科学家汪猷等成功地合成了具有生理活性的结晶牛胰岛素.70年代中,前后合成了前列腺素E1PGE1,前列腺素F2α及ω-乙基同系物ω-Ethyl-PGF2α和15-甲基前列腺素F2α15-Methyl PGF2α等前列腺素,以及一大批昆虫棉红铃虫等信息素.此外这期间也开展了一些天然药物的合成研究,如具抗癌活性的喜树碱和具抗疟活性的仙鹤草酚等.1978年作为中国科学院的重点研究课题启动了青蒿素的全合成研究.青蒿素是中国科学家从中药中发现的新一代抗疟药,同时其独特的过氧结构也是对有机合成的新挑战.1981年11月,我国科学家又在世界上首先人工合成了酵母丙氨酸转移核糖核酸.1983年报道了从青蒿的另一成分——青蒿酸出发合成青蒿素的工作.1984年进而完成了由香茅醛开始的全合成工作.国内90年代天然产物合成较前有很大的发展,合成目标涉及到多种类型的化合物:周维善利用糠胺的不对称反应合成了一批生物碱,以及对苯乙烯内酯的合成.王志勤、许杏祥等对康宁木酶素进行了合成.总之,50年代以来,尤其近20年来中国天然产物合成这一科学高峰的攀登取得了很大的进展,缩小了与国际先进水平的差距.4.参考资料1、有机合成化学王玉炉等编.科学出版社,2014年第三版2、有机合成化学黄宪等编,化学工业出版社,2003年版3、现代有机合成化学吴毓林等编,科学出版社,2001年版4、中国有机合成概况参考中国有机合成化学家的攀登吴毓林,伍贻康编,出版源化学通报, 199912:25-32。
咪唑类离子液体及其催化C-C偶联反应

图 1 在 [m m[F] 的 M cal 应 b i] 4 B 中 ihe 反
DM S 0
Fg1 T eMi aleco b m [F] i. h c e rat ni mil 4 h i n[ B
图 3结 果 表 明 , 三 乙胺 的存 在 下 , 需 要 铊 在 不 盐 等 消 卤试 剂 ,此 反应 即可 高效 的完 成 ; c 偶 联 Hek 反 应 和烯 胺 的 芳 基 取代 物 几 乎 全 部 发 生 在 杂原 子
He k S z k , i i gB y i— l n a d Alo i mia oi m o i i u d re y c ,u u i t n , a l Hi ma n d l i d z l W t s l n u i n c l is b if . q l
Ke wor s o c lq ds a ay i;c u i g r a to y d :ini i ui ;c tl ss o pln e c in
【1L一 ;有 机 阴离 子则 主 要 为含 氟 的 阴离子 , AC ]等 如 【C 3O ) 】、 FS 3、 FC O-[Fc 2 等 ¨ ( FS z2 一[ 3O] [ ,O l C ,o1 N C -C , 一 。
出现 更 多 性质 理 想 、 实 用 价值 的 离 子 液体 , 使 有 且 其具 有广 泛应 用领 域 。本文 简单介 绍 离子 液体 的种 类 和特点 , 点介 绍在 咪 唑类 离子 液体 中的 C C偶 重 —
在 均 相 中完成 , 且反 应器 体 积大 为减 小 ;5 离 子液 () 体 作 为 电解质 具 有较 大 的 电化学 窗 口 、 良好 的 导 电
有 机合 成 中一 个 重要 的 C C偶 联反 应 f 。传统 的 — J '
《有机化学》第三版 王积涛 课后习题答案 南开大学 无水印版本
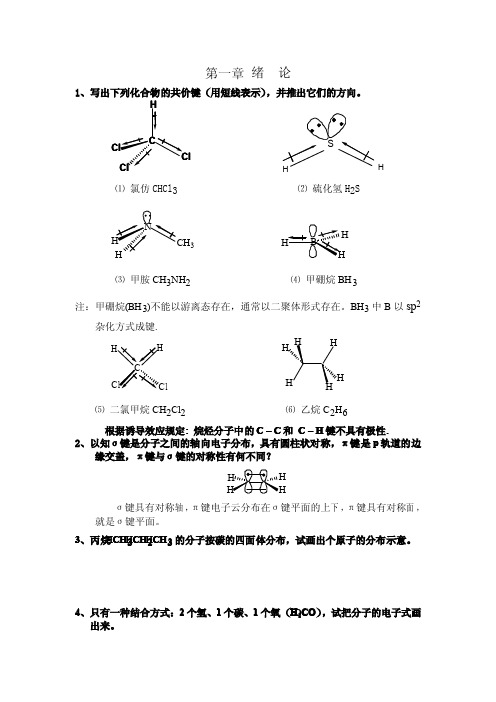
1、写出下列化合物的共价键(用短线表示),并推出它们的方向。 H
C Cl
Cl Cl
⑴ 氯仿 CHCl3
S
H
H
⑵ 硫化氢 H2S
N
H
CH3
H
H HB
H
⑶ 甲胺 CH3NH2
⑷ 甲硼烷 BH3
注:甲硼烷(BH3)不能以游离态存在,通常以二聚体形式存在。BH3 中 B 以 sp2
杂化方式成键.
__
_
2) CH3
CH-CH-CH3
+ CCl4
CH3 CCl3 + CH3-C-CH3
H
CH3 CH3-C-CH3 + CCl3
Cl
CH3 CHCl 3 + CH3-C-CH3
3)
CH3-—C-CH3 + CCl3 CH3
C H3- C- CH 3 —
+
C H3- C- CH 3 —
CH3
CH 3
130 (CH3)3CO-OC( CH3)3
2( CH3)3CO
异丁烷和才 CCl4 的混合物在 130℃~140℃时十分稳定。假如加入少量叔丁 基过氧化物就会发生反应,主要生成叔丁基氯和氯仿,同时也有少量叔丁醇 (CH3)3C-OH,其量相当于所加的过氧化物,试写出这个反应可能机理的所 有步骤。
_
|CH3 |CH3 5) CH3CHCH2CHCH3
2,4-二甲基戊烷 2,4-dimethylhentane
CH3 | CH3CCH2CH2CH3 | 6) CH3
CH3
|
CH3CH2CCH2CH3
|
7)
CH3
2,2-二甲基戊烷 2,2-dimethylhentane 3,3-二甲基戊烷 3,3-dimethylhentane
高一化学有机合成

第一章 绪 论
一、有机合成化学的发展历史及其定义
1828年德国科学家韦勒成功地从氰酸铵合成了尿素,揭开了有机 合成的序幕。迄今为止,有机合成化学历经了180多年的发展历史。 有机合成的历史可分为第二次世界大战之前的初创期和第二次世界大 战后的辉煌期。
第一阶段
有机合成主要是围绕以煤焦油为原料的染料和药物等的合成工业。 1856年 霍夫曼发现苯胺紫,威廉姆斯发现箐染料;
五、反合成分析法的基本概念
1. 切断:将目标分子中的化学键切断,使分子转化为合成所用的原料。
OH R C R' CH2COOR'' OH R C+ R' O R R' BrZnCH2COOR'' + CH2COOR''
合成子
合成等价剂
2. 合成子:也称合成元,是指切断目标分子化学键后所得到的带有电
《有机合成化学》课程介绍
有机合成化学是有机化学的重要组成部分和有机化学工业的基础,
在化学学科中占有独特的核心地位。有机合成的基础是各种各样的基元
合成反应,即有机化合物中碳碳键的形成、断裂和重组以及官能团之间
的转换。有机合成化学课的目的就是对有机化学中的基本反应进行系统 的知识梳理,在此基础上介绍一些有机合成的分析方法、有机合成过程 中的合成策略和技巧,从而使学生能够根据所学知识对目标化合物分子 进行反合成分析,设计合理的合成路线,并进行相关的合成实验,最终 得到需要的目标化合物。
时至20世纪90年代,完成的最复杂分子的合成当属Kishi小组的海 葵毒素的全合成。海葵毒素含有129个碳原子、64个手性中心和7个骨
架内双键,可能的异构体达271之多。合成化学家把合成化学与探索生
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
HCHO/HCl ZnCl2
CH2Cl
2.1 官能团化
2.1.4 芳烃的官能团化
1.芳环上的亲电取代反应
CH3
+CO + HCl
H3C
CH3
AlCl3
CH3 CHO
H3C 80% CH3
HO
OH
HCl
+ CH3CN ZnCl2 HO
OH NH2ClC
H2O
HO
CH3
OH O
C CH3
70%
主讲人:刘环宇
N Br H
Br2 RX
N
(RCOX)
MgX
N R(COR) H
RMgX N H
Na
① (CH3)2NCOCH3, POCl3 ② H2O
N
COCH3
H
HCHO, (CH3)2NHHCl
N
CH2N(CH3)2
H
C5H5N SO3
CH3COONO2
N SO3Ar
N
N
SO3H N
NO2
Na
H
H
N
COCH3
OH
CN
O R"
NH2
C C R" R"
CH(CO2Et)2 SH
R"SNa RCH2CHR'
S R"
主讲人:刘环宇
2. 2 官能团的转换
2.2.3 含卤化合物的转换
ArCN
NaCN
ArSO3Na
Na2SO3
ArSH
Na2S
ArX (Cl, Br)
NH4OH或NH3加压/CuCl/200o C
RNH2(催化,高温) (Ar)
2.1 官能团化
2.1.2 烯烃的官能团化
烯烃与卡宾的加成反应是合成环丙烷衍生物的重要方法
CH2N2 hv
CH2 + N2
CH3 CH CH2 + CH2
CH3 CH CH2 C H2
主讲人:刘环宇
2.1 官能团化
2.1.2 烯烃的官能团化
亲电加成的立体化学告诉我们:除硼氢化-氧化为顺式加成外,其余均为反式加成
NH
3
RCOOR'
Na/C2H5OH 或 LiAlH4
RCH2OH + R'OH R'
1 2R"MgX R C R"
2 H2O
R"OH/H+ 或 RONa
OH RCOOR" + R'OH
R"CH2COR'" RCOCHCOR'" EtONa
R"
R"CH2COOR ' RCOCHCOOR '
EtONa R"
CH2CH3 SeO2
CH2CH3 OH
CH3 CH3CH2C CHCH3
SeO2
CH3 CH3CHC CHCH3
HO
H3C C CHCH3 CH3
SeO2
H3C C CHCH3 CH2OH
二氧化硒氧化烯丙位氢时,通常发生在取代基较多的双键碳原子的-位,其顺序为:
主讲人:刘环宇
CH
|
CH2
CH3
Ar SO3H
ArN2+ClOH-
SO3, H2SO4
NaOH OH
气相接触 X
催化水解
主讲人:刘环宇
RCl
RCOCl
AlCl3 Friedel-Carefts
AlCl3 Friedel-Carefts
COR
HNO3, H2SO4 NO2
[H] Zn-Hg/HCl
CH2R
X2 FeX3 (X=Cl, Br)
CH3 C Cl + CH3
CH2 Cl H3C C H
CH3
CH3 H3C C CH3
CH3
Cl2 紫外光
CH3 H3C C CH2 Cl
CH3
主讲人:刘环宇
2.1 官能团化
2.1.2 烯烃的官能团化
烯烃与烷烃不同,进行官能团化集中表现在碳碳双键及双键的邻位——烯丙位两个位置上。
CH3CH2CH3
沸水煮 H3PO2
ArOH ArH
Cu2X2 HX
ArX(X=Cl, Br)
Ar (R) NNH2
R'
主讲人:刘环宇
2. 2 官能团的转换
2.2.3 含卤化合物的转换
R H2C CH R' MgX
Mg 乙醚
R H2C CH R' Li
Li
N2
R H2C CH
2Na
R' 2
R H2C CH R' X
(R)
R'X
ArNHR' HONO (R)
Ar (R) NNO [H]
R'
PhH PhAr
OH-
PhOH, OH-
NaNO2
Ar N N
OH
H2SO4
ArCN
ArI ArF
热解
ArNO2
NaNO2 ArN2BF4
KCN Cu2(CN)2
KI
NaBF4
ArN2+HSO4-
Na2S2 Ar S S Ar
ArCOR
ArH AlX3
RCHO
H2 Pd-BaSO4
RCH2OH
1 LiAlH4 2 H3+O
RCOR' R'
R'MgX 醚,低温
2 R'MgX
R C R' 醚,室温
OH
(RCO)2O
ArH AlX3
RCOAr
H 2O RCOAOCN2aO
NH 3,
-
O/OH
2
RCOX NH3
R'OH
RCONH2
ArOH
(RO)2SO2 或RX, OH -
ArOR
CH2N2
ArOCH3
主讲人:刘环宇
2. 2 官能团的转换
2.2.2 氨基的转换
ArNHCOR' (R)
ArNR2' R'X ArNR'3 X
(R)
(R)
or (R'CO)2O R'COCl
ArNHSO2Ar ArSO2Cl ArNH2 R'X
(R)
主讲人:刘环宇
2.1 官能团化
2.1.1 烷烃的官能团化
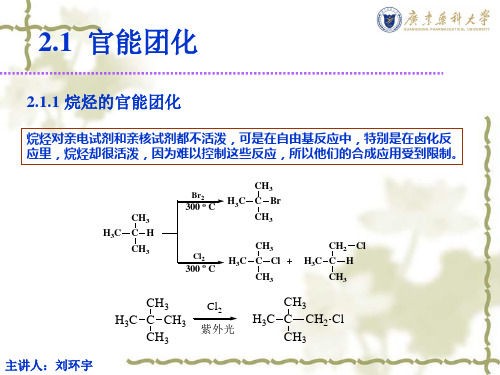
烷烃对亲电试剂和亲核试剂都不活泼,可是在自由基反应中,特别是在卤化反 应里,烷烃却很活泼,因为难以控制这些反应,所以他们的合成应用受到限制。
H3C
CH3 CH CH3
Br2
300 o C
H3C
CH3 C Br CH3
Cl2
300 o C
H3C
2.1 官能团化
2.1.2 烯烃的官能团化
N-溴代丁二酰亚胺(NBS)在光催化反应条件下,可使多种甾烯的亚甲基发生氧化,具 有良好的区域选择性
OOCCH3
主讲人:刘环宇
hv/NBS/CaCO3 THF/H2O
OOCCH3
O
81%
2.1 官能团化
2.1.2 烯烃的官能团化
用NBS进行溴化,因为反应涉及烯丙基自由基中间体,所以得到溴代烃的混合物
H3C
C H
CH2 +
V-W+
CH3CHVCH2W
H
H3C C CH2 OH Br
HOBr
ICl
H3C
C H
CH2
H
H3C C CH2 Cl I
H H3C C CH2
H Br
HBr
过氧化物
H3C
C H
CH2
HBr
无过氧化物
硼氢化—氧化
H H3C C CH2
Br H
H2 H3C C CH2
OH
主讲人:刘环宇
OH 发烟H2SO4 O2N
HNO3
OH NO2
NO2
CH3
NO2 Cl2/FeCl3 Cl
50~60 oC
CH3 NO2
NH2
+
NaOCl + HCl
H2O 25~30 oC
NO2
NH2 Cl + NaCl+H2O
NO2
主讲人:刘环宇
2.1 官能团化
2.1.5 取代苯衍生物的官能团化
NO2 + (PhCO2)2
NBS
RCH2CH CH2 (PhCO2)2 R CH CH CH2
.
R CH CH CH2
NBS
Br
Br
R CH CH CH2+ R CH CH CH2
主讲人:刘环宇
2.1 官能团化
2.1.3 炔烃的官能团化
主讲人:刘环宇
2.1 官能团化
2.1.4 芳烃的官能团化
1.芳环上的亲电取代反应
R
D2SO4 D
ArNH2
Na2Cr2O7 H2SO4 0 oC
ArNHOH
Zn NaOH水溶液
Zn, NaOH/CH3OH
Ar N N Ar
ArNHNHAr
Zn, NaOH水溶液
主讲人:刘环宇
2. 2 官能团的转换
2.2.5 氰基的转换
RCH2NH2
H2/Ni 或LiAlH4
① R'MgX/ 醚 RCOR' ② H3+O
RONa (Ar)
ArNH2
ArNHR(Ar)
ArOR(Ar)
