弹性蛋白酶
弹性酶

弹性酶弹性酶由240个氨基酸组成的多肽,分子量为25900,其分子从链走向和空间构型与胰凝乳蛋白酶相似。
弹性酶是有丝氨酸的蛋白酶,它存在于所有动物的胰脏中。
在人的主动脉、皮肤、血小板和白血球中也存在弹性酶活力的物质,除此之外,某些微生物和植物也具有弹性酶活力物质。
弹性酶最引人注目特性是溶解弹性蛋白,开始人们就认为弹性酶不是单一酶,其含有弹性水解 (elastolytie),粘糖水解(mueolytic)和脂水解(Lipolytic)作用的三种酶的混合物,它分别称为弹性蛋(elastprotcinase),弹性粘多糖酶( elastomucase)和弹性脂蛋白酶(elastolipoproteinase)。
这种粗弹性酶能分解弹性纤维是由于弹性粘多糖酶作用于弹性蛋白链间的粘多糖,弹性脂蛋白酶作用于弹性蛋白链间脂质,促进弹性蛋白酶分解弹性蛋白。
弹性酶是一种单纯蛋白,它不含辅基和金属离子,其活性中心取决于特异的三维结构,当其发生变性,构型改变,就引起失活。
最近人们认为弹性酶是含有二种酶:弹性酶1,即通常所称弹性酶;弹性酶Ⅱ,即新发现的蛋白酶。
这两种酶的理化性质和氨基酸组成是不同的。
氨基酸组成:弹性酶有降血脂、防治动脉粥样硬化等作用,广泛应用于临床。
弹性蛋白酶与其它蛋白类药物一样,易变性失活,对温度敏感,口服易被胃酸及蛋白酶破坏,在临床应用上受到限制。
生物分子工程学为解决这一问题带来希望。
用澳化氰活化的右旋糖醉对弹性蛋白酶进行修饰改变酶的性质。
修饰后的酶在常温下18个月活力保持不变。
一、弹性酶的修饰用修饰剂如右旋糖酐、聚乙二醇。
先将修饰剂进行活化,然后通过共价键连接于酶分子的表面,形成一层覆盖层,从而改变酶的物化性质。
右旋糖酐和聚乙二醇等可溶性大分子是最常用的酶的表面化学修饰剂,这两种修饰剂无毒性,反应条件温和,不与酶活性中心的基团结合,易于保留蛋白和酶的活性而不变性,且修饰后的酶水溶性较好。
1.右旋糖酐修饰取0.5g右旋糖酐溶于5mL蒸馏水中,加入0.5mL 2%KIO4溶液活化,于4℃冰箱过夜(18h以上),用蒸馏水透析过夜,再用pH 7.4的Tris-Cl 透析,用聚乙二醇浓缩至2mL。
弹性蛋白酶

弹性蛋白酶
弹性蛋白酶,由动物的胰脏用水提取而得,也可用细菌的培养液在低温下用水提取而得。
弹性蛋白酶的性状:
1.其外观呈淡黄色至深黄色粉末,也可是浅褐至深褐色液体。
可溶于水,不溶于乙醇,有吸湿性。
2.纯胰弹性蛋白酶,由240个氨基酸残基组成的单一肽链,相对分子质量约为25000,等电点为9.5。
3.弹性蛋白酶可使结缔组织蛋白质中的弹性蛋白消化分解,包括肽键结合的、
酰胺结合的和酯结合的进行加水分解。
作用的最适pH值7.8,最适作用温度25℃。
4.弹性蛋白酶具有明显的β-脂蛋白酶作用,能活化磷酯酶A,降低血清胆固醇,改善血清脂质,降低血浆胆固醇及低密度脂蛋白、甘油三酯,升高高密度脂蛋白、阻止脂质向动脉壁沉积和增大动脉的弹性,具有抗动脉粥样硬化及抗脂肪肝作用。
5.弹性蛋白酶最初以酶原的形式存在,经过酶切后才有活性。
Promega新推出四款蛋白酶新品推荐

Promega公司近日宣布推出四款新的蛋白酶,包括胃蛋白酶(Pepsin)、弹性蛋白酶(Elastase)、测序级别的Arg-C以及嗜热菌蛋白酶(Thermolysin)。
这些高品质的蛋白酶是Promega市场领先的蛋白样品制备试剂中的最新成员。
Promega公司近日宣布推出四款新的蛋白酶,包括胃蛋白酶(Pepsin)、弹性蛋白酶(Elastase)、测序级别的Arg-C以及嗜热菌蛋白酶(Thermolysin)。
这些高品质的蛋白酶是Promega 市场领先的蛋白样品制备试剂中的最新成员。
这些新的蛋白酶是以冻干粉形式提供的,可重悬于任何缓冲液中。
它们的应用包括肽段作图和蛋白鉴定实验,以及翻译后修饰的鉴定。
胃蛋白酶优先切割苯丙氨酸、酪氨酸、亮氨酸和色氨酸的羧基端。
弹性蛋白酶是一种丝氨酸蛋白酶,有着消化弹性蛋白的独特能力。
它优先切割丙氨酸、丝氨酸、缬氨酸、甘氨酸、亮氨酸或异亮氨酸的羧基端。
Arg-C是一种测序级别的肽链内切酶,切割精氨酸残基的羧基端,包括挨着脯氨酸的位点。
切割还会发生在赖氨酸残基。
在质谱及其他应用中,这三种蛋白酶可单独使用,或与其他酶结合使用。
嗜热菌蛋白酶是一种热稳定的金属蛋白酶,其最佳消化温度在65-85°C。
高的消化温度可替代变性剂,以改善某些耐水解蛋白的消化。
嗜热菌蛋白酶优先消化疏水氨基酸亮氨酸、苯丙氨酸、缬氨酸、异亮氨酸、丙氨酸和蛋氨酸的氨基端。
Promega公司为质谱分析提供了多款特色产品,包括“金牌胰蛋白酶”(Trypsin Gold)。
胰蛋白酶是丝氨酸蛋白酶,可特异性地切开赖氨酸和精氨酸残基的羧基端。
胰蛋白酶这种严格的特异性是蛋白质鉴定的基础。
天然胰蛋白酶易于自我水解,产生假胰蛋白酶,后者特异性较广,含有胰凝乳蛋白酶样活性。
这些自我水解产物能产生多余的肽片段,从而干扰质谱检测。
为此,Promega将猪胰蛋白酶中的赖氨酸残基经过还原甲基化修饰,成为活性高且稳定的分子,抗拒自我水解的性能特别强。
人中性粒细胞弹性蛋白酶及其抑制剂研究

人中性粒细胞弹性蛋白酶及其抑制剂研究人中性粒细胞弹性蛋白酶(human neutrophi l elastase,HNE)在机体各种炎症反应、组织损伤重构(如肺炎)、成人呼吸窘迫综合征、肺纤维化、急(慢)性肺损伤、肺水肿、动脉粥样硬化、硬皮病等病理过程中起重要作用,并且具有促进病毒、细菌的侵人及癌细胞转移的功能。
炎症机制研究显示,体内该酶及其内源性抑制剂的平衡失调可导致组织基质降解和炎症的恶化。
目前,国外用HNE抑制剂来治疗这一类炎症疾病的研究非常广泛,并已成功开发出第一个以抑制HNE为治疗途径的上市药物西维来司钠(sivelestat sodium hydrate),从而促进了HNE抑制剂的研究与开发。
1 BM的生理、病理作用及结构特征HNE,又称人白细胞弹性蛋白酶(human leukocyte elastase,IRE),属于基质金属蛋白酶类(matrix metalloproteinases,MMPs),即MMP-12,是一种金属离子依赖性基质降解酶,需要微量Zn2+和Ca2+离子的存在才具有酶活性,其底物类型非常广泛,几乎可降解细胞外基质中的所有蛋白。
白细胞、巨嗜细胞、肥大细胞内都存在着这种酶,中性粒细胞中其含量很高,大约每106个细胞中含有HNE的总量为 3μg。
生理条件下,HNE可以协助清除异源性物质,促进吞噬细胞消除有害病菌,并帮助消化受损组织,有助于伤口的愈合与组织再生。
而HNE过量表达则会对机体组织、基质造成危害,表现为破坏血管壁组分,使中性粒细胞更容易渗出血管并向炎症部位趋化集中及释放IL-8、TNF-α等炎症因子;它还能降解细胞基质,催化caspase 3诱导的细胞凋亡。
据报道,HNE还能增强病毒、细菌及癌细胞对正常细胞的黏附能力,促进微生物的入侵及癌细胞的增殖和转移。
HNE存在于中性粒细胞嗜苯胺蓝颗粒中,是由 218个氨基酸组成的单一肽链,分子质量大约25.9 kD,含4个二硫键,是丝氨酸蛋白酶家族一员,因此与其他丝氨酸家族蛋白酶具有30%~40%的同源性,最适pH值接近中性。
弹性酶临床应用范围是多少

弹性酶临床应用范围是多少弹性酶临床应用范围是很广泛的,涉及多个领域。
弹性酶(弹性蛋白酶)是一种酶类蛋白,主要作用是分解和降解组织中的弹性蛋白,从而实现对组织的软化和降解。
以下将从几个主要方面介绍弹性酶的临床应用范围。
首先,在胃肠领域,弹性酶被广泛应用于消化内镜检查中。
在内窥镜检查中,有时候发现病变组织或异物较难获取或去除,这时弹性酶可以起到软化组织的作用,帮助医生更好地获取或去除异物。
此外,弹性酶还可用于治疗食道溃疡、消化道梗阻等疾病,具有显著的临床疗效。
其次,弹性酶在皮肤整形美容领域也有重要应用。
例如在注射玻尿酸或肉毒杆菌等物质后,若需要溶解或矫正,可使用弹性酶进行局部溶解,避免手术风险,减少患者疼痛感,提高手术效果。
此外,弹性酶还被广泛应用于眼科领域。
在一些眼科手术中,如视网膜手术、玻璃体切除术等,弹性酶可以帮助医生顺利完成手术,提高手术成功率,减少手术并发症的发生。
另外,在妇产科领域,弹性酶也有一定的应用范围。
如在妇科手术中,可以利用弹性酶软化组织,减少手术创伤,提高手术效果,缩短患者康复时间。
同时,弹性酶还可以用于治疗子宫肌瘤、卵巢囊肿等妇科疾病,具有较好的治疗效果。
总的来说,弹性酶的临床应用范围很广,涵盖了消化内镜检查、皮肤整形美容、眼科手术、妇产科手术等多个领域。
随着科技的不断发展和进步,弹性酶在临床应用中的作用将会越来越重要,为医生提供更多的选择和可能性,为患者带来更好的医疗效果。
精浆弹性硬蛋白酶、生化、果糖

精浆弹性硬蛋白酶(PMN-Elastase)精浆弹性硬蛋白酶是检测炎症的手段之一,精浆弹性硬蛋白酶可作为静止型生殖道感染的诊断及愈后检测指标。
临床上主要用于检查男性生殖道感染。
精浆弹性硬蛋白酶检测原理包被于固相载体的抗弹性硬蛋白酶单抗可与精浆中弹性硬蛋白酶相结合,结合的待测物再与特异性酶标记物反应,最后通过底物显色,其吸光度大小与精浆标本中弹性硬蛋白酶浓度相关。
检测步骤(1)准备适当数量的包被微孔。
标准品、稀释标本加样量均为100μl/孔。
五个标准品浓度依次为3000、1500、750、375 和0ng/ml(以标本稀释液作为0 标准)。
(2)用封片膜封板。
以孵育振荡器(350 ~400rpm)室温(18 ~28℃)反应60min。
(3)弃去封板膜。
洗板:以洗涤液注满微孔,每次浸泡1min,共洗板5 次。
扣干。
(4)每孔加酶结合物100μl。
用封板膜封板。
以孵育振荡器(350 ~400rpm)室温(18 ~28℃)反应45min。
(5)弃去封板膜。
洗板:以洗涤液注满微孔,每次浸泡1min, 共洗板5 次。
扣干。
(6)每孔加显色液100μl, 室温避光反应20min[显色液临用前配制。
方法是:显色剂A: 显色剂B按体积比40: 1混合(如显色剂A 400μl + 显色剂B 10μl),显色液配制后30min 内使用]。
(7)每孔加终止液100μl,充分混匀。
15min 内上酶标仪双波长450/630nm 比色。
判断标准判断标准数值:< 290ng /ml, 隐性感染: 290 ~1000ng/ml, 确证感染: > 1000ng/ml。
急性炎症时, 弹性硬蛋白酶复合物浓度迅速从正常水平升高超过290ng/ml, 直到炎症被治愈, 否则还是保持高水平。
当临床上检查到有微生物感染, 炎症即可被诊断。
精浆生化学对精浆进行生物化学检测。
精浆主要由附属性腺(前列腺、精囊腺、尿道球腺)和附睾的分泌物组成,因此精浆生化检查对评估附属性腺的功能以及研究附属性腺对男性生育的影响有重要意义。
人中性粒细胞弹性蛋白酶(NE)酶联免疫分析(ELISA)
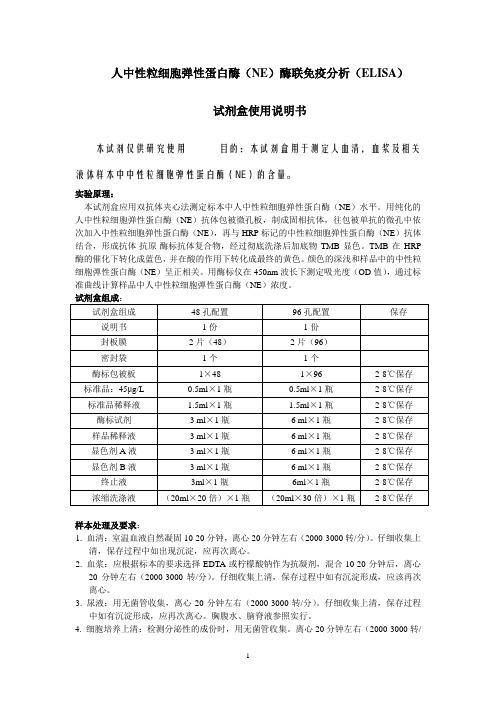
人中性粒细胞弹性蛋白酶(NE)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定人血清,血浆及相关液体样本中中性粒细胞弹性蛋白酶(NE)的含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中人中性粒细胞弹性蛋白酶(NE)水平。
用纯化的人中性粒细胞弹性蛋白酶(NE)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入中性粒细胞弹性蛋白酶(NE),再与HRP标记的中性粒细胞弹性蛋白酶(NE)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP 酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的中性粒细胞弹性蛋白酶(NE)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人中性粒细胞弹性蛋白酶(NE)浓度。
样本处理及要求:1. 血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
2. 血浆:应根据标本的要求选择EDTA或柠檬酸钠作为抗凝剂,混合10-20分钟后,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应该再次离心。
3. 尿液:用无菌管收集,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应再次离心。
胸腹水、脑脊液参照实行。
4. 细胞培养上清:检测分泌性的成份时,用无菌管收集。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
检测细胞内的成份时,用PBS(PH7.2-7.4)稀释细胞悬液,细胞浓度达到100万/ml左右。
通过反复冻融,以使细胞破坏并放出细胞内成份。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
保存过程中如有沉淀形成,应再次离心。
5. 组织标本:切割标本后,称取重量。
加入一定量的PBS,PH7.4。
弹性蛋白酶检测方法

弹性蛋白酶,是由动物的胰脏用水提取而成,也可用细菌的培养液在低温下用水提取获得。
弹性酶是由240个氨基酸组成的多肽,其CAS:39445-21-1,分子从链走向和空间构造型与胰凝乳蛋白酶相似。
弹性酶是有丝氨酸的蛋白酶,它存在于所有动物的胰脏中。
在人的动脉、皮肤、血小板和白血球中也存在弹性酶活力的物质。
除此之外,一些微生物和植物中也具有弹性酶活力物质。
弹性蛋白是一种单纯蛋白、它不含辅助基和金属离子,其活性中心取决于特异的三维结构,当其中发生兵役,构型将会改变、引起失活。
弹性蛋白酶制备提取:一般由动物的胰脏用水提取而得,也可用细菌的培养液在低温下用水提取而得。
弹性蛋白酶检测步骤:(仅供参考)(1)准备适当数量的包被微孔。
标准品、稀释标本加样量均为100μl/孔。
五个标准品浓度依次为3000、1500、750、375 和0ng/ml(以标本稀释液作为0 标准)。
(2)用封片膜封板。
以孵育振荡器(350 ~400rpm)室温(18 ~28℃)反应60min。
(3)弃去封板膜。
洗板:以洗涤液注满微孔每次浸泡1min共洗板5 次。
(4)每孔加酶结合物100μl。
用封板膜封板。
以孵育振荡器( 350 ~400rpm)室温(18 ~28℃)反应45min。
(5)弃去封板膜。
洗板:以洗涤液注满微孔,每次浸泡1min 共洗板5 次。
(6)每孔加显色液100μl 室温避光反应20min[显色液临用前配制。
方法是:显色剂A: 显色剂B按体积比40: 1混合(如显色剂A 400μl + 显色剂B 10μl)显色液配制后30min 内使用。
(7)每孔加终止液100μl充分混匀。
15min 内上酶标仪双波长450/630nm 比色。
弹性蛋白酶的提取流程分析

弹性蛋白酶的提取流程分析下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor.I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!弹性蛋白酶的提取流程分析弹性蛋白酶,作为一种重要的生物酶,广泛应用于食品、医药、化妆品等领域,其主要功能是分解和降解弹性蛋白。
弹性蛋白酶调节中性粒细胞炎性募集的功能研究

doi:10.3969/j.issn.1000-484X.2024.03.001·论著/基础免疫学·弹性蛋白酶调节中性粒细胞炎性募集的功能研究刘洋孟玲范思佳任春光张欢(重庆医科大学基础医学院细胞与遗传教研室发育生物学研究室,重庆 400016)中图分类号R392.12 文献标志码 A 文章编号1000-484X(2024)03-0449-07[摘要]目的:探索中性粒细胞弹性蛋白酶(NE)对中性粒细胞炎性募集的影响。
方法:采用外源性弹性蛋白酶抑制剂西维来司钠盐预处理小鼠骨髓来源的中性粒细胞,通过腹膜炎过继性迁移、细胞体外趋化、流动室黏附、免疫荧光染色、细胞伸展等实验,检测NE的抑制对中性粒细胞体内炎性募集、体外趋化、牢固黏附、细胞极化与伸展能力的影响;利用流式细胞术及鲁米诺化学发光系统检测NE的抑制对中性粒细胞吞噬及活性氧(ROS)释放能力的影响。
结果:西维来司钠盐预处理显著减弱了中性粒细胞体内炎性募集(P<0.001);减弱了中性粒细胞在体外趋化过程中对催化剂方向性的感知(P<0.05),减慢了趋化速率(P<0.05),降低了趋化距离(P<0.05);减少了中性粒细胞在炎性内皮细胞表面形成牢固黏附的能力(P<0.000 1),抑制了中性粒细胞对细菌的吞噬能力(P<0.01);但对中性粒细胞的伸展、极化及ROS的释放均无显著影响。
结论:NE的抑制显著损害了中性粒细胞在体内外的炎性募集级联反应及吞噬作用,但对中性粒细胞的伸展、极化、ROS释放等功能无显著影响。
[关键词]中性粒细胞;弹性蛋白酶;西维来司钠盐;炎性募集Functional study on elastase regulation of inflammatory neutrophils recruitment LIU Yang,MENG Ling,FAN Sijia,REN Chunguang,ZHANG Huan. Laboratory of Developmental Biology,Department of Cell Biology and Genetics, School of Basic Medical Sciences, Chongqing Medical University, Chongqing 400016,China[Abstract]Objective:To explore the effect of neutrophil elastase (NE)on neutrophil inflammatory recruitment. Methods:Mice bone marrow-derived neutrophils were pretreated with an exogenous elastase inhibitor-sivelestat sodium. The effects of elastase inhibition on the in vivo inflammatory recruitment,chemotaxis,adhesion,cell polarization and spreading of NE were examined by peritonitis adoptive transfer assay,dunn chamber,flow chamber,immunofluorescence staining and spreading assay,respectively. The effects of elastase inhibition on NE phagocytosis and reactive oxygen species (ROS) release capacity were detected by flow cytom‑etry and the luminol chemiluminescence system. Results:Sivelestat sodium pretreatment significantly attenuated neutrophil in vivo in‑flammatory recruitment (P<0.001); impaired neutrophil perception of chemotaxis in vitro (P<0.05), slowed chemotactic velocity (P< 0.05), and decreased the chemotactic distance (P<0.05); reduced the adhesion of neutrophils to inflamed endothelial cells (P<0.000 1)and inhibited the phagocytosis of bacteria by neutrophils (P<0.01); however, there was no significant effect on neutrophil spreading,polarization and ROS. Conclusion:NE inhibition significantly impaired the inflammatory recruitment cascade response and phagocyto‑sis of neutrophils in vitro and in vivo but had no significant effect on the spreading, polarization and ROS release of neutrophils.[Key words]Neutrophils;Elastase;Sivelestat;Inflammatory recruitment基金项目:中国博士后科学基金面上项目(2021MD703921);重庆市人社局重庆市留学人员回国创业创新支持计划(cx2020029);重庆市科委博士直通车项目CSTB2022BSXM-JCX0036);重庆市博士后科学基金(cstc2021jcyj-bshX0080);重庆医科大学未来医学青年创新团队发展支持计划(W0052)。
mmp8分子量

mmp8分子量MMP8(Matrix Metalloproteinase 8)是一种分子量为50 kDa的酶,也被称为中性粒细胞弹性蛋白酶(neutrophil collagenase)。
它属于金属蛋白酶家族,参与了细胞外基质的降解和重建过程。
MMP8在炎症反应、组织修复和癌症等多个生理和病理过程中发挥重要作用。
MMP8主要由中性粒细胞产生,在炎症反应中起着重要作用。
当组织遭受损伤或感染时,中性粒细胞迁移到受损区域,并释放MMP8来降解受损的组织。
MMP8主要作用于胶原蛋白,能够切割胶原纤维,从而促进细胞外基质的降解。
这种降解作用有助于清除受损组织,并为新组织的修复提供空间。
除了在炎症反应中的作用外,MMP8在组织修复过程中也起着重要作用。
当组织受损后,MMP8能够调控细胞外基质的降解和重建过程。
在组织修复初期,MMP8通过降解受损的组织,为新的细胞定位和迁移提供通道。
随后,MMP8促进新生血管的形成和新的细胞外基质的合成,从而促进组织的修复和再生。
除了在炎症和组织修复中的作用外,MMP8还与癌症的发展和转移密切相关。
一些研究发现,MMP8能够促进肿瘤细胞的侵袭和转移。
MMP8可以降解肿瘤周围的细胞外基质,破坏正常的组织结构,从而为肿瘤细胞的侵袭和转移提供条件。
此外,MMP8还能够促进肿瘤血管的新生,为肿瘤的生长和转移提供营养和氧气。
尽管MMP8在多个生理和病理过程中发挥重要作用,但它的活性和表达水平需要严格调控。
过高或过低的MMP8活性都可能导致炎症、组织破坏或肿瘤的发展。
因此,了解MMP8的调控机制对于炎症治疗、组织修复和癌症治疗具有重要意义。
MMP8作为一种分子量为50 kDa的酶,在炎症反应、组织修复和癌症等多个生理和病理过程中发挥着重要作用。
它通过降解组织和调控细胞外基质的降解和重建过程,参与了这些过程的调控和实施。
深入研究MMP8的功能和调控机制,有助于我们更好地理解炎症、组织修复和癌症等疾病的发生和发展机制,并为相关疾病的治疗提供新的策略和靶点。
弹性蛋白酶(猪胰)性状及用途

弹性蛋白酶(猪胰)性状及用途
货号:E8210
规格:1g
保存:-20℃
CAS号:39445-21-1
级别:BioChemika
活力:≥30units/mg
干燥失重:≤8.0%
灼烧残渣:≤2.0%
不稳定状态:<PH3.5
溶解性:200mM Tris HCl buffer,pH8.8(1mg/ml)。
活力定义:20分钟水解1毫克刚果红-弹性蛋白所需要的酶量为一个活力单位。
性状:白色针状结晶或微黄色冻干粉末。
分子量25000(胰)。
溶于水,是一种以分解不溶性弹性蛋白为特征的广谱蛋白水解酶,它可由动物胰脏提取或由微生物发酵制得。
由动物胰脏提取纯化的弹性蛋白酶是一种肽链内切酶,含240个氨基酸残基,等电点PI9.5,最佳PH8.1-8.8,于4-6℃,PH5-10酶活可维持几天,冻干粉在5℃以下可保存6-12个月,遇强酸即失活,能催化弹性蛋白肽酶或中性氨基酸形成的其他肽键的水解。
用途:生化研究。
微生物弹性蛋白酶与胰弹性蛋白酶一样,具有较广的水解特性,不但能降解弹性蛋白,而且对酪蛋白、明胶、血纤维蛋白、血红蛋白、白蛋白等多种蛋白质都能分解,是一种广谱的肽链内切酶。
此酶能增加脂蛋白酶活性,具有A脂蛋白酶的作用,能阻止胆固醇在体内合成并促其转化为胆酸。
多肽在皮肤中的水解酶

在皮肤中,多肽的水解酶是一种蛋白质分解酶,主要作用是分解和代谢多肽。
这种酶有助于保持皮肤的健康和功能。
具体来说,多肽在皮肤中的水解酶有如下几种:
1. 弹性蛋白酶:它主要负责分解弹性蛋白,这种蛋白是皮肤中的重要组成部分,有助于保持皮肤的弹性和紧致度。
2. 胶原蛋白酶:胶原蛋白酶负责分解胶原蛋白,这种蛋白是皮肤的主要结构成分,对于维持皮肤的弹性和饱满度至关重要。
3. 角蛋白酶:角蛋白酶主要分解角蛋白,这是一种在皮肤表面形成的蛋白质,对于皮肤的屏障功能和保护作用具有重要作用。
这些酶的正常运作对于维持皮肤的健康和功能至关重要。
如果这些酶的活性受到干扰或不足,可能会导致皮肤问题,如干燥、粗糙、弹性丧失等。
因此,保持这些酶的活性对于维护皮肤的健康至关重要。
弹性酶肠溶片

参考文献
[1]弹性酶肠溶片使用参考说明书. (常州生化千红制药 有限公司) [2]弹性酶临床应用进展. (10):50-51 陈植. 中级医刊,19疗效观察. 张荣江,吴晓 辉,王湛,等. 中国医师杂志,2000,2(10):633-634
[4]胰弹性酶治疗高脂血症的临床观察. 杨高韵. 湖南医 药杂志,1983,1:15-17 [5]弹性酶与脂必妥对糖尿病高脂血症及微量蛋白尿的疗 效观察. 朱永福,赵淑珍,李 新. 中西医结合实用临床急 救,1999,6(5):214-215
◆有文献报道了应用弹性酶治疗高脂 血症179例的临床疗效,并与脂必妥进行了 对比观察。治疗组 179 例,口服弹性酶 300 单位 / 次,每日 3 次;对照组 50 例,口服脂 必妥 1.05g/ 次,每日 3 次。疗程均为 3 个月。 结果显示,弹性酶降低血脂的疗效优于脂 必妥,二者差异有显著性( P<0.01 ),且 弹性酶尚有治疗脂肪肝、保护肾脏功能的 作用。
◆弹性酶增加脂蛋白脂肪酶(LPL) 活性,且具有脂蛋白酶的作用,降低TG, 促进TC的分解和代谢,阻止胆固醇在动 脉壁沉积;还可直接参与调节和改善动 脉壁和结缔组织中弹性蛋白的代谢,维 持肾血管壁正常弹性,这些是其他降脂 药所不具备的;
◆在抑制肾小球基底膜增厚的同 时,还使血浆中内皮素明显降低,减 少血管收缩因子内皮素 Ⅰ 的分泌,扩 张血管,降低肾血流阻力,减少尿蛋 白丢失。因此,在血压和血糖稳定控 制状态时,弹性酶具有抑制糖尿病进 展的作用。
[6]透明质酸酶及弹性酶联合治疗冠心病及高脂血症 的临床观察. 周毅刚,舒坤贤,龙苏,等. 中国医师杂 志,2001年增刊:221-222 [7]弹性酶和胰激肽释放酶对糖尿病肾病的疗效观察. 尹建梅,张善春,张丽华. 新医学,1998,29(5):251 -252 [8]弹性酶治疗早期糖尿病肾病. 张俊清,郑家玑, 高妍,等. 中国临床药理学杂志,1998,14(4):193- 196 [9]弹性酶逆转颈动脉粥样硬化疗效观察. 王孟琼, 徐庆,黄静. 四川医学,2001,22(2):136-137
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
13.4.2.3酶制剂的工业提取法
(一)发酵液的预处理及过滤 微生物发酵液的分离,过滤,发酵液中加絮凝剂
或凝固剂 。絮凝剂有聚丙烯酰胺、右旋糖酐和聚谷 氨酸 。 (二)酶液的脱色
活性炭、脱色树脂 。 (三)盐析法
用得最多的是(NH4)2SO4,在常温下不会造成 酶的失活,若分级沉淀应用得当,杂蛋白杂质也较少。
(四)有机溶剂法 有机溶剂沉淀蛋白质的能力为丙酮>异丙醇>乙
醇>甲醇 。工业上通常采用乙醇作为沉淀剂。 (五)喷雾干燥直接制备粉末酶制剂
喷雾干燥用于干燥菌体,药用酶常用冷冻干燥。
13.4.2.4、酶的纯化
评价纯化工艺主要看二个指标,一是酶比活,二是总活 力回收。
酶在纯化过程中的一些技术难点:
(一)杂质的除去
菌种是工业发酵生产酶制剂的重要条件。与增加品 种、缩短生产周期、改进发酵和提炼工艺条件等密切 相关。
优良菌种的获得有三条途径:
①是从自然界分离筛选:
②是用物理或化学方法处理、诱变;
③是用基因重组与细胞融合技术。因此微生物的分离 筛选是一切工作的基础。
13.4.1.3微生物酶制剂生产的发酵技术
首先要合理选择培养方法、培养基、培养温度、 pH和通气量等。还要研究酶的分离提纯技术和制备 工艺。
(5)如用动物组织作原料,则此动物宰杀后应立即 取材。
从动物或植物中提取酶受到原料的限制,随着酶 应用日益广泛和需求量的增加,工业生产的重点已 逐渐转向微生物。用微生物发酵法生产药用酶,不 受季节、气候和地域的限制,生产周期短,产量高, 成本低,能大规模生产。
13.4.1.2微生物酶制剂高产菌株的选育
2、液体培养法
液体培养法是利用液体培养进行微生物的生长繁 殖和产酶。根据通气(供氧)方法的不同,又分为液 体表面培养和液体深层培养两种。
3、影响酶产生的一些因素
菌种的产酶性能是决定发酵效果的重要因素,但 是发酵工艺条件对产酶的影响也是十分明显的。
(1)温度 一般发酵温度比种子培养时略高些,这 样对产酶有利。
用核酸酶,将核酸降解成核苷酸,使粘度下降便 于离心分离。
用核酸沉淀剂如三甲基十六烷基溴化铵、硫酸 链霉素、聚乙烯亚胺、鱼精蛋白和二氯化锰等。
13.4.2酶类药物的提取和纯化 13.4.2.1生物材料的预处理 (一)动物材料的预处理
1、机械处理 用绞肉机绞,一般细胞并不破碎 。有的酶必须细胞
破碎后才能有效地提取,在实验室常用的是玻璃匀浆 器和组织捣碎器。
2、反复冻融 冷到-10℃左右,再缓慢溶解至室温,如此反复多
次。由于细胞中冰晶的形成,及剩下液体中盐浓度 的增高,能使细胞中颗粒及整个细胞破碎,从而使 某些酶释放出来。
酶提取液中,除所需酶外,还含有大量的杂蛋白、 多糖、脂类和核酸等 。
(1)pH和加热沉淀法
(2)蛋白质表面变性法 利用蛋白质表面变性性质的 差别,也可除去杂蛋白,加入氯仿和乙醇进行震荡, 可以除去杂蛋白。
(3)选择性变性法 利用蛋白质稳定性的不同,除去杂蛋白。
甚至可用2.5%三氯乙酸处理。 (4)核酸沉淀剂法
(二)微生物的预处理
要是酶是胞外酶,则可除去菌体后再直接从发酵 液中吸附提取酶。但对胞内酶则需将菌体细胞破壁, 制成无细胞的悬液后再行提取。
菌体用生理盐水洗涤除去培养基后,应深冻保存。
干燥法,因为干燥常能导致细胞自溶,增加酶的 释放,从而在后处理中破壁不必太剧烈就能达到预期 目的。
1、干燥法: ①空气干燥 25~30℃ ②真空干燥 还 原剂作保护剂 ③冷冻干燥对较敏感的酶宜 用此法。
(—)原料
利用微生物生产酶制剂的主要原料为碳源和氮源, 此外还有无机盐、生长因素和产酶促进剂等。
如果添加少量某种物质就能明显增加酶的产量时, 这类物质通称为产酶促进剂。它们大多属于酶的诱导 物或表面活性剂。
1、固体培养法
固体培养法亦称麸曲培养法 ,该法是利用麸皮 或米糠为主要原料,另外视需要添加其它谷糠、豆饼 等,加水拌成含水适度的半固态物料作为培养基 。
(2)pH 可用糖或淀粉 。氧必须是溶解 于培养基中的氧 。
(4)搅拌 增加液体湍流速度 ,减少气泡周围液 膜厚度 。有利于促进细胞的新陈代谢。
(5)泡沫和消沫剂 由于培养基中蛋白质分子排 在气泡表面形成一层吸附膜,聚集成泡沫层之故 。
(6)添加诱导剂和抑制剂 诱导酶诱导酶的合成, 诱导酶是该酶作用底物或者是其类似物。抑制剂 促进酶的形成 。加入适量表面活性剂 。
13.4 酶类药物
13.4.1 酶类药物的原料来源 13.4.1.1原料选择
选用原料应注意以下几点: (1)不同酶的用料选择:
(2)注意不同生长发育情况及营养状况, 用微生 物制酶,故需测其活力来决定取酶阶段。用动物器官 提取酶,则与动物年龄及饲养条件有关。
(3)从原料来源是否丰富考虑;
(4)从简化提纯步骤着手
2、机械法:常用的方法有研磨法,组织匀浆法, 超声波法,高压匀浆法等。
3、酶法处理
用得最多的是溶菌酶,如在37℃,pH8.0下对小 球菌进行破壁处理,历时15分钟,即可提取核酸酶。 也有用脱氧核糖核酸酶处理,操作与溶菌酶同。
13.4.2.2酶的提取
1、水溶液法
常用稀盐溶液或缓冲液提取。一般在低温下操作。 在酸性条件下稳定的酶要在酸性条件下提取。一般来 说,碱性蛋白酶用酸性溶液提取,酸性蛋白酶用碱性 溶液提取。
3、丙酮粉
组织经丙酮迅速脱水干燥制成丙酮粉,不仅可减 少酶的变性,同时因细胞结构成份的破碎使蛋白质与 脂质结合的某些化学键打开,促使某些结合酶释放到 溶液中,常用的方法是将组织糜或匀浆悬浮于 0.0lmol/L,pH6.5的磷酸缓冲液中,在0℃下一边搅 拌,一边徐徐倒入10倍体积的-15℃无水丙酮内,10 分钟后,离心过滤取其沉淀物,反复用冷丙酮洗几次, 真空干燥即得丙酮粉。丙酮粉在低温下可保存数年。
盐浓度一般以等渗为好,相当于0.15mol/L NaCl的离子强度是最适宜于酶的提取。
2、有机溶剂法
某些结合酶如微粒体和线粒体膜的酶,由于和脂 质牢固结合,为此必须除去结合的脂质,且不能使酶 变性,最常用的有机溶剂是丁醇。
3、表面活性剂法
表面活性剂能与蛋白质结含而分散在溶液中,故 可用于提取结合酶。
