EMSA操作方法(原核表达纯化蛋白)
凝胶迁移实验(EMSA)实验方法

凝胶迁移实验(EMSA)实验方法凝胶迁移实验有称凝胶阻滞实验或电泳迁移率实验(EMSA,electrophoretic mobility shift assay),是一种用于蛋白与核算相互作用的技术。
最初是用于转录因子与启动子相互作用的验证性实验,也可应用与蛋白-DNA、蛋白-RNA互作研究。
一、实验原理EMSA主要基于蛋白-探针复合物在在凝胶电泳过程中迁移较慢的原理。
根据实验设计特异性和非特异性探针,当核酸探针与样本蛋白混合孵育时,样本中可以与核酸探针结合的蛋白质与探针形成蛋白-探针复合物;这种复合物由于分子量大,在进行聚丙烯酰胺凝胶电泳时迁移较慢,而没有结合蛋白的探针则较快;孵育的样本在进行聚丙烯酰胺凝胶电泳并转膜后,蛋白-探针复合物会在膜靠前的位置形成一条带,说明有蛋白与目标探针发送互作。
二、实验操作步骤1、实验前准备(1)合理的实验方案根据研究目的合理设计特异性探针实验组以及非特异性探针对照组,如有必要还可以添加特异性抗体组、特异性核酸竞争组等。
(2)样本制备可以选择提取样本的总蛋白、核蛋白或者使用纯化好的目的蛋白。
对样本蛋白进行定量,实验中等量加入蛋白。
(3)探针制备根据实验要求设计不同的探针并添加标记,可以合成核酸后自行添加,部分已知蛋白有商业化的抗体也可以直接购买。
现在大多数实验室已经不再使用放射性标记,生物素使用相对较多。
2、形成蛋白-探针复合物(1)在0.5ml离心管中按顺序将下列组份混匀:(2)冰浴5min后,加入1μ探针。
(对照组加1ul对照探针)(3)PCR仪中室温(20-23℃)温育30min。
3、制备凝胶,电泳(1)制备6.5%非变性聚丙烯酰胺凝胶:(注意根据试剂情况按比例调整总体积)(2)按标准步骤制备凝胶。
(3)加样前先在预冷的0.5X TBE buffer中120V预电泳10min,与电泳完毕后冲洗加样孔。
(4)混合样本及电泳缓冲液,点样电泳。
(5)将电泳槽置于冰上或者4℃环境中,恒压100V进行电泳,直至缓冲液指示带距离凝胶底部2~3cm为止。
emsa实验

emsa实验
EMSA实验是基于DNA结合蛋白与DNA的特异性结合,依据实验需要,设计标记探针、非标记探针、蛋白特异性抗体等参照物。
通过电泳迁移率的变化来进行定性和定量分析,钟鼎生物提供的EMSA实验(凝胶/电泳迁移率实验)基于生物素标记探针与对应的DNA结合蛋白的特异性结合,设计合理、科学的实验方案,为客户提供验证性的EMSA,竞争性的EMSA以及超迁移EMSA(Super-shift EMSA)实验服务。
1、细胞核蛋白或纯化的转录因子,部分实验亦可使用重组表达的蛋白,依据实验设计每张膜至少提供50ul,浓度大于0.5mg/ml。
2、探针序列,如无探针序列,请提供DNA结合蛋白相关信息或相关文献,便于钟鼎生物技术人员设计探针。
3、结合蛋白特异性抗体50ul以上,浓度大于0.5mg/ml。
凝胶迁移阻滞实验(EMSA)实验操作方法及注意事项

凝胶迁移阻滞实验(EMSA)实验操作方法及注意事项凝胶迁移阻滞实验(EMSA)转载丁香园大神的帖子!非常详细!EMSA实验技术作为一个经典的DNA/protein,RNA/protein的检测技术,不是很多简单的实验技术可以替代的! EMSA试验技术的独特性和复杂性决定了,要想做成功EMSA试验,拿到阳性结果可总结为一句话: 把握整体,注意细节!EMSA的整体性包括6大点:探针制备(设计,合成,标记,纯化,退火);个人实验设计(时间剃度浓度查阅文献等);核蛋白制备;浓度测定;EMSA 操作;实验时竞争设计. 这六大点都是会直接影响到EMSA试验的成功与否!简介:EMSA ( Electrophoretic Mobility Shift Assay ) 凝胶迁移实验是一种研究DNA与蛋白质或RNA与蛋白质相互作用的常用技术。
这项技术是基于DNA/蛋白质或RNA/蛋白质复合体在聚丙烯酰胺凝胶电泳(PAGE)中有不同迁移率的原理。
当核转录因子与一条人工合成的特异的DNA或RNA结合后,其在PAGE中的迁移率将小于未结合核蛋白转录因子的DNA,从而检测到活化的与DNA或RNA结合的蛋白转录或调节因子。
发展:从发展史来看,这项实验技术起初是用32P同位素标记人工合成的寡核苷酸形成探针,但是由于同位素的放射性很强,而且半衰期为14天,所以从定购到标记再到做完试验,必须14天完成,种种制约因素导致现代科技发展非同位素EMSA试验技术,这就出现了地高辛标记为探针的非放射EMSA实验技术.在实践中没多久,地高辛标记为探针的非放射EMSA实验技术就暴露了一个严重的缺陷,标记的探真纯化后灵敏度弱,导致实验结果的信号不行,最终就出现了现在的生物素标记探真的EMSA实验技术.配合化学发光技术良好的解决了灵敏度的问题,到目前为止, 生物素标记探真的EMSA实验技术广为应用!EMSA试验成功的关键因素:1.1.试验设计,主要是你用药品刺激细胞时,设计的药品浓度和时间剃度的问题,这个很关键,很多同学不注意这一点,最后试验确实是拿不到阳性结果,比如我一前一个朋友用药物处理SGC7901细胞,就是因为时间点设计的不好EMSA试验结果是阴性的,后来根据自己药品刺激的特性重新设计了刺激时间剃度,最终得到阳性结果! 所以这个设计很关键给一个个人的实验总结希望能帮助大家:一是受体结合类的直接刺激激活信号通路的方法,一般达到EMSA核转运高峰的时间比较短,大概控制在30min-2h之间,很多时候都是在45min和1h达到高峰,当然还有合适的浓度二是是你用的是药物刺激产生受体可能时间会长一些,因为药物还有一个渗透和刺激产生细胞因子的过程.时间可以长一些,主要根据自己的药物刺激特性确定时间点.2.核蛋白样品的制备;制备蛋白样品的关键是:1.注意用专用的和核蛋白抽提试剂来做,才能使制备的核蛋白保持蛋白原有的天然活性和构像.2.掌握好核蛋白的浓度和纯度,尤其是浓度. 能入核的蛋白本来就不是很多,所以核蛋白的浓度往往不会很高,但是EMSA试验对核蛋白的浓度要求还是听高的! 一般要求在1ug/ul以上!有时候稍微低于这个数量级也可以,但是不能太低,否则影响结合反应拿不到结果. 这就要求核蛋白抽提尽量避免核蛋白的损失.同时,一般制备核蛋白的材料为细胞和组织, 细胞要比组织好做的多,最重要的是用细胞得到核蛋白的纯度比组织要高很多. 而组织抽提后杂蛋白相对较多!杂蛋白多会影响试验结果不容易得到EMSA阳性结果!!3.探针的制备:又很多站友都在问我生物素标记到3’端还是5’端,其实我觉得最好还是两端都标记,这样才能更好的提高灵敏度, 国内的标记技术我还不是很了解,我们这边的探真都是国外定做的,还算可以,其制作程序如下: 合成寡核苷酸---标记生物素---纯化---退火合成双链.也是一个比较复杂的过程.4.EMSA实验技术. 这一点主要是操作的细节问题! 下面会更细的谈到.技术要点:关于技术要点,我在这里只提一下关键的几点需要注意的细节操作,其他的照正常程序就可以了!1. 制胶必须是非变性PAGE凝胶,我们实验室一般用6.5%的非变性胶.制胶很重要,直接影响电泳的效果!一般控制在5分钟凝固的效果.10X TBE 1.0ml40% Acrylamide(40%聚丙烯酰胺)3.3ml50% Glycerol(50%甘油)1.0mldH2O(蒸馏水)14.8mlTEMED(四甲基乙二氨)20μl脱气10min10% AP(过硫酸氨)120μl总量20.0ml2. 一般试剂盒包括的试剂l 10X Binding Buffer(10X 结合反应液)(-20 oC)l Poly (dI:dC) (dI:dC)(聚核苷酸竞争物)(-20 oC)l 6X Loading Buffer(10X 上样缓冲液)(4 oC)l Cold oligonucleotides(非标记竞争性寡核苷酸)(-20 oC)l Biotin-Labeled Probe(生物素标记探针)(-20 oC)l Streptavidin-HRP(链霉亲核素-HRP)(4oC)l 2×Blocking Buffer(2×封闭液)(4 oC)l 5×Washing Buffer(5×洗涤液)(4 oC)l Equilibration Solution(平衡液)(4 oC)l Binding-membrane(结合反应膜)(RT)3. 结合反应每次结合反应需1-5μl核蛋白(根据核蛋白浓度而定),根据不同的核提取物浓度加入核提取物用量,用双蒸蒸馏水将终体积调节到15μl (1)结合反应体系:10X 结合反应液1.5μlPoly(dI:dC)(dI:dC) 1.0μl细胞核提取物* ? μl双蒸水* ? μl混匀室温静置20 分钟生物素标记的探针0.5μl总量15μl混匀室温静置20分钟或以上。
EMSA操作说明

非放射性凝胶迁移试剂盒(EMSA)操作手册本说明书适用于产品号为SIDET001, SIDET003与SIDET004的产品VER. 3.112005年2月目录1. 简介 (3)2. 试剂盒包装清单 (3)3. 自备实验材料与仪器 (4)4. DNA/蛋白质结合反应 (4)5. 聚丙稀酰胺凝胶电泳 (5)6. 电转移 (6)7. DNA的交联固定 (6)8. 化学发光反应 (6)9. 化学发光图像显示 (7)10.常见问题 (8)11. 参考文献 (8)12.注意事项 (9)2005© Viagene,All rights reserved.1.简介EMSA ( Electrophoretic Mobility Shift Assay ) 凝胶迁移实验是一种研究DNA与蛋白质或RNA与蛋白质相互作用的常用技术。
这项技术是基于DNA/蛋白质或RNA/蛋白质复合体在聚丙烯酰胺凝胶电泳(PAGE)中有不同迁移率的原理。
当核转录因子与一条人工合成的特异的DNA或RNA结合后,其在PAGE中的迁移率将小于未结合核蛋白转录因子的DNA,从而检测到活化的与DNA或RNA结合的蛋白转录或调节因子。
本非放射性EMSA成套试剂盒是结合高灵敏度的化学致发光技术建立起来的实验系统。
与市场上的EMSA产品比较,Viagene公司的EMSA试剂盒操作更简单迅速,并可得到更好的实验效果;与同位素放射法相比Viagene公司的非放射性EMSA试剂盒解决了探针不稳定、同位素辐射等问题,并具有高灵敏度、快速获得结果、避免材料浪费等优点。
目前Viagene公司提供三套非放射性EMSA试剂盒用来检测活化的NF-KB(核转录因子-KB,Cat#; SIDET001)、STAT3(信号转导和转录激活因子3,Cat#; SIDET003)和STAT5(信号转导和转录激活因子5,Cat#; SIDET004)。
每种试剂盒均经过多次实验测试,并已优化了DNA-蛋白转录因子的结合条件。
EMSA原理简介

EMSA实验技术及方法简介实验简介凝胶迁移或电泳迁移率实验(EMSA-electrophoretic mobility shift assay)是一种研究DNA 结合蛋白和其相关的DNA结合序列相互作用的技术,可用于定性和定量分析。
这一技术最初用于研究DNA结合蛋白,目前已用于研究RNA结合蛋白和特定的RNA序列的相互作用。
通常将纯化的蛋白和细胞粗提液和32P同位素标记的DNA或RNA探针一同保温,在非变性的聚丙烯凝胶电泳上,分离复合物和非结合的探针。
DNA-复合物或RNA-复合物比非结合的探针移动得慢。
同位素标记的探针依研究的结合蛋白的不同,可是双链或者是单链。
当检测如转录调控因子一类的DNA结合蛋白,可用纯化蛋白,部分纯化蛋白,或核细胞抽提液。
在检测RNA结合蛋白时,依据目的RNA结合蛋白的位置,可用纯化或部分纯化的蛋白,也可用核或胞质细胞抽提液。
竞争实验中采用含蛋白结合序列的DNA或RNA片段和寡核苷酸片段(特异),和其它非相关的片段(非特异),来确定DNA或RNA结合蛋白的特异性。
在竞争的特异和非特异片段的存在下,依据复合物的特点和强度来确定特异结合。
凝胶迁移或电泳迁移率检测(Electrophoretic Mobility Shift Assay, EMSA)是一种检测蛋白质和DNA序列相互结合的技术,最初用于研究DNA结合蛋白和其相关的DNA结合序列相互作用,可用于定性和定量分析。
这一技术目前已用于研究RNA结合蛋白和特定的RNA 序列的相互作用。
由于很多研究的TF不具有结合的特异性,所以即使发现TF和被研究的寡核苷酸探针结合,也不表示在体内该TF不能和其它寡核苷酸结合,运用一些生物信息学软件,可以模拟表示TF与基因启动子区寡核苷酸结合的具体情况,发现TF可以和启动子区PUTATIVE 结合。
同时,由于EMSA在体外不能模拟细胞内众多生物分子的相互作用,比如,某一TF 在细胞内由于受到其它TF的协同或者修饰后才能与寡核苷酸结合的话,那么在体外是不能重现这一结果的。
凝胶迁移(EMSA)实验总结

EMSA实验总结实验原理:凝胶迁移实验(EMSA-electrophoretic mobility shift assay)是一种研究蛋白与核酸(DNA/RNA)相互作用的技术。
实验步骤:(参考碧云天化学发光法EMSA 试剂盒)1.蛋白:利用原核表达蛋白,进行纯化后测定蛋白的浓度(BSA法测定)。
4 ℃保存。
注:提取的植物总蛋白(贝博试剂盒)进行EMSA实验,蛋白易滞留在点样孔,具体原因尚不明确。
2.探针:合成biotin标记的探针、未标记的探针、突变探针(需要HPLC纯化)。
注:合成单链探针,使用时1:1混合,利用PCR仪合成双链探针。
具体步骤:探针根据使用浓度用DEPC水稀释,正链:反链 = 1:1 ,PCR程序:75 ℃30 min,以后每个循环降低0.1 ℃,直到0 ℃。
3.6 % EMSA非变性胶:制胶前需要把制胶模具清洗干净,不能有SDS残留。
一块胶的用量(6 mL),不用制浓缩胶。
5 × TBE 1 mL30 % acrylamide/bisacrylamide 2 mL40 % 甘油 625 μLO 3.125 mLdd H210 % 过硫酸铵 150μLTEMED 5 Μl4.EMSA结合反应:(20 µl反应体系,蛋白和探针根据实验需求和预实验进行调整)阴性对照反应:Nuclease-Free Water add to 20 µlEMSA/Gel-Shift 结合缓冲液(5X) 4µl标记好的探针样品反应:Nuclease-Free Water add to 20 µlEMSA/Gel-Shift 结合缓冲液(5X) 4µl细胞核蛋白或纯化的转录因子标记好的探针探针冷竞争反应:Nuclease-Free Water add to 20 µlEMSA/Gel-Shift 结合缓冲液(5X) 4µl细胞核蛋白或纯化的转录因子未标记的探针标记好的探针突变探针的冷竞争反应:Nuclease-Free Water add to 20 µlEMSA/Gel-Shift 结合缓冲液(5X) 4µl细胞核蛋白或纯化的转录因子未标记的突变探针标记好的探针Super-shift反应:Nuclease-Free Water add to 20 µlEMSA/Gel-Shift 结合缓冲液(5X) 4µl细胞核蛋白或纯化的转录因子目的蛋白特异抗体标记好的探针在加入标记好的探针前先混匀,并且室温(20-25ºC)放置10分钟,从而消除可能发生的探针和蛋白的非特异性结合,或者让冷探针优先反应。
emsa方法

emsa方法
哎呀,咱今儿个就来唠唠 emsa 方法。
这 emsa 方法啊,就像是一个神奇的魔法棒,能在生物学的世界里变出好多奇妙的东西呢!
你想想看,它就像一个超级侦探,能帮我们找到那些隐藏在细胞里的秘密。
它能让我们看到蛋白质和核酸之间的互动,就好像在看一场精彩的舞台剧,蛋白质和核酸就是舞台上的主角,它们在那里演绎着各种故事。
咱就说,要是没有 emsa 方法,我们怎么能知道这些分子之间有着这么多有趣的关系呢?这就好比你不知道你的好朋友心里在想啥,那多无趣呀!emsa 方法就帮我们打开了这扇了解分子世界的大门。
它操作起来也挺有意思的。
要准备各种试剂啦,要设置合适的条件啦,就跟做饭似的,得把握好各种调料的比例,火候也得恰到好处,不然可就做不出美味的菜肴啦。
做 emsa 实验也是一样,每个步骤都得精心对待,稍有疏忽可能就看不到想要的结果咯。
而且啊,这 emsa 方法还特别灵敏呢!一点点小小的变化都能被它察觉到。
就像一个超级敏锐的小雷达,任何风吹草动都逃不过它的法眼。
你说它是不是很厉害?它能让我们更深入地了解生命的奥秘,为生物学的研究提供重要的支持。
有了它,我们对疾病的发生机制、药物的作用原理等等都能有更清楚的认识。
咱再想想,如果没有 emsa 方法,那些科学家们得走多少弯路呀!它就像一盏明灯,照亮了我们在生物学道路上前行的方向。
所以啊,可别小瞧了这 emsa 方法。
它虽然看起来不起眼,但在生物学的领域里可是有着举足轻重的地位呢!它就像一个默默奉献的幕后英雄,为我们解开一个又一个的谜题。
你说,它是不是值得我们好好去研究和利用呢?我觉得那是必须的呀!。
EMSA原理简介

EMSA实验技术及方法简介实验简介凝胶迁移或电泳迁移率实验(EMSA-electrophoretic mobility shift assay)是一种研究DNA 结合蛋白和其相关的DNA结合序列相互作用的技术,可用于定性和定量分析。
这一技术最初用于研究DNA结合蛋白,目前已用于研究RNA结合蛋白和特定的RNA序列的相互作用。
通常将纯化的蛋白和细胞粗提液和32P同位素标记的DNA或RNA探针一同保温,在非变性的聚丙烯凝胶电泳上,分离复合物和非结合的探针。
DNA-复合物或RNA-复合物比非结合的探针移动得慢。
同位素标记的探针依研究的结合蛋白的不同,可是双链或者是单链。
当检测如转录调控因子一类的DNA结合蛋白,可用纯化蛋白,部分纯化蛋白,或核细胞抽提液。
在检测RNA结合蛋白时,依据目的RNA结合蛋白的位置,可用纯化或部分纯化的蛋白,也可用核或胞质细胞抽提液。
竞争实验中采用含蛋白结合序列的DNA或RNA片段和寡核苷酸片段(特异),和其它非相关的片段(非特异),来确定DNA或RNA结合蛋白的特异性。
在竞争的特异和非特异片段的存在下,依据复合物的特点和强度来确定特异结合。
凝胶迁移或电泳迁移率检测(Electrophoretic Mobility Shift Assay, EMSA)是一种检测蛋白质和DNA序列相互结合的技术,最初用于研究DNA结合蛋白和其相关的DNA结合序列相互作用,可用于定性和定量分析。
这一技术目前已用于研究RNA结合蛋白和特定的RNA 序列的相互作用。
由于很多研究的TF不具有结合的特异性,所以即使发现TF和被研究的寡核苷酸探针结合,也不表示在体内该TF不能和其它寡核苷酸结合,运用一些生物信息学软件,可以模拟表示TF与基因启动子区寡核苷酸结合的具体情况,发现TF可以和启动子区PUTATIVE 结合。
同时,由于EMSA在体外不能模拟细胞内众多生物分子的相互作用,比如,某一TF 在细胞内由于受到其它TF的协同或者修饰后才能与寡核苷酸结合的话,那么在体外是不能重现这一结果的。
EMSA原理和方法

凝胶迁移或电泳迁移率检测(Electrophoretic Mobility Shift Assay, EMSA)是一种检测蛋白质和DNA序列相互结合的技术,最初用于研究DNA结合蛋白和其相关的DNA结合序列相互作用,可用于定性和定量分析。
这一技术目前已用于研究RNA结合蛋白和特定的RNA序列的相互作用。
由于很多研究的TF不具有结合的特异性,所以即使发现TF和被研究的寡核苷酸探针结合,也不表示在体内该TF不能和其它寡核苷酸结合,运用一些生物信息学软件,可以模拟表示TF与基因启动子区寡核苷酸结合的具体情况,发现TF可以和启动子区PUTATIVE 结合。
同时,由于EMSA在体外不能模拟细胞内众多生物分子的相互作用,比如,某一TF在细胞内由于受到其它TF的协同或者修饰后才能与寡核苷酸结合的话,那么在体外是不能重现这一结果的。
03 年上一篇关于ChIP方法的介绍文献攻击EMSA 没有考虑细胞内完整自然的染色质结构和调节的影响而受到很大的限制!下面是在一个PROTOCAL1.探针的标记:(1) 如下设置探针标记的反应体系:待标记探针(1.75pmol/微升) 2微升T4 Polynucleotide Kinase Buffer (10X) 1微升Nuclease-Free Water 5微升[γ-32P]A TP(3,000Ci/mmol at 10mCi/ml) 1微升T4 Polynucleotide Kinase (5-10u/微升) 1微升总体积10微升按照上述反应体系依次加入各种试剂,加入同位素后,V ortex混匀,再加入T4 Polynucleotide Kinase,混匀。
(2) 使用水浴或PCR仪,37℃反应10分钟。
(3) 加入1微升探针标记终止液,混匀,终止探针标记反应。
(4) 再加入89微升TE,混匀。
此时可以取少量探针用于检测标记的效率。
通常标记的效率在30%以上,即总放射性的30%以上标记到了探针上。
EMSA操作方法(原核表达纯化蛋白)

三、凝胶滞留试验(EMSA)凝胶迁移滞留试验(electrophoretic mobility shift assays,EMSA)是研究核酸与蛋白质相互作用简单、快速、敏感的方法,目前已经成为转录因子研究的经典方法,并且用于研究RNA结合蛋白和特定的RNA序列的相互作用。
其基本原理是蛋白质可以与末端标记的核酸探针结合,电泳时这种复合物比无蛋白结合的自由探针在凝胶中泳动的速度慢,即表现为相对滞后。
(一)转录因子-标签融合蛋白和标签蛋白的原核表达纯化以GST标签为例。
裂解液:25mM pH7.8Tris-HCl、100mM NaCl、2 mM NaEDTA、1mM DTT和21×Complete Protease InhibitorCocktail。
洗脱液:50 mMpH7.8Tris-HCl、200mM NaCl、1mM DTT、0.02%(v/v)Triton X-100和10 mM还原性谷胱甘肽。
EDTA、1mM DTT和1×Complete 透析液:25mM pH8.0 Tris-HCl、1mM Na2Protease InhibitorCocktail。
1将转化了pGEX-4T-2载体或者pGEX-4T-2-目的基因重组载体的BL21大肠杆菌在5 mL含100 μg mL-1氨苄青霉素的LB培养液中37℃、200 rpm震荡培养12 h。
2 取1 mL菌液加入100 mL 含100 μg mL-1氨苄青霉素的LB培养液中,37℃、200 rpm震荡培养至OD600为0.5左右。
3 加入IPTG至终浓度为0.5 mM,28℃、200 rpm培养6 h。
4 冰上放置10 min,4℃、3000×g离心15 min,收集菌体并称重。
5 每克菌体加入3 mL裂解液,重悬菌体,加入溶菌酶至终浓度为0.5 mgmL-1,在冰上温和地搅动菌液30 min。
6 超声波破碎30 s(破碎10 s停10 s)。
EMSA说明书

非放射性凝胶迁移试剂盒(EMSA)操作手册 本说明书适用于产品号为SIDET001, SIDET003与SIDET004的产品目录号 产品名称 包装SIDET001非放射性 NF-KB EMSA36 次结合反应SIDET003非放射性 STAT3 EMSA36 次结合反应SIDET004非放射性 STAT5 EMSA36 次结合反应VER. 3.112005年2月目 录1. 简介 (3)2. 试剂盒包装清单 (3)3. 自备实验材料与仪器 (4)4. DNA/蛋白质结合反应 (4)5. 聚丙稀酰胺凝胶电泳 (5)6. 电转移 (6)7. DNA的交联固定 (6)8. 化学发光反应 (6)9. 化学发光图像显示 (7)10.常见问题 (8)11. 参考文献 (8)12.注意事项 (9)2005© Viagene,All rights reserved.1.简介EMSA ( Electrophoretic Mobility Shift Assay ) 凝胶迁移实验是一种研究DNA与蛋白质或RNA与蛋白质相互作用的常用技术。
这项技术是基于DNA/蛋白质或RNA/蛋白质复合体在聚丙烯酰胺凝胶电泳(PAGE)中有不同迁移率的原理。
当核转录因子与一条人工合成的特异的DNA或RNA结合后,其在PAGE中的迁移率将小于未结合核蛋白转录因子的DNA,从而检测到活化的与DNA或RNA结合的蛋白转录或调节因子。
Viagene公司的非放射性EMSA成套试剂盒是结合高灵敏度的化学致发光技术建立起来的实验系统。
与市场上的EMSA产品比较,Viagene公司的EMSA试剂盒操作更简单迅速,并可得到更好的实验效果;与同位素放射法相比Viagene公司的非放射性EMSA试剂盒解决了探针不稳定、同位素辐射等问题,并具有高灵敏度、快速获得结果、避免材料浪费等优点。
目前Viagene公司提供三套非放射性EMSA试剂盒用来检测活化的NF-KB(核转录因子-KB,Cat#; SIDET001)、STAT3(信号转导和转录激活因子3,Cat#; SIDET003)和STAT5(信号转导和转录激活因子5,Cat#; SIDET004)。
EMSA原理简介

EMSA实验技术及方法简介实验简介凝胶迁移或电泳迁移率实验(EMSA-electrophoretic mobility shift assay)是一种研究DNA 结合蛋白和其相关的DNA结合序列相互作用的技术,可用于定性和定量分析。
这一技术最初用于研究DNA结合蛋白,目前已用于研究RNA结合蛋白和特定的RNA序列的相互作用。
通常将纯化的蛋白和细胞粗提液和32P同位素标记的DNA或RNA探针一同保温,在非变性的聚丙烯凝胶电泳上,分离复合物和非结合的探针。
DNA-复合物或RNA-复合物比非结合的探针移动得慢。
同位素标记的探针依研究的结合蛋白的不同,可是双链或者是单链。
当检测如转录调控因子一类的DNA结合蛋白,可用纯化蛋白,部分纯化蛋白,或核细胞抽提液。
在检测RNA结合蛋白时,依据目的RNA结合蛋白的位置,可用纯化或部分纯化的蛋白,也可用核或胞质细胞抽提液。
竞争实验中采用含蛋白结合序列的DNA或RNA片段和寡核苷酸片段(特异),和其它非相关的片段(非特异),来确定DNA或RNA结合蛋白的特异性。
在竞争的特异和非特异片段的存在下,依据复合物的特点和强度来确定特异结合。
凝胶迁移或电泳迁移率检测(Electrophoretic Mobility Shift Assay, EMSA)是一种检测蛋白质和DNA序列相互结合的技术,最初用于研究DNA结合蛋白和其相关的DNA结合序列相互作用,可用于定性和定量分析。
这一技术目前已用于研究RNA结合蛋白和特定的RNA 序列的相互作用。
由于很多研究的TF不具有结合的特异性,所以即使发现TF和被研究的寡核苷酸探针结合,也不表示在体内该TF不能和其它寡核苷酸结合,运用一些生物信息学软件,可以模拟表示TF与基因启动子区寡核苷酸结合的具体情况,发现TF可以和启动子区PUTATIVE 结合。
同时,由于EMSA在体外不能模拟细胞内众多生物分子的相互作用,比如,某一TF 在细胞内由于受到其它TF的协同或者修饰后才能与寡核苷酸结合的话,那么在体外是不能重现这一结果的。
EMSA原理和方法

EMSA原理和方法EMSA(Electrophoretic Mobility Shift Assay,电泳迁移位移分析)是一种常用的分析DNA结合蛋白与DNA结合的技术。
它可以通过观察DNA是否与蛋白结合来研究蛋白与DNA的相互作用。
EMSA方法具有操作简便、成本低廉、结果可靠等优点,因此被广泛应用于生物医学、遗传学以及分子生物学等领域。
EMSA基于DNA与蛋白质所生成的复合物的电泳迁移速度与DNA的游离状态不同的原理。
DNA与蛋白质结合后形成的复合物较大,迁移速度较慢,而游离状态的DNA则迁移速度较快。
通过将待测的DNA与蛋白反应,将形成的DNA-蛋白复合物与游离状态的DNA物理上分离,然后经过聚丙烯酰胺凝胶电泳,进一步观察蛋白与DNA结合的结果。
EMSA方法步骤:1.准备工作:制备DNA探针和蛋白样品。
DNA探针可以是标记有放射性核素或融合具有染色剂/荧光信号的探针。
蛋白样品可以是纯化的蛋白或细胞提取物等。
2.反应:将DNA探针与蛋白样品一起孵育,使其发生结合反应。
孵育条件可以根据实验需要进行调节,如温度、时间和缓冲液组分等。
3.分离:将反应体系进行电泳分离。
一般来说,使用聚丙烯酰胺凝胶作为电泳介质,并在缓冲液中加入电解质以产生电场。
根据DNA与蛋白复合物的大小不同,可以调整电泳条件以实现适当的分辨率。
4.可视化:根据标记方式的不同,可以采用相应的方法进行检测。
对于放射性标记的DNA探针,可以使用放射自显影或闪烁计数方法来观察。
而对于使用染料或荧光标记的DNA探针,则可以使用紫外线照射或荧光成像等方式进行可视化。
EMSA应用:1.鉴定和验证DNA-蛋白相互作用:通过EMSA可以迅速判断DNA与特定蛋白是否发生结合,从而推断该蛋白是否与一些基因或DNA序列相关联。
2.研究DNA结合蛋白的特性:EMSA可以帮助研究DNA结合蛋白的亲和性、特异性以及结合位点等特性。
3.研究信号转导通路:EMSA可以用于检测信号转导通路中的激活因子与DNA的结合情况,从而了解这些激活因子在信号转导过程中的作用。
(完整版)EMSA实验流程

1、细胞核蛋白抽提细胞:1.1 在EP管中准备单细胞混悬液1.2 进行4度,500g离心后去上清 (离心后细胞体积不得超过250 ul)。
1.3 加入150 ul NucBuster Reagent 1 /50 ul 细胞体积(按照细胞体积进行试剂比例调整),重悬细胞(1.5 ml 离心管)。
1.4 震荡混匀15秒,冰上静置5分钟(重复两次)。
1.5 进行 4度16000g 离心后去上清(上清为细胞质组分)。
1.6(可选细胞质清洗步骤)加入500 ul 预冷PBS缓冲液重悬、离心、去上清。
1.7 每50ul细胞体积,按比例加入预先混合的(1ul 复合蛋白抑制酶(100X),1ul 100mM DTT 以及75 ul NucBuster Extraction Reagent 2),进行重悬。
1.8 震荡15秒,冰上静置 5分钟(重复两次)。
1.9 进行4度16000g离心后,将上清转移至新的1.5ml离心管(此上清为细胞核组分)。
此上清可立即用于EMSA实验,或分装后存放于-80度。
组织:1.1 用液氮将组织磨碎,将组织收集到EP管中,根据组织体积按比例加入NucBuster Reagent 1试剂,利用枪头重悬组织。
1.2 震荡混匀15秒,冰上静置5分钟(重复两次)。
1.3 进行 4度16000g 离心后去上清。
1.4 下同细胞部分的1.3-1.92、探针合成与标记2.1 正反配对并包含转录因子结合位点的两条生物素标记的引物进行退火反应,得到25 uM (未标记)或 1 uM (标记)终浓度双链引物,-20度保存备用。
使用NEB2 buffer,在PCR仪或者加热块上进行,98度5分钟,逐渐冷却至室温即可。
3、4-6% 非变性EMSA胶(0.5 X TBE)配置注意事项:必须采用非变性胶(即不能加入SDS等变性试剂),并需采用TBE 缓冲液。
凝胶配置详见凝胶试剂盒说明书。
4、EMSA结合反应注意事项:按照上述顺序依次加入各种试剂,在加入热探针前先混匀,避免剧烈震荡,并且室温放置10分钟,从而消除可能发生的探针与蛋白的非特异性结合,并且让冷探针优先反应,然后加入热探针(或对应抗体),混匀,室温放置20分钟。
凝胶迁移实验(EMSA)实验方法

凝胶迁移实验(EMSA)实验方法凝胶迁移实验有称凝胶阻滞实验或电泳迁移率实验(EMSA,electrophoretic mobility shift assay),是一种用于蛋白与核算相互作用的技术。
最初是用于转录因子与启动子相互作用的验证性实验,也可应用与蛋白-DNA、蛋白—RNA互作研究。
一、实验原理EMSA主要基于蛋白—探针复合物在在凝胶电泳过程中迁移较慢的原理.根据实验设计特异性和非特异性探针,当核酸探针与样本蛋白混合孵育时,样本中可以与核酸探针结合的蛋白质与探针形成蛋白-探针复合物;这种复合物由于分子量大,在进行聚丙烯酰胺凝胶电泳时迁移较慢,而没有结合蛋白的探针则较快;孵育的样本在进行聚丙烯酰胺凝胶电泳并转膜后,蛋白—探针复合物会在膜靠前的位置形成一条带,说明有蛋白与目标探针发送互作.二、实验操作步骤1、实验前准备(1)合理的实验方案根据研究目的合理设计特异性探针实验组以及非特异性探针对照组,如有必要还可以添加特异性抗体组、特异性核酸竞争组等。
(2)样本制备可以选择提取样本的总蛋白、核蛋白或者使用纯化好的目的蛋白。
对样本蛋白进行定量,实验中等量加入蛋白.(3)探针制备根据实验要求设计不同的探针并添加标记,可以合成核酸后自行添加,部分已知蛋白有商业化的抗体也可以直接购买。
现在大多数实验室已经不再使用放射性标记,生物素使用相对较多。
2、形成蛋白—探针复合物(1)在0。
5ml离心管中按顺序将下列组份混匀:(2)冰浴5min后,加入1μ探针。
(对照组加1ul对照探针)(3)PCR仪中室温(20—23℃)温育30min。
3、制备凝胶,电泳(1)制备6.5%非变性聚丙烯酰胺凝胶:(注意根据试剂情况按比例调整总体积)(2)按标准步骤制备凝胶.(3)加样前先在预冷的0。
5X TBE buffer中120V预电泳10min,与电泳完毕后冲洗加样孔。
(4)混合样本及电泳缓冲液,点样电泳。
(5)将电泳槽置于冰上或者4℃环境中,恒压100V进行电泳,直至缓冲液指示带距离凝胶底部2~3cm为止。
EMSA 操作说明
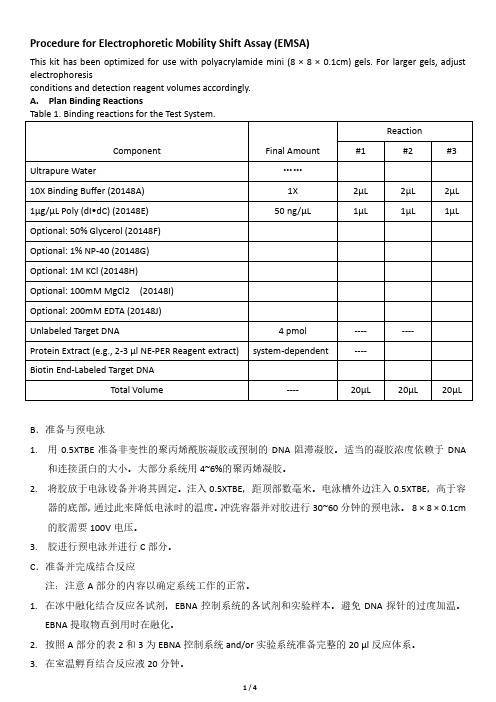
Procedure for Electrophoretic Mobility Shift Assay (EMSA)This kit has been optimized for use with polyacrylamide mini (8 × 8 × 0.1cm) gels. For larger gels, adjust electrophoresisconditions and detection reagent volumes accordingly.A. Plan Binding ReactionsB.准备与预电泳1.用0.5XTBE准备非变性的聚丙烯酰胺凝胶或预制的DNA阻滞凝胶。
适当的凝胶浓度依赖于DNA和连接蛋白的大小。
大部分系统用4~6%的聚丙烯凝胶。
2.将胶放于电泳设备并将其固定。
注入0.5XTBE,距顶部数毫米。
电泳槽外边注入0.5XTBE,高于容器的底部,通过此来降低电泳时的温度。
冲洗容器并对胶进行30~60分钟的预电泳。
8 × 8 × 0.1cm 的胶需要100V电压。
3.胶进行预电泳并进行C部分。
C.准备并完成结合反应注:注意A部分的内容以确定系统工作的正常。
1.在冰中融化结合反应各试剂,EBNA控制系统的各试剂和实验样本。
避免DNA探针的过度加温。
EBNA提取物直到用时在融化。
2.按照A部分的表2和3为EBNA控制系统and/or实验系统准备完整的20 µl反应体系。
3.在室温孵育结合反应液20分钟。
4.每个20 µl反应体系中添加5 µl的5X Loading Buffer,并吹打数分钟以充分混匀。
不能涡旋或剧烈混合。
D.电泳移动结合反应1.却断凝胶电泳的电源;2.冲洗,每样本加入20 µl到凝胶上;3.开启电流(set to 100 V for 8 × 8 × 0.1cm gel),电泳样本直到溴酚蓝跑过凝胶总长度的2/3到3/4时。
EMSA原理简介

EMSA原理简介emsa实验技术及方法简介实验导论凝胶迁移或电泳迁移率实验(emsa-electrophoreticmobilityshiftassay)是一种研究dna结合蛋白和其相关的dna结合序列相互作用的技术,可用于定性和定量分析。
这一技术最初用于研究dna结合蛋白,目前已用于研究rna结合蛋白和特定的rna序列的相互作用。
通常将纯化的蛋白和细胞粗提液和32p同位素标记的dna或rna探针一同保温,在非变性的聚丙烯凝胶电泳上,分离复合物和非结合的探针。
dna-复合物或rna-复合物比非结合的探针移动得慢。
同位素标记的探针依研究的结合蛋白的不同,可是双链或者是单链。
当检测,如转录调控因子一类的dna结合蛋白,可用纯化蛋白,部分纯化蛋白,或核细胞抽提液。
在检测rna结合蛋白时,依据目的rna结合蛋白的位置,可用纯化或部分纯化的蛋白,也可用核或胞质细胞抽提液。
竞争实验中采用含蛋白结合序列的dna或rna片段和寡核苷酸片段(特异),和其它非相关的片段(非特异),来确定dna或rna结合蛋白的特异性。
在竞争的特异和非特异片段的存在下,依据复合物的特点和强度来确定特异结合。
凝胶迁移或电泳迁移率转移分析(电泳迁移率转移分析,EMSA)是一种检测蛋白质和DNA序列结合的技术。
它最初用于研究DNA结合蛋白与其相关DNA结合序列之间的相互作用,可用于定性和定量分析。
该技术已被用于研究RNA结合蛋白与特定RNA序列之间的相互作用。
由于很多研究的tf不具有结合的特异性,所以即使发现tf和被研究的寡核苷酸探针结合,也不表示在体内该tf不能和其它寡核苷酸结合,运用一些生物信息学软件,可以模拟表示tf与基因启动子区寡核苷酸结合的具体情况,发现tf可以和启动子区putative 结合。
同时,EMSA不能在体外模拟细胞内许多生物分子的相互作用,例如TF细胞内由于受到其它tf的协同或者修饰后才能与寡核苷酸结合的话,那么在体外是不能重现这一结果的。
EMSA的具体实验方法

1.探针的标记:(1) 如下设置探针标记的反应体系:待标记探针(1.75pmol/微升)2微升T4 Polynucleotide Kinase Buffer (10X)微升Nuclease-Free Water 5 微升[-32P]ATP(3,000Ci/mmol at 10mCi/ml) 1 微升T4 Polynucleotide Kinase (5-10u 微升)1 微升总体积10微升按照上述反应体系依次加入各种试剂,加入同位素后,Vortex混匀,再加入T4PolynucleotideKinasq 混匀。
(2) 使用水浴或PCR仪,37 C反应10分钟。
(3) 加入1微升探针标记终止液,混匀,终止探针标记反应。
(4) 再加入89微升TE,混匀。
此时可以取少量探针用于检测标记的效率。
通常标记的效率在30%以上,即总放射性的30%以上标记到了探针上。
为实验简便起见,通常不必测定探针的标记效率。
(5) 标记好的探针最好立即使用,最长使用时间一般不宜超过3天。
标记好的探针可以保存在-20 C。
2。
.探针的纯化:通常为实验简便起见,可以不必纯化标记好的探针。
在有些时候,纯化后的探针会改善EMSA的电泳结果。
如需纯化,可以按照如下步骤操作:(1) 对于100微升标记好的探针,加入体积即25微升的5M醋酸铉,再加入2体积即200微升的无水乙醇,混匀。
⑵在-70C至-80C沉淀1小时,或在-20C沉淀过夜。
⑶在4C, 12,000g-16,000g离心30分钟。
小心去除上清,切不可触及沉。
⑷在4C, 12,000g-16,000g离心1分钟。
小心吸去残余液体。
微晾干沉淀,但不宜过分干燥。
(5)加入100微升TE,完全溶解沉淀。
标记好的探针最好立即使用,最长使用时间一般不宜超过3天。
标记好的探针可以保存在-20C。
3。
EMSA胶的配制:(1) 准备好倒胶的模具。
可以使用常规的灌制蛋白电泳胶的模具,或其它适当的模具。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
三、凝胶滞留试验(EMSA)凝胶迁移滞留试验(electrophoretic mobility shift assays,EMSA)是研究核酸与蛋白质相互作用简单、快速、敏感的方法,目前已经成为转录因子研究的经典方法,并且用于研究RNA结合蛋白和特定的RNA序列的相互作用。
其基本原理是蛋白质可以与末端标记的核酸探针结合,电泳时这种复合物比无蛋白结合的自由探针在凝胶中泳动的速度慢,即表现为相对滞后。
(一)转录因子-标签融合蛋白和标签蛋白的原核表达纯化以GST标签为例。
裂解液:25mM pH7.8Tris-HCl、100mM NaCl、2 mM NaEDTA、1mM DTT和21×Complete Protease InhibitorCocktail。
洗脱液:50 mMpH7.8Tris-HCl、200mM NaCl、1mM DTT、0.02%(v/v)Triton X-100和10 mM还原性谷胱甘肽。
EDTA、1mM DTT和1×Complete 透析液:25mM pH8.0 Tris-HCl、1mM Na2Protease InhibitorCocktail。
1将转化了pGEX-4T-2载体或者pGEX-4T-2-目的基因重组载体的BL21大肠杆菌在5 mL含100 µg mL-1氨苄青霉素的LB培养液中37℃、200 rpm震荡培养12 h。
2 取1 mL菌液加入100 mL 含100 µg mL-1氨苄青霉素的LB培养液中,37℃、200 rpm震荡培养至OD600为0.5左右。
3 加入IPTG至终浓度为0.5 mM,28℃、200 rpm培养6 h。
4 冰上放置10 min,4℃、3000×g离心15 min,收集菌体并称重。
5 每克菌体加入3 mL裂解液,重悬菌体,加入溶菌酶至终浓度为0.5 mgmL-1,在冰上温和地搅动菌液30 min。
6 超声波破碎30 s(破碎10 s停10 s)。
7 4℃、12000×g离心30 min,上清液用0.45µm滤膜过滤,向滤液中加入5 M NaCl,使NaCl的浓度为200 mM。
8 去掉Glutathione Sepharose 4 Fast Flow中的储存液,用5倍树脂体积的裂解液清洗树脂。
9 待裂解液流到树脂上沿以下时,加入已过滤的菌体裂解液。
流出液再过一次树脂,收集流穿液。
10 用5倍树脂体积的裂解液清洗树脂,收集洗涤液并置于冰上。
11 用5倍树脂体积的洗脱液洗脱目的蛋白,收集目的蛋洗脱液置于冰上。
12 洗脱结束后,用5倍树脂体积的裂解液清洗树脂,收集清洗液置于冰上。
13 用5倍树脂体积的双蒸水洗涤树脂,树脂保存于3倍体积的20%(v/v)乙醇中。
14 通过SDS-PAGE电泳分析流穿液、洗涤液、目的蛋洗脱液和清洗液中出现的目的蛋白。
15 用截留分子量不大于目的蛋白分子量1/3的超滤管超滤纯化目的蛋白,并加入透析液继续超滤至合适的体积,转移到1.5 mL离心管中,-20℃保存。
(二)蛋白质浓度的BCA法测定用Thermo Fisher公司生产的BCA蛋白定量分析试剂盒测量蛋白质溶液的浓度。
1用透析液稀释2000 µg mL-1标准蛋白质溶液,得到浓度分别为0、25、125、250、500、750、1000、1500、2000 µg mL-1 的标准蛋白质溶液。
2A液与B液按50:1的体积混匀,得到WR液。
3将200 µL WR液分别与25µL不同浓度的标准蛋白质溶液混匀,封口,37℃温育30min。
4冷却至室温后测量562nm波长的吸光值,测3次,取平均值。
做出标准曲线。
5将25µL待测蛋白质溶液加到200 µL WR液中,混匀,封口,37℃温育30min。
6冷却至室温后测量562nm波长的吸光值,测3次,取平均值。
根据标准曲线得出待测蛋白质溶液中的蛋白质浓度。
(三)转录因子直接结合DNA的EMSA验证用Thermo Scientific公司生产的Chemiluminescent Nucleic AcidDetection Module检测生物素标记探针。
1配制6%非变性PAGE凝胶:1800 µL双蒸水、3500 µL 1×TBE缓冲液(50 mMEDTA)、1400 µL 30%(w/v)Acr/Bis(29:1)、219 µL 80% Tris-硼酸和2 mM Na2(v/v)甘油、52.5 µL 10%(w/v)APS和3.5 µL TEMED。
EDTA、600 mM KCl、2配制4×结合缓冲液:200 mM pH 8.0Tris-HCl、4 mM Na24 mM DTT;3配制结合反应液:5 µL 4×结合缓冲液、1 µL poly(dI·dC)、5 µg纯化蛋白和0.1 pM生物素标记探针,用双蒸水补至20 µL。
竞争反应加入相应量的非标记探针。
室温下放置1 h。
4小型垂直电泳槽放置在冰中,将结合反应液加入6%非变性PAGE凝胶的进样孔中,在0.5×TBE缓冲液中100 V电压电泳60 min。
5剪出与凝胶大小相当的尼龙膜和滤纸(4张),将尼龙膜和滤纸在0.5×TBE 中浸泡10 min以上。
6在半干转膜仪中加入0.5×TBE,依次铺上2层滤纸、尼龙膜、凝胶、2层滤纸,每层之间不能有气泡。
500 mA电转1 h。
7移走滤纸将尼龙膜取出,在超净台紫外灯下约10 cm处紫外交联10 min。
8 从冰箱取出Blocking Buffer和4×Wash buffer,置37 ℃烘箱,使白色沉淀溶解。
9 将尼龙膜放在5 mL Blocking Buffer中,轻微振荡15 min。
10将16.7 μL Stabilized Streptavidin-Horseradish Peroxidase Conjugate加到5 mL Blocking Buffer中(1:300稀释)配制Conjugate/Blocking Buffer。
倒出Blocking Buffer,加入Conjugate/Blocking buffer,轻微振荡15 min。
11 用4×Wash buffer加纯水配制40 mL 1×Wash buffer。
12 将膜移动到新容器中,用10 mL 1×Wash buffer洗涤尼龙膜4次,每次5 min,轻微振荡。
13 将膜移动到新容器中,加入10 mL Substrate Equilibration Buffer,轻微振荡5 min。
14 将结合膜取出放置到滤纸上,吸掉水分,再放到新的滤纸上。
15 在暗室中将Luminol/Enhancer Solution和Stable Peroxide Solution 等体积混合配制Substrate Working Solution,将Substrate Working Solution 加到尼龙膜上。
16用保鲜膜覆盖尼龙膜,放上X-感光片,曝光,显影,拍照。
蛋白原核表达及激酶活性测定吴赴清提供一、蛋白原核表达(一)载体选择1、蛋白表达的载体系统很多,常用的有pET系统(有his-tag),pGEX-4T-1(GST tag),pMAL系统(MBP tag)。
2、由于pET系统标签小,纯化洗脱都比较方便,因此一般首选这个系统;如果pET表达困难,可以考虑用pGEX-4T-1和pMAL系统,GST标签与MBP标签一方面都可以增加蛋白的可溶性,另一方面也利于增加难表达蛋白的表达水平。
二者的区别是某些情况下,pMAL系统表达复杂结构蛋白能力更强些,但MBP融合蛋白不容易从树脂上洗脱下来。
(二)表达菌株表达菌株使用最多的是BL21(DE3),另外对某些表达特别困难的蛋白也可以选用由这个菌株优化的新菌株,如rostta(DE3), BL21(DE3)plysS等。
(三)融合蛋白表达纯化1、His蛋白表达纯化(1)测序正确的质粒转化BL21(DE3)感受态细胞,涂板后培养8-16h。
(2)挑取3单菌落接种于5ml LB培养基中,37℃摇菌至OD600=0.6。
(3)取1 ml菌液保存菌种,取2ml加入IPTG使终浓度为1mM,16℃,160rpm, 16h诱导,另2 ml不加IPTG,16℃,160rpm, 16h,作未诱导对照。
(4)诱导结束后,诱导和未诱导的,各取1ml, 10000 rpm离心1min, 去上清,沉淀中加入50 µl PBS重悬,再加入50µl 2×蛋白上样缓冲液,100℃煮样5min, 10000 rpm离心5min, 得到的上清为总蛋白。
取10-20 µl 电泳检测目的蛋白表达情况。
(5)如果要检测表达的蛋白是在上清中还是在沉淀中,则按下面步骤进行:取5 ml诱导和5ml未诱导菌液,离心收集沉淀,加入300-500ul PBS重悬,超声破碎,至菌体变为澄清,12000 rpm离心5min,取50ul上清加入50ul 2×蛋白上样缓冲液; 取沉淀加入100-200ul PBS,再加入等体积2×蛋白上样缓冲液,100℃煮样5min, 10000 rpm离心5min, 取10-20 µl 电泳检测目的蛋白表达情况。
(6)融合蛋白纯化如果小量诱导发现蛋白有表达,则进行纯化,下面以1升LB为例介绍纯化过程。
1)诱导完毕后,7000rpm, 4℃,离心5min收菌。
沉淀可在-20℃保存数月。
2)用40ml 冷PBS重悬细胞沉淀, 加入蛋白酶抑制剂cocktail(Roche),和2mM DTT, 200µl Triton X-100轻微涡旋混匀。
4)超声破碎细胞,至菌体澄清,12000 rpm,4℃,离心10min,小心转移上清到一个新的50ml 离心管中。
5)取0.5-1ml Ni-NTA His•Bind树脂到结合柱中,让液体流下,加入2x5ml PBS 漂洗树脂,结束后将树脂加到4)的蛋白上清中。
6)将离心管封严平放在冰盒中,摇床上100rpm摇动结合1-2h。
7)将上述结合混合物上柱子,让溶液流出,收集树脂。
8)用3X5ml 冰中预冷的PBS漂洗树脂。
9)配制梯度咪唑溶液(100mM、200mM、300mM、400mM、500mM)放置冰中, 分别用500ul上述溶液从低浓度到高浓度依次洗脱目的蛋白。
