中药新药开制备工艺制剂研究中试
中药新药开发制备工艺的特点及工艺研究

医学信息2011年5月第24卷第5期Medical Information.May.2011.Vol.24.No.5临床医学PPI 临床应用分析钟洛梅(昆明市东川区第二人民医院,云南昆明654100)收稿日期:2011-03-20收稿日期:2011-03-20质子泵抑制剂(PPI )是临床常用药,常规用于胃食道反流病等酸相关性疾病的长期治疗。
由于PPI 高效、低毒的特点,目前已成为最常用的处方药之一,但是,笔者观察在临床中存在PPI 过度使用现象。
不断有研究证实,PPI 治病亦致病,可导致相关不良事件。
1不良反应1.1PPI 会削弱抗凝病的疗效抗凝药有抗凝、降低血脂、扩张血管、改善循环的作用,多用于治疗冠心病、心肌梗塞、支架手术、缺血性脑血管疾病。
但有数据显示某些PPI 类药物会削弱抗凝药的效果,从而增加心脏病发作或其它凝血性不良反应(如脑血管疾病)发生的风险。
1.2PPI 可使感染发生率增高PPI 过度使用可致胃酸浓度降低。
机体感染防御机制第一道防线--胃内酸环境的被破坏,使院内获得性肺炎发生率增高,同时也使肠道感染危险加倍,尤其是艰难梭菌相关性疾病发病危险。
1.3PPI 影响微量元素及维生素的吸收PPI 长期使用可使胃酸浓度降低,胃PH 值升高,可影响一些微量元素及维生素的吸收,导致一些疾病,如维生素C 吸收和生物利用度下降,导致胃内亚硝酸盐浓度上升,维生素B12和铁吸收受到影响可致贫血;钙吸收减少导致骨质疏松、骨折。
1.4PPI 可致骨骼肌不良反应多为一过性,如肌肉痉挛。
但有些可能会非常严重,甚至危及生命,如横纹肌溶解症。
1.5PPI 致酸相关性疾病①停用PPI 后,可致反跳性酸分泌增加:2009年7月份出版的美国《胃肠病学》杂志报道,PPI 治疗停药后的4周内可出现胃灼热等酸相关症状。
这是因为PPI 可致肠嗜铬样细胞处于过度分泌状态或存在增生,导致胃酸分泌增加[1]。
②PPI 高胃泌素血症:PPI 治疗期间,胃内PH 值显著升高,胃窦部G 细胞的胃泌素分泌增加。
中试经验(制药)

中试放大经验总结中间实验阶段是进一步研究在一定规模的装置中各步化学反应条件的变化规律,并解决实验室中所不能解决或发现的问题。
虽然化学反应的本质不会因实验生产的不同而改变,但各步化学反应的最佳反应工艺条件,则可能随实验规模和设备等外部条件的不同而改变。
因此,中试放大很重要。
一、实验进行到什么阶段才进行中试呢?至少要具备下列的条件:1,小试收率稳定,产品质量可靠。
2,造作条件已经确定,产品,中间体和原理的分析检验方法已确定。
3,某些设备,管道材质的耐腐蚀实验已经进行,并有所需的一般设备。
4,进行了物料衡算。
三废问题已有初步的处理方法。
5,已提出原材料的规格和单耗数量。
6,已提出安全生产的要求。
二、新药研究的最终目的:最终目的是生产出质量合格的药品,供医疗应用。
新药投入大量生产以前,必须研制出一条成熟、稳定、适合于工业生产的技术工艺路线。
研制过程分阶段进行,包括:实验研究阶段,小量试制剂段,中试生产阶段,最后才能过渡到工业生产。
各个阶段前后衔接,相互促进,任务各不相同,研究的重点也有差异,制备的规模逐渐由小变大。
新药申请注册前应完成中试生产。
下面以合成药物为例,说明各个阶段的主要任务。
1、实验室研究阶段:这是新药研究的探索阶段,目的是发现先导化合物和对先导化合物的结构修饰,找出新药苗头。
其主要任务是:合理设计化合物尽快完成这些化合物的合成;利用各种手段,确证化合物的化学结构;测定化合物的主要物理参数;了解化合物的一般性质,而对化合物的合成方法不作过多的研究。
为了制备少量的样品供药理筛选,不惜采用一切分离纯化手段,如反复分馏,多次重结晶,各种层析技术等。
显然,这样的合成方法与工业生产的距离很大。
2、小量试制阶段:新药苗头确定后,应立即进行小量试制(简称小试)研究,提供足够数量的药物供临床前评价。
其主要任务是:对实验室原有的合成路线和方法进行全面的、系统的改革。
在改革的基础上通过实验室批量合成,积累数据,提出一条基本适合于中试生产的合成工艺路线。
中药中试研究的技术要求

同时应关注变化对产品质量的影响 程度。
32
资料整理
? 提供的资料简单甚至有误 ——缺乏评价 的客观基础,导致发补,延误注册进程。
? 一般要求提供的内容: 批号、投料量、半成品量、辅料量、 成品量、成品率、可测成分转移率、半 成品和成品的质量控制和检测数据等。
中药、天然药物中试研究是指在 实验室完成系列工艺研究后,采用与生 产基本相符的条件进行工艺放大研究的 过程。
? 中试研究是小型生产模拟和放大试验。 ? 目的:实现工业化生产,并使样品质量
相对稳定、可控。
11
(一)概述 -2
? 强调了中试研究的重要意义
? 中试研究是对实验室工艺合理性的验 证与完善
? 是保证工艺达到生产稳定性、可操作 性的必经环节
2、中试研究的有关问题
? 中试研究设备与生产设备的技术参数 应基本相符。
? 中试样品如用于临床研究,应当在符 合《药品生产质量管理规范》条件的 车间制备。
? 有关说明:设备、场地
19
(二)基本内容
2、中试研究的有关问题
? 由于药品剂型不同,所用生产工艺、 设备、生产车间条件、辅料、包装等都 有很大差异,因此在中试研究中要结合 剂型,特别要考虑如何适应生产的特点 开展工作。
相似点: ? 中试研究是对实验室工艺合理性的验证与完
善,是保证制剂【制法】达到生产可操作性 的必经环节。 ? 供质量标准制订、稳定性考察、药理毒理和 临床研究用样品应是经中试研究确定的工艺 制备而成。 ? 规模:制剂处方量的 10倍以上。 ? 质量控制
40
与中药新药研究的技术要求中试研究的比较
不同点: ? 增加了中试研究的定义 ? 供质量标准制订的样品 ? 增加了对工艺可行性、劳动保护、生产
浅谈中药新药临床及药学研究用样品的质量控制

浅谈中药新药临床及药学研究用样品的质量控制【关键词】中药新药;研究用样品;质量控制中药新药的临床试验及药学研究涉及多方面的内容,需进行大量的试验研究。
通过这些研究获得试验数据,以探索、了解和确认药品的安全性、有效性和质量可控性。
对研究用样品进行良好的质量控制,用质量均一的样品进行研究是正确认识药品安全性、有效性、质量可控性的前提,也有利于对试验过程中出现的问题进行分析。
笔者对目前中药新药的临床试验及药学研究用样品在质量控制方面的注意事项进行初步分析和讨论,供同行参考。
1 临床试验用样品的质量控制临床试验一般应采用生产规模的样品;对于有效成分或有效部位制成的制剂,可采用中试或中试以上规模的样品[1]。
临床试验所用样品与临床前的药效毒理研究用样品相比,药用物质基础应变化不大。
在不同分期的临床试验中,所用样品的质量原则上应基本一致,并与以后大生产样品的质量基本一致。
1.1 样品的制备1.1.1 Ⅰ期临床试验按法规要求,应进行Ⅰ期临床试验的主要有以下几种情形:①处方中含有毒性药材或无法定标准的原料;②非临床安全性试验结果出现明显毒性反应等临床安全性担忧;③有效成分制剂;④新的中药注射剂[2]。
这些新药往往缺少人用历史的参考或具有安全性担忧,需要对新药的耐受性进行探索性研究。
虽然Ⅰ期临床试验的时间较早,制剂成型等工艺的细节还有可能随着生产规模的放大而调整,但所用样品的工艺路线及关键工艺参数应与大生产一致。
1.1.2 Ⅱ期临床试验Ⅱ期临床试验用样品的生产工艺、工艺参数及制剂处方应与大生产基本一致。
为了满足Ⅱ期临床试验探索给药剂量的需要,可以制备多个规格(含生药量不同)的样品,并对多个规格的样品进行相应研究,如成型工艺研究、加速稳定性考察等。
对传统复方制剂而言,有一定的临床应用背景及中医理论指导,其剂量的确定有一定的依据。
但对于有效成分及有效部位新药而言,Ⅱ期临床试验的目的就是探索最佳给药剂量、适用人群及给药方案等,往往需要采用含药量不同的多种规格样品进行剂量探索研究。
关于中试及工艺验证要求的法规信息汇总
国家药监局:化学药品注射剂基本技术要 求(试行)
2008年1月10日
国食药监注[2006]265号:关于进一步加 强药品注册核查工作的通知
2006年6月26日
11
国家药监局:药品注册核查和生产现场检 查要点及判定原则 山东省药监局:药品注册申请自查自纠工 申报批准文号所需样品的试制应在本企业生产车间内进 作要求及标准附件1,药品注册现场核查 行;量按生产规模比例的大、中、小。 要点及判定标准 【关键词】药品注册管理办法,修订,工艺研究,中试放 大,工艺验证;初步阐述了工艺研究与验证各阶段的研 药审中心:审评四部,黄晓龙,《论坛》 究目的、内容与重要意义,从技术层面提出了如何通过 2008年2期总第20期 深入细致的研究工作来保证药品注册获得批准后能够按 照申报工艺组织生产。
输液品种和水针品种的灭菌工艺要求问题2006年1月24日中试规模样品的工艺研究的重点之一就是在gmp车间内对生产设备以及制备工艺的关键参数进行确定结合小试样品工艺研究数据通过放大的设备对生产工艺进行重现性试验确定工艺参数范围为生产规模样品的生产提供试验数据并通过此研究确定生产工艺的基本流程药审中心化学药物评价栏目
ห้องสมุดไป่ตู้
2008年5月23日 2006年11月21日 此项为核查的否决项。
2008年6月5日
该刊物应该涉及有中试放大、工 艺验证内容,但未看到全文。
12
13
14
15
中试研究是对实验室工艺合理性研究的验证与完善,是 保证制剂【制法】达到生产可操作性的必经环节。供质 量标准、稳定性、药理与毒理、临床研究用样品应是经 中试研究的成熟工艺制备的产品。中试规模应为制剂处 方量的10倍以上。中试过程中应考察工艺、设备及其性 能的适应性,加强制备工艺关键技术参数考核,修订、 完善适合生产的制备工艺。应提供至少三批中试生产数 据,包括投料量、半成品量、质量指标、辅料用量、成 品量及成品率等。提供制剂通则要求的一般质量检查、 微生物限度检查和含量测定结果。 仿制药进行质量研究和临床试验应采用中试以上规模的 样品。为了使进行质量研究和临床试验的样品具有代表 性,可以代表将来上市产品的质量,仿制药在临床前就 应对工艺放大进行充分的研究和初步的验证,以确保上 市产品与临床批样品质量一致。 中试研究是指在实验室完成系列工艺研究后,采用与大 生产基本相符的条件进行工艺放大研究的过程。中试研 究是小型生产模拟试验。 稳定性试验药物制剂的供试品应是放大试验的产品(如 片剂在10000片左右),其处方与生产工艺应与大生产 一致。
中药中试研究的技术指导原则

主 讲 人:马秀璟 讲习组成员:周跃华、金芳 药品审评中心 2005.7
一、起草背景及指导思想 二、整体结构 三、主要内容
四、有关问题的说明
五、结语
2
一、起草背景
《药品管理法》和《药品注册管理
办法》的实施
中试研究的重要性
中试研究的现实
3
一、起草背景
22Βιβλιοθήκη 中试研究的批次 一般要求
申报临床研究时,应提供至少1批稳定 的中试研究数据,包括批号、投料量、 半成品量、辅料量、成品量、成品率等。
中试研究一般需经过多批次试验,以达 到工艺稳定的目的。
关于“至少1批稳定的中试数据”和 对批次的讨论
23
中试研究规模与批次
补充申请
变更药品规格的补充申请一般不需提供中 试研究资料,但改变辅料的除外。
15
进行中试研究的前提条件
工艺路线已确定。
小试的工艺考察已完成,工艺过程及工 艺参数已确定。 如: 提取(时间、方法、 溶剂)、分离纯化、浓缩(方法、温 度)、中间体和成品的质量控制等。
小试工艺基本可行、稳定。 原料、中间体和产品的质量控制方法已 建立。 ——成熟的小试是进行中试的最主要的基 础
有关说明
“质量标准制订”:是指
在质量标准前期研究的基础上,根 据中试样品的检测结果最终确定。
制订过程中对上述内容的
有关讨论
18
(二)基本内容
2、中试研究的有关问题
中试研究设备与生产设备的技术参数 应基本相符。
中试样品如用于临床研究,应当在符 合《药品生产质量管理规范》条件的 车间制备。
关于中试及工艺验证要求

12
13
14
15
中试研究是对实验室工艺合理性研究的验证与完善,是 保证制剂【制法】达到生产可操作性的必经环节。供质 量标准、稳定性、药理与毒理、临床研究用样品应是经 中试研究的成熟工艺制备的产品。中试规模应为制剂处 方量的10倍以上。中试过程中应考察工艺、设备及其性 能的适应性,加强制备工艺关键技术参数考核,修订、 完善适合生产的制备工艺。应提供至少三批中试生产数 据,包括投料量、半成品量、质量指标、辅料用量、成 品量及成品率等。提供制剂通则要求的一般质量检查、 微生物限度检查和含量测定结果。 仿制药进行质量研究和临床试验应采用中试以上规模的 样品。为了使进行质量研究和临床试验的样品具有代表 性,可以代表将来上市产品的质量,仿制药在临床前就 应对工艺放大进行充分的研究和初步的验证,以确保上 市产品与临床批样品质量一致。 中试研究是指在实验室完成系列工艺研究后,采用与大 生产基本相符的条件进行工艺放大研究的过程。中试研 究是小型生产模拟试验。 稳定性试验药物制剂的供试品应是放大试验的产品(如 片剂在10000片左右),其处方与生产工艺应与大生产一 致。
11
【关键词】药品注册管理办法,修订,工艺研究,中试放 大,工艺验证;初步阐述了工艺研究与验证各阶段的研究 药审中心:审评四部,黄晓龙,《论坛》 目的、内容与重要意义,从技术层面提出了如何通过深 2008年2期总第20期 入细致的研究工作来保证药品注册获得批准后能够按照 申报工艺组织生产。
2008年6月5日
国家药监局:化学药品注射剂基本技术要 求(试行)
2008年1月10日
国食药监注[2006]265号:关于进一步加强 药品注册核查工作的通知
2006年6月26日
国家药监局:药品注册核查和生产现场检 2008年5月23日 查要点及判定原则 山东省药监局:药品注册申请自查自纠工 作要求及标准附件1,药品注册现场核查要 2006年11月21日 此项为核查的否决项。 点及判定标准 该刊物应该涉及有中试放大、工 艺验证内容,但未看到全文。
中药新药开31制备工艺前处理提取纯化

剂型:临床适应性、质量稳定行、生产可行性
成
方法
型
辅料的种类、用量、用法
10造Leabharlann 工艺条件3、包装选择 4、中试
内包装容器的材料、结构、形状、规格
标签设计
说明书拟订
制备临床实验用药及各种考核样品3~5批以上 考核、修改工艺 配套设备 初步核算成本
5、临床实验用药品的制备工艺(制备方法)
6、生产用制备方法
–提取药材一般粉碎成粗粉(过10目筛) –眼用粉200目 –口服100-120目
27
• 确定粉碎方法
(1)干法粉碎 混合粉碎:含糖或胶质、粘性、油性或动物的皮、肉、骨等特殊 药料的,须采用串料、串油、蒸罐等粉碎技术。 单独粉碎:贵重细料、毒性药物、树脂、树胶类药物、质地坚硬 药物、单独提取的药物等需单独粉碎。
1、处方筛选
药味 药味比例 口服剂量
9
工艺路线(根据剂型、处方、药味性质、工厂技术、设备)
2、
工
艺
筛
选
工
艺
条
件
前处理
鉴定与检验 炮制与加工
粉碎药物 粉碎程度 粉碎方法 细粉收率
提取
提取 纯化
分离 除杂 浓缩 干燥
提取药物 提取方法 提取溶媒种类、用量 提取工艺条件
方法 设备 工艺条件 半成品质量标准及收率
生产工艺的繁简、产品生产成本等
7
制备工艺研究的原则
• 中医药特色原则 –保存各药的药性(与功能主治相关的成分) –实现君药的特性(质量控制指标) –临床需要之剂型 –功能与主治为主线贯穿研究过程
• 时代特色原则 –新技术、新工艺、新辅料、新设备、新剂型 –评价指标和评价方法现代化和综合化
中药新药质量标准的研究及常见问题分析

吗啡含量(%) 材 麻黄碱总量(g)
麻黄碱含量(%)
吗啡总量(g) 半 吗啡含量(%)
8.5164 0.141
吗啡转移率(%) 成 麻黄碱总量(g)
54.00 38.5352
麻黄碱含量(%) 品 麻黄碱转移率(%)
0.638 57.84
常见问题与案例分析
****0305 8.86
15.7708 0.178 66.6272 0.752 8.7145
0.145 55.26 38.5458 0.658 59.35
****0612
8.3096 0.136 52.69 36.7211 0.601 55.11
46
常见问题与案例分析
例4:胶囊剂
批号
****0605
吗啡总量(g)
8.2339
中 吗啡含量(mg/粒)
试 吗啡转移率(%) 成 麻黄碱总量(g) 品
常见问题与案例分析
批号 投料量 药材1 (kg) 药材2 成品量(粒) 成品率(%)
**** 0216 **** 0218 **** 0220
0.49
0.49
0.49
2.95
2.95
2.95
9860
9860
9880
98.6
98.6
98.8
36
例2 胶囊剂
批号
投料量(kg)
一 桑叶细粉(kg)
步 制
麻黄碱含量(mg/粒)
0.432 52.21 37.3576 1.96
麻黄碱转移率(%) 56.07
****0305 8.7145 0.442 54.09 38.793 2.01 58.22
****0612 8.3096 0.427 52.01 36.1148 1.88 54.20
中药新药研发学要点

中药新药:是在中医药理论指导下,以中药材、中药饮片、中药提取物等为原料,研制生产的未曾在中国境内外上市销售的中成药中试研究:也称中试放大,指在实验室完成系列工艺研究后,采用与生产基本相符的条件进行工艺放大研究的过程。
放大率:指工业设备的设计大小与采集数据所用的最大实验设备生产速率之间的比例关系(放大率=工业生产速率/中试工厂生产速率)物料衡算:也称物料平衡,产品或物料实际产量或实际用量及收集到的损耗之和与理论产量或理伦用量之间的比较,并考虑可允许的偏差范围中药新药的稳定性:指中药新药(原料或制剂)的化学、物理及生物学特性发生变化的程度急性毒性试验:又称为单次给药急性毒性试验,是指在24小时内一次或多次给予动物受试物后,观察所产生的毒性反应的试验长期毒性试验:又称为重复给药毒性试验,是描述动物重复接受受试药物后的毒性特征遗传毒性试验:指用于检测通过不同机制直接或间接诱导遗传学损伤的受试物的体外和体内实验生殖毒性试验:是指用于检测药物对雌性和雄性生殖系统,从生殖细胞分化至整个细胞发育,也包括对胚胎发育损害的试验致癌试验:指通过一定途径使动物在正常生命期的大部分时间内反复接触不同剂量或浓度的受试物,观察受试物对试验动物的致癌作用过敏性:又称超敏反应,指机体受同一抗原再刺激后产生的一种表现为组织损伤或生理功能紊乱的特异性免疫反应溶血性:指药物制剂引起的溶血和红细胞凝聚等反应刺激性:指非口服给药制剂给药后对给药部位产生的可逆性炎症反应依赖性:可分为躯体依赖性和精神依赖性。
躯体依赖性主要是机体对长期使用依赖性药物所产生的一种适应性状态,包括耐受性和停药后的戒断反应;精神依赖性是药物对中枢神经系统作用所产生的一种特殊的精神效应,表现为对药物的强烈渴求和强迫性觅药行为临床试验:是指任何以人类为对象的试验、研究不良事件:指临床试验受试者接受试验用药品后出现的所有不良医学事件严重不良事件:指因使用任何剂量的试验用药品发生的、任何引起人体损害的不利医学事件1.中药新药研发学的任务(1)研制临床急需的中药新药,满足医疗卫生的需要(2)研制市场广阔的中药新药,契合经济发展的需要(3)挖掘传统中医药宝库,实现振兴民族医药产业的需要2.中药新药研究的基本构架(1)选题立项(2)临床前研究1)药学研究①原料前处理研究②提取纯化工艺研究③制剂工艺研究④中试研究⑤质量标准研究⑥稳定性研究2)药理研究①主要药效学研究②一般药理学研究③药物代谢动力学研究3)毒理研究①急性毒性试验②长期毒性试验③特殊毒性试验(遗传毒性、生殖毒性、致癌)④其他安全性试验(过敏性、溶血性、刺激性、依赖性)(3)临床研究(4)申报审批(5)正式生产3.中药、天然药物的注册分类(1)未在国内上市销售的从植物、动物、矿物等物质中提取的有效成分及其制剂(2)新发现的药材及其制剂(3)新的中药材代用品(4)药材新的药用部位及其制剂(5)未在国内上市销售的从植物、动物、矿物等物质中提取的有效部位及其制剂(6)未在国内上市销售的中药、天然药物复方制剂(7)改变国内已上市销售中药、天然药物给药途径的制剂(8)改变国内已上市销售中药、天然药物剂型的制剂(9)已有国家标准的中药、天然药物其中1-8的品种为新药,9的品种为已有国家标准的药品4.注册分类第6类又包括11)传统中药复方制剂22)现代中药复方制剂33)天然药物复方制剂44)中药、天然药物和化学药品组成的复方制剂5.申报资料项目(1)综述资料(2)药学研究资料(3)药理毒理研究资料(4)临床试验资料6.中药新药研发的选题原则(1)科学性(2)创新型(3)可行性(4)效益性7.中药新药研发的选题方法(1)调查研究1)查阅文献2)计算机检索3)市场调查、信息咨询(2)选择课题1)传统古方与经方2)临床有效的方剂3)从常见病、多发病、疑难病入手4)从中成药中选题5)从药理、药效学试验研究方法中选题6)引进新技术、新设备,建立新疗法、新工艺8.中药新药命名的原则(1)科学简明、避免重名(2)必要、合理(3)避免暗示、夸大疗效(4)体现传统文化特色9.中药制剂工艺研究的内容及程序(1)处方筛选(处方来源、各药味间用量比例、日服剂量)(2)工艺筛选(工艺路线、工艺条件)(3)中试研究(样品制备、考察与完善工艺参数、配套设备、初步评价)(4)生产用制备方法10.中药制剂工艺路线选择的因素(1)药物的性质(2)剂型的需要(3)新药类别的要求(4)生产可行性及成本核算的需要11.制剂中间体制备工艺条件研究的原则(1)系统性(2)一致性(3)规范化12.制剂成型工艺设计应考虑的问题(1)成型工艺路线的选择与制剂处方设计的关系(2)成型工艺与生产设备间的适应性(3)成型工艺研究与制剂质量13.中药、天然药物的申报资料项目表符号说明(1)“+”表示必须报送的资料(2)“-”表示可以免报的资料(3)“土”表示可以用文献综述代替实验研究的资料(4)“▲”表示具有法定标准的中药材、天然药物可以不提供,否则必须提供(5)“*”表示按照申报资料项目说明和申报资料具体要求14.中药新药设计的思维方法(八字纲领)(1)“理”与,,法”(2)“方”与“药”(3)“剂”与“工”(4)“质”与“效”在中药新药的设计与研制过程中,从选题、设计到试验研究及最后整理资料,均应以病症为目标,以“理”“法”为理论指导,以“方”“药”为核心,以制备工艺为主体,以质控、药理为指标,以临床疗效为目的,进行整套的设计与试验研究,最后具体的生产过程要按中药生产的GMP严格管理,才能生产出优质高效的中药新药,才能为防止疾病提供更多更好的武器,为人类造福。
副本关于中试及工艺验证要求
出处
中药、天然药物中试研究的技术指导原则
时间
2005年3月
备注
2
药审中心“咨询问答”栏目:化学药物研 究和评价药学问题(四)
2006年7月7日
3
药审中心“共性问题”栏目:输液品种和 水针品种的灭菌工艺要求问题 药审中心“化学药物评价”栏目:审评三 部魏农农,药品制备工艺研究和工艺验证 的再次认识
2006年1月24日
中药新药制备工艺研究的技术要求
药审中心:审评三部霍秀敏,《论坛》 2008年2期总第20期,从注册角度浅谈如 何提高仿制药质量 药审中心:马秀璟,中药、天然药物中试 研究中应关注的有关问题 2005版《中国药典》二部:药物稳定性试 验指导原则
2008年6月5日
2004年8月
2005年7月
4
2008年7月9日
5
药审中心“化学药物评价”栏目:审评三 部魏农农,药品制备工艺研究和工艺验证 的再次认识 药审中心“化学药物评价”栏目:审评三 部魏农农,药品制备工艺研究和工艺验证 的再次认识
2008年7月9日
6
2008年7月9日
7
8
9 10
所选择的制剂制备工艺应当经过验证。验证包括工艺研 究阶段的验证及放大生产阶段对工艺的验证。工艺研究 阶段的验证是通过对多批样品制备过程的分析,以及对 制剂中间产品及终产品质量的分析,对工艺过程本身是 否稳定,是否易于控制进行验证和评价。放大生产阶段 对工艺的验证主要是考察所采用的制备工艺在规模化生 产时的可行性,对工艺是否适合工业化生产进行验证和 评价。应至少在确定的工艺条件下制备三批中试规模以 上的产品,对其制备过程的工艺控制进行评价,并对产 品的质量及质量均一性进行评价。中试生产的设备应与 大生产一致。实际生产中若采用的工艺设备与中试规模 不同,应重新进行工艺验证。 对申请注册新药时申报批准文号或者申请注册已有国家 药品标准的,应核查其样品试制是否在该生产企业用于 批量生产的实际设备完成,样品试制量是否与该品种经 过验证的实际批生产能力相适应,3批样品的试制量是 否分别为该品种已验证生产能力的最大量、半数量、最 临床试验用样品和申报批准文号的样品的生产条件是否 符合《药品化学药品注射剂基本技术要 求(试行)
中药复方制剂生产工艺研究技术指导原则(试行)

附件中药复方制剂生产工艺研究技术指导原则(试行)一、概述本指导原则主要用于指导申请人开展以中药饮片为原料的中药复方制剂生产工艺研究。
申请人应在中医药理论指导下,根据临床用药需求、处方组成、药物性质及剂型特点,尊重传统用药经验,结合现代技术与生产实际进行必要的研究,以明确工艺路线和具体工艺参数,做到工艺合理、可行、药品质量均一稳定可控,保障药品的安全、有效。
本指导原则涉及以下内容:前处理研究、提取纯化与浓缩干燥研究、成型研究、包装选择研究、中试研究、商业规模生产研究、工艺验证等。
由于中药复方组成复杂、化学成份众多以及存在多靶点作用等特点;不同处方药味组成不同,相同的药味针对不同的适应症和临床需求,可能需要采用不同的处理工艺;制剂制备工艺、技术与方法繁多,新技术与新方法不断涌现;不同的制备工艺、方法与技术所应考虑的重点,需进行研究的难点,要确定的技术参数,均有可能不同。
因此中药复方制剂生产工艺的研究既要遵循中医药理论,尊重传统用药经验,又要遵循药品研究的一般规律,利用现代研究成果,在分析处方组成和各药味之间的关系、各药味所含成份的理化性质和药理作用的基础上,结合制剂工艺和生产实际、环保节能等要求,综合应用相关学科的知识,采用合理的试验设计和评价指标,开展相关研究。
鼓励采用符合产品特点的新技术、新方法、新辅料。
二、基本原则及要求(一)尊重传统用药经验中药复方制剂的研究是基于中医药对生命、健康、疾病的认识,是以既往古籍及现代文献记载以及实际临床应用过程中的研究探索和数据积累为基础的。
中药复方制剂工艺研究应遵循中医药理论,尊重传统用药经验。
因此前期的文献研究工作越系统、深入,临床应用中积累的数据越充分,越能更好地把握研究的核心和重点。
(二)质量源于设计中药复方制剂研究应基于“质量源于设计”的理念。
中药复方制剂工艺研究初期就应以临床价值为导向,在了解药物配伍、临床应用等情况的基础上,设计工艺路线和药物剂型,通过试验研究,理解产品的关键质量属性和量质传递,确定关键工艺参数;根据物料性质、工艺条件等,建立能满足产品质量设计要求且工艺稳健的设计空间,如确定工艺参数控制范围等,并根据设计空间,开展质量风险管理,确立质量控制策略和药品质量标准体系。
传统中药新药制备工艺与质量研究的要求

• 剂型选择依据
• 文献、试验 • 剂型对药物成分、作用的影响
• 一、制剂处方设计: • 考虑方面--半成品性质、剂型、给药途径、
临床要求 • 目的--为制剂成型而确立辅料种类、用量 • 考察--辅料选择的依据
• 二、制剂成型工艺: • 药物+辅料=剂型 • 成型方法、设备、技术参数、药品内包
装
• (3)临床应用确有疗效,有明显的优势与特色。
• (4)功能主治应当与古代医籍记载一致。
• (5)功能主治适应症范围不属于急重症,不属于孕 妇、儿童等特殊人群用药。
• (6)处方中不含毒性药材或配伍禁忌,不含有濒危 野生动植物。
• (7)处方中药材均应有法定标准,且用量不超过法 定标准的推荐量。
此类中药复方制剂的注册申请,可不提供非 临床药效学试验资料及临床试验资料,但需 提供非临床安全性研究资料,并直接申报生 产。
• ②天然药物复方制剂应当提供多组份药效、 毒理相互影响的试验资料及文献资料;
③处方中如果含有无法定标准的药用物质,还应当 参照相应注册分类中的要求提供相关的申报资料;
④中药、天然药物和化学药品组成的复方制剂中的 药用物质必需具有法定标准,申报临床时应当提 供中药、天然药物和化学药品间药效、毒理相互 影响(增效、减毒或互补作用)的比较性研究试 验资料及文献资料,以及中药、天然药物对化学 药品生物利用度影响的试验资料;申报生产时应 当通过临床试验证明其组方的必要性,并提供中 药、天然药物对化学药品人体生物利用度影响的 试验资料。处方中含有的化学药品(单方或复方) 必须被国家药品标准收载。
• 要求: • 深入性、严谨性、科学性
• 规范性、真实性、重复性
• 6.1中药复方制剂; • 6.2天然药物复方制剂; • 6.3中药、天然药物和化学药品组成
中药新药开32制备工艺制剂研究中试
处方 1
2
3
4
5
6
7
8
9
10 11 12
号
17 18
• 药物性质
–化学性质:光热稳定性、pH、分解、氧化(紫草萘醌) –物理性质:溶解性(水飞蓟素)、挥发性(冰片) –生物学性质:药代参数、生物膜通透性、治疗窗 –日服用量:颗粒剂、合剂含药量多;胶囊、片;分散
片、口崩片含药量少
18 19
• 药物安全性
–增效的同时要保证安全(如固体分散技术) –胃肠道刺激药物可制成肠溶制剂 –急重症注射剂疗效明显的同时关注安全性(班蝥) –毒性成分宜制成缓释制剂,改善峰谷现象 –改剂、改途径也要注意安全性
给药方法 注射剂、贴膏剂(巴布膏剂、橡胶膏剂)、气雾 剂、喷雾剂、搽剂、洗剂、涂膜剂、栓剂等
处方组成 糖浆剂、酒剂、酊剂等
制法 煎膏剂、滴丸剂、流浸膏、浸膏剂、露剂等
其它 胶剂、锭剂、茶剂等
34
剂型范围:根据研究和发展的实际情况调整
剂型
实例
丸剂 微丸不作为独立剂型;滴丸剂作为独立剂型
散剂 片剂
定义中增加“提取物”(散剂系指药材或药材提取物 经粉碎、混合制成的粉末状制剂)
– 药膏:又称油膏。主要以植物油、蜂蜡或其他适宜的物质为基质,加入药 物,经加热后,提取药物有效成分。或不经加热,将药物研成细粉或极细 粉混匀。
• 丹药:系指用汞及某些矿物类药物,在高温条件下经烧炼制成不同结 晶形状的无机化合物。
78
• 灸剂:系将艾叶捣、碾成绒状,或另加其他药料捻制成卷烟状或其他 形状,供熏灼穴位等患部的外用剂型。
与合理性,并作剂型对比。
22 22
剂型案例
• 治疗牙痛选口胶 • 水溶性成分选分散片 • 含苦味、腥味药材的片剂改含片 • 颗粒剂改胶囊,15粒/次 • 药材原粉制成分散片、滴丸、含片 • 一品种同时申报胃溶及肠溶(酸不稳定成分)制剂 • 口腔溃疡泡腾片(冰硼贴片)
中药新制剂的研究中制备工艺路线的选择应体现 科学性 合理性 可行性 重现性

1.中药新制剂的研究中制备工艺路线的选择应体现科学性合理性可行性重现性。
2.中药新制剂工艺条件最常用的筛选方法是正交试验法。
3.下列处方之际的命名属于主要药材加功能并结合剂型命名的是藿香正气口服液。
4.用薄层色谱法设计质量标准中的鉴别时,应作标准品对照标准药材对照阴性对照。
5.下列哪项不是中试研究应收集的忠实数据半数致死量。
6.些列处方制剂的命名属于处方中的药味数与主要药材名或药味数与功能结合命名九味羌活丸。
7.质量标准研究中,“含量测定”设计用高效液相色谱法,色谱柱应首选ODC(C18)。
8.质量标准研究的设计中,胶囊剂的处方形式是以1000粒计。
9.些列哪些是治疗胸痹心痛证药物的药效学试验方法抗心肌缺血性损伤试验增加心肌营养性血流量试验降低心肌耗氧量试验影响心脏功能及血流动力学的试验。
10.药物半数致死量测定最常用的试验动物是小鼠。
11.中药新制剂的稳定性研究应观察(三批)样品。
12.质量标准中“含量测定”的设计应首选君药。
13.质量标准中“检查”的拟定,应按(要点的规定)设计。
14.质量标准中“性状”的拟定至少应观察三批样品。
15.中药新制剂的研究中制备工艺的设计首先应进行药味的选择。
16.药效学研究热源研究常用动物是兔。
17.不是胸痹心痛证药效学试验方法的是抗休克。
18.重金属检查中砷盐的含量不得高于2ppm。
19.些列哪项不是工艺条件筛选最常用的评价指标化学指标。
20.些列哪项不是颗粒剂成型工艺常用辅料增塑剂。
21.些列不是注射剂成型工艺条件要求的项目是甲醛含量。
22.些列哪项不是注射剂检查的项目是澄清度。
23.形象比喻加剂型命名玉屏风散。
24.浓缩蜜丸水分不得超过15%,水蜜丸水分不得过12%。
25.下列哪种剂型不检查水分蜡丸。
26.下列哪项不是硬胶囊稳定性试验应考察的项目硬度。
27.下列哪项不是合剂(口服液)稳定性试验应考察的项目热源。
28.下列哪项不是酒剂,酊剂稳定性试验应考察的项目澄明度与相对密度。
中药中试研究的技术指导原则

为什么这样定?
1000个制剂单位:制剂单位为“粒、
片、贴、克、毫升”等。
21
中试研究的规模
不同剂型和工艺应有所区别:
适当扩大中试规模
装量大于或等于100ml的液体制剂
适当降低中试研究投料量 1、有效成分、有效部位为原料 2、 以全生药粉入药的制剂等 ——均要达到中试研究的目的;半成品 率、成品率应相对稳定
22
中试研究的批次
一般要求
申报临床研究时,应提供至少1批稳定 的中试研究数据,包括批号、投料量、 半成品量、辅料量、成品量、成品率等。
中试研究一般需经过多批次试验,以达 到工艺稳定的目的。
关于“至少1批稳定的中试数据”和 对批次的讨论
23
中试研究规模与批次
补充申请
变更药品规格的补充申请一般不需提供中 试研究资料,但改变辅料的除外。
剂型不同,工艺研究过程中的关键控制
点不同。 例:颗粒剂、口服液、注射液
27
主要考察内容
原药材、辅料要符合要求 药材、辅料有无法定标准
注意药材品种 依法检验、自建检测方法及结果是否符 合要求
28
关键工艺技术参数的考察
以小试结果为基础,结合设备,进行工 艺优化,不同工艺,质控点不同。 提取工艺:浸膏得量/率、有效成分/ 指标成分含量 分离、纯化工艺:如醇沉工艺:醇沉 浓度、药液的相对密度、温度、搅拌速度、 静置时间等,使用有机溶剂:安全性、防 爆措施、环保等 浓缩、干燥工艺:方法、 温度、时 间等 成型工艺:方法、辅料等
中试不同。
2、原回流提取、浓缩分步进行,现为
热回流抽提-浓缩机组引起的改变。
31
小试、中试工艺参数和质量的比较
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
给药途径 鼻用制剂(滴鼻剂)、眼用制剂(滴眼剂)
给药方法 注射剂、贴膏剂(巴布膏剂、橡胶膏剂)、气雾 剂、喷雾剂、搽剂、洗剂、涂膜剂、栓剂等
处方组成 糖浆剂、酒剂、酊剂等
制法 煎膏剂、滴丸剂、流浸膏、浸膏剂、露剂等
其它 胶剂、锭剂、茶剂等
4
剂型范围:根据研究和发展的实际情况调整
剂型
实例
丸剂 微丸不作为独立剂型;滴丸剂作为独立剂型
中药新药制备工艺研究 制剂研究
1
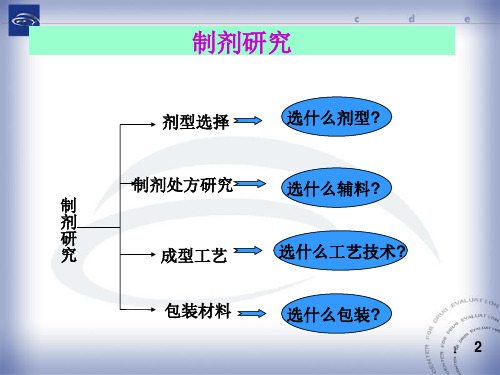
制剂研究
剂型选择
选什么剂型?
制剂处方研究
选什么辅料?
制
剂
研
究
成型工艺
选什么工艺技术?
包装材料
选什么包装?
2
剂型选择
• 剂型知识 • 选择依据 • 注意问题 • 案例分析
3
剂型知识
剂型的分类:我国采用综合分类法
分类方法
剂型实例
形态
丸剂、散剂、颗粒剂、片剂、凝胶剂、软膏剂、 合剂等
• 线剂:是将丝线或棉线置药液中先浸后煮,经干燥制成的外用制剂, 利用所含药物的轻微腐蚀作用和药线的机械扎结作用,切断痔核瘘管。
• 条剂:又称纸捻,系指将药物研细过筛,混匀后,用桑皮纸粘药膏搓 捻成细条(软膏),或用桑皮纸搓成条粘一层面糊(硬条),再粘附 药粉而成。
• 棒剂:是将药物(海螵蛸)制成棒状物直接施用于皮肤或粘膜,以起 腐蚀、收敛等作用的外用剂型。 9
现代中药剂型 (23种)
• 合剂:系指中药材经提取、浓缩而制成的内服液体剂型。 • 酊剂:系指药物用规定浓度的乙醇浸出或溶解而制成的澄清液体
剂型。 • 乳剂:系指将含挥发油或油脂的药材经提油后,加适当的乳化剂
而制成的剂型。 • 流浸膏剂:系指用适宜的溶媒浸出药材的有效成分后,蒸去部分
溶媒,调整浓度为每1ml相当于原药材1g(除另有规定外)的液体 浸出制剂。 • 浸膏剂:系指用适宜的溶媒和方法,浸出药材的有效成分后,蒸 去全部溶媒,浓缩成稠膏状或块、粉状的浸出制剂。除另有规定 外,每1g浸膏相当于原药材2~5g。
11
现代中药剂型
• 片剂:系指药物经加工压制成片状的一种剂型。
– 内服片:指经胃肠道崩解吸收而发挥疗效的片剂。 – 压制片:素片,指药物与赋形剂混合后,经加工压制而成
(不经包衣)的片剂。 – 包衣片:指压制片包有衣膜的片剂。(糖衣片、薄膜衣片等) – 长效片:含有延缓崩解物料的片剂。 – 嚼用片:指在口内嚼碎后咽下的压制片。
10
现代中药剂型
• 糖浆剂:系指含有药物、药材提取物或芳香物质的口服浓蔗糖水溶液 • 口服液:系指将中药经提取精制后,加入适宜的附加剂、防腐剂,不
经灭菌;或加入适宜的附加剂后,经灭菌制成的供口服单剂量装瓶的 液体剂型。 • 颗粒剂:系指以药材提取物与适宜辅料(或药物细粉)制成的可溶性 或混悬性制剂,分颗粒状或块状两种,供内服用。 • 硬胶囊剂:系将固体药物(亦可加辅料)填充于空硬胶囊壳中制成。 • 软胶囊剂:系将油类或对囊材无溶解作用的液体药物封闭于软质囊材 中而成的一种圆形或椭圆形剂型。 • 微囊剂:系指利用天然或合成的高分子材料(统称囊材),将药粉微 粒或药液微滴(统称囊心物)包囊成直径为1~5000μm的微小囊状物 的剂型。
8
• 灸剂:系将艾叶捣、碾成绒状,或另加其他药料捻制成卷烟状或其他 形状,供熏灼穴位等患部的外用剂型。
• 熨剂:系用铁砂,并配合一些治风寒湿痹的药物,经混合后装于布袋 (或纱布等)中,用时常以醋淬之,待发热后熨患处。
• 钉剂:系将药物细粉加糯米粉混匀后加水蒸制成软材,搓成纺锤形的 外用固体制剂,常用于治疗瘘管、溃疡性疮疡等。
• 锭剂:系指药物和细粉加适宜黏合剂制成不同形状的固体剂型。 • 茶剂:茶剂系指含茶叶(或不含茶叶)的药物经粉碎,加工制成的粗
末制品或加入适宜的黏合剂制成的方块状制。袋泡茶为新型的茶剂。 • 曲剂:系将药料与面粉混合后,在一定的温度与湿பைடு நூலகம்下经发酵制成的
内服固体制剂。如六神曲、红曲。 • 糕剂:系指药物细粉与米面、蔗糖蒸制而成的块状内服制品。 • 胶剂:系指以动物皮、骨、角、甲为原料,用水煎取胶质,浓缩成稠
胶状,经干燥制成的固体内服剂型。如阿胶。
7
• 外用膏剂:系指药材、植物油与红(黄)丹炼制而成,或以油、蜡为 基质,加入药物,经加热后,提取药物有效成分;或不经加热,将药 物研成细粉或极细粉混匀而成的外用剂型。
– 黑膏药:系指以植物油与黄丹经高温炼制而成的铅硬膏为基质,并含有药 物或中药材提取物的外用剂型。
制而成的片剂。 – 泡腾片:指含泡腾崩解物料的片剂。可供口服和外用。 – 多层片:指片剂各层含有不同赋形剂组成的颗粒或不同的药物经压
12
– 口含片:指含于口腔内缓缓溶解的压制片,能对口腔及咽喉等局部 产生较持久的药效,用于局部的消炎、消毒等。
– 舌下片:指置于舌下使用的压制片,能在舌下唾液中溶解后被粘膜 吸收,起速效作用。
– 外用片:指阴道片和专供配制外用溶液的压制片。 – 微囊片:指固体或液体药物利用微囊化工艺制成干燥的粉粒,经压
制成的半固体剂型。 • 散剂:系指一种或多种药物混合制成的粉末状剂型。 • 丸剂:系指药物细粉或药材提取物加适宜的黏合剂或辅料制成的球形
剂型。)
– 蜜丸:系指药物细粉以蜂蜜为黏合剂制成丸剂。 – 水丸:系指药物细粉用水(或根据制法用黄酒、醋、稀药汁等)为黏合剂
制成的丸剂。
6
– 糊丸:系指药物细粉用米糊或面糊为黏合剂制成的丸剂。 – 蜡丸:系指药物细粉以蜂蜡为黏合剂制成的丸剂。
– 白膏药:系指以植物油与宫粉为基质,油炸药料,去渣后与宫粉反应而成 的另一种铅硬膏。
– 药膏:又称油膏。主要以植物油、蜂蜡或其他适宜的物质为基质,加入药 物,经加热后,提取药物有效成分。或不经加热,将药物研成细粉或极细 粉混匀。
• 丹药:系指用汞及某些矿物类药物,在高温条件下经烧炼制成不同结 晶形状的无机化合物。
散剂 片剂
定义中增加“提取物”(散剂系指药材或药材提取物 经粉碎、混合制成的粉末状制剂)
类型中增加含片、咀嚼片、泡腾片、阴道片、肠溶片
胶囊剂 硬胶囊剂增加小丸、液体、半固体内容物
5
传统中药剂型(18)
• 酒剂:系指用白酒浸提制成的澄清液体剂型。 • 露剂:系指芳香性植物药材经水蒸气蒸馏法制得的内服澄明液体制剂 • 煎膏剂:又名膏滋,系指将药材用水煎煮,滤液浓缩后,加炼蜜和糖
