xi第三章碳正与碳负离子
4.碳正离子与碳负离子

有机化学基本理论主讲人:史达清4. 碳正离子与碳负离子碳正离子、碳负离子是有机化学中非常重要的两类活性中间体,我们有必要掌握这两类活性中间体的结构、生成方法及影响稳定性的因素。
(1)碳正离子碳正离子是指碳原子带有正电荷的三价化合物,对碳正离子的研究是最早且最深入的,被称为物理有机化学的基础,许多有机反应历程的研究概念和方法都起始于碳正离子的研究工作。
(a)碳正离子的结构碳正离子的中心碳原子是sp2 杂化的平面型结构,正电荷在p 轨道中:例外:下面的几个实例是例外,这是由于它们都不能形成空的p 轨道形式,如乙烯正离子,乙炔正离子是线型结构,有一个空的sp 杂化轨道,苯基正离子C6H5+则有一个空的sp2杂化轨道,但它们都很难生成,因为空轨道与π 体系相互垂直,正电荷得不到分散。
(b)碳正离子的生成方法离解是形成碳正离子的一个主要方法,离解时,与碳原子相连的基团带着一对对子离去。
苯磺酸根离子和卤离子是常用的较好的离去基团。
卤代物中的卤离子还可以在Ag+ 或Lewis 酸存在下脱去而生成碳正离子。
例如:醇一般是在酸作用下,将不容易离去的羟基转变成易离去的水离去,可以形成碳正离子:伯胺一般先用亚硝酸重氮化得到重氮盐,再脱氮得到碳正离子:如果生成的碳正离子具有芳香性,那么这些碳正离子就比较容易生成。
例如:另一类产生碳正离子的方法是质子或其它带正电荷的原子团或Lewis 酸对不饱和体系的加成。
例如:(c)碳正离子的稳定性凡是能够使碳正离子的正电荷得到分散的,则碳正离子比较稳定;相反,如果使碳正离子的正电荷集中,则碳正离子更不稳定。
其影响因素主要有:(i) 诱导效应给电子的诱导效应(+I)使碳正离子稳定;而吸引电子的诱导效应(-I),使碳正离子不稳定。
例如:(ii) 共轭效应给电子的共轭效应(+C)使碳正离子稳定;而吸电子的共轭效应(-C)使碳正离子不稳定。
例如:(iii) 空间效应由于碳正离子是平面型结构,如果正电荷在桥头碳原子上,由于桥的刚性结构,难以形成平面型,所以该碳正离子的稳定性比较差,例如:1-氯双环[2.2.1]庚烷的乙醇解速度比叔丁基氯慢1013倍。
第三章 碳负离子的反应
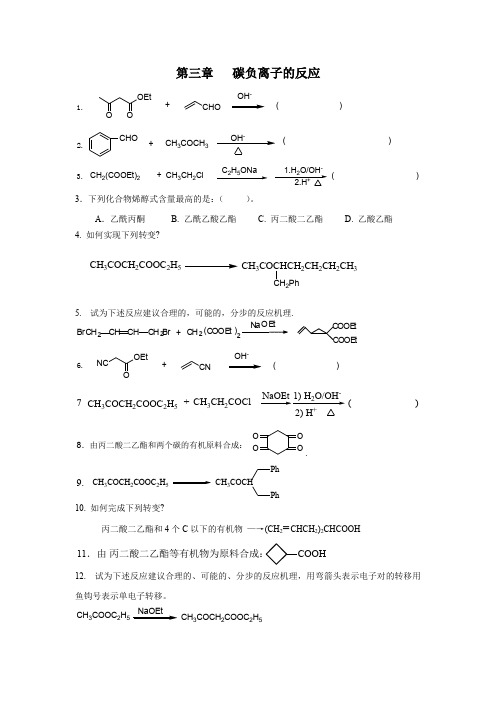
第三章 碳负离子的反应OEtO+CHOOH -( )O1.CHO+ CH 3COCH 3OH -( )2.+CH 3CH 2Cl25-( )CH 2(COOEt)23.3.下列化合物烯醇式含量最高的是:( )。
A .乙酰丙酮 B. 乙酰乙酸乙酯 C. 丙二酸二乙酯 D. 乙酸乙酯 4. 如何实现下列转变?CH 3COCH 2COOC 2H 5CH 3COCHCH 2CH 2CH 2CH 3CH 2Ph5. 试为下述反应建议合理的,可能的,分步的反应机理.CH CHBrC H 2C H 2Br +C H 2(C OOE t )C OOE t C OOE tNCOEt O+CNOH -( )6.( )CH 3CH 2COClNaOEt 1) H 2O/OH -2) HCH 3COCH 2COOC 2H 5+78.由丙二酸二乙酯和两个碳的有机原料合成:OOO O.CH 3COCH 2COOC 2H 5CH 3COCHPh Ph9.10. 如何完成下列转变? 丙二酸二乙酯和4个C 以下的有机物 —→(CH 2=CHCH 2)2CHCOOH11.由 丙二酸二乙酯等有机物为原料合成:COOH12. 试为下述反应建议合理的、可能的、分步的反应机理,用弯箭头表示电子对的转移用鱼钩号表示单电子转移。
CH 3COOC 2H 5NaOEtCH 3COCH 2COOC 2H 514.COOEt COOEt+CH 2(COOEt)-H 3O +O+CH 2(COOC 2H 5)2EtONa 15.KOHH2O+H16.COOH+COOEt17.OCH 3+(H 2C)4COOEtCOOEtEtONa(1) OH -_H 2O (2) H 3O +18.?(3) H 3+O,CO 2_(2) BrCH 2CH 2CH 2CH 2CH 2B r(1) 2 NaOC 2H 5,C 2H 5OH CH 2(COOC 2H 5)2,19.20.O H+1. BrCH COOC H2. H 3O21.OOEtO+EotONaOC 2H 5O O+PhCH 2252-( )22.CNO+H N H1.( )( )323.+CH 3CH 2ClC 2H 5ONa-( )CH 2(COOEt)224.CHOCN 25225.26. 下列四种化合物亚甲基的相对酸性顺序为: ( ) 1) CH 3COCH 2COCH 3 2).CH 3COCH 2COOC 2H 5 3) CH 3COCH 2COPh 4). CH 2(COOC 2H 5)2 A.1)>2)>3)>4) B.2)>4)>1)>3) C.1)>2)>4)>3) D.3)>1)>2)>4)28. 下列化合物的亚甲基哪个活性(或相对酸性)最强? ( )29. 下列化合物酸性最小的是: ( )H 3CC HC C CH 33H 3CC CCCH 3OCH 3CH 3H 3CC H 2C CCH 3OO ABC30. 写出下列反应的主要有机产物或所需之原料、试剂(如有立体化学问题请注明)。
碳负离子简介
HC
C
> CH2 CH
-I, +I
> CH3CH2
2) 诱导效应
3) 共轭效应
Ph3C->Ph2CH->PhCH2-
4. 芳香性导致的稳定性
5.由相邻杂原子导致的稳定性
如:鎓内盐
• 鎓内盐 (ylid) 是指一种化合物,再其分子 内含有碳负离子,和碳负离子相邻的杂 原子带正电荷,这些杂原子为P、N、S、 As、Sb、Se等
• 许多内鎓盐可以结晶离析,并广泛用于有机合 成中。而普通的碳负离子不能离析出来,因为 对水和氧极其敏感。 • 鎓内盐在有机合成中应用最广的是磷、硫叶立 德,磷叶立德与羰基化合物反应合成烯就是著 名的Wittig反应
6. 邻位π键的影响
还有其他的一些基团,如:NO2, C=O, -SO2-, CN, SO 等,也可以稳定C-离子。诱导与共轭效应均有。
稳定能力:NO2 > C=O > -SO2- ~ CN
Ph Ph Ph Ph
P
+
-
CH2
Ph Ph
P
CH2
• 磷鎓内盐的X光结晶结构研究表明,碳为 平面结构,即为sp2杂化。
• 鎓内盐较为稳定:与碳负离子相邻的带正电荷 的杂原子基团,使碳负离子稳定性明显增大。 2p(C) 与3d (P), 4d(As)或5d(Sb)空轨道重叠 • 碳原子2p轨道的未共用电子对进入d空轨道,负 电荷分散,从而使碳负离子稳定。
CH3COCHCOOEt
2. 负离子对双键的加成
HC
CH
OCH3
CH CH OCH3
HOCH3
CH2 CH OCH3
负碳离子的结构
第三章 碳负离子的反应

第三章碳负离子的反应-OHOEt+( )1.CHOOO-OHCHO( )COCH+ CH332.-CHONa1.HO/OH252+CHCl( )CHCH(COOEt)3.3222+2.H 3(下列化合物烯醇式含量最高的是:( )。
A(乙酰丙酮 B. 乙酰乙酸乙酯 C. 丙二酸二乙酯 D. 乙酸乙酯 4. 如何实现下列转变?CHCOCHCOOCHCHCOCHCHCHCHCH322532223CHPh25. 试为下述反应建议合理的,可能的,分步的反应机理.OEtNaCOOEt()COOEtCHBr+CHBrCHCHCH2222COOEt-OHOEtNC+6.( )CNO-1) HO/OHNaOEt2+CHCOClCH( )7CHCOCHCOOCH323225+2) HOO8(由丙二酸二乙酯和两个碳的有机原料合成:OO.PhCHCOCHCOOCHCHCOCH9.32253Ph10. 如何完成下列转变?丙二酸二乙酯和4个C以下的有机物—?(CH=CHCH)CHCOOH 22211(由丙二酸二乙酯等有机物为原料合成:COOH12. 试为下述反应建议合理的、可能的、分步的反应机理,用弯箭头表示电子对的转移用鱼钩号表示单电子转移。
NaOEtCHCOOCH325COCHCOOCHCH3225steel bolts, screws and studs GB/T3098.6-2000 scope of this project are: 1, 2, 3 aluminium sheet curtain wall of glass curtain wall and the Aluminum plastic Board curtain wall 4, and stone curtain wall 5, and curtain wall buried pieces 6, and light steel points type glass rain canopy, and aluminum Board rain canopy 7, and aluminum Venetian 8, and outdoor advertising (containing roofing and the State surface advertising) 9 to spring glass door 10, and concrete structure and curtain wall between of layer between, and around fire seal blocking 11, and anti-mine 12, and daughter wall top processing 13, and pan light ming, engineering of tie construction 14, and buildings of deformation sewing (settlement sewing, and expansion joints,) 15, and After the detailed design drawings issued a wall embedded part is inconsistent with the tenderer needs to increase fixed curtain wall structure 16, decorative surfaces and decorative surface and joints between parts of other buildings facing sealing process, required to support the outer decoration of a hole, hole, plugging holes and so on. This works more decorative items, in order to ensure that the decoration construction progress and quality, trying to avoid construction does not ... Processing. After installation is complete if you have damaged galvanized parts shouldCOOEt+-HOOH2EtONa14.3+(COOEt)CH22HO2COOEtOEtONa(COOCH)CH15.+2252EtOH+KOHEtOHHO3+OHH2COOEtEtONaCOOH+16.COOHCOOEtCH3KOH, EtOHKOH, EtOH+17.OOCOOEt-_(1) OHHOEtONa2(HC)18.+24O(2) H3COOEt() NaOCH,CHOH122525 19.CH(COOCH)252?2() BrCHCHCHCHCHBr222222+_() HO,,3CO32 OH1. BrCHCOOCH+225NH20.++2. HO3OEtEotONaCHO21.+OO-CHONaOOO/OH1.H252( )ClPhCH+222.+OCH2.H25 H( )( )+23.+O2.H3 -O/OH1.HCHONa225+24.( )CHCHClCH(COOEt)3222+2.H-CNCHO25.CHOHO/H252steel bolts, screws and studs GB/T3098.6-2000 scope of this project are: 1, 2, 3 aluminium sheet curtain wall of glass curtain wall and the Aluminum plastic Board curtain wall 4, and stone curtain wall 5, and curtain wall buried pieces 6, and light steel points type glass rain canopy, and aluminum Board rain canopy 7, and aluminum Venetian 8, and outdoor advertising (containing roofing and the State surface advertising) 9 to spring glass door 10, and concrete structure and curtain wall between of layer between, and around fire seal blocking 11, and anti-mine 12, and daughter wall top processing 13, and pan lightming, engineering of tie construction 14, and buildings of deformation sewing (settlement sewing, and expansion joints,) 15, and After the detailed design drawings issued a wall embedded part is inconsistent with the tenderer needs to increase fixed curtain wall structure 16, decorative surfaces and decorative surface and joints between parts of other buildings facing sealing process, required to support the outer decoration of a hole, hole, plugging holes and so on. This works more decorative items, in order to ensure that the decoration construction progress and quality, trying to avoid construction does not ... Processing. After installation is complete if you have damaged galvanized parts should26. 下列四种化合物亚甲基的相对酸性顺序为: ( ) 1) CHCOCHCOCH2).CHCOCHCOOCH 3) CHCOCHCOPh 4). CH(COOCH) 3233225322252A.1),2),3),4)B.2),4),1),3)C.1),2),4),3)D.3),1),2),4)28. 下列化合物的亚甲基哪个活性(或相对酸性)最强? ( )OOOO (A)CHCCHCCH(B)CCHCOCHCH3233225OOO(D)NO(C)COCCHCOCHHCHCCH2252225329. 下列化合物酸性最小的是: ( )CH3HH2HCHCHCCHCCCHCCCCCHCCC333333CHOOOO3OOCH3CBA30. 写出下列反应的主要有机产物或所需之原料、试剂(如有立体化学问题请注明)。
《碳负离子的反应》课件

防护措施
禁止事项
应急处理
废弃物处理
实验时需佩戴实验服、 护目镜等防护装备。
禁止在实验过程中饮食 、吸烟等行为。
熟悉实验中可能发生的 意外情况及处理方法。
按规定正确处理实验废 弃物。
实验废弃物的处理
分类处理
根据废弃物的性质进行分类, 如有机废弃物、无机废弃物等
。
回收利用
部分废弃物可进行回收利用, 以节约资源。
副产物的生成。
06
碳负离子反应的实验操作 与安全注意事项
实验操作规程
01
02
03
04
实验前的准备
确保实验室环境整洁,检查实 验器材是否齐全、完好。
试剂取用
按照需求适量取用,避免浪费 或不足。
操作步骤
按照规定的顺序进行实验操作 ,不可省略或颠倒。
数据记录
实时记录实验数据,确保准确 无误。
安全注意事项
安全处置
对于无法回收利用的废弃物, 需按照规定进行安全处置。
记录存档
对废弃物的处理过程进行记录 ,并存档备查。
THANKS
感谢观看
自由基反应
总结词
自由基反应是碳负离子与自由基的反 应,通常发生在碳负离子的未共用电 子对被自由基的空轨道接收的过程中 。
详细描述
在自由基反应中,碳负离子与自由基 相互作用,形成新的碳-碳键或碳-自 由基键。这种反应通常在高温或光照 条件下进行,有利于自由基的形成和 反应。
光化学反应
总结词
光化学反应是碳负离子在光的作用下发 生的化学反应,通常需要特定波长的光 照射。
β-羟基酸酯的合成
总结词
β-羟基酸酯是有机合成中的一种特殊结构, 碳负离子可以用于合成β-羟基酸酯。
第3章 有机化合物反应活性及性质比较

1、比较下列碳负离子的稳定性。
A. CH3 C. CH3CHCH3
B. CH3CH2 D. (CH3)3C
A>B > C > D(供电子效应使碳负离子不稳定)
2、比较下列碳负离子的稳定性。
A. C(NO2)3 C. CH(CHO)2
B. CH(NO2)2 D. CH2NO2
A>B > C > D(吸电子效应使碳负离子稳定)
第3章 有机化合物反应活 性及性质比较
主要检测内容:
◆ 物理性质 ◆ 反应活性中间体 ◆ 酸碱性 ◆ 芳香性 ◆ 反应活性 ◆ 互变异构 ◆ 光谱性质 ◆ 立体异构
一、物理性质
1、熔点
熔点增高的因素:
◆ 分子量增大; ◆ 分子极性增强; ◆ 分子间作用力(氢键、范德华力、偶及作用等)增大; ◆ 分子对称性高; ◆ 反式烯烃高于顺式烯烃。
3、偶极矩
µ = q ×d
影响偶极矩的因素:
◆ 原子的电负性大小; ◆ 分子的对称性。
1、比较丙烷、丙烯、丙炔分子中C-H键偶极矩的 大小。
A . C H 3 C H 2 C H 3 B . C H 3 C H = C H 2 C . C H 3 C C H
C > B > A(电负性sp>sp2>sp3)
A. H3C HOOC
COOH
HOOC B.
COOH
Cl
COOH Cl
C. H3C H3C
COOH H
H3C N D.
OCH3
OH
OH
A.
B.
C.
D.
OH
D > C > B > A(氢键、极性)
3、下列化合物哪一个熔点最低?
一、碳负离子的产生二、碳负离子的烃基化反应三、碳负离子的酰基化
Department of Material and Engineering, Soochow University
碳负离子是有机分子中的碳氢键失去质子所形成的共轭 碱。它能作为一种亲核性碳质体广泛用于碳-碳键形成中。 其 中 应 用 最 广 泛 的 是 以 烯 醇 负 离 子 ( Enolate ) 和 烯 胺 (Enamine)为中间体的一些反应。本章重点是烯醇负离子 和烯胺的产生、主要反应及在有机合成中的应用。
第三章 碳负离子反应
一、碳负离子的产生
3 动力学控制和热力学控制
反应条件对产物的影响 非质子溶剂:
1 2 34 56
1 碳负离子的生成
2 碳负离子的结构 3 动力学控制和
热力学控制
Department of Material and Engineering, Soochow University
18
(C6H5)3CH
~40
(CH3)3COH
19
CH3SOCH3
~40
Department of Material and Engineering, Soochow University
第三章 碳负离子反应
一、碳负离子的产生
2 碳负离子的结构 12
在碱的作用下,这些活性亚甲基化合物失去质子形成碳 负离子或烯醇负离子
Department of Material and Engineering, Soochow University
第三章 碳负离子反应
一、碳负离子的产生
1 碳负离子的生成
3 动力学控制和热力学控制
1 2 34 56
热力学控制(Thermodynamic control)
xi第三章卡宾

OMe n(CO)M Ph
Fischer 型
LnM
C
X Y
LnM
C
X Y LnM C
X Y
卡宾的反应性能
H :B(c)
CO CO CO
CO Cr
(e)
:Nu
(a)
CR2 OR ..
E(b)
C
(d)
CO
(f)
a)强正电性的卡宾碳表现为亲电中心。 b)亲电试剂络合到卡宾碳邻位杂原子上。 c)卡宾配体的α-碳原子上的H具有明显的酸性,故可被 碱脱去H原子形成金属卡宾负离子然后与一系列亲电试 剂反应生成C-C键。 d)络合物中的杂原子还可被亲核性更强的试剂取代。 e)金属与卡宾之间的碳键也可发生断裂。 f)络合物中配体(CO)也可以被其它配体取代。
:CH2 > :C H > CO2R :C H Ph > :C H ~ Br :C H Cl
除了C-H 键可以进行插入反应外, 卡宾还可以在C-Br, C-Cl, C-O 键上进行插入反应, 但C-C键不能.
(CH3) 3C Cl
:CH2
(CH3) 3CCH2Cl + (CH3) 2C-CH2CH2-H Cl
此法经济实用,产率亦好,可直接制备胺基卡宾络合物 c) 由金属羰基化合物和炔烃制备
W(CO)6 + R R'OH OR' (CO)5W R
此法对制备某些特殊卡宾络合物有用,其优点是不需要高 反应活性的亲电试剂。此法是利用金属-炔烃络合物的重排, 然后用醇类化合物捕获制备。
(3) 金属卡宾络合物的反应 卡宾络合物所经历的反应可分为两类 A.卡宾配体的反应 <1>亲核取代反应
(2)金属卡宾络合物的制备 a)从金属羰基化合物的制备
碳负离子的反应

官能团转化反应
卤代烃的水解反应
卤代烃在碱性条件下生成碳负离 子,与水发生亲核取代反应生成 醇。
酯的水解反应
酯在碱性条件下生成碳负离子, 与水发生亲核取代反应生成羧酸 和醇。
立体选择性反应
烯烃的顺反异构化反应
在光照或加热条件下,烯烃与卤素发生 加成反应生成卤代烷,卤代烷在碱性条 件下生成碳负离子,再与另一分子烯烃 发生亲核加成反应,生成具有立体选择 性的顺反异构体。
碳负离子的反应
汇报人:XX
• 碳负离子概述 • 碳负离子的反应类型 • 碳负离子在有机合成中的应用 • 碳负离子的反应机理与动力学 • 碳负离子的实验方法与检测技术 • 碳负离子的应用前景与挑战
01
碳负离子概述
定义与性质
定义
碳负离子是指带有负电荷的碳原子, 通常表示为$C^-$。它是许多有机化 学反应中的重要中间体。
自由基反应
自由基引发
在某些条件下,如高温或过氧化物存在下,碳负离子可以引发自由基链式反应。通过均裂产生自由基,进而引发 后续的自由基传递和终止步骤。
自由基加成
碳负离子可以作为自由基受体,与自由基发生加成反应。例如,在烯烃的自由基加成反应中,碳负离子与烯烃中 的双键发生加成,生成新的自由基中间体。
电化学反应
性质
碳负离子具有亲核性,可以与亲电试 剂发生反应。它的稳定性取决于其所 处的化学环境,如溶剂、温度、pH值 等。
结构与稳定性
结构
碳负离子的结构通常是一个或多个碳 原子通过共价键与其他原子或基团相 连,并带有一个负电荷。这个负电荷 可以通过共振结构进行分散,从而提 高其稳定性。
稳定性
碳负离子的稳定性与其结构密切相关 。一般来说,具有较大共轭体系或能 够通过共振稳定化的碳负离子更稳定 。例如,苯基负离子比甲基负离子更 稳定。
xi第三章碳正与碳负离子

2021/5/19
N 2
S b F 6
35
④ 在超酸中制备C正离子溶液
比100%的H2SO4的酸性更强的酸——超酸 (Super acid)
常见的超酸 (与100%H2SO4的酸性比较)
HSO3F(氟硫酸)
1000倍
HSO3F - SbF5 (魔酸) 1013倍
HF-SbF5
1016倍
2021/5/19
44
同烯丙基碳正离子中间体
由于π、σ键邻基参与而形成非经典碳正离子
2021/5/19
配位数可以为5个
45
2:
比较上图(A)、(B)、 (C) 在140C的乙酸解的速 度,得到的结果是1:13.3:148,中间体是一致的, 中间体在两个碳原子上有部分正电荷,而且被甲基所 稳定化。
2021/5/19
36
几乎任何一个卤化物、醇、酯在介质如硫酸、
氟磺酸、五氟化锑等超强酸中,都可以形成稳定的 碳正离子。在酸的水溶液中,时常也能形成这样的 碳正离子。
2021/5/19
37
它们的稳定性可以用pKR(醇和碳正离子浓度相等的 pH值)来表示。这里,三苯甲醇的pKR,值为-6;三对甲 氧基苯甲醇为0.8,下图所示的醇为9.1;通过uv或nmr可 以测定离子的浓度,从而得到pKR值。
第二章 有机反应活性中间体
(Reactive intermediates in Organic Chemistry)
2021/5/19
1
概述
在有机反应中,有机反应有些是属于一步 完成的,称为协同反应。
CH2 HC
+
HC CH2
O C
O C O
HC HC
H2 C
碳负离子反应

穿戴防护装备:实验过程中必须穿戴防护 服、手套、护目镜等防护装备。
实验环境:实验应在通风良好的实验室中 进行避免在密闭空间内进行。
实验材料:实验材料应妥善保管避免接触 皮肤和眼睛。
实验操作:实验过程中应严格按照实验 步骤进行操作避免操作不当导致危险。
实验废弃物:实验结束后应妥善处理实验 废弃物避免环境污染。
碳负离子反应是合 成有机化合物的重 要方法之一广泛应 用于药物合成、材 料科学等领域。
碳负离子反应的机 理包括亲核加成、 亲核取代、亲核消 除等。
碳负离子反应的分类
碳负离子反应可以分为两类:亲核碳负离子反应和亲电碳负离子反应 亲核碳负离子反应是指碳负离子作为亲核试剂与亲电试剂发生反应 亲电碳负离子反应是指碳负离子作为亲电试剂与亲核试剂发生反应 碳负离子反应在合成化学中具有广泛的应用如合成有机化合物、药物合成等
碳负离子反应的特点
碳负离子是一种重要的有机合成中间体 碳负离子反应具有高度选择性和立体选择性 碳负离子反应可以生成多种类型的有机化合物 碳负离子反应在合成化学中具有广泛的应用
碳负离子反应的原理
碳负离子反应的化学键特征
碳负离子反应是一种化学反应其中 碳原子失去电子形成负离子。
碳负离子反应的化学键特征还与反 应条件、反应物浓度等因素有关。
碳负离子反应的研究趋势和展望
研究热点:碳负离子反应在材料科学、化学合成等领域的应用 研究方法:理论计算、实验验证相结合的研究方法 研究挑战:如何提高碳负离子反应的效率和选择性 研究展望:未来可能会在能源、环保等领域取得突破性进展
碳负离子反应的研究方法和手段
实验方法:通过实验观察碳负离子反应的过程和结果 理论研究:通过理论推导和计算来研究碳负离子反应的机理和规律 模拟计算:通过计算机模拟来研究碳负离子反应的条件和影响因素 合作研究:与其他研究机构或企业合作共同推进碳负离子反应的研究
第三章 碳碳键的形成讲解

—CN、>CO。
有机钯催化的形成碳碳键的反应是构筑分子结构的有效方法,具有高的化学选 择性和区域选择性。Heck、Negishi和Suzuki三位化学家因在钯催化交叉偶联方面 做出的杰出贡献而获得2010年诺贝尔化学奖。
有机合成
第3章
碳碳键的形成
有机合成
第3章
碳碳键的形成
有机合成
第3章
碳碳键的形成
羟醛缩合反应
OH 2 CC
OH, 或 H+
O
OH H
CCCC
H2O
H
H
H
注意
(1)反应前后分子结构的变化
(2)反应需要α -氢的参与 (3)至少含有两个α -氢时才会发生脱水 (4)酸也可以催化
O
H
CCCC
H
有机合成
第3章
碳碳键的形成
碱催化机理
OH CC
OH
H
O
OH H
CCCC
H
H
OH
O CC
四氢吡咯
吗啉
六氢吡啶
有机合成
第3章
碳碳键的形成
和醛酮的直接烷基化相比,烯胺的烷基化反应有下列优点:
Xi第三章自由基

CH3 H3C C .
CH3
苯基自由基:
.
.
苄基自由基:
CH2 . Ph3C .
卤素自由基: F. Cl. Br. I.
烷氧基自由基: RO .
常见离子自由基
负离子自由基
正离子自由基
.
+ S2O82-
正离子自由基
.
Na
负离子自由基
(2) 按自由基相对稳定性分类 a. 活泼自由基
大多数自由基表现很活泼,在反应过程中仅能瞬 时存在。许多自由基反应是按照自由基链反应机理, 由一个活泼自由基周而复始地引起许多其他分子连续 发生反应,如溴化氢在过氧化物作用下与丙烯的加成:
Me
Me
外消旋产物
实际上,叔碳烷基自由基,如叔丁基自由基是 角锥型构型,但由于不同构型之间相互转化的能 垒很低,分离不出异构体。
. H3C
H3C C H3C
2.5kJ/mol
CH3
.C CH3
CH3
双环桥头碳正离子与叔丁基正离子比较,由于 碳正离子一般是平面构型,桥头碳因几何形状限 制,不可能为平面构型,因而不稳定。 但双环桥头碳自由基与叔丁基自由基比较,其 稳定性并无明显不利倾向。
(2)光照
在可见和紫外光波段,对辐射具有吸收 能力的分子,利用光照射可以使之分解而 产生自由基。
Cl2 hv 2 Cl
hv
Cl3CBr
Cl3C + Br
另一个有用的光解反应是丙酮气相光照分 解反应。
H3C CO
h
H3C C
O*
H3C
320nm H3C
O H3C C. + CH3 .
CH3. + CO
稳定化碳负离子的烷基化和酰基化
非对称酮:
SN2 反应
? 如何选择性烷基化
烯醇硅醚的生成及其烷基化反应
烯醇硅醚的制备方法 动力学控制法制备烯醇硅醚:
热力学控制法制备烯醇硅醚:
无异构化现象!
实例
四、烯胺和亚胺负离子的反应
烯醇的氮杂类似物——烯胺(36)、肟、腙 烯醇负离子的氮杂类似物——亚胺负离子(37)
肟负离子(37a)腙负离子(39)
Bu-i
2. H3O
ii、增加ß-C的亲核性
R R2 C
R1
CHO
R
t-Bu NH2 R
EtMgBr R
CHCHO R1
C CH N Bu-t R1
CC
R1
H
H
MgX N
Bu-t
iii、利用烯胺ß-锂盐
Li CCN
具有更强的亲核性
H
Br O HN
R C C R' H
Br R' RCCN
BuLi
Li R' RCCN
THF、DME、DMF、DMSO、HMPA、TMEDA、DMPU
3. 烷基化试剂的特性
O-烷基化
C-烷基化
实验规律:
极性的非质子性溶剂中(HMPA),采用磺酸酯或硫酸酯作烷化剂可使游离 的烯醇负离子有利于O-烷基化;
溶剂为极性较小的THF或DME时,采用卤代烷作烷化剂有利于C-烷基化; 硅卤、酸酐和膦酰卤的反应优先发生在氧上。
强弱碱
碳负离子的烷基化反应: 反应液中有足够浓度的负离子,以确保烷基化反应的快速进行。
第一代强碱:Na(K)OH/H2O、RONa(K)/ROH 第二代强碱:Na(K)NH2/NH3(l) 、Na(K)H/THF、Ph3CNa(K)/DMF(DMSO) 第三代强碱:LDA、LHMDS、LiTMP、LICA/THF
4.碳正离子与碳负离子

有机化学基本理论主讲人:史达清4. 碳正离子与碳负离子碳正离子、碳负离子是有机化学中非常重要的两类活性中间体,我们有必要掌握这两类活性中间体的结构、生成方法及影响稳定性的因素。
(1)碳正离子碳正离子是指碳原子带有正电荷的三价化合物,对碳正离子的研究是最早且最深入的,被称为物理有机化学的基础,许多有机反应历程的研究概念和方法都起始于碳正离子的研究工作。
(a)碳正离子的结构碳正离子的中心碳原子是sp2 杂化的平面型结构,正电荷在p 轨道中:例外:下面的几个实例是例外,这是由于它们都不能形成空的p 轨道形式,如乙烯正离子,乙炔正离子是线型结构,有一个空的sp 杂化轨道,苯基正离子C6H5+则有一个空的sp2杂化轨道,但它们都很难生成,因为空轨道与π 体系相互垂直,正电荷得不到分散。
(b)碳正离子的生成方法离解是形成碳正离子的一个主要方法,离解时,与碳原子相连的基团带着一对对子离去。
苯磺酸根离子和卤离子是常用的较好的离去基团。
卤代物中的卤离子还可以在Ag+ 或Lewis 酸存在下脱去而生成碳正离子。
例如:醇一般是在酸作用下,将不容易离去的羟基转变成易离去的水离去,可以形成碳正离子:伯胺一般先用亚硝酸重氮化得到重氮盐,再脱氮得到碳正离子:如果生成的碳正离子具有芳香性,那么这些碳正离子就比较容易生成。
例如:另一类产生碳正离子的方法是质子或其它带正电荷的原子团或Lewis 酸对不饱和体系的加成。
例如:(c)碳正离子的稳定性凡是能够使碳正离子的正电荷得到分散的,则碳正离子比较稳定;相反,如果使碳正离子的正电荷集中,则碳正离子更不稳定。
其影响因素主要有:(i) 诱导效应给电子的诱导效应(+I)使碳正离子稳定;而吸引电子的诱导效应(-I),使碳正离子不稳定。
例如:(ii) 共轭效应给电子的共轭效应(+C)使碳正离子稳定;而吸电子的共轭效应(-C)使碳正离子不稳定。
例如:(iii) 空间效应由于碳正离子是平面型结构,如果正电荷在桥头碳原子上,由于桥的刚性结构,难以形成平面型,所以该碳正离子的稳定性比较差,例如:1-氯双环[2.2.1]庚烷的乙醇解速度比叔丁基氯慢1013倍。
碳正离子、碳负离子、自由基参与的化学反应 王竹青 29号 应化09-2

碳正离子、碳负离子、自由基参与的化学反应应用化学09-2班 王竹青 29号一 碳正离子参加的反应含有一个外层只有 6 个电子的碳原子作为中心碳原子的正离子。
常见的碳正离子如下:(一)碳正离子的形成一般有三种方法产生碳正离子。
1 .由反应物直接生成 :RXRX与碳原子直接相连的原子或原子团带着一对成键电子裂解,产生碳正离子。
极性溶剂、Lewis 酸常有促进效果。
1.1 X=H 。
烃很少自动失去氢负离子,只有在强亲电试剂如Lewis 酸或其它稳定正离子的因素存在下才能发生这一反应。
CHCH 3CH 3H 3C3C CH 3CH 3H 3C+HAlCl 31.2 X=F 、Cl 、Br 或I 。
这是SN1异裂反应。
Lewis酸可加速这种电离作用。
CClCH 3CH 3H 3CAlCl 3C CH 3CH 3H 3C+HAlCl 4CH 3CH 3CH 2(CH 3)3C1.3 X=OTs 酯类衍生物。
OTs 是一个很好的离去基团,这类酯很易 解离。
1.4 X=OCOZ ,其中Z= Cl 、Br 或I ,其推动力是由于形成二氧化碳。
氯亚磺酸酯,X=OSOCl 也属于这一类。
其推动力是由于排除SO2。
COSOClRR R3C RRR+Cl+SO 21.5 X=H2O 或ROH 。
断裂是由醚ROR 中氧原子的质子化引起的。
1.6 X= N 2。
亚硝酸和伯胺的反应生成的重氮离子很容易分解成碳正离子,推动力是由于生成了氮气。
1.7 X=CO 。
当相应的正离子稳定的时候,某些羧酸先质子化,然后脱去羰基。
C CH 3CH 3H 3CAlCl 3C CH 3CH 3H 3C+OTs -+C OCOClR RRC R RR+Cl -CO2+OR'RH OR'RR +R'OH+N 2H +N 2+COH 2OCOH 2O++CO 1.8 X=CO2。
羧酸氧化脱羧,生成碳正离子和CO2。
RCOOAgBr 2R+Br+AgBr+CO 22 质子或其它阳离子与不饱和体系加成质子或其它阳离子与不饱和体系加成,留下的临碳原子带正电。
碳负离子和碳正离子对比,碳负离子的稳定性,碳正离子的稳定性,自由基的稳定性

碳正离子与碳负离子的对比一、碳正离子1.碳正离子的产生碳正离子可以认为是通过C-C 单键中一对电子的异裂形成的,式中X 代表卤素。
碳正离子中带正电荷的碳原子是sp 2 杂化,三个杂化轨道呈平面排列与其他原子或基团成键,键角约为120o ,有一个垂直于此平面的空p 轨道,这个空的P 轨道与化学性质密切相关。
B碳正离子很不稳定,需要电子来完成八隅体构型,因此任何给电子的因素都能使正电荷分散而稳定,任何吸电子的因素均能使正电荷集中而更不稳定。
故而R 的共轭效应,给电子的诱导效应和立体效应,以及烷基的超共轭效应都能对碳正离子起稳定作用。
2.碳正离子的稳定性烷基有给电子的诱导效应,故带正电荷的碳上的烷基越多,给电子的诱导效应越大,使正电荷越分散而稳定。
还有超共轭效应,也使得碳正离子更稳定。
P-π共轭也能使正电荷分散而稳定,碳正离子与不饱和的烯或芳基相连时,共轭体系越多,碳正离子越稳定。
(CH 3)3C +>(CH 3)2C +H>CH 3C +H 2>C +H 3 (CH 2=CH)3C +>(CH 2=CH)2C +H>CH 2=CHC +H 2由于碳正离子中带正电荷的碳原子是sp 2 杂化,桥头碳原子由于桥的刚性结构,不形成具有平面三角形的SP 2轨道的碳正离子,即使能形成也很不稳定。
3.碳正离子的反应(1)与与亲核试剂结合:R ++Nu —→R —Nu (2)消除邻位碳上的一个质子而形成烯烃:(3)和烯烃加成形成更大的碳正离子:R 3CXR 3C+XoC +3C +2HC+H 2>>CHC+C CR ++C CC C +R(4)使芳香环烷基化:(5)重排成为更稳定的碳正离子:在有碳正离子的反应中,例如S N 1中,其反应机理如下:R 33C ++X _ R 3C ++N u 3CNu由于碳正离子的平面结构,带正电的碳原子上有一个空的P 轨道,如果该碳原子上连接着三个不同的基团,由于亲核试剂从平面两边进攻的机会相等,因而可以得到“构型保持”和“构型翻转”两种化合物如下:S N 1反应中还包含了碳正离子的另一个重要的反应—重排反应,如上面已给的图中,由一级碳正离子转变为三级碳正离子就是一个重排反应。
碳正离子

碳正离子碳正离子是一种带正电的极不稳定的碳氢化合物。
分析这种物质对发现能廉价制造几十种当代必需的化工产品是至关重要的。
欧拉教授发现了利用超强酸使碳正离子保持稳定的方法,能够配制高浓度的碳正离子和仔细研究它。
他的发现已用于提高炼油的效率、生产无铅汽油和研制新药物。
碳正离子与自由基一样,是一个活泼的中间体。
碳正离子有一个正电荷,最外层有6个电子。
带正电荷的碳原子以SP2杂化轨道与3个原子(或原子团)结合,形成3个σ键,与碳原子处于同一个平面。
碳原子剩余的P轨道与这个平面垂直。
碳正离子是平面结构。
1963年有报道,直接观察到简单的碳正离子,证明了它的平面结构,为它的存在及其结构提供了实验依据。
根据带正电荷的碳原子的位置,可分为一级碳正离子,二级碳正离子和三级碳正离子。
碳正离子的结构与稳定性直接受到与之相连接的基团的影响。
它们稳定性的一般规律如下:(1)苄基型或烯丙型一般较稳定;(2)其它碳正离子是:3°>2°>1°;碳正离子越稳定,能量越低,形成越容易,加成速度也越快,可见碳正离子的稳定性决定烯烃加成的取向。
碳正离子根据结构特点不同可分为:经典碳正离子和非经典碳正离子碳负离子(Carbanion)指的是含有一个连有三个基团,并且带有一对孤对电子的碳的活性中间体。
碳负离子带有一个单位负电荷,通常是四面体构型,其中孤对电子占一个sp3 杂化轨道。
通过比较相应酸的酸性大小,可以大致判断碳负离子的稳定性大小。
一般地,具有能稳定负电荷的基团的碳负离子具有较高的稳定性。
这些基团可以是苯基、电负性较强的杂原子(如O,N,基团如-NO2、-C(=O)-、-CO2R、-SO2-、-CN和-CONR2等)或末端炔烃(也可看作电负性的缘故),例如,三苯甲烷、三氰基甲烷、硝基甲烷和1,3-二羰基化合物具有较强的酸性。
除此之外,不同于缩酮,缩硫酮的α氢也具有较强的酸性。
这可以用硫的3d轨道与C-S键σ*轨道的超共轭效应来解释。
碳负离子

碳正离子与碳负离子的对比李文峰 学号2013301040145 化基五班摘要:碳负离子和碳负离子都是有机化学中重要的活性中间体,但两者的形成和反应机理都不尽相同。
本文大体依据《有机化学》,结合相关文献。
对二者进行两相对比增益于化学的学习。
关键词:碳正离子 碳负离子 重排 一、碳正离子碳正离子的产生碳正离子可以认为是通过C-C 单键中一对电子的异裂形成的,式中X 代表卤素。
碳正离子中带正电荷的碳原子是sp 2 杂化,三个杂化轨道呈平面排列与其他原子或基团成键,键角约为120o ,有一个垂直于此平面的空p 轨道,这个空的P 轨道与化学性质密切相关。
B碳正离子很不稳定,需要电子来完成八隅体构型,因此任何给电子的因素都能使正电荷分散而稳定,任何吸电子的因素均能使正电荷集中而更不稳定。
故而R 的共轭效应,诱导效应和立体效应,以及烷基的超共轭效应都能对碳正离子起稳定作用。
碳正离子的稳定性烷基有给电子的诱导效应故带正电荷上的碳烷基越多,给电子的诱导效应越大,使正电荷越分散而稳定。
还有超共轭效应,也使得碳正离子更稳定。
P-π共轭也能使正电荷分散而稳定,一般是碳正离子与不饱和的烯或是芳基相连时,共轭体系越多,正碳离子越稳定。
(CH 3)3C +>(CH 3)2C +H>CH 3C +H 2>C +H 3 (CH 2=CH)3C +>(CH 2=CH)2C +H>CH 2=CHC +H 2由于碳正离子中带正电荷的碳原子是sp 2 杂化,桥头碳原子由于桥的刚性结构,不形成具有平面三角形的SP 2轨道的碳正离子,即使能形成也很不稳定。
碳正离子的反应1、与与亲核试剂结合R ++Nu —一 R —Nu2、消除邻位碳上的一个质子而形成烯烃RXR 3C+XoC +3C +2HC +H 2>>3、和烯烃加成形成更大的碳正离子4、使芳香环烷基化5、重排成为更稳定的碳正离子在有碳正离子的反应中例如S N 1中,其反应机理如下R 33C ++X _R 3C ++N u 3CNu由于碳正离子的平面结构,带正电的碳原子上有一个空的P 轨道,如果该碳原子上连接着三个不同的基团,由于亲核试剂从平面两边进攻的机会相等,因而可以得到“构型保持”和“构型翻转”两种化合物如下S N1反应中还包含了碳正离子的另一个重要的反应—重排反应如上面以给的图中,由一级碳正离子转变为三级碳正离子就是一个重排反应。
碳负离子

上面我们从碳负离子的自身结构出发讨论了结构对碳负离子稳定性的影响。此外溶剂对一个碳负离子的稳定性也有较大影响,若所用溶剂能与负离子发生溶剂化作用,则溶剂分子通过偶极—偶极相互作用分散负离子的电荷,所以起到了稳定负离子的作用。
本文从六个方面论述了碳负离子的稳定性和结构的关系,对于碳负离子的理解和机理的研究有一定的意义。
浅谈碳负离子
摘要:碳负离子的稳定性对其形成和反应性有着最直接的影响,因此定性或定量地研究碳负离子的稳定性无论在理论上还是实际上都是有意义的。本文从几个方面定性地讨论了结构与碳负离子稳一种重要的有机活性中间体,在有机化学理论以及有机合成中占有非常重要的地位。随着有机试剂的不断发展和商品化,更丰富了这一领域的内容,促进了碳负离子化学的研究和实际应用。碳负离子作为亲核质体与亲电试剂作用形成碳碳键,即增长碳链,这在有机合成化学领域中具有相当大的应用价值。碳负离子的稳定性对其形成和反应性有着最直接的影响。而碳负离子的稳定性与其自身的结构有着密切的关系,因此从结构的角度出发,定性或定量地研究碳负离子的稳定性无论在理论上还是实际上都是有意义的。
题目:浅谈碳负离子
学院:化工学院
专业:应用化学
姓名:何露芬
学号:S112978
4、d- pπ反馈键
在硫醚、亚砜、砜、锍盐及季磷盐等含硫、磷化合物中,由于硫、磷原子具有空的3d轨道,能使相邻碳负离子上的电荷反馈到3d轨道,从而起到使负碳离子稳定的作用,如下面这些含硫、磷的碳负离子。
5、带有吸电子基的碳负离子
吸电子基团使碳负离子上的电荷得到分散,因而起到使负离子稳定的作用,这些基因团硝基,羰基,砜基及氰基等。它们的拉电子能力是;- NO2> C=O > SO2D-CN。- I的诱导和- C的共轭效应都是有利于稳定亚甲基负离子:-CH2NO2,-CH2COPh,-CH2COH3, H2SO2Ph,-CH2SO2CH3和-CH2CN。这种吸电子效应具有加合性,即多个拉电子基团应更加使负离子稳定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3
Br
-Br-
CH3 H3C
C +
CH3
H2O
Transition state H3C C
CH3 CH3
Intermediate
CH3 CH3
OH2
H3C
C
CH3
+
OH2
-H
+
H3C
C
CH3
+
OH
Transition state
2018/11/19
4
分步反应的能峰图 协同反应的能峰图
氧上未共有电子对所 占 p 轨道 与中心碳原子上的空的 p轨道 侧面交盖,未共有电子对离域, 正电荷分散。
CH3 O
CH2
CH3O
CH2
类似地,羰基正离子:
R C O
2018/11/19
R C
O
19
乙烯型正碳离子:
H R
C
C
H
+
C原子进行sp2杂化, p轨道用于形成π键, 空着的是sp2杂化轨道,使正电荷集中。
+
HC
Transition State
2018/11/19
Diels-Alder反应
2
更多的有机反应则不止一步,反应中至少
包括一个活性中间体的生成。例如叔卤代烷 的水解首先生成碳正离子,然后与水反应而 得到水解产物。
2018/11/19
3
CH3 H3C
C
CH3
OH
Br
-
H2O
H3C C
2018/11/19
46
3:
进一步证明上述确是一个非经典碳正离子,是从 相对稳定的原冰片二烯正离子的nmr谱得到的。这里, nmr 谱表明2及3质子和4及5 质子是不相当的。那么, 在带正电荷的碳原子和一个双键之间存在着相互作用。
2018/11/19
47
4:
有许多现象证明其他双键在同烯丙基位置和在更 远的位置也能有助于反应的进行;但一般速度比例比 较低得多。例如,对溴苯磺酸--(顺-7-原冰片烯基)乙 酯(图A),在25C,乙酸解速度比相应的饱和同系物 (图B)的快140,000倍。
6
(一) 碳正离子 碳正离子(carbonium ion) 是带有正电荷的含碳离 子,是一类重要的活性中间体,可用R3C+表示(R为烷 基)。碳正离子及其反应于20世纪20年代由C.K.英 戈尔德等提出的。碳正离子可以认为是通过共价C-C 单键中一对电子的异裂反应而产生,式中X为卤素。
2018/11/19
CH2
>
>
2018/11/19
17
环丙甲基正离子的结构:
C
CH2 空的 p 轨道与弯曲轨道的交盖 随着环丙基的数目增多, 正碳离子稳定性提高。
CH2
CH2
中心碳原子上的空的 p轨道与环丙基中 的弯曲轨道进行侧面交盖,其结果是使 正电荷分散。
2018/11/19 18
直接与杂原子相连的正碳离子结构:
2018/11/19
44
同烯丙基碳正离子中间体
由于π、σ键邻基参与而形成非经典碳正离子
2018/11/19
配位数可以为5个
45
2:
比较上图(A)、(B)、 (C) 在140C的乙酸解的速 度,得到的结果是1:13.3:148,中间体是一致的, 中间体在两个碳原子上有部分正电荷,而且被甲基所 稳定化。
10
正碳离子的稳定性:
CH3 3C > CH3 2CH > CH3CH2 > CH3
轨道交盖在这里
H
空的 p 轨道
σ- p超共轭效应
C H H
C
2018/11/19
11
共轭效应
烯丙型正碳离子:
CH2 CH CH2 CH2 CH CH2
p-π共轭
电子离域 正电荷分散程度大
2018/11/19
12
共轭体系的数目越多,正碳离子越稳定:
2018/11/19
20
苯基正离子:
结构同乙烯型正碳离子,正电荷
集中在sp2杂化轨道上。
此二类正碳离子稳定性极差!空的杂化轨道 与π键垂直,正电荷得不到分散。
2018/11/19 21
芳香性的影响
环丙烯正离子
环庚三烯正离子
环戊二烯正离子
有芳香性,特别稳定
反芳香性,很不稳定
2018/11/19
22
2018/11/19
38
叔丁醇在下列条件下完全转变成叔丁基正离子:
CH3 H3C C OH CH3 CH3
HSO3F - SbF5 - SO2 -60℃
H3C C + H +O + SO F3 3 CH3 + SbF + SO
5 2
很多正碳离子的结构与稳定性的研究都是在
超酸介质中进行的。
2018/11/19
7
所形成的碳正离子R3C+,带有一个正电荷,配位 数为3,一般是平面结构(sp2杂化),另一空的p轨道垂 直于该平面。取代基R的共轭效应,诱导效应和立体 效应,以及烷基的超共轭效应都能对碳正离子起稳定 作用。
早期,人们通过冰点降低法测定离子数目,用以证明正碳 离子的存在。 欧拉教授发现了利用超强酸使碳正离子保持稳定的方法, 从而可以研究它们的结构和性质。 2018/11/19 8
2018/11/19
15
当共轭体系上连有取代基时,
给电子基团使正碳离子稳定性增加;
吸电子基团使其稳定性减弱:
CH3
CH2
>
CH2
> O2N
CH2
2018/11/19
16
环丙甲基正离子比苄基正离子还稳定:
随着环丙基的数目增多, 正碳离子稳定性提高。
3
C
>
C
2 CH
>
C H
CH2
>
C H H
Cl
1-氯双环[2,2,1]庚烷
2018/11/19
26
烯丙基型正离子通常是稳定的,但下列碳 正离子则因非平面结构不能使电荷离域很 不稳定:
2018/11/19
27
但在形成的桥环足够大时,桥头C可取
平面构型,如1-金刚烷碳正离子:
2018/11/19
28
溶剂效应:
1) 溶剂的诱导极化作用, 利于底物的解离。 2) 溶剂使碳正离子稳定:
•注意活性(反应)中间体与过渡态的区别及联系。
2018/11/19 5
一、碳正离子(Carbocation)
二、碳负离子(Carbanions)
三、自由基(Free radicals)
四、碳烯(卡宾,Carbenes)
五、氮烯(乃春,Nitrenes) 六、苯炔 (Benzyne)
2018/11/19
C C
HCl
C C
Cl
C O
2018/11/19
H
C OH
C OH
34
③ 由其它正离子转化而生成
NH2
NaNO3 HCl
N2
N2
H
H Ph3CSbF6 SbF6
2018/11/19
35
④ 在超酸中制备C正离子溶液
比100%的H2SO4的酸性更强的酸——超酸
(Super acid) 常见的超酸 (与100%H2SO4的酸性比较) HSO3F(氟硫酸) 1000倍 HSO3F - SbF5 (魔酸) 1013倍 HF-SbF5 1016倍
Br + C 溴鎓离子
2018/11/19 42
C
TsO
H
AcO
AcOH -TsO
H
Ts = CH3
SO2
+
7
1 3
2电子3中心体系
5 4 2
2018/11/19
43
(1) C=C作为邻位基团
最引人注目的是对甲苯磺酸-7-原冰片烯酯的乙酸 解比对甲苯磺酸-7-原冰片酯的快1011倍,并且保持构 型不变。
第二章 有机反应活性中间体
(Reactive intermediates in Organic Chemistry)
2018/11/19 1
概述
在有机反应中,有机反应有些是属于一步
完成的,称为协同反应。
O CH2 HC C HC O HC CH2 C O C H2 CH C O H2 C CH O C O HC C H2 CH C O HC H2 C CH O O C
HOAc
OBs
AcOK
OAc
(I)
exo-
HOAc endoOBs
AcOK
OAc
( II )
生成外消旋化合物。
2018/11/19 52
5 6 1 exo-
4
3 2
OBs
SN 2 6
5 1 +
4 3 2
SN1 endoOBs
+ +
对外型而言-OBs离去是从C-6得到了邻基帮 助,即C-6在C-2背面进攻,推出-OBs,相 当于SN2反应,同时生成非经典C正离子。
2018/11/19 36
几乎任何一个卤化物、醇、酯在介质如硫酸、 氟磺酸、五氟化锑等超强酸中,都可以形成稳定的 碳正离子。在酸的水溶液中,时常也能形成这样的 碳正离子。
2018/11/19
37
它们的稳定性可以用pKR(醇和碳正离子浓度相等的 pH值)来表示。这里,三苯甲醇的pKR,值为-6;三对甲 氧基苯甲醇为0.8,下图所示的醇为9.1;通过uv或nmr可 以测定离子的浓度,从而得到pKR值。
