高中化学乙烯
高中化学乙烯的合成教案

高中化学乙烯的合成教案
教学目标:了解乙烯的合成方法,掌握乙烯的生产原理和工业应用。
教学重点:乙烯的合成方法,乙烯的生产原理,乙烯的工业应用。
教学步骤:
一、引入
老师简要介绍乙烯的概念和重要性,以及乙烯在工业生产中的应用。
二、乙烯的合成方法
1. 介绍乙烯的主要合成方法:裂解、氧化、蒸汽重整等。
2. 具体讲解裂解法合成乙烯的原理和步骤。
3. 讲解氧化法和蒸汽重整法合成乙烯的原理和特点。
三、乙烯的生产原理
1. 分析不同合成方法的优缺点。
2. 探讨乙烯的生产过程中可能遇到的问题和解决方法。
3. 结合实际案例,讲解乙烯生产中的关键环节和技术要点。
四、乙烯的工业应用
1. 介绍乙烯在合成乙烯酮、聚乙烯等化学品中的应用。
2. 探讨乙烯在塑料、橡胶、合成纤维等工业中的广泛应用。
3. 分析乙烯在环保、能源、医药等领域的潜在应用价值。
五、小结与展望
总结乙烯的合成方法、生产原理和工业应用,展望乙烯在未来的发展前景。
教学延伸:
1. 学生可以通过实验模拟乙烯的合成过程,深化对乙烯合成方法的理解。
2. 学生可以做乙烯在不同工业领域中的应用调研,拓展对乙烯的应用领域的认识。
课堂设计:
整堂课以讲解、讨论和实验为主,增强学生的实践操作和思维能力。
通过案例分析和问题解答,引导学生深入探讨乙烯的合成原理和工业应用,培养学生的综合分析和解决问题的能力。
高中化学乙烯教案doc

高中化学乙烯教案doc教学内容:乙烯一、教学目标:1. 了解乙烯的基本性质和结构;2. 掌握乙烯的物理性质和化学性质;3. 理解乙烯在工业生产和日常生活中的应用。
二、教学重点和难点:1. 乙烯的结构和性质;2. 乙烯的工业生产和应用。
三、教学方法:1. 讲授结合实验;2. 案例分析;3. 课堂讨论。
四、教学内容:1. 乙烯的基本性质和结构:乙烯是一种无色、有毒气体,具有刺激性气味。
它的化学式为C2H4,结构式为CH2=CH2。
乙烯的键长度较短,键能较高,稳定性较弱。
2. 乙烯的物理性质:乙烯是一种无色、有毒气体,易燃。
其密度小于空气,可以溶解在水中。
乙烯具有特殊的刺激性气味。
3. 乙烯的化学性质:乙烯是一种具有不饱和双键的烃类化合物,在化学反应中常表现出特殊的活性。
乙烯可以发生加成反应、氧化反应、卤素加成反应等。
4. 乙烯在工业生产和日常生活中的应用:乙烯是一种重要的工业原料,用于生产乙烯聚合物、合成橡胶、合成衬里等。
此外,乙烯还可用于制备醋酸乙烯酯、氯丙烯等有机化合物。
五、教学过程:1. 讲授乙烯的基本性质和结构;2. 实验演示乙烯的物理性质;3. 分析乙烯的化学性质;4. 讨论乙烯的工业生产和应用;5. 案例分析乙烯在日常生活中的应用。
六、教学总结:通过本节课的学习,学生将了解乙烯的基本性质和结构,掌握乙烯的物理性质和化学性质,理解乙烯在工业生产和日常生活中的应用。
同时,通过案例分析和课堂讨论,提高学生的探究能力和实践能力,培养学生的综合能力和创新思维。
高中化学第三节--乙烯-烯烃ppt课件

七、烯烃(单烯烃)
•1、概念: 分子里含有碳碳双键的不饱和链烃叫烯烃。
•2、烯烃的通式:CnH2n (n≥2)同环烷烃通式 最简式:CH2
结构特征: 与C=C双键相连的四个原子在同一个面上, .
其余的可能共面,也可能不共面。
3、烯烃的同分异构体
⑴ 碳链异构: 在分子中由于支键的位置不同而产生的异构。
实验1 :在空气中点燃乙烯
现象:点燃纯净的乙烯,它能在空气里 燃烧,有明亮的火焰。
有关的化学反应为:
C 2 C H 2 3 O H 2 点 燃2 C 2 2 H O 2 O ( L )
.
实验2:把甲烷通入到酸性高锰酸钾溶液中
实验3:把乙烯通入到酸性高锰酸钾溶液中
现象:甲烷不能使酸性高锰酸钾溶液褪色。乙 烯使酸性高锰酸钾溶液逐渐褪色。 说明:酸性高锰酸钾溶液具有强氧化性,乙烯 能被氧化,具有还原性,能发生氧化还原反应。 而甲烷比较稳定。 结论1:用酸性高锰酸钾溶液可以区别乙烯和 甲烷等饱和烷烃。
.
如果在某种特殊情况下,碳碳双键发生断裂 了,但又没有其它原子存在,这时会发生什 么变化呢?
CH2=CH2 CH2=CH2
―→ ―CH2 ― CH2― ―→ ―CH2 ― CH2―
…… ……
.
催化剂
nCH2=CH2
[CH2—CH2] n
乙烯聚合过程
聚合反应:分子量小的化合物分子(单体)互相 结合成分子量大的化合物(高分子化合物)
H OH
浓硫酸 170 ℃
CH2=CH2 + H2O
分子内脱水
乙醇(酒精) 注意:浓硫酸与乙醇的体积比为3:1.将浓硫酸注入乙醇, 浓硫酸作用:催化剂、脱水剂。
.
3装置:液+液→气体(乙烯)
人教版高中化学乙烯教案

人教版高中化学乙烯教案
第一课时:
一、导入
通过呈现一些现实生活中乙烯的应用场景,引起学生的兴趣和好奇心。
二、习题讨论
1. 请学生回顾已学乙烷、乙炔的结构式,并简要介绍其分子式和官能团;
2. 请学生讨论乙烯分子结构,引导学生发现其中的特点。
三、教学内容
1. 乙烯的基本性质:分子式、分子结构、物理性质等;
2. 乙烯的化学性质:有机物与溴水反应,有机物与卤素氧化物反应等。
四、实验设计
设计一个简单的实验来展示乙烯的性质,如乙烯的不饱和性能。
第二课时:
一、复习
通过问题讨论或小测验来复习第一课时所学内容。
二、新知探究
1. 乙烯的化工应用:乙烯的制取方法、聚乙烯的生产及用途等;
2. 展示一些乙烯在日常生活和工业生产中的实际应用。
三、教学互动
分组讨论乙烯的环境问题,如乙烯的工业生产对环境的影响及相应的环保措施。
四、课堂总结
总结乙烯的基本性质及化工应用,强调乙烯在工业生产和生活中的重要性,并鼓励学生对化学知识的应用。
五、作业布置
布置乙烯相关的练习题或实验报告,巩固所学知识。
教学资源:实验室设备、乙烯样品、相关实验器材及资料。
评价方式:根据学生的实验报告、课堂表现及理解程度来评价学生的学习效果。
高中化学必修2乙烯教案

高中化学必修2乙烯教案教学内容:
1. 乙烯的结构和性质
2. 乙烯的制备方法
3. 乙烯的应用及环境问题
教学目标:
1. 理解乙烯的结构和性质
2. 掌握乙烯的制备方法
3. 了解乙烯的应用及环境问题
教学重点和难点:
1. 乙烯的结构和性质
2. 乙烯的制备方法
3. 乙烯的应用及环境问题
教学过程:
一、乙烯的结构和性质
1.介绍乙烯的结构和化学式
2.讲解乙烯的物理性质和化学性质
3.进行一些简单的实验,观察乙烯的性质
二、乙烯的制备方法
1.介绍乙烯的主要制备方法:热裂解法和蒸气裂解法
2.讲解不同方法的原理和操作步骤
3.进行相关的实验,制备乙烯并观察结果
三、乙烯的应用及环境问题
1.介绍乙烯的主要应用领域:聚乙烯、乙烯树脂等
2.讲解乙烯生产和使用过程中可能产生的环境问题
3.讨论如何减少乙烯对环境的影响,提出解决方案
教学评估:
1. 考试:期末考试包含乙烯相关知识的选择题和简答题
2. 实验报告:要求学生完成乙烯相关实验并提交实验报告,评分考虑实验操作和实验结果的准确性
3. 课堂讨论:鼓励学生参与课堂讨论,展示对乙烯知识的理解和应用能力
教学反思:
在教学过程中,要注重培养学生的实验技能和动手能力,让他们能够独立完成实验操作并获得准确的实验结果。
此外,要引导学生关注乙烯在生产和使用过程中可能产生的环境问题,培养他们的环境意识和责任感。
最终目的是使学生掌握乙烯的基本知识,能够正确理解和应用在实际生活和工作中。
高中化学(新人教版)必修第二册:乙烯【精品课件】

【课堂练习】
2. 下列说法错误的是(C)
A.无论是乙烯与Br2的加成反应,还是乙烯使酸性KMnO4溶液褪色,都与分子内含有 的碳碳双键有关 B.溴的四氯化碳溶液和酸性KMnO4溶液都可以鉴别乙烯和甲烷 C.相同质量的乙烯和甲烷完全燃烧后生成水的质量相同 D.乙烯的化学性质比乙烷的化学性质活泼
【课堂练习】
乙烯
学习目标 1、会写乙烯的分子式、结构式、结构简式、电子式。 2、知道乙烯能够发生氧化反应、加成反应、聚合反应。 3、理解加成反应的概念。
核心素养 1、微观探析:认识乙烯的组成、结构、性质和变化,形成“结构决定性质”的观念 2、证据推理:通过分析、推理认识乙烯发生加成反应时的断键和成键情况。
目录
二、乙烯的化学性质
1.氧化反应
(1)燃烧
点燃
CH2=CH2 + 3O2
2CO2 + 2H2O
现象:火分数较高,燃烧时碳并没有 完全被氧化,而本身被烧成炽热状态,故火焰明亮;又 由于一部分碳呈现游离态,所以有黑烟冒出。可以据此 检验乙烯和甲烷。
二、乙烯的化学性质
3.长途运输水果时,常常将浸泡有高锰酸钾溶液的硅土放置在盛放水果的容
器中,其目的是(C )
A.利用高锰酸钾溶液杀死水果周围的细菌,防止水果霉变 B.利用高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂 C.利用高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟 D.利用高锰酸钾溶液的氧化性,催熟水果
【课堂练习】
碳碳单键 C、H不全在一个平面内
2C2H6+7O2 ―点――燃→ 4CO2+6H2O C2H6+Cl2 ―光 ―→ C2H5Cl+HCl
不反应
碳碳双键 6个原子都在同一平面内
C2H4+3O2 ―点――燃→2CO2+2H2O CH2==CH2+Br2―→CH2BrCH2Br 因发生氧化反应而使其褪色
高中化学必修2之知识讲解_乙烯(基础)-
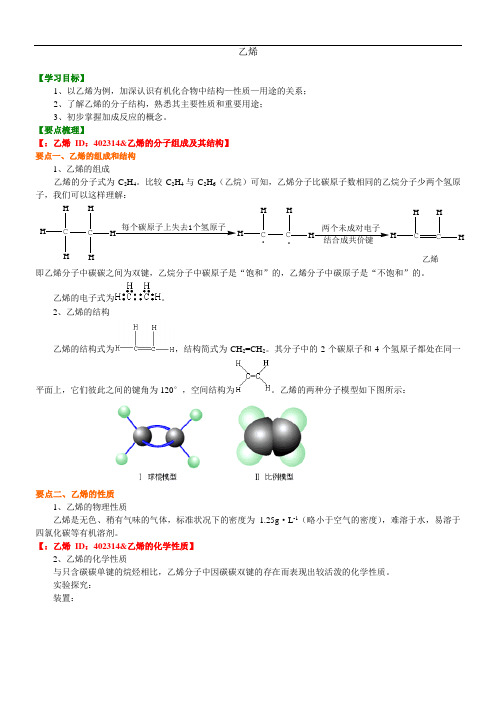
乙烯【学习目标】1、以乙烯为例,加深认识有机化合物中结构—性质—用途的关系;2、了解乙烯的分子结构,熟悉其主要性质和重要用途;3、初步掌握加成反应的概念。
【要点梳理】【:乙烯ID:402314&乙烯的分子组成及其结构】要点一、乙烯的组成和结构1、乙烯的组成乙烯的分子式为C2H4。
比较C 2H4与C2H6(乙烷)可知,乙烯分子比碳原子数相同的乙烷分子少两个氢原子,我们可以这样理解:C HHH C HHH每个碳原子上失去1个氢原子CHHC HH.两个未成对电子结合成共价键CHHC HH乙烯.即乙烯分子中碳碳之间为双键,乙烷分子中碳原子是“饱和”的,乙烯分子中碳原子是“不饱和”的。
乙烯的电子式为。
2、乙烯的结构乙烯的结构式为,结构简式为CH2=CH2。
其分子中的2个碳原子和4个氢原子都处在同一平面上,它们彼此之间的键角为120°,空间结构为。
乙烯的两种分子模型如下图所示:要点二、乙烯的性质1、乙烯的物理性质乙烯是无色、稍有气味的气体,标准状况下的密度为1.25g·L-1(略小于空气的密度),难溶于水,易溶于四氯化碳等有机溶剂。
【:乙烯ID:402314&乙烯的化学性质】2、乙烯的化学性质与只含碳碳单键的烷烃相比,乙烯分子中因碳碳双键的存在而表现出较活泼的化学性质。
实验探究:装置:实验步骤与现象:实验步骤实验现象将气体通入酸性高锰酸钾溶液中溶液褪色将气体通入溴的四氯化碳溶液中溶液褪色用排水法收集气体验纯后,点燃火焰明亮,伴有黑烟结论一:石蜡油分解产生了能使高锰酸钾溶液、溴的四氯化碳溶液褪色的气态产物,由此可知产物中含有与烷烃性质(烷烃不能使酸性高锰酸钾溶液褪色)不同的烃。
结论二:研究表明,石蜡油分解的产物主要是乙烯和烷烃的混合物。
要点诠释:a.碎瓷片起催化作用。
b.高锰酸钾溶液中常加入少量的稀硫酸,以增强其氧化性。
c.酸性高锰酸钾溶液和溴的四氯化碳溶液的量不宜太多,浓度也不宜太大,因为实验中乙烯量不大。
人教版高中化学 必修第2册 学案设计 第七章 第二节 第一课时《乙烯》
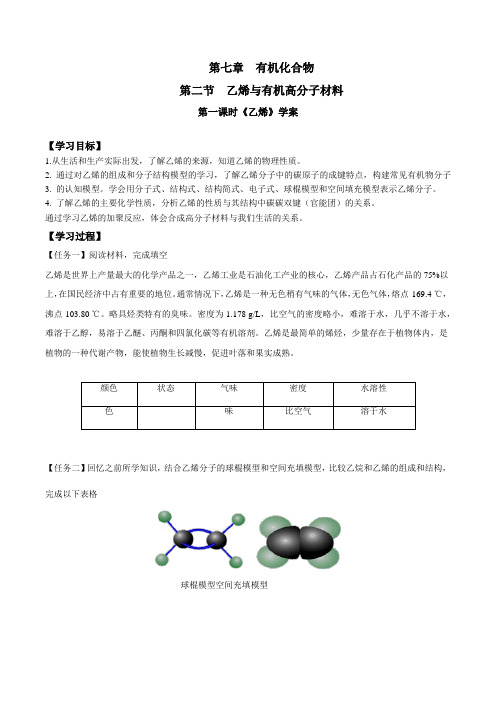
第七章有机化合物第二节乙烯与有机高分子材料第一课时《乙烯》学案【学习目标】1.从生活和生产实际出发,了解乙烯的来源,知道乙烯的物理性质。
2. 通过对乙烯的组成和分子结构模型的学习,了解乙烯分子中的碳原子的成键特点,构建常见有机物分子3. 的认知模型。
学会用分子式、结构式、结构简式、电子式、球棍模型和空间填充模型表示乙烯分子。
4. 了解乙烯的主要化学性质,分析乙烯的性质与其结构中碳碳双键(官能团)的关系。
通过学习乙烯的加聚反应,体会合成高分子材料与我们生活的关系。
【学习过程】【任务一】阅读材料,完成填空乙烯是世界上产量最大的化学产品之一,乙烯工业是石油化工产业的核心,乙烯产品占石化产品的75%以上,在国民经济中占有重要的地位。
通常情况下,乙烯是一种无色稍有气味的气体,无色气体,熔点-169.4 ℃,沸点-103.80 ℃。
略具烃类特有的臭味。
密度为1.178 g/L,比空气的密度略小,难溶于水,几乎不溶于水,难溶于乙醇,易溶于乙醚、丙酮和四氯化碳等有机溶剂。
乙烯是最简单的烯烃,少量存在于植物体内,是植物的一种代谢产物,能使植物生长减慢,促进叶落和果实成熟。
【任务二】回忆之前所学知识,结合乙烯分子的球棍模型和空间充填模型,比较乙烷和乙烯的组成和结构,完成以下表格球棍模型空间充填模型思考:乙烯和乙烷的组成和结构有什么相同点和不同点? 【任务三】阅读以下资料,分析乙烯分子中的碳碳双键的特点思考:乙烯分子中的碳碳双键有什么特点?【任务四】用乙烯进行如下实验,将实验现象填写在表格中思考:乙烯和酸性高锰酸钾溶液、溴的四氯化碳溶液的实验现象可能的产生原因?【任务五】乙烯在一定条件下,可以与Cl 2、H 2、HCl 、H 2O 等物质发生加成反应,请根据这些反应总结加成反应的反应规律CH 2===CH 2+Cl 2―→CH 2ClCH 2Cl CH 2===CH 2+H 2――→催化剂△CH 3CH 3CH 2===CH 2+HCl ――→催化剂△CH 3CH 2ClCH 2===CH 2+H 2O――→催化剂加热、加压CH 3CH 2OH【任务六】查阅教材,完成填空。
人教版高中化学必修2-乙烯(共33张PPT)

Br Br CH2CH2 1,2-二溴乙烷
——可用于鉴别或除杂。 Br Br (CH2BrCH2Br) 无色油状液体, 密度比水大,
不溶于水,易溶于CCl4 。
迁移应用
试写出乙烯与H2 、HCl 、H2O发生加成反应 的化学方程式。
催化剂
CH2=CH2 + H-H △
CH3-CH3 乙烷
催化剂
CH2=CH2 + H-Cl
石油裂解气: 主要成分是乙烯, 还含有丙烯、异丁 烯、甲烷、乙烷、 异丁烷、硫化氢和 碳的氧化物等。
一、乙烯的分子结构
分子式
C2H4
球棍模型
电子式
结构式 结构简式 CH2= CH2
CH2CH2
比例模型
空间构型: 平面型分子 6个原子共平面
( 键角约120° )
六个原子共面
约120°
约120°
约120°
研究表明,石蜡油分解的产物 主要是烯烃和烷烃的混合物
资料卡片 石油的裂化、裂解
催化剂
CC168HH3146
△
催化剂
C8CH81H8 16
△
C4H10 C4H10
催化剂
△
催化剂
△
CC8H4H1810++CC8H4H168 辛烷 辛烯
C4H10 + C4H8 丁烷 丁烯
C2H4 + C2H6 乙烯 乙烷 CH4 + C3H6 甲烷 丙烯
• 8、普通的教师告诉学生做什么,称职的教师向学生解释怎么做,出色的教师示范给学生,最优秀的教师激励学生。上午10时55分 53秒上午10时55分10:55:5324.3.4
实验 通入酸性高锰酸钾溶液中
高中乙烯知识点

高中乙烯知识点关键信息1、乙烯的分子结构化学式:C₂H₄结构式:CH₂=CH₂空间构型:平面型分子,6 个原子共平面键角:约 120°双键:一个σ 键和一个π 键2、乙烯的物理性质无色气体稍有气味难溶于水密度比空气略小3、乙烯的化学性质氧化反应燃烧:C₂H₄+ 3O₂ → 2CO₂+ 2H₂O(火焰明亮,伴有黑烟)使酸性高锰酸钾溶液褪色加成反应与溴水:CH₂=CH₂+ Br₂ → CH₂BrCH₂Br与氢气:CH₂=CH₂+ H₂ → CH₃CH₃与氯化氢:CH₂=CH₂+HCl → CH₃CH₂Cl与水:CH₂=CH₂+ H₂O → CH₃CH₂OH(工业制乙醇)聚合反应加聚反应:nCH₂=CH₂ → CH₂CH₂n (聚乙烯)4、乙烯的用途化工原料:用于生产聚乙烯、乙醇、氯乙烯等植物生长调节剂:促进果实成熟、花朵凋谢、叶片脱落等11 乙烯的分子结构乙烯的化学式为C₂H₄,其结构式为CH₂=CH₂。
在乙烯分子中,两个碳原子以双键相连,双键由一个σ 键和一个π 键组成。
乙烯分子为平面型分子,6 个原子共平面,键角约为 120°。
这种独特的分子结构决定了乙烯具有特殊的化学性质。
111 σ 键和π 键的特点σ 键是原子轨道沿键轴方向“头碰头”重叠形成的共价键,其电子云重叠程度较大,键能较高,比较稳定。
π 键是原子轨道平行“肩并肩”重叠形成的共价键,电子云重叠程度较小,键能较低,不如σ 键稳定。
乙烯分子中的双键中,一个是σ 键,一个是π 键,π 键的存在使得乙烯容易发生加成反应。
12 乙烯的物理性质乙烯是一种无色气体,稍有气味。
它难溶于水,密度比空气略小。
在通常状况下,乙烯是一种气态的有机化合物。
121 乙烯物理性质的应用由于乙烯难溶于水且密度比空气略小,在收集乙烯气体时,通常采用排水法,而不采用排空气法。
13 乙烯的化学性质乙烯具有多种化学性质,包括氧化反应、加成反应和聚合反应等。
高中化学 乙烯习题

乙烯[基础巩固]1.长途运输水果时,常常将浸泡有高锰酸钾溶液的硅土放置在盛放水果的容器中,其目的是()A.利用高锰酸钾溶液杀死水果周围的细菌,防止水果霉变B.利用高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂C.利用高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟D.利用高锰酸钾溶液的氧化性,催熟水果2.下列关于乙烯结构与性质的叙述中,错误的是()A.乙烯分子中6个原子在同一平面内B.乙烯与酸性KMnO 4溶液发生加成反应使其褪色C.乙烯与溴的四氯化碳溶液发生加成反应D.乙烯分子的一氯代物只有一种结构3.下列物质,不可能是乙烯的加成产物的是()A.CH 3CH 3B.CH 3CHCl 2C.BrCH 2CH 2BrD.CH 3CH 2Br 4.下列反应不属于加成反应的是()5.某烯烃与H 2加成后的产物为,则该烯烃可能的结构简式有()A.1种B.2种C.3种D.4种6.(2019·自贡高一检测)能证明乙烯分子中含有一个碳碳双键的事实是()A.乙烯分子中碳、氢原子的个数比为1∶2B.乙烯完全燃烧生成的CO 2和H 2O 的物质的量相等C.乙烯易与溴水发生加成反应,且1mol 乙烯完全加成需消耗1mol 溴单质D.乙烯能使酸性KMnO 4溶液褪色7.(2019·衡阳高一期末)体育比赛中当运动员肌肉挫伤或扭伤时,队医随即对准运动员的受伤部位喷射药剂氯乙烷(CH 3—CH 2Cl)(沸点为12.27℃),进行局部冷冻麻醉应急处理。
制取氯乙烷的最好方法是()A.乙烷与氯气发生取代反应B.乙烯与氯气发生加成反应C.乙烷与氯化氢混合D.乙烯与氯化氢发生加成反应8.(2019·武汉高一期中)①②是两种常见烃的球棍模型,则下列叙述正确的是()A.都能在空气中燃烧B.都能使酸性高锰酸钾溶液褪色C.都能发生加成反应D.等质量的①②完全燃烧时,产生CO 2的量相同9.根据乙烯的性质填空。
(1)乙烯通入酸性KMnO 4溶液中观察到的现象是____________________________,乙烯发生了________反应。
高中化学乙烯公开课教案

高中化学乙烯公开课教案【课时】1课时【教学内容】乙烯【教学目标】1. 了解乙烯的基本性质和化学结构;2. 掌握乙烯的制备方法;3. 理解乙烯在工业生产中的重要应用。
【教学重点】1. 乙烯的基本性质和化学结构;2. 乙烯的制备方法。
【教学难点】1. 理解乙烯的分子结构;2. 掌握乙烯的制备方法。
【教学过程】一、导入(5分钟)1. 出示乙烯的分子结构,并让学生讨论乙烯在生活中的应用;2. 引导学生思考:乙烯是如何制备的?二、乙烯的基本性质和化学结构(10分钟)1. 讲解乙烯的分子式、分子结构和物理性质;2. 介绍乙烯的化学性质,强调其具有不饱和性和活泼性。
三、乙烯的制备方法(15分钟)1. 讲解乙烯的制备方法,包括蒸馏法和裂化法;2. 对比两种制备方法的优缺点,引导学生讨论。
四、乙烯的工业应用(10分钟)1. 介绍乙烯在工业生产中的重要应用,如合成聚乙烯等;2. 引导学生思考:乙烯如何改变人们的生活?五、小结(5分钟)1. 总结乙烯的基本性质、化学结构和制备方法;2. 强调乙烯在工业应用中的重要性。
【课堂活动】1. 分组讨论乙烯的应用;2. 实验演示乙烯的制备方法。
【教学案例】1. 乙烯是一种重要的有机化合物,具有广泛的应用领域,比如合成塑料、合成橡胶等;2. 制备乙烯的蒸馏法和裂化法分别适用于不同的工业生产需求。
【课后作业】1. 搜集乙烯的相关信息,了解乙烯在不同领域的应用;2. 思考乙烯的未来发展方向,写一份小结。
【教学反思】1. 本节课内容涉及乙烯的基本性质、化学结构、制备方法和工业应用,涵盖了乙烯这一有机化合物的全貌;2. 课堂活动要求学生积极参与,提高学生的学习兴趣和学习效果。
高中化学必修2_第三章_第二节_乙烯

C=C断开一个,2个Br分别直接与 2个价键不饱和的C结合
来自石油的基本化工原料——乙烯
12
乙烯分子内碳碳双键的键能 (615KJ/mol)小于碳碳单键键能 (348KJ/mol)的二倍,说明其中 有一条碳碳键键能小,容易断裂。
来自石油的基本化工原料——乙烯
13
溴分子
来自石油的基本化工原料——乙烯
615
8
来自石油的基本化工原料——乙烯
科学探究:乙烯化学性质实验
① 石蜡油:17个C以
上的烷烃混合物
②碎瓷片:催化剂
③加热位置:碎瓷片
④将生成气体通人酸 性高锰酸钾溶液中。 ⑤生成的气体通入溴的四氯化碳溶液 ⑥点燃气体
火焰明亮,并伴有黑烟。
9
来自石油的基本化工原料——乙烯
3、化学性质 ——活泼 ⑴ 氧化反应
14
来自石油的基本化工原料——乙烯
15
来自石油的基本化工原料——乙烯
16
来自石油的基本化工原料——乙烯
17
来自石油的基本化工原料——乙烯
18
来自石油的基本化工原料——乙烯
19
来自石油的基本化工原料——乙烯
20
有机物分子中双键或三键两端的碳 原子与其它原子或原子团直接结合生成 新的化合物的反应,叫做加成反应 。
①燃烧 ——火焰明亮,少量黒烟
CH2=CH2 + 3O2
②被KMnO4氧化
点燃
2CO2 + 2H2O
将乙烯通入酸性KMnO4溶液中: 现象: 紫红色褪去
KMnO4 + H2SO4+ C2H4 → MnSO4 + K2SO4 + CO2 + H2O 来自石油的基本化工原料——乙烯
高中化学教案乙烯教材

高中化学教案乙烯教材
教学目标:
1. 了解乙烯的性质和结构;
2. 了解乙烯的制备方法和应用;
3. 认识乙烯对环境和健康的影响。
教学重点:
1. 乙烯的结构和性质;
2. 乙烯的制备方法和应用。
教学难点:
乙烯的环境和健康影响。
教学过程:
一、导入
请学生回顾一下碳的化学性质和族式、结构式的表示方法。
二、乙烯的结构和性质
1. 介绍乙烯的结构:C2H4,为无色气体,具有特殊的臭味。
2. 讲解乙烯的性质:乙烯是一种不饱和烃,较容易燃烧,与卤素发生加成反应等。
三、乙烯的制备方法和应用
1. 制备方法:乙烯可以通过蒸馏石油裂解产生。
2. 应用:乙烯是工业上重要的化工原料,用于生产乙烷、乙醇等化合物。
四、乙烯的环境和健康影响
1. 环境影响:乙烯可以污染空气,造成大气中有毒气体的增加。
2. 健康影响:乙烯的长期接触可能导致呼吸道、皮肤等方面的问题。
五、案例分析
讨论乙烯的应用领域和对环境的影响,引导学生思考如何减少乙烯对环境的影响。
六、课堂练习
出示相关习题,让学生巩固所学知识。
七、作业布置
布置作业,要求学生总结乙烯的结构、性质、制备方法和应用,并写出乙烯对环境和健康的影响。
教学反思:
通过本节课的学习,学生应该能够掌握乙烯的结构、性质、制备方法和应用,了解乙烯对环境和健康的影响,培养学生的环境保护意识和环境责任感。
高中化学必修二乙烯烯烃.ppt.ppt

要成分是聚四氟乙烯。下列关于四氯乙烯和聚四氟乙
烯的叙述中正确的是
C
A、它们都属于纯净物
B、它们都能使酸性高锰酸钾溶液褪色
C、它们的分子中都不含氢原子
D、它们都可由乙烯只发生加成反应得到
ห้องสมุดไป่ตู้
二、烯烃(单烯烃)
1、概念:分子里含有碳碳双键的不饱和链烃。
2、烯烃的通式:CnH2n (n≥2) 同环烷烃通式
3、烯烃同系物的物理性质
取代反应与加成反应的比较
意义 归属 断键规律
产物特点
取代反应
取而代之,有进有出 烷烃的特征反应
C-H 断裂 两种产物,产物复 杂, 为混合物
加成反应
加之而成,有进无出 烯烃等的特征反应
C-C断裂 一种产物,产物相 对较纯净
(3)、 加聚反应
问:乙烯分子之间可否发生加成反应呢?
nCH2=CH催2化剂 ─[CH2 ─]CH2─n
10、下列分子的所有原子在同一平面的是(AD )
A、CO2 B、P4 C、CH4 D、C2H4
12、1molCH2=CH2与氯气完全加成后再与氯气取代,整个
过程最多需Cl2的物质的量为C(
)
A.1mol B.4mol C.5mol
D.6mol
13.四氯乙烯对环境有一定的危害,干洗衣服的干洗剂
主要成分是四氯乙烯;家用不粘锅内侧涂覆物质的主
CH3—CH = C︳—CH2—CH3 CH3
3-甲基-2-戊烯
CH2=C︳—CH2—CH =CH2
CH2CH3
2-乙基-1,4-戊二烯
45
14、向装有溴的玻璃瓶中通入乙烯,结果玻璃瓶质 量增加4.2 g,则溴吸收的乙烯在标况下体积是
高中化学必修第三章第二节乙烯课件

3、结构
分子式: C2H4
电子式:
H.. H.. H:C::C:H
HH 结构式:H C C H
结构简式:
正:CH2=CH2
误:CH2CH2
空间构型:
H2C=CH2
来自石油的基本化工原料——乙烯
生命的道路上永远没有捷径可言,只有脚踏实地走下去。 来自石油的基本化工原料——乙烯 CH2 = CH2 + Br – Br → CH2Br – CH2Br 你接受比抱怨还要好,对于不可改变的事实,你除了接受以外,没有更好的办法了。 你接受比抱怨还要好,对于不可改变的事实,你除了接受以外,没有更好的办法了。 6个原子共平面,平面型分子,键角120° 试写出乙烯分别与H2、Cl2、HCl、H2O在一定条件下发生加成反应的化学方程式 自然界没有风风雨雨,大地就不会春华秋实。 知道看人背后的是君子; 来自石油的基本化工原料——乙烯 ⑤生成的气体通入溴的四氯化碳溶液 有机物分子中双键或三键两端的碳原子与其它原子或原子团直接结合生成新的化合物的反应,叫做加成反应 。
6个原子共平面,平面型分子,键角120°
来自石油的基本化工原料——乙烯
分子式 碳碳键型
C=C双键中有一个键
不稳定,易断裂
乙烷 C2H6
乙烯 C2H4
C-C单键
C=C双键
键角
109º28ˊ
120°
键能(kJ/mol)
348
615
来自石油的基本化工原料——乙烯
4、化学性质 ——活泼
⑴ 氧化反应
①燃烧 ——火焰明亮,少量黒烟 CH2=CH2 + 3O2 点燃 2CO2 + 2H2O
19
来自石油的基本化工原料——乙烯
要想人前显贵,必得人后受罪。 世界原本就不是属于你,因此你用不着抛弃,要抛弃的是一切的执著。万物皆为我所用,但非我所属。 当你达到你的`梦想之前,他人对你的亵渎都是作为梦想所付出的代价,你必须接受它,不然,你的梦想都是单薄的。 如果不去加强并发展儿童的个人自尊感,就不能形成他的道德面貌。……教育技巧的全部诀窍就在于抓住儿童的这种上进心,这种道德上的自勉。 ——苏霍姆林斯基 生命的道路上永远没有捷径可言,只有脚踏实地走下去。 每一件事都要用多方面的角度来看它。 读书以过目成诵为能,最是不济事。 别人对你好,你要争气,图日后有能力有所报答,别人对你不好,你更要争气望有朝一日,能够扬眉吐气。 自然界没有风风雨雨,大地就不会春华秋实。 知道看人背后的是君子;知道背后看人的是小人。 你接受比抱怨还要好,对于不可改变的事实,你除了接受以外,没有更好的办法了。 成功永远属于马上行动的人。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Page
7
Hale Waihona Puke 答案返回二 乙烯的分子结构
Page
8
导学探究 按要求填空 CH2 =CH2
C2H4
Page
9
相关视频
答案
归纳总结
Page
11
活学活用 2.关于乙烯分子结构的描述错误的是( D ) A.乙烯的结构简式为CH2===CH2 B.乙烯是最简单的烯烃 C.乙烯分子中所有原子都在同一平面上 D.乙烯分子中所有原子都在一条直线上
石蜡油分解产物的实验探究 乙烯的分子结构 乙烯的化学性质
当堂检测 40分钟课时作业
Page 2
一 石蜡油分解产物的实验探究
Page
3
导学探究
1.按表中实验操作要求,完成实验并填写下表:
实验操作
B中溶液 紫红色褪去
实验现象 实验结论
C中溶液 红棕色褪去 D处点燃 火焰明亮且伴有黑烟
石蜡油分解的产物中含有不饱和烃
Page
27
答案
1
2
3
4
5
2.下列各反应中属于加成反应的是( C ) 点燃 A.CH2===CH2+3O2——→2CO2+2H2O 光照 B.H2+Cl2=====2HCl
催化剂 D.CH3—CH3+2Cl2 ——→ CH2Cl—CH2Cl+2HCl
C.相同质量的乙烯和甲烷完全燃烧后产生的水的质量相同
D.利用燃烧的方法可以鉴别乙烯和甲烷
Page
23
解析答案
学习小结 乙烯的性质 稍有气味水难溶,高锰酸钾溴反应。 现象相同理不同,前因氧化后加成。 加氧燃烧黑烟冒,聚合分子碳链增。
Page
25
返回
当堂检测
Page
26
1
2
3
4
5
1.下列关于乙烯的叙述中,不正确的是( D ) A.乙烯的化学性质比乙烷活泼 B.乙烯燃烧时火焰明亮,同时冒出黑烟 C.乙烯可作为香蕉等果实的催熟剂 D.乙烯双键中的一个键可以断裂,容易发生加成反应和取代反应
Page 4
答案
上述实验结果显示,石蜡油(烷烃)分解产物中有不同于烷烃的物质产生,
即烯烃。
因为烷烃 2.请说明上述实验石蜡油(烷烃)分解产物中含有烯烃的依据:_________ 不能使酸性高锰酸钾溶液或溴的四氯化碳溶液褪色,而烯烃可以 _____________________________________________________________ 。
生加成反应,请写出相关的化学方程式。
答案
催化剂 CH2===CH2+H2 ——→ CH3—CH3 △
催化剂 CH2===CH2+HCl ——→ CH3CH2Cl △
CH2===CH2+Cl2 ― →
催化剂 CH2===CH2+H2O——————→CH3CH2OH 加热、加压
Page 18
答案
(4)聚乙烯( CH2—CH2 )在日常生活中用途很广,是一种高分子化合物, 如用作食品保鲜膜、水管材料等。它是由乙烯分子在一定条件下相互加成 得到的,写出合成聚乙烯反应的化学方程式。
Page 15
相关视频
答案
2.乙烯的加成反应 原子 (1)加成反应:有机物分子中 双键(或三键) 两端的碳原子与其他 或原子团 结合生成 新的化合物 的反应叫加成反应。如将乙烯通入溴的四氯 化碳溶液(或用溴水代替)中,现象是 加成 1,2反应,生成了 -二溴乙烷。 溴的红棕色褪去 ,乙烯与溴发生了
Page
12
答案
返回
三 乙烯的化学性质
Page
13
导学探究 1.乙烯的氧化反应 (1)观察实验,记录现象。
实验 点燃乙烯 通入酸性高锰酸钾溶液
现象
火焰明亮,伴有黑烟,同时放出大量热 _____________________________________ 酸性高锰酸钾溶液褪色 _____________________
来自石油和煤的两种基本化工原料
乙
烯
Page
1
1.会写乙烯的分子式、结构式、结构简式、电子式,知道乙烯的结构特点,
学习目标定位
了解烯烃的概念。
2.知道乙烯能够发生氧化反应和加成反应。
3.知道乙烯发生加成反应时的断键和成键情况,会写乙烯与H2、HCl、Cl2、
H2O发生加成反应的化学方程式。
内容索引
一 二 三
气除去。
Page
20
答案
归纳总结
1.乙烯的氧化反应
明亮
黑烟
褪色
Page
21
答案
2.乙烯的加成反应
CH3-CH3
CH3CH2Cl
CH3CH2OH
Page
22
相关视频
答案
活学活用 3.下列说法中,错误的是( 内含有碳碳双键有关 )
A.无论乙烯与Br2的加成,还是乙烯使酸性KMnO4溶液褪色,都与分子 B.用溴的四氯化碳溶液或酸性KMnO4溶液都可以鉴别乙烯和乙烷
Page
14
答案
(2)写出乙烯燃烧的化学方程式。为什么甲烷燃烧没有黑烟,而乙烯燃 烧有较浓的黑烟? 点燃 答案 C2H4+3O2——→2CO2+2H2O,乙烯燃烧时有较浓的黑烟是因为乙
烯分子里含碳量(85.7%)比较大,未完全燃烧,产生碳的小颗粒造成的。
(3)乙烯可以作为水果的催熟剂,可以使生果实尽快成熟,但是用浸泡 过酸性高锰酸钾溶液的硅藻土与果实或花朵放在一起,可以延长果实 或花朵的成熟期,达到保鲜的目的。请解释其中的奥秘。 答案 乙烯能被酸性高锰酸钾溶液氧化。
答案
一定条件 nCH2===CH2————→ CH2—CH2
Page
19
答案
3.如何区分甲烷和乙烯?甲烷中有乙烯如何除去? 答案 乙烯能使酸性KMnO4溶液或溴水褪色,由此可区别甲烷(烷烃)和
乙烯(烯烃)。乙烯被酸性KMnO4溶液氧化的产物是 CO2,因此CH4中混
有乙烯时,不能用酸性高锰酸钾溶液除去(引入新的杂质),应用溴水洗
Page
16
相关视频
答案
(2)请设计实验验证乙烯通入溴水发生的是加成反应而不是取代反应。 写出该加成反应的化学方程式。
答案
通入乙烯之后溴水的酸性减弱,说明发生的不是取代反应;
CH2===CH2+Br2― →
Page
17
答案
(3) 乙烯除了与溴加成外,一定条件下还能与 H2 、 HCl 、 Cl2 、 H2O 等发
Page
5
答案
归纳总结
1.不饱和烃与烯烃 少于
CnH2n (n≥2)
2.乙烯是最简单的烯烃,它是一种 无 色、稍有气味、 难 溶于水的气
体。从石油中可以获得大量乙烯,乙烯的产量是衡量一个国家化工水
平的标志;它还是一种植物 生长调节剂
Page 6
。
答案
活学活用 1.下列物质属于不饱和烃的是( C ) A. C.CH2===CH—CH3 D.C8H18 B.
