【人教版】高中化学必修二:《乙烯》ppt课件
合集下载
人教版高中化学必修二课件:3.3乙烯 (共10张PPT)

冷凝回流
安全瓶
(3)如何检验乙醇和浓硫酸反应生成的二氧化碳、 二氧化硫、水蒸气?
澄清石灰水 品红溶液
A
B
溴水 无水硫酸铜粉末
C
D
D—B—C—B—A
小结:乙烯的实验室制法
硫酸乙醇三比一,反应温度一百七, 为防暴沸加瓷片,不生乙醚生乙烯。
气体的发生装置
固+固 →Δ 气
固+液 → 气
液+液 →Δ 气
补充:
一、乙烯的制法
(一)工业制法:分离石油裂解气
(二)实验室制法
1、反应原理:
乙醇和浓硫酸迅速加热到170 ℃制取乙烯
CH2—CH2 浓H2SO4
170
H
OH ℃
CH3CH2OH
浓H2SO4 170℃
CH2=CH2 ↑+ H2O CH2=CH2 ↑+ H2O
浓硫酸:催化剂、脱水剂
2、装置原理
CH3CH2OH
浓H2SO4 170℃
CH2=CH2 + H2O
思考:请设计一套实验室制取乙烯的装置?
(气体发生装置、收集装置)
液+液→△气(需控制温度)
170OC℃
收集方法:排水法
乙醇 浓硫酸
碎瓷片
液+液△→气 (需控制温度)
思 考:
(1)温度计的水银球应插在什么位置?为什么?
水银球放在溶液中控制溶液的温度在170℃,但不能接触瓶底。 否则测出的温度偏高且可能引起温度计水银球炸裂。
讨论:
(1)实验中有什么现象?为什么? 反应液的颜色加深,浓硫酸使乙醇炭化。 C+2H2SO4(浓)Δ==CO2↑+2SO2↑+2H2O
(2)气体如何净化?请设计一套乙烯的制取、净化、收集装置?
安全瓶
(3)如何检验乙醇和浓硫酸反应生成的二氧化碳、 二氧化硫、水蒸气?
澄清石灰水 品红溶液
A
B
溴水 无水硫酸铜粉末
C
D
D—B—C—B—A
小结:乙烯的实验室制法
硫酸乙醇三比一,反应温度一百七, 为防暴沸加瓷片,不生乙醚生乙烯。
气体的发生装置
固+固 →Δ 气
固+液 → 气
液+液 →Δ 气
补充:
一、乙烯的制法
(一)工业制法:分离石油裂解气
(二)实验室制法
1、反应原理:
乙醇和浓硫酸迅速加热到170 ℃制取乙烯
CH2—CH2 浓H2SO4
170
H
OH ℃
CH3CH2OH
浓H2SO4 170℃
CH2=CH2 ↑+ H2O CH2=CH2 ↑+ H2O
浓硫酸:催化剂、脱水剂
2、装置原理
CH3CH2OH
浓H2SO4 170℃
CH2=CH2 + H2O
思考:请设计一套实验室制取乙烯的装置?
(气体发生装置、收集装置)
液+液→△气(需控制温度)
170OC℃
收集方法:排水法
乙醇 浓硫酸
碎瓷片
液+液△→气 (需控制温度)
思 考:
(1)温度计的水银球应插在什么位置?为什么?
水银球放在溶液中控制溶液的温度在170℃,但不能接触瓶底。 否则测出的温度偏高且可能引起温度计水银球炸裂。
讨论:
(1)实验中有什么现象?为什么? 反应液的颜色加深,浓硫酸使乙醇炭化。 C+2H2SO4(浓)Δ==CO2↑+2SO2↑+2H2O
(2)气体如何净化?请设计一套乙烯的制取、净化、收集装置?
化学人教版(2019)必修第二册第七章第二节《 乙烯》(共25张ppt)

知识精讲
现象:溴水褪色
结论: CH2 CH2 + Br Br
CH2 CH2 Br Br
1,2-二溴乙烷
知识精讲
加成反应 概念:有机物中的不饱和碳原子与其他原子或原子 团直接结合生成新的化合物的反应。
特点:有上无下
知识精讲
【思考】请写出乙烯与H2O、 H2 、HCl 反应化学方程式。
CH2
CH2
的含碳量大于乙烷,燃烧时有黑烟产生 D.乙烯分子中因含有不饱和键,导致乙烯能使酸性KMnO4溶液和
溴的四氯化碳溶液褪色
对点训练
课堂练习
3.下列关于烯的说法错误的是(B )
A.结构简式为CH2=CH2 B.能与HCl反应生成氯乙烯 C.能使酸性KMnO4溶液褪色 D.可发生聚合反应生成聚乙烯
对点训练
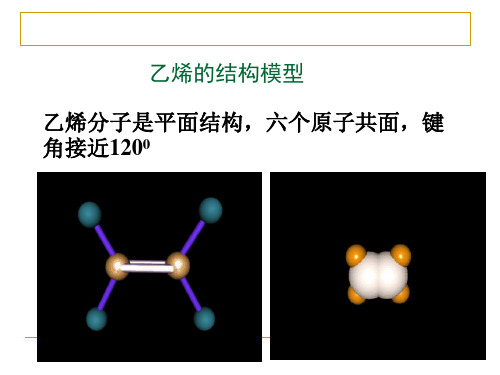
乙烯是一种无色、稍有气味的气体,密度比空气略 小,难溶于水。
分子式为C2H4
知识精讲
结构
结构式
平面型,所有原子共面;键角120°
CH2 CH2 结构简式
知识精讲
【思考】对比乙烯和乙烷结构式,它们之间有何异同?
相同点:1.两者都有碳、氢两种元素组成
2. 每个碳原子均形成4个共价键 3.每个分子中均含有C-H单键。 不同点:1.乙烷中含C-C单键,乙烯中含C=C双键
课堂练习
4.文献记载“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并
无涩味。”下列有关“气”的说法错误的是( D )
A.将该“气”通入溴水中,发生加成反应,溴水褪色且分层 B.将该“气”通入酸性KMnO4溶液中,发生氧化反应,溶液褪色 C.该“气”能作植物生长的调节剂,促进植物生长 D.常温下,将该“气”通入水中很快生成CH3CH2OH
高中化学(新人教版)必修第二册:乙烯【精品课件】

【课堂练习】
2. 下列说法错误的是(C)
A.无论是乙烯与Br2的加成反应,还是乙烯使酸性KMnO4溶液褪色,都与分子内含有 的碳碳双键有关 B.溴的四氯化碳溶液和酸性KMnO4溶液都可以鉴别乙烯和甲烷 C.相同质量的乙烯和甲烷完全燃烧后生成水的质量相同 D.乙烯的化学性质比乙烷的化学性质活泼
【课堂练习】
乙烯
学习目标 1、会写乙烯的分子式、结构式、结构简式、电子式。 2、知道乙烯能够发生氧化反应、加成反应、聚合反应。 3、理解加成反应的概念。
核心素养 1、微观探析:认识乙烯的组成、结构、性质和变化,形成“结构决定性质”的观念 2、证据推理:通过分析、推理认识乙烯发生加成反应时的断键和成键情况。
目录
二、乙烯的化学性质
1.氧化反应
(1)燃烧
点燃
CH2=CH2 + 3O2
2CO2 + 2H2O
现象:火分数较高,燃烧时碳并没有 完全被氧化,而本身被烧成炽热状态,故火焰明亮;又 由于一部分碳呈现游离态,所以有黑烟冒出。可以据此 检验乙烯和甲烷。
二、乙烯的化学性质
3.长途运输水果时,常常将浸泡有高锰酸钾溶液的硅土放置在盛放水果的容
器中,其目的是(C )
A.利用高锰酸钾溶液杀死水果周围的细菌,防止水果霉变 B.利用高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂 C.利用高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟 D.利用高锰酸钾溶液的氧化性,催熟水果
【课堂练习】
碳碳单键 C、H不全在一个平面内
2C2H6+7O2 ―点――燃→ 4CO2+6H2O C2H6+Cl2 ―光 ―→ C2H5Cl+HCl
不反应
碳碳双键 6个原子都在同一平面内
C2H4+3O2 ―点――燃→2CO2+2H2O CH2==CH2+Br2―→CH2BrCH2Br 因发生氧化反应而使其褪色
人教版高中化学必修二课件:3.2 乙烯(共28张PPT)

5、除去乙烷中混有的少量乙烯的方法,正确的 是( B ) A.通入氯气后进行光照 B.通入溴水 C.通入澄清的石灰水 D.点燃
6、1mol C2H4与Cl2完全加成,再与Cl2彻底取代, 两过程共用Cl2( ) C A.2 mol C.5mol B.4mol D.6mol
6.哪个有机物中碳原子都在同一平面内? A.CH3-CH=C-CH3 CH3
阅读课本 P 66 思考与交流有关内容
石油分馏中得到的石蜡油进一步加热会得 到什么?
科学探究
阅读课本P67
石蜡油分解实验
石蜡油的分解实验
① 石蜡油:17个C以 上的烷烃混合物 酸性:增强氧
化性。 ②碎瓷片:催化剂
③加热位置:碎瓷片 ④将生成气体通人酸性 高锰酸钾溶液中。
褪色,为什么? ⑤生成的气体通入溴的四氯化碳溶液褪色,为什么?
思考:该烯烃的双键在哪两个碳原子之间 只能是③④之间
1.工业上的乙烯主要来源于 石油化工 ,它是一 难 溶于水。 种 无 色、 稍有气味 味的气体,____ 实验室制取乙烯时用 排水 法收集。 2 .下列物质不可能是乙烯加成产物的是 (B ) A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
H2O 聚合
CH3—CH2Cl
CH3—CH2OH
[ CH2—CH2]n
?你能想出几种方法鉴别C H 和CH
2 4
4
1.分别点燃两种气体,燃烧时有黑烟的是乙烯 2.分别通入酸性高锰酸钾溶液中,能使溶液 褪色的是乙烯 3.分别通入溴水中,能使溴水褪色的是乙烯
知识小结(重点掌握)
一、乙烯的结构(平面型分子)
[ CH2—CH2 ]n
聚合反应:
nCH2=CH2
人教版高中化学必修2-乙烯(共33张PPT)

Br Br CH2CH2 1,2-二溴乙烷
——可用于鉴别或除杂。 Br Br (CH2BrCH2Br) 无色油状液体, 密度比水大,
不溶于水,易溶于CCl4 。
迁移应用
试写出乙烯与H2 、HCl 、H2O发生加成反应 的化学方程式。
催化剂
CH2=CH2 + H-H △
CH3-CH3 乙烷
催化剂
CH2=CH2 + H-Cl
石油裂解气: 主要成分是乙烯, 还含有丙烯、异丁 烯、甲烷、乙烷、 异丁烷、硫化氢和 碳的氧化物等。
一、乙烯的分子结构
分子式
C2H4
球棍模型
电子式
结构式 结构简式 CH2= CH2
CH2CH2
比例模型
空间构型: 平面型分子 6个原子共平面
( 键角约120° )
六个原子共面
约120°
约120°
约120°
研究表明,石蜡油分解的产物 主要是烯烃和烷烃的混合物
资料卡片 石油的裂化、裂解
催化剂
CC168HH3146
△
催化剂
C8CH81H8 16
△
C4H10 C4H10
催化剂
△
催化剂
△
CC8H4H1810++CC8H4H168 辛烷 辛烯
C4H10 + C4H8 丁烷 丁烯
C2H4 + C2H6 乙烯 乙烷 CH4 + C3H6 甲烷 丙烯
• 8、普通的教师告诉学生做什么,称职的教师向学生解释怎么做,出色的教师示范给学生,最优秀的教师激励学生。上午10时55分 53秒上午10时55分10:55:5324.3.4
实验 通入酸性高锰酸钾溶液中
人教版化学必修二第三章第二节《乙烯》乙烯 课件(共26张)

H H H C C H Br Br
1,2-二溴乙烷
有机物分子中双键或叁键两端的碳原子与其他原 子或原子团结合生成新的化合物的反应,叫做加成反应。
乙烯的化学性质
H H C
H C H
+ Br—Br
H H H C C H Br Br
取代反应
反应特点 归 属 断键规律 产物特点
取而代之,有进有出 烷烃的特征反应 C-H 断裂 一般为两种产物 产物复杂, 为混合物
乙烷
CH2ClCH2Cl
一定条件
1,2-二氯乙烷
CH3CH2Cl
氯乙烷
一定条件
CH3CH2OH
乙醇
04
结构与性质的关系
结构与性质的关系
01
为什么卤素单质与烷烃发生取代反应而与乙烯发生加成反应呢?
化学键 键参数 键长(10-10m) 1.33 1.54 1.09 键能(KJ/mol) 615 348 414
)
A.无论乙烯与Br2加成,还是乙烯使酸性KMnO4溶液褪色,都与分子内含有碳碳双键有关
B.用溴的四氯化碳溶液或酸性KMnO4溶液都可以鉴别乙烯和乙烷
C.相同质量的乙烯和甲烷完全燃烧后产生的水的质量相同
D.利用燃烧的方法可以鉴别乙烯和甲烷
【解析】乙烯分子中含有碳碳双键,决定了它的性质与甲烷、乙烷等烷烃的性质有所不同。乙烯的加成反应
【答案】 B
课堂小结
2.下列物质,不可能是乙烯的加成产物的是( A.CH3CH3 B.CH3CHCl2
)
C.CH3CH2OH
D.CH3CH2Br
【解析】乙烯加成是断开一个不饱和键,分别在双键两端的不饱和碳原子上连接一个原子或原子团,
如果去掉加上去的成分应恢复为乙烯的结构。
7.2 第1课时 乙烯 人教版(2019)高中化学必修第二册课件 (共18张PPT)

4.下列说法正确的是 ( C ) A.乙烯的电子式为 C.乙烯分子是空间平面结构
B.乙烯的球棍模型为 D.乙烯的结构简式为CH2CH2
➢ 第二节 乙烯与有机高分子材料
5.对比甲烷和乙烯的燃烧反应,下列叙述中正确的是( C ) A.二者燃烧时现象完全相同 B.点燃前都不需验纯 C.甲烷燃烧的火焰呈淡蓝色,乙烯燃烧的火焰较明亮 D.二者燃烧时都有黑烟生成
饱和
CH2=CH2 碳碳双键 不饱和
碳碳双键 使乙烯表 现出较活 泼的化学 性能
➢ 第二节 乙烯与有机高分子材料
二、乙烯的性质 1. 乙烯的物理性质
无色、气态、稍有气味、难溶于水、密度略小于空气
2. 乙烯的化学性质
(1)氧化反应
a. 燃烧
现象:火焰明亮,伴有黑烟,放出大量热
点燃
C2H4 + 3O2
➢ 第二节 乙烯与有机高分子材料
一、乙烯的组成、结构
分子式 电子式
结构式
C2H4
结构简式
空间构型
键角
CH2=CH2
平面形 所有原子共平面
120°
球棍模型材料
名称
乙烷和乙烯的结构比较 乙烷
乙烯
结构式
结构简式 碳碳键类别 碳原子价键是否饱和
CH3CH3 碳碳单键
➢ 第二节 乙烯与有机高分子材料
(2)加成反应 定义: 有机物分子中的不饱和碳原子与其他原子或原子团直接结合生成 新的化合物的反应。 特点: 断1加2,只进不出
+
➢ 第二节 乙烯与有机高分子材料
(2)加成反应 在一定条件下,乙烯也可以和Cl2、H2、HCl、水发生加成
(工业制乙醇的原理)
➢ 第二节 乙烯与有机高分子材料
人教版-必修二-化学乙烯课件ppt
1. 乙烯通入酸性高锰酸钾溶液—紫色退去 2. 通入溴的四氯化碳溶液—红棕色退去 3. 通入溴水—黄色退去 4. 能燃烧,发出明亮的火焰。
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
注意问题:
(1)浓硫酸:浓硫酸与乙醇的体积比为3:1 (2)对反应温度的要求:170℃以下及170 ℃以上不能 有效脱水,故必须迅速将温度升致170℃并保持恒温。 140 ℃时分子间脱水生成乙醚和水 170℃以上浓硫酸使乙醇脱水炭化
现象、 用途
CH2=CH2 +H-Cl →CH3CH2Cl
CH2=CH2
+
H-OH
催化剂 加热、加压
CH3CH2OH
加成反应:
有机物分子中双键或叁键两端的碳原子与其他原 子或原子团直接结合生成新的化合物的反应。
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
△
C2H5OH+2H2SO4(浓)==2C+2SO2↑+5H2O
△
C2H5OH+4H2SO4(浓)==2CO↑+4SO2↑+7H2O
△
C2H5OH+6H2SO4(浓)==2CO2↑+6SO2↑+9H2O
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
4、烯烃的命名
(1)在分子中含有多个双键时,选择满 足有尽可能多的双键的最长的碳链的为主 链,并命名为某烯; (2)从最靠近双键的这一端开始编号; (3)其它命名同烷烃。
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
注意问题:
(1)浓硫酸:浓硫酸与乙醇的体积比为3:1 (2)对反应温度的要求:170℃以下及170 ℃以上不能 有效脱水,故必须迅速将温度升致170℃并保持恒温。 140 ℃时分子间脱水生成乙醚和水 170℃以上浓硫酸使乙醇脱水炭化
现象、 用途
CH2=CH2 +H-Cl →CH3CH2Cl
CH2=CH2
+
H-OH
催化剂 加热、加压
CH3CH2OH
加成反应:
有机物分子中双键或叁键两端的碳原子与其他原 子或原子团直接结合生成新的化合物的反应。
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
△
C2H5OH+2H2SO4(浓)==2C+2SO2↑+5H2O
△
C2H5OH+4H2SO4(浓)==2CO↑+4SO2↑+7H2O
△
C2H5OH+6H2SO4(浓)==2CO2↑+6SO2↑+9H2O
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
4、烯烃的命名
(1)在分子中含有多个双键时,选择满 足有尽可能多的双键的最长的碳链的为主 链,并命名为某烯; (2)从最靠近双键的这一端开始编号; (3)其它命名同烷烃。
优质课高中化学人教版必修二3.2.1《乙烯》课件 (共35张PPT)

吨,同比增长10.4%。预计今年全国乙烯产
量将突破1500万吨。
尽管中国乙烯生产有很大的增长,但仍 不能满足下游产品的市场需求,进口量成倍
增长。
探究实验:石蜡油(17个C以上)分解实验 (1)加热分解石蜡油,观察现象; (2)将产生的气体分别通入溴的四氯化碳溶液、高锰 酸钾溶液,观察现象; (3)用排水集气法收集一试管气体,点燃观察燃烧的 情况
2、常见的烯烃 CH2=CH2 乙烯 CH2=CH-CH2CH3 1-丁烯 3、单烯烃的通式: CnH2n CH2=CH-CH3 丙烯 CH3-CH=CH-CH3 2-丁烯 (n≥2)
巩固练习: 1.可以用来鉴别甲烷和乙烯,还可以用来除 去甲烷中乙烯的操作方法是( B ) A.将混合气体通过盛有硫酸的洗气瓶 B.将混合气体通过盛有足量溴水的洗气瓶 C.将混合气体通过盛有水的洗气瓶 D.将混合气体通过盛有澄清石灰水的洗气瓶
四、乙烯的化学性质 1.氧化反应 (1) 燃烧
放出大量热,燃烧时火焰 明亮,并产生黑烟.
点燃
C2H4+3O2 → 2CO2+2H2O
(2)被酸性高锰酸钾氧化: 实验探究:将乙烯和甲烷分别通入酸性高锰酸钾溶液.
现象:乙烯使酸性高 锰酸钾褪色。 甲烷不能使酸 性高锰酸钾褪色。
结论:常温下乙烯易被 氧化剂氧化。如将乙 烯通入酸性KMnO4溶 液,溶液的紫色褪去, 由此可用于鉴别乙烯 和甲烷。
乙烯分子内碳碳双键的键能(615KJ/mol)小于碳 碳单键键能(348KJ/mol)的二倍,说明其中有一 条碳碳键键能小,容易断裂。
乙烯
溴分子
1,2-二溴乙烷
2. 加成反应: 有机物分子中双键或三键两端的碳原子与其 它原子或原子团直接结合生成新的化合物的反
量将突破1500万吨。
尽管中国乙烯生产有很大的增长,但仍 不能满足下游产品的市场需求,进口量成倍
增长。
探究实验:石蜡油(17个C以上)分解实验 (1)加热分解石蜡油,观察现象; (2)将产生的气体分别通入溴的四氯化碳溶液、高锰 酸钾溶液,观察现象; (3)用排水集气法收集一试管气体,点燃观察燃烧的 情况
2、常见的烯烃 CH2=CH2 乙烯 CH2=CH-CH2CH3 1-丁烯 3、单烯烃的通式: CnH2n CH2=CH-CH3 丙烯 CH3-CH=CH-CH3 2-丁烯 (n≥2)
巩固练习: 1.可以用来鉴别甲烷和乙烯,还可以用来除 去甲烷中乙烯的操作方法是( B ) A.将混合气体通过盛有硫酸的洗气瓶 B.将混合气体通过盛有足量溴水的洗气瓶 C.将混合气体通过盛有水的洗气瓶 D.将混合气体通过盛有澄清石灰水的洗气瓶
四、乙烯的化学性质 1.氧化反应 (1) 燃烧
放出大量热,燃烧时火焰 明亮,并产生黑烟.
点燃
C2H4+3O2 → 2CO2+2H2O
(2)被酸性高锰酸钾氧化: 实验探究:将乙烯和甲烷分别通入酸性高锰酸钾溶液.
现象:乙烯使酸性高 锰酸钾褪色。 甲烷不能使酸 性高锰酸钾褪色。
结论:常温下乙烯易被 氧化剂氧化。如将乙 烯通入酸性KMnO4溶 液,溶液的紫色褪去, 由此可用于鉴别乙烯 和甲烷。
乙烯分子内碳碳双键的键能(615KJ/mol)小于碳 碳单键键能(348KJ/mol)的二倍,说明其中有一 条碳碳键键能小,容易断裂。
乙烯
溴分子
1,2-二溴乙烷
2. 加成反应: 有机物分子中双键或三键两端的碳原子与其 它原子或原子团直接结合生成新的化合物的反
高一化学1《乙烯》课件(新人教版必修2)

液褪色的气体有 ( C )
A. CO C. C2H4
B. CO2 D. C2H6
4. 乙烯发生的下列反应中,不属于加成反应 的是 ( D )
A. 与氢气反应生成乙烷 B. 与水反应生成乙醇 C. 与溴水反应使之褪色 D. 与氧气反应生成二氧化碳和水
例题选讲:
[例1]某气态烃在密闭容器中与氧气混合,用电火 花点燃,完全燃烧前后容器内压强保持不变(温 度为120℃),则该烃为( AC)
3. 聚合反应
催化剂
nCH2=CH2
[ CH2- CH2 ]n
定义:由相对分子质量小的化合物分子互 相结合成相对分子质量大的高分子的反应 叫做聚合反应
在聚合反应中,由不饱和的相对分子质量 小的化合物分子结合成相对分子质量大的 化合物的分子,这样的聚合反应同时也是加 成反应,所以这种聚合反应又叫做加成聚合 反应,简称加聚反应.
4、能否用排空法收集乙烯? 不能,因为乙烯的密度与空气的密度接近。
5பைடு நூலகம்实验结束是先撤酒精灯还是先撤导管? 先撤导管,防止倒吸。
6、加热过程中混合液颜色如何变化?
溶液由无色变成棕色最后变成黑色。
原因是浓硫酸使酒精脱水碳化
△
2H2SO4+C2H5OH
2SO2↑+2C+5H2O
7、加热时间过长,还会产生有刺激性气味的气体, 为什么?
1、关于乙烯分子结构的说法中,错误的是
(C)
A.乙烯分子里含有C=C双键;
B.乙烯分子里所有的原子共平面;
C.乙烯分子中C=C双键的键长和乙烷分 子中C-C单键的键长相等。
D.乙烯分子里各共价键之间的夹角为 120。
2、除去乙烷中混有的少量乙烯的方法,正确
A. CO C. C2H4
B. CO2 D. C2H6
4. 乙烯发生的下列反应中,不属于加成反应 的是 ( D )
A. 与氢气反应生成乙烷 B. 与水反应生成乙醇 C. 与溴水反应使之褪色 D. 与氧气反应生成二氧化碳和水
例题选讲:
[例1]某气态烃在密闭容器中与氧气混合,用电火 花点燃,完全燃烧前后容器内压强保持不变(温 度为120℃),则该烃为( AC)
3. 聚合反应
催化剂
nCH2=CH2
[ CH2- CH2 ]n
定义:由相对分子质量小的化合物分子互 相结合成相对分子质量大的高分子的反应 叫做聚合反应
在聚合反应中,由不饱和的相对分子质量 小的化合物分子结合成相对分子质量大的 化合物的分子,这样的聚合反应同时也是加 成反应,所以这种聚合反应又叫做加成聚合 反应,简称加聚反应.
4、能否用排空法收集乙烯? 不能,因为乙烯的密度与空气的密度接近。
5பைடு நூலகம்实验结束是先撤酒精灯还是先撤导管? 先撤导管,防止倒吸。
6、加热过程中混合液颜色如何变化?
溶液由无色变成棕色最后变成黑色。
原因是浓硫酸使酒精脱水碳化
△
2H2SO4+C2H5OH
2SO2↑+2C+5H2O
7、加热时间过长,还会产生有刺激性气味的气体, 为什么?
1、关于乙烯分子结构的说法中,错误的是
(C)
A.乙烯分子里含有C=C双键;
B.乙烯分子里所有的原子共平面;
C.乙烯分子中C=C双键的键长和乙烷分 子中C-C单键的键长相等。
D.乙烯分子里各共价键之间的夹角为 120。
2、除去乙烷中混有的少量乙烯的方法,正确
3.2.1 乙烯-同步精品课件(人教版必修2)(共30张PPT)

二、乙烯的性质
2、化学性质: 氧化反应
①燃烧
二、乙烯的性质
2、化学性质: 氧化反应
①燃烧 CH 2 CH 2 2O2 点燃2CO2 2H 2O
现象:火焰明亮并伴有黒烟
思考:为何火焰颜色会明亮?并伴有黑烟?
火焰明亮是碳微粒受 灼热而发光
含碳量高,燃烧不充分
二、乙烯的性质
2、化学性质: 氧化反应
2.所属类别——混合物(常温下呈液态,无固定沸点)
3.石油的用途:从石油中不仅可以得到多种常用燃料,而且可以从中获
得大量的基本化工原料,其中,从石油中获得乙烯,已成为生产乙烯的
主要途径。
乙烯的产量是衡量一个国家
石油化工发展水平的重要标志
科学探究 石蜡油的分解实验
科学探究 石蜡油的分解实验
实验现象:
2、化学性质: 加成反应
二、乙烯的性质
2、化学性质: 加成反应
1,2-二溴乙烷
反应实质:乙烯分子中的碳碳双键断开一个, 2个Br分别直接与2个价键
不饱和的C结合。
碳碳双健中两个化学键的 强度不同
用结构简式表示
归纳小结
加成反应:有机物分子里不饱和的碳原子(双键或三键)与其它原子或 原子团直接结合生成新的物质的反应。
A. 与氢气反应生成乙烷 B. 与水反应生成乙醇 C.与溴水反应使之褪色 D.与氧气反应生成二氧化碳和水
随堂练习
10.四氯乙烯对环境有一定的危害,干洗衣服的干洗剂主要成分是四氯乙烯;家用 不粘锅内侧涂覆物质的主要成分是聚四氟乙烯。下列关于四氯乙烯和聚四氟乙烯的
叙述中正确的是( ) C
A、它们都属于纯净物 B、它们都能使酸性高锰酸钾溶液褪色 C、它们的分子中都不含氢原子 D、它们都可由乙烯只发生加成反应得到
人教版高中化学必修二课件:第3章 第2节 第1课时乙烯 (共29张PPT)

-18-
第1课时 乙烯
探究一
探究二
首页
课前篇 自主预习
课课堂堂篇篇 探探究究学学习习
随堂演练
解析除杂时要注意不能引入新杂质。此题为气体除杂,应用洗气 装置,通过反应除掉杂质气体。A选项,两种气体都不能与水反应且 无明显现象,不正确;B选项,乙烷不与溴水反应,乙烯与溴水发生加 成反应,使溴水褪色,所以可以鉴别出来,并且通过洗气瓶时乙烯留 在溶液里生成CH2BrCH2Br,正确;C选项,乙烷不与H2反应,乙烯与H2 可在催化剂Ni的作用下反应生成乙烷,并不是简单的混合就可以反 应,而且会引入H2杂质气体,不正确;D中,乙烷不与酸性高锰酸钾溶 液反应,乙烯能使酸性高锰酸钾溶液褪色,所以可以用来鉴别乙烷 和乙烯,但乙烯被酸性高锰酸钾溶液氧化时有CO2生成,会引入新的 杂质,不正确。
随堂演练
-4-
第1课时 乙烯
知识铺垫
新知预习
自主预测
二、乙烯的性质和用途 1.乙烯的物理性质 颜色 状态 气味 无色 气体 稍有气味
2.乙烯的化学性质 (1)氧化探究学习
随堂演练
水溶性 难溶于水
密度 比空气略小
-5-
第1课时 乙烯
首页
课前篇 自主预习
课堂篇 探究学习
-11-
第1课时 乙烯
探究一
探究二
首页
课前篇 自主预习
课课堂堂篇篇 探探究究学学习习
随堂演练
乙烯的结构和性质
问题探究
1.乙烯的空间构型是什么?其键角为多少?
答案平面结构;键角为120°。
2.
分子中所有原子共平面吗?
答案乙烯中的一个氢原子被氯原子取代,所有原子共平面。
3.能用溴的CCl4溶液除去乙烷中的乙烯吗? 答案不能。因为乙烷能溶于CCl4中。
【人教版】高中化学必修二:3.2.1《乙烯》pptx课件

第23页
RJ版·化学·必修2
45分钟作业与单元评估
二合一
课基堂础训练练习
限时:20 分钟
总分:60 分
第三章 第二节 第1课时
第24页
RJ版·化学·必修2
45分钟作业与单元评估
二合一
1.下列有关乙烯的说法,其中错误的是( ) A. 乙烯分子的双键中有一个键较易断裂 B. 乙烯分子里所有原子都在同一个平面上,且碳氢键之间 的键角约为 120° C. 乙烯的化学性质比乙烷活泼
45分钟作业与单元评估
二合一
4.(1)①明亮且伴有黑烟 C2H4+3O2―点―燃→2CO2+2H2O
②紫色 (2)①有机物分子中双键(或三键)两端的碳原子与其他
原子或原子团直接结合生成新的化合物 ②1,2-二溴乙烷
③CH2 CH=2=+△==H=2Ni CH3CH3
CH2 CH2+=H=△=C=l=催化剂 CH3CH2Cl( 制 氯 乙 烷 )
第三章 第二节 第1课时
第30页
RJ版·化学·必修2
45分钟作业与单元评估
7.由乙烯推测丙烯的结构或性质正确的是( ) A.分子中 3 个碳原子在同一条直线上 B.分子中所有原子都在同一平面上 C.能使溴的四氯化碳溶液褪色 D.与 HCl 加成只生成一种产物
二合一
第三章 第二节 第1课时
第31页
RJ版·化学·必修2
第三章 第二节 第1课时
第14页
RJ版·化学·必修2
45分钟作业与单元评估源自二合一(2)乙烯的加成反应: ①加成反应:_____________________________________ _________________________________的反应叫做加成反应。 ②乙烯能使溴的四氯化碳溶液的红棕色褪去,也能使溴水 的橙色褪去,生成无色的________。化学方程式为:__________ ___________________________________________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
④模型图:
⑤分子结构特点:a. 乙烯是________结构,所有原子处于 ________ 。 b. 碳 原 子 间 以 ________ 结 合 , 其 中 有 一 个 键 ________。c. 碳氢键夹角________。
3.乙烯的物理性质 通常状况下,乙烯是________颜色、________气味的气体。 在标准状况下密度为 1.25 g/L,比空气________,________于 水,________于四氯化碳等有机溶剂。
注意:为制得纯净的氯乙烷,应用乙烯与 HCl 的加成反应 而不宜用乙烷与 Cl2 的取代反应。因为乙烯与 HCl 加成产物只 有一种,而乙烷与 Cl2 的取代产物是多种氯代烃的混合物。
(3)乙烯的加聚反应: 在适当温度、压强和有催化剂存在的情况下,乙烯双键里 的一个键会断裂,分子里的碳原子能互相结合成为很长的链, 生成聚乙烯。 ______________________________________________________
5.调节剂 催熟剂
课基堂础训练练习
限时:20 分钟
总分:60 分
1.下列有关乙烯的说法,其中错误的是( ) A. 乙烯分子的双键中有一个键较易断裂 B. 乙烯分子里所有原子都在同一个平面上,且碳氢键之间 的键角约为 120° C. 乙烯的化学性质比乙烷活泼
实验 操作
现象 实验结论
B 中溶液紫色________ C 中溶液红棕色________ D 处点燃火焰________并伴 有________ 石蜡油分解的产物中含有不 饱和烃
2. 乙烯的结构 乙烯的分子结构 ①分子式:________________________________________ ②电子式:________________________________________ ③结构式:_________________________________________ (结构简式:______________________________________)
4.乙烯的化学性质 与分子中只含碳碳单键的烷烃相比,碳碳双键的存在使乙 烯与酸性高锰酸钾溶液、溴的四氯化碳溶液均能发生化学反应, 表现出较活泼的化学性质。
(1)乙烯的氧化反应: ①乙烯的燃烧:乙烯在空气或氧气中燃烧,火焰________, 同时放出大量的热。化学方程式为:______________________ ___________________________________________________。 注意:a.乙烯是可燃性气体,所以点燃乙烯前要验纯。b. 乙烯燃烧时火焰明亮,但与甲烷燃烧时相比有更大的黑烟,这 是因为乙烯的含碳量比较大,未完全燃烧,产生碳的小颗粒而 造成的。
第三章 有机化合物
第二节 来自石油和煤的两种基本化工原料
第1课时 乙烯
课
课ቤተ መጻሕፍቲ ባይዱ
课
前
堂
后
预
练
作
习
习
业
课基前础训预练习
一、烯烃 1 . 概 念 : 分 子 中 含 有 一 个 ________ 的 链 烃 , 如 乙 烯 (CH2===CH2)。 2.通式:________。
二、乙烯 1.烯烃的工业制取原理的实验
注意:a.证明乙烯与 Br2 发生的反应是加成反应而不是取代 反应的方法是滴加 AgNO3 溶液或测溶液的 pH。b.利用乙烯能 使溴水褪色而甲烷(烷烃)不能使溴水褪色,既可以区别乙烯和 甲烷(烷烃),也可以除去甲烷(烷烃)中混有的乙烯气体,以提纯 甲烷(烷烃)。
③在一定条件下,乙烯还可以与 H2、HCl、Cl2、H2O 等物 质发生加成反应。反应的化学方程式为: ______________________________________________________ ______________________________________________________ ______________________________________________________ ______________________________________________________ ______________________________________________________
2. C2H4 平面 同一平面 双键 不稳定 120°
3.没有 稍有 略小 难溶 易溶
CH2===CH2
4.(1)①明亮且伴有黑烟 C2H4+3O2―点―燃→2CO2+2H2O ②紫色 (2)①有机物分子中双键(或三键)两端的碳原子与其他 原子或原子团直接结合生成新的化合物 ②1,2-二溴乙烷
③CH2 CH=2=+△==H=2Ni CH3CH3 CH2 CH2+=H=△=C=l=催化剂 CH3CH2Cl( 制 氯 乙 烷 ) CH2 CH2+Cl2―→=C=H==2C=lCH2Cl CH2 CH2 + H2O 催――化→剂 CH3CH2OH(制乙醇) (3)nCH2CH=2=催==化=剂 CH2—CH2
②乙烯能被酸性高锰酸钾溶液氧化,而使酸性高锰酸钾溶 液的________褪去。
注意:a.利用该性质可区别 CH4(烷烃)和 C2H4(烯烃)。b. 乙烯被酸性高锰酸钾氧化的产物是 CO2,因此 CH4 中混有 C2H4 时,不能用酸性高锰酸钾溶液来除去。
(2)乙烯的加成反应: ①加成反应:_____________________________________ _________________________________的反应叫做加成反应。 ②乙烯能使溴的四氯化碳溶液的红棕色褪去,也能使溴水 的橙色褪去,生成无色的________。化学方程式为:__________ ___________________________________________________。
5.乙烯的用途 乙烯是一种重要的基本化工原料,主要用于制塑料、合成 纤维、有机溶剂等,其产量可以用来衡量一个国家的石油化工 发 展水 平。 此外, 乙烯 还可 用作 植物生 长 ________ 和 水果 ________。
课前预习 一、1.碳碳双键 H2n(n≥2) 二、1.褪去 褪去 明亮 黑烟
