酵母基因克隆与表达载体
酵母菌表面展示操作步骤之基因重组和构建

酵母菌表面展示操作步骤之基因重组和构建酵母菌表面展示是一种常用的蛋白质表达和展示技术,可以用于各种研究和应用领域。
其中,基因重组和构建是实施酵母菌表面展示的关键步骤之一。
本文将详细介绍酵母菌表面展示操作中的基因重组和构建步骤。
一、基因重组和构建的原理基因重组和构建是指将目标蛋白质的基因序列插入到酵母菌表面展示载体上,使其能够被酵母菌表面展示。
这一步骤包括以下几个关键的操作过程:1. 寻找合适的表达载体:根据目标蛋白质的特性和需要展示的表面酵素活性,选择合适的表达载体。
常用的载体包括pYD1、pCTCON2等。
2. 提取目标基因:从目标蛋白质的源菌中提取基因序列,通过PCR扩增获得目标基因片段。
3. 消化酵母菌表面展示载体:使用限制性内切酶对表达载体进行切割,以产生适当的限制性内切片段。
4. 连接目标基因和载体:将目标基因片段与切割后的载体通过DNA连接酶进行连接。
连接时需确保目标基因与载体之间的方向一致,以便正确表达。
5. 转化酵母菌:将连接好的重组载体转化到酵母菌中,可使用化学转化或电穿孔法。
二、基因重组和构建的操作步骤下面将具体介绍酵母菌表面展示操作中的基因重组和构建步骤:1. 寻找合适的表达载体根据实验需求选择合适的表达载体。
常用的表达载体包括pYD1、pCTCON2等。
根据需要选择合适的酵母菌,如酿酒酵母(Saccharomyces cerevisiae)或表面展示酵母(Pichia pastoris)。
2. 提取目标基因从目标蛋白质的源菌中提取基因序列,可以通过细菌基因组DNA提取试剂盒等常用试剂盒进行提取。
提取后,使用PCR扩增获得目标基因片段。
3. 消化酵母菌表面展示载体将所选择的表达载体进行消化,使用适当的限制性内切酶切割载体。
消化后的载体含有适当的限制性内切片段,以便与目标基因连接。
4. 连接目标基因和载体将目标基因片段与切割后的载体进行连接,可采用DNA连接试剂盒等常用试剂盒进行连接。
克隆载体与表达载体
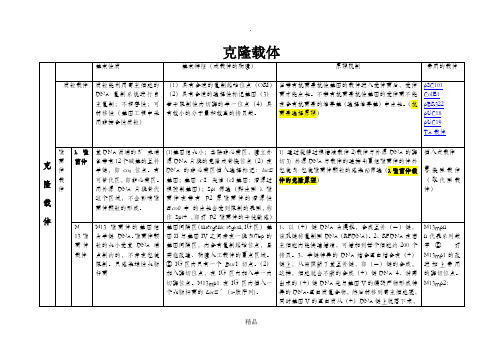
染色体具有复制功能,利用染色体的复制元件来驱动外源DNA片段复制的载体称为人工染色体载体
其装载外源DNA的容量比质粒、噬菌体和噬菌体-质粒杂合载体等有很大的拓展,甚至可以跟染色体的大小相媲美。
人工染色体载体拷贝数少,制备困难,通常采取“穿梭载体”的策略来解决
含有质粒载体所必备的第一受体(大肠杆菌)质粒复制起始位点,这样的载体在大肠杆菌内可以按质粒复制形式进行高拷贝复制,含有第二受体(如酵母)端粒(TEL)、DNA复制起始位点(ARS)和着丝粒(CEN)以及合适的选择标记。载体在体外与目的DNA重组后转化到第二受体细胞,按照染色体复制的形式进行复制和传递。筛选第一受体的克隆子一般采用抗生素抗性选择标记;筛选第二受体的克隆子常用与受体互补的营养缺陷型。
克隆载体
基本性质
基本特征(或载体的构建)
原理机制
常用的载体
克隆载体
质粒载体
质粒能利用寄主细胞的DNA复制系统进行自主复制;不相容性;可转移性(基因工程中采用非接合性质粒)
(1)具有合适的复制起始位点(ORI)(2)具有合适的选择性标记基因(3)若干限制性内切酶的单一位点(4)具有较小的分子量和较高的拷贝数。
M13噬菌体产生单双链DNA的机制)
LacZ’ 5’端的第13个核苷酸G突变成A,产生了一个EcoR I切点
一类人工构建的含有λ-DNA cos序列和质粒复制子的的特殊类型载体。能像l-DNA那样进行体外包装,并高效转染受体细胞;能像质粒那样在受体细胞中自主复制具有较高容量的克隆能力:45kb;具有与同源性序列的质粒进行重组的能力
当带有抗菌素抗性基因的载体进入受体菌后,受体菌才能生长。不带有抗菌素抗性基因的受体菌不能在含有抗菌素的培养基(选择培养基)中生长。(抗菌素选择原理)
酵母文库构建原理

酵母文库构建原理
酵母文库构建原理是指利用酵母作为表达载体构建基因文库的方法。
酵母文库是由数百万个基因克隆所组成的DNA资源库,可以用来研究基因功能、蛋白质相互作用等生物学问题。
酵母文库的构建过程包括以下几个步骤:
1. 酵母基因组DNA的提取和片段化:从酵母细胞中提取总DNA 并用限制酶酶切,获得大小为数千到数万碱基对的DNA片段。
2. DNA片段的连接到载体上:将上述DNA片段与载体(如质粒或噬菌体)上的兼容酶切位点配对后用DNA连接酶连接,形成重组DNA分子。
3. 重组DNA分子的转化到酵母细胞中:将上述重组DNA分子转化到酵母细胞中,使其在细胞内复制并表达。
4. 筛选目标基因:通过筛选、鉴定,找到目标基因的克隆,进而研究其功能和调节机制。
总之,酵母文库构建原理充分利用了酵母细胞在基因工程中的独特优势,为研究基因功能、蛋白质相互作用等提供了有效的手段。
- 1 -。
第七章 酵母基因工程

Dividing Saccharomyces cerevisiae (baker’s yeast) cells
一. 酵母克隆载体
① 能在E.coli中克隆和扩增。 Ori ②有大肠杆菌的选择标记 Ampr、Tetr。 ③ 有酵母的选择标记 Leu2+、His+、Ura3+、Trp1+;
如pYF92:
pBR322 2m 酵母his 3+
2m质粒: 酿酒酵母的内源质粒,长度是2m 。含有自主 复制起始区ori和STB序列(使质粒在供体中维 持稳定)。
特点:
①很高的转化活性(103-105转化子/微克 DNA). ②拷贝数多(25-100分子/细胞)。 ③比YRp稳定。
YEp24
亮氨酸lue2—β-异丙基苹果酸脱 氢酶
• 该酶是把丙酮酸转化成亮氨酸的代谢酶之 一.只要使用亮氨酸lue2突变的营养缺陷型 酵母作受体,载体上带有亮氨酸lue2基因就 能在不含亮氨酸的培养基上实现转化克隆 的筛选(书170页图).
四. 酵母表达系统的特点
(1)优点 ①对其遗传学和生理学的研究比较深入。 ②小量培养和大规模反应器中都能生长。 ③已经分离出很强的启动子。 ④有翻译后的加工。 ⑤本身自然分泌很少,便于胞外蛋白的纯 化。 ⑥安全性高(FDA确认的安全生物),不 需要宿主的安全性检验。
④不稳定,容易丢失。
(3)着丝粒质粒(YCp) 在YRp质粒中插入酵母染色体的着丝粒 区。 YRp质粒 酵母着丝粒 特点: ①行为像染色体,能稳定遗传。 ②单拷贝存在。
③不易从细胞中提取。
(4)附加体型载体(YEp) 由大肠杆菌质粒、2m质粒及酵母染色体 DNA选择标记构成。 大肠杆菌质粒 2m质粒 酵母选择标记
酵母单杂交步骤

酵母单杂交步骤酵母单杂交是一种常用的遗传实验方法,通过将两个不同的酵母株进行杂交,可以研究它们的基因互作关系。
本文将详细介绍酵母单杂交的步骤。
一、准备工作1.选择合适的酵母株:选择两个不同的酵母株,一个为“诱饵”(bait)株,另一个为“猎物”(prey)株。
这两个株系需要有明显的表型差异,以便于筛选出杂交后产生的重组子代。
2.构建诱饵和猎物表达载体:将目标基因克隆到表达载体中,使其能够在酵母细胞中表达。
其中诱饵表达载体需要加入转录激活域(transcription activation domain),而猎物表达载体则需要加入DNA结合域(DNA binding domain)。
3.筛选适当的培养基:选择适当的培养基来培养诱饵和猎物细胞,并且要添加相应抗生素以确保只有带有目标表达载体的细胞能够生长。
二、进行单杂交实验1.将诱饵和猎物细胞分别培养到对数生长期,并收集细胞。
2.将诱饵和猎物细胞混合在一起,并进行共同培养。
在共同培养的过程中,两种细胞会发生杂交,形成重组子代。
3.收集重组子代,并进行筛选。
可以使用选择性培养基来筛选出带有目标表达载体的重组子代,进一步筛选出具有表型差异的重组子代。
4.验证重组子代中目标基因的相互作用关系。
可以使用多种方法来验证,如β-galactosidase报告基因检测、荧光素酶报告基因检测等。
三、结果分析通过对单杂交实验结果进行分析,可以得到两个不同酵母株之间的相互作用关系图谱。
这些相互作用关系图谱可以用于预测蛋白质相互作用网络,并进一步研究这些蛋白质在细胞内的功能和调控机制。
总结:酵母单杂交是一种常用的遗传实验方法,通过将两个不同的酵母株进行杂交,可以研究它们的基因互作关系。
该实验步骤包括准备工作、进行单杂交实验和结果分析。
在进行单杂交实验时,需要注意选择合适的酵母株、构建表达载体和筛选适当的培养基。
通过对单杂交实验结果进行分析,可以得到两个不同酵母株之间的相互作用关系图谱,为研究蛋白质相互作用网络提供了基础。
毕赤酵母常用培养基与载体

毕赤酵母常用培养基与载体一、毕赤酵母表达常用载体:典型的巴斯德毕赤酵母表达载体载体包含醇氧化酶-1(AOX1)基因的启动子和转录终止子(5'AOX1和3'AOX1),它们被多克隆位点(MCS)分开,外源基因可以在此插入。
此载体还包含组氨醇脱氢酶基因(HIS4)选择标记及3'AOX1区。
当整合型载体转化受体时,它的5'AOX1和3'AOX1能与染色体上的同源基因重组,从而使整个载体连同外源基因插入到受体染色体上,外源基因在5'AOX1启动子控制下表达。
毕赤酵母本身不分泌内源蛋白,而外源蛋白的分泌需要具有引导分泌的信号序列。
而由89个氨基酸组成的酿酒酵母的分泌信号—α交配因子(α-factor)引导序列已经成功地引导了几种外源蛋白的分泌。
分泌表达载体主要有:pPIC9,pPIC9K,pHIL-S1,pPICZα A,pYAM75P等。
胞内表达载体主要有:pHIL-D2,pA0815,pPIC3K,pPICZ,pHWO10,pGAPZ,pGAPZa(Invitrogen),pPIC3.5K等。
工程菌株Y11430,MG1003,GS115 (AOX1),KM71,SMD1168。
毕赤酵母宿主菌常用的有GS115和KM71两种,都具有HIS4营养缺陷标记。
其中,GS115茵株具有AOX1基因,是Mut+,即甲醇利用正常型;而KM71菌株的AOX1位点彼ARG4基因插入,表型为Muts,即甲醇利用缓慢型,两种菌株都适用于一般的酵母转化方法。
多拷贝表达菌株的获得方式:与自主复制的质粒型表达载体不同,整合型表达载体的拷贝数可以有很大的变化。
含多拷贝外源基因的表达菌株合成蛋白的量也较多。
体内整合可通过高遗传霉素抗性,筛选可能的多拷贝插入;而体外整合可通过连接产生外源基因的串联插入。
多拷贝表达菌株的获得方式有两种:一种是利用SDS-PAGE 电泳、免疫杂交或菌落点杂交方法在大量的转化子中进行自然筛选。
表达质粒和克隆质粒

表达质粒和克隆质粒
质粒是一种小型的DNA分子,通常存在于细菌和酵母等单细胞生物中。
质粒可以自主复制,也可以被细胞复制。
质粒通常含有一些有用的基因,如抗生素抗性基因、荧光蛋白基因等,这些基因可以被用于基因工程和生物技术研究中。
克隆质粒是一种特殊的质粒,它们被用于克隆DNA序列。
克隆质粒通常含有一些特殊的序列,如限制性内切酶切割位点和选择标记基因等。
通过将目标DNA序列插入到克隆质粒中,可以实现DNA 的克隆和扩增。
在克隆质粒的制备过程中,首先需要选择一个合适的质粒载体。
常用的质粒载体有pUC19、pBR322、pGEM-T等。
这些质粒载体都含有一些常用的限制性内切酶切割位点和选择标记基因,可以方便地进行DNA克隆和筛选。
接下来,需要将目标DNA序列插入到质粒载体中。
这可以通过PCR扩增、限制性内切酶切割和连接等方法实现。
插入DNA序列的长度通常不超过质粒载体的限制性内切酶切割位点之间的距离。
需要将克隆质粒转化到宿主细胞中。
常用的宿主细胞有大肠杆菌、酵母等。
转化后,可以通过选择标记基因的筛选来筛选出含有目标DNA序列的克隆质粒。
质粒和克隆质粒在基因工程和生物技术研究中扮演着重要的角色。
通过对质粒和克隆质粒的研究,可以更好地理解DNA的结构和功能,也可以为生物技术的发展提供有力的支持。
酵母表达体系构建

酵母表达体系构建酵母表达体系是一种常用的基因表达系统,可以用于生产重组蛋白质、疫苗、抗体等生物制品。
构建酵母表达体系需要选择合适的酵母菌种、载体、目的基因以及必要的宿主细胞,并通过基因克隆、转化、筛选等一系列步骤实现。
本文将详细介绍酵母表达体系的构建过程。
一、选择酵母菌种和载体1.酵母菌种选择:根据需要表达的蛋白质的种类和性质,选择适合的酵母菌种。
常用的酵母菌种有Saccharomyces cerevisiae(酿酒酵母)、Pichia pastoris(毕赤酵母)等。
2.载体选择:载体是携带目的基因进入宿主细胞的必要元件,常用的载体包括质粒、整合型载体和噬菌体载体等。
在构建酵母表达体系时,应根据目的基因的性质和表达量要求选择合适的载体。
二、目的基因的克隆和鉴定1.基因克隆:将目的基因插入到载体中,形成重组DNA分子。
可以通过PCR、基因文库等方法获取目的基因,也可以从基因组或cDNA文库中筛选出目的基因。
2.转化宿主细胞:将重组DNA分子导入到宿主细胞中,常用的方法包括电穿孔法、转化法等。
3.阳性克隆筛选:通过菌落PCR或 southern 杂交等方法筛选出含有目的基因的阳性克隆。
4.序列分析:对阳性克隆进行序列分析,确保目的基因正确插入载体中,并且没有发生任何突变。
三、构建酵母表达体系1.质粒制备:从阳性克隆中提取重组质粒,并进行纯化和鉴定。
2.转化酵母细胞:将重组质粒转化到酵母细胞中,常用的方法包括电穿孔法、热激法等。
3.筛选阳性克隆:通过 southern 杂交等方法筛选出含有重组质粒的阳性克隆。
4.鉴定表达产物:对阳性克隆进行蛋白质表达水平检测,常用的方法包括 western 杂交、ELISA等。
同时对表达产物进行生物活性检测,以评估表达产物的质量和功能。
5.优化表达条件:通过对培养条件(如温度、pH值、营养物质浓度等)进行优化,提高目的基因的表达水平和产量。
6.生产与纯化:在优化条件下进行大规模培养和表达,并对表达产物进行纯化和加工,以满足实际应用需求。
酵母菌表面展示操作步骤之基因克隆与构建

酵母菌表面展示操作步骤之基因克隆与构建酵母菌表面展示技术是一种广泛应用于蛋白质工程和生物药物研发领域的技术。
它通过将目标蛋白质的编码基因插入酵母菌表面展示载体中,使得酵母菌能够在外界环境中表达和展示该蛋白质,并且能够通过酵母菌表面展示载体的特定信号传导机制,将目标蛋白质定向地展示在酵母菌表面。
本文将介绍酵母菌表面展示操作中的基因克隆与构建步骤。
基因克隆是酵母菌表面展示操作的第一步,它包括了目标蛋白质基因的扩增、酶切、连接和转化等过程。
首先,需要通过PCR方法扩增目标蛋白质基因序列。
根据已知的目标蛋白质序列,设计引物并进行PCR扩增。
扩增得到的产物将带有酶切位点。
接下来,使用相应的限制性内切酶对扩增产物进行酶切。
选择适当的酶切位点,将目标蛋白质基因序列切割成需要的片段。
然后,将酶切后的目标蛋白质基因片段与表达载体进行连接。
表达载体通常是一个环状的质粒,其中含有所需的基因调控元件和表达元件。
使用DNA连接酶将酶切后的目标蛋白质基因片段连接到表达载体上。
经过连接后,将连接产物进行转化。
将连接产物与酵母菌进行共转化,使得表达载体能够进入酵母菌细胞,并在酵母菌中稳定复制。
经过基因克隆步骤,即完成了酵母菌表面展示操作的基本构建工作。
下一步将对构建完成的酵母菌细胞进行筛选和鉴定。
可以通过选择性培养基的筛选来鉴定含有目标蛋白质基因的酵母菌细胞。
将转化后的酵母菌细胞接种于含有相应选择性抗生素的培养基中,通过抗生素的抑制作用,筛选出带有目标蛋白质基因的酵母菌细胞。
同时,也可以通过PCR、Western blot等方法对酵母菌细胞进行鉴定。
通过PCR可以验证目标蛋白质基因是否被成功地插入到酵母菌细胞的基因组中;通过Western blot可以检测目标蛋白质在酵母菌细胞中的表达情况。
最后,经过筛选和鉴定后的酵母菌细胞即可用于表面展示实验。
将筛选出的酵母菌细胞培养并收获细胞,通过洗涤和离心等操作,去除培养基和杂质。
通过以上步骤,我们完成了酵母菌表面展示操作中的基因克隆与构建工作。
酵母双杂交步骤

酵母双杂交步骤酵母双杂交是一种常用的实验方法,用于研究基因之间的相互作用以及确定基因功能。
这种方法可以帮助科学家更好地理解生物学系统的复杂性,并为疾病的研究提供重要线索。
下面将介绍酵母双杂交的步骤及其意义。
进行酵母双杂交实验需要准备两个重要的构建:酵母表达载体和融合蛋白质的基因。
酵母表达载体通常包含启动子、选择标记基因和复制起点等元件,可以在酵母细胞中稳定表达外源基因。
而融合蛋白质的基因则是由研究人员设计合成,其中包含感兴趣的基因片段与激活结构域的融合。
将融合蛋白质的基因克隆到酵母表达载体中,构建成表达载体。
然后将这些表达载体分别转化到两株不同的酵母菌株中,形成两个亲本菌株。
接着,将这两个亲本菌株进行交配,使它们在同一酵母细胞内共存。
接下来,通过培养这个双杂交菌株,观察融合蛋白质是否发生相互作用。
如果两个融合蛋白质相互结合,可能会激活报告基因的表达,从而产生可检测的信号。
通过检测这些信号,可以初步判断这两个蛋白质之间是否存在相互作用。
为了验证这种相互作用的真实性,通常需要进行一系列的对照实验和进一步的验证。
例如,可以利用突变体蛋白质来确认相互作用位点,也可以通过共沉淀实验证明这种相互作用在细胞内是否真实发生。
酵母双杂交实验是一种简单而有效的方法,可以帮助科学家快速筛选出潜在的蛋白质相互作用,并为后续的深入研究提供基础。
通过这种方法,研究人员可以更好地理解生物学系统的复杂性,揭示基因之间的相互关系,为疾病的研究和治疗提供新的思路。
总的来说,酵母双杂交是一种重要的实验方法,对于生物学研究具有重要意义。
通过这种方法,科学家们可以揭示基因之间的相互作用,探索生物学系统的奥秘,为人类健康和疾病治疗提供新的思路和方法。
希望未来能有更多的科研工作者投入到这一领域,共同推动生命科学的发展和进步。
pPICZ A酵母表达载体说明

pPICZ A编号 载体名称北京华越洋生物VECT2440 pPICZ ApPICZA载体基本信息出品公司: Invitrogen载体名称: pPICZA, p PICZ A质粒类型: 毕赤酵母蛋白表达载体表达水平: 高拷贝启动子: AOX1克隆方法: 多克隆位点,限制性内切酶载体大小: 3329 b p5' 测序引物及序列: 5´ A OX1:5´-‐GACTGGTTCCAATTGACAAGC-‐3´ 3' 测序引物及序列: 3´ A OX1:5´-‐GCAAATGGCATTCTGACATCC-‐3´ 载体标签: C-‐Myc, C-‐His载体抗性: Zeocin 博来霉素筛选标记: HIS4备注: 插入基因是必需包含起始密码子ATG。
产品目录号: -‐-‐稳定性: 稳定 Stable组成型: 组成型 Constitutive病毒/非病毒: 非病毒pPICZA载体质粒图谱和多克隆位点信息pPICZA多克隆位点pPICZA载体简介pPICZ A,B和C是3.3 k b的毕赤酵母蛋白载体。
表达的重组蛋白是融合蛋白,含有一个C-‐端多肽,多太重含c-‐myc和C-‐His标签。
载体能够在毕赤酵母中利用甲醇诱导的高水平的表达目的蛋白,并且可以用在任何毕赤酵母中,包括X33,GS115菌株,SMD1168H,KM71H。
pPICZ系列载体包含以下元素:•5'片段含有AOX1启动子的严格调控,利用甲醇诱导表达任何感兴趣的基因(Ellis等,1985; Koutz等人,1989;tschopp等人,1987A)。
•Zeocin抗性基因在大肠杆菌和毕赤酵母都能用于筛选(Baron等人,1992; D rocourt等人,1990)。
酵母表达手册

酵母表达手册
酵母表达系统是一种常用于生产重组蛋白质的方法,其利用酵母细胞作为宿主来表达外源基因。
以下是酵母表达系统的基本步骤:
1. 基因克隆和转化:将目的基因克隆到酵母表达载体中,常用的载体有质粒和整合型载体。
转化方法包括电转化和化学转化。
2. 重组蛋白表达:将转化后的酵母细胞接种到发酵罐中进行培养,在适宜的温度、pH和营养条件下,目的基因在酵母细胞中表达出重组蛋白。
3. 蛋白质纯化:通过一系列的纯化技术,如离心、过滤、沉淀、亲和层析等,将重组蛋白从酵母细胞中分离出来并进行纯化。
4. 蛋白质后处理:根据需要,对纯化的重组蛋白进行进一步的后处理,如去盐、脱色、除菌等。
5. 蛋白质检测:通过SDS-PAGE、Western blot等方法检测重组蛋白的表达水平和纯度。
6. 蛋白质功能研究:对纯化的重组蛋白进行生物活性检测和功能研究,如酶活测定、免疫分析等。
在实际应用中,需要根据不同的需求选择不同的酵母表达系统,如酿酒酵母表达系统、毕赤酵母表达系统等。
同时,还需要对重组蛋白进行质量分析和稳定性研究,以确保其用于后续的实验或生产中具有可靠性和有效性。
酿酒酵母蛋白表达载体是什么?

酿酒酵母蛋⽩表达载体是什么?
酿酒酵母基因表达载体系统是基于⼴泛使⽤的pYES2载体⽽构建的,它是⼀个可⽤于在酵母中表达重组蛋⽩,或者通过在酵母中进⾏过表达以研究基因功能的强⼤⽽有效的系统。
⽬的基因可以克隆在该载体上,通过客户选择的启动⼦来介导表达。
VectorBuilder上有⼏种可供选择的标准启动⼦,其中之⼀是来⾃酵母半乳糖激酶(GAL1)基因的强诱导型启动⼦,它是酵母重组蛋⽩表达系统中最常⽤的启动⼦。
在典型的酵母实验菌株(如INVSc1)中,GAL1启动⼦的转录活性与培养基中的碳源有⼀定的关系。
在葡萄糖存在的情况下,GAL1启动⼦的的转录受到抑制;半乳糖则会激活该启动⼦。
因此,通过简单地去除葡萄糖的培养基,并⽤含有半乳糖的培养基替代,可以实现⽬的基因的诱导表达。
或者,将棉⼦糖作为碳源。
棉⼦糖既不抑制也不诱导GAL1启动⼦的转录,即使在棉⼦糖存在情况下,加⼊半乳糖也⾜以激活GAL1启动⼦。
与使⽤葡萄糖培养基培养的细胞相⽐,半乳糖对使⽤含棉⼦糖培养基培养的细胞诱导更快。
然⽽,由于棉⼦糖⽆法抑制GAL1启动⼦,所以该⽅法会导致诱导前⽬的基因的“泄漏”表达。
通常情况下,利⽤葡萄糖维持培养的细胞经半乳糖诱导后约4⼩时可检测到重组蛋⽩的表达,⽽⽤棉⼦糖培养的细胞仅需约2⼩时即可。
建议您设置⼀个时间梯度来优化重组蛋⽩的表达。
酵母菌质粒 讲解

酵母菌质粒酵母菌质粒是一种广泛用于酵母遗传工程的重要工具。
酵母菌质粒是由DNA分子构成的小环状结构,通常具有自主复制和表达基因的能力。
本文将对酵母菌质粒的构成、功能和应用进行讲解。
构成酵母菌质粒通常由几个部分构成:选择标记、复制起源、多克隆位点和表达元件。
选择标记选择标记是一种基因,其作用是将含有质粒的酵母细胞与不含质粒的细胞区分开来。
最常用的选择标记是抗生素抵抗基因,如能使酵母细胞对抗生素耐受的抗药性基因。
复制起源复制起源是质粒进行自主复制的启动点。
酵母菌质粒通常包含一段可以被酵母细胞复制机制所识别的特定序列,确保在细胞分裂过程中能够被复制并传递给下一代细胞。
多克隆位点多克隆位点是酵母菌质粒上的特定位点,用于插入外源DNA片段。
这些位点通常由特定的限制酶切位点组成,使得外源DNA片段可以被切割并连接到质粒上。
常见的多克隆位点有pUC19、pBluescript等。
表达元件表达元件包括启动子、转录终止信号和编码蛋白质的基因。
启动子是DNA上的一个区域,能够在酵母细胞内转录蛋白质基因。
转录终止信号是终止转录的信号序列。
基因则根据所需的表达蛋白质进行选择,并插入到酵母菌质粒的适当位点上。
功能和应用酵母菌质粒在酵母遗传工程中具有广泛的功能和应用。
以下列举了其中的几个重要应用:基因克隆和表达酵母菌质粒作为克隆载体,可以用于插入、克隆和表达各种外源DNA片段。
通过在菌体内表达目标蛋白质,可以研究其功能、相互作用和调控机制。
此外,酵母菌质粒还可以用于制备大量纯化的蛋白质,用于进一步的研究和应用。
逆向遗传学酵母菌质粒是逆向遗传学的重要工具之一。
通过插入外源DNA片段或干扰特定基因,可以研究特定基因的功能和作用机制。
逆向遗传学可以帮助研究者确定基因的功能和互作网络,从而更深入地理解生物体的生物学过程。
药物筛选和基因组工程酵母菌质粒还可以用于药物筛选和基因组工程。
例如,可以构建酵母菌质粒表达库,用于高通量筛选具有特定功能的化合物。
酵母表达系统

比较基因组学
通过比较不同物种之间的基因组 和转录组,分析生物进化的特征 和规律。
05 酵母表达系统的未来发展
提高表达产物的产量与质量
基因编辑技术
利用基因编辑技术,如CRISPR-Cas9,对酵母基因进行精确修饰, 以提高目标蛋白的表达量和纯度。
沉默子
沉默子是能够抑制基因表达的DNA序列,通过与转录因子结合来抑制基因的表达,在基因表达调控中具有重要作 用。
转录因子与基因表达调控
转录因子
转录因子是能够识别并结合DNA序列的蛋白质,通过与特定DNA序列的结合来调控基因的表达。
转录因子与基因表达调控
转录因子在基因表达调控中发挥关键作用,通过与启动子、增强子或沉默子等DNA序列的相互作用来 调节基因的表达。
蛋白质相互作用
通过酵母双杂交等技术研究蛋白质之间的相互作用,揭示基因调控 的分子机制。
基因突变分析
通过构建突变体分析基因突变对酵母生长、代谢等的影响,研究基因 的功能。
生物进化研究
物种进化
利用酵母表达系统研究物种之间 的进化关系,通过比较不同物种 之间基因表达的差异,揭示物种 进化的规律。
适应性进化
利用酵母表达系统生产食品添 加剂、酶制剂等,提高食品质 量和安全性。
农业领域
通过酵母表达系统改良农作物 ,提高抗逆性、产量和品质等
。
酵母表达系统的优缺点
优点
操作简便、周期短、成本低、可大规 模生产、安全性高。
缺点
表达水平相对较低、分泌蛋白的加工 和修饰能力有限、易受宿主菌遗传背 景的影响。
02 酵母表达系统的基本组成
对启动子、终止子等表达元件进行优化,提高其转 录和翻译效率,促进目标蛋白的表达。
将目的基因导入酵母菌的方法

将目的基因导入酵母菌的方法全文共四篇示例,供读者参考第一篇示例:将目的基因导入酵母菌是一种常见的实验技术,可以用于基因工程、生物学研究和生物技术应用等领域。
以下是关于将目的基因导入酵母菌的方法的详细介绍。
一、介绍酵母菌是一种常见的真菌,广泛应用于食品发酵、生物燃料生产和药物生产等领域。
将外源基因导入酵母菌可以改变其代谢特性、增强其生产能力,从而扩大其应用范围。
下面将介绍将目的基因导入酵母菌的方法。
二、选择适当的表达载体在将目的基因导入酵母菌之前,首先需要选择一个适当的表达载体。
常用的表达载体有质粒、病毒、质粒体等。
质粒是最常用的表达载体,因为它具有较强的载体稳定性和易于操作的特点。
还需要考虑选择适当的启动子、选择子和标记基因等。
三、构建目的基因载体构建目的基因载体是将目的基因插入到选择的载体中,以便将其导入酵母菌。
首先需要将目的基因进行PCR扩增,获得目的基因的DNA序列。
然后,将目的基因与载体进行连接,可以通过酶切和连接、PCR扩增等方法进行。
最终构建出目的基因载体。
四、转化酵母菌转化是将构建好的目的基因载体导入酵母菌的过程。
目前常用的转化方法有质粒转化、电穿孔法、化学转化、凝血作用等。
质粒转化是最为常用的方法。
质粒转化的步骤主要包括酵母菌细胞的预处理、质粒的导入和细胞的再生。
五、筛选阳性转化子在转化酵母菌后,需要进行阳性转化子的筛选。
阳性转化子是指成功导入了目的基因的酵母菌细胞。
常用的筛选方法有抗生素抗性筛选、蓝白斑筛选、基因荧光标记筛选等。
通过有效的筛选方法,可以获得目的基因成功导入的阳性转化子。
六、验证目的基因的表达最后一步是验证目的基因在酵母菌中的表达情况。
可以通过RT-PCR、Western blot等方法来检测目的基因的表达水平。
验证表达成功后,即可进行后续的实验和应用。
在将目的基因导入酵母菌的过程中,需要注意以下几个方面的问题:1. 酵母菌细胞的处理条件,包括培养基的配制、细胞密度的控制等。
克隆载体与表达载体
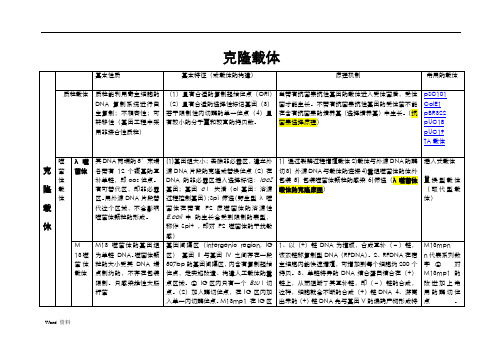
噬菌 粒载 体
M13-DNA 那样体外包 装,并高效转染受体细 胞 装载量比常规的 M13mp 系列要大很多
点、抗生素抗性选择标记和丝状体噬菌 体 DNA 间隔区(含有噬菌体 DNA 复制 起始、终止以及噬菌体颗粒形态发生所 必需的全部顺式作用元件)
个 ampr 基因作为选择记号,便于转化子的选择; 3. 拷贝数含量高 4. 存在着一个多克隆位点区,因 此多种不同类型的外源 DNA 片段,不经修饰便可 直接插入到载体分子上;5.多克隆位点区阻断了大
噬 黏粒 装,并高效转染受体细 位点,因而能象质粒一样转化和增殖。 DNA 可大于 40kb。重组的柯斯质粒可象噬菌体λ
菌 载体 胞;能像质粒那样在受 克隆的最大 DNA 片段可达 45kb 。 一样感染大肠杆菌,并在细菌细胞中复制。
体-
体细胞中自主复制具有 有的粘粒载体含有两个 cos 位点,在
质
M13 噬菌 体的 基 因组 为单链 DNA。噬菌体颗 粒的大小受其 DNA 端 点制约的,不存在包装 限制。只感染雄性大肠 杆菌
(1)基因组大小;去除非必需区,建立外 源 DNA 片段的克隆或替换位点(2)在 DNA 的非必需区插入选择标记:lacZ 基因;基因 cⅠ 失活(cI 基因:溶源 过程控制基因);Spi 筛选(野生型 λ 噬 菌 体 在 带 有 P2 原 噬 菌 体 的 溶 源 性 E.coli 中 的生长会受到限制的表型, 称作 Spi+ ,即对 P2 噬菌体的干扰敏 感) 基因间隔区(intergenic region, IG 区) 基因 II 与基因 IV 之间存在一段 507bp 的基因间隔区,内含有复制起始 位点,是实施改造、构建人工载体的重 点区域。② IG 区内只有一个 Bsu I 切 点。(2)加入酶切位点,在 IG 区内加 入单一内切酶位点。M13mp1 在 IG 区
基因工程与酵母菌表面展示载体构建

基因工程与酵母菌表面展示载体构建基因工程是一种利用生物技术手段对生物体的基因进行修改和重新组合的过程。
而酵母菌表面展示载体则是一种将外源蛋白质表达在酵母菌表面的工具,用于研究和应用于生物医药领域。
本文将介绍基因工程与酵母菌表面展示载体构建的相关知识和步骤。
首先,进行基因构建前的准备工作。
确定目标蛋白质的序列,为此可以利用已有的文献或数据库进行搜索和筛选。
然后选择合适的酵母菌表面展示载体进行基因的导入和表达。
酵母菌表面展示载体一般包括信号序列、载体复制源、选择标记和目标蛋白质的表达区。
其次,进行基因克隆。
将目标蛋白质的基因序列与酵母菌表面展示载体连接在一起。
这可以通过PCR扩增目标基因、线性化载体,然后利用连接酶将目标基因和载体连接。
也可以利用限制酶将目标基因和载体进行酶切,然后进行连接。
然后,将构建好的基因载体导入酵母菌细胞中。
酵母菌细胞可以利用电转化、化学转化或冷冻转化等方法进行导入。
其中,电转化是最常用的方法,它利用高压脉冲将DNA导入细胞内。
接着,进行酵母菌细胞的培养和表达。
将导入基因载体的酵母菌细胞培养在适当的培养基中,利用荧光检测、Western blot或质谱等方法确认目标蛋白质在细胞内的表达情况。
如果目标蛋白质表达不稳定或表达量较低,可以尝试优化培养条件、选择合适的诱导剂或筛选高表达株系,以提高目标蛋白质的表达水平。
最后,进行酵母菌表面展示验证。
利用荧光显微镜、流式细胞术或ELISA等技术,检测目标蛋白质是否成功表达在酵母菌表面,并研究其在表面展示状态下的稳定性与活性。
还可以利用此酵母菌表面展示系统进行基因工程和酵母菌载体的进一步应用研究,比如疫苗研发、抗体筛选、高通量蛋白质互作研究等。
总结起来,基因工程与酵母菌表面展示载体构建是一项复杂而又有趣的科研工作。
通过合理的基因构建、基因导入和表达调控等步骤,可以实现目标蛋白质的可视化表达和展示,为生物医药领域的研究和应用提供了有力的工具和手段。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Gal4蛋白有一个非常突出的特性,它的二个结构域在其适当的连接区被打断后仍具有各自的功能,而且这两个不同的结构域可以重建继续发挥转录激活作用。这一特性使得研究者可以构建两个载体来研究蛋白质与蛋白质之间的相互作用。具体方法是:将A基因与DB融合构建一个表达质粒(通常带Trp标志基因,以下简称Trp质粒)在酵母中表达Gal4-BD-A,将B基因与AD融合构建另一个表达质粒(通常带Leu标志基因)表达Gal4-AD-B,然后将者两个质粒转化酵母,在泛基诺SD/-Trp-Leu双缺培养基上筛选转化克隆(备注:两个质粒共转化的效率一般很低,也可先后逐个转化,即先转化Trp质粒,在泛基诺SD/-Trp的培养平皿中筛选阳性克隆后再转化Leu质粒。如果A蛋白和B蛋白之间存在相互作用,那么Gal4-BD和Gal4-AD通过A和B的桥接作用被聚集在一起而重建转录因子的活性,启动下游报告基因的转录。早期的报告基因选用LacZ,后来为减少非特异性激活而产生的假阳性,增加了双报告基因和三报告基因(LacZ,His3,Ade2)。
此类质粒在细胞内以附加体的形式高度复制, 每个细胞高达200-400个拷贝贝
用途: 用于外源基因的表达
(二). 表达载体
1、GAL1启动子表达载体-----半乳糖诱导的表达载体
(1).Trp筛选标志 (2).Ura筛选标志 (3).Leu筛选标志 (4).His筛选标志 (5).G418筛选标志
此类质粒在细胞内可自主复制,且由于含有中心粒复制序列,因此每个细胞近乎只有一个拷贝。
用途: 由于每个细胞平均只有一个拷贝,避免了目的基因的盈余表达,因而特别适用于基因功能的研究
3、酵母附加体质粒(Yeast episomal plasmid, YEP)
(1).Trp筛选标志 (2).Ura筛选标志 (3).Leu筛选标志 (4).His筛选标志 (5).G418筛选标志
2、Cup1启动子表达载体-----硫酸铜诱导的表达载体
(1).Trp筛选标志 (2).Ura筛选标志 (3).Leu筛选标志 (4).His筛选标志 (5).G418筛选标志
3、ADH启动子表达载体-ADC1组成型表达载体
(1).Trp筛选标志 (2).Ura筛选标志 (3).Leu筛选标志 (4).His筛选标志 (5).G418筛选标志
此类质粒经酶切线性化后可整合到酵母细胞基因组中
用途: a.基因取代或基因删除 b.稳定型表达元件的整合(integration)和敲入(knock in)
2、酵母中心粒-自主复制质粒(Yeast CEN-ARS plasmid, YCP)
(1).Trp筛选标志 (2).Ura筛选标志 (3).Leu筛选标志 (4).His筛选标志 (5).G418筛选标志
不久前,由于一个委托研究课题的需要,我用荧虫酶报告基因Luciferase将LacZ置换掉,原始材料分别选用Y187和AH109,在实验之前,需要对局部基因组区域测序收集有关信息,结果发现:Y187和AH109这两个酵母报告株每个报告基因的上游UASg序列与我当年用定点突变优化的组合序列竟完全一致,一个碱基也不差!!我真的不敢想这是否就是出自我当年之手。谈笑间,二十年过去,往事如梦,但一切又仿佛是在昨天,令人感慨万千! 有一首歌是怎么唱的来着?仿佛是:多年后,终点又回到了起点。这就是酵母双杂交系统的前事今生!二十年前酵母遗传学的副产品酵母双杂交系统如今在后基因组时代-蛋白质组研究中再次大放异彩。
1. 酵母表达载体的选择
用酵母来获得高产量蛋白质,其表达载体应具备以下三个特点:一是高效启动子,二是高拷贝质粒,三是可控性。GAL1启动子在半乳糖的诱导下,具有高效启动表达的特性,且在葡萄糖存在的情况下表达几乎完全被抑止,因此在大量表达某些蛋白可能对酵母细胞产生毒性的情况下,GAL1诱导性启动子是很好的选择。这类表达载体的代表是Invitrogen公司的pYes2和pYes3,泛基诺(FunGenome)公司的pYes4,pYes5,pYes6。如果大量表达的蛋白质不具有细胞毒性,ADH构成性(又称组成性)启动子则是非常适用的选择,这类表达载体的代表是泛基诺公司的pAY2,pAY3,pAY4
2. 酵母营养缺陷型培养基的选择
根据表达载体的特性来选择培养基,举例来说:如果选用的表达载体是pYes2那么就应该用SD-Ura(Synthetic Dropout Ura media),其原理是pYes2含尿嘧啶(Ura)合成酶途径中一个关键酶基因Ura3,当pYes2转化Ura3基因缺陷的酵母时,便可以在缺乏Ura的选择缺陷培养基SC-Ura中筛选。同样的道理,pYes3对应的选择缺陷培养基是SD-Trp(简写pYes3-Trp), pYes4(对应的选择缺陷培养基是SC-His,pYes5对应的选择缺陷培养基是SC-Leu, pYes6对应的选择缺陷培养基是SC-Ade。多元基因表达或质粒共转化时可选用SC-Ura-Trp-His-Leu-Ade的适当组合。更详细的培养基选择信息和特殊的个性化要求可发送电子邮件到fungenome@咨询。这里特别强调,泛基诺公司提供的酵母选择缺陷培养基含有除葡萄糖外的所有营养成分,不需要再另加minimal SD base酵母含氮碱和其他氮源,加水后高压灭菌即可,极大地方便了使用者的配置,由于提供的是粉剂,因此在保存干燥的情况下可以长期保存
GAL4基因是酵母糖代谢中的一个重要基因,其编码的蛋白质Gal4(备注: GAL4表示基因,Gal4表示蛋白)具有两个结构域:位于N末端的DNA结合结构域(DNA-binding domain,简称BD)和位于C末端的转录激活结构域(transcription-activating domain,简称AD)。DNA结合结构域(BD)能识别GAL1基因启动子的上游激活序列(Upstream Activating sequence,UAS),转录激活结构域(AD)可同转录复合物的其他成分作用,启动GAL1基因的转录。GAL1基因上游含4个特殊序列UASg (upstream activator sequence-galactose)。每个UASg由17bp序列构成,当加入半乳糖作为诱导物后,Gal4可全方位的与GAL1的UASg结合,从而使GAL1基因的表达成千倍地增加。
二.酵母基因克隆与表达载体
(一).功能型骨架载体-----用于不同用途的功能研究和载体改造
1、酵母基因组整合质粒(Yeast integrating plasmid, YIP)
(1).Trp筛选标志 (2).Ura筛选标志 (3).Leu筛选标志 (4).His筛选标志 (5).G418筛选标志
作为分子生物学实验操作的案头资料-红皮书(Current Protocol in Molecular Biology)将酵母作为一个独立的章节与其他常用分子生物学实验技术并行而列;而被生命科学实验室奉为圣经的分子克隆, 其第三版的多个章节则穿插有不同方面的酵母实验操作, 足见酵母遗传学方法在当今生命科学研究中的重要作用。酵母在生命科学研究中主要用于以下几个方面:
神奇的酵母遗传学技术与高等生物基因功能研究系列讲座(二)酵母双杂交系统的前世今生
2010-08-02 15:39:40| 分类: 酵母遗传学方法与 | 标签:转录 gal4-bd gal4ad 报告基因 酵母双杂交 |举报|字号 订阅
酵母双杂交系统的原理、应用与进展
酵母实验操作在国内研究型实验室广为传播的主要原因还是酵母双杂交系统的应用和发展,关于酵母双杂交系统的原理,这方面的文章俯拾皆是,但无论是新手上路还是导师专家,花几分钟的时间参阅下面由泛基诺技术总监撰写的内容,相信您还是能得到一些非常有用的信息,并在实际科研工作中有一定的借鉴作用。
【正文】酵母双杂交系统首先由Stanley Fields实验室建立的,其原始出处参见1987年Cell杂志上的论文。该系统的理论基础是建立在对于酵母半乳糖代谢调控的两个关键转录因子Gal80负调控因子和Gal4正调控因子的功能解析上。
作者: 泛基诺技术总监 胡恩泛
【编辑部按:无论是新手上路还是导师专家,花几分钟的时间参阅下面由泛基诺技术总监撰写的内容,相信您还是能得到一些非常有用的信息,并在实际科研工作中有一定的借鉴作用】
酵母遗传学对二十世纪九十年代以来的生命科学与医学研究产生了极大地推动作用,其威力之巨大、影响之深远、应用之广泛使得其他任何一种模式生物都不能望其项背。这一节主要讲述酵母双杂交系统原理的最新诠释和实验操作精要。
神奇的酵母遗传学技术与高等生物基因功能研究讲座(一)外源基因在酵母中的表达
2010-07-24 11:51:11| 分类: 酵母遗传学方法与 | 标签:酵母培养基 选择缺陷 dropout 表达质粒 |举报|字号 订阅
作者:泛基诺技术部模式生物组 朱蕾诺
芽生酵母(budding yeast, Saccharomyces cerevisiae)俗称酿酒酵母,是单细胞真核生物,它的基因组比较简单(仅为大肠杆菌的3-4倍),易于操作,遗传背景相对清楚,加之其突变株又易于分离,而被誉为“真核大肠杆菌”(Eukaryotic E.coli)和“体内试管”(In vivo test tube), 因而是研究高等真核生物基因功能的理想模式生物。正象离不开大肠杆菌的操作一样, 一个向深度发展的分子生物学实验室离不开酵母实验操作。
一、外源基因在酵母中的的表达(Foreign gene expression in yeast)
最常用的外源基因表达受体是大肠杆菌,然而,自然界一些物种之间存在巨大的密码子偏好差异,一些物种的基因可以在大肠杆菌中得到有效的表达,而另一些物种的基因则在大肠杆菌中表达很弱或不能表达(如某些林木类植物),在这种情况下,作为真核细胞的酵母便成为目的基因表达的首选受体细胞。泛基诺公司技术部成功地为一些林业科学研究单位表达出大量具有天然活性的蛋白质,而这些蛋白质在原核生物大肠杆菌中是不能表达的(更详细的理论和技术信息可发电子邮件到:fungenome@进行咨询)。另外,由于酵母具有易于繁殖且又无毒的特性(日常生活中用来发酵面粉和酿酒,故又称为面包酵母和啤酒酵母),因此生物技术和产业界研究人员常用酵母来表达外源基因,获得大量具有天然活性的蛋白质和经基因工程改造生产疫苗等。
