届一轮复习人教版 氯及其化合物 卤素 课件(108张)
合集下载
一轮复习氯及其化合物PPT课件

第四章 非金属元素及其化合物
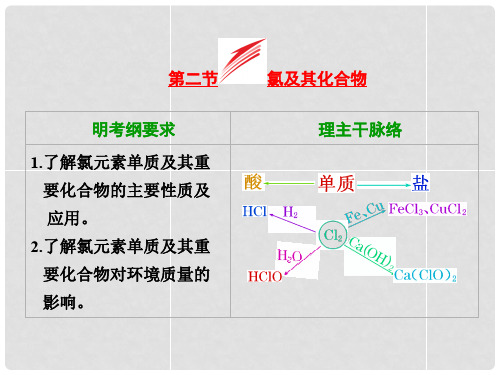
第二节 富集在海水中的元素——氯
2014年9月23日
考向分析
命题形式
本节高考重点考查: 1氯及其重要化合物的性质、应 用及制备方法; 2氯气对环境的影响. 3卤素单质及离子的性质
一般在选择题、化工和探 究题可能出现.常常以Cl2的制备 为载体,在Cl2的性质、尾气处理 及氯水成分与性质上进行命题 并且涉及氧化还原反应的考查.
为:
分子
.
弱
HClO
H+ + ClO-
三、氯水的性质
①氯气不仅溶解于水,而且和水发生反应,化学方程式
为
Cl2+H2O
HCl+HClO
.
离子方程式为 Cl2+H2O
H++Cl-+HClO
.
②氯气的水溶液称氯水,新制氯水中存在的微粒有 ____H_2_O___C__l2___H_C_l_O___H__+__C__l-__C_l_O-
反应现象
溶液由无色变橙色 溶液由无色变深黄色
Fe2+ 2Fe2+ + Cl2 == 2Fe3+ + 2ClCl2
S2-
S2- + Cl2 == S + 2Cl-
溶液由浅绿色变黄色 溶液变浑浊
SO32- H2O + SO32- + Cl2 == SO42- + 2Cl- + 2H+ 溶液无明显现象
SO2 2H2O + SO2 + Cl2 == SO42- + 2Cl- + 4H+溶液没有明显7现象
产生棕黄色的烟,溶于水溶液呈蓝色
2Fe+3Cl2
2FeCl3(现象?)
第二节 富集在海水中的元素——氯
2014年9月23日
考向分析
命题形式
本节高考重点考查: 1氯及其重要化合物的性质、应 用及制备方法; 2氯气对环境的影响. 3卤素单质及离子的性质
一般在选择题、化工和探 究题可能出现.常常以Cl2的制备 为载体,在Cl2的性质、尾气处理 及氯水成分与性质上进行命题 并且涉及氧化还原反应的考查.
为:
分子
.
弱
HClO
H+ + ClO-
三、氯水的性质
①氯气不仅溶解于水,而且和水发生反应,化学方程式
为
Cl2+H2O
HCl+HClO
.
离子方程式为 Cl2+H2O
H++Cl-+HClO
.
②氯气的水溶液称氯水,新制氯水中存在的微粒有 ____H_2_O___C__l2___H_C_l_O___H__+__C__l-__C_l_O-
反应现象
溶液由无色变橙色 溶液由无色变深黄色
Fe2+ 2Fe2+ + Cl2 == 2Fe3+ + 2ClCl2
S2-
S2- + Cl2 == S + 2Cl-
溶液由浅绿色变黄色 溶液变浑浊
SO32- H2O + SO32- + Cl2 == SO42- + 2Cl- + 2H+ 溶液无明显现象
SO2 2H2O + SO2 + Cl2 == SO42- + 2Cl- + 4H+溶液没有明显7现象
产生棕黄色的烟,溶于水溶液呈蓝色
2Fe+3Cl2
2FeCl3(现象?)
高考化学一轮复习 第二章 第2节 氯及其化合物配套课件
(4)与碱反应:与 NaOH 溶液反应,离子方程式为 Cl2+2OH- ===Cl-+ClO-+H2O 。
(5)与还原性无机化合物反应(书写离子方程式): ①与碘化钾溶液反应: 2I-+Cl2===I2+2Cl- 。
②与 SO2 水溶液反应:Cl2+SOபைடு நூலகம்+2H2O===4H++2Cl- +SO24-。
(× )
2.如遇到氯气泄漏,应如何自救? 提示:Cl2 的密度比空气大,要逆风向高处转移。由于 Cl2 易 和碱反应,可用蘸有肥皂水或纯碱溶液的毛巾捂住鼻孔。
3.久置的氯水和新制氯水性质上有哪些差异?
提示:长时间放置的氯水最终会变成稀盐酸,溶液酸性增强,
但氧化性降低,最终溶液由黄绿色变成无色。 4.把 Cl2 通入石蕊溶液中的现象是什么?能否用 pH 试纸测定
氯水的 pH? 提示:先变红后褪色;不能用 pH 试纸测定氯水的 pH。
5.试写出下列反应的离子方程式: (1)向 FeBr2 溶液中通入少量 Cl2:_______________________。 (2)向含 1 mol FeBr2 的溶液中通入 1 mol Cl2:____________。 (3)向 FeI2 溶液中通入少量 Cl2:_______________________。 (4)向 FeI2 溶液中通入足量 Cl2:________________________。 答案:(1)2Fe2++Cl2===2Fe3++2Cl- (2)2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl- (3)2I-+Cl2===I2+2Cl- (4)2Fe2++4I-+3Cl2===2Fe3++2I2+6Cl-
为 2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-。
(5)与还原性无机化合物反应(书写离子方程式): ①与碘化钾溶液反应: 2I-+Cl2===I2+2Cl- 。
②与 SO2 水溶液反应:Cl2+SOபைடு நூலகம்+2H2O===4H++2Cl- +SO24-。
(× )
2.如遇到氯气泄漏,应如何自救? 提示:Cl2 的密度比空气大,要逆风向高处转移。由于 Cl2 易 和碱反应,可用蘸有肥皂水或纯碱溶液的毛巾捂住鼻孔。
3.久置的氯水和新制氯水性质上有哪些差异?
提示:长时间放置的氯水最终会变成稀盐酸,溶液酸性增强,
但氧化性降低,最终溶液由黄绿色变成无色。 4.把 Cl2 通入石蕊溶液中的现象是什么?能否用 pH 试纸测定
氯水的 pH? 提示:先变红后褪色;不能用 pH 试纸测定氯水的 pH。
5.试写出下列反应的离子方程式: (1)向 FeBr2 溶液中通入少量 Cl2:_______________________。 (2)向含 1 mol FeBr2 的溶液中通入 1 mol Cl2:____________。 (3)向 FeI2 溶液中通入少量 Cl2:_______________________。 (4)向 FeI2 溶液中通入足量 Cl2:________________________。 答案:(1)2Fe2++Cl2===2Fe3++2Cl- (2)2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl- (3)2I-+Cl2===I2+2Cl- (4)2Fe2++4I-+3Cl2===2Fe3++2I2+6Cl-
为 2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-。
高中化学一轮复习课件:氯及其化合物课件

H2+Cl2
2HCl
苍白
白雾
[注意] 氯气可与Si、P等大多数非金属单质化合,如2P+3Cl2
Si+2Cl2
SiCl4。
2PCl3、
(3)从化合价的角度认识Cl2产生的“歧化反应” Cl2中氯元素为0价,处于氯元素的中间价态,因此Cl2既具有氧化性又具有还原性。 常温下,Cl2与水或碱溶液反应时,Cl2产生“歧化反应”,Cl元素由0价变为+1价和-1价。
为
,最外层有7个电子,在化学反应中很容易 得到 1个电子,使
最外电子层到达8个电子的稳定结构。
(1)与金属反应 氯气能与大多数金属化合,生成金属氯化物;与变价金属(Fe、Cu等)反应生成 高价态金属氯化物。
2Fe+3Cl2
2FeCl3
Cu+Cl2
CuCl2
(2)与非金属反应
H2+Cl2 2HCl
⑥ Ca(ClO)2+4HCl(浓) =CaCl2+2Cl2↑+2H2O ;
⑦ 2Fe+3Cl2 2FeCl3 ;
⑧ H2+Cl2 2HCl ;
⑨ Fe+2HCl =FeCl2+H2↑
(其他合理答案均可)
。
1.判断正误(正确的打“√”,错误的打“×”) (1)新制氯水在空气中久置,氯水酸性增强,氧化性减弱( √ )
[解析]氯气与Na、Fe、Cu和H2反应,生成金属氯化物或HCl,Cl2均是氧化剂,表 现氧化性,A正确; 金属钠的熔点低,且灼烧生成过氧化钠,正确的操作为取一块绿豆大的金属钠, 用滤纸吸干煤油、切去氧化层,放在陶土网上用酒精灯微热,待钠熔成小球,将 盛有Cl2的集气瓶迅速倒扣在钠上方,B错误;
2024届高考化学一轮总复习:氯气和卤族元素课件

(5)与还原性物质FeCl2反应的化学方程式为Cl2+2FeCl2===2FeCl3(溶液由浅绿色变 为棕黄色);与KI反应的化学方程式为Cl2+2KI===2KCl+I2(往溶液中加入新制氯 水后,再加入四氯化碳振荡、静置。若四氯化碳层出现橙红色,说明原溶液中存
在Br-;若四氯化碳层出现紫红色,说明原溶液中存在I-);与SO2反应的化学方程 式为Cl2+SO2+2H2O===2HCl+H2SO4(将SO2气体和Cl2气体混合后作用于有色溶液, 漂 白 效 果 将 大 大 减 弱 ) ; 与 Na2SO3 反 应 的 化 学 方 程 式 为 Cl2 + Na2SO3 + H2O===Na2SO4+2HCl(除去工业废水中多余的氯)。 3.实验室制法。
(1)反应原理:实验室常用 MnO2 和浓盐酸混合共热制得 Cl2,有关反应的化学方程式
为 MnO2+4HCl(浓)==△===MnCl2+Cl2↑+2H2O,也可用更强的氧化剂如 KMnO4、
KClO3、K2Cr2O7 等与浓盐酸来制备 Cl2,制取过程中不需加热。
(2)实验装置:
Cl2的净化用水或饱和食盐水洗气,除去混在Cl2中的HCl气体;用浓H2SO4除去混在 Cl2中的水蒸气。由于Cl2的密度比空气大,常用向上排空法收集,还可用排饱和食 盐水的方法收集。用润湿的淀粉KI试纸检验(放在瓶口),如试纸变蓝,则表示Cl2 已收满。由于Cl2有毒,多余的Cl2不能直接排放,一般用浓NaOH溶液吸收,而不 能用水或澄清石灰水吸收。因Cl2在水中溶解度不大,澄清石灰水中溶解的Ca(OH)2 的量很少,只能吸收少量的Cl2。
2.次氯酸盐:ClO-的 VSEPR 模型为四面体形,在溶液中水解使溶液显碱性,水解 的离子方程式为 ClO-+H2O HClO+OH-;无论在酸性还是在碱性溶液中,ClO-
公开课 高三化学一轮复习 氯气及其化合物_卤素_PPT课件

(2)HF酸腐蚀玻璃,可存于塑料容器或铅制容器 中;
(3)AgF溶于水,CaF2难溶; (4)F元素无正价,氟无含氧酸;
(5)HF水溶液呈弱酸性,而HCl,HBr,HI水溶液为 强酸性;
氯
⑴凡能生成次氯酸的物质均有强氧化 性〔Cl2水、NaClO、Ca(ClO)2〕;
⑵Cl-+Ag+=AgCl↓(白),不溶于稀 HNO3;
Cl
的相同点 电子,有强氧化性
Br
①核电荷数增加
I
原子结构上 ②电子层数增加
At
的不相同点 ③原子半径增大
元素的非金属性依次减弱 单质的氧化性依次减弱 对应离子(X-)的还原性依次增强
2、化学性质 (1)液氯和氯水
液氯 分类 纯净物
氯水 混合物 新制氯水 久置氯水
成分
只有Cl2 分子
分子:Cl2 HClO H2O 离子:H+ Cl- ClO-OH-
加成
与CH2=CH2、乙炔等 不饱和烃加成
【例】 Cl2在70℃的NaOH水溶液中,能同时 发生两个自身氧化还原反应,反应完全后测
得溶液中NaClO与NaClO3的物质的量之比为
1︰2,则反应中被氧化的Cl2与被还原的Cl2
的物质的量之比为
D
A. 2︰3
B. 4︰3
C. 10︰3
D. 3︰11
(3)、卤素单质的化学性质及递变规律
2FeBr3
与Cu
反应 Cu+Cl2=
方程
CuCl2
式
Cu+Br2= CuBr2
2Cu+I2= 2CuI
④与强碱反应:
X2 + 2NaOH = NaX + NaXO + H2O
(3)AgF溶于水,CaF2难溶; (4)F元素无正价,氟无含氧酸;
(5)HF水溶液呈弱酸性,而HCl,HBr,HI水溶液为 强酸性;
氯
⑴凡能生成次氯酸的物质均有强氧化 性〔Cl2水、NaClO、Ca(ClO)2〕;
⑵Cl-+Ag+=AgCl↓(白),不溶于稀 HNO3;
Cl
的相同点 电子,有强氧化性
Br
①核电荷数增加
I
原子结构上 ②电子层数增加
At
的不相同点 ③原子半径增大
元素的非金属性依次减弱 单质的氧化性依次减弱 对应离子(X-)的还原性依次增强
2、化学性质 (1)液氯和氯水
液氯 分类 纯净物
氯水 混合物 新制氯水 久置氯水
成分
只有Cl2 分子
分子:Cl2 HClO H2O 离子:H+ Cl- ClO-OH-
加成
与CH2=CH2、乙炔等 不饱和烃加成
【例】 Cl2在70℃的NaOH水溶液中,能同时 发生两个自身氧化还原反应,反应完全后测
得溶液中NaClO与NaClO3的物质的量之比为
1︰2,则反应中被氧化的Cl2与被还原的Cl2
的物质的量之比为
D
A. 2︰3
B. 4︰3
C. 10︰3
D. 3︰11
(3)、卤素单质的化学性质及递变规律
2FeBr3
与Cu
反应 Cu+Cl2=
方程
CuCl2
式
Cu+Br2= CuBr2
2Cu+I2= 2CuI
④与强碱反应:
X2 + 2NaOH = NaX + NaXO + H2O
2023届高考化学一轮复习 第10讲 氯气 卤素 课件(72张PPT)

酸性KMnO4与浓盐酸制氯气的实验装置如图所示。
制备装置类型:固体+液体→气体(不加热)。
(2) K2Cr2O7 与浓盐酸制氯气 化学方程式:____K__2C__r_2O__7_+__1_4H__C_l_(_浓__)=_=_=__2K__C_l_+__2_C_r_C__l3_+__3_C_l_2↑__+__7_H__2_O______。 (3) KClO3 与浓盐酸反应制氯气 化学方程式: _K__C_l_O_3_+__6_H__C_l_(浓__)_=_=_=_K__C_l_+__3_C_l_2↑___+__3_H_2_O__________________。 (4) Ca(ClO)2 与浓盐酸反应制氯气 化学方程式: _C_a_(_C_l_O_)_2_+__4_H_C__l(_浓__)=_=__=_C_a_C_l_2_+__2_C_l_2↑__+__2_H__2O________________。
含氯化合物 1. 次氯酸(HClO)
光照 (1) HClO不稳定性,见光易分解:2HClO ===== 2HCl+O2↑,所以久置的氯水将 成为稀盐酸。 (2) HClO具有较强的氧化性:作杀菌消毒剂、漂白剂。 (3) HClO是弱酸,酸性比碳酸弱。
2. 漂白粉 (1) 工业上制取漂白粉是用氯气与石灰乳反应制得,不是用氯气与石灰水反应制 得。漂白粉是混合物[CaCl2、Ca(ClO)2],其中有效成分是____C_a_(_C_l_O_)_2_____。 (2) 漂白粉的漂白原理: 在潮湿的空气中能吸收CO2,化学方程式: _C__a_(C__lO__)2_+__C_O__2_+__H_2_O_=_=_=__2_H_C__lO__+__C_a_C__O_3_____________________。 漂白粉要密封保存,漂白粉失效的原因:
高三一轮复习氯及其化合物性质氯气制备卤素的性质PPT课件

第27页/共65页
一套完整的气体制取装置应该包括哪几步?
•气体发生装置 •气体净化装置 •气体收集装置 •尾气处理装置 10min时间学习复习92页气体的实验室制备,净化和收集
第28页/共65页
1.气体发生装置
长颈漏斗
分液漏斗 圆底烧瓶
固-固加热型 例如:制O2,NH3
固-液常温型
固(液)-液加热型
()
B.pH 减小,Cl-浓度增大
C.pH 增大,Cl-浓度减小
D.pH 减小,HClO 浓度减小
氯水中存在如下平衡:Cl2+H2O H++Cl-+HClO。加入 Na2CO3 粉末,与溶液中的 H+反应,上述平衡正移,c(Cl-)和 c(HClO)均增大,c(H+)减小,pH 增大。
第20页/共65页
氢气与氯气点燃反应的现象
2.次氯酸的性质
3.氯水的成分及保存
4.漂白物质的分类与举例。
5.新制氯水,久制氯水,液氯的区别
6.根据
平衡移动原理:
(1)用排饱和食盐水的方法收集Cl2的原理是什么?
(2)除去Cl2中混有的HCl气体时,所选最佳试剂是什么?
(3)如何制备较高纯度的次氯酸?
第25页/共65页
应用
①用饱和食盐水除Cl2中的 HCl ②用排饱和食盐水法收集 Cl2 次氯酸盐与浓盐酸反应制 Cl2 用NaOH溶液吸收多余Cl2
制漂白粉
制高浓度的HClO溶液
氯水避光保存或现用现配
第19页/共65页
[典题示例] 1.在新制的氯水中加入少量碳酸钠粉末,下列说法正确的是
A.pH 增大,HClO 浓度增大
完成高考领航71页题组一、题组二
第26页/共65页
氯气是一种性质活泼的气体,以氯气的实验室制备、性质探 究为素材的实验题目在高考实验类试题中占有较大的比重。如 2016 年四川卷 T9、2015 年江苏卷 T19、福建卷 T25、海南卷 T17、 重庆卷 T9。高考题在书外,理在书中。高考实验无非是教材实验 的创新考查而已。
一套完整的气体制取装置应该包括哪几步?
•气体发生装置 •气体净化装置 •气体收集装置 •尾气处理装置 10min时间学习复习92页气体的实验室制备,净化和收集
第28页/共65页
1.气体发生装置
长颈漏斗
分液漏斗 圆底烧瓶
固-固加热型 例如:制O2,NH3
固-液常温型
固(液)-液加热型
()
B.pH 减小,Cl-浓度增大
C.pH 增大,Cl-浓度减小
D.pH 减小,HClO 浓度减小
氯水中存在如下平衡:Cl2+H2O H++Cl-+HClO。加入 Na2CO3 粉末,与溶液中的 H+反应,上述平衡正移,c(Cl-)和 c(HClO)均增大,c(H+)减小,pH 增大。
第20页/共65页
氢气与氯气点燃反应的现象
2.次氯酸的性质
3.氯水的成分及保存
4.漂白物质的分类与举例。
5.新制氯水,久制氯水,液氯的区别
6.根据
平衡移动原理:
(1)用排饱和食盐水的方法收集Cl2的原理是什么?
(2)除去Cl2中混有的HCl气体时,所选最佳试剂是什么?
(3)如何制备较高纯度的次氯酸?
第25页/共65页
应用
①用饱和食盐水除Cl2中的 HCl ②用排饱和食盐水法收集 Cl2 次氯酸盐与浓盐酸反应制 Cl2 用NaOH溶液吸收多余Cl2
制漂白粉
制高浓度的HClO溶液
氯水避光保存或现用现配
第19页/共65页
[典题示例] 1.在新制的氯水中加入少量碳酸钠粉末,下列说法正确的是
A.pH 增大,HClO 浓度增大
完成高考领航71页题组一、题组二
第26页/共65页
氯气是一种性质活泼的气体,以氯气的实验室制备、性质探 究为素材的实验题目在高考实验类试题中占有较大的比重。如 2016 年四川卷 T9、2015 年江苏卷 T19、福建卷 T25、海南卷 T17、 重庆卷 T9。高考题在书外,理在书中。高考实验无非是教材实验 的创新考查而已。
高三化学第一轮复习氯及其化合物(人教版)精品PPT课件

命题点 2 氯水中的平衡移动及应用
Cl2+H2O ⇌ HCl+HClO 平衡移动的应用
向氯水中加入
平衡移动
浓度变化
的物质
的方向
应用
可溶性氯化物 c(Cl-)增大
左移
①用饱和食盐水除Cl2中的 HCl ②用排饱和食盐水法收集
盐酸
c(H+)和c(Cl-) 增大
左移
Cl2 次氯酸盐与浓盐酸反应制 Cl2
1.氯水的成分 氯 水 中 存 在 三 个 平 衡 : ①Cl2 + H2O ⇌ HCl + HClO , ②HClO ⇌ H++ClO-,③H2O ⇌ H++OH-。根据可逆反应的 特点,即可得出氯水中存在的各种微粒。
2.氯水的多重性质 新制氯水的多种成分决定了它具有多重性质,在不同的反应 中,新制氯水中起作用的成分不同。
点燃 b.与铜反应: Cu+Cl2=====CuCl2 。
②与非金属反应: 点燃
与 H2 反应:H2+Cl2=====2HCl ,
③与水反应:溶于水的氯气部分与水反应,离子方程式为 _C__l2_+ __H__2O__⇌___H__+_+__C_l_-_+__H_C__lO___
④与碱反应:与 NaOH 溶液反应,离子方程式为 Cl2+2OH-===Cl-+ClO-+H2O
A.pH 增大,HClO 浓度增大
(
)
B.pH 减小,Cl-浓度增大
C.pH 增大,Cl-浓度减小
D.pH 减小,HClO 浓度减小
氯 水 中 存 在 如 下 平 衡 : Cl2 + H2O H + + Cl - + HClO 。 加 入 Na2CO3 粉末,与溶液中的 H+反应,上述平衡正移,c(Cl-)和 c(HClO)均增大,c(H+)减小,pH 增大。
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【解析】 钠着火燃烧产生黄色火焰,A错误;氯气性质活 泼,易与活泼金属钠发生化合反应生成NaCl,反应时有大量 白烟,B正确;氯气有毒,不能排放到空气中,氯气易与 NaOH溶液反应而被吸收,C正确;氯气具有强氧化性,与碘 化钾发生置换反应,可根据其颜色变化判断氯气是否被碱液 完全吸收,棉球②变蓝色则证明氯气未被碱液完全吸收,不 变蓝证明吸收完全,D正确。
【答案】 A
2.(2018·江苏苏锡常镇四市一模)下列有关实验装置进行 的相应实验,不能达到实验目的的是( )
A.用装置甲制取氯气 B.用装置乙除去氯气中的少量氯化氢和水蒸气 C.用装置丙可证明Cl2的氧化性强于S D.用装置丁可以完成“喷泉”实验 【解析】 乙装置中应最后除水蒸气,B错误。 【答案】 B
1.判断正误(正确的打“√”,错误的打“×”)。 (1)过量的铁粉在少量氯气中加热,充分反应后产物为 FeCl2(×) (2)氯气溶于水得氯水,溶液呈酸性且可以导电,所以氯气是 电解质(×) (3)新制氯水必须用棕色瓶密封保存,光照氯水有气泡逸出, 该气体是氯气(×) (4)新制取的漂白粉是混合物 (√)
(4)用MnO2和浓盐酸制取Cl2的反应中,氧化剂与还原剂物 质的量之比为1∶4(×)
(5)检验氯气可用湿润的淀粉K置→收集 或性质验证装置→尾气处理装置 (√)
2.下图是用KMnO4与浓盐酸反应制取适量氯气的简易装 置。
装置B、C、D的作用分别是: B_______________________________________________; C_______________________________________________; D_______________________________________________。 【答案】 向上排气收集氯气 安全作用,防止D中的液体 倒吸进入集气管B中 吸收尾气,防止氯气扩散到空气中污 染环境
(5)氯气可以使湿润的有色布条褪色,但是实际起漂白作用的
物质是次氯酸,而不是氯气(√)
(6)Cl2 具有很强的氧化性,在化学反应中只能作氧化剂(×)
(7)Cl2 通入水中的离子方程式为 Cl2+H2O
2H++Cl-+
ClO-(×)
(8)用 pH 试纸测定氯水的 pH 为 4(×)
2.在空气中长时间放置的漂白粉,最终得到的主要固 体物质是什么?用方程式表示漂白粉在空气中久置变质的 过程。
-强,从图中可知,c(HClO)在 pH=7.5 时比在 pH=6.5 时低,则
杀菌效果较差,C 项正确;夏季温度高,氯的溶解能力变差,杀
菌效果也变差,D 项错误。
【答案】 C
【知识归纳】 Cl2+H2O HCl+HClO平衡移动的应用
考点3 次氯酸、次氯酸盐的性质与应用 7.判断正误(正确的打“√”,错误的打“×”)。 (1)(2016·全国丙卷)漂白粉能漂白织物的原因是次氯酸盐具 有氧化性(√) (2)(2014·全国卷Ⅰ)漂白粉在空气中久置变质,是因为漂白 粉中的CaCl2与空气中的CO2反应生成了CaCO3(×) (3)(2015·上海高考)HClO见光不会分解 (×) (4)(2015·四川高考)漂粉精作消毒剂,起还原作用(×) (5)(2014·安徽高考)由较强酸可以制取较弱的酸的规律可推 出次氯酸溶液无法制取盐酸(×)
【解析】 Cl2(g)+H2O
2H++ClO-+Cl-,K=K1×K2
×Ka,由图可得 Ka=10-7.5,故 K 值为 10-12.1,A 项错误;根据电
荷守恒得,c(H+)=c(OH-)+c(ClO-)+c(Cl-),而 c(HClO)由于部
分电离而不等于 c(Cl-),B 项错误;已知 HClO 的杀菌能力比 ClO
2.(2018·上海浦东新区期中考试)某兴趣小组设计如下装 置进行氯气与金属钠的反应,先将钠预热,在钠熔融成小球 时,撤火,并通入氯气即发生反应,下列叙述中错误的是
()
A.钠着火剧烈燃烧产生苍白色的火焰 B.反应产生的大量白烟是氯化钠固体 C.棉球①的作用是吸收过量氯气防止产生污染 D.棉球②变蓝色则证明氯气未被碱液完全吸收
正确;B 项,若加入稀硫酸,使溶液中 c(H+)增大,平衡逆向移动,
溶液的漂白性减弱,错误;C 项,加入氯化钙溶液,不能发生反
应,但对氯水起稀释作用,使溶液的漂白性减弱,错误;D 项,
加入二氧化硫的水溶液,SO2 与 Cl2 反应,平衡左移,c(HClO)减 小,溶液的漂白性减弱,错误。
【答案】 A
【答案】 A
【方法总结】 氯水成分和多重性质的实验探究方法 新制氯水的多种成分决定了它具有多重性质,在不同的化 学反应中,氯水中参与反应的微粒不同。
考点2 氯水中的化学反应原理及应用
5.(2016·上海高考)向新制氯水中加入少量下列物质,能
增强溶液漂白能力的是( )
A.碳酸钙粉末
B.稀硫酸
C.氯化钙溶液
第13讲 氯及其化合物 卤素
[考纲要求] 1.掌握氯单质及其重要化合物的主要性质及应用 。2.了解氯单质及其重要化合物对环境质量的影响。3.掌握氯 气的实验室制法(包括所用试剂、仪器,反应原理和收集方法 )。4.了解卤族元素的性质递变规律及与化工生产相结合的资 源综合利用。
高频考点一 氯及其化合物的性质与应用
-会发生氧化还原反应生成 Cl2。D.HClO 有较强的漂白性。因为
CH3COOH 的酸性强于 HClO,在该消毒液中加入 CH3COOH,会 使 CH3COOH 与 ClO-反应生成 HClO,增强其漂白性。
【答案】 B
【说明】 NO3-不同于 ClO-,在酸性条件下 NO3-具有强氧化 性,与 Fe2+、I-、S2-、SO23-不能大量共存,而在碱性条件下, NO-3 与 I-、S2-、SO23-能大量共存。
2.实验装置
3.验满方法 (1)将湿润的淀粉碘化钾试纸靠近盛Cl2的集气瓶口,观察 到试纸立即变__蓝__,则证明已集满。 (2)将湿润的蓝色石蕊试纸靠近盛Cl2的集气瓶口,观察到 试纸__先__变__红__后__褪__色__,则证明已集满。
考点1 氯气制备及其性质探究 1.(2018·宁德高三联考)某化学小组用如图所示装置制取 氯气。下列说法正确的是( )
【解析】 A.将 Cl2 通入 NaOH 溶液中可制得消毒液,离子
方程式为 2OH-+Cl2
Cl-+ClO-+H2O。B.饱和 NaClO 溶
液的 pH 约为 11,现在该消毒液的 pH 为 12,故不可能仅为 ClO-
的水解所致,该消毒液中还含有一定量的 NaOH,是使消毒液的
pH 约为 12 的主要原因。C.该消毒液与洁厕灵混用时,ClO-与 Cl
高频考点二 氯气的实验室制法
1.判断正误(正确的打“√”,错误的打“×”)。 (1)除去氯气中HCl杂质可用饱和食盐水,也可用饱和碳酸 氢钠溶液(×) (2)足量的MnO2与40 mL 10 mol·L-1浓盐酸加热条件下反应 转移0.2 mol电子(×)
(3)用NaOH溶液吸收多余的Cl2时,导气管不能伸到液面以 下,原因是防止倒吸(×)
(4)尾气吸收时,用NaOH溶液吸收Cl2,不能用澄清石灰水 吸收,因为溶液中含Ca(OH)2的量少,吸收不完全。
考点2 氯化物的制备 3.(2018·山东济南诊断)某同学用下列装置制备并检验Cl2 的性质。下列说法正确的是( )
A.图Ⅰ中:如果MnO2过量,浓盐酸就可被全部消耗 B.图Ⅱ中:量筒中发生了取代反应 C.图Ⅲ中:生成蓝色的烟 D.图Ⅳ中:干燥的有色布条褪色,说明氯气有漂白性
【解析】 浓盐酸与二氧化锰的反应过程中浓度逐渐降 低,稀盐酸与二氧化锰不反应,所以图Ⅰ中,如果MnO2 过量,浓盐酸也不可能全部被消耗,A错误;图Ⅱ中,量 筒内发生了甲烷和氯气的取代反应,B正确;图Ⅲ中,铜 和氯气反应生成氯化铜,产生棕黄色的烟,C错误;氯气 与水反应生成的次氯酸具有漂白性,因此图Ⅳ中湿润的有 色布条褪色,D错误。
【答案】 A
(二)氯水的性质及应用 3.(2017·宁德模拟)某同学在一pH试纸上滴几滴新制的氯 水,现象如图所示,下列有关该实验的说法中正确的是 ()
A.该实验说明Cl2分子具有漂白性 B.该实验说明H+扩散速度比HClO分子快 C.将实验后的pH试纸在酒精灯上微热,试纸又恢复为原 来的颜色 D.若用久置的氯水进行实验,现象相同
二、次氯酸和次氯酸盐的性质 1.次氯酸
【注意】 (1)氯水中的HClO见光易分解,通常保存在棕色 试剂瓶中并置于阴暗处。
(2)HClO不稳定,不能单独存在,只存在于氯水、次氯酸 盐溶液或次氯酸盐与酸反应的混合物中。
2.次氯酸盐 (1)漂白液
考点1 氯气、氯水的性质及应用 (一)氯气的性质及应用 1.判断正误(正确的打“√”,错误的打“×”)。 (1)(2016·四川高考)氯气作水的杀菌消毒剂时没有发生化学 变化(×) (2)(2016·上海高考)Cl2能使湿润的淀粉碘化钾试纸变蓝, 说明Cl2具有氧化性(√)
【解析】 HClO具有漂白性,Cl2无漂白性,A项错误。 久置的氯水主要成分为稀盐酸,无漂白性,D项错误。 HClO的漂白持久、稳定,实验后的pH试纸加热不会恢复原 来的颜色,C项错误。
【答案】 B
4.(2017·秦皇岛模拟)氯水中存在多种分子和离子,可通 过实验的方法加以确定。下列有关氯水中存在的粒子的说法
A.该装置图中至少存在三处明显错误 B.该实验中收集氯气的方法不正确 C.如果需要得到干燥纯净的Cl2,只需在气体发生装置和 收集装置之间连接一个装有浓硫酸的洗气瓶即可 D.含有2 mol HCl的某浓盐酸与足量MnO2混合,在一定 条件下反应,转移1 mol电子
【解析】 A 项,该装置的错误有:没有用酒精灯加热,MnO2 不与浓盐酸发生反应,从而得不到 Cl2;装置中没有用分液漏斗 而采用长颈漏斗导致气体外逸和 HCl 的挥发;没有进行尾气处理;
