碳酸钠-碳酸氢钠缓冲液(0.1mol-L,pH9.16-10.83)使用说明
生物实验中常见buffer的配制

常用缓冲溶液配置方法常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)X甘氨酸分子量= 75.07,0.2 mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)X邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升Na2HPO4分子量= 14.98,0.2 mol/L溶液为28.40克/升。
Na2HPO4-2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
4①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
②5柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1 mol/L溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L)Na 2Ac·3H 2O 分子量 = 136.09,0.2 mol/L 溶液为27.22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2)Na 2HPO 4·2H 2O 分子量 = 178.05,0.2 mol/L 溶液为85.61克/升。
Na 2HPO 4·2H 2O 分子量 = 358.22,0.2 mol/L 溶液为71.64克/升。
Na 2HPO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。
(2)磷酸氢二钠–磷酸二氢钾缓冲液(1/15 mol/L )Na2HPO4·2H2O分子量= 178.05,1/15M溶液为11.876克/升。
KH2PO4分子量= 136.09,1/15M溶液为9.078克/升。
常用缓冲溶液的配制及PH计校正溶液配置方法

常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液24Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液① 使用时可以每升中加入1克克酚,若最后pH 值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L )6872柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量294.12,0.1mol/L 溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L )Na 2Ac·3H 2O 分子量 = 136.09,0.2 mol/L 溶液为27.22克/升。
7.磷酸盐缓冲液242Na 2HPO 4·12H 2O 分子量 = 358.22,0.2 mol/L 溶液为71.64克/升。
Na 2HPO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。
(2)磷酸氢二钠–磷酸二氢钾缓冲液(1/15 mol/L )242KH 2PO 4分子量 = 136.09,1/15M 溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M )9.巴比妥钠-盐酸缓冲液(18℃)10.Tris–盐酸缓冲液(0.05M ,25℃)50毫升0.1M 三羟甲基氨基甲烷(Tris )溶液与X 毫升0.1N 盐酸混匀后,加水稀释至100三羟甲基氨基甲烷(Tris )HOCH2 CH2OH CHOCH2 NH2分子量=121.14;0. 1M 溶液为12.114克/升。
碳酸氢钠碳酸钠缓冲液的配置

碳酸氢钠碳酸钠缓冲液的配置
碳酸氢钠碳酸钠缓冲液是一种常用的缓冲液,可以用于调节溶液的pH 值。
它的配置方法如下:
1. 准备所需试剂:碳酸氢钠(NaHCO3)、碳酸钠(Na2CO3)、去离子水。
2. 根据所需pH值和缓冲液体积,计算所需的碳酸氢钠和碳酸钠的摩尔浓度。
碳酸氢钠和碳酸钠的摩尔浓度比应为1:1,可以根据以下公式计算:
C1 = 10^(pKa - pH)
C2 = 10^(pH - pKa)
其中,C1为碳酸氢钠的摩尔浓度,C2为碳酸钠的摩尔浓度,pKa为碳酸氢钠和碳酸钠的共同pKa值,pH为所需的缓冲液pH值。
3. 根据计算得到的摩尔浓度和缓冲液体积,计算所需的碳酸氢钠和碳酸钠的质量。
可以使用以下公式:
m1 = C1 * V * M1
m2 = C2 * V * M2
其中,m1为碳酸氢钠的质量,m2为碳酸钠的质量,V为缓冲液体积,M1和M2分别为碳酸氢钠和碳酸钠的摩尔质量。
4. 将计算得到的碳酸氢钠和碳酸钠分别加入到去离子水中,搅拌至完
全溶解。
5. 根据需要,可以使用酸或碱调节缓冲液的pH值。
需要注意的是,碳酸氢钠碳酸钠缓冲液的pH值受温度影响较大,因
此在配置时应注意控制温度。
此外,碳酸氢钠碳酸钠缓冲液的pH值
范围较窄,一般适用于pH值在8.0-10.0之间的实验。
如果需要在其
他pH值范围内进行实验,可以选择其他适合的缓冲液。
常用缓冲溶液的配制方法
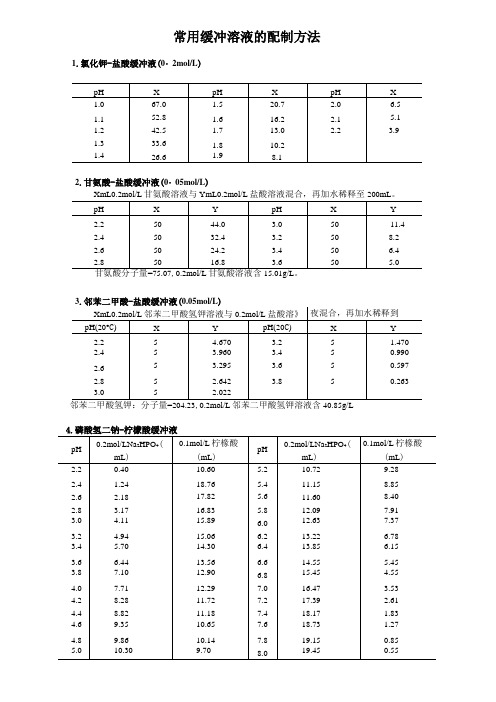
常用缓冲溶液的配制方法1.氯化钾-盐酸缓冲液(0・2mol/L)邻苯二甲酸氢钾:分子量=204.23,0.2mol/L邻苯二甲酸氢钾溶液含40.85g/L 4.磷酸氢二钠-柠檬酸缓冲液pH 0.2mol/LNa2HPO4(mL)0.1mol/L柠椽酸(mL)pH0.2mol/LNa2HPO4(mL)0.1mol/L柠椽酸(mL)2.2 0.40 10.60 5.2 10.72 9.28 2.4 1.24 18.76 5.4 11.15 8.85 2.6 2.18 17.82 5.6 11.60 8.402.83.17 16.83 5.8 12.09 7.913.04.11 15.896.0 12.637.373.24.94 15.066.2 13.22 6.78 3.4 5.70 14.30 6.4 13.85 6.153.6 6.44 13.56 6.6 14.555.453.8 7.10 12.90 6.8 15.454.554.0 7.71 12.29 7.0 16.47 3.53 4.2 8.28 11.72 7.2 17.39 2.61 4.4 8.82 11.18 7.4 18.17 1.83 4.6 9.35 10.65 7.6 18.73 1.274.8 9.86 10.14 7.8 19.15 0.85Na2HPO4分子量=141.98,0.2mol/L溶液为28.40g/L。
Na2HPO4・2H2O分子量=178.05,0.2mol/L溶液含35.61g/L。
C6H8O7•H2O分子量=210.14,0.1mol/L溶液为21.01g/L。
5.使用时可以向每升混合液中加入1g酚,若最后p H值有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。
6•柠檬酸-柠檬酸钠缓冲液(0・1mol/L)柠檬酸C6H8O7・H2O:分子量210.14,0.1mol/L溶液为21.01g/L。
常用缓冲溶液的配制方法
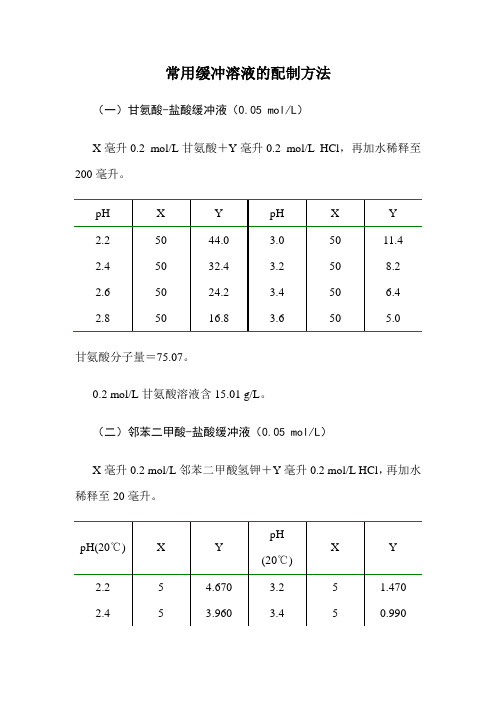
常用缓冲溶液的配制方法(一)甘氨酸-盐酸缓冲液(0.05 mol/L)X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCl,再加水稀释至200毫升。
甘氨酸分子量=75.07。
0.2 mol/L甘氨酸溶液含15.01 g/L。
(二)邻苯二甲酸-盐酸缓冲液(0.05 mol/L)X毫升0.2 mol/L邻苯二甲酸氢钾+Y毫升0.2 mol/L HCl,再加水稀释至20毫升。
邻苯二甲酸氢钾分子量=204.23。
0.2 mol/L邻苯二甲酸氢钾溶液含40.85 g/L。
(三)磷酸氢二钠-柠檬酸缓冲液Na 2HPO 4分子量=141.98;0.2 mol/L 溶液为28.40 g/L 。
Na 2HPO 4·2H 2O 分子量=178.05;0.2 mol/L 溶液为35.61 g/L 。
Na 2HPO 4·12H 2O 分子量=358.22;0.2 mol/L 溶液为71.64 g/L 。
C 6H 8O 7·H 2O 分子量=210.14;0.1 mol/L 溶液为21.01 g/L 。
(四)柠檬酸-氢氧化钠-盐酸缓冲液①使用时能够每升中加入1克酚,若最后pH值有变化,再用少量50%氢氧化钠溶液或者浓盐酸调节,冰箱储存。
(五)柠檬酸-柠檬酸钠缓冲液(0.1 mol/L)柠檬酸:C6H8O7·H2O分子量=210.14 ;0.1 mol/L溶液为21.01 g/L。
柠檬酸钠:Na3C6H5O7·2H2O分子量=294.12 ;0.1 mol/L溶液为29.41 g/L。
(六)醋酸-醋酸钠缓冲液(0.2 mol/L)NaAc·3H2O分子量=136.09;0.2 mol/L溶液为27.22 g/L。
冰乙酸11.8 mL稀释至1 L(需标定)。
(七)磷酸二氢钾-氢氧化钠缓冲液(0.05 mol/L)X 毫升0.2 mol/L KH2PO4+Y毫升0.2 mol/L NaOH 加水稀释至20毫升。
不同PH值溶液的配置

常用pH缓冲溶液的配制和pH值那就配磷酸缓冲液吧。
1/15mol/L PBS(磷酸缓冲液Phosphate Buffer Solution,PBS)甲液:1/15mol/L Na2HPO4溶液Na2HPO4 9.465g蒸馏水加至1000ml乙液:l/15mol/L KH2PO4溶液KH2P04 9.07g蒸馏水加至1000m1分装在棕色瓶内,于4℃冰箱中保存,用时甲、乙两液各按不同比例混合,即可得所需pH的缓冲液,见下表:pH 甲液ml 乙液mI5.29 2.5 97.55.59 5.0 95.05.91 10.0 90.06.24 20.0 80.06.47 30.0 70.06.64 40.0 60.06.81 50.0 50.06.98 60.0 40.07.17 70.0 30.07.38 80.0 20.07.73 90.0 10.08.04 95.0 5.0(二)0.067(1/15)Mol/L磷酸缓冲液1.1/15Mol/L磷酸二氢钾溶液的配制:称取磷酸二氢钾(KH2PO4,A.R.)9.08g,用蒸馏水溶解后,倾入1 000ml容量瓶内,再稀释至刻度(1 000ml)。
2.1/15Mol/L磷酸二氢钠溶液的配制:称取无水磷酸氢二钠(Na2HPO4,A.R.)9.47g(或者Na2HPO4·2H2O 11.87g)用蒸馏水溶解后,放入1 000ml容量瓶内,再加蒸馏水稀释至刻度(1 000ml)。
3.按附表的比例,配制成不同pH值的缓冲溶液。
3.磷酸氢二钠-柠檬酸缓冲液pH 0.2M Na2HPO4/ml 0.1M柠檬酸/ml pH 0.2M Na2HPO4/ml 0.1M柠檬酸/ml2.2 0.40 19.6 5.2 10.72 9.282.4 1.24 18.76 5.4 11.15 8.852.6 2.18 17.82 5.6 11.60 8.402.83.17 16.83 5.8 12.09 7.913.04.11 15.896.0 12.637.373.24.94 15.066.2 13.22 6.783.4 5.70 14.30 6.4 13.85 6.153.6 6.44 13.56 6.6 14.555.453.8 7.10 12.90 6.8 15.454.554.0 7.71 12.29 7.0 16.47 3.534.2 8.28 11.72 7.2 17.39 2.614.4 8.82 11.18 7.4 18.17 1.834.6 9.35 10.65 7.6 18.73 1.274.8 9.86 10.14 7.8 19.15 0.855.0 10.30 9.70 8.0 19.45 0.55Na2HPO4分子量=141.98 0.2M溶液含28.40g/LNa2HPO4·2H2O分子量=178.05 0.2M溶液含35.61g/LC6H8O7·H2O分子量=210.14 0.1M溶液含21.01g/L16.硼砂—氢氧化钠缓冲液(0.05mol/L硼酸根)x ml 0.05mol/L硼砂+y ml 0.2mol/L NaOH,加水稀释至200mlpH x/ml y/ml pH x/ml y/ml9.3 50 6.0 9.8 50 34.09.4 50 11.0 10.0 50 43.09.6 50 23.0 10.1 50 46.0硼砂Na2B4O7•10H2O,Mr = 381.43,0.05mol/L溶液为19.07g/L17.碳酸钠—碳酸氢钠缓冲液(0.1mol/L)Ca2+、Mg2+存在时不得使用pH 0.1mol/L碳酸钠/ml 0.1mol/L碳酸氢钠/ml20℃37℃9.16 8.77 1 99.40 9.12 2 89.51 9.40 3 79.78 9.50 4 69.90 9.72 5 510.14 9.90 6 410.28 10.08 7 310.53 10.28 8 210.83 10.57 9 1无水碳酸钠Mr = 105.99,0.1mol/L溶液为10.60g/L碳酸氢钠Mr = 84.01,0.1mol/L溶液为8.40g/L19.氯化钾—氢氧化钠缓冲液25ml 0.2mol/L KCl+x ml 0.2mol/L NaOH,加水稀释至100ml pH x/ml pH x/ml pH x/ml12.0 6.0 12.4 16.2 12.8 41.212.1 8.0 12.5 20.4 12.9 53.012.2 10.2 12.6 25.6 13.0 66.012.3 12.8 12.7 32.2KCl Mr = 74.55;0.2mol/L溶液为14.91g/L。
碳酸氢钠缓冲溶液的配制

碳酸氢钠缓冲溶液的配制碳酸氢钠缓冲溶液是一种常用的缓冲溶液,它可以在生物化学实验中起到重要的作用。
下面将介绍碳酸氢钠缓冲溶液的配制方法。
一、理论基础碳酸氢钠缓冲溶液是一种弱酸弱碱缓冲溶液,其化学式为NaHCO3。
在水中溶解时,NaHCO3会分解成Na+、HCO3-和H2O,其中HCO3-是一种弱酸,可以与OH-反应生成CO32-和H2O,从而起到缓冲作用。
二、配制方法1. 确定所需浓度和体积首先需要确定所需的碳酸氢钠缓冲溶液的浓度和体积。
一般来说,浓度为0.1M的碳酸氢钠缓冲溶液是最常用的,而体积则根据实验需要而定。
2. 计算所需物质的质量根据所需浓度和体积,可以计算出所需的NaHCO3的质量。
NaHCO3的摩尔质量为84.01g/mol,因此可以使用下面的公式计算所需质量:所需质量(g)=浓度(mol/L)×体积(L)×摩尔质量(g/mol)3. 加入适量的水将计算出的NaHCO3质量加入适量的去离子水中,搅拌至完全溶解。
4. 调节pH值由于NaHCO3是一种弱酸,因此在缓冲溶液中,pH值会受到CO2的影响而发生变化。
为了保持缓冲溶液的稳定性,需要将pH值调节到所需范围内。
一般来说,碳酸氢钠缓冲溶液的pH值在8.2左右。
5. 调整体积最后,根据实验需要,可以将缓冲溶液的体积调整至所需的体积。
三、注意事项1. NaHCO3在空气中容易吸收水分和CO2,因此需要保存在干燥的环境中。
2. 在配制缓冲溶液时,需要使用去离子水或高纯度水,以避免杂质对实验结果的影响。
3. 在调节pH值时,可以使用pH计或指示剂来检测pH值。
4. 在调整体积时,需要注意溶液的浓度和体积的准确性,以保证实验结果的可靠性。
综上所述,碳酸氢钠缓冲溶液的配制方法相对简单,但需要注意一些细节问题。
只有在正确的配制下,才能保证实验结果的准确性和可靠性。
标准缓冲液pH值与温度对照表
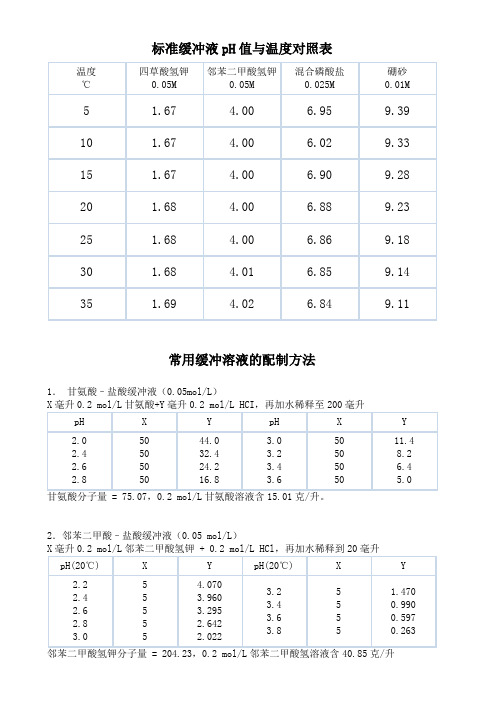
标准缓冲液pH值与温度对照表常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)3.磷酸氢二钠–柠檬酸缓冲液Na 2HPO 4分子量 = 142.98,0.2 mol/L 溶液为28.40克/升。
Na 2HPO 4·2H 2O 分子量 = 178.05,0.2 mol/L 溶液含35.61克/升。
C 4H 2O 7·H 2O 分子量 = 210.14,0.1 mol/L 溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液 ① 使用时可以每升中加入1克克酚,若最后pH 值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
②柠檬酸C 6H 8O 7·H 2O :分子量210.14,0.1 mol/L 溶液为21.01克/升。
6872柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量294.12,0.1 mol/L 溶液为29.41克/毫升。
227.磷酸盐缓冲液242NaH 2PO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。
242KH 2PO 4分子量 = 136.09,1/15M 溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M )10.Tris –盐酸缓冲液(0.05M ,25℃)50毫升0.1M 三羟甲基氨基甲烷(Tris )溶液与X 毫升0.1N 盐酸混匀后,加水稀释至100毫升。
232升。
Tris 溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。
2472硼酸H 2BO 3,分子量=61.84,0.2M 溶液为12.37克/升。
硼砂易失去结晶水,必须在带塞的瓶中保存。
2472硼酸H 2BO 3,分子量=61.84, 0.2M 溶液为12.37克/升。
硼砂易失去结晶水,必须在带塞的瓶中保存。
12.甘氨酸–氢氧化钠缓冲液(0.05M )13.硼砂-氢氧化钠缓冲液(0.05M 硼酸根)14.碳酸钠-碳酸氢钠缓冲液(0.1M )232NaHCO 3分子量=84.0;0.1M 溶液为8.40克/升。
常用缓冲溶液的配置方法
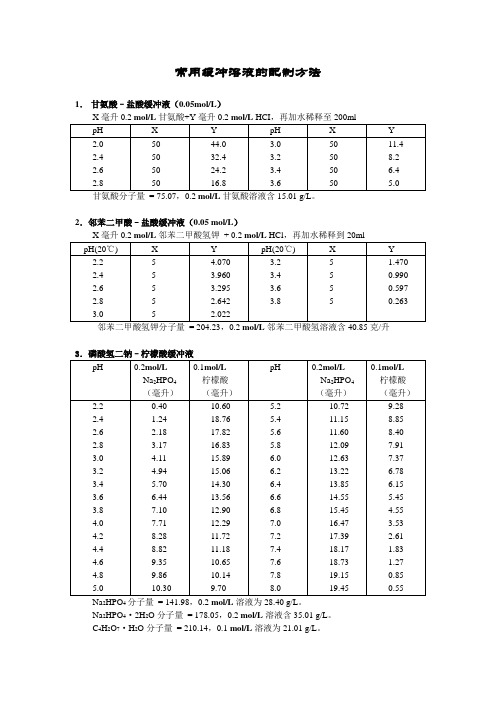
常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液24Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液含35.01 g/L。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01 g/L。
① 使用时可以每升中加入1g 酚,若最后pH 值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
6872柠檬酸钠Na 3 C 6H 5O7·2H 2O :分子量294.12,0.1 mol/L 溶液为29.41 g/L 。
227.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2 mol/L )Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液为85.61克/升。
Na2HPO4·12H2O分子量= 358.22,0.2 mol/L溶液为71.64克/升。
Na2HPO4·2H2O分子量= 156.03,0.2 mol/L溶液为31.21克/升。
Na2HPO4·2H2O分子量= 178.05,1/15M溶液为11.876克/升。
KH2PO4分子量= 136.09,1/15M溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05 mol/L)巴比妥钠盐分子量=206.18;0.04M 溶液为8.25克/升10.Tris –盐酸缓冲液(0.05M ,25℃)50毫升0.1M 三羟甲基氨基甲烷(Tris )溶液与X 毫升0.1N 盐酸混匀后,加水稀释至100吸收二氧化碳,使用时注意将瓶盖严。
11.硼酸–硼砂缓冲液(0.2M 硼酸根)硼砂Na 2B 4O 7·H 2O,分子量=381.43;0.05M 溶液(=0.2M 硼酸根)含19.07克/升。
不同PH值溶液的配置

常用pH缓冲溶液的配制和pH值那就配磷酸缓冲液吧。
1/15mol/L PBS(磷酸缓冲液Phosphate Buffer Solution,PBS)甲液:1/15mol/L Na2HPO4溶液Na2HPO4 9.465g蒸馏水加至1000ml乙液:l/15mol/L KH2PO4溶液KH2P04 9.07g蒸馏水加至1000m1分装在棕色瓶内,于4℃冰箱中保存,用时甲、乙两液各按不同比例混合,即可得所需pH的缓冲液,见下表:pH 甲液ml 乙液mI5.29 2.5 97.55.59 5.0 95.05.91 10.0 90.06.24 20.0 80.06.47 30.0 70.06.64 40.0 60.06.81 50.0 50.06.98 60.0 40.07.17 70.0 30.07.38 80.0 20.07.73 90.0 10.08.04 95.0 5.0(二)0.067(1/15)Mol/L磷酸缓冲液1.1/15Mol/L磷酸二氢钾溶液的配制:称取磷酸二氢钾(KH2PO4,A.R.)9.08g,用蒸馏水溶解后,倾入1 000ml容量瓶内,再稀释至刻度(1 000ml)。
2.1/15Mol/L磷酸二氢钠溶液的配制:称取无水磷酸氢二钠(Na2HPO4,A.R.)9.47g(或者Na2HPO4·2H2O 11.87g)用蒸馏水溶解后,放入1 000ml容量瓶内,再加蒸馏水稀释至刻度(1 000ml)。
3.按附表的比例,配制成不同pH值的缓冲溶液。
3.磷酸氢二钠-柠檬酸缓冲液pH 0.2M Na2HPO4/ml 0.1M柠檬酸/ml pH 0.2M Na2HPO4/ml 0.1M柠檬酸/ml2.2 0.40 19.6 5.2 10.72 9.282.4 1.24 18.76 5.4 11.15 8.852.6 2.18 17.82 5.6 11.60 8.402.83.17 16.83 5.8 12.09 7.913.04.11 15.896.0 12.637.373.24.94 15.066.2 13.22 6.783.4 5.70 14.30 6.4 13.85 6.153.6 6.44 13.56 6.6 14.555.453.8 7.10 12.90 6.8 15.454.554.0 7.71 12.29 7.0 16.47 3.534.2 8.28 11.72 7.2 17.39 2.614.4 8.82 11.18 7.4 18.17 1.834.6 9.35 10.65 7.6 18.73 1.274.8 9.86 10.14 7.8 19.15 0.855.0 10.30 9.70 8.0 19.45 0.55Na2HPO4分子量=141.98 0.2M溶液含28.40g/LNa2HPO4·2H2O分子量=178.05 0.2M溶液含35.61g/LC6H8O7·H2O分子量=210.14 0.1M溶液含21.01g/L16.硼砂—氢氧化钠缓冲液(0.05mol/L硼酸根)x ml 0.05mol/L硼砂+y ml 0.2mol/L NaOH,加水稀释至200mlpH x/ml y/ml pH x/ml y/ml9.3 50 6.0 9.8 50 34.09.4 50 11.0 10.0 50 43.09.6 50 23.0 10.1 50 46.0硼砂Na2B4O7•10H2O,Mr = 381.43,0.05mol/L溶液为19.07g/L17.碳酸钠—碳酸氢钠缓冲液(0.1mol/L)Ca2+、Mg2+存在时不得使用pH 0.1mol/L碳酸钠/ml 0.1mol/L碳酸氢钠/ml20℃37℃9.16 8.77 1 99.40 9.12 2 89.51 9.40 3 79.78 9.50 4 69.90 9.72 5 510.14 9.90 6 410.28 10.08 7 310.53 10.28 8 210.83 10.57 9 1无水碳酸钠Mr = 105.99,0.1mol/L溶液为10.60g/L碳酸氢钠Mr = 84.01,0.1mol/L溶液为8.40g/L19.氯化钾—氢氧化钠缓冲液25ml 0.2mol/L KCl+x ml 0.2mol/L NaOH,加水稀释至100ml pH x/ml pH x/ml pH x/ml12.0 6.0 12.4 16.2 12.8 41.212.1 8.0 12.5 20.4 12.9 53.012.2 10.2 12.6 25.6 13.0 66.012.3 12.8 12.7 32.2KCl Mr = 74.55;0.2mol/L溶液为14.91g/L。
碳酸钠与碳酸氢钠缓冲溶液的缓冲原理

碳酸钠与碳酸氢钠缓冲溶液的缓冲原理一、引言缓冲溶液是化学实验和生物实验中常用的一种溶液,它能够维持溶液的酸碱度在一定范围内保持稳定。
碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)是常用的缓冲剂之一,它们能够形成碳酸盐体系,起到缓冲作用。
本文将从缓冲溶液的定义、缓冲原理、碳酸钠与碳酸氢钠的缓冲机制等方面进行阐述。
二、缓冲溶液的定义缓冲溶液是指在一定酸碱度范围内,能够抵抗外界酸碱的影响,保持溶液酸碱度稳定的溶液。
当外界加入酸或碱时,缓冲溶液能够通过化学反应吸收或释放H+离子或OH-离子,从而抵消外界酸碱的影响,使溶液的pH值保持不变。
三、缓冲原理缓冲溶液的缓冲原理主要涉及酸碱中和反应和酸碱离子的平衡。
在缓冲溶液中,酸和碱可以通过以下反应进行中和:HA + OH- → A- + H2OHB + H+ → B + H2O其中,HA和A-分别代表弱酸与其共轭碱,HB和B-分别代表弱碱与其共轭酸。
当缓冲溶液中的酸和碱浓度适当时,可以保持酸碱度的稳定。
四、碳酸钠与碳酸氢钠的缓冲机制碳酸钠和碳酸氢钠可以形成碳酸盐体系,起到缓冲作用。
碳酸钠是一种强碱,碳酸氢钠是一种弱碱,它们在水中溶解时会发生以下反应:Na2CO3 + H2O → 2Na+ + CO32- + H2ONaHCO3 + H2O → Na+ + HCO3- + H2O在这两个反应中,碳酸盐离子(CO32-和HCO3-)起到了缓冲作用。
当外界加入酸时,碳酸盐离子可以与酸中的H+离子反应,产生HCO3-离子,从而抵消酸的影响。
当外界加入碱时,碳酸盐离子可以与碱中的OH-离子反应,产生CO32-离子,从而抵消碱的影响。
这样,碳酸钠与碳酸氢钠的缓冲溶液能够保持酸碱度的稳定。
五、碳酸钠与碳酸氢钠缓冲溶液的应用碳酸钠与碳酸氢钠缓冲溶液广泛应用于实验室中,特别是在生物化学实验中。
例如,在DNA电泳实验中,缓冲溶液能够维持电泳缓冲槽中的酸碱度稳定,确保DNA分子在电场中迁移的正常进行。
生化微生物常用缓冲
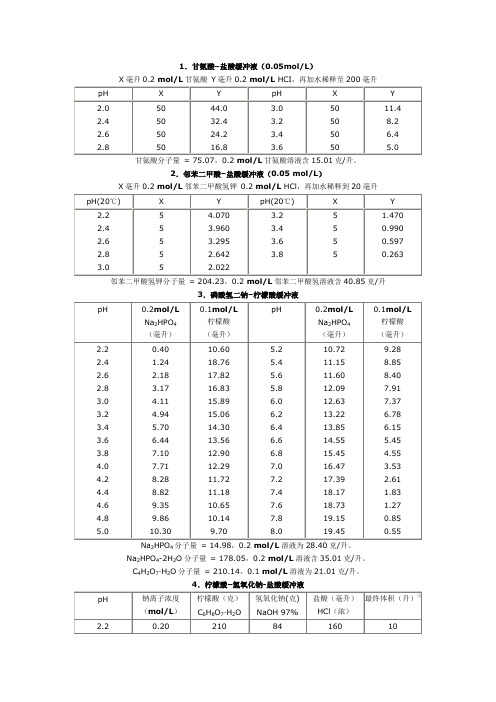
1.甘氨酸–盐酸缓冲液(0.05mol/L)X毫升0.2 mol/L甘氨酸Y毫升0.2 mol/L HCI,再加水稀释至200毫升甘氨酸分子量= 75.07,0.2 mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)X毫升0.2 mol/L邻苯二甲酸氢钾0.2 mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液24分子量= 14.98,0.2 mol/L溶液为28.40克/升。
Na2HPO4-2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液① 使用时可以每升中加入1克克酚,若最后pH 值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
②5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L )柠檬酸C 6872柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量294.12,0.1 mol/L 溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L )2.63.84.0 4.2 4.4 4.60.75 1.20 1.80 2.65 3.70 4.909.25 8.80 8.20 7.35 6.30 5.104.85.0 5.2 5.4 5.6 5.85.90 7.00 7.90 8.60 9.10 9.404.10 3.00 2.10 1.40 0.900.60Na 2Ac·3H 2O 分子量 = 136.09,0.2 mol/L 溶液为27.22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2)242Na 2HPO 4·2H 2O 分子量 = 358.22,0.2 mol/L 溶液为71.64克/升。
缓冲液缓冲范围

常见缓冲液的缓冲范围缓冲液名称及常用浓度缓冲pH范围主要物质分子量MES (2吗啉代乙磺酸) 5.5-6.7 195.2Bis-Tris 5.8-7.2 209.2HEPES 6.8-8.2 238.3PIPES 6.1-7.5 302.4MOPS 6.5-7.9 209.3Tricine 7.4-8.8 179.2TEA (三乙醇胺) 7.4-8.3 149.2甘氨酸-盐酸缓冲液(0.05mol/L) 2.2-5.0 甘氨酸Mr=75.07邻苯二甲酸-盐酸缓冲液(0.05mol/L) 2.2-3.8 邻苯二甲酸氢钾Mr=204.23磷酸氢二钠-柠檬酸缓冲液 2.2-8.0 磷酸氢二钠Mr=141.98柠檬酸-氢氧化钠-盐酸缓冲液 2.2-6.5 柠檬酸Mr=192.06柠檬酸-柠檬酸钠缓冲液(0.1mol/L) 3.0-6.6 柠檬酸Mr=192.06 柠檬酸钠Mr=257.96乙酸-乙酸钠缓冲液(0.2mol/L) 3.6-5.8 乙酸钠Mr=81.76 乙酸Mr=60.05邻苯二甲酸氢钾-氢氧化钠缓冲液 4.1-5.9 邻苯二甲酸氢钾Mr=204.23磷酸氢二钠-磷酸二氢钠缓冲液(0.2mol/L) 5.8-8.0磷酸氢二钠-磷酸二氢钾缓冲液(1/15 molL) 4.92-8.18磷酸二氢钾-氢氧化钠缓冲液(0.05mol/L) 5.8-8.0巴比妥钠-盐酸缓冲液(18℃) 6.8-9.6 巴比妥钠Mr=206.18 Tris-盐酸缓冲液(0.05mol/L 25℃) 7.10-9.00 三羟甲基氨基甲烷(Tris)Mr=121.14甘氨酸-氢氧化钠缓冲液(0.05mol/L) 8.6-10.6 甘氨酸Mr=75.07硼砂-氢氧化钠缓冲液(0.05mol/L) 9.3-10.1 硼砂Na2B4O7?10H2O Mr=381.43碳酸钠-碳酸氢钠缓冲液(0.1mol/L) 9.16-10.83 碳酸钠Mr=286.2 碳酸氢钠Mr=84.0碳酸钠-氢氧化钠缓冲液(0.025mol/L) 9.6-11.0磷酸氢二钠-氢氧化钠缓冲液 10.9-12.0氯化钾-盐酸缓冲液(0.2mol/L) 1.0-2.2 氯化钾Mr=74.55氯化钾-氢氧化钠缓冲液(0.2mol/L)12.0-13.0 氯化钾Mr=74.55。
【资料】常用pH缓冲液缓冲液缓冲范围
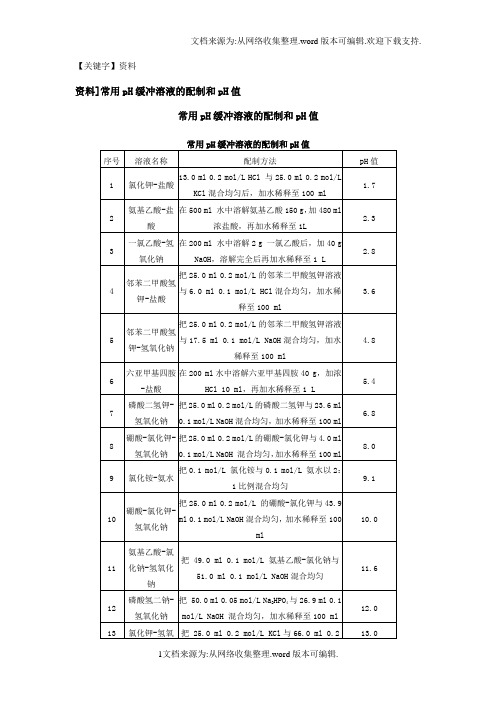
【关键字】资料资料]常用pH缓冲溶液的配制和pH值常用pH缓冲溶液的配制和pH值一、常用溶液的配制(一)溶液配制注意事项1.药品要有较好的质量试剂分为优级纯(保证试剂,Guaranteed reagent,G.R.)、分析试剂(Antalytical reagent,A.R.)化学纯(Chemical pure,C.P.)和实验试剂(Laboratory reagent,L.R.)等等。
工业用的化学试剂,杂质较多,只在个别情况下应用,如配洗液用的硫酸、配干燥剂的氯化钙等。
2.药品称量要精确。
3.配制试剂用水应用新鲜的去离子水或双蒸馏水,比电阻值在50万欧姆以上,pH在5.5~7.0之间才可应用,在组织培养等特殊用途时应注意此项要求,配制一般化验用溶液只要求用双蒸馏水或去离子水。
4.配好后的溶液,应立即除菌处理(如高压灭菌、抽滤或加抑菌物质),以防杂菌生长。
(二)0.067(1/15)Mol/L磷酸缓冲液1.1/15Mol/L磷酸二氢钾溶液的配制:称取磷酸二氢钾(KH2PO4,A.R.)9.08g,用蒸馏水溶解后,倾入1 000ml容量瓶内,再稀释至刻度(1 000ml)。
2.1/15Mol/L磷酸二氢钠溶液的配制:称取无水磷酸氢二钠(Na2HPO4,A.R.)9.47g(或者Na2HPO4·2H2O 11.87g)用蒸馏水溶解后,放入1 000ml容量瓶内,再加蒸馏水稀释至刻度(1 000ml)。
3.按附表的比例,配制成不同pH值的缓冲溶液。
(三)0.15Mol/L PB液Na2HPO4·2H2O分子量=175.05 0.15Mol/L溶液含26.7g/L。
Na2HPO4·12H2O分子量=358.22 0.15Mol/L溶液含53.7g/L。
NaH2PO4·H2O分子量=138.00 0.15Mol/L溶液含20.7g/L。
NaH2PO4·2H2O分子量=156.03 0.15Mol/L溶液含23.4g/L。
常用的碳酸缓冲盐浓度

常用的碳酸缓冲盐浓度
常用的碳酸缓冲盐浓度为0.1mol/L。
碳酸缓冲盐常用的就是碳酸钠-碳酸氢钠缓冲液。
以总浓度0.1mol/L 的为例,常见做法是分别先配置0.1mol/L的碳酸钠和碳酸氢钠溶液,然后向碳酸氢钠溶液里滴加碳酸钠溶液,用pH计监测pH值,到9之后停止。
事实上缓冲溶液的配置不会特别准确,不论是浓度还是pH值都很难控制到想精确达到的值。
不过缓冲溶液一般也不用配的很准,差不多就可以用了。
所以这里给出一个简单一些的配置方法,还是0.1mol/L,直接将此浓度的碳酸钠和碳酸氢钠溶液按照1:9混合,就能得到8.9~9.2左右pH值的缓冲溶液,室温温度越高,pH值越低。
常用缓冲液配方

常见缓冲液的缓冲范围缓冲液名称及常用浓度缓冲pH范围主要物质分子量MES (2吗啉代乙磺酸) 5.5-6.7 195.2Bis-Tris 5.8-7.2 209.2HEPES 6.8-8.2 238.3PIPES 6.1-7.5 302.4MOPS 6.5-7.9 209.3Tricine 7.4-8.8 179.2TEA (三乙醇胺) 7.4-8.3 149.2甘氨酸-盐酸缓冲液(0.05mol/L) 2.2-5.0 甘氨酸Mr=75.07邻苯二甲酸-盐酸缓冲液(0.05mol/L)2.2-3.8 邻苯二甲酸氢钾Mr=204.23 磷酸氢二钠-柠檬酸缓冲液 2.2-8.0 磷酸氢二钠Mr=141.98柠檬酸-氢氧化钠-盐酸缓冲液 2.2-6.5 柠檬酸Mr=192.06柠檬酸-柠檬酸钠缓冲液(0.1mol/L)3.0-6.6 柠檬酸Mr=192.06 柠檬酸钠Mr=257.96 乙酸-乙酸钠缓冲液(0.2mol/L) 3.6-5.8 乙酸钠Mr=81.76 乙酸Mr=60.05 邻苯二甲酸氢钾-氢氧化钠缓冲液 4.1-5.9 氢钾Mr=204.23磷酸氢二钠-磷酸二氢钠缓冲液(0.2mol/L) 5.8-8.0磷酸氢二钠-磷酸二氢钾缓冲液(1/15 molL) 4.92-8.18磷酸二氢钾-氢氧化钠缓冲液(0.05mol/L) 5.8-8.0巴比妥钠-盐酸缓冲液(18℃) 6.8-9.6 巴比妥钠Mr=206.18 Tris-盐酸缓冲液(0.05mol/L 25℃) 7.10-9.00 三羟甲基氨基甲烷(Tris)Mr=121.14 甘氨酸-氢氧化钠缓冲液(0.05mol/L) 8.6-10.6 甘氨酸Mr=75.07硼砂-氢氧化钠缓冲液(0.05mol/L) 9.3-10.1 硼砂Na2B4O7?10H2O Mr=381.43 碳酸钠-碳酸氢钠缓冲液(0.1mol/L) 9.16-10.83 碳酸钠Mr=286.2 碳酸氢钠Mr=84.0 碳酸钠-氢氧化钠缓冲液(0.025mol/L) 9.6-11.0磷酸氢二钠-氢氧化钠缓冲液10.9-12.0氯化钾-盐酸缓冲液(0.2mol/L) 1.0-2.2 氯化钾Mr=74.55氯化钾-氢氧化钠缓冲液(0.2mol/L)12.0-13.0 氯化钾Mr=74.55参考下图:常见缓冲液的缓冲范围参考下图:常见缓冲液的缓冲范围常用缓冲液的配制方法1.甘氨酸-盐酸缓冲液(0.05M)X ml 0.2M甘氨酸+Y ml 0.2M盐酸再加水稀释至200mlpH X/ml Y/ml pH X/ml Y/ml2.2 50 44.03.0 50 11.42.4 50 32.43.2 50 8.22.6 50 24.23.4 50 6.42.8 50 16.83.6 50 5.0甘氨酸分子量=75.07 0.2M甘氨酸溶液含15.01g/L2.邻苯二甲酸-盐酸缓冲液(0.05M)X ml 0.2M邻苯二甲酸氢钾+Y ml 0.2M盐酸再加水稀释至200mlpH X Y pH X Y2.2 5 4.6703.2 5 1.4702.4 53.960 3.4 5 0.9902.6 53.295 3.6 5 0.5972.8 5 2.6423.8 5 0.2633.0 5 2.032邻苯二甲酸氢钾分子量=2.4.23 0.2M邻苯二甲酸氢钾溶液含40.85g/L3.磷酸氢二钠-柠檬酸缓冲液pH 0.2M Na2HPO4/ml 0.1M柠檬酸/ml pH 0.2M Na2HPO4/ml 0.1M柠檬酸/ml 2.2 0.40 19.6 5.2 10.72 9.282.4 1.24 18.76 5.4 11.15 8.852.6 2.18 17.82 5.6 11.60 8.402.83.17 16.83 5.8 12.09 7.913.04.11 15.896.0 12.637.373.24.94 15.066.2 13.22 6.783.4 5.70 14.30 6.4 13.85 6.153.6 6.44 13.56 6.6 14.555.453.8 7.10 12.90 6.8 15.454.554.0 7.71 12.29 7.0 16.47 3.534.2 8.28 11.72 7.2 17.39 2.614.4 8.82 11.18 7.4 18.17 1.834.6 9.35 10.65 7.6 18.73 1.274.8 9.86 10.14 7.8 19.15 0.855.0 10.30 9.70 8.0 19.45 0.55Na2HPO4分子量=141.98 0.2M溶液含28.40g/LNa2HPO4·2H2O分子量=178.05 0.2M溶液含35.61g/LC6H8O7·H2O分子量=210.14 0.1M溶液含21.01g/L4.柠檬酸-氢氧化钠-盐酸缓冲液pH 钠离子浓度/M 柠檬酸C6H8O7·H2O/g 氢氧化钠NaOH/g 浓盐酸HCl/ml 终体积/L2.2 0.20 210 84 160 103.1 0.20 210 83 116 103.3 0.20 210 83 106 104.3 0.20 210 83 45 105.3 0.35 245 144 68 105.8 0.45 285 186 105 106.5 0.38 266 156 126 10使用时可以每升中加入1g酚,若最后pH有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。
标准缓冲液pH值与温度对照表
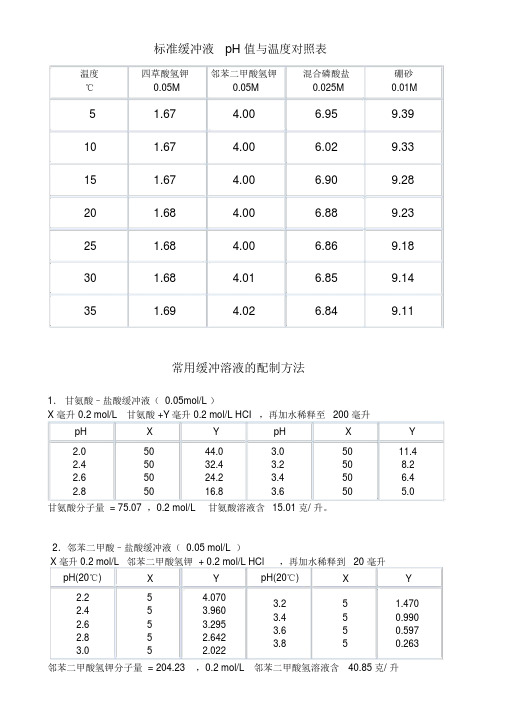
标准缓冲液pH 值与温度对照表温度四草酸氢钾邻苯二甲酸氢钾混合磷酸盐硼砂℃0.05M0.05M0.025M0.01M5 1.67 4.00 6.959.3910 1.67 4.00 6.029.3315 1.67 4.00 6.909.2820 1.68 4.00 6.889.2325 1.68 4.00 6.869.1830 1.68 4.01 6.859.1435 1.69 4.02 6.849.11常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液( 0.05mol/L )X 毫升 0.2 mol/L甘氨酸 +Y毫升 0.2 mol/L HCI,再加水稀释至200 毫升pH X Y pH X Y2.05044.03.05011.42.45032.43.2508.22.65024.23.450 6.42.85016.83.650 5.0甘氨酸分子量 = 75.07 ,0.2 mol/L甘氨酸溶液含15.01 克/ 升。
2.邻苯二甲酸–盐酸缓冲液( 0.05 mol/L )X 毫升 0.2 mol/L邻苯二甲酸氢钾 + 0.2 mol/L HCl,再加水稀释到20 毫升pH(20℃)X Y pH(20℃)X Y2.25 4.0703.25 1.4702.453.9603.450.9902.653.2953.650.5972.85 2.6423.850.2633.05 2.022邻苯二甲酸氢钾分子量 = 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85 克/ 升3.磷酸氢二钠–柠檬酸缓冲液0.2mol/L0.1mol/L0.2mol/L0.1mol/LpH Na2HPO4柠檬酸pH Na2HPO4柠檬酸(ml)(ml)(ml)(ml)2.20.4010.60 5.210.729.282.4 1.2418.76 5.411.158.852.6 2.1817.82 5.611.608.402.83.1716.83 5.812.097.913.04.1115.896.012.637.373.24.9415.066.213.22 6.783.4 5.7014.30 6.413.85 6.153.6 6.4413.56 6.614.555.453.87.1012.90 6.815.454.554.07.7112.297.016.47 3.534.28.2811.727.217.39 2.614.48.8211.187.418.17 1.834.69.3510.657.618.73 1.274.89.8610.147.819.150.855.010.309.708.019.450.55 Na2HPO4分子量 = 142.98,0.2 mol/L溶液为 28.40克/ 升。
缓冲液配制及注意事项

缓冲液配制及注意事项
蛋白质缓冲液的配制及注意事项
1、缓冲液的概念
缓冲液是指以一定酸碱度的水溶液形式,其pH值在某一特定范围内比较稳定的溶液,也就是说这种溶液具有抗变化性,在常温下其pH值只有很小的变化。
2、缓冲液的配制
缓冲液可以通过使用不同的组分来配制,如:
(1)根据pH值使用碳酸钠或氢氧化钠等碱性盐类添加到水中,其中碳酸钠用量为0.1mol/L,氢氧化钠用量为0.2mol/L;
(2)使用不同的表面活性剂,如去离子表面活性剂、有机表面活性剂等混合使用;
(3)添加适量的糖类,增加溶液的规模和稳定性,如使用葡萄糖、蔗糖、淀粉等;
(4)如果要提高溶液的抗菌能力,可以加入癸二酸钠等抗菌剂。
3、缓冲液的注意事项
(1)为了保持缓冲液的稳定性,在配制前最好先测量溶液的pH 值;
(2)配制时一定要使用净水,并且在进行实验前检查溶液的纯度;
(3)在加入不同的组分时,要把握好比例,以保证溶液的稳定性;
(4)缓冲液一旦配制完毕,最好随时监测其溶液的pH值,以便及时发现溶液的变化,从而可以及时作出调整;
(5)实验室和温室缓冲液的温度范围一般限制在4-37℃,溶液的pH值也会随着温度的变化而发生变化,因此一定要注意温度和pH 值变化的关系。
碳酸盐缓冲液(pH9.2)说明书

北京索莱宝科技有限公司
碳酸盐缓冲液(0.1mol/L,pH9.2)说明书
货号:G0220
规格:500mL
保存:4℃,有效期12个月
产品说明:
平衡盐溶液(Balanced Salt Solution,BSS)与细胞生长状态下的pH值、渗透压等环境状态一致,具有维持渗透压、控制酸碱平衡、供给细胞生存代谢所必需的能量和无机盐成分等作用,可满足体外实验中细胞生存并维持一定的代谢的基本需要。
本碳酸盐缓冲液(0.1mol/L,pH9.2)主要由碳酸钠、碳酸氢钠组成,其碳酸根为0.1M,pH值为9.2,主要用作酶与抗体的偶联的缓冲液或其他常规用途。
操作步骤(仅供参考):
无需配制,直接使用。
注意事项:
1、注意密闭保存,防止挥发。
2、为了您的安全和健康,请穿实验服并戴一次性手套操作。
第1页,共1页。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氢钠缓冲液(0.1mol/L,pH9.16-10.83)使用说明
货号:G0260
规格:500mL
保存:室温保存,有效期12个月。
产品说明:
平衡盐溶液(Balanced Salt Solution,BSS)与细胞生长状态下的pH值、渗透压等环境状态一致,具有维持渗透压、控制酸碱平衡、供给细胞生存代谢所必需的能量和无机盐成分等作用,可满足体外实验中细胞生存并维持一定的代谢的基本需要。
碳酸钠-碳酸氢钠缓冲液(0.1mol/L,pH9.16-10.83)由碳酸钠、碳酸氢钠组成,客户可以选择的pH值为:9.16、9.4、9.51、9.79、9.9、10.14、10.28、10.53、10.83,注意密闭保存。
操作步骤(仅供参考):
按实验具体要求操作
注意事项:
1、注意密闭保存,避免挥发。
2、为了您的安全和健康,请穿实验服并戴一次性手套操作。
