第四章 碳碳双键的加成反应
4第四章 碳-碳双键的加成反应

烯烃与NBS的反应:
❖ NBS(N-Bromo-Succinimide,N-溴代丁二酰亚胺)
❖ 丁二酰亚胺与溴化氢反应生成的低浓度溴不与少 量仲自由基反应,只与烯丙基自由基反应生成α溴代产物
烯烃双键上的亲核加成(反马氏加成)
❖ 特强亲核试剂可与乙烯反应R-(RLi)
❖ H.C.Brown美国Purdue Uni.(1959) ❖ 1979年Nobel price
❖ 历程:
❖ 不对称烯烃的反马氏加成(加水),制备伯 醇
烯烃与卡宾(碳烯)的加成
❖ 卡宾(Carbene,碳烯):只有六个价电子的两价 碳原子化合物的总称,其中四个价电子在两个共 价键上,另外两个电子未成键,
H COOH
H
C
+
Br
+ Br2 C
HOOC H
HOOC
H
COOH Br-
COOH
H
Br
H
Br
COOH
H Br
COOH
HOOC
Br H
2,3-二溴丁二酸(内消旋体)
❖ 与氯加成不易形成环状鎓离子,有重 排产物
不对称烯烃与不对称试剂加成(遵循 Markovnikov规则,马氏加成)
❖ 活性 HI>HBr>HCl>HF ❖ 丙烯与氯化氢加成的区域选择性:(+C,+I )
第四章
碳-碳双键 的加成反应
催化加氢:
❖ 催化剂Ni、Pd或Pt 顺式加成
据反应历程加成反应分别有:
❖ 亲电加成(Electrophilic Addition):
RCH=CH2 + H+
亲核加成

NO2
_ + CH3
H H H C C NO2 CH3 NO2
2
碳-碳双键的亲核加成反应
• 亲核试剂对碳-碳双键加成的反应历程: • 反应的第一步是亲核试剂带着一对电子进攻双键 上的一个碳原子,而电子则被集中到另一个双键 碳原子上形成碳负离子,这是慢的一步。第二步 是碳负离子与质子或带正电荷的物质结合形成产 物。
+ E+ C C Nu E C C Nu
3
C C
+ E Nu
• 一些常见得促进亲核加成反应的取代基有: CHO、 COR、COOR、 CN、NO2、 CONH2、SO2R等。 它们通过降低碳-碳双键碳原子上的p电子云密度 来促进亲核试剂的进攻,但更重要的是,这样的 取代基能使生成的碳负离子中间体的负电荷分散 而得到稳定。
C2H5O
-
H O C C C CH3
1)水解 2)加热
O
7
碳-碳三键的亲核加成反应
• 碳-碳三键通常比双键更容易被亲核试剂进攻,而较难被 亲电试剂进攻。这是因为碳-碳三键之间的距离较短,三 键中的电子被束缚的比双键中的紧,所以进攻的亲电试剂 夺取三键中的一个电子较困难。从杂化角度来考虑,三键 碳原子(sp杂化)比双键碳原子(sp2杂化)具有较多的s成分, 因此它与电子的结合力较强,表现出较强的亲电性。
O
NH2NH2
NNH2
NH2NHCONH2
NNCONH2
RSH
• 羰基化合物与醇的反应
• 醛(酮)能与一分子醇加成生成半缩醛(酮)。半缩醛(酮)不稳 定,容易分解成醛(酮)和醇或与另一分子醇进一步缩合, 生成缩醛(酮)。 • 由于缩醛(酮)生成后又可水解成原来的化合物,故可利用 缩醛(酮)生成还保护醛(酮)基。 • 环状缩醛(酮):最常见的是利用羰基化合物和乙二醇反应, 生成二氧戊环化合物,该化合物比烷基缩醛(酮)更加稳定, 可耐大多数碱性及中性的反应条件。
04 烯 烃

RCH OH
CH2
注:
加成产物符合马氏规则。
应用:①间接法合成符合马氏规则的醇; ②硫酸氢烷基酯能溶于浓硫酸, 可用于鉴别、分离提纯烯烃。
(3)与H2O的加成
水是一种弱酸,需在H+作催化剂的条件下才能进行。
CH2 CH2
+ H H2O
CH3 CH2OH
H
+
CH3CH CH2
+H2O
(CH3)2CHOH
CH 2=CH 2
Br2 H2O NaCl
CH 2 CH 2 + Br Br
CH 2 CH 2 + CH 2 CH 2 Br Cl Br OH
3)有重排现象 4)符合马氏规则 5)反式加成
3、自由基加成——过氧化效应
CH3CH CH2
+ +
HBr
hν 或 过氧化物
CH3CHBrCH3+ CH3CH2CH2Br
表5-2 一些烯烃的氢化热
名 称 乙烯 丙烯 1-丁烯 顺-2-丁烯 反-2-丁烯 2,3-二甲基 -2-丁烯 构 造 式 氢 化 热 △H/kJ· mol-1 137 126 127 120 115 112
CH2
CH3CH
CH2
CH2
CH 2
CH 3 H
CH 3CH 2CH
CH 3 H
C
C
CH3 H
烯 烃
烯烃--分子中有一个碳碳双键的开链不饱和烃. 烯烃的通式--CnH2n
>C=C< 是烯烃的官能团.
第四章 烯 烃
一、烯烃的结构
物理方法证明
1. 碳、氢原子共平面。 2.键角接近120°; 3.双键键长0.133nm,比单键键 长0.154nm短;
形成碳碳双键的反应

磷内翁盐与醛或酮的反应即Wittig 反应是按下述过程进行的:
Wittig反应的难易程度取决于反应物内翁盐及醛 或酮的结构。 对于稳定的磷内翁盐,由于R1和R2为拉电子基, 内翁盐α-碳上的负电荷因分散而降低了亲核活性, 在一般情况下不利于Wittig反应的进行。 在不稳定的内翁盐中,R1和R2为推电子基,因而 可以增强内翁盐α-碳上的负电荷而使亲核活性增 加,使之与醛酮的反应容易进行。对于羰基化合 物来说,R3和R4如果是推电子基,羰基碳上的电 子云密度相对增高,不利于内翁盐对羰基进行亲 核反应;R3或R4为拉电子基时,可降低羰基碳上 的电子云密度,因而容易接受亲核试剂的进攻, 有利于反应的进行。一般情况下,醛的反应活性 比酮高,有时脂也能进行Wittig反应,但活性较 酮低。利用羰基不同的活性,可进行选择性的羰 基烯化反应。
Wittig反应所得烯烃可能存在Z、E两种立体异构 体。决定产物中两种异构体比例的因素很多,通 过选择适当的磷内翁盐及改变反应条件(如温度、 溶剂性质、有无盐存在等),可获得一定构型的 产物。一般规律是:较稳定的活性低的磷内翁盐, 生成以E型烯烃为主的产物,但在质子溶剂或含 盐的非极性溶剂中进行反应,可增加产物中Z型 烯烃的比例;而不稳定的活性较高的磷内翁盐立 体选择性较差,一般情况下生成E、Z两种异构体 的混合物。若选用非极性溶剂,可高选择性的生 成Z型产物,而在含盐的非极性溶剂中,E型烯烃 的比例增加。例如:
例如,在丙酮的缩合中,将固体催化剂氢 氧化钡加入Soxhlet抽提器内,反应器中的 丙酮不断回流,在提取器内与催化剂接触 发生缩合反应,然后溢流到反应器内,产 物二丙酮醇脱离催化剂,从而避免了可逆 反应的发生。二丙酮醇经碘或磷酸催化脱 水,可得71%产率的异丙叉丙酮。
碳碳双键与氢气加成反应方程式

碳碳双键与氢气加成反应方程式碳碳双键和氢气加成反应是一种常见的有机反应。
在这种反应中,氢气分子会与碳-碳双键中的两个碳原子形成一个新的双键,从而生成一种新的有机反应物。
碳碳双键与氢气加成反应的最基本的反应式为:R-C≡C-R + H2 R-C-H2-C-R这里,R和R是不同的有机化学官能团,例如烷基、羧基、醛基或芳基等。
碳碳双键与氢气加成反应是有机化学中应用最多的反应之一,它们能够被用来合成各种有机化合物。
例如,氢化反应可以用来合成各种烃类或醇类有机化合物;氯甲烷加成反应可以用来合成特定的有机物,如酚醛树脂;而氢苯加成反应则可以用来合成芳香族化合物。
此外,碳碳双键与氢气加成反应也可以用来进行合成药物,因为它能够高效地生成多层次结构复杂的分子,而这恰恰是有效制备药物所需要的丰富性结构。
在碳碳双键与氢气加成反应中,氢化物及有机键是反应物,而有机键是反应产物。
在催化剂的作用下,氢化物及有机键会共同形成新的双有机键,从而形成新的有机化合物。
在有机合成中,各种催化剂通常都能够促进碳碳双键与氢气加成反应的发生,其中常用的催化剂包括贵金属催化剂如金属铂、金属钯或金属镍等,以及非金属催化剂如硅钙、硼砂或硅烷等。
碳碳双键与氢气加成反应的反应条件及其反应机理也是有机化学研究的热点,近年来,随着材料科学和分子催化研究的进展,人们已经发现了大量可以提高反应效率和活性的新型催化剂,从而改善了碳碳双键与氢气加成反应的效率。
例如,开发了新型金属有机框架材料用作催化剂,这种新型材料能够更有效地促进反应的进行。
另外,不同的金属催化剂也有不同的反应机理,以及各自的特点。
综上所述,碳碳双键与氢气加成反应是有机化学中广泛应用的反应,它可以被用来合成各种有机化合物,近年来又有了许多新的催化剂出现,这些催化剂可以在一定程度上提高反应效率,大大改善了碳碳双键与氢气加成反应的应用前景。
碳碳双键的一些特殊加成反应

碳碳双键的一些特殊加成反应
王笃年
【期刊名称】《高中数理化》
【年(卷),期】2022()16
【摘要】问题1不对称烯烃与HBr等不对称分子的加成产物如何判断?以丙烯(CH_(2)=CH-CH_(3))为代表的不对称烯烃在酸性条件下与含氢化合物(如HBr、H-OH等)发生加成反应时,氢原子主要连接到原来连氢较多的碳原子上,而带负电的离子(基团)连接到原来连氢较少的碳原子上.
【总页数】3页(P39-41)
【作者】王笃年
【作者单位】北京十一学校
【正文语种】中文
【中图分类】O62
【相关文献】
1.碳碳双键与卤素的加成反应
2.碳碳双键亲电加成反应的启发式教学
3.有机磷化合物的研究:66.亚磷酸二酯对碳氮双键诱导不对称加成反应的…
因版权原因,仅展示原文概要,查看原文内容请购买。
第四章碳氧双键的加成反应1

反应(克拿维纳盖尔反应) 二、Knoevenagel 反应(克拿维纳盖尔反应)
O O
CHO
+
COOEt
哌哌 (81%) COOEt
O CH3NO2
+
C H
N(CH3)2
C5H11NH2
O2NCH2
C H
N(CH3)2 (83%)
CN O COOEt
CN
+
RNH2,HAc
CN COOEt (100%)
22%
由苯甲醛合成萘满酮
CHO O HOOC HOOC 强强 COOEt COOEt
+
CHO
+
H2C COOEt EtONa C COOEt H2 H2 C PPA CH2 CH2
COOEt C C H CH2COOH
H3O+ HOOC
H2/Pt
(75-80%) O
HOOC
四、Darzens 反应
R2C=O + H2O*
R2C-OH O*H
R2C=O*+ H2O
Carbonyl compounds
CH2O CH3CHO CH3CH2CHO (CH3)2CHCHO (CH3)3CCHO CF3CHO C6H5CHO CH3COCH3 FCH2COCH3 CF3COCH3 CF3COCF3 C6H5COCH3
O
R1 强 R2
COOR C COOH H2
COOR R' C CH B O CH 2 C O R''
历历: H2C COOR C COOR H2 R'' R' C C O CH 2 C O B HC COOR C COOR H2 R'
碳碳双键发生的化学反应

碳碳双键发生的化学反应
碳碳双键是由两个碳原子共享四个电子而形成的共轭键。
它们可以参与许多化学反应,下面是一些常见的碳碳双键反应:
1. 加成反应:在加成反应中,一个或多个试剂添加到碳碳双键上,形成新的化学键。
例如,在氢化反应中,氢气(H2)可以加成到碳碳双键上,生成饱和的碳碳单键。
2. 消除反应:消除反应是碳碳双键断裂的反应,通常伴随着新的化学键的形成。
一个常见的消除反应是脱水反应,在这个反应中,碳碳双键上的一个碳原子失去一个水分子(H2O),形成一个新的双键。
3. 氧化反应:碳碳双键可以被氧化剂氧化,形成含有更多氧原子的化合物。
例如,碳碳双键可以被酸性高锰酸钾(KMnO4)氧化为羧酸。
4. 还原反应:碳碳双键可以被还原剂还原,减少为含有更少氧原子的化合物。
一个常见的还原反应是烷基化反应,其中碳碳双键上的一个碳原子被氢原子取代。
这只是碳碳双键可以发生的一些典型化学反应的例子,实际上有许多不同类型的反应都可以涉及到碳碳双键。
具体的反应类型和机理取决于反应条件和试剂的选择。
碳碳双键的加成反应ppt课件

亲核取代
CHO
CH3
O
CH3CH2CCH=CH2 (CH3)3CO-
O CH2CHO
Michael加成
CH3 CH2 C CH2
O CH3
OH-
CH3
Robinson反应
O 36
课外作业
• P78: 5, • 6, (1) (2) (6) •7
37
H+ (CH3)2C CH(CH3)2 重排
OH
①Hg(OAc)2, H2O
② NaBH4, OH-
(CH3)3CCHCH3 OH 94%
20
4.2.5 硼氢化反应
顺式的反马氏加成(形式与结果),事实上是马氏
加成。
δ +δ CC
+
δ-δ+ H BH2
H
H BH2
CC H
π-络合物
H BH2 CC
H BH2 CC
价碳原子,它是一种亲电试剂,与烯烃反应得环丙烷
衍生物,分为单线态和三线态。
23
H
C H
p轨道 sp2杂化轨道
sp2杂化 单线态卡宾
pp轨轨道道
H
C
H
三线态卡宾
(双自由基形式)
sp杂化
24
单线态与烯烃加成时的立体化学为顺式加成(立体
专一性反应)。
Et
H
C=C
+ CCl2
H
Et
反式
Cl Cl
C
Et
H
8
OH
H2/PtO2 AcOH
O
COOEt
H2/PtO2 CH3OH
4.2 亲电加成反应
H COOEt
H
第四章碳氧双键的加成反应2
OH 90%
CH3
C6H5 1%
+ CH3CH=CH-C-C6H5 CH3CH-CH-CO-CH3
OH <1%
C6H5 37%
b)亲核试剂:
O C6H5-CH=CH-C-C6H5
OH
O
+ C6H5-CH=CH-C-(C6H5)2 C6H5-CH-CH2-C-C6H5
1,2加成
C6H5 1,4加成
C6H5MgBr
2.历程:
Wittig 反应经由两个阶段,(1)Wittig 试剂对羰基进行亲核
加成,(2)中间产物受热消除Ph3PO,生成烯烃。
如:
+
+ R1R2C O
Ph3P
-
CHR
R1 R2
C
CHR +
Ph3PO
R1 O
C R2 HC
P+Ph3
R
R1 O C
R2 HC R
PPh3
O
+-
加成
+ Ph3P CHR
1.羟醛缩合是醛酮自身作为活泼氢组分。 2.Knoevenagel反应是以活泼亚甲基化合物为活泼氢组分 3.Stobbe 反应以丁二酸酯为活泼氢组分 4.Darzens缩合以-卤代酸酯为活泼氢组分 5.Mannich反应是但对羰基的亲核进攻,羰基为醛 6.Micheal 反应是,-不饱和羰基化合物为羰基组分,碳 负离子对它的亲核进攻(加成)
H2 H2
CH2 + HN.R2'
H Cl
水解
O
R
C
C H2
C H2
CH2COOH
所以,Mannich反应可以生成比原来酮多一个碳的,- 不 饱和酮,生成氨基醇,生成酮酸。
第四章 加成反应

②
4.2.3. 亲核加成反应的实例 1. Wittig 反应
Wittig 试剂与羰基发生亲核加成反应,生成烯烃:
C O
Ph3P C
R R'
R C C R'
2. 羟醛缩合
CH3CHO + CH3CHO
OH
O CH3CHCH2C H OH
3. Claisen 酯缩合反应及相关反应
两个酯分子至少有一个酯分子是含有α-氢,在 强碱的作用下,相互缩合成β-羰基酯。
例如溴与烯烃的加成反应。烯烃与溴首先生成π络合物, 然后Br+对π键进行亲电加成生成三元环状正离子中间体-溴 鎓离子,最后Br-从体积较大的溴鎓离子反面进攻原双键碳 原子之一,生成1,2-二溴化物。
H CH3 Br2 H CH3 Br Br- H CH3 H Br CH3 Br Br H CH3 H CH3 H CH3 H CH3 H Br H Br CH3 -Br- Br CH3
典型代表:Cl2、Br2、I2、HOCl、HOBr等与烯烃的亲 电加成反应。
2、三分子亲电加成
Y
2E
E
Y
C C
+ Y
Y+ C C Y
C C E
E
E
一般来说,烯烃与卤化氢的加成,若生成比较不稳定的 正碳离子时,则倾向于按AdE3历程进行,加成的立体化学 特征是反式加成。
4.1.2 亲电加成反应立体化学
Nu E 顺和反异构体
(1)正碳离子历程
a、若生成的正碳离子中间体的正电荷能够在碳骨架中发生 离域,则有利于按正碳离子历程进行; 典型代表:卤化氢、溴和氯与双键碳原子上连有苯基的烯烃 所进行的加成反应。
解释3,3-二甲基-1-丁烯与卤化氢的加成得到2,3-二甲基2-卤丁烷的历程。
碳碳双键的加成反应
烯烃的硼氢化反应总是顺式加成。如:
① B2H6 ,醚
② H2O2/OH-
CH3
OH H + H H3C
H CH3OH H( Nhomakorabea加)二.反应物的影响
当同一亲电试剂与不同烯烃进行亲电加成 反应时,其立体选择性也不相同。
C=C双键与卤化氢加成的立体选择性主要 依赖于烯烃的结构。
非共轭环状烯烃如环已烯、1,2-二甲基环 戊烯、1,2-二甲基环已烯和异丁烯与HX 的加成主要是反式加成。如:
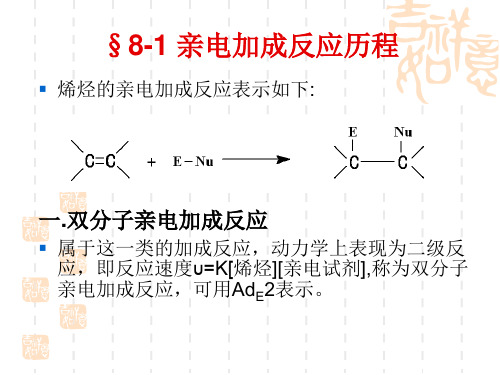
§8-1 亲电加成反应历程
烯烃的亲电加成反应表示如下:
一.双分子亲电加成反应
属于这一类的加成反应,动力学上表现为二级反 应,即反应速度υ=K[烯烃][亲电试剂],称为双分子 亲电加成反应,可用AdE2表示。
此类反应分两种历程:反应过程中生成正 碳离子中间体历程和环状鎓型离子中间体 历程。
如顺-2-丁烯与四氧化锇加成生成顺式环状锇酸酯,后者水解生成 内消旋1,2-二醇,总的结果是羟基化,具有顺式立体选择性。
许多加成反应具有立体选择性,但对于某些加成反应则只有很小 的立体选择性,如Z-1,2-二甲基环已烯的酸性水解反应,生成 大约等量的顺和反1,2二甲基环已醇。如:
烯烃加成的立体选择性是可变的,它与亲电试剂的性质、 烯烃的结构和反应条件等因素有关。
烯烃与HX的加成,在按AdE3历程进行时, 由于烯烃与一分子HX中的H+结合时,从另 一方向又与第二个分子的HX或X-结合,故 加成的立体化学特征是反式加成。
§8-2 亲电加成反应的立体化学
亲电试剂E-Nu与C=C双键进行加成时,试剂的两 部分E+和Nu-可以从反应物的同侧或异侧加到双 键上。当试剂的两部分加到分子的同侧时,叫做 顺式加成。当试剂的两部分从烯烃的异侧加到双 键碳原子上时,叫做反式加成。
碳碳双键的加成反应 有机化学课件

高等有机化学
加成反应:催化氢化、亲电加成、亲核加成和自由基
加成。 4.1 催化氢化
催化氢化分为非均相催化(多相催化)和均相催化。
非均相催化的催化剂为固体,均相催化的催化剂溶于
介质成液相,整个反应体系为一相。
4.1.1 多相催化氢化
氢和烯烃吸附在催化剂表面,使π键和H-H键断裂,形 成金属氢化物和配合物,氢原子再分别转移到双键碳 原子. 立体化学为顺式加成,反应收率高,速度快。
CH3 δ+ - H δ C C + CH3 CH3
δ- δ+ HO-Cl
HO-
CH3 CH CHCH3 CH3 Cl
OH CH3 C CHCH3 CH3 Cl
CF3
δ- δ+ CH=CH2 +
δ+ δ- AlBr3 CF3 CH2 CH2Br H Br
H C Br
-I
H2C CH
H C H Br + H Br
C
C
+ H2
Pd,BaSO4 喹啉
C=C
OH
OH Pd,BaSO 4 喹啉 30℃
OH OH
4.底物结构
空阻大的底物催化氢化比较困难。
活性
RCOCl (RCHO) > RNO2(R-NH2) > RC
CR'
(RCH=CHR’) > RCHO ( RCHOH ) >RCH=CHR’ (RCH2CH2R’)>RCOR’>RCH (OH) R’>ArCH2OR (ArCH3) >RCN (RCH2NH2)
H H
C C
吸附
H H
《有机化学基础》官能团——碳碳双键、碳碳三键

《有机化学基础》官能团——碳碳双键、碳碳三键一、介绍1.碳碳双键(-C=C-)是烯烃的官能团,烯烃的通式符合Cn H2n,其代表物是乙烯。
2.碳碳三键(-C C-)是炔烃的官能团,炔烃的通式符合Cn H2n-2,其代表物是乙炔。
二、性质碳碳双键、碳碳三键的性质类似。
1.加成反应(与H2、HX、X2、H2O等加成,X表示卤素元素)(1)CH2=CH2+H2→一定条件→CH3CH3、CH≡CH+H₂→ CH₂=CH₂(2)CH2=CH2+HX→一定条件→CH3CH2X、CH≡CH+HX→一定条件→CH2=CHX(3)CH2=CH2+X2→CH2XCH2X、CH≡CH+X2→CHX=CHX(4)CH2=CH2+H2O→一定条件→CH3CH2OH2.氧化反应(1)在氧气中燃烧生成二氧化碳CH2=CH2+3O2→点燃→2CO2+2H2O、2CH≡CH+5O2→点燃→4CO2+2H2O(2)能被强氧化剂所氧化如乙烯能被高锰酸钾氧化为二氧化碳。
3.加聚反应(1)单烯烃、单炔烃nCH2=CH2→一定条件→-[-CH2-CH2-]-n、n CH≡CH→一定条件→-[-CH=CH-]-n(2)其他如:nCH2=CH-CH=CH2→一定条件→-[-CH2-CH=CH-CH2 -]-n。
碳碳双键的加成原理

碳碳双键的加成原理碳碳双键是有机化学中重要的反应类型之一,也是有机分子中最常见的化学键之一。
它的加成反应原理是指在碳碳双键上发生的加成反应,即将两个碳原子之间的双键断裂,并与其他原子或基团形成新的化学键。
碳碳双键的加成反应可以分为两类:电子亲和性试剂的加成和亲核试剂的加成。
电子亲和性试剂的加成通常发生在双键的两侧,而亲核试剂的加成则通常发生在双键中间。
在电子亲和性试剂的加成反应中,试剂中的原子或基团具有较强的亲电子性,能够从双键上吸引电子。
这种试剂可以是正电荷离子、电子亲和性较强的分子或自由基。
在加成反应中,双键上的π电子与试剂中的原子或基团结合,形成新的化学键。
这种加成反应通常会产生稳定的化合物,并且往往是可逆的。
亲核试剂的加成反应则是指试剂中的原子或基团具有较强的亲核性,能够攻击双键中的电子。
这种试剂可以是负电荷离子、含有不稳定电子对的分子或具有强亲核性的分子。
在加成反应中,试剂中的亲核性原子或基团攻击双键中的电子,形成新的化学键。
这种加成反应通常会产生不稳定的中间体,并且往往是不可逆的。
碳碳双键的加成反应在有机合成中具有广泛的应用。
通过这种反应,可以构建复杂的有机分子结构,合成具有特定功能的化合物。
例如,通过碳碳双键的加成反应,可以将不饱和化合物转化为饱和化合物,或者将两个碳原子之间的双键断裂,形成新的化学键。
这种反应不仅可以在实验室中进行,还可以在工业上进行大规模的生产。
碳碳双键的加成反应是有机化学中的基础知识,也是有机化学实验中常用的实验操作之一。
通过掌握碳碳双键的加成原理,可以更好地理解和解释有机反应的机理和规律。
此外,还可以根据加成反应的原理,设计和合成新颖的有机化合物,为有机合成化学提供新的思路和方法。
碳碳双键的加成原理是有机化学中重要的反应类型之一。
通过这种反应,可以构建复杂的有机分子结构,合成具有特定功能的化合物。
掌握碳碳双键的加成原理对于理解和解释有机反应的机理和规律具有重要意义,也为有机合成化学提供了新的思路和方法。
02加成、消去反应-【化学方程式】高考重要化学方程式汇总

高考重要的有机化学方程式汇总02 加成、消去反应一、典型的加成反应1.碳碳双键的加成反应(1)反应原理:双键变单键,连碳上各加一个原子或原子团(2)反应举例①丙烯与Br2反应:CH3CH=CH2+Br2CH3--CH2Br②丙烯与H2反应:CH3CH=CH2+H2CH3CH2CH3③丙烯与HCl反应:CH3CH=CH2+HCl CH3--CH3或CH3CH2CHCl④丙烯与H2O反应:CH3CH=CH2+H2O CH3--CH3或CH3CH2CHOH 2.二烯烃的加成反应3.碳碳叁键的加成反应(1)普通加成:同碳碳双键①乙炔与Br2反应:CH≡CH+Br2BrCH=CHBr,CH≡CH+2Br2CHBr2-CHBr2②乙炔与H2反应:CH≡CH+H2CH2=CH2,CH≡CH+2H2CH3CH3③乙炔与HCl反应:CH≡CH+HCl CH2=CHCl④乙炔与HCN反应:CH≡CH+HCN CH2=CHCN(2)炔烃与水加成:先加成生成烯醇,再发生自身加成生成醛或酮①CH≡CH+H2O CH3CHO(工业上制取乙炔)②CH3-C≡C-CH3+H2O CH3--CH2-CH3③C≡CH+H2O CH2CHO或-CH3 3.苯环的加成反应(1)加成物质:在催化剂作用下和H2加成(2)加成原理:苯环完全加成变成环己环(3)反应举例①苯的加成:+3H2②甲苯加成:CH3+3H2-CH3③苯酚加成:OH+3H2-OH4.碳氧双键的加成反应(1)醛酮的加成反应:碳氧双键断裂,氧上加氢,碳上加其他部分①乙醛的加成反应②丙酮的加成反应(2)酸羰基、酯羰基、肽羰基:一般不能发生加成反应二、典型的消去反应1.卤代烃的消去反应(1)消去条件:碱的醇溶液,加热(2)消去原理:消卤素原子和β-H形成不饱和键(3)反应举例①溴乙烷的消去:CH3CH2Br+NaOH CH2=CH2↑+NaBr+H2O②1-溴丙烷的消去:CH3CH2CH2Br+NaOH CH2=CHCH3↑+NaBr+H2O (4)特别提醒①卤代烃消去反应产物种类的判断:有几种β-H就有几种消去产物②邻二卤代烃发生消去反应后可能在有机物中引入碳碳三键或两个碳碳双键。
亲电加成

+
H CH3 + Br H
CH3 Br CH3
Br
CH3 CH3
Br
-
H H3C H Br
H
6
3. 三分子历程(AdE3)
• 两个亲电试剂E-Nu分子分别与烯烃起反应,其中 一个E-Nu分子先与C=C双键形成p络合,具有亲 电性。而另一个E-Nu分子则表现为亲核性,但总 的是以亲电性为主,因此把这种反应称为三分子 亲电加成反应。
H
+
H2C CH2CH2CH3 H3C CHCH2CH3
+
+
2个C-H键s-p共轭 5个C-H键s-p共轭
18
H2C CHCH2CH3
H2C CHCH2CH3
H+
+
H2C CH2CH2CH3 H3C CHCH2CH3
+
+
ClCl-
Cl H2C CH2CH2CH3 H3C CHCH2CH3 Cl
• 但对含强吸电子基团的烯烃与不对称亲电试剂的 加成,从表面来看是反Markovnikov's规则的。
+ + +
C CH2 H
E+
+ C CH2 H E
亲电加成反应活性: C CH2 H
>
H2C CH2
>
C C H H
13
• 当双键碳原子上连有吸电子基团(如卤素、氰基时,由于 吸电子基吸引电子的结果,降低了C=C双键间的电子云密 度,而不利于亲电试剂的进攻。从过渡态或活性中间体考 虑,因吸电子基对中间体起着去稳定作用,也不利于反应 的进行。 E+
亲核加成反应PPT课件

CH2 COOEt 2 CH3COCH2COOEt NCCH2COOEt RCH2NO2
催化剂:醇钠(钾)、氨基钠、吡啶、三乙胺、季铵碱
第7页/共147页
OO CH3-C-CH2-C-OC2H5 NaOC2H5
OO CH3-C-CH-C-OC2H5
- Na+
O ddC+ C C
1,4-加成
OC2H5 O C=O CH3C-CH C
d+
d-
C
d+
N
d-
(C22H55)。3CN,,7叔1%丁醇
CH3COCHCOCH3 CH2CH2CN
HC
C
d+
C
OC2H5 + CH3COCH2COOC2H5 C2H5ONa
H-C=CH-COOC2H5
d+ d- O
CH3COCHCOOC2H5
d-
第11页/共147页
Micheal反应的应用
OO + O2N
12.1 碳碳双键的亲核加成反应
反应机理:
CC
E Nu
CC
E
引入吸电子基团,降低电子云密度
Nu E
CC
E
CC
Nu
Nu
Y:
CHO COR COOR CONH2
CN NO2
第1页/共147页
SO2R
H C
Ph C
CN
Ph
CN
H
HH
Ph Ph C C
HCN
Ph C C Ph
CN CN
CN
CN CN
苯环分散了负电荷,而且CN的吸电子诱导 效应和共轭效应稳定了碳负离子
C H
碳氧双键的加成反应

O
O
CH3 C CH ቤተ መጻሕፍቲ ባይዱOEt
上面的反应机理说明在进行缩合反应时当酯的α碳上只有一 上面的反应机理说明在进行缩合反应时当酯的 碳上只有一 个氢时,需要使用很强的碱, 个氢时,需要使用很强的碱,当有两个氢时使用比较弱的 碱如醇钠就可以, 碱如醇钠就可以,同时反应中应用碱性较强的溶剂
21
Dieckmann反应 反应 假若分子中的两个酯基被四个或四个以上的碳原子隔开时, 假若分子中的两个酯基被四个或四个以上的碳原子隔开时, 也可以发生分子内的缩合反应, 也可以发生分子内的缩合反应,这种环化酯缩合反应称为 Dieckmann反应 反应
Br O + HBr O
23
亲核加成 1,4-加成 加成
Nu
C
C
C R
O
Nu C C
C O R
H
Nu C C C O R
弱碱性亲核试剂进 攻羰基碳时主要是 1,4-加成
H
1,2-加成 加成
C C CO R
Nu
强碱性亲核 试剂进攻羰 基碳时主要 是1,2-加成
Nu C C CO R
Nu C C C OH R
羟醛缩合的产物极易失去一分子水,固此反应是合成 羟醛缩合的产物极易失去一分子水,固此反应是合成α, β-不 不 饱和醛酮的一个很好的方法
12
4、Perkin反应 、 反应 芳醛与酸酐,在碱性催化剂作用下发生缩合反应, 芳醛与酸酐,在碱性催化剂作用下发生缩合反应,称 为Perkin(浦尔金)反应 (浦尔金) 反应一般式如下: 反应一般式如下
24
2、金属氢化物与羰基化合物的加成 、
LiAlH4
CH2 CH CH CH CHO or NaBH CH2 CH CH CH CH2OH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
+
CH3 CH3
反式( ) 顺式( ) 反式(dl) 顺式(dl) 50% 50% 4.2.3 不对称加成规则 不对称烯烃与不对称试剂的加成具有区域选择性, 不对称烯烃与不对称试剂的加成具有区域选择性 , 马氏加成。形成了较稳定的碳正离子。 为马氏加成。形成了较稳定的碳正离子。 试剂中带部分正电的原子或基团加到具有较多负 电荷双键碳上。 电荷双键碳上。
第四章 碳碳双键的加成反应
高等有机化学
加成反应:催化氢化、亲电加成、 加成反应:催化氢化、亲电加成、亲核加成和自由基 加成。 加成。 4.1 催化氢化 催化氢化分为非均相催化(多相催化) 均相催化。 催化氢化分为非均相催化(多相催化)和均相催化。 非均相催化 非均相催化的催化剂为固体, 非均相催化的催化剂为固体,均相催化的催化剂溶于 介质成液相,整个反应体系为一相。 介质成液相,整个反应体系为一相。 4.1.1 多相催化氢化 氢和烯烃吸附在催化剂表面, 键和H-H键断裂,形 键断裂, 氢和烯烃吸附在催化剂表面,使π键和 键和 键断裂 成金属氢化物和配合物, 成金属氢化物和配合物,氢原子再分别转移到双键碳 原子. 原子 立体化学为顺式加成,反应收率高,速度快。 立体化学为顺式加成,反应收率高,速度快。
CH3CH CH2 + HBr
过氧化 物
CH3CH2CH2Br
稳定性: 稳定性 旋转. 旋转
CH3CHCH2Br > CH3CHBrCH2
H3 C
CH2Br
溴亚甲基为供电子基:+C’ > -I 溴亚甲基为供电子基:
4.2.4 烯烃的羟汞化-脱汞反应 烯烃的羟汞化-
加成方向为马氏加成,是合成醇一种常用方法。 加成方向为马氏加成,是合成醇一种常用方法。
历程
δδ+ RCH CH2 + Hg(OAc)2
-OAc-
Hg
OAc
H2O
OH RCHCH2 HgOAc
CH3 COOC C
+
CH3 C C CH3
COOBr2
CH3 Br C C O
-
Br CH3
CH3
COO-
+
CH3 Br CH3 C C C O COOO
CH3 C C
-
COOBr2
CH3 Br C C+
COO-
OOC
CH3
-
OOC
CH3
4.2.2 亲电加成的立体化学 1. 通过溴鎓离子的反式加成
C
C
+ H2
Pd,BaSO4 喹啉
C=C
OH
OH Pd,BaSO 4 喹 啉 3 0℃
OH OH
4.底物结构 4.底物结构 空阻大的底物催化氢化比较困难。 空阻大的底物催化氢化比较困难。 活性
RCOCl (RCHO) > RNO2(R-NH2) > RC
CR'
(RCH=CHR’) > RCHO ( RCHOH ) >RCH=CHR’ (RCH2CH2R’)>RCOR’>RCH (OH) R’>ArCH2OR (ArCH3) >RCN (RCH2NH2)
O O
+
O ArCO
O + ArCO- + Cu2+
ArCOOCAr + Cu
-CO2 Ar.
二、自由基加成历程 包括链引发、链增长和链传递。 包括链引发、链增长和链传递。在链增长阶段要消耗 一个自由基就产生一个自由基,活化能很小。 一个自由基就产生一个自由基,活化能很小。 4.3.2自由基加成反应的方向 自由基加成反应的方向
H + O
H
57% % 93%
H
47% % 7%
乙醇中几乎没有选择性
OH
H2/PtO2
O COOEt
AcOH
H COOEt H
95%
顺式
H
H2/PtO2 CH3OH
OH COOEt H
95%
反式
4.2 亲电加成反应
4.2.1
C C
亲电加成反应的历程
E+ + E Nu
+ -
E C C
σ -络合物(碳正离子) 络
+
CH3 H Br
Ph H
H
苏式 (83%)
Br CH3 H Br
C-Cσ键转动 键
碳正离子有 一定的寿命
Br-
H
+
C
CH3 H Br
H Ph
相当于顺 式加成
Ph
赤 式 (17% )
BrPh C C H CH3 H + Br2
CCl4
Ph
+
H CH3
Br Ph
H CH3
H
Br
H
Br
C-Cσ键转动 键
BrClH2O
NaCl
CH2BrCH2
CH2BrCH2Br CH2BrCH2Cl CH2BrCHOH2
-H+
CH2BrCH2OH
2. 2,3-二甲基丁烯二酸钠与 2得溴代苹果酸的 内 二甲基丁烯二酸钠与Br 二甲基丁烯二酸钠与 得溴代苹果酸的β-内 酯。 说明C+中间体存在,反应是分步 说明 中间体存在,
> > RCONHR'(RCH2NHR') > PhH ( > RCOOR'(RCH2OH+R'OH) )
溶剂的种类和极性, 溶剂的种类和极性,反应体系的酸碱性均能影响催化氢 化的反应速度和选择性。 化的反应速度和选择性。
+ H2 O
Pd-CaCO3 25℃ ℃
H O
C2H5OH C2H5OH+HCl(10%)
Br-
赤式(88%)
Br
H
H
+
C
H CH3 Br
H
CH3
Ph
Ph
Br
苏式 (12%)
主要产物为赤式(相当于反式加成) 主要产物为赤式(相当于反式加成),次要产物 赤式 反式加成 苏式(顺式加成) 为苏式(顺式加成)
3. 通过平面碳正离子中间体的非立体选择性加成
H2O HNO3
CH3 CH3 OH CH3 OH H CH3 H
CH3 δ+ - H δ C C + CH3 CH3
CH3
δ- δ+ HO-Cl
HO-
OH CH3 C CHCH3 CH3 Cl
CH CHCH3 CH3 Cl
CF3
δ- δ+ CH=CH2 +
δ+ δ- AlBr3 CF3 CH2 CH2Br H Br
H C Br
-I
H2C CH
H C H δ+ δ− Br + H Br
p轨道 轨道
H C H
sp2杂化
sp2杂化轨道
单线 态卡宾
p轨道 p轨道 轨道 轨道
H
C
H
sp杂化 杂化
三线态卡宾 双自由基形式) (双自由基形式)
单线态与烯烃加成时的立体化学为顺式加成( 单线态与烯烃加成时的立体化学为顺式加成(立体 顺式加成 专一性反应)。 专一性反应)。
Cl Et C=C H Et H + CCl2 Et C H C C Et Cl H
H H
C C
吸附
H H
C C
H H
C
C
H
C C H
C C H H 解吸 C C H H +
为了提高催化剂的催化性能,常加入惰性载体的活性 为了提高催化剂的催化性能, 炭、碳酸钙等。 碳酸钙等。 4.1.2影响催化氢化反应的因素 4.1.2影响催化氢化反应的因素 1. 温度 (1)升高温度有利于氢化反应,但氢化反应的选择降低。 升高温度有利于氢化反应,但氢化反应的选择降低。 升高温度有利于氢化反应
O* CH3CCH3
CH3 + CH3C
CH3 + CO
激发态
2. 热解 温度一般为50-150℃,共价键发生均裂。 ℃ 共价键发生均裂。 温度一般为
Br Br △ 2Br
CN
CN
60-100
(CH3)2C N N C(CH3)2
C
2(CH3)2CCN + N2
偶氮二异丁晴 3. 氧化 还原反应(发生单电子转移) 氧化-还原反应 发生单电子转移) 还原反应(
Br C C + Br Br C C
Br C C
Br C C
Br -
sp2杂化
Br C C Br
H C C H
COOH
Br2
Br H H COOH COOH
内消旋体
COOH
①
Br H H Br ①
②
Br-
H Br + H Br
COOH
COOH COOH
COOH ②
dl 外消旋体
反 式加成
H C C HOOC
2.压力 2.压力 增加氢气压力相当于提高氢气浓度,有利于氢化, 增加氢气压力相当于提高氢气浓度 ,有利于氢化 , 但选择性降低. Lindlar催化剂 常压生成烯, 催化剂, 但选择性降低 . 如 Lindlar 催化剂 , 常压生成烯 , 加 压为烷烃。 压为烷烃。 3.催化剂 催化剂 不同催化剂对同一反应的催化活性不同, 不同催化剂对同一反应的催化活性不同 , 同一反应 用不同的催化剂,其产物可能不一样。 用不同的催化剂,其产物可能不一样。 催化剂的活性与比表面、 载体、 催化剂的活性与比表面 、 载体 、 助催化剂和抑制剂 有关.催化剂的比表面越大 活性越高, 催化剂的比表面越大, 有关 催化剂的比表面越大,活性越高,载体的作用是 提高催化剂的分散度,增加催化剂的稳定性和比表面。 提高催化剂的分散度,增加催化剂的稳定性和比表面。 助催化剂能提高催化剂活性, 助催化剂能提高催化剂活性 ,而抑制剂可部分降低催 化剂活性。 化剂活性。
