国标法检测食品中大肠菌群2015技术文件(赛项规程)
食品微生物检验技术W3305 大肠菌群检验(第二法)-4-微教材

《微生物检验技术》课程-微教材微课编号W3305 微课名称 大肠菌群检验(第二法) 所属模块(章节)M3 微生物常规指示菌检验 子模块 M3-3大肠菌群检验 关键词大肠菌群检验第二法;平板计数法;检验准备;操作程序及要点;结果计数与报告 是否通用√通用 农产品 食品 是否重点建设 是 √否 微课类型 讲授型 微课形式 PPT 动画式微课类型 讲授型 教学目标 熟悉食品中大肠菌群检验第二法的检验准备工作内容;掌握食品中大肠菌群检验第二法的操作程序及要点;掌握食品中大肠菌群检验第二法的结果报告方法。
教学内容 知识点技能点 1、食品中大肠菌群检验第二法的检验准备工作内容;2、食品中大肠菌群检验第二法的操作程序及要点;3、食品中大肠菌群检验第二法的结果报告方法。
1、食品中大肠菌群检验第二法的检验准备; 2、食品中大肠菌群检验第二法的操作; 3、食品中大肠菌群检验第二法的结果报告。
知识讲解一、食品中大肠菌群检验(第二法)的国标解读与检验准备国标对于食品中大肠菌群检验所需的设备材料有明文规定,检验中所用的仪器设备必须符合国标规定的精密度要求。
下面我们来做一个详细解读。
首先,是一个基本的微生物检验实验室必须要具备的常规灭菌设备和培养设备,这些常规设备是满足基本的无菌物料制备和微生物培养的基础。
比如,高压蒸汽灭菌锅和超净工作台等,都是必须要具备的。
在大肠菌群检验项目中,重要的培养设备是恒温培养箱。
培养箱温度设定为36℃。
对于培养箱温度设置精度的要求是±1℃。
在大肠菌群检验的实际工作中,冰箱也是必不可少的,可以对样品和各类需要冷藏试剂及培养基,进行妥善保存。
恒温水浴锅在大肠菌群检验中的作用,是用于将融化的结晶紫中性红胆盐琼脂培养基保持在46℃。
感量为0.1g的天平,通常放置在无菌室,用于准确称取固体检验样品。
均质器用于处理固体样品,如果是做液体样品的检测,那么就不需要用到均质器了。
均质器有两种,一种是拍击式,另一种是旋刃式。
大肠菌群测定操作规程

版次 审核
第一版
共 1 页 批准 更改次数
第 1 页
大肠菌群测定操作规程
适用范围:大肠菌群系指一群在 36℃条件下培养 48h 能发酵乳糖、产酸产气的需氧和兼性厌氧的革 兰氏阴性无芽孢杆菌。通常用此法作为粪便污染指标来评价食品的卫生质量。
二. 1.
操作内容: 检验程序: 检样→ 稀释 → LST 发酵管(36±1℃,24±2h)
↓→不产气 → 大肠菌群阴性 → 报告 产气 →BGLG(36±1℃,48±2h) → 不产气 → 大肠菌群阴性 → 报告 产气 → 大肠菌群阳性 → 报告 2. 操作方法:
2.1 以无菌操作,将检样 10ml 被测液放于含有 90ml 灭菌生理盐水或其他稀释液的灭菌玻璃瓶内(瓶 内预置适当数量的玻璃珠)或灭菌乳钵内,经充分振摇或研磨做成 1:10 的均匀稀释液。 2.2 用 1ml 灭菌吸管吸取 1:10 稀释液 1ml,沿管壁徐徐注入含有 9ml 灭菌生理盐水或其他稀释液的 试管内(注意吸管尖端不要触及管内稀释液) ,振摇试管,混合均匀,做成 1:100 的稀释液。 (均 液的 PH 值应在 6.5~7.5 之间,必要时分别用 1mol/L 氢氧化钠(NaoH)或(1mol/L)盐酸(HCL) 调节。 2.3 另取 1ml 灭菌吸管,按上条操作顺序,做 10 倍递增稀释液,如此每递增稀释一次,即换用 1 支 1ml 灭菌吸管。 2.4 根据食品卫生标准要求或对检污染情况的估计,选择三个稀释度,每个稀释度接种 3 管。 2.5 初发酵试验:将待检样品接种于月桂基硫盐胰蛋白胨发酵管内,接种量在 1ml,每一稀释度接种 3 管, 36±1℃文箱内培养 24±2h, 置 观察倒管内是否有气泡产生, 如未产气则继续培养至 48h±2h. 记录在 24h 和 48h 内产气的 LST 肉汤管数。未产气者为大肠菌群阴性,产气者则进行复发酵试验。 2.6 复发酵试验 用按种环从所有 48h±2h 内发酵产气的 LST 肉汤管中分别取培养物 1 环, 移种于 BGLB 肉汤管中, 36±1℃培养 48h±2h,观察产气情况。产气者,计为大肠菌群阳性管。 2.8 报告: 根据证实为大肠菌群阳性的管数, MPN 检索表 查 (见 GB/T4789.3 附表 B) 报告每 100ml , (g) 大肠菌群的 MPN 值。
GZ025 食品安全与质量检测赛题第8套-2023年全国职业院校技能大赛拟设赛项赛题完整版(10套)

表3-8是非题2023年全国职业院校技能大赛高职组“食品安全与质量检测”竞赛食品理化分析技能考核任务1乳品中三聚氧胺含量检测(样品8)现场操作规程及要求赛位号:注意事项:1,考虑竞赛的时间要求以及公平公正的大赛原则,本项目操作规程在参照国家标准GB∕T22388∙2008《原料乳与乳制品中三聚寓胺检测方法》第一法的基础上略有改动。
2.竞赛由组委会统一准备空白样品,每位选手做三个平行加标样,样品预处理完成后,由组委会统一送至第三方检测机构检测,此法可较好控制比赛时间,同时能够保证结果准确度的可评价性。
3.选手提前10分钟进场。
选手入场后可检视仪器设备,如有问题可提出更换;比赛正式开始后不再处理任何仪器设备问题,一切后果选手自负。
4.离心、氮吹步骤统一安排,轮流进行,有些步骤需按要求举手示意裁判确认。
5.比赛过程中请做好相应的安全防护措施,并进行设备使用登记。
6.比赛时间:150分钟,其中氮吹行进和等待时间扣除。
乳品中三聚氧胺含量的检测1.样品预处理考虑到竞赛的时间要求以及公平公正的大赛原则,本项目操作规程在参照国家标准GB/T22388-2008《原料乳与乳制品中三聚氟胺检测方法》第一法的基础上略有改动。
竞赛由组委会统一准备空白样品,每位选手做三个平行加标样,样品预处理完成后,由组委会统一送至第三方检测机构检测,这样能够较好地控制比赛时间,同时能够保证结果准确度的可评价性。
(1)样品称量称取2g(精确至0.0Ig)乳品试样于50m1.具塞塑料离心管中,并及时填写样品称量记录单。
(2)样品提取在上述离心管中用移液枪加入标液100μ1.,准确移入15.0Om1.三氯乙酸溶液和5.00m1.乙睛,涡旋混匀后超声提取5min后以≥7000r/min速度离心5min,移取4.00m1.上清液并加入2m1.水充分混匀后作为待净化液。
依次用3m1.甲醇、5m1.水活化固相萃取柱,转移待净化液至固相萃取柱,依次用3m1.水和3m1.甲醇淋洗,抽至近干后用6.0Om1.氨化甲醇溶液洗脱,洗脱液于50C。
大肠菌群测定—食品中大肠菌群的测定方法

培养特性: 大肠杆菌合成代谢能力强,在含无机盐、铵盐、葡萄 糖的普通培养基上生长良好。最适生长温度为37℃, 在42-44 ℃条件下仍能生长,生长温度范围15-46 ℃。
➢ 在普通营养琼脂上有3中菌落形 态:
➢ 1)光滑型:菌落边缘整齐, 表面有光泽、湿润、
➢ 光滑、呈灰色,在生理盐水 中易分散;
计,选择三个稀释度,每个稀释度接种三管乳 糖胆盐发酵管。
•
接种量在1ml以上者,用双料乳糖胆盐发酵管,1ml及1ml
以下者,用单料乳糖胆盐发酵管,同时用大肠埃希氏菌和产气肠
杆菌混合菌种混合接种于1支作单料乳糖胆盐发酵管对照。
• 置36±1℃温箱培养24±2小时,如所有发酵管 都不产气,则可报告为大肠菌群阴性,如有产 气者,则与对照的混合菌种一起按下列程序进 行。
4、 大肠菌群最可能数(MPN )的报告
➢ 根据大肠菌群阳性管数,检索MPN 表(见附录
B ) ,报告每克(或毫升)样品中大肠菌群的 MPN 值。 ✓注意:当检样的量与表中的量有增加或减少时,
表内的数也应相应减少或增加。
大肠杆菌 0157显色 培养基上 的菌落
在伊红美兰乳糖琼脂(EMB)上
大肠菌群在去氧胆酸钠琼脂上的典型特征
设备和材料
食品中大肠菌群测定
参考 GB4789.3-2010
➢主要由肠杆菌科中埃希氏菌属、肠杆菌 属、克雷伯氏菌属的一部分及沙门氏属 的Ⅲ亚属细菌组成。
3、大肠杆菌的生物学特性
基本形态
此菌为两端钝圆的短小杆菌,一般约0.50.8μm*1.0-3.0 μm,多单独存在或成双,但 不呈长链排列。约50%的菌株有周生鞭毛, 但多数只有1-4根,一般不超过10根,故菌体 动力弱。多数菌株有菌毛,有的有荚膜或微 荚膜,不形成芽孢,对普通碱性染料着色良 好,革兰氏染色阴性。
2015年版微生物限度检验操作规程完整

2015年版微生物限度检验操作规程完整2015版微生物限度检验操作规程目的建立微生物限度检查操作规程,规操作,保证结果的准确性。
围成品、辅料、包装袋及纯化水的检验。
容概述:本检验操作规程依据中国药典2015年版四部《通则1105 非无菌产品微生物限度检查:微生物计数法》和《通则1106 非无菌产品微生物限度检查:控制菌检查法》进行检查。
微生物计数法一、计数方法1.微生物计数法系用于能在有氧条件下生长的嗜温细菌和真菌的计数。
2、计数方法本法包括平皿法、薄膜过滤法。
3、计数培养基适用性检查和供试品计数方法适用性检查供试品微生物计数中所使用的培养基应进行适用性检查。
供试品的微生物计数方法应进行方法适用性试验,以确定采用的方法适合于该产品的微生物计数。
4、菌种及菌液的制备4.1试验用菌株的传代次数不得超过5代(从菌种保藏中心获得的干燥菌种为第0袋),并采用适宜的菌种保藏技术进行保藏。
计数培养基适用性检查和计数方法适用性试验见表1。
4.2菌液制备按表1规定培养各试验菌株。
取金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌的新鲜培养物,用PH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液制成适宜浓度的菌悬液;取黑曲霉的新鲜培养物加入3-5ml含0.05%(ml/ml)聚山梨酯80的PH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液,将孢子洗脱。
采用适宜的方法吸出孢子悬液至无菌试管中,用含0.05%(ml/ml)聚山梨酯80的PH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液制成适宜浓度的黑曲霉孢子悬液。
菌液制备后若在室温下放置,应在2小时使用;若保存在2-8℃,可在24小时使用。
黑曲霉孢子悬液可保存在2-8℃,在验证过的贮存期使用。
表1 试验菌液的制备和使用4.3阴性对照为确认试验条件是否符合要求,应进行对照试验,阴性对照试验应无菌生长。
4.4培养基适用性检查按照表1规定,接种不大于100cfu的菌液至胰酪大豆胨液体培养基或胰酪大豆胨琼脂培养基平板或沙氏葡萄糖琼脂培养基平板,置规定的条件下培养。
大肠菌群检验技术

2.初发酵和证实试验:
无论是国家标准的三步法还是行业标准的两步 法,都利用了乳糖发酵管进行了两次发酵试验,培 养基的配制略有不同,但都是为了证实培养物是否 符合大肠菌群的定义,即“在37℃分解乳糖产酸产 气”。 初发酵阳性管,不能肯定就是大肠菌群细菌, 经过证实试验后,有时可能成为阴性。有数据表明, 食品中大肠菌群检验步骤的符合率,初发酵与证实 试验相差较大。因此,在实际检测工作中,证实试 验是必需的。
5.抑菌剂:
大肠菌群检验中常用的抑菌剂有胆盐、十二烷基硫 酸钠、洗衣粉、煌绿、龙胆紫、孔雀绿等。抑菌剂的主 要作用是抑制其它杂菌,特别是革兰氏阳性菌的生长。 国家标准中乳糖胆盐发酵管利用胆盐作为抑菌剂, 行业标准中LST肉汤利用十二烷基硫酸钠作为抑菌剂, BGLB肉汤利用煌绿和胆盐作为抑菌剂。 抑菌剂虽可抑制样品中的一些杂菌,而有利于大肠 菌群细菌的生长和挑选,但对大肠菌群中的某些菌株有 时也产生一些抑制作用。有些抑菌剂用量甚微,称量时 稍有误差,即可对抑菌作用产生影响,因此抑菌剂的添 加应严格按照标准方法进行。
3.产气量与倒管:
在乳糖发酵试验工作中,经常可以看到在发酵 倒管内极微少的气泡(有时比小米粒还小),有时 可以遇到在初发酵时产酸或沿管壁有缓缓上浮的小 气泡。实验表明,大肠菌群的产气量,多者可以使 发酵倒管全部充满气体,少者可以产生比小米粒还 小的气泡。如果对产酸但未产气的乳糖发酵如有疑 问时,可以用手轻轻打动试管,如有气泡沿管壁上 浮,即应考虑可能有气体产生,而应作进一步试验。
4.挑选菌落:
国家标准中,需要对初发酵阳性培养物接种伊红美蓝 平板分离,对典型和可疑菌落进行观察和证实试验。由于 大肠菌群是一群细菌的总称,在平板大肠菌群菌落的色泽、 形态等方面较大肠菌更为复杂和多样,而且与大肠菌群的 检出率密切相关。国家标准方法规定伊红美蓝平板为分离 培养基,在该平板上,大肠菌群菌落呈黑紫色有光泽或无 光泽时,检出率最高;红色、粉红色菌落检出率较低。 另外,挑取菌落数与大肠菌群的检出率有密切关系, 只挑取一个菌落,由于机率问题,尤其当菌落不典型时, 很难避免假阴性的出现。所以挑菌落一定要挑取典型菌落, 如无典型菌落则应多挑几个,以免出现假阴性。
2015版中国药典微生物检验

非无菌药品微生物限度标准 (通则1107)解析
• 修订思路
(1)将《中国药典》2010版一、 二、三部微生物限度标准项目进行对比、整合。 • 采用一部的限度标准项目作为合并后限度标准的 基础。 • 参考EP7.0、USP35、JPⅩⅤ标准,修订中国 药典的微生物限度标准。 • 采用清晰直观的表格形式,按给药途径、分液 体、固体性状、列出各类药品的限度标准。
检验量
• 一般随机抽取不少于2个最小包装的供试品 ,混合,取规定量供试品进行检验。 • 除另有规定外,一般供试品的检验量为10g 或10ml;膜剂为100cm2;贵重或微量包装 药品的检验量可以酌减。 • 检验时,应从2个以上最小包装单位中抽取 供试品,大蜜丸还不得少于4丸,膜剂还不 得少于4片。
微生物基本知识
• 定义:微生物(microorganism)是对所有 形体微小,单细胞或结构较为简单的多细 胞甚至无细胞结构的低等生物的统称。
微生物的分类
• 原核微生物:细菌、放线菌、立克次氏体 支原体、衣原体、蓝细菌和古细菌
• 真核微生物:酵母菌、霉菌、粘菌、原生 动物和藻类 • 非细胞型生物:病毒、噬菌体、类病毒、 拟病毒和朊病毒
试剂和试药
• 中和剂、灭活剂和表面活性剂均应对微生物无 毒性其相互间具有相容性,有利于样品中微生 物均匀分散。 • 稀释液 1、pH7.0无菌氯化钠-蛋白胨缓冲液;2、pH6.8 无菌磷酸盐缓冲液、pH7.2无菌磷酸盐缓冲液 、pH7.6无菌磷酸盐缓冲液;如需要,可在上 述稀释液灭菌前或灭菌后加入表面活性剂或中 和剂等。3、0.9%无菌氯化钠溶液。
格式变化
中国药典2010年版微生物计数法编排方式
中国药典2015年版微生物计数法编排方式
内容变化
微生物限度检查操作规程(中国药典2015版四部通则)
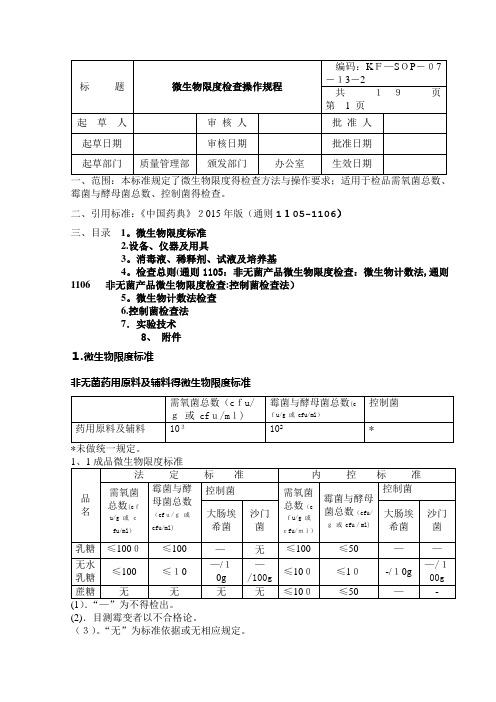
霉菌与酵母菌总数、控制菌得检查。
二、引用标准:《中国药典》2015年版(通则1105-1106)三、目录1。
微生物限度标准2.设备、仪器及用具3。
消毒液、稀释剂、试液及培养基4。
检查总则(通则1105:非无菌产品微生物限度检查:微生物计数法,通则1106非无菌产品微生物限度检查:控制菌检查法)5。
微生物计数法检查6.控制菌检查法7.实验技术8、附件1.微生物限度标准非无菌药用原料及辅料得微生物限度标准(2).目测霉变者以不合格论。
(3)。
“无”为标准依据或无相应规定。
准依据或无相应规定.2.设施、仪器及用具2、1、设施:2、1、1.微生物限度检查室及相关设施:微生物计数试验环境应符合微生物限度检查得要求。
检验全过程必须严格遵守无菌操作,防止再污染,防止污染得措施不得影响供试品中微生物得检出。
单向流空气区域、工作台面及环境应定期进行监测。
2、1、2.其她设备:高压蒸汽灭菌器;细菌培养箱(30~35℃);霉菌培养箱(25~28℃);电炉(或其她适宜得加热装置);恒温水浴;电热干燥箱(250~300℃);电冰箱。
生化试剂储存箱。
2、2仪器及器皿2、2、1。
菌落计数器;显微镜(1500X);电子天平或药物天平(感量0、1g);pH 系列比色计。
2、2、2.玻璃器皿:锥形瓶(250~300ml,内装玻璃珠若干)、研钵(玻璃或陶瓷制,∮10~12cm)、培养皿(∮9 cm)、量筒(100ml)、试管(18×180mm)及塞、吸管(1ml分度0、01,10ml分度0、1)、载玻片、盖玻片、玻璃消毒缸(带盖)。
2、2、3新购得玻璃器皿得清洁:先用流水冲洗,浸泡于1%~2%盐酸(工业用)液中约2~6小时,除去游离碱质,再用流水冲洗.用于化学分析得玻璃仪器,需用重铬酸钾清洁液浸泡数分钟后,再用流水冲洗,最后以纯化水涮洗2~3次,晾干备用。
2、3用过得玻璃器皿:2、3、1未被病原微生物污染得器皿:可随时洗涤.用清水冲洗(或浸泡),除容量仪器外,可用毛刷与肥皂粉,内外刷洗,再用清水涮洗干净,晾干备用.容量仪器宜用清洁液浸泡或涮洗,再用流水冲洗,最后以纯化水涮洗2~3次.试管及培养皿:先正放或直立于高压蒸汽灭菌器内,经121℃灭菌30 分钟.趁热倾出培养物,再以清水或用毛刷及肥皂粉刷洗,最后以流水涮净。
国标食品中大肠杆菌的检测流程

国标食品中大肠杆菌的检测流程英文回答:The detection process of Escherichia coli (E. coli) in food products follows a standardized procedure to ensure food safety. The testing process involves several steps, including sample collection, sample preparation, and the actual detection of E. coli.Firstly, sample collection is crucial in ensuring the accuracy of the test results. The food samples arecollected from various sources, such as farms, food processing facilities, or retail stores. For example, if we are testing ground beef for E. coli, we would collect a representative sample from different batches or lots.Once the samples are collected, they need to be prepared for testing. This involves grinding or homogenizing the sample to create a uniform mixture. The purpose of this step is to ensure that any potential E.coli present in the sample is evenly distributed and can be detected.After sample preparation, the actual detection of E. coli takes place. There are different methods available for E. coli detection, such as culture-based methods, molecular methods, and immunological methods. Culture-based methods involve growing the bacteria on specific media that promote the growth of E. coli. This allows for the identification and quantification of E. coli colonies. Molecular methods, such as polymerase chain reaction (PCR), detect the presence of E. coli DNA in the sample. Immunological methods use antibodies that specifically bind to E. coli antigens, allowing for the detection of the bacteria.Once the detection is completed, the results are interpreted and reported. The presence or absence of E.coli in the sample is determined based on the detection method used. The results are then compared to the established standards or regulations to determine if the sample is compliant or non-compliant.In conclusion, the detection process of E. coli in food products involves sample collection, sample preparation,and the actual detection using various methods. This standardized procedure ensures the safety of food products and helps in preventing foodborne illnesses.中文回答:国标食品中大肠杆菌的检测流程遵循一套标准化的程序,以确保食品的安全。
大肠杆菌检测国家标准

大肠杆菌检测国家标准
首先,大肠杆菌检测国家标准要求对食品和水质中的大肠杆菌进行定量检测。
这意味着需要准确测量样品中大肠杆菌的数量,以评估其是否超过了安全标准。
这项标准的制定,能够有效地防止因大肠杆菌超标而引发的食品安全事件,保障公众的身体健康。
其次,大肠杆菌检测国家标准要求检测方法的准确性和可靠性。
为了确保检测
结果的准确性,标准明确了检测方法的操作流程、仪器设备的要求以及质控措施等。
这些严格的要求能够保证检测结果的可靠性,为食品生产企业和监管部门提供了科学依据。
此外,大肠杆菌检测国家标准还规定了对检测人员的资质和培训要求。
只有经
过专业培训并取得相应资质的检测人员,才能进行大肠杆菌的检测工作。
这一举措能够保证检测人员具备足够的专业知识和操作技能,提高检测结果的可信度。
除了食品和水质中的大肠杆菌检测,大肠杆菌检测国家标准还对相关产品和设
备进行了规范。
例如,对于用于大肠杆菌检测的培养基、试剂盒、检测仪器等产品,标准对其质量和性能提出了明确的要求,以确保其在检测过程中的有效性和稳定性。
总的来说,大肠杆菌检测国家标准的制定和执行,对于保障食品和水质安全,
预防疾病传播,维护公众健康具有重要意义。
这一标准的实施,不仅能够提高食品生产企业的自律管理水平,也能够为监管部门提供科学依据,有效防范食品安全风险,保障公众的健康权益。
在未来,我们应该进一步完善大肠杆菌检测国家标准,不断提高检测方法的灵
敏度和准确性,加强对检测人员的培训和管理,推动大肠杆菌检测技术的创新和发展,为保障食品和水质安全做出更大的贡献。
【干货分享】大肠菌群、粪大肠、大肠埃希氏菌检验的相关知识

【干货分享】大肠菌群、粪大肠、大肠埃希氏菌检验的相关知识食品微生物检测1、大肠菌群、粪大肠菌群和大肠埃希氏菌检验方法(1)大肠菌群(colifoms)一群在36°C培养48h可发酵乳糖产酸产气、需氧或兼性厌氧的革兰氏阴性无芽孢杆菌。
该菌主要来源自人畜粪便,作为粪便污染指标评价食品的卫生状况,推断食品中肠道致病菌污染的可能。
(2)粪大肠菌群(Fecal colifoms)也称耐热大肠菌群。
指大肠菌群中能在44.5C生长、发酵乳糖产生气体的一群细菌。
与大肠菌群一样,并非细菌学分类命名,而是卫生细菌领域的用语,它不代表某-一个或某一属细菌,而指的是具有某些特性的-组与粪便污染有关的细菌,这些细菌在生化及血清学方面并非完全一致。
食品卫生学意义:作为粪便污染食品的指标菌,MPN值愈低则说明食品受粪便污染程度及对人体健康危害程度愈低作为肠道致病菌污染食品的指针,大肠菌群数量越多则肠道致病菌存在的可能性就越高,但两者之间并不总是呈平行关系。
(3)大肠埃希氏菌(Escherichia coli)分类学概念:肠杆菌科、埃希氏菌属。
是人和温血动物肠道内普遍存在的细菌,是粪便中的主要菌种。
一般生活在人大肠中并不致病,但它侵入人体一些部位时,可引起感染。
主要有:■O抗原(菌体抗原,150个)■K抗原(荚膜抗原,90个)■H抗原( 鞭毛抗原,50个)(4)致泻性大肠埃希氏菌能侵入肠粘膜上皮细胞,引起食物中毒的大肠埃希氏菌。
产毒性大肠埃希氏菌(ETEC)-肠胃炎、旅行性腹泻。
■致病性大肠埃希氏菌(EPEC)-婴儿腹泻;■肠出血性大肠埃希氏菌(EHEC)--出血性结肠炎;(O157∶H7;O104∶ H4;O111;O126等)■侵袭性大肠埃希氏菌(EIEC)—杆菌性痢疾;■粘附性大肠埃希氏菌(EAEC)—急慢性腹泻。
2、大肠菌群、粪大肠菌群、大肠埃希氏菌的关系3、相关检验方法标准■GB4789.3-2016食品安全国家标准食品微生物学检验大肠菌群计数■GB 4789.38-2012食品安全国家标准食品微生物学检验大肠埃希氏菌计数■GB 4789.39- -2013食品安全国家标准食品微生物学检验粪大肠菌群计数■GB4789.6- 2016 食品安全国家标准食品微生物学检验致泻大肠埃希氏菌检验■GB4789.36-2016食品安全国家标准食品微生物学检验大肠埃希氏菌O157:H7/NM检验。
食品中大肠菌群计数测定的标准操作规程

食品中大肠菌群计数测定的标准操作规程1.目的本标准操作规程的目的是为了能够准确、快速地测定食品中大肠菌群的数量,以便于对食品的卫生状况进行评估。
2.应用范围该操作规程适用于各种食品样品,如肉、鱼、蔬菜、水果等。
3.实验器材和试剂3.1器材:(1)无纤维纸滤纸或滤膜或滤布等过滤介质。
(2)LED 灯或紫外灯。
(3)培养皿、移液器、无毒胶带和显微镜。
(4)电子天平。
(5)水槽和蒸馏水。
3.2试剂:(1)胆盐琼脂培养基。
(2)大肠埃希菌ANTISERUM(可以根据需要添加,如:O157等)。
(3)含有氯化钠、肉汤和酚红的PB(NaCl、pH值7.2±0.2、菜心草浸提液)培养基。
4.操作流程4.1样品的准备样品应当是新鲜的、无病变的,如为肉类样品则需要去除肉骨、制成均匀的细碎物;如为水果蔬菜,则需将其冲洗干净削皮去籽核、制成较小的碎片。
如果是液体样品,需要摇匀,取少量样品进行分析。
(1)将胆盐琼脂培养基先膜切成适当的大小,放置在无菌的培养皿中,静置至凝固(温度约35℃)后,置于4℃左右冷藏备用。
(2)PB培养基的制备:每升PB(NaCl、pH值7.2±0.2、菜心草浸提液)培养基中加入10克肉汤粉和0.01克酚红,用蒸馏水充分搅拌均匀,灭菌后置于4℃左右。
4.3分析程序(1)取样品约10g,加入90mLPB(NaCl、pH值7.2±0.2、菜心草浸提液)中,用搅拌器搅拌1分钟,摇匀后放置2分钟(2分钟后即是样品液体)。
(2)取上述处理好的样品液1mL,加入9mL的PBS(NaCl、pH7.2±0.2)中均匀悬浮。
去除上清后再次悬浮,充分均匀。
(3)取上述悬浮液,利用无菌的吸管分别在胆盐琼脂培养基上均匀涂布(充分在滤纸上滤过),然后进行相应的实验测定:a.在培养皿边缘涂上大肠埃希菌ANTISERUM(注意稀释)。
b.在光照充足的环境下,在37℃下培养16-18小时。
国标法检测食品中大肠菌群2015技术文件资料(赛项规程)

2015年省高职院校“食品类专业”(国标法检测食品肠菌群)学生技能大赛赛项规程二〇一五年九月一、赛项名称2015年省高职院校“食品类专业”(国标法检测食品肠菌群)学生技能大赛。
二、参赛对象与比赛方式(一)参赛对象参赛选手为省高职院校食品类专业的在校学生(三二连读与五年制高职应为4-5年级学生),年龄25周岁以下(1990年10月7日后出生);往届省级以上(含省级)本赛项获三等奖以上(含三等奖)的选手不能参加本次比赛。
指导教师须是同校在职专任教师。
(二)比赛方式本次竞赛中每个参赛队由1名参赛选手组成,每名选手独立完成现场操作比赛,每所学校可报1-2个参赛队,每名选手限1名指导教师,1名教师可同时指导2名选手。
选手与指导教师的对应关系一旦确定,不得随意更改。
三、比赛时间与比赛地点(一)比赛时间2015年10月17日。
(二)比赛地点职业学院第二校区(省市双城区迎宾路162号)。
四、竞赛容与说明1、竞赛容根据食品微生物检测的常规检测项目和社会关注热点,选择具有代表性的检测项目“国标法检测食品肠菌群”作为操作考核容,在国标中有两种法—大肠菌群MPN计数法和大肠菌群平板计数法,根据本次大赛的指导思想和竞赛原则,同时考虑到竞赛项目的可操作性,本次大赛选择“大肠菌群MPN计数法”作为竞赛项目。
检验程序及操作技术依照《食品安全国家标准食品微生物学检验大肠菌群计数》(GB 4789.3-2010)进行考核评判。
本项目主要考察学生在食品微生物学检验实施过程中所涉及的样品稀释液的制备、样品的接种、无菌操作、发酵结果的判断及数据处理等环节的基本操作技能,以及在整个实验过程中的操作文明和操作安全意识。
竞赛容具体分为两个环节,第一环节为初发酵试验,主要包括采样、制备样品稀释液、样液接种;第二环节为复发酵试验,包括初发酵结果观察判断、转接种、复发酵结果观察、出具检验报告。
2、竞赛说明本赛项由一名选手独立完成整个操作过程,并要求参赛选手在0.5个小时完成初发酵试验(15分种)和复发酵试验(15分钟)的各步操作容,如超时,将按超出时间的长短酌情扣分。
大肠菌群测定能力验证技术方案

食品卫生微生物学检验GB/T 4789.3-2003大肠菌群测定能力验证技术方案根据《新项目论证技术要求》,为保证此次能力验证数据准确,结果可靠,特制定如下技术方案:一、检验依据《食品卫生微生物学检验大肠菌群测定GB/T 4789.3-2003》一、检品蛋糕、蜜饯、汽水三种不同种类的典型性样品二、人员比对蛋糕:a、b分别试验进行数据比对(双人双平行);蜜饯:c、a分别试验进行数据比对(双人双平行);汽水:c、b分别试验进行数据比对(双人双平行)。
三、准备工作仔细核对试验使用试剂及相关培养基,灭菌试验所需要的试剂、耗材以及玻璃器皿等。
四、质量控制1、按照国家标准规定准确称取样品和试剂并进行前处理。
2、仪器设备性能和检测环境的确认(1)依据《消毒与灭菌效果的评价方法与标准GB15981-1995》定期对高压蒸汽灭菌锅的灭菌效果进行检测评价并记录;(2)依据《无菌室消毒灭菌操作规程》定期对对无菌室、生物安全柜、超净台、无菌衣进行清洁消毒灭菌;(3)依据《实验室质量控制规范食品微生物检测GB/T27405-2008》定期对对无菌室、生物安全柜及超净台进行沉降菌检测并记录。
3、培养基性能测试依据《食品微生物学检验培养基和试剂的质量GB4789.28-2013》对此参数涉及到的伊红美兰琼脂(EMB)、磷酸盐缓冲液进行验证并记录。
4、对照每次实验均应进行空白对照确保实验数据的可靠性。
五、注意事项1、所用培养基应该事先放在恒温水浴锅内,使得培养基的温度保持在45~55℃之间;2、实验后对本实验所涉及到含阳性菌的耗材、容器、玻璃器皿、培养基、菌株等进行灭菌处理并做好记录;3、实验人员要严格按照《无菌检查系统操作规程》进出无菌室;4、严格按照《食品微生物学检验总则GB4789.1-2016》进行实验。
4、食品安全标准试题(带答案)

(第四部分方法标准部分)一、单选题在《中华人民共和国食品安全法》(2015年修订)第三章第二十六条中规定,食品安全标准应当包括(B)。
A 食品检验方法与规程;B 与食品安全有关的食品检验方法与规程;C 与食品质量和安全有关的食品检验方法与规程;D 以上均不正确。
解析:《中华人民共和国食品安全法》第二十六条食品安全标准应当包括下列内容:(一)食品、食品添加剂、食品相关产品中的致病性微生物,农药残留、兽药残留、生物毒素、重金属等污染物质以及其他危害人体健康物质的限量规定;(二)食品添加剂的品种、使用范围、用量;(三)专供婴幼儿和其他特定人群的主辅食品的营养成分要求;(四)对与卫生、营养等食品安全要求有关的标签、标志、说明书的要求;(五)食品生产经营过程的卫生要求;(六)与食品安全有关的质量要求;(七)与食品安全有关的食品检验方法与规程;(八)其他需要制定为食品安全标准的内容。
我国的检验方法类食品国家安全标准是(A)标准。
强制性的;B.推荐性的;C.可以是强制性的,也可以是推荐性的;D.以上均不正确解析:《中华人民共和国食品安全法》第二十五条食品安全标准是强制执行的标准。
除食品安全标准外,不得制定其他食品强制性标准。
第二十六条食品安全标准应当包括下列内容:(七)与食品安全有关的食品检验方法与规程。
下列关于复检的说法,哪项不正确(A)。
A.采用国家规定的快速检测方法对食品农产品进行抽查检测,被抽查人对检测结果有异议的,可以自收到检测结果时起十二小时内申请复检B.复检机构与初检机构不得为同一机构C.复检机构名录由国务院认证认可监督管理、食品药品监督管理、卫生行政、农业行政等部门共同公布D.复检机构出具的复检结论为最终检验结论解析:《中华人民共和国食品安全法》第八十八条采用国家规定的快速检测方法对食用农产品进行抽查检测,被抽查人对检测结果有异议的,可以自收到检测结果时起四小时内申请复检。
复检不得采用快速检测方法。
大肠菌群检验

使用第二法(附带做第一法中, 使用第二法(附带做第一法中,
3个试管初发酵试验),以污水为样品。 个试管初发酵试验),以污水为样品。ห้องสมุดไป่ตู้个试管初发酵试验),以污水为样品
第一法: 第一法:检样稀释与初发酵试验
MPN:表示食品中大肠菌群数是以每100ML或克检样内大肠 :表示食品中大肠菌群数是以每 或克检样内大肠 菌群最大可能数。一般采用9管法 菌群最大可能数。一般采用 管法. 管法
一般样品25ML(克)+225ML生理盐水 :10,从 一般样品 ( 生理盐水=1: , 生理盐水 10-1取样 取样1ML,接种到 管LST(月桂基硫酸盐胰蛋白 ,接种到3管 ( 胨肉汤) 胨肉汤)中。 取样1ML+9 ML生理盐水 :100,从10-2取样 生理盐水=1: 从10-1取样 生理盐水 , 1ML,接种到3管LST中。 ,接种到 管 中 取样1ML+9 ML生理盐水 :1000,从10-3取 生理盐水=1: 从10-2取样 生理盐水 , 样1ML,接种到 管LST中。 ,接种到3管 中
旧国家标准
大肠菌群MPN 计数法 第一法 大肠菌群
第二法 大肠菌群平板计数法
第一天
小组: 使用第一法(附带做第二法中, 第1、3、5、7小组: 使用第一法(附带做第二法中, 、 、 、 小组 两个平板接种),以自来水为样品。 两个平板接种),以自来水为样品。 ),以自来水为样品
小组: 第2、4、6小组: 、 、 小组
(2)原理 ) 溴甲酚紫,中性时呈蓝紫色,酸性时呈黄色, 溴甲酚紫,中性时呈蓝紫色,酸性时呈黄色,如果 颜色不变(呈蓝紫色),说明无产酸的大肠菌群; 颜色不变(呈蓝紫色),说明无产酸的大肠菌群; ),说明无产酸的大肠菌群 如果颜色变黄色,说明可能出现能分解乳糖产酸 产酸的 如果颜色变黄色,说明可能出现能分解乳糖产酸的 大肠菌群。 大肠菌群。 胆盐可以抑制其它细菌生长繁殖。 胆盐可以抑制其它细菌生长繁殖。 分解乳糖产酸产气的大肠菌群,看小倒管中的气体。 分解乳糖产酸产气的大肠菌群,看小倒管中的气体。 产气的大肠菌群
食品中大肠菌群计数——第二法检测程序步骤.

条件
36 ℃±1 ℃ 2 ℃~5 ℃ 46℃±1℃ 感量0.1g 无特殊要求 无特殊要求
无菌吸管
无菌锥形瓶 无菌培养皿
1mL(具0.01mL刻度)、10mL(具0.1mL 刻度)或微量移液器及吸头
500mL 直径90mm
pH 计或pH 比色管或精密 pH 试纸
菌落计数器
无特殊要求
无特殊要求
— 4—
食品营养与检测专业教学资源库
盛有225mL 磷酸盐缓冲液或 生理盐水的无菌均质杯内
1:10样品匀液
1mL 1mL 9mL 无理 冲 磷 菌盐 液 酸 试水 或 盐 管的 生 缓 1:1000样品匀液
9mL 无理 冲 磷 菌盐 液 酸 试水 或 盐 管的 生 缓
无理 冲 磷 菌盐 液 酸 试水 或 盐 管的 生 缓
1:100样品匀液
配制说明
将上述成分溶于蒸馏水中,静置几分钟,充分搅拌,调节pH 至7.4±0.1。煮沸2min,将培养基融 化并恒温至45 ℃~50 ℃倾注平板。使用前临时制备,不得超过3h。
— 4—
食品营养与检测专业教学资源库
培养基和试剂
名称
煌绿乳糖 胆盐(BGLB) 肉汤
物料名称
蛋白胨 乳糖 牛胆粉溶液 0.1%煌绿水溶液 蒸馏水
选取2个~3 个适宜的连 续稀释度 无菌生 1mL 理盐水
36 ℃±1 ℃ 培养18 h~ 24 h
空白对照
空白对照
36 ℃±1 ℃ 培养18 h~ 24 h
— 4—
食品营养与检测专业教学资源库
过渡页 平板菌落数的选择
五
— 2—
食品营养与检测专业教学资源库
平板菌落数的选择 选取菌落数在15~150cfu之间的平板,分别计数平板上出现的典型和 可疑大肠菌群菌落(如菌落直径较典型菌落小)。典型菌落为紫红 色,菌落周围有红色的胆盐沉淀环,菌落直径为0.5mm或更大,最 低稀释度平板低于15CFU的记录具体菌落数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2015年黑龙江省高职院校“食品类专业”(国标法检测食品中大肠菌群)学生技
能大赛赛项规程
二〇一五年九月
一、赛项名称
2015年黑龙江省高职院校“食品类专业”(国标法检测食品中大肠菌群)学生技能大赛。
二、参赛对象与比赛方式
(一)参赛对象
参赛选手为黑龙江省高职院校食品类专业的在校学生(三二连读与五年制高职应为4-5年级学生),年龄25周岁以下(1990年10月7日后出生);往届省级以上(含省级)本赛项获三等奖以上(含三等奖)的选手不能参加本次比赛。
指导教师须是同校在职专任教师。
(二)比赛方式
本次竞赛中每个参赛队由1名参赛选手组成,每名选手独立完成现场操作比赛,每所学校可报1-2个参赛队,每名选手限1名指导教师,1名教师可同时指导2名选手。
选手与指导教师的对应关系一旦确定,不得随意更改。
三、比赛时间与比赛地点
(一)比赛时间
2015年10月17日。
(二)比赛地点
黑龙江职业学院第二校区(黑龙江省哈尔滨市双城区迎宾路162号)。
四、竞赛内容与说明
1、竞赛内容
根据食品微生物检测的常规检测项目和社会关注热点,选择具有代表性的检测项目“国标法检测食品中大肠菌群”作为操作考核内容,在国标中有两种法—大肠菌群MPN计数法和大肠菌群平板计数法,根据本次大赛的指导思想和竞赛原则,同时考虑到竞赛项目的可操作性,本次大赛选择“大肠菌群MPN计数法”作为竞赛项目。
检验程序及操作技术依照《食品安全国家标准食品微生物学检验大肠菌群计数》(GB 4789.3-2010)进行考核评判。
本项目主要考察学生在食品微生物学检验实施过程中所涉及的样品稀释液的制备、样品的接种、无菌操作、发酵结果的判断及数据处理等环节的基本操作技能,以及在整个实验过程中的操作文明和操作安全意识。
竞赛内容具体分为两个环节,第一环节为初发酵试验,主要包括采样、制备样品稀释液、样液接种;第二环节为复发酵试验,包括初发酵结果观察判断、转接种、复发酵结果观察、出具检验报告。
2、竞赛说明
本赛项由一名选手独立完成整个操作过程,并要求参赛选手在0.5个小时内完成初发酵试验(15分种)和复发酵试验(15分钟)的各步操作内容,如超时,将按超出时间的长短酌情扣分。
另外参赛选手还应明确一点,竞赛过程中用到的初发酵管、初发酵结
果、复发酵管、复发酵结果及MPN检索表均由工作人员事先准备好,参赛选手只要按照竞赛内容里规定项目依据国标要求完成各步操作。
五、评分办法和评分标准
1、评分办法
本项竞赛评分严格按照公平、公正、公开的原则。
竞赛成绩按照百分制计分。
竞赛成绩的评定完全依照赛前制定的技术文件中的主要考核内容及评分标准,根据选手实际操作表现,由现场裁判组进行客观评判、计分。
有关现场操作考核内容及评分标准另见文件中相关标题。
在竞赛过程中,参赛选手如有不服从裁判判决、扰乱赛场秩序、舞弊等不文明行为,由裁判长按照规定扣减相应分数,情节严重的取消竞赛资格,竞赛成绩记0分。
2、对考评员的要求
(1)不得少于3人。
(2)提前15min到达考核现场,熟悉考核规则、评分标准。
(3)按评分标准独立评分。
不得涂改考核记录表。
3、评分标准
表1 主要考核内容及评分标准
评审专家签字:年月日
核分人签字:年月日
六、竞赛规则
1、选手参加考试竞赛顺序将通过抽签决定。
2、参赛选手进入赛场,不允许携带任何书籍和其他纸质资料(相关技术资料由组委会提供),不允许携带通讯工具和存储设备。
现场操作考核项目的操作规程、数据记录纸、签字笔等将由组委会统一提供,现场提供的物品各参赛选手可以根据竞赛需要自行选择使用。
3、参赛选手必须在正式比赛前15分钟到赛场候考室报到,
报到时应持本人学生证、身份证,并携带(佩戴)大赛组委会签发的参赛证、胸牌。
只有等比赛正式开始后,方可进行操作。
4、比赛期间,参赛选手必须严格遵守赛场纪律,不得在赛场内大声喧哗,不得作弊或弄虚作假;同时,必须严格遵守操作规程,确保设备和人身安全,并接受裁判员的监督和警示。
若因选手因素造成设备故障或损坏,无法进行比赛,裁判长有权终止该队比赛;若因非选手个人因素造成设备故障的,由裁判长视具体情况做出裁决。
5、在竞赛规定时间结束时各参赛选手应立即停止操作,不得以任何理由拖延竞赛时间。
参赛选手欲提前结束比赛,应向现场裁判员举手示意并记录比赛终止时间,比赛终止后,不得再进行任何与比赛有关的操作。
6、竞赛操作结束时,各参赛选手要按照大赛要求提交竞赛材料,按照现场考试要求的名字进行命名,如不符合命名规则,体现单位信息与编号信息的,该队竞赛成绩将被取消。
七、竞赛技术规范
(一)竞赛项目行业、职业技术标准
竞赛项目的命题结合食品微生物检测职业岗位的技能需求,并参照GB 4789.3-2010《食品安全国家标准食品微生物学检验大肠菌群计数》制定。
(二)赛场场地和环境
1、本次竞赛在指定比赛赛场进行,操作比赛地点为黑龙江
职业学院食品药品学院实训室,比赛区环境标准要求照明、控温良好,能提供稳定的水、电。
2、竞赛所需试剂以及部分溶液,由组委会事先准备好,并标示清楚,整齐放置在每位选手的比赛用品中,其余所用试剂、设备等(表2、3),也按照要求,事先放置在比赛区域内,供选手取用。
表2 竞赛项目所用主要设备、仪器、材料
表3 竞赛项目所用主要试剂、培养基清单
九、奖励办法
竞赛只设单项奖,将评出一、二、三等奖和优秀奖,获奖比例分别为参赛人数的10%、20%、30%,其余为优秀奖。
获奖选手和获省内三等以上(含三等)奖项学生的指导教师,由省教育厅颁发相应证书。
十、申诉与仲裁
(一)申诉
1、参赛队对不符合竞赛规定的设备、工具等材料,有失公正的评判、奖励以及对工作人员的违规行为等,均可以提出申诉。
2、申诉应在比赛结束后1小时内提出,超过时效将不予受理。
申诉时,应按照规定的程序由参赛队领队向大赛组委会递交书面申诉报告。
报告中应对申诉事件的现象、发生的时间、涉及到的人员、申诉依据与理由等进行充分的、实事求是的叙述。
事实依据不充分、仅凭主观臆断的申诉不予受理。
申诉报告须有申诉的参赛选手、指导教师和领队的签名。
3、大赛组委会在收到申诉报告后,应在3小时内做出是否
受理申诉的答复并受理申诉。
4、参赛队不得采取过激行为攻击工作人员,否则不予受理申诉;在约定时间内,如约定的联系人未到场或中途离开,视为放弃申诉。
(二)仲裁
1、大赛组委会负责受理比赛中出现的申诉并进行仲裁,以保证比赛的顺利进行和比赛结果的公平、公正。
2、大赛组委会根据收集并经核对的证据、证词,按照合法的程序组织召开听证会进行听证和仲裁。
3、参赛队不得因提起申诉或对申诉处理意见不服而停止比赛或滋事,否则按弃权处理。
比赛不因申诉事件而组织重赛。
十一、其他
本比赛办法与规则的最终解释权归大赛组委会。
