其它氢原子光谱谱线共29页
合集下载
氢原子光谱

主条目:韩福瑞系
主量子数n大于或等于7的电子跃迁到n = 6的能阶,产生的一系列光谱线称为“韩福瑞系列”,由韩福瑞于 1953年发现,位于红外光波段。
里德伯公式
主条目:里德伯公式
1889年瑞典物理学家约翰内斯·里德伯(Johannes Robert Rydberg)将上述各系列谱线归纳出氢原子谱线 的经验公式:
主条目:布拉开线系
主量子数n大于或等于5的电子跃迁到n = 4的能阶,产生的一系列光谱线称为“布拉格系列”,由布拉格于 :蒲芬德系
主量子数n大于或等于6的电子跃迁到n = 5的能阶,产生的一系列光谱线称为“蒲芬德系列”,由蒲芬德于 1924年发现,位于红外光波段。
1885年,巴耳末(er,瑞士,1825-1898)将位于可见光波段,能量位于410.12奈米、434.01奈米、 486.07奈米、656.21奈米等谱线,以下列经验公式表示:,m = 3、4、5、6...,此方程称为巴耳末公式方程。
主条目:帕申系
主量子数n大于或等于4的电子跃迁到n = 3的能阶,产生的一系列光谱线称为“帕申系列”,由帕申于1908 年发现,位于红外光波段。
谢谢观看
六个线系
0 1
来曼系列
0 2
巴耳末系列
0 3
帕申系列
0 4
布拉格系列
0 6
韩福瑞系
0 5
蒲芬德系列
主条目:来曼系
主量子数n大于或等于2的电子跃迁到n = 1的能阶,产生的一系列光谱线称为“来曼系列”。此系列谱线能 量位于紫外光波段。
主条目:巴耳末系
主量子数n大于或等于3的电子跃迁到n = 2的能阶,产生的一系列光谱线称为“巴耳末系”。巴耳末系有四 条谱线处于可见光波段,所以是最早被发现的线系。
氢原子光谱

1885年巴耳末(Balmer,J.J.182 1885年巴耳末(Balmer,J.J.182 年巴耳末(Balmer,J.J. 1898) 5—1898)根据埃格斯充(Augstrom, 1898 根据埃格斯充(Augstrom, A.J.1814 1874)对光谱线的精确测量,提 A.J.1814—1874)对光谱线的精确测量, 1814 1874 出了氢原子光谱可见光区域光谱线波长的经验公式。 出了氢原子光谱可见光区域光谱线波长的经验公式。19 13年 玻尔(Bohr,N.H.D.1885 19 13年,玻尔(Bohr,N.H.D.1885—19 (Bohr,N.H.D.1885 62)引入量子概念提出的氢原子模型假说, 62)引入量子概念提出的氢原子模型假说,给出了氢光 谱线系规律的理论解释。 谱线系规律的理论解释。
五.数据记录与处理
1.高压汞灯 入射线= 入射线
φ0 右 + φ
2
0左
2、氢灯
特征 谱线
谱线位置
波数Leabharlann 红青蓝若此时仍保持入射角i不变, 若此时仍保持入射角 不变,用未知波长的光线入 不变 射,测出相应的偏向角θ′,便可从定标曲线上找 测出相应的偏向角 , 出它所对应的波长来。 出它所对应的波长来。本实验用汞原子光谱作出 定标曲线,再测出氢原子三条可观察到的光谱线 定标曲线, 的偏向角,在定标曲线上求出它们所对应的波长, 的偏向角,在定标曲线上求出它们所对应的波长, 验算里德伯常数。 验算里德伯常数。
氢原子光谱
引言
每种原子、分子都有其特征光谱。 每种原子、分子都有其特征光谱。因此分析其特征 光谱,对研究不同原子、分子及其结构有着重大的意义。 光谱,对研究不同原子、分子及其结构有着重大的意义。 光谱学已成为光学的一个重要分支, 光谱学已成为光学的一个重要分支,并被广泛用于科研 和生产中。 和生产中。 氢原子是最简单的原子,其光谱线在按波长( 氢原子是最简单的原子,其光谱线在按波长(或波 数)大小的排列次序上显示出简单的规律性。研究原子 大小的排列次序上显示出简单的规律性。 结构,很自然氢原子首先被关注。 结构,很自然氢原子首先被关注。
物理选修-人教版氢原子光谱-ppt精品课件

实践证明,原子不同,发射的明线光谱也不同,每种原 子只能发出具有本身特征的某些波长的光,因此明线光谱的 谱线也叫原子的特征谱线。
物理选修3-5人教版 18.3氢原子光谱 (共14张PPT)
物理选修3-5人教版 18.3氢原子光谱 (共14张PPT)
2. 吸收光谱
高温物体发出的白光(其中包含连续分布的一切波长的 光)通过物质时,某些波长的光被物质吸收后产生的光谱, 叫做吸收光谱。
物理选修3-5人教版 18.3氢原子光谱 (共14张PPT)
物理选修3-5人教版 18.3氢原子光谱 (共14张PPT)
3. 根据巴耳末公式,指出氢原子光谱在可见光范围内波 长最长的两条谱线所对应的 n,这两条谱线的波长各是多 少?氢原子光谱有什么特点?
氢原子在可见光范围内的谱线为不连续的明线
物理选修3-5人教版 18.3氢原子光谱 (共14张PPT)
各种原子的吸收光谱中的每一条暗线都跟该种原子的 原子的发射光谱中的一条明线相对应。这表明,低温气体 原子吸收的光,恰好就是这种原子在高温时发出的光。因 此吸收光谱中的暗谱线,也是原子的特征谱线。太阳的光 谱是吸收光谱。
物理选修3-5人教版 18.3氢原子光谱 (共14张PPT)
物理选修3-5人教版 18.3氢原子光谱 (共14张PPT) 物理选修3-5人教版 18.3氢原子光谱 (共14张PPT)
BC
物理选修3-5人教版 18.3氢原子光谱 (共14张PPT)
物理选修3-5人教版 18.3氢原子光谱 (共14张PPT)
2 . 下列说法正确的是 ( BD )
A. 通过光栅或棱镜可以把光按波长展开,从而获得光的波 长成分的记录,这就是光谱。即光谱与光强度无关 B. 通过光栅或棱镜可以把光按波长展开,从而获得光的波 长成分和强度分布记录,这就是光谱。即光谱不仅记录了光 的波长分布,还记录了强度分布 C. 在研究太阳光谱时发现太阳光谱中有许多暗线,这说明 了太阳内部缺少对应的元素 D. 在研究太阳光谱时发现太阳光谱中有许多暗线,这些暗 线与某些元素的特征谱线相对应,这说明了太阳大气层内存 在对应的元素
物理选修3-5人教版 18.3氢原子光谱 (共14张PPT)
物理选修3-5人教版 18.3氢原子光谱 (共14张PPT)
2. 吸收光谱
高温物体发出的白光(其中包含连续分布的一切波长的 光)通过物质时,某些波长的光被物质吸收后产生的光谱, 叫做吸收光谱。
物理选修3-5人教版 18.3氢原子光谱 (共14张PPT)
物理选修3-5人教版 18.3氢原子光谱 (共14张PPT)
3. 根据巴耳末公式,指出氢原子光谱在可见光范围内波 长最长的两条谱线所对应的 n,这两条谱线的波长各是多 少?氢原子光谱有什么特点?
氢原子在可见光范围内的谱线为不连续的明线
物理选修3-5人教版 18.3氢原子光谱 (共14张PPT)
各种原子的吸收光谱中的每一条暗线都跟该种原子的 原子的发射光谱中的一条明线相对应。这表明,低温气体 原子吸收的光,恰好就是这种原子在高温时发出的光。因 此吸收光谱中的暗谱线,也是原子的特征谱线。太阳的光 谱是吸收光谱。
物理选修3-5人教版 18.3氢原子光谱 (共14张PPT)
物理选修3-5人教版 18.3氢原子光谱 (共14张PPT) 物理选修3-5人教版 18.3氢原子光谱 (共14张PPT)
BC
物理选修3-5人教版 18.3氢原子光谱 (共14张PPT)
物理选修3-5人教版 18.3氢原子光谱 (共14张PPT)
2 . 下列说法正确的是 ( BD )
A. 通过光栅或棱镜可以把光按波长展开,从而获得光的波 长成分的记录,这就是光谱。即光谱与光强度无关 B. 通过光栅或棱镜可以把光按波长展开,从而获得光的波 长成分和强度分布记录,这就是光谱。即光谱不仅记录了光 的波长分布,还记录了强度分布 C. 在研究太阳光谱时发现太阳光谱中有许多暗线,这说明 了太阳内部缺少对应的元素 D. 在研究太阳光谱时发现太阳光谱中有许多暗线,这些暗 线与某些元素的特征谱线相对应,这说明了太阳大气层内存 在对应的元素
氢原子光谱中的不同谱线

2
• 光子的质量:
光子的静止质量: m0 0
h m 2 2 c c
• 光子的动量:
h h p c c
光电效应证实了光的粒子性。
1927诺贝尔物理学奖
• A.H.康普顿 • 发现了X射线通过 物质散射时,波长 发生变化的现象
第 3节
康普顿效应
一、康普顿效应的实验规律
3、氢原子的能量
1 13.6 En 2 eV 2 2 2 2 n 32 0 n
me4
(n 1,2,3,)
n 1 的定态叫基态, n 1 的定态叫激发态。
讨 论:
1)基态能 2)电离能
E1 13.6eV E E1 13.6eV
me
4
3)氢原子能级跃迁所辐射的光子频率
m 4, n 5,6,7 为布喇开系, (4) 各谱线位于远红外波段。
m 5, n 6,7,8 为普芳德系, ( 5) 各谱线位于远红外波段。
2 、里兹组合原则
其他元素的光谱也可用两光谱项之差表示其波数,即:
~ T (m) T (n)
前项参数的 m 值对应着谱线系。后项参数n 的值对应着各谱线系中的光谱系。
1 1 ( 2 2) 2 3 3 n 64 0 m
相应的波数 :
~
1 1 ( 2 2) 2 3 3 c 64 0 c m n
1
me 4
氢原子能级及能级跃迁所产生的光谱线,如下图 。
E n ( eV ) 0
氢原子光谱中的不同谱线
连续区 40.50
第2节 光电效应和爱因斯坦的光量子论
爱因斯坦的光子理论(光子假设): 光是以光速运动的光量子流(简称光子流), 在频率为v 的光波中,每个光子的能量 :
• 光子的质量:
光子的静止质量: m0 0
h m 2 2 c c
• 光子的动量:
h h p c c
光电效应证实了光的粒子性。
1927诺贝尔物理学奖
• A.H.康普顿 • 发现了X射线通过 物质散射时,波长 发生变化的现象
第 3节
康普顿效应
一、康普顿效应的实验规律
3、氢原子的能量
1 13.6 En 2 eV 2 2 2 2 n 32 0 n
me4
(n 1,2,3,)
n 1 的定态叫基态, n 1 的定态叫激发态。
讨 论:
1)基态能 2)电离能
E1 13.6eV E E1 13.6eV
me
4
3)氢原子能级跃迁所辐射的光子频率
m 4, n 5,6,7 为布喇开系, (4) 各谱线位于远红外波段。
m 5, n 6,7,8 为普芳德系, ( 5) 各谱线位于远红外波段。
2 、里兹组合原则
其他元素的光谱也可用两光谱项之差表示其波数,即:
~ T (m) T (n)
前项参数的 m 值对应着谱线系。后项参数n 的值对应着各谱线系中的光谱系。
1 1 ( 2 2) 2 3 3 n 64 0 m
相应的波数 :
~
1 1 ( 2 2) 2 3 3 c 64 0 c m n
1
me 4
氢原子能级及能级跃迁所产生的光谱线,如下图 。
E n ( eV ) 0
氢原子光谱中的不同谱线
连续区 40.50
第2节 光电效应和爱因斯坦的光量子论
爱因斯坦的光子理论(光子假设): 光是以光速运动的光量子流(简称光子流), 在频率为v 的光波中,每个光子的能量 :
氢原子光谱ppt课件

03
氢原子光谱实验观测与分析
氢原子光谱实验装置介绍
光源
氢原子灯或放电管,产生氢原子 光谱。
单色仪
将复合光分解为单色光,并可选 择特定波长的光通过。
光探测器
如光电倍增管或CCD,将光信号 转换为电信号进行记录和分析。
数据采集与处理系统
对实验数据进行采集、处理和分 析,得出实验结果。
氢原子光谱观测方法
氢原子光谱研究挑战与机遇
实验技术挑战
01
尽管精密测量技术取得了显著进展,但进一步提高测量精度仍
面临诸多挑战,如如何消除系统误差、提高信噪比等。
理论模型挑战
02
现有理论模型在描述某些复杂现象时仍存在一定局限性,需要
进一步完善和发展。
交叉学科机遇
03
氢原子光谱研究与粒子物理、宇宙学等领域密切相关,这些领
04
氢原子光谱理论解释与应用
薛定谔方程与波函数概念
薛定谔方程
描述了微观粒子状态随时间变化 的规律,是量子力学的基本方程
之一。
波函数
量子力学中用来描述粒子状态的函 数,其模平方表示粒子在特定位置 被发现的概率。
量子数
描述原子或分子中电子运动状态的 参数,如主量子数、角量子数等。
氢原子光谱理论解释
玻尔模型
玻尔提出的氢原子模型,假设电子在 特定轨道上运动,且能量是量子化的。
能量级与光谱线
选择定则
解释了为何只有特定能级间的跃迁才 会产生光谱线,如偶极跃迁选择定则 等。
氢原子光谱由一系列分立的谱线组成, 对应着电子在不同能级间的跃迁。
氢原子光谱在物理、化学等领域应用
01
02
03
04
原子钟
利用氢原子光谱的稳定性和精 确性,制成高精度原子钟,用
原子物理学第二章氢原子光谱

n2
激发态(excited state) 电子轨道
巴耳末系 帕邢系
n 3
பைடு நூலகம்
赖曼系
2
能级(energy level)
1
n
1
2
3
4
En R Tn 2 n hc
hcR En 2 n
根据波尔理论,氢原子的光谱可以作如下的解释: 氢原子在正常状态时,它的能级最小,电子 位于最小的轨道,当原子吸收或放出一定的 能量时,电子就会在不同的能级间跃迁,多 余的能量便以光子的形式向外辐射,从而形 成氢原子光谱。
e Ze
Ze2 F 4π 0 r 2
e2 Ze2
2
n2 Z c rn a1 vn n 1, 2, 3, Z n Z 2 hcR 1 Z 2e2 En 2 2n 4π 0 a1 n2
En2 En1 hc
1 1 1 1 Z R 2 2 R 2 2 n1 Z n2 Z n1 n2
2 2 e 4 RA 2 3 (4 0 ) h c
2 2 me 4 M M R 2 3 (4 0 ) h c M m M m
(3)
我们看到,当原子核质量M→∞时, RA=R∞=109737.31cm-1。在一般情况下,可以 通过(3)式来计算里德伯常数。
里德伯常数随原子核质量变化的情况曾被 用来证实氢的同位素—氘的存在。还可以测 定原子量、电子的核质比、质子的质量和电 子的质量之比等。 起初有人从原子质量的测定问题估计有质量 是2个单位的中氢。 1932年,尤雷在实验中发现,所摄液氢赖 曼系的头四条谱线都是双线,双线之间波长 差的测量值与通过里德伯常数 R 计算出的双 线波长差非常相近,从而确定了氘的存在。
激发态(excited state) 电子轨道
巴耳末系 帕邢系
n 3
பைடு நூலகம்
赖曼系
2
能级(energy level)
1
n
1
2
3
4
En R Tn 2 n hc
hcR En 2 n
根据波尔理论,氢原子的光谱可以作如下的解释: 氢原子在正常状态时,它的能级最小,电子 位于最小的轨道,当原子吸收或放出一定的 能量时,电子就会在不同的能级间跃迁,多 余的能量便以光子的形式向外辐射,从而形 成氢原子光谱。
e Ze
Ze2 F 4π 0 r 2
e2 Ze2
2
n2 Z c rn a1 vn n 1, 2, 3, Z n Z 2 hcR 1 Z 2e2 En 2 2n 4π 0 a1 n2
En2 En1 hc
1 1 1 1 Z R 2 2 R 2 2 n1 Z n2 Z n1 n2
2 2 e 4 RA 2 3 (4 0 ) h c
2 2 me 4 M M R 2 3 (4 0 ) h c M m M m
(3)
我们看到,当原子核质量M→∞时, RA=R∞=109737.31cm-1。在一般情况下,可以 通过(3)式来计算里德伯常数。
里德伯常数随原子核质量变化的情况曾被 用来证实氢的同位素—氘的存在。还可以测 定原子量、电子的核质比、质子的质量和电 子的质量之比等。 起初有人从原子质量的测定问题估计有质量 是2个单位的中氢。 1932年,尤雷在实验中发现,所摄液氢赖 曼系的头四条谱线都是双线,双线之间波长 差的测量值与通过里德伯常数 R 计算出的双 线波长差非常相近,从而确定了氘的存在。
碱金属原子的光谱

第一辅线系:~
(3
R
p )2
(n
R
d
)2
~ 3 p nd
第二辅线系:~
(
3
R
p
)2
(
n
R
s
)2
~ 3 p ns
柏格曼系:
~ R R ( 3 d )2 ( n f )2
~ 3d nf
第16页,共27页。
总结
➢ 谱线特征:1)四套线系(四套动项); 2)三个终端(三套固定项); 3)两个量子数(n,l)确定能级 。
d,l 2 n*
2.999 3.999 5.000
f ,l 3
T
n*
6855. 5 4381. 2
4.000 5.004
67
3499. 6 2535. 3
5.599 6.579
3094. 4 2268. 9
5.955 6.954
3046. 9 2239. 4
6.001 7.000
3031. 0
氢
可以看出,对能级产生影响的除了R值,还有有效电荷 ,通过前 面的学习我们了解到R值是与核的质量联系着的,而原子实极化和轨道贯 穿导致了碱金属和氢原子之间有效电荷的差别。当有效电荷 代替Z时, 我们得到
光谱项为:T
Z2R n2
(
R n Z
)2
R n2
第25页,共27页。
原子实极化
价电子吸引原子实中的正电部分, 排斥负电部分 原子实正、负电荷 的中心不再重合 原子实极化 能量降低
(3)第二辅线系(锐线系the sharp series): 第一条在红外,其余均在可见区,其谱线较宽,边缘清 晰,故又称锐线系。锐线系和漫线系的系限相同,所以 均称为辅线系。
氢原子光谱 课件

㈣光谱分析及其应用:
由于每种原子都有自己的特征谱线,因此可以根 据光谱来鉴别物质和确定它的化学组成。这种方 法叫做光谱分析。做光谱分析时,可以利用明线 光谱,也可以利用吸收光谱。
这种方法的优点是非常灵敏而且迅速。某种元素在物质中的含量达10-10克, 就可以从光谱中发现它的特征谱线,因而能够把它检查出来。光谱分析在科 学技术中有广泛的应用。例如,在检查半导体材料硅和锗是不是达到了高纯 度的要求时,就要用到光谱分析。在历史上,光谱分析还帮助人们发现了许 多新元素。例如,铷和铯就是从光谱中看到了以前所不知道的特征谱线而被 发现的。光谱分析对于研究天体的化学组成也很有用。十九世纪初,在研究 太阳光谱时,发现它的连续光谱中有许多暗线。最初不知道这些暗线是怎样 形成的,后来人们了解了吸收光谱的成因,才知道这是太阳内部发出的强光 经过温度比较低的太阳大气层时产生的吸收光谱。仔细分析这些暗线,把它 跟各种原子的特征谱线对照,人们就知道了太阳大气层中含有氢、氦、氮、 碳、氧、铁、镁、硅、钙、钠等几十种元素。
明线光谱(原子光谱):每一种原 Nhomakorabea都有自己特定的原子光谱,不同原子,其 明线光谱(原子光谱)均不同
2.吸收光谱:高温物体发出的白光(其中 包含连续分布的一切波长的光)通过物质 时,某些波长的光被物质吸收后产生的光 谱,叫做吸收光谱。 ⑴各种原子的吸收光谱中的每一条暗线跟 该种原子的发射光谱中的一条明线都恰好 相对应,即频率相同.这表明,低温气体 原子吸收的光,恰好就是这种原子在高温 时发出的光. ⑵吸收光谱也是原子的特征谱线。
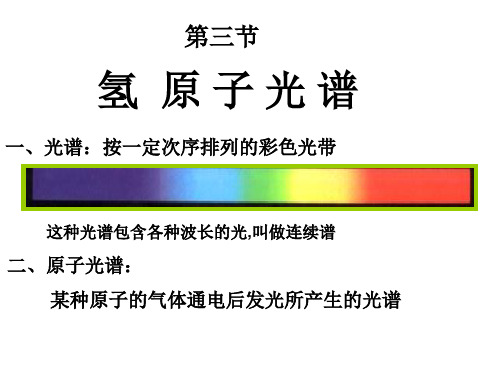
氢原子光谱
㈠光谱:将单色光(有时包括不可见光)按 波长或频率的大小依次排列起来形成的图 案,全称为光学频谱。简称光谱。
㈡得到光谱的方法: 1.摄谱仪
第三节氢原子光谱
R(
1 22
1 n2
)
n=3,4,5,6……
其中R称为里德伯常量
R 1.097 10 m 对于氢原子
7
-1
注意表达的顺序,因为不同
的原子,该常数也不同.
氢原子光谱的实验规律
H
H H H
H
656.3n m 486.1n m 434.1nm 410.2nm 364.6nm
n=3
n=4
不同的m对应不同的谱系;当m一定时,每 T (n)
式中
T
(m)
R m2
,
T
(n)
R n2
称为光谱项
6、原子光谱
氢原子光谱只是众多原子光谱中最简单的一种,下图列出 了钠、氦和汞等原子的光谱。
科学家观察了大量的 原子光谱,发现每种原子都有 自己特定的原子光谱。不同的原子,其原子光谱均不相同, 因而,原子光谱被称为原子的“指纹”。我们可以通过对 光谱的分析鉴别不同的原子,确定物体的化学组成并发现 新元素。
1 R( 42
1 n2
)
n=5,6,7,8……
普丰德系(红外区)1 R( 1 1 ) n=6,7,8,9……
52
n2
简称为莱巴帕布普. 请标出课本图3-3-4中帕邢系的4.5.6.7;强调n越小,波长越大
3、广义巴尔末公式
1
1 R( m2
1 n2 )
式中 m与n都是正整数,且 n > m.
莱区 用曼发一系现个(了简紫氢单原的外子公区的式)其表他示1线。系,R这(些11线2 系也n和12巴)耳n末=系2,一3样,可4,以5,…
氢原子光谱

3.4eV 13.6eV
n=2
赖曼系
n =1
赖曼系中波长最短的谱线光子能量是多少? 例:赖曼系中波长最短的谱线光子能量是多少?
答: 13.6eV
巴耳末系中波长最短的谱线光子能量是多少? 例:巴耳末系中波长最短的谱线光子能量是多少?
答: 3.4eV 例:写出氢原子光谱各谱线系的极限波数表达式 ~ = 1 = R( 1 1 ) n →∞ ν (∞) = R ~ 解: ν λ k 2 n2 k2
e2
e2
n = 1,2,3,
= 13.6eV
n =1
n=2
E1 =
e2 8πε0r1
E2 = E1 / 22 = 3.4eV
E3 = E1 / 32 = 1.51eV, En = E1 / n2
n =3
E1 < E2 < E3 <
的定态:基态, 的定态, n =1的定态:基态, n > 1的定态,激发态
( L = r × P = r ×mV
L = rPsin θ = rmV si 2 n22 mr
4πε02 2 r= n 2 me
n =1,2,3,
n =1
4πε02 r= = 0.529 Α 1 2 me
n=2
r2 = r1 2
2
n =3
r3 = r 32 1
1
n2 λ=B 2 n 4
4 4 1 1 1 n2 4 1 1 1 ~= = = (1 2 ) = ( 2 2 ) = R( 2 2 ) ν 2 B 2 n B n λ B n 2 n
n = 3,4,5,
————里德伯公式 里德伯公式
4 R = = 1.096776 ×107 m1 :里德伯恒量 B
相关主题
