氧化还原反应-复习PPT课件
合集下载
氧化还原反应ppt课件

根据下列反应判断有关物质还原性强弱的顺序 A
H2SO3 + I2 + H2O === 2HI + H2SO4
2FeCl3 + 2HI === 2FeCl2 + 2HCl + I2 A.H2SO3 > I- > Fe2+ B.I- > Fe2+ > H2SO3 C.Fe2+ > I- > H2SO3 D.Fe2+ > H2SO3 >I-
电子的得失、共用电子对的偏移
氧化反应 还原反应 二者关系
元素化合价
电子的转移
升高
失电子(偏离)
降低
得电子(偏向)
二者是同时进行的
1.下列变化过程中,元素失去电子的是( D )
A.MnO2 → Mn2+
B.CuO → CuCl2
C.Ag+ → Ag2O
D.Sn2+ → Sn4+
2.下列说法正确的是( D ) A.有得、失氧的反应才是氧化还原反应 B.氧化还原反应中,氧化反应与还原反应是先后进行的 C.有电子得失的反应才是氧化还原反应 D.凡是有化合价升降的反应,都是氧化还原反应
高温
C + H2O ===== H2 + CO
CuO + H2 ==== Cu + H2O
物质 CuO
C H2O
C CuO H2
氧化(还原)反应 还原 氧化 还原 氧化 还原 氧化
化合价变化 降低 升高 降低 升高 降低 升高
化合价升高 —— 氧化反应
化合价降低 —— 还原反应
化合价升高,发生氧化反应
Zn + 2HCl ==== ZnCl2 + H2↑
化合价
得失电子
氧化还原反应复习-完整版课件

若有3molHCl被氧化,则有多少摩尔氧化 剂参加反应?
练原1全习.反后:现应得已有,到知45反9C0.7l应02gm在C完Ll7溶2全0,℃液后将的.测其N得通aO溶入H液水到中溶足N液量a中C7l0O,℃与能的N同NaCa时lOO发H3的水生物溶两质液个的中自量,身之反氧比应化为完还4: ((12))写计出算C完l2全在反70应℃后的生Na成OH物水N溶aC液lO中3的符物合质上的述量条浓件度的.总反应方程式。
• (2018.4)27.(6分)某同学用含结晶水的正盐X(四种短 周期元素组成的纯净物)进行了如下实验:
• 实验中观测到:混合气甲呈无色并被蒸馏水全部吸收; 固体乙为纯净物;在步骤③中,取溶液丙1/10,恰好中 和需消耗0.00200 mol NaOH;另取一定量的溶液丙,加 入少量K2FeO4固体,产生黄绿色气体。(且将被还原为 +3价) • 请回答: • (2) 溶液丙与K2FeO4固体反应的化学方程式是________。
• A.Cl2→Cl• B.I-→I2 • C.SO2→SO32• D.CuO→Cu
问B题r23+:2KI已=2知KB反r+应I2,:试Cl比2+2较KBKrB=r2、KCKlI+、BKrC2;l的还原性强弱?
若将少量氯水加入KBr、KI的混合溶液中 ,会如何反应? 问题4:实验室也可用反应: KClO3+6HCl=KCl+3Cl2↑+3H2O制取Cl2,用双线 桥表示该反应的电子转移方向与数目?
氯气及氧化还原反应复习
判断:下列有关Cl2的叙述是否正确,错误的请改正。 1、新制氯水可使蓝色石蕊试纸先变红后褪色 ,可知氯气 有漂白性。
2、工业上用Cl2和石灰水为原料制造漂白粉。 3、Cl2可与Fe反应生成FeCl2,故不能用铁罐存放液氯 。 4、工业上常用MnO 2和稀盐酸共热来制取氯气 。 5、漂白粉在空气中易失效,应密封保存。
练原1全习.反后:现应得已有,到知45反9C0.7l应02gm在C完Ll7溶2全0,℃液后将的.测其N得通aO溶入H液水到中溶足N液量a中C7l0O,℃与能的N同NaCa时lOO发H3的水生物溶两质液个的中自量,身之反氧比应化为完还4: ((12))写计出算C完l2全在反70应℃后的生Na成OH物水N溶aC液lO中3的符物合质上的述量条浓件度的.总反应方程式。
• (2018.4)27.(6分)某同学用含结晶水的正盐X(四种短 周期元素组成的纯净物)进行了如下实验:
• 实验中观测到:混合气甲呈无色并被蒸馏水全部吸收; 固体乙为纯净物;在步骤③中,取溶液丙1/10,恰好中 和需消耗0.00200 mol NaOH;另取一定量的溶液丙,加 入少量K2FeO4固体,产生黄绿色气体。(且将被还原为 +3价) • 请回答: • (2) 溶液丙与K2FeO4固体反应的化学方程式是________。
• A.Cl2→Cl• B.I-→I2 • C.SO2→SO32• D.CuO→Cu
问B题r23+:2KI已=2知KB反r+应I2,:试Cl比2+2较KBKrB=r2、KCKlI+、BKrC2;l的还原性强弱?
若将少量氯水加入KBr、KI的混合溶液中 ,会如何反应? 问题4:实验室也可用反应: KClO3+6HCl=KCl+3Cl2↑+3H2O制取Cl2,用双线 桥表示该反应的电子转移方向与数目?
氯气及氧化还原反应复习
判断:下列有关Cl2的叙述是否正确,错误的请改正。 1、新制氯水可使蓝色石蕊试纸先变红后褪色 ,可知氯气 有漂白性。
2、工业上用Cl2和石灰水为原料制造漂白粉。 3、Cl2可与Fe反应生成FeCl2,故不能用铁罐存放液氯 。 4、工业上常用MnO 2和稀盐酸共热来制取氯气 。 5、漂白粉在空气中易失效,应密封保存。
《氧化还原反应》PPT课件

氧化性: MnO4-> MnO2 > Cl2 > Br2 > Fe3+ > I2
第4讲 氧化还原反应方程式的 配平
氧化性、还原性强弱比较规律:
(一)根据方程式判断氧化还原性强弱
对于任何氧化还原反应,都满足下列规律:
失电子、化合价升高、被氧化,发生氧化反应
氧化剂 + 还原剂 = 氧化剂的还原产物 + 还原剂的氧化产物
A
B
b
a
得电子、化合价降低、被还原,发生还原反应
氧化性:A >a(氧化产物) 还原性:B > b(还原产物)
(1)物质的浓度越高,氧化性或还原性越强。
浓HNO3的氧化性强于稀HNO3;H2SO4(浓) > (2H)温2S度O越4(高稀),氧化性或还原性越强。
C、CO、H2常温下不显还原性;
(3)酸性越强,氧化性越强;碱性越强,还原性越强。
再如KMnO4氧化性:酸性 > 中性 > 碱性
例题: 1.判断下列反应能否发生?若能发生写出离子反 应方程式,并比较氧化性强弱。
⑴所有的置换反应都是 氧化还原反应
⑵所有的复分解反应都 是非氧化还原反应
⑶有单质参加的化合反 应一定是氧化还原反应
分解反应 化合反应
氧化还原反应 置换反应
复分解反应
⑷有单质生成的分解反 应一定是氧化还原反应
【例2】在 CaH2+2H2O=Ca(OH)2+2H2↑
的反应中,下列叙述正确的是
(1)H2是氧化产物
生成 原 产
原 具有 性
原应
物
性质 反应物 特征 实质 过程 反应 产物 性质
(同时存在)
(总数相等)(同时进行同时消失)(同时生成)
第4讲 氧化还原反应方程式的 配平
氧化性、还原性强弱比较规律:
(一)根据方程式判断氧化还原性强弱
对于任何氧化还原反应,都满足下列规律:
失电子、化合价升高、被氧化,发生氧化反应
氧化剂 + 还原剂 = 氧化剂的还原产物 + 还原剂的氧化产物
A
B
b
a
得电子、化合价降低、被还原,发生还原反应
氧化性:A >a(氧化产物) 还原性:B > b(还原产物)
(1)物质的浓度越高,氧化性或还原性越强。
浓HNO3的氧化性强于稀HNO3;H2SO4(浓) > (2H)温2S度O越4(高稀),氧化性或还原性越强。
C、CO、H2常温下不显还原性;
(3)酸性越强,氧化性越强;碱性越强,还原性越强。
再如KMnO4氧化性:酸性 > 中性 > 碱性
例题: 1.判断下列反应能否发生?若能发生写出离子反 应方程式,并比较氧化性强弱。
⑴所有的置换反应都是 氧化还原反应
⑵所有的复分解反应都 是非氧化还原反应
⑶有单质参加的化合反 应一定是氧化还原反应
分解反应 化合反应
氧化还原反应 置换反应
复分解反应
⑷有单质生成的分解反 应一定是氧化还原反应
【例2】在 CaH2+2H2O=Ca(OH)2+2H2↑
的反应中,下列叙述正确的是
(1)H2是氧化产物
生成 原 产
原 具有 性
原应
物
性质 反应物 特征 实质 过程 反应 产物 性质
(同时存在)
(总数相等)(同时进行同时消失)(同时生成)
氧化还原反应ppt课件

请找出下列反应的氧化剂、氧化产物、还原剂、还原产物
Fe2O3 + 3CO
高温
=
2Fe + 3CO2
2KMnO4 Δ= K2MnO4+MnO2+O2 ↑
SO2 + 2H2S = 3S↓+2H2O
1.3 氧化还原反应
第二课时
4、氧化还原反应的本质
点燃
2Na + Cl2 = 2NaCl 化合价发生改变的原因:电子得失
部分非金属单质
含有高价态元素的
氧
化合物
化 某些金属活动性较
剂 弱的元素对应的高
价态离子
过氧化物
O2、Cl2等 浓硫酸、HNO3、KMnO4、MnO2、
KClO3、K2Cr2O7等
Fe3+、Ag+、Pb4+、Cu2+等
Na2O2、H2O2等
4、氧化性 还原性
还原剂具有还原性(降低其他物质元素的化合价)
化合价升高,失电子,被氧化
化合价降低,得电子,被还原
氧化剂:所含元素的化合价降低, 即得到电子(或电子对偏向)的反应物。
还原剂:所含元素的化合价升高, 即ห้องสมุดไป่ตู้去电子(或电子对偏离)的反应物。
记忆口诀
升失氧,降得还,要说剂,恰相反 还原剂: 化合价升高,失去电子,发生氧化反应,被氧化,生成氧化产物 氧化剂: 化合价降低,得到电子,发生还原反应,被还原,生成还原产物
2.单线桥法(不同元素,失电子物质指向得电子物质)
2×3e-
0 +3
0 +3
①必须箭头(失电子物质元素)指向箭尾(得电子物质对应元素) ②单线桥上不须注明“得到”或“失去”,仅注明电子转移数目
B (大本 P27 第 4 题)下列反应中,电子转移的方向和数目正确的是( )
氧化还原反应ppt课件

化合价降低,得电子,被还原
化合价升高,失电子,被氧化
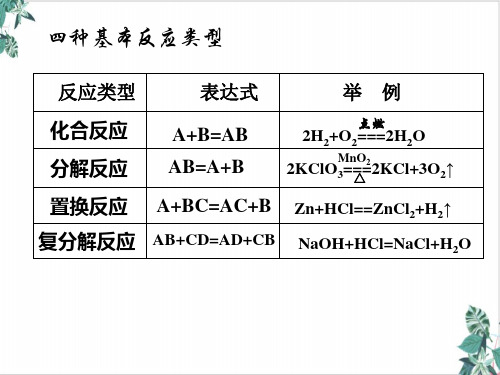
三、四个基本反应类型与氧化还原反应的关系
1、化合反应:
A + B = AB
2、分解反应:
3、置换反应:
4、复分解反应:
AB = A + B
A + BC = B + AC
思考:有单质参加或生成的反应一定是置换反应吗?
AB + CD = AD + CB
C
B D
自我检测
5、下列哪个反应表示二氧化硫被还原( )A、SO2+2H2O+Cl2 = H2SO4+2HCl B、SO2+2H2S = 2H2O+3S↓C、SO2+2NaOH = Na2SO3+H2O D、SO2+Na2CO3 = Na2SO3+CO2↑
B
自我检测
氧化还原反应 第一课时
一、从不同角度认识氧化还原反应
1、从得氧失氧的角度认识氧化还原反应
得到氧原子,发生氧化反应
失去氧原子,发生还原反应
H2 + CuO = Cu + H2O
化合价升高
化合价降低
氧化反应
还原反应
0 +1
失去电子
发生氧化反应
元素化合价降低
得到电子
发生还原反应
口诀:
升、失、氧
降、得、还
二、关于氧化还原反应的几个重要概念
1、氧化剂:
2、还原剂:
反应物中元素化合价降低的物质
(被还原的物质)
(主要从升失氧、降得还入手分析)
氧化性:
(氧化剂具有氧化性)
物质得到电子的性质
√
化合价升高,失电子,被氧化
三、四个基本反应类型与氧化还原反应的关系
1、化合反应:
A + B = AB
2、分解反应:
3、置换反应:
4、复分解反应:
AB = A + B
A + BC = B + AC
思考:有单质参加或生成的反应一定是置换反应吗?
AB + CD = AD + CB
C
B D
自我检测
5、下列哪个反应表示二氧化硫被还原( )A、SO2+2H2O+Cl2 = H2SO4+2HCl B、SO2+2H2S = 2H2O+3S↓C、SO2+2NaOH = Na2SO3+H2O D、SO2+Na2CO3 = Na2SO3+CO2↑
B
自我检测
氧化还原反应 第一课时
一、从不同角度认识氧化还原反应
1、从得氧失氧的角度认识氧化还原反应
得到氧原子,发生氧化反应
失去氧原子,发生还原反应
H2 + CuO = Cu + H2O
化合价升高
化合价降低
氧化反应
还原反应
0 +1
失去电子
发生氧化反应
元素化合价降低
得到电子
发生还原反应
口诀:
升、失、氧
降、得、还
二、关于氧化还原反应的几个重要概念
1、氧化剂:
2、还原剂:
反应物中元素化合价降低的物质
(被还原的物质)
(主要从升失氧、降得还入手分析)
氧化性:
(氧化剂具有氧化性)
物质得到电子的性质
√
人教版化学必修一氧化还原反应ppt33张课件
单质还原性逐渐减弱:K>Ca>Na>Mg>Al>Zn>Fe…
2.元素处于最低价态时,只能做还原剂:Cl-、S2-、I- 元素处于最高价态时,只能做氧化剂:KMnO4、 FeCl3、H2SO4、HNO3
阳离子氧化性逐渐增强: K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe 2+…
3.归中规律 同种元素不同价态间发生氧坏反应时,高价+ 低价 中间价态,即“只靠拢,不交叉。”
例:在KClO3+6HCl(浓)===KCl+3Cl2+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为 。
3、这是从电子得失的角度看(也是氧化还原反应的实质):
因此,有电子转移(得失或电子对偏移)的反应都是氧化还原反应。
Fe + 2HCl = FeCl2 + H2 ↑
2e-
CH4 + 2O2 = CO2 + 2H2O
8e-
-4 0 +4 -2
0 +1 +2 0
有单质参加的
有单质生成的
三、氧还反应中电子转移的表示方法
1.双线桥法:
(1)标出反应中化合价发生变化的元素的化合价,判断其升降。
(2)画线条,箭头由反应物指向生成物中同种元素。
(3)在桥上标明电子“得”“失”电子,同时用a×b e-形式表示得、失电子数。 a—得、失电子的原子总数 b—每个原子得失电子数(a,b为1时可省略)
如: 2Fe+3Cl2 =2FeCl3 Fe+S= FeS 则氧化性:Cl2 > S
氧化还原反应ppt课件

化合价降低,被还原,发生还原反应
+2
0 高温 0
+4
2CuO + C = 2Cu + CO2
有氧参与的反应
化合价升高,被氧化,发生氧化反应
一、氧化还原反应
凡有元素化合价升降的化学反应都是氧化还原反应。
化合价降低,被还原,发生还原反应
+1
0
0
+2
无氧参与的反应
化合价升高,被氧化,发生氧化反应
(2019·抚顺高一期末)下列化学反应中,不属于氧化还原反应的是
解析 A项,氧化性:Z2>W2,不符合题给信息,反应不能发生; B项,氧化性:Z2>X2,符合题给信息,反应能发生; C项,氧化性:Y2>W2,不符合题给信息,反应不能发生; D项,氧化性:X2>Z2,不符合题给信息,反应不能发生。
二、氧化性、还原性强弱比较
(3)根据反应的难易(反应条件)比较下列物质的氧化性强弱
√A.CaCO3+2HCl===CaCl2+CO2↑+H2O
B.Fe+CuSO4===Cu+FeSO4 高温
C.Fe2O3+3CO===== 2Fe+3CO2 D.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
判断正误
(1)氧化还原反应中一定有氧元素的得失(× ) (2)氧化还原反应中得电子的物质发生还原反应(√ ) (3)氧化还原反应中所有元素的化合价都一定发生变化(× ) (4)一个反应中可以只有元素化合价升高,而无元素化合价降低(× ) (5)有单质参加的反应一定是氧化还原反应(× )
②Fe+S
△ =====
FeS
可判断氧化性:氯气__>__硫。
1.下列微粒:①Al3+ ②Cl- ③N2 ④S2- ⑧MnO-4 。既具有氧化性又具有还原性的是
+2
0 高温 0
+4
2CuO + C = 2Cu + CO2
有氧参与的反应
化合价升高,被氧化,发生氧化反应
一、氧化还原反应
凡有元素化合价升降的化学反应都是氧化还原反应。
化合价降低,被还原,发生还原反应
+1
0
0
+2
无氧参与的反应
化合价升高,被氧化,发生氧化反应
(2019·抚顺高一期末)下列化学反应中,不属于氧化还原反应的是
解析 A项,氧化性:Z2>W2,不符合题给信息,反应不能发生; B项,氧化性:Z2>X2,符合题给信息,反应能发生; C项,氧化性:Y2>W2,不符合题给信息,反应不能发生; D项,氧化性:X2>Z2,不符合题给信息,反应不能发生。
二、氧化性、还原性强弱比较
(3)根据反应的难易(反应条件)比较下列物质的氧化性强弱
√A.CaCO3+2HCl===CaCl2+CO2↑+H2O
B.Fe+CuSO4===Cu+FeSO4 高温
C.Fe2O3+3CO===== 2Fe+3CO2 D.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
判断正误
(1)氧化还原反应中一定有氧元素的得失(× ) (2)氧化还原反应中得电子的物质发生还原反应(√ ) (3)氧化还原反应中所有元素的化合价都一定发生变化(× ) (4)一个反应中可以只有元素化合价升高,而无元素化合价降低(× ) (5)有单质参加的反应一定是氧化还原反应(× )
②Fe+S
△ =====
FeS
可判断氧化性:氯气__>__硫。
1.下列微粒:①Al3+ ②Cl- ③N2 ④S2- ⑧MnO-4 。既具有氧化性又具有还原性的是
氧化还原反应PPT课件

第二章 化学反应及其变化
Part 01
二、氧化剂及还原剂
2、还原剂:失电子的物质。(化合价升高的物质)
1、氧化剂:得电子的物质。(化合 价降低的物质)
氧化剂
还原剂
e-
Zn + 2HCl == ZnCl2 + H2 ↑
分析:下列反应的元素化合价变化。
2Na + Cl2 = 2NaCl
+1
0
0
-1
虽然没有氧的得失,但元素的化合价发生了变化, 是氧化还原反应。
氧化还原反应
(特征)
定义: 凡有元素化合价升降的化学反应都是氧化还原反应。 判断一个反应是否为氧化还原反应的依据是否有元素化合价的改变。
练习:1、分析下列反应中各元素化合价在反应前后有无变化,如何变化。并判断是否是氧化还原反应。
电子转移及氧化还原关系的表示方法---双线桥法
再如:
升失 氧, 降 得还
化合价升高
是因为失去了电子
这种元素被氧化或 发生了氧化反应
规律:
练习: 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。
① Fe2O3 + 3CO 2Fe + 3CO2 ② Zn + 2HCl == ZnCl2 + H2 ↑
练习: 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。
① Fe2O3 + 3CO 2Fe + 3CO2
② Zn + 2HCl == ZnCl2 + H2 ↑
+4
+3
+2
0
化合价升高 失2e- × 3 被氧化
0
+1
+2
Part 01
二、氧化剂及还原剂
2、还原剂:失电子的物质。(化合价升高的物质)
1、氧化剂:得电子的物质。(化合 价降低的物质)
氧化剂
还原剂
e-
Zn + 2HCl == ZnCl2 + H2 ↑
分析:下列反应的元素化合价变化。
2Na + Cl2 = 2NaCl
+1
0
0
-1
虽然没有氧的得失,但元素的化合价发生了变化, 是氧化还原反应。
氧化还原反应
(特征)
定义: 凡有元素化合价升降的化学反应都是氧化还原反应。 判断一个反应是否为氧化还原反应的依据是否有元素化合价的改变。
练习:1、分析下列反应中各元素化合价在反应前后有无变化,如何变化。并判断是否是氧化还原反应。
电子转移及氧化还原关系的表示方法---双线桥法
再如:
升失 氧, 降 得还
化合价升高
是因为失去了电子
这种元素被氧化或 发生了氧化反应
规律:
练习: 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。
① Fe2O3 + 3CO 2Fe + 3CO2 ② Zn + 2HCl == ZnCl2 + H2 ↑
练习: 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。
① Fe2O3 + 3CO 2Fe + 3CO2
② Zn + 2HCl == ZnCl2 + H2 ↑
+4
+3
+2
0
化合价升高 失2e- × 3 被氧化
0
+1
+2
氧化还原反应复习课课件

04 氧化还原反应的应用
在化学工业中的应用
氧化还原反应在化学工业中有着广泛的应用,如金属的冶炼、染料和塑料的合成等 。
在金属冶炼过程中,通常需要将矿石中的金属氧化物还原成金属单质,这需要利用 还原反应。
在染料和塑料的合成中,通常需要利用氧化反应将原料中的某些元素氧化成高价态 ,以生成所需的产物。
电子转移
在氧化还原反应中,电子从还原剂转移到氧化剂,是反 应进行的必要条件。电子转移的数量决定了反应的产物 和反应的进行方向。
常见氧化还原反应方程式
如$4HCl + MnO_{2} = MnCl_{2} + Cl_{2} uparrow + 2H_{2}O$、$2Na + 2H_{2}O = 2NaOH + H_{2} uparrow$等。
修复等。
在水处理中,可以通过添加氧化 剂或还原剂来去除水中的有害物 质,如重金属和有机污染物等。
在土壤修复中,可以通过调节土 壤中的氧化还原状态来促进污染
物的降解和转化。
05 氧化还原反应的实验操作
实验操作注意事项
安全注意事项
由于涉及到化学物质,实验操作中需 特别注意安全,避免直接接触化学试 剂,佩戴实验服和化学防护眼镜。
氧化还原反应的实例
总结词
列举几个常见的氧化还原反应实例。
1. 铁生锈
铁与氧气和水反应生成铁锈,这是一 个典型的氧化还原反应。
2. 电池工作原理
电池内部的化学反应是氧化还原反应 ,其中正极发生氧化反应,负极发生 还原反应。
3. 植物的光合作用
植物通过光合作用将二氧化碳和水转 化为葡萄糖,并释放氧气,这也是一 个氧化还原反应。
详细描述
在氧化还原反应中,氧化剂是获得电子的物质,它被还原并发生还原反应;而还 原剂是失去电子的物质,它被氧化并发生氧化反应。
氧化还原反应的概念ppt课件

(1) 2Al
高温
+ Fe2O3
2Fe + Al2O3
(2)Cl2 + 2NaOH
NaCl + NaClO + H2O
(3) MnO2 + 4HCl Δ MnCl2 + 2H2O + Cl2↑
失2×3e-,化合价升高,被氧化
0 +3 高温 0 +3
(1) 2Al + Fe2O3
2Fe + Al2O3
氧化性、还原性的强弱取决于物质得失电子的难易程度, 与得失电子数目的多少无关。
1.根据反应方程式来比较 “强” 制“弱”
氧化性: 氧化剂﹥氧化产物 还原性: 还原剂﹥还原产物
例1:根据下列三个氧化还原反应: (1)2 Fe3+ + 2 I- = 2Fe2+ + I2 (2)2 Fe2+ + Cl2 = 2 Fe3+ + 2Cl- 试比较:
得2×3e-,化合价降低,被还原
氧化剂: Fe2O3 还原产物: Fe
还原剂:Al 氧化产物: Al2O3
失1×e-,化合价升高,被氧化
0
(2)Cl2 + 2NaOH
-1
+1
NaCl + NaClO + H2O
得1×e-,化合价降低,被还原
氧化剂、还原剂:Cl2
还原产物:NaCl 氧化产物:NaClO
+17
Cl-
NaCl
Na+ Cl-
NaCl的形成过程示意图
12
3.从电子转移的角度认识氧化还原反应
• 金属与非金属的反应
得到2×1个电子,化合价降低2×1
氧化还原反应ppt课件

VS
拉瓦锡 1743~1794 (法)
弗兰克兰 1825~1899(英)
1852年,弗兰克兰在研究金属有化合物时提出化合价的概念,并逐步得到完善后,人们把化合价升高的反应叫做氧化反应,把化合价降低的反应叫做还原反应。
得失氧的视角
化合价的视角
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
氧化还原反应
环节三:宏观辨识,归纳氧化还原反应和四大基本反应类型的关系
反应前后物质的类别和数目
反应前后有无元素化合价的变化
氧化还原反应
环节三:宏观辨识,归纳氧化还原反应和四大基本反应类型的关系
氧化还原反应
非氧化还原反应
本节小结
得氧、失氧
元素(宏观视角)
元素化合价升降
电子(微观视角)
电子转移(电子得失或共用电子对的偏移)
物质水平——得失氧的视角
在一个反应中同时发生
氧化还原反应
狭义
一种物质得到氧发生氧化反应,同时另一种物质失去氧发生还原反应的反应叫氧化还原反应。
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
1774年,拉瓦锡创立氧化学说(既燃烧是物质与氧气的反应)推翻了流行千年的燃素说,以解释燃烧等实验现象,指出动物的呼吸实质上是缓慢氧化。
化合价升高,
化合价降低,
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
氧化还原反应
非氧化还原反应
无元素化合价变化
有元素化合价变化
氧化还原反应的特征
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
拉瓦锡 1743~1794 (法)
弗兰克兰 1825~1899(英)
1852年,弗兰克兰在研究金属有化合物时提出化合价的概念,并逐步得到完善后,人们把化合价升高的反应叫做氧化反应,把化合价降低的反应叫做还原反应。
得失氧的视角
化合价的视角
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
氧化还原反应
环节三:宏观辨识,归纳氧化还原反应和四大基本反应类型的关系
反应前后物质的类别和数目
反应前后有无元素化合价的变化
氧化还原反应
环节三:宏观辨识,归纳氧化还原反应和四大基本反应类型的关系
氧化还原反应
非氧化还原反应
本节小结
得氧、失氧
元素(宏观视角)
元素化合价升降
电子(微观视角)
电子转移(电子得失或共用电子对的偏移)
物质水平——得失氧的视角
在一个反应中同时发生
氧化还原反应
狭义
一种物质得到氧发生氧化反应,同时另一种物质失去氧发生还原反应的反应叫氧化还原反应。
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
1774年,拉瓦锡创立氧化学说(既燃烧是物质与氧气的反应)推翻了流行千年的燃素说,以解释燃烧等实验现象,指出动物的呼吸实质上是缓慢氧化。
化合价升高,
化合价降低,
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
元素水平——化合价升降的视角
氧化还原反应
非氧化还原反应
无元素化合价变化
有元素化合价变化
氧化还原反应的特征
氧化还原反应
环节一:宏观视角,认识氧化还原反应的特征
氧化还原反应ppt课件

NaCl的形成过程
+11
+17
Na Na+
Cl- Cl
化合 价升 降原 因之 一电 子得 失
HCl形成过程
H
+1
+17
Cl
HCl +1
+17
+1 -1
H Cl
H Cl
化合 价升 降原 因之 一共 用电 子对 偏移
延伸:
HCl的形成过程
H
+1
+17
Cl
HCl +1
+17
+1 -1
H Cl
H Cl
发生在身边的事------
发生在身边的事------
发生在身边的事------
Fe2O3
Fe
铁矿石
人教版 必修一
第二章 化学物质及其变化
第三节氧化还原反应
第一课时
【复习】 从得氧和失氧角度将化学反应分类
活学活用 从得氧失氧角度分析氧化还原反应
从
来看是 还原
反应
从
来看是 氧化 反应
氧化反应和还原反应为什么一定是同时发生的?
氧化还原反应实质:电子的转移
总结
小组合作
有人说置换反应、有单质参加的化合反应和 有单质生成的分解反应全部属于氧化还原反应。 你认为这个观点对吗?(请大家完成导学案-探究)
二、氧化还原反应和四大基本反应类型的关系:
氧化还原反应 非氧化还原反应
置换反应
复分解反应
分解反应
有单质参加 的化合反应 或有单质生 成的分解反 应以及置换 反应一定是 氧化还原反 应
化合 价升 降原 因之 一共 用电 子对 偏移
氧化还原反应ppt课件

氧化还原反应 非氧化还原反应
化学反应按照不同的分类方法可以分为不同 的反应,四大基本反应类型与氧化还原反应 什么关系?
随堂检测
1. 回答下列问题:
① CO2+C 高温 2CO ③ C+H2O(g) 高温 CO+H2 ⑤ CaCO3 高温 CaO+CO2↑
② CaO+H2O===Ca(OH)2 ④ 2H2O 电解 2H2↑+O2↑
00
2Na+Cl2
+1 -1
2NaCl
化合价降低,还原反应
化合价升降的原因:电子的得失
三、从电子转移的角度认识氧化还原反应
微观探析:以H2与Cl2反应为例
H +1 1
都可得1个e-
Cl +17 2 8 7
化合价升高,氧化反应
共用电子对
00
H2+Cl2
点燃
+1 -1
2HCl
化合价降低,还反应
化合价升降的原因:共用电 子对的偏移(偏离或偏向)
一、从得失氧的角度认识氧化还原反应
根据初中学过的氧化反应和还原反应的知识,分析以下反应:
得到氧
2Cu+O2
2CuO
➢ 铜: 得__到__氧变成了氧化铜,发生 氧___化_反应,被氧气_氧___化。
一、从得失氧的角度认识氧化还原反应
根据初中学过的氧化反应和还原反应的知识,分析以下反应:
得到氧
2CuO+H2
还原反应
化合价升高
0 +2
Fe+ CuSO4
+2
0
FeSO4+Cu
化合价降低 ➢ Fe元素:化合价升高,发生氧化反应,被氧化。
➢ Cu元素:化合价降低,发生还原反应,被还原。 虽没有物质得氧、失氧,但反应前后却有元素化合价的变化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
活泼的金属单 质
M(金属)
活泼的非金属
H2
单质
C
氧化物
CO SO2
元素处于低价 态时的化合物
酸
H2S HI
盐
SO32-
Fe2+
2021
对应氧化产物
Mn+
H2O CO或CO2
CO2 SO3或SO42-
S
I2
SO42-
Fe3+
7
三、氧化还原的计算:得失电子守恒。
硫代硫酸钠可作为脱氯剂,已
知25.0ml,0.100 mol/L Na2S2O3
链接高考
(2009· 上海高考)某反应中反应物与生成物有: AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一 种未知物质X. (1)已知KBrO3在反应中得到电子,则该反应的还原剂 是__________. (2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X, 则X的化学式为__. (3)根据上述反应可推知________. a.氧化性:KBrO3>H3AsO4 c.还原性:AsH3>X b.氧化性:H3AsO4>KBrO3 d.还原性:X>AsH3 (4)将氧化剂和还原剂的化学式及其配平后的化学计量数 填入下列方框中,并标出电子转移的方向和数目(用单线 桥法)
③Cl2的氧化性比ClO-的氧化性
④Cl2 是
产物。
反应, ,
2021
4
一、概念间的关系
氧化剂→____→____→____ →______→____
↑↑↑↑
↑↑
反应物—性质—本质 — 特征 —反应 — 生成物
↓↓↓↓
↓↓
还原剂→____→_____→____ →______→______
二、常见的氧化剂、还原剂
知识应用
氧化反应
原电池
还原反应
知识应用
(2011上海高考)雄黄(As4S4)和雌黄 (As2S3)是提取砷的主要矿物原料,二者在 自然界中共生。根据题意完成下列填空:
(3)As2S3和HNO3有如下反应:
As2S3 + 10H+ + 10NO3-===2H3AsO4 + 3S
+10NO2↑+ 2H2O。若生成2mol H3AsO4,则
步骤一、根据价态变化找出反应物,推出生成物
反应物:K2Cr2O7+ C2H5OH+ H2SO4 氧化产物、还原产物:CH3COOH 和Cr2(SO4)3 步骤二、请写出未配平的方程式: 步骤三、根据得失电子守恒进行配平。
2K2Cr2O7+3C2H5OH+8H2SO4= 2K2SO4+2Cr2(SO4)3+3CH3COOH +11H2O
1.常见的氧化剂
物质类型
举例
对应还原产物
活泼的非金属 单质
元素处于高价 态的化合物
过氧化物
X2(卤素)
O2
氧化物 MnO2
含氧酸
浓硫酸 硝酸
盐
KMnO4
Fe3+
Na2O2、202H1 2O2
X- O2-或OH-
Mn2+
SO2或S
NO或NO2 Mn2+
Fe2+或Fe
H2O
6
2.常见的还原剂
物质类型
举例
溶液恰好把224 ml(标准状况下) Cl2
转化为Cl-,则S2O32-将转化成
A. S2-
B. S
C. SO32-有K2Cr2O7的 硅胶颗粒的装置吹气,通过某些现象,即可 证明司机是酒后驾车。
Cr2O72-橙红色 Cr3+蓝绿色
四、陌生方程式书写、配平方法
2021
2
资料 检 索
主要成分 各种无机酸 和有机酸、 缓蚀剂、增 稠剂、表面 活性剂、香 精等。
主要成分 NaClO、NaCl。 无色或淡黄色 液体,有效氯 含量5.5~ 6.5%
2021
3
“洁厕灵”遇到“84消毒液”
ClO-+Cl-+2H+ =Cl2↑+H2O
①体现氧化性的离子
,
②由Cl- 转变为Cl2发生了
反应中转移电子的物质的量为
。若将该
反应设计成一原电池,则NO2应该在 “正极”或“负极”)附近逸出。
(填
2021
13
化学课
某日上化学课 ,老师宣布下节课要小 考。小宇紧张地立即举手问老师会不会考得 很难,老师只说了一句:十分简单。乐得大 家拍手叫好,可是考完后每个人都考得惨不 忍睹,怎么会简单呢?于是小宇又问了老 师 ,只听老师说:我可没说错哦,十分简 单,剩下九十分很难 !
2021
1
氧化还原反应 复习
义乌中学——朱秀丹
