小鼠早期胚胎发育
小鼠胚胎早期发育过程中OCT4作用的研究进展

小鼠胚胎早期发育过程中OCT4作用的研究进展引言小鼠胚胎早期发育是一个复杂的过程,其中涉及到许多基因的调控和表达。
其中一个关键基因是OCT4,是一种转录因子,对于胚胎干细胞的自我更新和分化具有重要作用。
在过去的几十年里,科学家们对OCT4在小鼠胚胎早期发育中的作用展开了大量研究,取得了一系列重要的进展。
本文将综述这些研究成果,探讨OCT4在小鼠胚胎早期发育过程中的作用及其潜在机制。
OCT4的功能和表达调控OCT4是一个关键的转录因子,它在胚胎干细胞中的作用被广泛研究。
OCT4对于维持胚胎干细胞的干性、自我更新和多能性具有重要作用。
在小鼠早期胚胎发育中,OCT4的表达模式也备受关注。
研究显示,OCT4在小鼠受精卵后期的囊胚阶段开始表达,并且在早期内细胞(ICM)中高度表达。
随着胚胎发育的进展,OCT4的表达范围逐渐限制在胚胎内细胞中,而在外细胞中逐渐减少。
这种表达模式的调控与胚胎干细胞的定向分化密切相关。
OCT4调控基因表达的机制OCT4通过调控多个基因的表达来维持胚胎干细胞的干性和多能性。
在早期的研究中发现,OCT4可以与其他转录因子(如SOX2、NANOG等)形成复合物,共同调控多个靶基因的表达。
近期的研究进展显示,OCT4还可以通过与表观遗传修饰因子相互作用,影响染色质结构和可及性,从而调控基因的表达。
OCT4还可以通过miRNA的调控网络影响胚胎干细胞的功能。
这些新的研究成果为我们深入理解OCT4的作用机制提供了新的思路。
OCT4在转基因技术中的应用随着对OCT4功能的深入研究,人们发现OCT4在胚胎干细胞和再生医学领域具有广阔的应用前景。
利用OCT4转基因技术可以实现胚胎干细胞的高效自我更新和多能性维持,并且为再生医学提供了丰富的细胞来源。
OCT4还可以通过调控其下游的基因网络,促进器官再生和损伤修复。
OCT4在转基因技术中的应用潜力巨大,将为再生医学领域带来革命性的进展。
结论OCT4在小鼠胚胎早期发育过程中发挥着重要作用。
小鼠胚胎观察实验报告(3篇)

第1篇一、实验背景随着生物科学技术的不断发展,基因编辑技术、细胞培养技术等在胚胎研究中的应用日益广泛。
本研究旨在通过观察小鼠胚胎发育过程,了解胚胎的形态变化、细胞分裂、器官形成等关键阶段,为进一步研究胚胎发育机制提供实验依据。
二、实验目的1. 观察小鼠胚胎发育过程中的形态变化。
2. 研究胚胎细胞分裂、器官形成等关键阶段。
3. 探讨胚胎发育过程中基因表达和调控机制。
三、实验材料与仪器1. 实验材料:小鼠胚胎、小鼠母体、培养皿、解剖显微镜、显微镜、载玻片、盖玻片、生理盐水、DAB染色剂、苏木精染色剂、酒精、盐酸、显微镜切片机等。
2. 实验仪器:解剖显微镜、显微镜、载玻片、盖玻片、显微镜切片机、恒温培养箱、显微镜切片机、图像采集系统等。
四、实验方法1. 实验分组:将实验分为对照组和实验组,对照组为正常小鼠胚胎,实验组为基因编辑小鼠胚胎。
2. 胚胎采集:在胚胎发育的第3天,采集对照组和实验组小鼠胚胎。
3. 胚胎观察:将采集的胚胎放置于载玻片上,使用解剖显微镜观察胚胎的整体形态变化。
4. 细胞分裂观察:将胚胎切片,使用显微镜观察细胞分裂情况。
5. 器官形成观察:将胚胎切片,使用显微镜观察器官形成情况。
6. 基因表达分析:使用实时荧光定量PCR技术检测胚胎中关键基因的表达水平。
五、实验结果与分析1. 胚胎形态变化:与对照组相比,实验组小鼠胚胎形态变化不明显,整体发育状况良好。
2. 细胞分裂:实验组小鼠胚胎细胞分裂速度与对照组相似,无显著差异。
3. 器官形成:实验组小鼠胚胎器官形成情况与对照组相似,无显著差异。
4. 基因表达:实验组小鼠胚胎中关键基因的表达水平与对照组相似,无显著差异。
六、实验结论1. 本研究成功观察了小鼠胚胎发育过程中的形态变化、细胞分裂、器官形成等关键阶段。
2. 实验结果表明,基因编辑技术对小鼠胚胎发育无明显影响,为后续研究胚胎发育机制提供了实验依据。
七、实验讨论1. 本实验通过观察小鼠胚胎发育过程,揭示了胚胎发育过程中形态变化、细胞分裂、器官形成等关键阶段。
小鼠的生殖生理学特点

在观察小鼠附植前胚胎发育时,可按照配种时间将其分为几个日龄阶段:
配后日龄0~1天,为单细胞胚胎,即合子时期,形成雌雄二原核。雌原核位于第二极体之下,具多个核仁,雄原核位置接近中心,体积较大,核仁少。合子位于输卵管漏斗部,透明带表面尚可见分散的卵丘细胞。有时多个合子期胚胎由输卵管粘性分泌物粘附,不易分开。
(三)排卵和交配
雌性小鼠排卵期为3~4天,但在排卵期仅有数小时允许公鼠交配。小鼠属于自发排卵的动物,排卵一般发生在发情期末的半夜至凌晨4:30左右,交配一般发生在排卵前的22:00至次日凌晨1:00,即交配早于排卵2小时左右。交配后精子到达输卵管受精部位的时间为20~60分钟,等待新鲜的卵子。小鼠的排卵数因品系、个体及饲养管理等环境因素的不同而有所差异,我们在实验中常选用的昆白系小鼠排卵较多,但个体差异较大。
(一)性成熟和体成熟
动物生长发育到一定程度,即达到性成熟期。性成熟的表现是生殖器官发育完全,出现第二性征。这时雄性动物有产生精子、雌性动物有产生卵子的能力,并出现性的要求。
小鼠性成熟时期的标志是:雌性小鼠阴道口张开,出现求偶周期,有交配的欲望,愿意接近公鼠;公鼠睾丸下降,精子生成。雌鼠一般在20日龄以前阴道口由皮肤闭合,之后阴道口皮肤逐渐变薄,阴道开口,其开口与卵巢机能活动相一致,所以阴道开口是雌鼠性成熟的主要标志。雄鼠在25日龄左右,睾丸自腹腔落入阴囊,35日龄后睾丸形成精子,40日龄后的精子可受精,同时体重增加较快。
(七)妊娠、分娩和哺乳
小鼠的妊娠期,因品种不同而有所差异。纯系小鼠妊娠期一般为19天,部分20天;国内普通小白鼠妊娠期变化范围较纯系小鼠大,为18~21天。小鼠的分娩可昼夜进行,但以晚间为多。母鼠产前一般是表现不安状态,常常不停地整理产窝。母鼠分娩的全过程一般需要1小时左右,分娩完毕后约12~24小时出现产后发情,此时交配,多能受孕。仔鼠哺如期一般18~21天,留种仔鼠可延长到23天,但不能超过25天。
实验小鼠和大鼠各胚胎发育时期的变化

实验小鼠和大鼠各胚胎发育时期的变化时期胎龄(日)胚胎发育小鼠大鼠1 1 1 单核细胞(输卵管内)2 2 2细胞期(输卵管内)3 2 3.25 4细胞期(输卵管内)4 2.5 3.5 8-12细胞期(输卵管内)5 3 3. 桑椹期(输卵管—子宫上部)6 3.5 4 囊胚初期(子宫内)7 4 5 囊胚期8 4.5 6 植入开始9 5 6.75 内外胚层分化10 5.5 7.25 植入末期,卵黄腔形成,分化成内外胚层,11 6.5 7.75 植入完毕,出现羊膜。
12 7 8.5 出现中胚层和原条。
13 7.5 9 出现神经板,头部突起,出现尿膜褶。
14 7.75 9.5 体节1-4(头部)完成外层胎盘。
15 8~8.5 10 腔,胚外体腔内和羊膜腔发育。
体节5-12(颈椎部)形成神经沟,胚回转开始。
16 8.5~9 10.5 体节13-20(胸椎前部)胚回转结束。
17 9.5 11 体节21-25(胸椎后部),神经沟闭锁。
18 10 11.5 体节26-28(腰椎前部),前肢出现。
19 10.25 11.75 体节29-31(腰椎后部),后肢出现。
20 体节32-33(荐椎后部)。
21 12 体节34、35(荐椎后部)。
22 10.5 体节36(第一层尾椎)鼻窝形成23 体节37、38(尾椎)。
24 体节39、40(尾椎)。
25 11 12.5 体节41、42,前肢变大。
26 体节43-45(尾椎)手指分化。
27 12 13 体节46-48(尾椎)脐疝明显。
28 12.5 13.5 体节49-51(尾椎),鼻上颌闭锁。
29 14 体节52-55(尾椎)。
30 13 14.5 体节56-60(尾椎),耳孔开,耳壳形成31 13.5~14 15 体节61-63(尾椎),口盖板闭锁32 14.5 15.5 体节64(尾椎)、体表出现毛囊。
33 15 16 体节65(最终尾椎)34 16-16.5 17-18 脐疝消失,眼脸、耳壳闭锁。
小鼠胚胎早期发育过程中OCT4作用的研究进展

小鼠胚胎早期发育过程中OCT4作用的研究进展OCT4是一种高度保守的Pou家族转录因子,主要在早期胚胎和胚胎干细胞中表达。
其在胚胎发育中的功能得到了广泛的研究,研究显示OCT4在小鼠胚胎干细胞的形成和维持中具有重要作用。
OCT4还参与调控胚胎干细胞的自我更新和分化,对胚胎干细胞的干细胞特性维持起着至关重要的作用。
OCT4在小鼠胚胎早期发育过程中的作用备受关注。
在小鼠胚胎早期发育过程中,OCT4的作用主要体现在三个方面:细胞命运决定、胚胎干细胞的形成和自我更新以及干细胞特性维持。
OCT4通过调控其下游基因的表达,影响胚胎干细胞的细胞命运决定。
研究表明,OCT4可以调控其他干细胞基因的表达,如Nanog、Sox2等,从而影响干细胞的命运。
OCT4在胚胎干细胞的形成和自我更新中发挥重要作用。
OCT4蛋白通过与其他转录因子和辅助蛋白结合,参与形成复合物,调控胚胎干细胞的基因表达,从而维持胚胎干细胞的自我更新能力。
OCT4对干细胞特性的维持也具有重要作用。
OCT4的下调或过表达都会导致干细胞特性的丧失,从而影响胚胎干细胞的干细胞性能和分化潜能。
除了以上提到的方面,最新研究还发现,OCT4在小鼠胚胎早期发育过程中可能还涉及到其他一些新的作用。
一些研究表明OCT4参与了胚胎干细胞的细胞周期调控,通过调控细胞周期相关蛋白的表达,影响胚胎干细胞的增殖和分化。
OCT4还可能参与胚胎干细胞的代谢调控,调控能量代谢和相关信号通路的活化。
这些新的研究进展为我们更全面地了解OCT4在小鼠胚胎早期发育中的作用提供了新的视角和机会。
在研究中,科学家们通过使用基因编辑技术、分子生物学方法、细胞生物学技术等手段,对OCT4在小鼠胚胎早期发育中的作用进行了深入研究。
通过构建OCT4的敲除小鼠模型,科学家们发现OCT4缺失会导致胚胎停滞和胚胎干细胞的缺失,从而进一步验证了OCT4在小鼠胚胎早期发育中的重要作用。
科学家们还通过对OCT4下游基因的功能和与OCT4相互作用的分子的研究,进一步揭示了OCT4参与调控胚胎干细胞自我更新和分化的分子机制。
小鼠早期胚胎发育的研究 )

小鼠早期胚胎发育的研究(实验方案)基础生物学课程设计所在学院生物科学与工程学院专业班级生物科学学生姓名学生学号指导教师XXXX年XX月XX日小鼠早期胚胎发育的研究一、引言胚胎发育一词通常是指从受精卵起到胚胎出离卵膜的一段过程。
而无脊椎动物胚胎学家则常把其概念扩展到胎后发育直到性成熟,甚至整个生活史。
动物胚胎的发育过程虽然动物的种类繁多,但是胚胎的发育依然拥有相似的过程,能够分成受精、卵裂、桑葚胚、囊胚、原肠胚与器官形成等阶段。
此外脊椎动物的胚胎发育过程中,各种动物共同拥有的特征会首先出现(如皮肤),之后才逐渐发展出特化的构造(如鱼鳞),而且较复杂的物种与较原始的物种之间一开始相当类似,之后才随着发育的时间而慢慢增加变异。
受精:卵子和精子融合为一个合子的过程。
它是有性生殖的基本特征,普遍存在于动植物界,卵裂:精子与卵子结合之后会形成受精卵,由于卵黄的分布具有不对称的特性,因此受精卵可以分为动物极(会发展成外胚层)和植物极(会发展成中胚层与内胚层)。
在卵裂时期,卵子会先分裂成两个细胞,之后细胞通常会逐次倍增,但是对哺乳类而言,有时候会有不同时分裂并造成只有奇数个细胞的现象。
在这个阶段,胚胎的总体积大致不变。
不同的物种具有不同的卵裂方式,可以分为完全卵裂(holoblastic cleavege)和不完全卵裂(meroblastic cleavage),分别又可以细分成许多不同方式。
如无脊椎动物的辐射卵裂与螺旋卵裂、哺乳动物的旋转式分裂等。
原肠胚:当细胞分裂成为囊胚之后,会经过一段称为原肠形成的型态发生过程,之后形成原肠胚。
原肠形成过程有许多不同方式,能够大致分成5种:内陷式(Invagination)、衰退式(Involution)、进入式(Ingression)、脱层式(Delamination)、包覆式(Epiboly),动物的胚胎利用这5种方式形成了外胚层、中胚层与内胚层的组合,而这三种胚层在之后会形成各种细胞。
小鼠胚胎早期发育过程中OCT4作用的研究进展

小鼠胚胎早期发育过程中OCT4作用的研究进展1. 引言1.1 小鼠胚胎发育概述小鼠是广泛应用于生物学研究的重要模式动物之一,其胚胎发育过程是研究胚胎发育和干细胞生物学的重要模型。
小鼠胚胎发育过程包括受精、卵裂、胚胎植入、胚胎期、胚胎器官形成和胚胎发育成熟等阶段。
在受精后的早期,小鼠胚胎经过连续的细胞分裂形成胚胎囊,然后在囊胚期和早期胚胚期发生胚胚的胚胎干细胞方向分化。
在小鼠胚胎干细胞中,一些特定的转录因子扮演着重要的角色,其中OCT4是其中的重要代表之一。
OCT4在胚胎干细胞的自我更新、多能性维持和分化等过程中起着关键作用,对小鼠早期胚胎发育中的重要性不可忽视。
通过对OCT4的研究,可以更深入地了解小鼠胚胎早期发育过程中的分子机制和调控网络,为解开胚胎发育和再生医学等领域的奥秘提供更多的参考和支持。
1.2 OCT4在胚胎干细胞中的重要性OCT4在胚胎干细胞中的作用不仅仅局限于自我更新和分化,它还参与了细胞周期调控、基因转录调控等多个方面的生物学过程。
对OCT4的研究不仅有助于揭示胚胎早期发育和胚胎干细胞的分子机制,还有助于深入了解细胞分化、肿瘤发生等相关领域。
OCT4在胚胎干细胞中的重要性无可替代,对其研究将为我们揭开生命奥秘的一角,同时也为临床治疗提供了新的思路和希望。
2. 正文2.1 OCT4在小鼠胚胎早期发育中的表达模式OCT4是一种关键的转录因子,在小鼠胚胎早期发育中扮演着重要的角色。
研究表明,在小鼠胚胎的早期阶段,OCT4的表达模式是动态变化的。
在受精卵阶段,OCT4的表达在整个胚胎中广泛分布,并在细胞分化的过程中逐渐限制在内细胞团。
随着胚胎发育的进展,OCT4的表达在外细胞团逐渐减少,最终局限在内细胞团,这种差异性表达模式对于细胞命运的决定至关重要。
研究还发现,OCT4的表达模式受到多种外源性因素的调控,如细胞外基质的成分、细胞间相互作用等。
这些因素可以影响OCT4的表达水平和分布模式,进而影响胚胎的发育方向和命运。
小鼠早期胚胎发育的研究 )

小鼠早期胚胎发育的研究(实验方案)基础生物学课程设计所在学院生物科学与工程学院专业班级生物科学学生姓名学生学号指导教师XXXX年XX月XX日小鼠早期胚胎发育的研究一、引言胚胎发育一词通常是指从受精卵起到胚胎出离卵膜的一段过程。
而无脊椎动物胚胎学家则常把其概念扩展到胎后发育直到性成熟,甚至整个生活史。
动物胚胎的发育过程虽然动物的种类繁多,但是胚胎的发育依然拥有相似的过程,能够分成受精、卵裂、桑葚胚、囊胚、原肠胚与器官形成等阶段。
此外脊椎动物的胚胎发育过程中,各种动物共同拥有的特征会首先出现(如皮肤),之后才逐渐发展出特化的构造(如鱼鳞),而且较复杂的物种与较原始的物种之间一开始相当类似,之后才随着发育的时间而慢慢增加变异。
受精:卵子和精子融合为一个合子的过程。
它是有性生殖的基本特征,普遍存在于动植物界,卵裂:精子与卵子结合之后会形成受精卵,由于卵黄的分布具有不对称的特性,因此受精卵可以分为动物极(会发展成外胚层)和植物极(会发展成中胚层与内胚层)。
在卵裂时期,卵子会先分裂成两个细胞,之后细胞通常会逐次倍增,但是对哺乳类而言,有时候会有不同时分裂并造成只有奇数个细胞的现象。
在这个阶段,胚胎的总体积大致不变。
不同的物种具有不同的卵裂方式,可以分为完全卵裂(holoblastic cleavege)和不完全卵裂(meroblastic cleavage),分别又可以细分成许多不同方式。
如无脊椎动物的辐射卵裂与螺旋卵裂、哺乳动物的旋转式分裂等。
原肠胚:当细胞分裂成为囊胚之后,会经过一段称为原肠形成的型态发生过程,之后形成原肠胚。
原肠形成过程有许多不同方式,能够大致分成5种:内陷式(Invagination)、衰退式(Involution)、进入式(Ingression)、脱层式(Delamination)、包覆式(Epiboly),动物的胚胎利用这5种方式形成了外胚层、中胚层与内胚层的组合,而这三种胚层在之后会形成各种细胞。
采集小鼠受精卵

采集小鼠受精卵小鼠受精卵(早期胚胎)采集在基因工程小鼠的制备和保种中都是非常重要的步骤。
只有采集到足够数量和质量的受精卵,才能更有效地进行显微注射、胚胎移植或冻存复苏,保证获得高质量的子代小鼠。
那么受精卵到底是怎么采集的呢?今天我们就来介绍一下1细胞期与2细胞期胚胎的收集方法。
哺乳动物的受精过程发生在输卵管内,小鼠胚胎进入子宫着床时间大约为4天左右。
因此,需要在配种后或受精后的适当时间从超排供体收集不同时期的胚胎。
小鼠受精后4.5天内早期胚胎发育的过程:[图片来自:Genetics & Development]人、小鼠、大鼠胚胎发育阶段对应时间点:[图片来自:https://.au]受精卵获得的方法分自然排卵、激素诱发排卵和体外受精三种方法。
我们今天介绍的是诱发排卵(超排)后采集受精卵的方法。
雌鼠超排与合笼超排不同背景的小鼠超排周龄都是不同的,剂量也是不同的。
那以常用的C57小鼠为例,超排周龄为3-4周龄。
当达到超排周龄后,向雌小鼠腹腔内注射5个国际单位(IU)的孕马血清促性腺激素(PMSG),然后约46-48h后再注射5 IU的人绒毛膜促性腺激素(hCG),12h后即可诱发排卵。
图1. 雌鼠超排与受精卵早期发育时间轴[图片来自:Ivan Bedzhov, et al. In vitro culture of mouse blastocysts beyond the implantation stages. Nature Protocols volume 9, pages 2732–2739 (2014)]合笼1)雌小鼠给予hCG后与成熟雄性小鼠进行合笼。
雄鼠交配一般是在夜晚发生,交配过程中建议不换笼,交配过的雄小鼠,间隔一周后才进行下次交配。
2)交配后过夜易见小鼠的阴道栓。
1-cell期胚胎采集输卵管切开1)通过断颈快速处死见栓0.5天的小鼠。
2)将小鼠背部靠尾部剃毛并用70%的乙醇彻底涂搽手术部位。
(完整word版)小鼠的生长周期(word文档良心出品)

小鼠的生长周期
1、胚胎期
小鼠卵在输卵管壶腹部受精后开始分裂发育,至桑椹胚(约3天)进入子宫,形成囊胚(约第5 天)开始着床,妊娠期为19~21天。
2、生后早期及哺乳期
1)新生小鼠赤裸无毛,皮肤肉红色,不开眼,双耳与皮肤粘连。
2)4~6日龄双耳张开耸立。
3)7~8日龄四肢发育开始爬动游走,被毛逐渐浓密,下门齿长出。
4)9~10 日龄有听觉,被毛长齐。
5)12~14日龄睁眼,长出上门齿,开始采食及饮水。
3、断奶期:出生后3 周龄可离乳独立生活。
4、青春早期及生长期
1)4周龄,雌鼠阴腔张开。
2)5周龄,雄鼠睾丸降落至阴囊,开始生成精子。
3) 出生后4-8周为生长期。
5、青春后期出生后5-8周
6、性成熟期:出生后45~60日龄性发育成熟。
性周期:4~5天
7、体成熟期出生后60~90天,此即为成年期。
8、中老年期:出生后120天,逐渐进入中年期,至出生后180天,随后进入老年期。
9、健康小鼠寿命可达18~24个月,最长可达3年。
激素对小鼠胚胎体外发育的影响

激素对小鼠胚胎体外发育的影响摘要探讨小鼠胚胎体外发育过程中,2种激素(孕马血清促性腺激素PMSG、人绒毛膜促性腺激素HCG)对早期胚胎发育的影响。
取原核期胚胎培养于不同的培养体系中,确定适合胚胎发育的最佳体外培养体系;在胚胎培养液中加入不同浓度的激素,观察激素对体外发育的影响。
试验发现含10%胎牛血清的人输卵管液培养液(HTF)是该试验条件下小鼠早期胚胎发育的最佳培养液;在该培养液中添加不同浓度和不同种类的激素后,各发育阶段胚胎的发育率与未添加激素的对照组相比均有所下降,但未发现浓度依赖性。
由此可认为,高浓度的PMSG和HCG 对体外培养的胚胎发育有抑制作用,可降低胚胎发育到各阶段的比例,尤其是显著降低了囊胚的发生率。
关键词激素;小鼠胚胎;体外发育;影响EffectsofHormoneonDevelopmentofMousePreimplantationEmbryosinVitroYAO YingXU Ying *CHEN Yi-fei(College of Medicine,Jiaxing University,Jiaxing Zhejiang 314001)AbstractThe system for mouse embryo culture,and the effects of two different hormone on mouse preimplantation embryos in vitro were explored.One-cell mouse embryos were cultured in different culture media to determine the optima system,and thendifferentconcentrationhormone were added to the medium to observe the effect ofhormone on mouse embryo development in vitro. HTF +10% FBS medium was the best culture system of mouse preimplantation embryod in viting. After hormone of different concentrations and kinds were added to HTF +10% FBS medium,the development rate of different stages embryos declines compared with control group. High concentration hormone could depress development of mouse preimplantation embryos in vitro,and lessens the developmental proportion of different stage embryos,then significant decreased the occurrence of blastocyst.Key wordshormone;mouse preimplantation embryos;development in vitro;effects早期胚胎体外培养技术在发育生物学、胚胎移植、转基因动物等领域的研究工作中都有很重要的作用[1]。
体外受精时程和胚胎培养方式对小鼠早期胚胎发育潜能的影响

【 中图分类号】R . 3
[ 文献标识码】 A
[ 文章编号】
一
一
一
Efe t f t e d r to f i ir e t ia i n a d t e c l r o e o f c s o h u a i n o n v t o f ri z t n h u t e m d f l o u e r o o h e eo me t l o p t n e o a l mb y c . mb y n t ed v l p n a m e e c fe ry e r o i mi e c n
Y n h — i T n Big b n , a a — h h a g Z i r n, a n - i g T n Xio s a a ( e t fR po u t e Me i n ,A l t si lo u y Me ia C l g ,Z n i C ne o e rd ci dc e f i e Hopt fZ n i dcl o ee u y r v i i ad a l G i o 6 0 3 C ia uz u5 3 0 , hn ) h
ቤተ መጻሕፍቲ ባይዱ
s e m- o ye c i c b t n w s 2 h u si r u p r o c t o n u a o a o r n g o p A,a d 1 o r n g o p B. h u t r d f mb o W ii e no i n 8 h u s i r u T e c l e mo e o u e r a dv d d i t y s 6 g o p a c r i g t e d f r n ou f me i m n h u e f c l r d e r o, e 0  ̄1 me i m n n ru c o dn o t i e e t v l me o d u a d t e n m r o u t e mb h b u y i .1 0 d u a d o e . e ro i r u ,l 0t d u a d tr e e a r o i r u 5 lme i m n n mb o i r u 5 me i m mb n g o p 1 O x me i m n h e l b n g o p 2, 0 d u a d o e e r n g o p 3, 0 y l y y du
小鼠胚胎培养方法的探究

小鼠胚胎培养方法的研究摘要目的:探讨小鼠早期胚胎在不同的体外培养液中生长发育的状况,从而寻找胚胎培养的最佳培养体系,为人类胚胎培养方法的改善提供理论依据,以提高临床体外受精一胚胎移植(IVF.ET)的成功率。
方法:配制不同的培养液,对100例小鼠超排卵共取卵子1678枚,分别在不同的培养液中进行体外授精,并将2一细胞鼠胚放入各组培养液中进行培养,其中,血清组的培养液为Earle培养液加10%人血清:卵泡液组的培养液为Earle培养液加lO%人卵泡液;蜕膜细胞条件培养液组的培养液为Earle培养液加lO%条件培养液:血清加卵泡液组的培养液为Earle培养液加10%人血清和5%人卵泡液:血清加条件培养液组为Earle培养液加10%人血清和5%条件培养液。
每日在显微镜下观察小鼠胚胎的发育情况,分析受精率、卵山西医科大掌裂率、卵裂速度及桑椹胚与囊胚形成率,采用x2分割检验进行统计分析。
结果:一、1、小鼠胚胎在蜕膜细胞条件培养液中有72.9%发育到8.细胞期,66.0%发育到桑椹胚,61.6%形成囊胚,32.1%胚胎孵化。
而对照组有43.6%发育到8.细胞期,30.9%发育到桑椹胚,19.1%到初级囊胚,55%孵化的胚胎。
两组比较有显著性差异。
2、卵泡液的胚胎有71.3%到8.细胞期,588%发育到桑椹胚,50.O%形成囊胚,257%孵化。
与对照组比较有差显著性异。
3、血清组有53,4%发育到8.细胞期,40.5%到桑椹胚,29.3%形成囊胚,仅有7.8%孵化。
与对照组无显著性差异。
二、鼠卵在不同培养液中受精率无显著性差别,而对于卵裂率和优质胚胎的形成率,鼠卯在蜕膜细胞条件培养液组和卵泡液组中均与对照组有显著性差异,而血清组与对照组比较无差异。
鼠胚在蜕膜细胞条件培养液和卵泡液中培养发育速度快,碎片率明显低于对照者。
三、小鼠早期胚胎在卵泡液组、蜕膜细胞条件培养液组中的调亡速度明显低于对照组,有显著性差异,而血清组中鼠胚的调亡速度低于对照组,但无显著性差异。
小鼠发育生物学实验内容

小鼠发育生物学实验内容实验一:小鼠卵母细胞和精子的形态观察一、实验目的:掌握胚胎体外操作工具的制备、小鼠超数排卵方法以及小鼠精子和不同发育阶段观卵母细胞的收集方法,观察精子结构和运动状态,评估精子活力,观察卵母细胞结构,了解体外授精操作过程。
二、操作过程:1 胚胎体外操作工具制备在酒精喷灯上将玻璃管拉成直径1mm的细管,连上乳胶管即可。
2 小鼠的抓去与保定3 收集精子断颈处死公鼠,打开腹腔,找到睾丸和附睾,剪取附睾尾,剪碎,置1.5ml离心管底部,加0.5ml 生理盐水,置37度水浴锅20分钟,用吸管从离心管上部取50微升液体,置细胞计数板,观察精子结构、密度和活力。
精子活力计算公式:精子活力=视野中直线运动的精子数/视野中总精子数4 收集卵母细胞成熟卵母细胞的收集:母鼠腹腔注射孕马血清促性腺激素PMSG(每只10单位),48小时后再注射人类绒毛膜促性腺HCG(每只10单位),18小时后断颈处死母鼠,打开腹腔,剪下输卵管,用镊子刺破输卵管壶腹部,释放卵母细胞,用透明质酸酶溶液(10毫克/毫升生理盐水)处理卵母细胞以除去颗粒细胞,在实体显微镜下观察卵母细胞的结构。
未成熟卵母细胞的收集:断颈处死性成熟前母鼠,打开腹腔,剪取卵巢,加入1毫升盐水,用刀片或镊子捣碎卵巢,寻找生发泡状态的卵母细胞,观察卵母细胞结构。
5 体外授精将卵母细胞与精子共培养(微滴培养法)(演示)三、实验结果各种精子和卵子的形态绘图;精子活力;精子密度四、实验收获与体会,存在问题和改进意见。
实验二:小鼠早期不同发育阶段胚胎的收集、观察以及胚胎移植一、实验目的:掌握小鼠附植前胚胎收集方法,观察不同发育阶段小鼠胚胎的结构,认识小鼠早期胚胎形态学,并了解体内发育阶段与所处生殖器官位置的关系,了解小鼠胚胎移植的基本原理和操作过程。
二、操作过程:1 小鼠超数排卵程序中午12时腹腔注射PMSG,48小时后腹腔注射HCG并与公鼠合笼交配,次日清晨检查阴道栓,如果发现阴道栓则妊娠0.5天。
小鼠胚胎早期发育过程中OCT4作用的研究进展

小鼠胚胎早期发育过程中OCT4作用的研究进展引言OCT4是一种重要的转录因子,它在胚胎干细胞和胚胎发育过程中起着关键作用。
OCT4主要用于维持干细胞的自我更新和多能性。
在小鼠胚胎早期发育过程中,OCT4也发挥着重要作用。
对OCT4在小鼠胚胎早期发育过程中的作用进行深入研究不仅有助于我们更好地理解胚胎发育的分子机制,也为干细胞治疗等领域的研究提供了重要的参考。
本文就小鼠胚胎早期发育过程中OCT4作用的研究进展进行综述。
OCT4的基本特性OCT4是一种POU家族的转录因子,它最早被发现于小鼠的胚胎干细胞中,后来又在人类和其他物种中得到了发现。
OCT4在胚胎干细胞中的表达水平很高,而在成体组织中基本不表达。
这表明OCT4在保持干细胞的自我更新和多能性中发挥着重要作用。
OCT4的表达和功能在小鼠胚胎发育过程中,OCT4主要表达在内细胞团(inner cell mass, ICM)和原始生殖细胞(primordial germ cells, PGCs)中。
在受精卵分化形成胚胎时,OCT4的表达会发生动态变化。
研究发现,OCT4的表达水平对于胚胎的发育起着至关重要的作用。
OCT4基因敲除小鼠的研究表明,缺乏OCT4会导致胚胎在发育早期就停止发育,最终形成胚胎致死。
OCT4与其他转录因子的相互作用OCT4在胚胎发育过程中的功能往往是通过与其他转录因子相互作用而实现的。
与SOX2、NANOG等转录因子的相互作用可以构成胚胎干细胞的转录调控网络,进而维持细胞的多能性和自我更新。
OCT4还能与其他转录因子一起调节胚胎发育的轴向模式形成和组织器官发育。
OCT4在早期胚胎干细胞的多能性维持中的作用在小鼠胚胎早期发育过程中,OCT4在维持内细胞团中干细胞的多能性和自我更新方面起着至关重要的作用。
研究发现,OCT4缺乏的胚胎内细胞团无法维持其多能性,进而影响到后续的胚胎发育过程。
而在体外实验中,OCT4的过度表达则会导致干细胞的多能性失去,转变为分化能力更强的细胞类型。
实验小鼠和大鼠各胚胎发育时期的变化
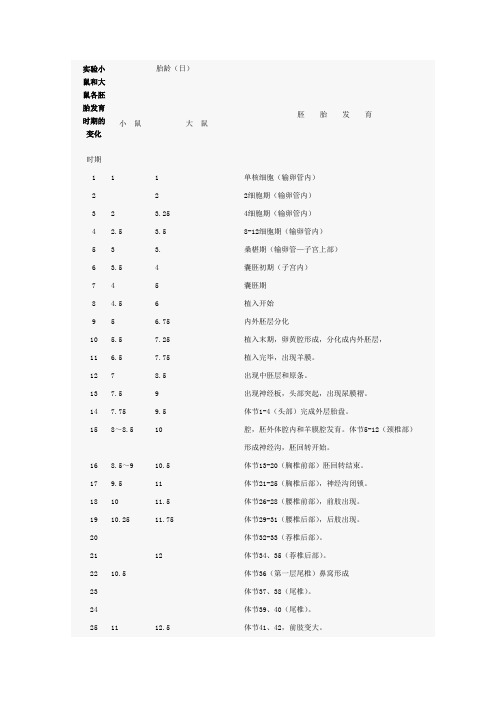
实验小鼠和大鼠各胚胎发育时期的变化时期胎龄(日)胚胎发育小鼠大鼠1 1 1 单核细胞(输卵管内)2 2 2细胞期(输卵管内)3 2 3.25 4细胞期(输卵管内)4 2.5 3.5 8-12细胞期(输卵管内)5 3 3. 桑椹期(输卵管—子宫上部)6 3.5 4 囊胚初期(子宫内)7 4 5 囊胚期8 4.5 6 植入开始9 5 6.75 内外胚层分化10 5.5 7.25 植入末期,卵黄腔形成,分化成内外胚层,11 6.5 7.75 植入完毕,出现羊膜。
12 7 8.5 出现中胚层和原条。
13 7.5 9 出现神经板,头部突起,出现尿膜褶。
14 7.75 9.5 体节1-4(头部)完成外层胎盘。
15 8~8.5 10 腔,胚外体腔内和羊膜腔发育。
体节5-12(颈椎部)形成神经沟,胚回转开始。
16 8.5~9 10.5 体节13-20(胸椎前部)胚回转结束。
17 9.5 11 体节21-25(胸椎后部),神经沟闭锁。
18 10 11.5 体节26-28(腰椎前部),前肢出现。
19 10.25 11.75 体节29-31(腰椎后部),后肢出现。
20 体节32-33(荐椎后部)。
21 12 体节34、35(荐椎后部)。
22 10.5 体节36(第一层尾椎)鼻窝形成23 体节37、38(尾椎)。
24 体节39、40(尾椎)。
25 11 12.5 体节41、42,前肢变大。
26 体节43-45(尾椎)手指分化。
27 12 13 体节46-48(尾椎)脐疝明显。
28 12.5 13.5 体节49-51(尾椎),鼻上颌闭锁。
29 14 体节52-55(尾椎)。
30 13 14.5 体节56-60(尾椎),耳孔开,耳壳形成31 13.5~14 15 体节61-63(尾椎),口盖板闭锁32 14.5 15.5 体节64(尾椎)、体表出现毛囊。
33 15 16 体节65(最终尾椎)34 16-16.5 17-18 脐疝消失,眼脸、耳壳闭锁。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Axis of Dorsal-Ventral
Myocardin
Cell lineages in early mouse embryo
Embryo culture system for time-lapse movie acquisition of node morphogenesis
in vitro embryo culture
GFP knock-in tracing
Dev Cell 13, 884-896, 2007
Time-lapse images of node morphogenesis
Noto-
Dev Cell 13, 884-896, 2007
The displacement model of endoderm morphogenesis in the mouse gastrula
Primitive streak formation
VE: visceral endoderm AVE: anterior VE DVE: distal VE
PS: Primitive Streak
EMT at mouse primitive streak
EMT at mouse primitive streak
E6.5
Dye injection
The distal cap epiblast cells migrate to the anterior neuroectoderm
M ag a zi ne
105
ne
ht yol k Epi bl ast nd
en
pxm l m ht
Yol k cel l s
?
Development 139, 3-14, 2012
Early mouse development
E3.5 ICM
E4.5
‘‘Salt and Pepper’’ expression of Nanog and Gata6 in the ICM of E3.5 blastocysts
Dev Cell 10, 615-624, 2006
Epiblast Primitve Streak Nascent Mesoderm
Cell Adhesion & Migration 4:3, 447-457
Mouse gastrulation and germ layer formation
Cell 132, 661–680, 2008
Late mouse development
Nat Cell Biol 13, 743-752, 2011
Origins of the dorsal and anterior visceral endoderm
Development 139, 3-14, 2012
Signaling pathways involved in A-P axis determination
l m
sm
hm nd ht end
l m end
exm
l St age 10+ 8 000 cel l si n bl ast oder m 5 000 cel l si n bl ast ul a 6 PS M ouse 50% epi bol y St age 10+ St age XI V 6. 5 days post coi t um se end Wheat germ agglutinin (WGA) Proxi m al PS 8 000 cel l si nnd bl ast oder m 5 000 l si n exm bl ast ul a 600 – 700 cel l si n epi bl ast 650 cel l si n epi bl ast am cel end
Development 139, 3-14, 2012
Mouse embryo development from fertilization to gastrulation
Development 139, 3-14, 2012
Early mouse embryo development and lineage segregation
5.5 dpc 5.75 dpc
6.0 dpc
6.25 dpc
Otx2 VEcis-lacZ
Otx2 KI-lacZ
DVE: distal visceral endoderm; AVE: anterior visceral endoderm
Asymmetric expression of Lefty1 transgenes in peri-implantation mouse embryos
Dev Cell 16, 398-410, 2009
Cell position-dependent differentiation mediated by Hippo signaling
Development 139, 3-14, 2012
Mouse embryo development from fertilization to gastrulation
Emerging asymmetry and establishment of anteriorposterior polarity in the E5.75 mouse embryo
Axis of Anterior-Posterior Axis of Proximal & Distal
Cell movements in early mouse embryos
CNS
Mesoderm
T
Ectoderm
Mesendoderm
E7.0
Mesendoderm markers
Bra
E7.5
Wnt3
Gene expression and regionalized allocation of tissue progenitors
Extraembryonic mesoderm
Fossat, N., et al. (2012) Cell Cycle 11: 26-32
“It is not birth, marriage, or death, but gastrulation, which is truly the most important time in your life.” Lewis Wolpert, 1986
FGF5, Nodal
Ectoderm
Neural Sox1 Pax6 Six3 Nestin Epidermis Ck5 Ck8 Ck18
Definitive endoderm
Mesoderm
Sox17 Gata4 Gata6
Foxa2
Nkx2.5 Mixl1 Flk1
Mesp1
Zo-1
Fate-mapping of the distal cap epiblast by carbocyanine dye labeling
Segregation and relocation of epiblast and PrE cells
Development 139, 3-14, 2012
Mouse embryo development from fertilization to gastrulation
?
Development 139, 3-14, 2012
Dev Cell 15, 509-520, 2008
Cell lineages in early mouse embryo
Cell lineage in early mouse embryo
Epiblast
Ectoderm
Mesendoderm Definitive endoderm
Epidermis
Dev Cell 10, 451-459, 2006
Two types of Lefty1+ cell in mouse embryos between E3.5 and E4.5
Nat Cell Biol 13, 743-752, 2011
Distinct origins of DVE and AVE
This was not new expression of the transgene, as GFP mRNA could only be detected in the yolk sac at this stage
These visceral endoderm derived cells continue to divide and are eventually incorporated into the epithelium of the gut tube
?
? ?
Development 139, 3-14, 2012
Two possible mechanisms for the generation of multiple cell types and polarity
Development 139, 3-14, 2012
Mouse trophectoderm distinguish from inner cell mass regulated by Hippo signaling pathway
小鼠早期胚胎发育
景乃禾
中国科学院上海生物化学与细胞生物学研究所
体轴形成和原肠运动
Axis formation & Gastrulation
小鼠早期胚胎发育
Early mouse development
Preimplantation
Early mouse development
Postimplantation
