毛细管电泳法 作业
毛细管电泳标准操作规程

毛细管电泳仪毛细管电泳标准操作规程开机前准备:如进一个样品,取样品瓶七个,分别用记号笔标号,1.2.4.6.7.8.号,分别用移液枪加入1号:氢氧化钠溶液(PH=9.3纯化、消除杂离子),加盖2号:水,加盖4号:缓冲溶液,加盖5号:缓冲溶液,加盖6号:缓冲溶液,加盖7号:样品溶液,加盖(加样前过滤净化)8号:空,不加盖(废液瓶)9号:空瓶,加盖(气冲洗)(注意:各个样品瓶加样完成后超声15分钟以上,加盖,瓶盖盖严平整,3号空位,49号空位,11-48号共可装载38个样品)打开仪器电源打开软件,进入instrument,选择inti进行初始化方法编辑进入method,选择eidt entire method ,选择前两项后确认,填写实验名称并确认,设置毛细管两端与瓶底距离为4mm,设置柱温盒温度,选择inlet(进口)为4号,outlet(出口)为5号,确认。
Inlet 换成7号(样品),选择加压时间(即进样时间),再将7号换成5or6号。
进入Preconditioning,选择eidrt,设置1行,inlet为2号,outlet为8号,模式flush,2号,时间1min;2行flrsh,,inlet 换为1号,时间5min,3行wait,时间5min,4行flush,5号,时间20min(同次测定2,3行可省略)。
进样模式,设置进样压力50mbar,时间4sec,确认。
Swith设置为on,正负调节为postive,电压值30kv,确认。
设置检测波长,带宽,确认,收集为off。
确认。
保存方法。
样品注册,选择小瓶图标,选择sample information ,选择样品瓶号,输入样品信息,确认,关机进入instrument,,选择maintenance进行维护。
选择inlet,设置为2号(即水瓶),再点击蓝色气瓶图标,flash(10-20min)。
选择inlet,设置为号9号,(即气冲洗瓶)再点击蓝色气瓶图标,flash(5-20min)。
毛细管电泳操作规程

毛细管电泳操作规程1.实验前的准备a.仔细检查实验仪器和设备的工作状态,确保其正常运转。
b.准备所需的试剂和溶液,并根据规定的浓度配制好实验用溶液。
c.对毛细管进行修整,包括清洗和填充。
2.毛细管安装a.将毛细管正确地安装到电泳仪上,并确认其连接牢固。
b.检查毛细管的末端是否光滑且无毛刺。
3.毛细管填充a.将填充溶液填充到毛细管内部,直至溶液充满毛细管并超出一段长度。
b.将毛细管两端的截止器插入,防止溶液泄漏。
4.电解质的调节a.根据样品类型和分析目的,选择合适的电解质和其浓度。
b.使用注射器或微型泵将电解质注入毛细管内,需要确保注入的电解质完全润湿毛细管内壁。
5.样品处理和注入a.根据分析要求,选择合适的样品预处理方法。
b.使用注射器或微型泵将处理好的样品注入至毛细管内,确保注入顺利并不产生气泡。
6.电场的施加a.将毛细管的两端插入到电泳仪中相应的电极槽中,并确保与电极接触良好。
b.根据需要选择合适的电场强度和方向。
c.将电场施加到毛细管上并调节到所需的程度。
7.数据记录与分析a.开始电泳后,记录关键时间点的数据,如电流强度、电离峰大小等。
b.根据实验结果进行数据分析和处理,如峰面积计算、峰高度对比等。
c.按照标准操作规程进行结果的判断和报告撰写。
8.实验结束后的清洁a.实验结束后,及时关闭电泳仪和电源,并拔出毛细管。
b.用适当的清洗剂清洗毛细管和电泳仪的部件。
c.将实验室恢复到干净整洁的状态。
在进行毛细管电泳实验时,操作人员应始终保持专注并按照规程进行操作。
同时,还需要密切关注实验过程中的安全问题,如电解质的燃烧和毒性等。
实验结束后,需要对实验设备和试剂进行正确的存储和处理,以确保实验室的安全。
总之,毛细管电泳操作规程是保证实验顺利进行和结果准确的关键。
操作人员应熟悉规程内容并遵守实验室安全操作规范,确保实验的成功进行。
毛细管电泳法的原理和应用

毛细管电泳法的原理和应用1. 原理毛细管电泳法(Capillary Electrophoresis,CE)是一种基于电场作用下离子在毛细管中迁移的分离技术。
其原理基于离子在电场中带电迁移速度与其电荷量、电场强度以及溶液介质的性质相关的事实。
毛细管电泳法通过在毛细管中施加电场,利用分子的电荷差异和大小来实现分离物质的目的。
1.1 分离机制毛细管电泳法的分离机制主要包括以下几个步骤:1.进样:待测样品经过电泳柱,在毛细管中形成等电流聚焦带。
2.分离:应用电场,待测物质开始在毛细管内移动,根据分子的电荷和尺寸差异,分离成不同的带电物质。
3.检测:通过检测器对不同迁移距离的带电物质进行监测和记录。
1.2 主要影响因素影响毛细管电泳分离效果的主要因素包括:•电场强度:电场强度越高,迁移速度越快,但也容易产生电泳柱壁的热效应。
•pH 值:溶液的pH 值会影响离子的电荷状态,从而影响其迁移速度。
•温度:温度的变化会影响毛细管电泳的分离效果,通常需要控制温度来确保数据的可靠性。
2. 应用领域毛细管电泳法在许多领域中得到了广泛的应用,下面列举了其中的几个主要应用领域:2.1 生物医药领域•药物分析:毛细管电泳法可以用于药物代谢产物分析、毒性物质筛选和药物质量分析等。
•蛋白质分析:毛细管电泳法对于蛋白质的分析具有高分辨率和高灵敏度的特点,被广泛应用于蛋白质药物的质量控制和结构研究等方面。
2.2 环境监测领域•水质监测:毛细管电泳法可以用于水质中有机和无机物质的分析,可用于环境污染监测和水质安全评价等。
•大气污染物监测:毛细管电泳法可以用于大气中挥发性有机物质(VOCs)和颗粒物的分析,对于大气污染物的来源和分布有重要作用。
2.3 食品安全领域•农药残留分析:毛细管电泳法可以用于食品中农药残留的检测,对于保证食品安全和农产品质量具有重要意义。
•食品添加剂分析:毛细管电泳法可用于食品添加剂的定性和定量分析,用于食品质量控制和标签声明的验证等。
毛细管电泳实验报告(含预习报告)

毛细管电泳实验报告(含预习报告)
系别____________ 学号 ________ 姓名 _________
组别 ____ 同组姓名 ___________________
实验日期年月日星期____ 得分____
1 实验目的
2 实验原理
3 预习报告
3.1请试回答以下问题
试列举影响电渗流(大小和/或方向)的几个主要因素:___________________;
决定离子电泳淌度的参数:,,。
3.2 查找下列物质的pKa值,并初步判断出峰顺序
苯甲醇:,苯甲酸:,水杨酸:,对氨基苯甲酸:
预测出峰顺序:
3.3进样前使用三种溶液对毛细管冲洗的目的分别是什么?
3.4 试列举毛细血管电泳的主要优势和劣势。
4 实验仪器及条件
仪器型号:
毛细管总长:毛细管有效长度:检测波长:
分析电压:进样压力:进样时间:
5 实验内容
6 数据处理
6.1 数据记录
6.2 各组分浓度计算(单点外标定量法)
计算公式:
6.3 各组分淌度计算
表观淌度计算公式:
有效淌度计算公式:
7 结论及讨论
(试讨论:1.判断在另外两种缓冲液下,各个峰的归属,并对各个组分迁移时间的变化做出合理分析和讨论;2. 判断哪个组分可以作为电渗流标记物,并试根据淌度结果说明之)
8 参考文献
(附:电泳谱图)。
毛细管电泳技术及应用

4. CE中电渗流的流形
电荷均匀分布,整体移动,电渗流的流动为平流,塞式 流动(谱带展宽很小);
液相色谱中的溶液流动为层流,抛物线流型,管壁处流 速为零,管中心处的速度为平均速度的2倍(引起谱带展宽 较大)。
5. CE中电渗流的作用
电渗流的速度约等于一般离子电泳速度的5~7倍;
各种电性离子在毛细管柱中的迁移速度为:
毛细管电泳(CE)基本原理
电泳是指带电离子在电场中的定向移动,不同离子具有 不同的迁移速度,迁移速度与哪些因素有关?
当带电离子以速度ν 在电场中移动时,受到大小相等、 方向相反的电场推动力和平动摩擦阻力的作用。 电场力:FE = qE
阻 力:F = fν 故: qE = fν
q—离子所带的有效电荷; E —电场强度; ν—离子在电场中的迁移速度; f —平动摩擦系数 ( 对于球形离子: f =6πηγ;γ —离子的表观液态动力 学半径;η —介质的粘度; )
所以,迁移速度:
qE q E (球形离子) f 6π
物质离子在电场中差速迁移是电泳分离的基础。
淌度μ :单位电场强度下的平均电泳速度。
q E 6π
q—离子所带的有效电荷; E —电场强度; γ —离子的表观液态动力学半径 η —介质的粘度;
电渗现象与电渗流
electroosmosis and electroosmotic flow
展宽;尽量选择与试样淌度相匹配的背景电解质溶液。 (2)“层流”现象对谱带展宽的影响
一般情况下,CE中不存在层流,但当毛细管两端存在压 力差时,出现抛物线形的层流;
产生的原因:毛细管两端液面高度不同。 实际操作时,保持毛细管两端缓冲溶液平面高度相同。
毛细管电泳仪
毛细管电泳法的使用方法

毛细管电泳法的使用方法毛细管电泳法是一种分离和分析化学物质的常用方法,它基于物质在电场中的运动速度差异而实现分离。
适用于各种复杂样品的分析,包括生物样品、环境样品和食品样品等。
本文将介绍毛细管电泳法的使用方法。
一、实验准备1. 仪器准备:毛细管电泳仪和电泳装置是进行毛细管电泳分析的关键设备。
确保仪器完好无损,并根据仪器的使用说明进行正确操作和维护。
2. 毛细管准备:选择适当的毛细管,一般为无机硅玻璃或石英毛细管。
根据分析需求,选择不同内径和长度的毛细管。
3. 缓冲溶液准备:根据分析的目标物质的性质,选择合适的缓冲溶液。
常用的缓冲溶液包括磷酸盐缓冲液、乙酸缓冲液等。
根据需要,可以添加其他辅助剂来改善分离效果。
二、样品制备1. 样品处理:根据分析目标,选择合适的处理方法。
常见的样品处理方法包括离心、过滤、稀释、萃取等。
2. 样品溶解:将处理后的样品溶解于适当的溶剂中,并进行必要的稀释。
保证样品的浓度范围适合毛细管电泳的检测方法。
3. 样品准备:将样品注入样品瓶中,并保持封闭状态,以防止污染和样品损失。
三、实验操作1. 建立分析方法:根据样品性质和目标物质的不同,确定最适合的毛细管电泳分析方法。
包括电泳条件的选择、运行缓冲溶液的优化以及检测参数的设置等。
2. 毛细管填充:在进行毛细管电泳之前,需要将毛细管填充成电泳缓冲液中的一种或多种成分。
常用的填充方法包括静态填充法、动态填充法和电泳填充法。
3. 毛细管电泳条件的设定:根据样品的性质和分析目标的要求,设定合适的毛细管电泳条件,包括电压、电流、温度、电泳缓冲液的浓度和pH值等。
4. 样品注入和分析:将样品通过母液喷射装置或静态注射装置注入到填充好的毛细管中,然后开启电源,进行电泳分析。
5. 检测和数据分析:通过检测器对分离后的化合物进行检测,并记录峰的峰高和峰面积等参数。
利用这些数据进行数据分析和结果解释。
四、实验注意事项1. 仪器操作:严格按照仪器的使用说明进行操作,保证实验安全和设备的长期稳定性。
区带毛细管电泳法
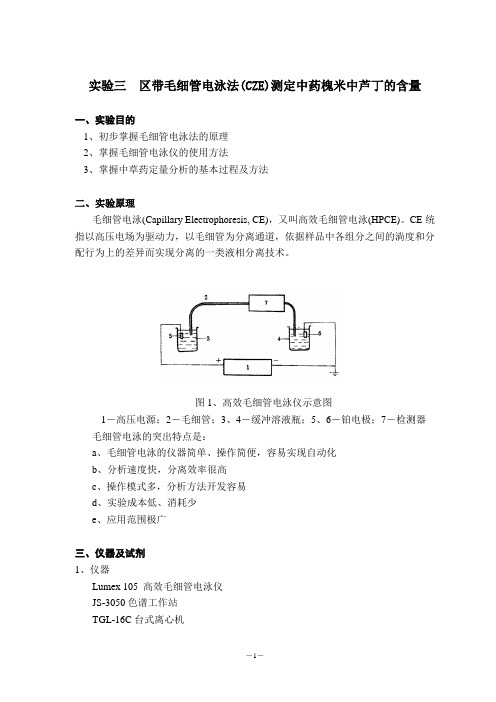
实验三区带毛细管电泳法(CZE)测定中药槐米中芦丁的含量一、实验目的1、初步掌握毛细管电泳法的原理2、掌握毛细管电泳仪的使用方法3、掌握中草药定量分析的基本过程及方法二、实验原理毛细管电泳(Capillary Electrophoresis, CE),又叫高效毛细管电泳(HPCE)。
CE统指以高压电场为驱动力,以毛细管为分离通道,依据样品中各组分之间的淌度和分配行为上的差异而实现分离的一类液相分离技术。
图1、高效毛细管电泳仪示意图1-高压电源;2-毛细管;3、4-缓冲溶液瓶;5、6-铂电极;7-检测器毛细管电泳的突出特点是:a、毛细管电泳的仪器简单、操作简便,容易实现自动化b、分析速度快,分离效率很高c、操作模式多,分析方法开发容易d、实验成本低、消耗少e、应用范围极广三、仪器及试剂1、仪器Lumex 105 高效毛细管电泳仪JS-3050色谱工作站TGL-16C台式离心机WR-E型微波样品制备系统(北京美诚公司)2、试剂槐米,芦丁标准品,无水乙醇(AR),硼砂(AR),NaOH(AR),二次蒸馏水。
四、实验步骤1、样品溶液制备(1)草药槐米经烘干、粉碎,过40目标准筛。
准确称取0.10g粉末于于50mL锥形瓶中,加入10ml乙醇,微波萃取10min。
萃取结束后,萃取液经过抽滤除去固体后,蒸干,用无水乙醇定容至25ml。
(2)将定容后的槐米提取液分装至2个5ml的离心管中,在6000rpm的转速下离心10min,取离心后的上层清液,将滤液收集合并,保留大约4ml溶液,冷冻保存,即为待测液。
2、缓冲溶液配制(1)准确称取Na2B4O7.10H2O固体9.5343g,在100ml的烧杯中用二次水溶解(需水浴加热),待固体全部溶解并冷却至室温后,定容至250ml,即得到0.1mol/L 的Na2B4O7溶液。
(2)用移液器取0.1mol/L的Na2B4O7溶液100μl用二次水稀释配制成10mmol/L的溶液1ml,稀释两份,置于1ml离心管中,用作电泳缓冲液。
化学电泳练习题凝胶电泳和毛细管电泳

化学电泳练习题凝胶电泳和毛细管电泳化学电泳练习题:凝胶电泳和毛细管电泳电泳技术是一种常用的分离和检测化学物质的方法,凝胶电泳和毛细管电泳是其中最常见和重要的两种电泳方法。
本文将介绍凝胶电泳和毛细管电泳的原理、应用、优缺点以及实验操作技巧。
一、凝胶电泳凝胶电泳是一种将带电分子通过凝胶基质的孔隙进行分离的电泳方法。
根据凝胶基质的种类,凝胶电泳分为聚丙烯酰胺凝胶电泳(PAGE)和琼脂糖凝胶电泳(agarose gel electrophoresis)两种。
1. 原理及实验步骤在PAGE中,聚丙烯酰胺凝胶作为分离基质,通过对应电极施加电压,在电场作用下,带电分子沿着电场方向缓慢迁移,根据分子大小和电荷差异,使不同的分子能够在凝胶中被分离。
而琼脂糖凝胶电泳则是利用琼脂糖凝胶作为基质,通过移动电荷沿电场迁移的方式实现分离。
凝胶电泳实验步骤一般包括样品制备、样品加载、电泳运行和染色检测。
首先,将待分离的样品加入至样品电泳缓冲液中,并进行热变性或添加染料等处理;然后,将样品加载到凝胶槽中的凝胶孔隙中;接着,在电泳槽中施加电压进行电泳运行;最后,通过染色或荧光检测等方式观察和分析分离结果。
2. 应用及优缺点凝胶电泳广泛应用于蛋白质、核酸等生物大分子的分离和分析领域。
例如,在蛋白质领域,PAGE可以用于分离复杂的蛋白质混合物,如血清、组织提取物等,并进一步用于检测表达差异、寻找特定蛋白质等。
在核酸领域,琼脂糖凝胶电泳可用于分离检测DNA片段,如PCR产物等。
凝胶电泳的优点是操作简单、成本较低,可以获得较高的分辨率和分离效果。
但由于凝胶孔隙大小固定和限制,无法适应较大分子的分离和分析需求,且分离速度较慢。
二、毛细管电泳毛细管电泳是一种基于毛细管内壁进行分离的电泳技术,常用的毛细管电泳有毛细管凝胶电泳和毛细管毛细液层色谱电泳两种。
1. 原理及实验步骤毛细管凝胶电泳实质上是将凝胶电泳的原理应用在毛细管中。
通过在毛细管内壁涂覆一层凝胶作为分离基质,并在电场作用下,待分离的样品通过凝胶孔隙进行分离,将不同成分的分子进行分离。
实验9 毛细管电泳法在材料分析中的应用(黄宝美)

实验九毛细管电泳法在材料分析中的应用一实验目的1.进一步理解毛细管电泳的基本原理;2.熟悉毛细管电泳仪器的构成;3.了解影响毛细管电泳分离的主要操作参数。
二实验原理1.电泳淌度毛细管电泳(CE)是以电渗流 (EOF)为驱动力,以毛细管为分离通道,依据样品中组分之间淌度和分配行为上的差异而实现分离的一种液相微分离技术。
离子在自由溶液中的迁移速率可以表示为:ν = μE (1)式中ν是离子迁移速率,μ为电泳淌度,E为电场强度。
对于给定的荷电量为q)和通过介质所受到的离子,淌度是其特征常数,它由离子所受到的电场力(FE的摩擦力(F)的平衡所决定。
F= qE (2)FE对于球形离子:= -6πηrν(3)FF式中η为介质粘度,r为离子的流体动力学半径。
在电泳过程达到平衡时,上述两种力方向相反,大小相等:qE= -6πηrν(4)因此,离子的电泳淌度与其荷电量呈正比,与其半径及介质粘度呈反比。
带相反电荷的离子其电泳淌度的方向也相反。
需要指出,我们在物理化学手册中可以查到的离子淌度常数是绝对淌度,即离子带最大电量时测定并外推至无限稀释条件下所得到的数值。
在电泳实验中测定的值往往与此不同,故我们将实验值称为有效淌度(μ)。
有些物质因为绝对淌度相同而难以分离,但我们可以通过改e变介质的pH值,使离子的荷电量发生改变。
这样就可以使不同离子具有不同有效淌度,从而实现分离。
下文中所提到的电泳淌度除特别说明外,均指有效淌度。
2.电渗流和电渗淌度电渗流(EOF)是CE中最重要的概念,指毛细管内壁表面电荷所引起的管内液体的整体流动,来源于外加电场对管壁溶液双电层的作用。
Zeta电势主要取决于毛细管表面电荷的多寡。
一般来说,pH越高,表面硅羟基的解离程度越大,电荷密度越大,电渗流速率就越大。
除了受pH的影响外,电渗流还与表面性质(硅羟基的数量、是否有涂层等)、溶液离子强度有关,双电层理论认为,增加离子强度可以使双电层压缩,从而降低Zeta电势,减小电渗流。
毛细管电泳法测定阿司匹林中的水杨酸(精)

毛细管电泳法测定阿司匹林中的水杨酸一、实验目的1 进一步理解毛细管电泳的基本原理;2 熟悉毛细管电泳仪器的构成;3 了解影响毛细管电泳分离的主要操作参数。
二、实验原理:毛细管电泳又称高效毛细管电泳( High Performance Capillary Electrophoresis, HPCE) 是一种仪器分析方法。
通过施加10-40kV 的高电压于充有缓冲液的极细毛细管,对液体中离子或荷电粒子进行高效、快速的分离。
现在,HPCE 已广泛应用于氨基酸、蛋白质、多肽、低聚核苷酸、DNA 等生物分子分离分析,药物分析,临床分析,无机离子分析,有机分子分析,糖和低聚糖分析及高聚物和粒子的分离分析。
人类基因组工程中DNA 的分离是用毛细管电泳仪进行的。
1.仪器结构毛细管电泳较高效液相色谱有较多的优点。
其中之一是仪器结构简单(见图1)。
它包括一个高电压源,一根毛细管,紫外检测器及计算机处理数据装置。
另有两个供毛细管两端插入而又可和电源相连的缓冲液池。
high-v oltagepower supply BufferV ialBuffer V ial Detector Recording dev icecapillaryElectrode Electrode2.分离原理毛细管中的带电粒子在电场的作用下,一方面发生定向移动的电泳迁移,另一方面,由于电泳过程伴随电渗现象,粒子的运动速度还明显受到溶液电渗流速度的影响。
粒子的实际流速 V 是泳流速度 Vep 和渗流速度 Veo 的矢量和。
即:V = V ep + Veo (1)电渗是一种液体相对于带电的管壁移动的现象。
溶液的这一运动是由硅/水表面的Zeta 势引起的。
CE 通常采用的石英毛细管柱表面一般情况下(pH>3)带负电。
当它和溶液接触时,双电层中产生了过剩的阳离子。
高电压下这些水合阳离子向阴极迁移形成一个扁平的塞子流,如图2。
毛细管管壁的带电状态可以进行修饰,管壁吸附阴离子表面活性剂增加电渗流,管壁吸附阳离子表面活性剂减少电渗流甚至改变电渗流的方向。
毛细管电泳分析技术的使用方法

毛细管电泳分析技术的使用方法毛细管电泳(Capillary Electrophoresis,CE)是一种基于电场作用在毛细管中对溶液中带电分子进行分析和分离的方法。
这种分析技术广泛应用于药学、食品安全、环境检测等领域。
本文将介绍毛细管电泳分析技术的使用方法,包括样品准备、背景电解质的选择、操作步骤、结果解读等方面。
一、样品准备在进行毛细管电泳分析之前,需要对样品进行准备。
首先,要保证样品的纯度和浓度。
若样品存在杂质,可能影响电泳分析的准确性。
其次,要选择合适的溶剂来溶解样品,避免样品组分的析出或溶解度的不足。
最后,需要对样品进行过滤处理,去除悬浮颗粒和固体杂质,以避免堵塞毛细管。
二、背景电解质的选择背景电解质(Buffer)在毛细管电泳中起到平衡电荷、调节pH值和提供可控电导率的作用。
选择一个适当的背景电解质对于保持稳定的电泳性能非常重要。
常用的背景电解质有磷酸盐缓冲液、甘氨酸缓冲液等。
选择时应考虑样品的特性,如酸碱性、离子强度等。
三、操作步骤1. 准备毛细管:首先要选择合适的毛细管,通常为多孔硅毛细管或厌氧硅毛细管,其内径一般在25-100 μm之间。
将毛细管切割至适当长度,并使用电泳缓冲液填充。
2. 运行条件设定:设置电压,通常为10-30 kV,电压过高或过低都可能影响分离效果。
调节温度,电泳分析通常在20-30℃进行,可根据具体分析物的特性进行调整。
3. 样品注射:将样品通过毛细管的一端注入,在电场的作用下,样品被迫进入毛细管。
4. 运行分析:开启电源,启动电泳分析。
分析过程中要注意检测信号的稳定性和峰形,判断分离情况。
四、结果解读在毛细管电泳分析完成后,需要对结果进行解读。
主要通过对峰面积、峰高度、电泳时间等参数进行分析,以获得所需的定性或定量信息。
同时,可以通过与标准物质进行比较来确认分析物的存在、纯度和浓度。
在解读结果时,需要注意以下几个方面:1. 峰的形状:正常情况下,峰应呈现尖峰形状,表示分离良好。
毛细管凝胶电泳技术

毛细管凝胶电泳技术毛细管电泳技术(Capillary Electrophoresis, CE)又称高效毛细管电泳(HPCE)或毛细管分离法(CESM),是一类以毛细管为分离通道、以高压直流电场为驱动力,根据样品中各组分之间迁移速度和分配行为上的差异而实现分离的一类液相分离技术,迅速发展于80年代中后期,它实际上包含电泳技术和色谱技术及其交叉内容,是分析科学中继高效液相色谱之后的又一重大进展。
1987年,Cohen发表了毛细管凝胶电泳的工作。
当电泳从凝胶板上移到毛细管中以后,发生了奇迹般的变化:分析灵敏度提高到能检测一个碱基的变化,分离效率达百万理论塔板数;分析片段能大能小,小到分辨单个核苷酸的序列,大到分离Mb的DNA;分析时间由原来的以小时计算缩减到以分、秒计算。
CE可以说是经典电泳技术与现代微柱分离技术完美结合的产物。
一.毛细管凝胶电泳的原理不同分子所带电荷性质、多少不同,形状、大小各异。
一定电解质及PH的缓冲液或其它溶液内,受电场作用,样本中各组分按一定速度迁移,从而形成电泳。
电泳迁移速度(v)可用下式表示:v=uE其中E为电场强度(E=V/L,V为电压,L为毛细管总长度)。
u为电泳淌度。
毛细管凝胶电泳是将板上的凝胶移到毛细管中作支持物进行的电泳。
凝胶具有多孔性,起类似分子筛的作用, 溶质按分子大小逐一分离。
凝胶粘度大, 能减少溶质的扩散, 所得峰形尖锐, 能达到CE中最高的柱效。
电流通过导体时产生焦耳热。
传统平板凝胶电泳的最大局限性在于其无法克服两端高电压带来的焦耳热所产生的负面影响。
焦耳热可使筛分介质内部出现温度、粘度及分离速度的不均一,影响迁移、降低效率、使区带变宽。
由于这种负面影响与电场强度成正比,所以极大地限制了高电压的引入。
也难以提高电泳速度。
毛细管电泳使样品在一根极细的柱子中进行分离。
细柱可减小电流,使焦耳热的产生减少;同时又增大了散热面积,提高散热效率,大大降低了管中心与管壁间的温差,减少了柱子径向上的各种梯度差,保证了高效分离。
毛细管电泳专题作业

毛细管电泳专题作业
06120801
申文伊
20081899
一.针对本专题你有哪些不理解不懂的问题和疑惑?
在听完屈峰老师的讲座后,我在课下查找了一些关于毛细管电泳这方面的资料,其中不理解不同的问题疑惑有一下几个:
1.石英材质的毛细管内表面在PH>3的情况下带负电,而在等电聚焦中,用两性电解质CAS
溶液形成ph梯度,如何可以保证这个梯度从ph=1到ph=14呢?是否因为蛋白质大多数的酸性不是太强所以可以忽略掉ph=1~ph=3这个范围呢?是否这也是悬着石英材质的毛细管的原因之一?
2.为什么说毛细管中电渗速度比电泳速度打一个数量级,就不可以实现样品组分同向泳动
呢?
3.采用聚丙烯酰胺涂层毛细管与CAs固定毛细管的偶联,可以避免碱性蛋白的吸附,为什么还可以使得等电点在pH3—10的蛋白质能有效的被检测到,拓宽了有效检测范围呢?
二.你对毛细管电泳这一技术和方法的看法?
我的看法主要有一下几点:
1.CE的应用非常广泛,由于CE具有多中分离介质和原理,它的功能叶很多,小到无机离子,大到生物大分子,甚至整个细胞,它也广泛应用于生命科学、医药科学、分子生物学、化学、环境、海关等领域。
2.上回在院长双星课题组看到了一台CE仪器,价格惊人,我想仪器价格这么昂贵,很难普遍推广,这还有很大的提升空间,而且在将CE与其它方法和技术(如HPLC、MS等)联合使用,以收到更好的效果,相信这也是今后CE技术研究、完善的方向和课题。
3.影响CE的因素有很多,如缓冲液、ph值、分离电压、温度、添加剂以及进样等,在试验过程中,一定要全面考虑多方面因素来保证实验的顺利进行。
色谱毛细管电泳法

第33页,共61页。
•测定方法
• 取约1.5g的内容物,精密称定,置于10ml量瓶中,用水 冲洗瓶内壁,洗液与样品合并,加水溶解并稀释至刻度, 混匀。用0.22m微孔滤膜过滤后,在上述电泳条件下进样, 记录维生素B12和D-生物素的峰面积
• 另精密量取上述样品溶液1.0ml,置于100 ml量瓶中,加 水稀释至刻度、摇匀,同法测定,记录VB1,VB6,VC、烟 酰氨、叶酸、核黄素磷酸钠、泛酸钠的峰面积,按外 标法计算样品含量
迁移速度()可用下式表示:
= eE
(1)
–e为电泳淌度
–E为电场强度(V/L)——是外加电压和毛细
管长度的函数
4
第4页,共61页。
•电泳迁移原理
• 对于给定的离子和介质,淌度e为离子的特征 常数,其大小取决于分子所受的电场力FE和其 通过介质时的摩擦力FF的平衡:
FE = qE
(q为离子电量)
FF= -6r
的选择性 • 在分离中性物质时,所有溶质都在t0与tm之间流出。亲
水性溶质随EOF流出,被胶束完全保留的溶质随胶束流 出。控制条件,采用中等程度的EOF和高迁移率的胶束, 以扩大时间窗口,提高分离度
29
第29页,共61页。
•中性溶质的流出时间窗口示意图
时间窗口
溶质
EOF
胶束
t0
t0
tR1
tR2
tR3
色谱毛细管电泳法
1
第1页,共61页。
概述
• 毛细管电泳又叫高效毛细管电泳 (HPCE),是80年代初 发展起来的一种新型分离分析技术,它是电泳技术与层 析技术相结合的产物
• 广泛用于生物大分子,手性药物,生物体内的药物及 代谢物,中西药物及其制剂等的分析,在选择性上与 高效液相法有很大的互补性
毛细管电泳实验
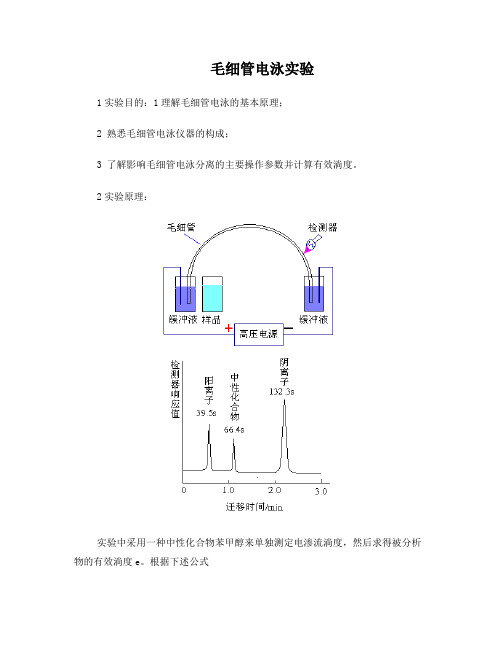
毛细管电泳实验1实验目的:1理解毛细管电泳的基本原理;2 熟悉毛细管电泳仪器的构成;3 了解影响毛细管电泳分离的主要操作参数并计算有效淌度。
2实验原理:实验中采用一种中性化合物苯甲醇来单独测定电渗流淌度,然后求得被分析物的有效淌度e。
根据下述公式,其中l和L毛细管有效长度和总长度,t迁移时间,V为分离电压,a为表观淌度。
先计算出电渗淌度以及不同离子的表观淌度,再求出有效淌度。
注意,阴离子的有效淌度为负值,因为其电泳淌度与电渗淌度的方向相反。
3实验设备:一台Beckman毛细管电泳仪,实验用毛细管总长度为48.5cm,有效长度(从进样口到检测点的距离)为40cm,分离电压为20kV。
4仪器及试剂:5 mL移液管2只,1mL 移液管共2支,分别标上四种标样的标签,两组公用。
每组10 mL容量瓶2个,滴管2支,分别标上标准、未知的标签。
塑料样品管共16个,每组8个,分别用于标准样品、未知样品、三种缓冲溶液、NaOH、水和废液,做好标号。
滴瓶一共5个,分别装三种缓冲液(buffer)、1mol/L的NaOH和乙醇。
镊子、洗瓶、吸耳球、试管架、塑料样品管架、废液烧杯每组一个。
剪刀一把,记号笔一支,滤纸。
标样:苯甲醇、苯甲酸、水杨酸、对氨基水杨酸,均溶于二次水中,浓度1.00 mg/mL,作为标准品。
缓冲溶液(buffer):10 mmol/L NaH2PO4-Na2HPO4 1:1缓冲溶液(NaH2PO4和Na2HPO4 各5mMol/L);20 mmol/L NaH2PO4-Na2HPO4 1:1缓冲溶液(NaH2PO4和Na2HPO4 各10mMol/L),。
1mol/L NaOH溶液,二次去离子水。
5实验步骤:1.仪器的预热和毛细管的冲洗:在实验教师的指导下,打开仪器和配套的工作站。
工作温度设置为30℃,不加电压,冲洗毛细管,顺序依次是:1 mol/L NaOH溶液5 min,二次水5 min,10 mmol/L NaH2PO4-Na2HPO4 1:1缓冲溶液5 min,冲洗过程中出口(outlet)对准废液的位置。
毛细管电泳测定

冲液的浓度对 ECL 强度有很大影响。实验证明, 当 Ru( bpy ) 3 浓度为 5 mmol/ L, 磷酸盐缓冲液浓 度为 50 mmol/ L 时 , 氢 溴 酸右 美 沙芬 有 满意 的 ECL 强度和最大信噪比。 施加在工作电极上的检测电位也是影响 ECL 强度 的 一 个 重 要 因 素。 检 测 电 位 在 1 05 ~ 1 35 V 范围 内变 化, 相应 的氢 溴酸 右 美沙 芬的 ECL 强度如图 2 所示, 可见在 1 15 V 左右, 氢溴 酸右美沙芬的 ECL 强度达到最大值。本文选择 1 15 V 为测定氢溴酸右美沙芬的检测电位。
图2
检测电位对电致化学发光强度的影响
Fig. 2 The effect of detection potential on electrochemiluminescence ( ECL) intensity
转变成 Ru( bpy)
2+
2+ 3
。最后 , Ru( bpy)
2+ * 3
发
光, 且回到 Ru( bpy) 3
2 3
优化分离条件
decloxizine hydrochloride and clorprenaline hydrochloride in phosphate solution ( pH 8 0) at bare Pt electrode
2 2
优化 ECL 检测条件 ECL 检测池中 Ru( bpy) 2+ 3 的浓度和磷酸盐缓
基态。
检测电位 : 1 15 V ; 其余条件同图 2 磷酸盐类缓冲液 ( pH 8 0) ; 扫描速率 : 50 mV/ s。 1. 空白磷 酸盐类缓冲液; 2. 磷酸盐缓 冲液 和 5 mmol/ L Ru ( bpy) 2+ 3 体系 的循环伏安图; 3. 磷酸盐缓 冲液 和 5 mmol/ L Ru ( bpy) 2+ 3 体系 与 2 5 mmol/ L 氢溴酸右美沙芬混合体的循环伏安图。
72毛细管电泳法

2 电泳和电渗
1. 2. 3.
电渗流的意义
分情况而论
电泳过程中,伴随着电渗现象 电渗流的速度比电泳速度快5-7倍 利用电渗流可将正、负离子或中性分子一起向同 一方向,产生差速迁移,在一次电泳操作中同时 完成正、负离子的分离分析
电渗流是毛细管电泳分离的重要参数 控制电渗流的大小和方向,可提高毛细管电 泳分离的效率、重现性、分离度。
3 毛细管凝胶电泳
CGE 是毛细管自由溶液区带电泳派生出的一种电泳方 式 用多孔性的凝胶或其它筛分剂作介质,网状结构, 按分子的大小分离
3 毛细管凝胶电泳
毛细管凝胶电泳综合了电泳技术和平板凝胶电泳 的优点 : 1. 电泳峰尖锐,柱效极高 2. 短柱上实现极好的分离 3. 试样容量为10-12g 主要缺点:制备柱较困难,寿命较短 已成为分离分析生物大分子如蛋白质、多肽、核 酸、 DNA 等强有力的工具。例应用 CGE 分离与 激光诱导荧光检测相结合,用于 DNA 序列快速 分析。
3 分离效率和分离度
分离度计算式
Rs = 2 (tm2 - tm1 ) / ( W1 + W2 )
tm1、tm2 分别为两个组份的迁移时间 W 为峰底的宽度
4 区带宽度及其展宽因素
区带宽度
时间宽度
Ws =(Wt﹒l/tm)-Wd
检测器的窗口宽度 空间宽度
4 区带宽度及其展宽因素
1. 2. 3. 4.
通用性 选择性,灵敏度高,微量 仪器复杂,可获结构信息, 质量灵敏度高 灵敏度高,操作有特殊要求
放射
10-9-10-11
四 应用
阵列毛细管凝胶电泳分析DNA序列 硬件由十六条毛细管组成阵列 用氩激光激发荧光检测 CCD检测器接收荧光
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
带电粒子的迁移速度=电泳和电渗流速度的矢量和。 正离子:两种效应的运动方向一致,在负极最先流出; 中性粒子:无电泳现象,受电渗流影响,在阳离子后流 出; 阴离子:两种效应的运动方向 相反;ν
电渗流
>ν
电泳时,阴离子在
负极最后流出,在这种情况下,不但 可以按类分离,同种类离子由于差 速迁移被相互分离。 最基本、应用广的分离模式;
2、分离过程
电场作用下,毛细
管柱中出现:电泳现 象和电渗流现象。
带电粒子的迁移速度=电泳+电渗流;两种速度的矢量和。 正离子:两种效应的运动方向一致,在负极最先流出; 中性粒子无电泳现象,受电渗流影响,在阳离子后流出; 阴离子:两种效应的运动方向相反。ν电渗流 >ν电泳时,阴 离子在负极最后流出,在这种情况下,不但可以按类分离,除中 性粒子外,同种类离子由于受到的电场力大小不一样也同时被 相互分离。
apVLef
DL
平均
平均
ap1 ap2
2
影响分离度的主要因素;工作电压V;毛细管有效长度 与总长度比;有效淌度差。分离度可按谱图直接由下式计算:
2(t 2 t1 ) R W2 W1
t1、t2 分别为两个组份的迁移时间 W 为峰底的宽度
三、影响分离效率的因素—区带展宽
毛细管电泳法
Capillary Electrophoresis, CE
分析化学
陈朵花 14109030980
一、概述
generalization
在电解质溶液中,位于电场中的带电离子在电场力的作 用下,以不同的速度向其所带电荷相反的电极方向迁移的现 象,称之为电泳。由于不同离子所带电荷及性质的不同,迁 移速率不同,可实现分离。 1937年,Tiselius(瑞典)将蛋白质混合液放在两段缓冲 溶液之间,两端施以电压进行自由溶液电泳,第一次将人血 清提取的蛋白质混合液分离出白蛋白和α、β、γ球蛋白; 发现样品的迁移速度和方向由其电荷和淌度决定; 第一次的自由溶液电泳;第一台电泳仪; 1948年,获诺贝尔化学奖;
3. HPCE中电渗流的流形
电荷均匀分布,整体移动,电渗流的流动为层流,塞式 流动(谱带展宽很小);
液相色谱中的溶液流动为层流,抛物线流型,管壁处流 速为零,管中心处的速度为平均速度的2倍(引起谱带展宽 较大)。
4 电泳和电渗
– 电渗流的表示
电渗流的大小可用淌度(μeo)或电渗流系数表示
μeo =υeo / E = l /( teo﹒E )
分离效率和分离度
–分离效率 柱效可以用理论塔板数n表示
n = (µep+µeo) V l /(2DL)
毛细管电泳分离的柱效方程 理论塔板高
H =L / n n = 5.54(χ/ W½ )2
实验上可按上式求出理论塔板数
χ为电泳图上从起点至电泳峰最大值之间的距离
W½ 为电泳峰的半高峰宽
分离度
R 0.177
4 毛细管壁对组分的吸附 电泳峰拖尾或变形,甚至消失。
抑制吸附作用常用的方法有: ●使用极端pH条件 ●加入中性盐或两性离子化合物 ●对毛细管内壁进行涂层处理
需要注意:方法也会抑制或改变电渗流
四 毛细管电泳的主要分离模式
• 毛细管区带电泳(capillary zone electrophoresis,CZE) • 胶束电动色谱(micellar electrokinetic chromatography, MEKC) • 毛细管凝胶电泳(capillary gel electrophoresis, CGE) • 毛细管等速电泳(capillary isotachophoresis, CITP) • 毛细管等电聚焦(capillary isoelectric focus, CIF) • 毛细管电色谱(capillary electrochromatography, CEC)
电渗流速度 毛细管有效长度 电渗流流出时间
电场强度
5. HPCE中电渗流的作用
电渗流的速度约等于一般离子电泳速度的5~7倍; 各种电性离子在毛细管柱中的迁移速度为: ν ν
+ 0
=ν =ν
电渗流 电渗流 电渗流
+ ν - ν
+ef -ef
阳离子运动方向与电渗流一致; 阴离子运动方向与电渗流相反;
ν
经典电泳分析
traditional electrophoresis
利用电泳现象对某些化学或生物物质进行分离分析的方 法和技术叫电泳法或电泳技术。 按形状分类:U型管电泳、柱状电泳、板电泳; 按载体分类:滤纸电泳、琼脂电泳、聚丙烯酰胺电泳、 自由电泳; 传统电泳分析:操作烦琐,分离效率低,定量困难,无 法与其他分析相比。
factors influenced the efficiency—band broadening
–区带宽度展宽因素 1. 焦耳热 2. 进样 3. 电泳扩散 4. 毛细管壁对组分的吸附
三、影响 influenced the efficiency—band broadening
=ν
中性粒子运动方向与电渗流一致;
(1)可一次完成阳离子、阴离子、中性粒子的分离; (2)改变电渗流的大小和方向可改变分离效率和选择性, 如同改变LC中的流速; (3)电渗流的微小变化影响结果的重现性; 在HPCE中,控制电渗流非常重要。
6、HPCE中影响电渗流的因素
factors influenced electroosmosis 1).电场强度的影响
一)、毛细管区带电泳
capillary zone electrophoresis ,CZE 毛细管电泳最基本的分离模式。背景电解质是缓冲液,分离 是基于样品中各个组分间质荷比的差异。有时需在缓冲液中 加入一定的添加剂,用以提高分离选择性,改变电渗流的大 小、方向或抑制毛细管壁的吸附等。 在CZE中,影响分离的操作条件为: √ 分离电压 √背景电解质种类、浓度和pH √添加剂种类和浓度
当固体与液体接触时,固体表面由于某种原因带一种电 荷,则因静电引力使其周围液体带有相反电荷,在液-固界 面形成双电层,二者之间存在电位差。 当液体两端施加电压时, 就会发生液体相对于固体表面 的移动,这种液体相对于固体 表面的移动的现象叫电渗现象。 电渗现象中整体移动着的 液体叫电渗流(electroosmotic flow ,简称EOF)。
在3.1min内分离36种无机及有机阴离子,4.1min内分 离了24种阳离子;分离柱效:105~107/m理论塔板数;
3.操作方便、消耗少
进样量极少,水介质中进行;
4.应用范围极广
有机物、无机物、生物、中性分子;生物大分子等;
分子生物学、医学、药学、化学、环境保护、材料等;
二、电渗现象与电渗流
electroosmosis and electroosmotic flow 1.电渗流现象
电渗流速度和电场强度成正比,当毛细管长度一定时, 电渗流速度正比于工作电压。
2).毛细管材料的影响
不同材料毛细管的表面电 荷特性不同,产生的电渗流大 小不同;
3. 电解质溶液性质的影响
(1)溶液pH的影响 对于石英毛细管,溶液pH增高时,表面电离多,电荷密 度增加,管壁zeta电势增大,电渗流增大,pH=7,达到最大; pH<3,完全被氢离子中和,表面电中性,电渗流为零。分析 时,采用缓冲溶液来保持pH稳定。 (2)阴离子的影响 在其他条件相同,浓度相同而阴离子不同时,毛细管中 的电流有较大差别,产生的焦耳热不同。
1981年,Jorgenson等用75μ m内径石英毛细管进行电泳 分析,柱效高达40万/m,促进电泳技术发生了根本变革,迅 速发展成为可与GC、HPLC相媲美的崭新的分离分析技术—— 高效毛细管电泳。
高效毛细管电泳的特点
1.仪器简单、易自动化
电源、毛细管、检测器、溶液瓶
2.分析速度快、分离效率高
六) 毛细管等电聚焦
capillary isoelectric focusing,CIEF
1. 根据等电点差别分离生物大分子的高分辨率电泳技术; 2. 毛细管内充有两性电解质(合成的具有不同等电点范围的 脂肪族多胺基多羧酸混合物),当施加直流电压(6~8V)时, 管内将建立一个由阳极到阴极逐步升高的pH梯度; 3. 氨基酸、蛋白质、多肽等的所带电荷与溶液pH有关,在酸 性溶液中带正电荷,反之带负电荷。在其等电点时,呈电中性, 淌度为零;
3.焦耳热与温度梯度的影响
电泳过程产生的焦耳热可由下式计算:
V I 2 Q Λm cb E 2 πr L
m—电解质溶液的摩尔电导;I—工作电流:cm—电解质浓度;
散热过程中,在毛细管内形成温度梯度(中心温度高),破 坏了塞流,导致区带展宽。
改善方法: (1)减小毛细管内径; (2)控制散热;
温度每变化1度,将引起背景电解质溶液黏度变化2%~3%;
5. 添加剂的影响
(1)加入浓度较大的中性盐,如K2SO4,溶液离子强度增大, 使溶液的黏度增大,电渗流减小。
(2)加入表面活性剂,可改变电 渗流的大小和方向;
加入不同阳离子表面活性剂 来控制电渗流。 加入阴离子表面活性剂,如 十二烷基硫酸钠(SDS),可以使 壁表面负电荷增加,zeta电势增 大,电渗流增大; (3)加入有机溶剂如甲醇、乙腈, 使电渗流增大。
缓冲溶液离子强度,影响双电层的厚度、溶液黏度和工 作电流,明显影响电渗流大小。缓冲溶液离子强度增加,电 渗流下降。
4. 温度的影响
毛细管内温度的升高,使溶液的黏度下降,电渗流增大。
温度变化来自于“焦耳热”; 焦耳热:毛细管溶液中有电流通过时,产生的热量; HPCE中的焦耳热与背景电解质的摩尔电导、浓度及电场强 度成正比。
2. 电泳流和电渗流的方向相反,且ν 负电胶束以较慢的速度向负极移动;
