医疗器械不良反应报告记录
医疗器械不良反应报告表格和例子样本

附件1:国家食品药物监督管理局制
可疑医疗器械不良事件报告表
报告日期:年月日编码: 报告来源: 生产公司 经营公司 使用单位单位名称:
联系地址:邮编:联系电话:
报告人签名:
例子:
附
件
1
:国家食品药物监督管理局制
可疑医疗器械
不良事件报告表
报告日期:10月25日 编 码:
报告来源: 生产公司 经营公司 √使用单位 单位名称:按实际填写
联系地址:按实际填写 邮 编: 联系电话:
报告人: 医师 技师 护士 其她
报告人签名:
例子2 附
件
1
:
国家食品药物监督管理局制
可疑医疗器械不良事件报告表 报告日期: 年 10 月 8日 编 码: 报告来源: 生产公司 经营公司 √ 使用单位 单位名称:
报告人: 医师 √ 技师 护士 其她
联系地址: 邮 编: 联系电话:
报告人签名:
报告人: 医师 技师
护士 √ 其她。
器械不良反应记录

医疗器械不良反应事件监测报告管理制度为加强我院医疗器械安全监测和管理,规范我院医疗器械不良反应事件报告和管理制度,根据国家食品药品监督管理司《医疗器械不良反应报告和监测管理办法》及国家相关法规及管理办法,制定制度如下。
1、组织领导医院成立医疗器械不良反应监测管理小组,领导和组织全院医疗器械不良反应事件的处理。
监测管理小组的日常具体工作由医疗器械科负责。
2、报告范围发生以下医疗器械不良反应事件必须报告监测管理小组:(1) 医疗器械不良反应(合格医疗器械正常用法的意外有害后果)。
(2) 医疗器械质量缺陷(假、劣)导致的不良反应事件。
(3) 使用不当导致的不良反应事件。
3、医疗器械不良反应的报告程序(1) 医疗器械不良反应事件实行逐级、定期报告制度。
必要时,可采取越级报告制度。
临床科室发现医疗器械不良反应必须及时报告。
(2) 医院建立医疗器械不良反应监控网络,由各临床科室制定专人负责医疗器械不良反应联络工作(科室联络员),负责本科室的医疗器械不良反应的搜集、汇总、上报,监督协调医护人员不良反应的报告。
(3) 各临床科室医护人员应高度重视医疗器械不良反应事件的报告和监测工作,密切关注和发生随时收集本科的医疗器械不良反应,一经发现医疗器械不良反应须及时进行详细记录、调查,及时准确填写《可疑医疗器械不良事件报告》,并按规定将填好表格上交科室联络员或医院医疗器械不良反应监测管理小组。
(4) 发现严重、罕见的不良反应病例,应先经医护人员诊治和处理,并做好医疗器械的留样、保存和记录工作,在24小时内报告给本科不良反应联络员和医院医疗器械不良反应监测管理小组,其中死亡病例必须在8小时内报告。
(5) 发现医疗器械严重不良反应或群体不良事件或死亡病例须在8小时内报告给本科不良反应联络员和医院医疗器械不良反应监测管理小组,并及时填写《医疗器械突发性群体不良事件基本信息表》。
(6) 医院医疗器械不良反应事件监测管理小组安排专门人员及时收集、整理,并按规定日期向国家医疗器械不良反应监测中心报告。
医疗器械不良事件调查报告记录表

3.医疗器械产品标准;
4.医疗器械检测机构出具的检测报告;
5.产品标签;
6.使用说明书复印件;
7.产品年产量、销量;
8.用户分布及联系方式;
9.本企业生产同类产品名称、标识及临床应用情况。
D.监测机构评价意见
报告人:
省级监测机构பைடு நூலகம்收日期:
国家监测机构接收日期:
生产企业(签章)
医疗器械不良事件调查报告记录表
医疗器械不良事件调查、报告记录表
报告时间: 年 月 日
A. 企业信息
企业名称:
传真:
企业地址:
邮编:
联系人:
电话:
事件涉及产品:
B.事件跟踪信息(至少包括:患者资料、调查分析及控制措施)
C.产品信息
请依次粘贴或装订下列材料(要求采用A4纸张):
1.医疗器械生产许可证复印件(境内企业);
省级监测机构(签章)
医疗器械不良反应报告表格和例子

医疗器械不良反应报告表格和例子
(1)!203
患者信息:张三,男,45岁,身高175cm,体重80kg,诊断为高血压。
使用器械为某某降压仪,使用时间为3天。
不良反应为头痛、恶心。
分析:张三使用某某降压仪后出现头痛、恶心的不良反应,可能与该器械的使用有关。
可能是因为器械的某种成分对患者的身体产生了不良反应,或者是因为使用方法不当导致的。
此病例提醒医生在使用该器械时应充分了解其成分和使用方法,并密切关注患者的不良反应情况。
建议:医生应告知患者可能出现的不良反应,并密切观察患者的反应情况。
如果不良反应持续或加重,应及时停药并采取相应措施。
同时,医生应认真阅读器械说明书,掌握正确的使用方法。
在选用降压仪时,医生应充分了解其成分和作用机制,根据患者的具体情况进行选择。
器械不良反应报告制度范本(3篇)

器械不良反应报告制度范本尊敬的领导:我根据《器械不良反应报告制度》的要求,就近期发生的器械不良反应进行了整理和归纳,现将报告如下:1. 器械名称:XXXXX简要描述:XXXXX是一种用于治疗血压异常的药物。
使用过程中,出现了一起严重的过敏反应,患者出现呼吸困难、皮肤潮红、心悸等症状。
添附患者病历和医院护理记录。
处理情况:立即停止使用该药物,给予抗过敏治疗,并密切监测患者情况。
后续随访显示症状缓解。
2. 器械名称:XXXXX简要描述:XXXXX是一种外科手术器械。
使用过程中,医生反馈该器械存在操作不便、易滑脱等问题。
这导致手术过程中的不稳定情况。
处理情况:经过与生产商的沟通和反馈,生产商承诺对器械进行改进,并提供了使用手册的更新版本。
医院将与生产商密切合作,确保新版本的器械安全使用。
3. 器械名称:XXXXX简要描述:XXXXX是一种心脏搏动监测仪器。
在使用过程中,出现了一起数据显示不准确的情况,导致医生误判了患者的心脏状况。
处理情况:立即停止使用该监测仪器,并通知生产商进行检修。
同时对患者进行其他检查以确保病情的准确评估。
以上是近期发生的几起器械不良反应报告,根据《器械不良反应报告制度》,我已将这些情况上报给相关部门,并与生产商进行了沟通,以取得进一步解决的方案。
我将继续密切关注器械的使用情况,并推动完善器械安全管理制度。
谢谢!XX医院器械不良反应报告人XX日期器械不良反应报告制度范本(2)引言:随着科技的发展和医疗水平的提高,医疗器械在诊断、治疗和康复中起到了越来越重要的作用。
但是,与之相对应的也是器械使用过程中不可避免的风险和不良反应。
为了确保患者的安全和权益,以及推动医疗器械的安全性和质量的提升,建立器械不良反应报告制度显得尤为重要。
本文将从不良反应报告制度的意义、目标、程序、评估和监督等方面进行详细阐述,以期为制定、完善和落实器械不良反应报告制度提供参考。
一、不良反应报告制度的意义制定器械不良反应报告制度的意义在于:1. 保障患者权益。
医疗器械不良反应报告表格和例子

国家食品药品监督管理局制可疑医疗器械不良事件报告表报告日期:报告来源: 联系地址:A. 患者资料1.姓名:2 .年龄: 3•性别 男 女4 .预期治疗疾病或作用:B. 不良事件情况5. 事件主要表现: 6 .事件发生日期: 年 月曰 7 •发现或者知悉时间: 年 月曰8. 医疗器械实际使用场所:医疗机构 家庭 其它(请注明):9. 事件后果死亡 _________________________________ (时间); 危及生命;机体功能结构永久性损伤; 可能导致机体功能机构永久性损伤; 需要内、外科治疗避免上述永久损伤; 其它(在事件陈述中说明)。
10. 事件陈述:(至少包括器械使用时间、使用目的、使 用依据、使用情况、出现的不良事件情况、对受害者影 响、采取的治疗措施、器械联合使用情况)报告人: 医师 技师 护士 其他邮 编:联系电话:报告人签名:附件1:年 月曰生产企业经营企业例子:附件1:可疑医疗器械不良事件报告表报告日期:2010年10月25日 编 码:邮 编:联系电话:A. 患者资料1.姓名:2 .年龄:3•性别男女"4 •预期治疗疾病或作用:输液B. 不良事件情况5•事件主要表现:穿刺部位红肿 6.事件发生日期: 2010年10 月22日7 .发现或者知悉时间: 2010年10月22日8. 医疗器械实际使用场所:V 医疗机构 家庭 其它(请注明):9. 事件后果死亡 _________________________________ (时间); 危及生命;机体功能结构永久性损伤; 可能导致机体功能机构永久性损伤; 需要内、外科治疗避免上述永久损伤;V 其它(在事件陈述中说明)。
国家食品药品监督管理局制报告来源: 生产企业 经营企业 "使用单位 单位名称:按实际填写联系地址:按实际填写10. 事件陈述:(至少包括器械使用时间、使用目的、使用依据、使用情况、出现的不良事件情况、对受害者影响、采取的治疗措施、器械联合使用情况)患者于2010年10月20日在我院留医治疗使用一次性使用静脉留置针,穿刺部位于穿刺输液后2天出现皮肤红肿,无发热等现象,拔除一次性使用静脉留置针1天后症状消失。
器械不良反应报告制度范文(2篇)

器械不良反应报告制度范文尊敬的主管领导:我是XXX部门的员工,根据公司要求,特向您汇报我在工作中发现的器械不良反应情况。
具体情况如下:时间:2022年XX月XX日地点:XXX部门实验室事件描述:该次实验中,我们使用了新购进的实验仪器,按照说明书和操作手册的指导进行使用。
然而,在实验过程中发现该仪器存在以下不良反应:1. 仪器在操作过程中突然停止工作,无法正常启动。
经过排查,发现是电源线连接不牢固导致的,重新连接后仪器恢复正常工作。
2. 在操作过程中,仪器显示屏出现反复闪烁的情况,导致实验数据无法正常显示和记录。
尝试重启和调整设置均无效,最终只能放弃该实验项目。
3. 使用该仪器进行多次实验后发现,仪器在高温环境下使用工作不稳定,容易出现停机现象。
处理过程:在发现以上问题后,我立即向实验室主管报告了情况,并请求其指导和协助解决问题。
实验室主管与供应商联系,对仪器进行检修和维修,并提出了以下解决方案:1. 提醒使用该仪器的员工,在操作仪器前,务必检查电源线连接是否牢固,确保线路正常。
2. 与供应商协商,寻找解决仪器显示屏闪烁问题的办法,确保实验数据准确可靠。
3. 在高温环境下使用该仪器时,适当调整实验温度,控制仪器工作环境,以减少停机现象的发生。
经过以上措施的实施,仪器的功能恢复正常,不良反应的情况得到了解决。
建议:鉴于该仪器存在的一系列不良反应问题,建议公司采取以下措施:1. 给予员工相关的仪器使用培训和操作指导,提高其对仪器故障排除和处理的能力。
2. 对购进的仪器进行更加严格的质量检查和验收,确保其质量符合要求。
3. 定期对仪器进行维护和保养,减少不良反应的发生。
总结:通过对该次不良反应情况的处理,我们不仅解决了实验中的问题,还提出了相应的建议和改进措施。
希望公司能够重视我提出的问题和建议,并采取相应的措施,以确保未来工作过程中仪器使用的稳定性和安全性。
谢谢您的关注和支持!此致敬礼XXX日期器械不良反应报告制度范文(二)一、目的及范围为确保对医疗器械不良反应的及时收集、评估和汇总,保障器械使用安全,制定本制度。
医疗器械不良反应报告

医疗器械不良反应报告
报告编号: [编号]
报告日期: [日期]
报告单位: [单位名称]
报告人: [姓名]
联系方式: [联系方式]
1. 器械信息:
- 器械名称: [名称]
- 器械型号: [型号]
- 器械生产批号: [批号]
- 器械注册证号: [注册证号]
- 器械生产商: [生产商]
2. 患者信息:
- 患者姓名: [姓名]
- 患者性别: [性别]
- 患者年龄: [年龄]
- 患者身体状况: [状况]
3. 不良反应描述:
- 不良反应类型: [类型]
- 不良反应症状: [症状描述]
- 不良反应严重程度: [严重程度]
- 不良反应发生时间: [时间]
- 不良反应处理措施: [处理措施]
4. 相关文件:
- 不良反应照片/视频: [附件]
- 医疗记录/报告: [附件]
5. 其他相关信息:
[其他信息]
请尽快处理该不良反应报告,并在处理后回复确认。
报告人签名: [签名]
日期: [日期]。
医疗器械不良反应报告表格和例子-(1)

附件1:国家食品药品监督管理局制可疑医疗器械不良事件报告表报告日期:年月日编码:报告来源:生产企业经营企业使用单位单位名称:联系地址: 邮编:联系电话:A.患者资料1.姓名:2.年龄: 3.性别男女4.预期治疗疾病或作用:B.不良事件情况5.事件主要表现:6.事件发生日期:年月日7.发现或者知悉时间:年月日8. 医疗器械实际使用场所:医疗机构家庭其它(请注明):9.事件后果死亡(时间);危及生命;机体功能结构永久性损伤;可能导致机体功能机构永久性损伤;需要内、外科治疗避免上述永久损伤;其它(在事件陈述中说明)。
10.事件陈述:(至少包括器械使用时间、使用目的、使用依据、使用情况、出现的不良事件情况、对受害者影响、采取的治疗措施、器械联合使用情况)报告人:医师技师护士其他C.医疗器械情况11.产品名称:12.商品名称:13.注册证号:14.生产企业名称:生产企业地址:企业联系电话:15.型号规格:产品编号:产品批号:16. 操作人:专业人员非专业人员患者其它(请注明):17. 有效期至:年月日18.生产日期:年月日19. 停用日期:年月日20. 植入日期(若植入):年月日21. 事件发生初步原因分析:22. 事件初步处理情况:23.事件报告状态:已通知使用单位已通知生产企业已通知经营企业已通知药监部门D. 不良事件评价24.省级监测技术机构评价意见(可另附附页): 25.国家监测技术机构评价意见(可另附附页):附件1: 国家食品药品监督管理局制可疑医疗器械不良事件报告表报告日期:2010年10月25日 编 码: 报告来源: 生产企业 经营企业 √使用单位 单位名称:按实际填写 联系地址: 按实际填写 邮 编: 联系电话:报告人签名:A .患者资料1.姓名:2.年龄:3.性别男女√4.预期治疗疾病或作用:输液B .不良事件情况5.事件主要表现:穿刺部位红肿6.事件发生日期: 2010 年 10 月 22 日7.发现或者知悉时间: 2010 年 10 月 22 日 8. 医疗器械实际使用场所:√ 医疗机构 家庭 其它(请注明): 9.事件后果死亡 (时间); 危及生命;机体功能结构永久性损伤;可能导致机体功能机构永久性损伤; 需要内、外科治疗避免上述永久损伤; √ 其它(在事件陈述中说明)。
可疑医疗器械不良反应报告表范文

可疑医疗器械不良反应报告表范文英文回答:Adverse Event Reporting Form for Suspected Medical Device Adverse Reactions.Name: [Your Name]Date: [Date]Patient Information:Name: [Patient's Name]Age: [Patient's Age]Sex: [Patient's Gender]Medical History: [Brief summary of patient's medical history]Device Information:Device Name: [Name of the medical device]Manufacturer: [Name of the manufacturer]Model/Serial Number: [Model/Serial Number of the device]Date of Implantation/Use: [Date of deviceimplantation/use]Description of the Adverse Event:Please provide a detailed description of the adverse event experienced by the patient, including any signs or symptoms observed.Example: I recently used a blood pressure monitoring device on a patient. The patient experienced severe painand discomfort during the procedure. The device seemed tobe malfunctioning as it was displaying inconsistentreadings. The patient's blood pressure was also abnormally high, which was concerning.Actions Taken:Please describe any actions taken in response to the adverse event, such as discontinuation of device use, medical intervention, or device replacement.Example: As soon as I noticed the patient's discomfort and the device malfunction, I immediately stopped using the device. I informed the patient about the situation and provided them with alternative methods for monitoring their blood pressure. I also reported the incident to thehospital's medical device department for further investigation.Outcome:Please describe the outcome of the adverse event, including any medical interventions or treatments provided to the patient.Example: After discontinuing the use of the blood pressure monitoring device, the patient's pain and discomfort subsided. The patient was closely monitored for any further complications and was eventually switched to a different device for blood pressure monitoring. No further adverse events were reported.Preventive Measures:Please suggest any preventive measures that can be taken to avoid similar adverse events in the future.Example: To prevent similar adverse events in the future, it is important to conduct regular maintenance and calibration checks on medical devices. Additionally, healthcare professionals should receive proper training on device usage and troubleshooting. It is also crucial to establish a robust reporting system for adverse events to ensure prompt investigation and appropriate action.中文回答:可疑医疗器械不良反应报告表。
医疗器械不良反应报告
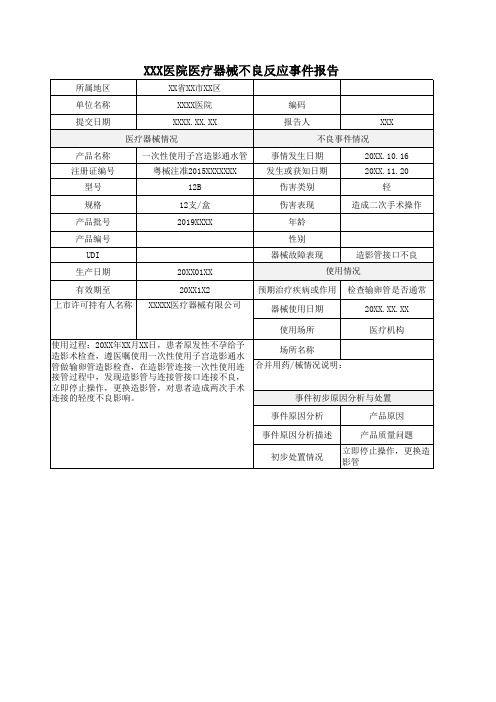
医疗机构
使用过程:20XX年XX月XX日,患者原发性不孕给予 造影术检查,遵医嘱使用一次性使用子宫造影通水 管做输卵管造影检查,在造影管连接一次性使用连 接管过程中,发现造影管与连接管接口连接不良, 立即停止操作,更换造影管,对患者造成两次手术 连接的轻度不良影响。
场所名称 合并用药/械情况说明:
事件初步原因分析与处置
伤害类别
轻
规格
12支/盒
伤害表现
造成二次手术操作
产品批号
2019XXXX
年龄
产品编号
性别
UDI
器械故障表现
造影管接口不良
生产日期
20XX01XX
使用情况
有效期至 上市许可持有人名称
20XX1X2 XXXXX医疗器械有限公司
预期治疗疾病或作用 检查输卵管是否通常
器械使用日期
20XX.XX.XX
使用场所
XXX医院医疗器械不良反应事件报告
所属地区
XX省XX市XX区
单位名称
XXXX医院编码提来自日期XXXX.XX.XX
报告人
XXX
医疗器械情况
不良事件情况
产品名称 注册证编号
一次性使用子宫造影通水管 粤械注准2015XXXXXXX
事情发生日期 发生或获知日期
20XX.10.16 20XX.11.20
型号
12B
事件原因分析
产品原因
事件原因分析描述
产品质量问题
初步处置情况
立即停止操作,更换造 影管
医疗器械不良反应报告表格和例子(1)

附件1: 国家食品药品监督管理局制可疑医疗器械不良事件报告表报告日期: 年 月 日 编 码:报告来源:生产企业 经营企业使用单位 单位名称:联系地址: 邮 编: 联系电话:报告人签名:A .患者资料1.姓名:2.年龄:3.性别男女4.预期治疗疾病或作用:B .不良事件情况5.事件主要表现:6.事件发生日期: 年 月 日 7.发现或者知悉时间: 年 月 日 8. 医疗器械实际使用场所: 医疗机构 家庭其它(请注明):9.事件后果死亡 (时间); 危及生命;机体功能结构永久性损伤;可能导致机体功能机构永久性损伤; 需要内、外科治疗避免上述永久损伤; 其它(在事件陈述中说明)。
10.事件陈述:(至少包括器械使用时间、使用目的、使用依据、使用情况、出现的不良事件情况、对受害者影响、采取的治疗措施、器械联合使用情况)报告人: 医师 技师 护士 其他 C .医疗器械情况11.产品名称: 12.商品名称: 13.注册证号: 14.生产企业名称: 生产企业地址: 企业联系电话: 15.型号规格: 产品编号: 产品批号: 16. 操作人:专业人员非专业人员患者其它(请注明):17. 有效期至: 年 月 日 18.生产日期: 年 月 日 19. 停用日期: 年 月 日 20. 植入日期(若植入): 年 月 日 21. 事件发生初步原因分析:22. 事件初步处理情况:23.事件报告状态: 已通知使用单位 已通知生产企业 已通知经营企业已通知药监部门D. 不良事件评价24.省级监测技术机构评价意见(可另附附页):25.国家监测技术机构评价意见(可另附附页):例子:附件1:国家食品药品监督管理局制可疑医疗器械不良事件报告表报告日期:2010年10月25日编码:报告来源:生产企业经营企业√使用单位单位名称:按实际填写联系地址: 按实际填写邮编:联系电话:A.患者资料1.姓名:2.年龄: 3.性别男女√4.预期治疗疾病或作用:输液B.不良事件情况5.事件主要表现:穿刺部位红肿6.事件发生日期:2010 年10 月22 日7.发现或者知悉时间:2010 年10 月22 日8. 医疗器械实际使用场所:√医疗机构家庭其它(请注明):9.事件后果死亡(时间);危及生命;机体功能结构永久性损伤;可能导致机体功能机构永久性损伤;需要内、外科治疗避免上述永久损伤;√其它(在事件陈述中说明)。
医疗器械不良反应报告

不良反响的成果:治愈□好转有后遗症□表示:逝世亡□直接逝世因:逝世亡时光:年月日
对原患疾病的影响:不显著病程延伸□病情加重□导致后遗症□表示:导致残逝世亡□
联系关系性评价省级ADR监测机构确定□很可能□可能√不大可能□未评价□无法评介□签名:
国度ADR监测中间确定□很可能□可能□不大可能□未评价□无法评介□签名:
医疗器械不良反响陈述表
企业名称:德律风: 陈述日期: 年代日
患者姓名:
性别:
男女
出诞辰期:年代日
土家族
体重(kg)
国度器械不良反响:
有√无□不详□
病历号/门诊号
工作单位或住址:
德律风:
既往器械不良反响情形:
有□无□不详√
原患疾病:腰椎间盘凸起
不良反响名称
不良反响产临床磨练)
商品名
国际非专利名
批号
剂型
年发卖量
年产量
疑惑引起不良的应的器械
并用器械
曾在国内.外产生的不良反响情形(包含报刊杂志报导情形)
国内:
国外:
其它:
陈述人: 职务:陈述人签名
医疗器械不良事件报告范例

二、骨科植入物医疗器械可疑不良事件报告范例
骨科植入物医疗器械在临床使用过程中,器械本身都 在不同程度上存在着变形、折弯、折断、松动、脱落、过 敏及磨损等危险性,并且也可能对周围正常组织产生刺激 症状,导致器械不能达到预期的使用目的。 • 在临床医务工作中,发现以下与使用骨科植入物医疗器械 有关的情况需要填写《可疑医疗器械不良事件报告表》向 当地监测部门报告: •
•
一次性输液用品如注射器、输液器不合格或包装不严 、长时间暴露后使用,隐裂、松口,PVC袋漏气,可导致 药物受污染。一次性输液器只用一枚短而饨的针头同时做 通气通液用,故气体经过时形成翻泡,外界空气中的各种 杂菌及尘粉可在此时被截留在无菌液体内形成污染。 • 在临床医务工作中,发现输液反应而不能排除输液器 因素者,需要填写《可疑医疗器械不良事件报告表》向当 地监测部门报告。
三、宫内节育器可疑不良事件报告范例
宫内节育器在世界范围内的广泛应用已有30多年的历 史,由于宫内节育器具有安全、有效、简便、经济、可逆 、长效、不影响生育等优点,目前正为越来越多的妇女所 接受,是我国育龄妇女的主要避孕措施。 • 由于宫内节育器在我国计划生育中举足轻重的作用, 宫内节育器使用的安全性已成为重大生殖健康问题。宫内 节育器使用中也存在着副反应及并发症/不良事件的问题, 常见的有疼痛,出血、月经改变,严重的则有贫血、盆腔 炎、异位妊娠、子宫穿孔、宫内节育器嵌顿等。 •
2、事件发生后未出现上述情况,但根据临床医生的经 验同类事件再次发生时,有可能出现上述情况,例如:患 者使用聚丙烯酰胺水凝胶产品后,因故要求取出注射物而 不能完全取出,尽管没有造成患者伤害,但再次发生同类 事件(如发生感染时)有可能引起患者伤害。 • 3、由于事件涉及器械、使用、个人多个因素,不能排 除与聚丙烯酰胺水凝胶产品有关,例如: • ① 注射后不明原因肩、背等身体部位疼痛; • ② 注射后患者哺乳期出现炎症、感染。 •
医疗器械不良反应报告表.doc

附件1:《可疑医疗器械不良事件报告表》及填写要求可疑医疗器械不良事件报告表报告日期:报告来源:联系地址:年月曰生产企业经营企业编码:使用单位单位名称:邮编:联系电话:A •患者资料1.姓名: 2 .年龄:3•性别男女4 •预期治疗疾病或作用:B.不良事件情况5 •事件主要表现:6•事件发生日期:年月曰7 •发现或者知悉时间:年月曰8.医疗器械实际使用场所:医疗机构家庭其他(请注明):9.事件后果死亡(时间);危及生命;机体功能结构永久性损伤;可能导致机体功能结构永久性损伤;需要内、外科治疗避免上述永久损伤;其他(在事件陈述中说明)。
10.事件陈述:(至少包括器械使用时间、使用目的、使用依据、使用情况、岀现的不良事件情况、对受害者影响、采取的治疗措施、器械联合使用情况)报告人:医师技师护士其他填写要求《可疑医疗器械不良事件报告表》由题眉、患者资料、不良事件情况、医疗器械情况、关联性评价、不良事件评价及题末7部分组成1. 题眉A.报告日期:是指填报人填报该次不良事件时的确切时间。
B.编码:由省(区、市)医疗器械不良事件监测技术机构填写,按以下排列方式:省(区、市)年份流水号□□ □□□□ □□□□□ 注:省(区、市)编码按中华人民共和国行政区划代码填写。
在医疗器械不良事件监测系统中,编码由系统自动生成。
C.报告来源:是指填报可疑医疗器械不良事件单位的类别,填写时请选择相应的选项,并在“□”中划“。
D.单位名称:是指填报可疑医疗器械不良事件单位的全称,不可用简称。
E.联系地址、电话及邮编:是指填报可疑医疗器械不良事件单位的联系地址、电话及邮编。
2. 患者资料A.患者姓名:是指患者真实全名。
若患者姓名无法获知,应填写未知;新生儿无姓名,应填写XX子或XX女。
B.年龄:是指患者发生可疑医疗器械不良事件时的实际年龄,字体为阿拉伯数字。
若患者年龄小于1 岁,应填写具体的月份或天数,如6 个月。
C.性别:是指患者的性别,填写时请选择相应的选项,并在“口D.预期治疗疾病或作用:是指涉及不良事件的医疗器械用于治疗的疾病或者预计使用该医疗器械所发挥的作用,例如血管内支架用于治疗急性心肌梗死。
医疗器械不良事件报告范例

医疗器械不良事件报告范例近年来,随着社会经济的发展和医疗技术的突破,医疗器械在医疗行业中的应用越来越广泛。
然而,与之同时,医疗器械不良事件也时有发生,给人们的生命安全带来了一定的威胁。
为了更好地管理和控制医疗器械不良事件,必须建立一个完善的报告系统。
本文将以一个医疗器械不良事件的报告范例为例,详细介绍该报告的内容和形式。
报告主题:医用电动吸引器失灵一、事件描述根据我院2021年5月1日至5月30日期间发生的医疗器械不良事件报告,报告编号:12345678。
事发时间为2021年5月15日上午10点,患者王某(男,65岁)在我院进行鼻窦炎手术后出现呼吸困难的不良状况。
经过紧急救治,患者目前病情稳定。
二、器械信息患者在手术时使用了我院购买的医用电动吸引器丙型型号(批次号:ABC123456)。
该器械主要用于排除呼吸道分泌物,确保患者的通畅呼吸。
三、失灵情况描述据手术室护士陈某的描述,手术期间,电动吸引器突然停止运转,无法完成抽吸任务。
护士随即通知同事切换到备用吸引器继续手术。
经过后续的检查和调查,确定该电动吸引器发生了严重故障,导致了此次意外。
四、结果由于电动吸引器故障,患者出现呼吸困难。
幸好我们的医护人员反应及时,迅速采取了紧急救治措施,患者目前病情稳定。
五、原因分析根据技术人员的分析,初步判断电动吸引器失灵的原因是设备内部的电线连接问题,导致电路中断,使得设备无法正常运行。
六、整改措施1. 停止使用该型号的电动吸引器,并将其送至供应商修理。
2. 加强器械设备的定期检查和维护,确保设备的正常运行。
3. 设立医疗器械不良事件报告制度,加强对医疗器械的质量监管。
七、教训与总结本次医疗器械不良事件表明,医疗机构在选择和使用医疗器械时必须十分谨慎。
对于设备故障要及时发现和排除,并加强对设备的定期检查和维护。
同时,建立医疗器械不良事件报告制度,及时报告和处理医疗器械不良事件,以提高患者的安全性和医疗服务质量。
医疗器械不良反应报告范文

医疗器械不良反应报告范文英文回答:Adverse Event Report for Medical Device.Introduction:Hello, my name is [Your Name] and I am writing to report an adverse event related to a medical device. I recently used a [name of the medical device] and experienced some unexpected side effects. I would like to provide detailed information about the event for further investigation and analysis.Description of the Event:I used the [name of the medical device] for [purpose of use] on [date]. After using the device, I noticed [describe the adverse event]. For example, I experienced severe skin irritation and redness at the application site. Thesymptoms persisted for several days and caused significant discomfort.Impact on My Daily Life:The adverse event had a negative impact on my daily life. For instance, the skin irritation was so severe that I had difficulty performing my regular activities. I had to avoid certain tasks that required direct contact with water or other irritants. The discomfort also affected my sleep, as it was difficult to find a comfortable position.Actions Taken:Upon experiencing the adverse event, I immediately stopped using the medical device and sought medical advice.I consulted with my healthcare provider, who examined the affected area and recommended appropriate treatment. I followed the prescribed treatment plan and took necessary measures to alleviate the symptoms.Conclusion:In conclusion, I believe it is important to report this adverse event to ensure the safety and effectiveness of the medical device. I hope that my report will contribute tothe ongoing monitoring and evaluation of the device, and ultimately lead to improvements in its design or usage instructions. Thank you for your attention to this matter.中文回答:医疗器械不良反应报告范文。
