化学选修四《化学反应原理》总复习试题
选修四化学反应原理综合测试题

化学反应原理期末测试题一、单选题(每题2分,包括10小题,共20分) 1.下列过程或现象与盐类水解无关的是 ( ) A .纯碱溶液去油污 B .加热稀醋酸溶液其pH 稍有减小C .小苏打溶液与AlCl 3溶液混合产生气体和沉淀D .浓的硫化钠溶液有臭味2. 下列有关中和滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液;⑥洗涤。
正确的操作顺序是( )A. ⑥③①②⑤B. ⑤①②⑥④③C. ⑤④③②①⑥D. ③①②④⑤⑥ 3.相同温度浓度的溶液,pH 值最小的是 ( ) A .Cl NH 4B .34HCO NHC .44HSO NHD .424SO )(NH4、对于0.1mol ·L -1的Na 2S 溶液,下列判断正确的是 ( ) A.溶液中阴离子浓度的大小顺序:c (S 2-)>c (OH -)>c (HS -) B .c (Na +)=2c (S 2-)+c (OH -)+c (HS -)C .向Na 2S 溶液中加水稀释,其所有离子的浓度都减小D .向溶液中加入少量NaOH 固体,能促进水的电离 5.下列对化学平衡移动的分析中,不正确...的是( )①已达平衡的反应C (s )+H 2O (g ) CO (g )+H 2(g ),当增加反应物物质的量时,平衡一定向正反应方向移动②已达平衡的反应N 2(g )+3H 2(g ) 2NH 3(g ),当增大N 2的浓度时,平衡向正反应方向移动,N 2的转化率一定升高③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动 A .①④B .①②③C .②③④D .①②③④6.将氨水缓缓地滴入盐酸中至中性,下列有关的说法:①盐酸过量 ②氨水过量③恰好完全反应④c (NH4+) = c(Cl-) ⑤c (NH4+) < c(Cl-) 正确的是()A.①⑤ B.③④ C.②⑤D.②④7.冰醋酸中加水稀释时,溶液中的氢离子浓度随加入的水量变化的下列各曲线图中,正确的是()8.把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡: Ca(OH)2(s)Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,温度保持不变,下列判断正确的是()A.溶液中Ca2+数目减少 B.溶液中c(Ca2+)增大 C.溶液pH值不变D.溶液pH值增大9.某学生欲完成反应2HCl+2Ag== 2AgCl↓+H2↑而设计了下列四个实验,你认为可行的是()10.常温下,K sp(CaSO4)=9×l0-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。
选修4化学反应原理测试题

选修4化学反应原理测试题一、选择题(每小题只有一个选项符合题意)3、在密闭容器里,A 与B 反应生成C ,其反应速率分别用A v 、B v 、C v 表示,已知2B v =3A v 、3C v =2B v ,则此反应可表示为( )A 、2A+3B=2CB 、A+3B=2C C 、3A+B=2CD 、A+B=C 4、下列说法正确的是( )A 、可逆反应的特征是正反应速率和逆反应速率相等B 、在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态C 、在其他条件不变时,升高温度可以使平衡向放热反应方向移动D 、在其他条件不变时,增大压强一定会破坏气体反应的平衡状态5、相同温度下等物质的量浓度的下列溶液中,pH 值最小的是 ( )A .Cl NH 4B .34HCONHC .44HSONH D .424SO )(NH7、化学电池可以直接将化学能转化为电能,化学电池的本质是 ( )A .化合价的升降B . 电子的转移C .氧化还原反应D .电能的储存8、随着人们生活质量的不断提高,废电池必须集中处理的问题被提到议事日程,首要原因是A 、利用电池外壳的金属材料B 、防止电池中汞、镉和铅等重金属离子对土壤和水源的污染C 、不使电池中渗泄的电解液腐蚀其他物品D 、回收其中石墨电极 9、在一密闭容器中进行如下反应:2SO 2(气)+O 2(气)2SO 3(气),已知反应过程中某一时刻SO 2、O 2、SO 3的浓度分别为0.2mol/L 、0.1mol/L 、0.2mol/L ,当反应达平衡时,可能存在的数据是A .SO 2为0.4mol/L 、O 2为0.2mol/LB .SO 2为0.25mol/LC .SO 2、SO 3均为0.15mol/LD .SO 3为0.4mol/L10、下列对化学平衡移动的分析中,不正确...的是 ( )①已达平衡的反应C (s )+H 2O (g) CO (g )+H 2(g ),当增加反应物物质的量 时,平衡一定向正反应方向移动②已达平衡的反应N 2(g )+3H 2(g ) 2NH 3(g ),当增大N 2的浓度时,平衡向正 反应方向移动,N 2的转化率一定升高③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向 移动④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动A .①④B .①②③C .②③④D .①②③④11、可以充分说明反应P (g )+Q (g ) R (g )+S (g )在恒温下已达到平衡的是 ( ) A .反应容器内的压强不随时间改变B .反应容器内P 、Q 、R 、S 四者浓度之比为1:1:1:1C .P 的生成速率和S 的生成速率相等D .反应容器内的气体总物质的量不随时间变化12、设C +CO 22CO -Q 1(吸热反应)反应速率为 V 1,N 2+3H 22NH 3+Q 2(放热反应)反应速率为V 2,对于上述反应,当温度升高时,V 1和V 2的变化情况为 A 、 同时增大 B 、同时减小 C 、增大,减小 D 、减小,增大13、在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是A.反应混合物的浓度B. 反应体系的压强C.正、逆反应的速率D. 反应物的转化率14、可以将反应Zn+Br 2 = ZnBr 2设计成蓄电池,下列4个电极反应①Br 2 + 2e -= 2Br - ②2Br -- 2e - = Br 2 ③Zn – 2e -= Zn 2+ ④Zn 2++ 2e -= Zn其中表示充电时的阳极反应和放电时的负极反应的分别是( ) A .②和③ B .②和① C .③和① D .④和①15、将氨水缓缓地滴入盐酸中至中性,下列有关的说法:①盐酸过量 ②氨水过量 ③恰好完全反应 ④c (NH 4+) = c(Cl -) ⑤c (NH 4+) < c(Cl -) 正确的是 ( )A .①⑤B .③④C .②⑤D .②④二、 选择题(每小题有一个或二个选项符合题意)16、反应4NH 3(g)+5O 2(g) = 4NO(g)+6H 2O(g) 在2 L 的密闭容器中进行,1分钟后,NH 3减少了0.12 mol ,则平均每秒钟各物质浓度变化正确的是 A 、 NO :0.001 mol·L -1B 、 H 2O :0.002 mol·L -1C 、 NH 3:0.002 mol·L -1D 、 O 2:0.001 mol·L -117、常温下,下列离子能使纯水中的H +离子数目增加的是 ( )A .S2-B .CO 32-C .NH 4+D .Br -18、下列水解化学方程式或水解离子方程式正确的是:( )A .CH 3COO — + H 2O CH 3COOH + OH —B .NH 4+ + H 2O NH 4OH + H +C .CH 3COOH + NaOHCH 3COONa + H 2O D .NaCl + H 2ONaOH + HCl19、近年来,加“碘”食盐较多的使用了碘酸钾(KIO 3),碘酸钾在工业上可用电解法制取。
化学反应原理试题及答案

化学反应原理试题及答案一、选择题(每题2分,共10分)1. 下列反应中,属于氧化还原反应的是:A. NaCl + AgNO3 → AgCl↓ + NaNO3B. 2H2O → 2H2↑ + O2↑C. 2Na + Cl2 → 2NaClD. 2H2O + CO2 → H2CO3答案:C2. 在标准状态下,1摩尔气体的体积是:A. 22.4 LB. 22.4 mLC. 224 LD. 224 mL答案:A3. 下列物质中,不属于电解质的是:A. HClB. NaOHC. H2OD. H2SO4答案:C4. 根据勒夏特列原理,当一个处于平衡状态的化学反应系统受到外部条件的改变时,系统会如何反应?A. 向减弱这种改变的方向移动B. 向增强这种改变的方向移动C. 不会发生变化D. 无法确定答案:A5. 反应速率是指:A. 反应物的浓度B. 反应物的质量C. 单位时间内反应物浓度的变化量D. 反应物的摩尔数答案:C二、填空题(每题2分,共10分)1. 一个化学反应的活化能是指反应物分子必须达到的最低能量,才能发生__________。
答案:有效碰撞2. 根据热力学第一定律,能量守恒,化学反应中的能量变化可以表示为:ΔH = __________ + ΔU。
答案:ΔQ3. 催化剂在化学反应中的作用是__________。
答案:降低活化能4. 反应物的浓度越大,反应速率__________。
答案:越快5. 酸碱中和反应的实质是__________。
答案:氢离子与氢氧根离子结合生成水三、简答题(每题10分,共20分)1. 简述什么是化学平衡,并举例说明。
答案:化学平衡是指在一个封闭系统中,正逆反应速率相等,反应物和生成物的浓度不再随时间变化的状态。
例如,N2(g) + 3H2(g) ⇌2NH3(g),在一定条件下,氮气和氢气生成氨气的速率与氨气分解的速率相等,此时系统达到化学平衡。
2. 描述影响化学反应速率的因素有哪些?答案:影响化学反应速率的因素包括:温度、压力、催化剂、反应物的浓度、反应物的接触面积、反应物的物理状态等。
新课标人教A 选修4 化学反应原理测试题 第二章 化学反应速率和化学平衡

第二章化学反应速率和化学平衡班级:姓名:_______________座号_______________一、选择题1.下列说法正确的是()A.硫酸工业常用煅烧硫铁矿或硫的方法制取二氧化硫B.为提高氨的产量,合成氨工业应采用低温高压的反应条件C.氯碱工业中用铁作电极电解饱和食盐水D.高纯度的石英可用于制光导纤维2.下列反应中能起到固氮作用的是( )A.NO与O2反应生成NO2B.NH3经催化氧化生成NOC.由NH3制碳铵和硫铵D.N2与H2在一定条件下合成氨3.下列有关化工生产的选项正确的是()A. 氨氧化制HNO3:合成塔、空气、铂铑合金、8000CB. 合成氨:沸腾炉、焦炭、铁触媒、5000CC. 生产水泥:回转窑、石灰石、粘土、高温D. 接触法制硫酸:氧化炉、硫铁矿、V2O5、4000C~5000C4.下列事实中,不能用勒夏特列原理来解释的是()A.增加氧气的量有利于氨氧化反应B.向氯水中加食盐不利于氯气的溶解C.500℃左右比室温更有利于合成氨反应D.高压条件有利于合成氨反应5.合成氨()工业中,常采用500℃的温度条件。
有下列关于选用该条件的叙述:①加快反应速率;②使平衡向产物方向移动;③提高原料转化率;④使催化剂的活性达到最佳状态。
其原因可能是下列中的()A、④B、①④C、②③D、①②③④6.N2+3H22NH3合成氨反应中,在下列情况下,不能使反应速率加快的是( ) A.加入氮气B.减小压强,扩大容器体积C.加入催化剂D.适当升高温度7.对于密闭容器中进行的反应:N2+O2=2NO,下列条件中哪些能加快该反应速率的(假定改变下列条件时温度不变)()A.缩小体积使压力增大B.体积不变充入N2使压强增大C.体积不变充入He气使压强增大D.减小压强使体积增大8.由于催化作用使反应速率加快的是()A.利用KClO3固体加热分解制氧气时,加入少量MnO2固体B.加热H2O2水溶液制氧气时,加入少量MnO2固体C.实验室制用浓盐酸制氯气,需加入MnO2固体加热D.锌与盐酸反应时,加入少量稀硫酸9.甲、乙两个容器内都进行A→B的反应,甲容器内每分钟减少了4molA,乙容器内每分钟减少2molA,则甲容器内的反应速率比乙容器内的反应速率()A.快B.慢C.相等D.无法判断10.在2A+B 3C+4D 反应中,表示该反应速率最快的是 ( )A .v (A )=0.5mol/L · sB .v (B )=0.3mol/L · sC .v (C )=0.8mol/L · sD .v (D )=1mol/L · s11.下列体系加压后,对化学反应速率没有影响的是( ) A .2SO 2+O 22SO 3 B .CO+H 2O (g )CO 2+H 2C .CO 2+H 2OH 2CO 3D .H ++OH -H 2O12.反应C(固)+H 2O(气) CO 2(气)+H 2(气)在一可变容积的密闭容器中进行,下列条件改变对其反应速率几乎无影响的是( )A. 增加C 的量B. 将容器的体积缩小一半C. 保持体积不变, 充入N 2D. 压强不变充入N 2使体积增大13.一定量的锌粉和6mol ·L -1的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H 2总量的是( )①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥无水乙酸 A.①③④ B.①③⑤ C.②④⑥ D.②⑤⑥ 14. 可逆反应:A B+322C D +在4种不同的情况下的反应速率分别为①v A mol L s ()./()=⋅015 ②v B mol L s ()./()=⋅06 ③v C mol L s ()./()=⋅04 ④v D mol L s ()./()=⋅045该反应进行速率最快的是( )A. ①B. ②和③C. ④D. ①和④15.在可逆反应2A(气) + B(气)2C(气) + Q 中,为了有利于A 的利用,应采用的反应条件是( ) A .高温、高压 B .高温、低压C .低温、低压D .适当温度、高压16.在一定条件下,合成氨反应到达平称衡状态,此时,再进行如下操作,平衡不发生移动的是( )A .恒温、恒压时,充入NH 3B .恒温、恒容时,充入N 2C .恒温、恒压时,充入HeD .恒温、恒容时,充入He17.以焦炭为主要原料合成氨,为了使通入合成塔的N 2与H 2保持1∶3的体积比,则焦炭(不计燃烧中的消耗)与空气的物质的量之比约为( )A .1∶3B .3∶2C .6∶5D .4∶3 18.在800℃时,下列可逆反应达到化学平衡状态:CO (g )+H 2O (g )CO 2(g )+H 2(g),已知CO 和H 2O (g )的初始浓度为0.01mol ·L -1时,H 2平衡浓度为0.005mol ·L -1。
人教版选修四《化学反应原理》期末试卷及答案分析

《化学反应原理》期末试卷第I卷(选择题共41分)一、选择题(本题包括10个小题,每小题2分,共20分,每小题只有一个答案符合题意)1.以油类为溶剂的防锈漆称为油基防锈漆,由于环保方面的原因,目前要推广使用水基防锈漆,但水基漆较易溶解O2,在干燥之前易导致金属表面产生锈斑,为此要在水基漆中加入缓蚀剂,以下可作为缓蚀剂添加的是()A.KMnO4 B.NaNO2 C.FeCl3 D.HNO32.下列说法中,正确的是()A.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的 pH 会增大B.在测定BaSO4沉淀的量前,先洗涤BaSO4沉淀,洗涤剂选择水或稀硫酸时的效果相同C.AgCl 悬浊液中加入 KI 溶液,白色沉淀变成黄色,证明此条件下 K sp(AgCl) > K sp(AgI) D.加水稀释酸溶液时,所有离子的浓度都降低3.广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。
根据上述信息,下列说法不正确的是()A.CaO2的水解产物是Ca(OH)2和H2O2 B.PCl3的水解产物是HClO和PH3C.NaClO的水解产物之一是HClO D.Mg3N2的水解产物是两种碱性物质4.t 0 C时,水的离子积为K w,该温度下混合可溶性一元酸HA与一元碱BOH溶液。
下列有关混合液的关系式中,可确认溶液一定呈中性的是()A.pH = 7 B.c(A-) > c(B+) C.c (OH-) = D.c(H+)-c(OH-) = c(A-)-c(B+) 5.有关下列装置图中的叙述正确的是()A.这是电解NaOH溶液的装置B.这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2沉淀的颜色C.Pt为正极,其电极反应为:O2+2H2O +4e-=4OH-D.这是一个原电池装置,Pt为负极,Fe为正极6.已知胆矾溶于水使溶液温度降低,室温下将1mol无水硫酸铜制成溶液释放出热量为Q1kJ,又知胆矾分解的化学方程式为:CuSO4·5H2O(s)=CuSO4(s)+5H2O(l);△H=+Q2(Q2>0),则Q1、Q2的关系为()A.Q1 <Q2 B.Q1 >Q2 C.Q1 =Q2 D.无法确定7.分别取pH=3的两种一元酸HA和HB溶液10mL,加入等量(过量)的镁粉,充分反应后,收集H2的体积在相同状况下分别为V1和V2,若V1>V2,下列说法正确的是()A.将原酸溶液都稀释到1L,pH都增大到5B.在相同条件下,NaA水溶液的碱性弱于NaB水溶液的碱性C.HB一定是强酸D.反应开始时二者生成H2的速率相同8.已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。
选修四化学反应原理期终测试
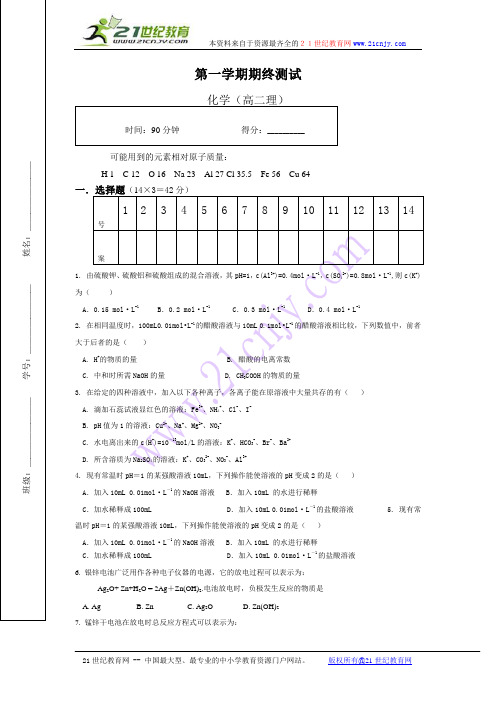
第一学期期终测试化学(高二理)可能用到的元素相对原子质量:H 1 C 12 O 16 Na 23 Al 27 Cl 35.5 Fe 56 Cu 64号1 2 3 4 5 6 7 8 9 10 11 12 13 14案1. 由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al 3+)=0.4mol·L -1,c(SO 42-)=0.8mol·L -1,则c(K +)为( )A .0.15 mol·L -1B .0.2 mol·L -1C .0.3 mol·L -1D .0.4 mol·L -12. 在相同温度时,100mL0.01mol•L -1的醋酸溶液与10mL 0.1mol•L -1的醋酸溶液相比较,下列数值中,前者大于后者的是( )A. H +的物质的量 B. 醋酸的电离常数 C. 中和时所需NaOH 的量 D. CH 3COOH 的物质的量3. 在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有( ) A. 滴加石蕊试液显红色的溶液:Fe 3+、NH 4+、Cl -、I -B. pH 值为1的溶液:Cu 2+、Na +、Mg 2+、NO 3-C. 水电离出来的c(H +)=10-13mol/L 的溶液:K +、HCO 3-、Br -、Ba 2+D. 所含溶质为Na 2SO 4的溶液:K +、CO 32-、NO 3-、Al 3+4. 现有常温时pH =1的某强酸溶液10mL ,下列操作能使溶液的pH 变成2的是( ) A .加入10mL 0.01mol·L -1的NaOH 溶液 B .加入10mL 的水进行稀释C .加水稀释成100mLD .加入10mL 0.01mol·L -1的盐酸溶液 5. 现有常温时pH =1的某强酸溶液10mL ,下列操作能使溶液的pH 变成2的是( ) A .加入10mL 0.01mol·L -1的NaOH 溶液 B .加入10mL 的水进行稀释C .加水稀释成100mLD .加入10mL 0.01mol·L -1的盐酸溶液 6. 银锌电池广泛用作各种电子仪器的电源,它的放电过程可以表示为:Ag 2O+ Zn+H 2O = 2Ag +Zn(OH)2.电池放电时,负极发生反应的物质是 A. Ag B. Zn C. Ag 2O D. Zn(OH)2 7. 锰锌干电池在放电时总反应方程式可以表示为:班级:________ 学号:________ 姓名:________时间:90分钟 得分:__________Zn (s )+2MnO 2+2NH 4+=Zn 2++Mn 2O 3(s )+2NH 3+H 2O在此电池放电时正极(碳棒)上发生反应的物质是( ) A. Zn B. 碳 C. MnO 2和NH 4+ D. Zn和NH 38.下列说法正确的是( )A .需要加热的化学反应都是吸热反应B .中和反应都是放热反应C .原电池是将电能转化为化学能的一种装置D .水力发电是将化学能转化为电能的过程9.一定量的稀硫酸跟过量铁粉反应,为了减缓反应速率,又不影响生产氢气的总量,可向稀硫酸中加入适量的( )A .COONa CH 3(固体)B .Cl NH 4(固体)C .4CuSO (溶液)D .2Ba(OH)(固体)10.对已达平衡的下列反应 2X (g )+Y (g )2Z (g ),减小压强时,对反应产生的影响是( )A .逆反应速率增大,正反应速率减小,平衡向逆反应方向移动B .逆反应速率减小,正反应速率增大,平衡向正反应方向移动C .正、逆反应速率都减小,平衡向逆反应方向移动D .正、逆反应速率都增大,平衡向正反应方向移动11.下列溶液中各微粒的浓度关系不.正确的是( ) A .0.1 mol·L-1HCOOH 溶液中:c (HCOO -)+c (OH -)=c (H +)B .1 L 0.1 mol·L -1CuSO 4·(NH 4)2SO 4·6H 2O 的溶液中:c (SO 2-4)>c (NH +4)>c (Cu 2+)>c (H +)>c (OH -)C .0.1 mol·L -1 NaHCO 3溶液中:c (H +)+c (H 2CO 3)=c (CO 2-3)+c (OH -) D .等体积、等物质的量浓度的NaX 和弱酸HX 混合后的溶液中:c (Na +)>c (HX)>c (X -)>c (H +)>c (OH -)12.电解含下列离子的水溶液,若阴极析出相等质量的物质则消耗的电量 最多的是( )A .Ag +B .Cu 2+C .Na +D .Hg 2+13.若在铜片上镀银时,下列叙述正确的是( )①将铜片接在电池的正极上,②将银片接在电源的正极上,③在铜片上发生的反应是:Ag ++e -=Ag ,④在银片上发生的反应是:4OH --4e -=O 2+2H 2O ,⑤需用CuSO 4溶液,⑥需用AgNO 3溶液作电解液 A .①③⑥ B .②③⑥ C .①④⑤D .②③④⑥14.下列推论正确的是( )A.S(g)+O 2(g)=SO 2(g) △H 1,S(s)+O 2(g)=SO 2(g) △H 2;则:△H 1>△H 2B.C(石墨,s)=C(金刚石,s) △H =+1.9kJ/mol ,则:由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.4kJ/mol,则:含20gNaOH的溶液与稀盐酸完全反应,放出的热量为28.7kJD. CaCO3(s)=CaO(s)+CO2(g) △H>0,△S>0,则:该反应任何温度下都能自发进行二、填空题(58分)15. (15分)2009年10月16日第十一届全运会在济南举行,在全运会上使用的火炬的燃料是丙烷(C3H8)。
选修四_化学反应原理综合测试题(含答案)

化学反应原理期末测试题一、选择题(共16小题,每题3分,共48分,每题有一个选项符合题意)1.下列物质间的反应,其能量变化符合下图的是()A.铁与硫粉在加热条件下的反应B.灼热的碳与二氧化碳反应C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合D.碳酸钙的分解2.已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1。
则HCN在水溶液中电离的ΔH等于( )A.-67.7 kJ·mol-1 B.-43.5 kJ·mol-1C.+43.5 kJ·mol-1 D.+67.7 kJ·mol-13.在同温同压下,下列各组热化学方程式中△H1>△H2的是()A. 2H2(g)+O2(g)=2H2O(l);△H1;2H2(g)+O2(g)=2H2O(g);△H2B.S(g)+O2(g)=SO2(g);△H1; S(s)+O2(g)=SO2(g);△H2C.C(s)+1/2O2(g)=CO(g);△H1; C(s)+O2(g)=CO2(g);△H2D.H2(g)+Cl2(g)=2HCl(g);△H1; 1/2H2(g)+1/2Cl2(g)=HCl(g);△H2。
4、下列关于外界条件的改变对化学反应速率影响的说法正确的是( )A、升高温度能加快吸热反应的速率,减慢放热反应速率B、增大压强不能加快前后气体体积不变的反应的反应速率C、压强的改变只有通过浓度的改变才能影响化学反应速率D、若外界条件的改变引起了正、逆反应速率的改变,就一定能引起化学平衡放热移动5、下列说法正确的是( )A、焓变是指1mol物质参加反应时的能量变化B、当反应放热时△H>0,当反应吸热时△H<0C、在加热条件下发生的反应均为吸热反应D、一个化学反应中,当反应物的能量大于生成物的能量时,反应热△H为负值6、下列说法或表示方法正确的是( )A、等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多B、在稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H= -57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJC、由C(s,石墨)=C(s,金刚石) △H= +1.90kJ/mol可知,石墨没有金刚石稳定D、在101kPa时,2g的氢气完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H= -285.8kJ/mol7.将4 mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生反应:2 A(g) +B(g) 2 C(g),经2s后测得C的浓度为0.6 mol·L-1,下列几种说法中正确的是()A.用物质A表示反应的平均速率为0.3 mol·L-1·s-1B.用物质B表示反应的平均速率为0.3 mol·L-1·s-1C.2 s时物质A的转化率为70%D.2 s时物质B的浓度为0.3 mol·L-18.如图为某化学反应的速率与时间的关系示意图。
选修4《化学反应原理》模块测试题A[1]
![选修4《化学反应原理》模块测试题A[1]](https://img.taocdn.com/s3/m/a2ae07b269dc5022aaea0052.png)
化学选修4《化学反应原理》模块 期末考试题说明:本试卷分第I 卷(选择题)和第II 卷(非选择题)两部分,全卷满分100分。
考试时间90分钟。
请将答案填在答题纸指定位置,考试结束只交回答题纸。
可能用到的相对原子质量:C-12 H-1 O-16 N-14 S-32 Cl-35.5 Na-23 K-39 Cu-64 Fe-56第Ⅰ卷 选择题(共48分)一.选择题(本题包括10小题,每小题只有一个正确选项,每小题3分,共48分) 1.已知:CH 3CH 2CH 2CH 3(g)+6.5O 2(g)4CO 2(g)+5H 2O(l);∆H =-2878 kJ·mol -1(CH 3)2CHCH 3(g)+6.5O 2(g)4CO 2(g)+5H 2O(l);∆H =-2869 kJ·mol -1下列说法正确的是( )A .正丁烷分子储存的能量大于异丁烷分子B .正丁烷的稳定性大于异丁烷C .异丁烷转化为正丁烷的过程是一个放热过程D .异丁烷分子中的碳氢键比正丁烷的多 2、已知298K 时下述反应的有关数据:C(s)+1/2 O 2(g)=CO(g) △H 1 = -110.5kJ·mol -1C(s)+O 2 (g)=CO 2(g), △H 2= -393.5kJ/mol 则C(s)+CO 2(g)=2CO(g) 的△H 为( ) A .283. kJ·mol -1B .172.5 kJ·mol-1C .-172.5 kJ·mol -1D .-504 kJ·mol -13、准确量取25.00毫升高锰酸钾溶液,可选用的仪器是( ) A .50 mL 量筒 B .25 mL 量筒 C .50 mL 碱式滴定管 D .50 mL 酸式滴定管4、某溶液中由水电离出来的C(OH —)=10-12mol/L ,则该溶液中的溶质不可能是( ) A 、HCl B 、NaOH C 、NH 4Cl D 、H 2SO 45、酸碱完全中和时( ) A .酸和碱的物质的量一定相等 B .酸所提供的H +与碱提供的OH -的物质的量相等 C .酸和碱的物质的量浓度相等 D .溶液一定呈中性6、在室温下等体积的酸和碱的溶液,混合后PH 值一定小于7的是( ) A 、 PH = 3的硝酸跟PH = 11的氢氧化钾溶液 B 、 PH = 3的盐酸跟PH = 11的氨水C 、 PH = 3的硫酸跟PH = 11的氢氧化钠溶液D 、 PH = 3的醋酸跟PH = 11的氢氧化钡溶液7、某同学按图所示的装置进行电解实验。
鲁科版高中化学选修四化学反应原理试题

高中化学学习材料化学反应原理试题说明:1.本试题包括卷Ⅰ、卷Ⅱ两部分,考试时间为100分钟,满分为100分。
2.卷Ⅰ为选择题,请用2B 铅笔将答案涂在答题卡上;卷Ⅱ为非选择题,请将答案用蓝、黑色钢笔或圆珠笔写在指定位置。
3.可能用到的相对原子质量: H:1 C:12 N:14 O:16 Cu:64第Ⅰ卷(选择题,共54分)一、 选择题(本题包括10小题,每小题3分,共30分。
每小题只有一个选项符合题意。
)1.氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为:H 2(g)+21O 2(g)=H 2O(l); △H =-285.8kJ •mol -1CO(g)+21O 2(g)=CO 2(g); △H =-283.0 kJ •mol -1C 8H 18(l)+225O 2(g)=8CO 2(g)+9H 2O(l);△H =-5518 kJ •mol -1CH 4(g)+2O 2(g)=CO 2(g)+2H 2O(l); △H =-89.3 kJ •mol -1 相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少 的是 ( ) A .H 2(g) B .CO(g) C .C 8H 18(l) D .CH 4(g)2.钢铁发生吸氧腐蚀时,正极上发生的电极反应是 ( )A .2H ++2e - H 2B .Fe 2++2e - FeC .2H 2O+O 2+4e - 4OH -D .Fe 3++e - Fe 2+3.X、Y、Z、M代表四种金属元素。
金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子。
则这四种金属的活动性由强到弱的顺序为()A.X>Z>Y>M B.X>Y>Z>M C.M>Z>X>Y D.X>Z>M>Y4.随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是()A.利用电池外壳的金属材料B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染C.不使电池中渗泄的电解液腐蚀其他物品D.回收其中石墨电极5.关于电解NaCl水溶液,下列叙述正确的是()A.电解时在阳极得到氯气,在阴极得到金属钠B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性6.一定温度下,反应:N2(g)+3H2(g)2NH3(g),达到化学平衡状态的标志是 ( ) A.c(N2)﹕c(H2)﹕c(NH3)=1﹕3﹕2B.N2,H2和NH3的质量分数不再改变C.N2与H2的物质的量之和是NH3的物质的量的2倍D.单位时间内每增加1 mol N2,同时增加3 mol H27.在一密闭容器中,反应 aA(气) bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%则( ) A.平衡向正反应方向移动了 B.物质A的转化率减少了 C.物质B的质量分数减小了 D.a>b8.已知反应A+3B 2C+D在某段时间内以A的浓度变化表示的化学反应速度为1mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为( )A.0.5mol·L-1·min-1 B.1 mol·L-1·min-1C.2 mol·L-1·min-1 D.3 mol·L-1·min-19.压强变化不会使下列化学反应的平衡发生移动的是( )A.H2(g)+ I2(g) 2 HI(g) B.3H2(g)+N2(g) 2NH3(g)C.2SO2(g)+O2(g) 2SO3(g) D.C(s)+ CO2(g) 2CO(g)10.对已达化学平衡的下列反应 2X(g)+Y(g)2Z(g)减小压强时,对反应产生的影响是 ( )A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动C.正、逆反应速率都减小,平衡向逆反应方向移动D.正、逆反应速率都增大,平衡向正反应方向移动二、选择题(本题包括6小题,每小题4分,共24分。
2020高中化学选修四化学反应原理书本知识归纳总结填空题附答案

1.人们把能够发生有效碰撞的分子叫做要条件。
〖X4-绪言03〗,有效碰撞可以认为是发生化学反应的充2.有没有这样的反应,温度对其反应速率几乎没有影响,其活化能接近于零?若有,请举例说明。
〖X4-绪言04〗。
3.焓(H)是与有关的物理量,在化学实验和生产中,通常遇到的反应是在。
〖X4-02〗中进行的,反应条件是恒压,此时反应的热效应等于4.书写热化学方程式必须注明温度和压强,如果没有注明,默认的温度和压强是:〖X4-03〗5.某反应的ΔH =-241.8kJ/mol ,其中的“每摩尔”指的是。
〖X4-04〗6.在中和反应反应热测定实验中,盐酸的浓度是0.50mol/L ,为什么NaOH 溶液的浓度是0.55 mol/L ,。
〖X4-05〗测盐酸温度的温度计要用水冲洗干净,冲洗液是否也要倒入反应的小烧杯中?7.我国目前使用的主要能源是化石燃料,〖X4-08〗化石燃料包括,。
它们的蕴藏量有限,且不能再生,最终会枯竭。
解决的办法是8.乙烷、乙烯、乙炔的燃烧热分别是ΔH 1、ΔH 2、ΔH 3,它们由大到小的顺序为:。
〖X4-07〗,再加以利用〖X4-09〗,氢已用作火9.太阳能的利用,一般是把太阳辐射能先转化成10.氢能的优点是、、,缺点是箭和燃料电池的燃料。
〖X4-09〗11.甲烷的燃烧热为890.31 kJ/mol ,而氢气的燃烧热只有285.8kJ/mol ,为什么说氢能的燃烧热值高?。
〖X4-09〗无关,这就是盖12.化学反应的反应热只与反应的有关,而与反应的〖X4-11〗斯定律。
盖斯是哪个国家的化学家?13.研究浓度对反应速率的影响,在锥形瓶内各盛有2g 锌粒然后分别加入等体积不同浓度的稀硫酸,可以比较,也可以比较,而得出实验结论。
〖X4-18〗14.研究浓度对反应速率的影响,还可以用不同浓度的草酸与等浓度的酸性KMnO 4溶液反应,记录而得出实验结论,〖X4-20〗反应的化学方程式为15.研究温度对反应速率的影响,应先用两支试管各加入5 mL0.1 mol/L 的Na 2S 2O 3溶液,另取两只试管各加入5 mL0.1 mol/L 的稀硫酸,分成两组(各有一支盛有Na 2S 2O 3和稀硫酸的试管),一组放入冷水中,另一组放入热水中,一段时间后再混合并搅拌。
年选修四化学反应原理总复习检测试卷

2017-2018学年度下学期化学选修四(化学反应原理)总复习检测试卷相对原子质量: H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S i-28 P-31 Fe -56 Cu-64 Zn -65 Ba-137(考试时间:90分钟 试卷满分:100分)注意事项:1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其他答案标号。
写在本试卷上无效。
3.回答第Ⅱ卷时,将答案写在答题卡上。
写在本试卷上无效。
4.测试范围:选修4《化学反应原理》。
5.考试结束后,将本试卷和答题卡一并交回。
第Ⅰ卷(选择题 共42分)1. 为解决能源危机,在汽油中掺入一定比例的乙醇(即乙醇汽油),以代替一部分汽油,乙醇在汽缸中完全燃烧的热化学方程式为:21C 2H 5O H(l )+23O2(g )=CO 2(g )+23H 2O (l)△H =-683.4KJ/mol .下列说法正确的是( )A. 该反应中,生成物的总能量大于反应物的总能量B. 该反应中,断裂化学键会放出能量ﻫC. 乙醇的燃烧热为683.4KJ/mol ﻫD . 反应21C 2H 5O H(l )+23O 2(g)=CO 2(g)+23H 2O(g )△H>-683.4KJ/mol 2. 下列各式中,属于正确的电离方程式的是( )A. H CO3-+H 2O ⇌H 2CO 3+OH - B. HS -+H2O⇌S2-+H3O -C. HCO 3-+OH -⇌H 2O+CO 32-ﻩD. H3P O4⇌3H ++P O43+3. 下列说法或表示正确的是( )A. 相同温度时,100m L0.01mo l/L 的醋酸溶液与10m L0.1mo l/L的醋酸溶液相比较,H +的物质的量前者等于后者B. 在稀溶液中,H +(aq )+OH -(aq )=H2O(l)△H =-57.3KJ/m ol,若将含1mol C H3C OOH 的稀溶液与含1m olNaOH 的稀溶液混合,放出的热量小于57.3KJ ﻫC. 反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H>0ﻫD. N2(g)+3H2(g)=2NH3(g)△H<0.其他条件不变时升高温度,反应速率和氢气的平衡转化率均增大4.下列各组离子在指定溶液中,一定能大量共存的是()A. 在由水电离出的c(OH-)=1×10-13mol/L的溶液中:Na+、Al3+、Cl-、NO3-B. 在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3-ﻫC. 在澄清透明的溶液中:Cu2+、K+、SO42-、Cl-ﻫD.在能使甲基橙变黄色的溶液中:Na+、CO32-、NO3-、K+5.下列事实不能用勒夏特列原理解释的是()A. 光照新制的氯水时,溶液的pH逐渐减小ﻫB. 可用浓氯水和氢氧化钠固体快速制取氨气C. 增大压强,有利于SO2与O2反应生成SO3ﻫD. 硅酸钠溶液在保存时不应用玻璃塞6.在一定条件下,在一恒容密闭容器中,能表示反应X(g)+Y(g)⇌2Z(g)一定达到平衡状态的是()①容器中气体的密度不再发生变化②X、Y、Z的浓度不再发生变化③容器中的压强不再发生变化④单位时间内生成n mol Y,同时生成2n mol Z.A. ①②ﻩB. ②④C.③④D. ①④7.等质量的两份锌粉a和b,分别加入过量的稀硫酸中,a中同时加入少量CuSO4溶液,下列各图中表示其产生氢气总体积(V)与时间(t)的关系正确的是()A.B. C. ﻩD.8.下列叙述正确的是()A.100℃纯水的pH=6,说明加热可导致水呈酸性B. pH=4的醋酸溶液,稀释至10倍后pH=5C. 0.2mol/L的盐酸,与等体积水混合后pH=1ﻫD. 25℃时,pH=3的醋酸溶液.与pH=11的NaOH溶液等体积混合后pH=79. 将E 和F 加入密闭容器中,在一定条件下发生反应:E(g)+F(s)⇌2G(g ),忽略固体体积,平衡时G的体积分数(%)的温度和压强的变化如下表所示.①b<f;②915℃,2.0MPa 时E 的转化率为60%;③该反应的△S>0;④K (1000℃)>K(810℃).上述①~④中正确的有( )A. 1个B. 2个 C . 3个ﻩD. 4个10. 分别取pH=2的两种一元酸HX 和H Y的溶液各50mL,加入过量的镁粉,充分反应后,收集H 2的体积在相同状况下分别为V1和V 2,若V 1>V 2,下列说法正确的是( ) A. HX 一定是弱酸B. NaX 水溶液的碱性弱于N aY 水溶液的碱性C. H X一定是强酸ﻫD. 反应过程中二者生成H 2的速率相同11. 部分弱酸的电离平衡常数如下表:下列选项错误的是( )A. 2CN -+H2O+CO 2=2HCN+C O32-ﻫB. 2HCOOH+CO 32-=2HCOO -+H 2O +CO 2↑ﻫC. 中和等体积、等pH 的HCOOH 和HCN 消耗NaO H的量前者小于后者ﻫD . HCOO H+CN -=HCOO -+HCN12. 下列关于盐类水解的说法错误的是( )A. pH 相等的①NaHC O3、②N a2CO 3、③NaOH 溶液的物质的量浓度大小:③>②>①ﻫB. 浓度均为0.1m ol/L 的①(NH 4)2C O3、②(NH 4)2SO 4、③(NH 4)2Fe(SO 4)2溶液中,c (NH 4+)的大小顺序为:①>②>③C . 在NH 4Cl 溶液中加入稀HNO 3,能抑制NH 4+水解ﻫD. 在CH 3CO ONa 溶液中加入冰醋酸,能控制CH 3COO -水解13. T K 时,向2L 恒容密闭容器中充入1mol COCl 2,发生反应CO Cl 2(g)⇌Cl 2(g)+CO(g ),经过一段时间后达到平衡,反应过程中测定的部分数据见下表:下列说法正确的是( ) A. 反应在前2s 的平均速率v(CO)=0.080mol/L/sB. 保持其他条件不变,升高温度,平衡时c(C l2)=0.11mo l/L ﻫC. T K 时起始向容器中充入0.9molC OCl 2/0.10molC O,反应达到平衡前v (正)>v (逆)D. T K 时起始向容器中充入1.0mo lCl 2和0.9m olCO.达到平衡时,Cl 2的转化率小于80%第Ⅱ卷(非选择题 共58分)14. (1)某温度(t ℃)时,测得0.01mo l/L的NaOH 溶液的pH=11,则该温度下水的K w =______ .在此温度下,将pH =a 的NaOH 溶液V a L 与pH=b 的H 2SO 4溶液V b L 混合,若所得混合液为中性,且a+b =12,则Va :V b = ______ .(2)25℃时,0.1mo l/L 的HaA 溶液中()()-+OH c H c =1010.请回答下列问题: ①H aA 是 ______ (填“强电解质”或“弱电解质”).②在加水稀释Ha A溶液的过程中,随着水量的增加而增大的是 ______ (填字母)a .c (H aA ) b.()()HaA c H c +c .C(H +)与c (OH -)的乘积 d.c(OH-) ③Na a A 溶液显 ______ (填“酸性”、“中性”或“碱性”),理由是(用离子方程式表示) ______ .15. 某市对大气进行检测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um 的悬浮颗粒物)其主要来源为燃烧、机动车尾气等.因此,对PM2.5、S O2、NO 等进行研究具有重要意义.回答下列问题:(1)已知:C H4(g)+2O 2(g)=C O2(g)+2H 2O(l )△H=-890.3KJ/m olN 2(g)+O 2(g)=2NO(g )△H=+180KJ/mol ﻫCH 4可用于燃烧脱硝,CH 4(g)+4NO(g)=CO 2(g)+2N 2(g)+2H 2O(l )△H=______.(2)汽车尾气中NO x 和CO 的生成及转化ﻫ①已知气缸中生成NO 的反应为:N 2(g )+O2(g)⇌2NO (g)△H>0汽车启动后,气缸温度较高,单位时间内NO排放量越大,原因是______.ﻫ②汽车燃油不完全燃烧时产生C O,有人设想按下列反应除去CO;2C O(g)=2C(s)+O 2(g )已知反应的△H>0,简述该设想能否实现的依据______. ③目前,在汽车尾气系统中安装催化转化器可减少CO 和NO 的污染,其化学方程式为______.(3)一定温度下,在密闭容器中反应2NO 2(g)⇌N 2O 4(g )△H =-57.20KJ /m ol达到平衡.其他条件不变时,下列措施能提高NO 2转化率的是______(填字母)ﻫa.减小N O2的浓度 b.降低温度 c.增加N O2的浓度 d .升高温度在一定温度和压强下,密闭容器中N2O 4和N O2的混合气体达到平衡时,c(N2O 4)=0.0120mo l/L(已知2NO 2(g)⇌N 2O 4(g)反应在该温度下的平衡常数K =340).计算平衡时N O2物质的量浓度为______. 16. 为了探究外界条件对H 2O2分解速率的影响,有同学利用实验室提供的仪器和试剂进行了如下实验,请填写下列空白: ﻫ试剂:5%H2O 2溶液,10%H2O 2溶液,1mol/L Fe Cl3溶液,MnO 2粉末 ﻫ仪器:试管、胶头滴管、酒精灯(1)实验目的:探究温度对化学反应速率的影响 ﻫ实验步骤:分别对A 、B 两支试管中加入5mL 5%H 2O 2溶液,将试管A 放入5℃水浴中,将试管B 放入40℃水浴中,同时分别向两试管中加入2~3滴1mol/LFeCl 3溶液.观察实验现象.实验现象:试管 ______ (填“A”或“B ”)中产生气泡的速率快,说明 ______ . (2)实验目的:探究浓度对化学反应速率的影响实验步骤:向试管A中加入5m L 5%H2O 2溶液,向试管B中加入5mL 10%H 2O 2溶液,观察实验现象. ﻫ实验现象:试管A 、B 中均有少量气体缓慢产生. ﻫ请你改进实验方案,使该实验的实验现象更为明显,以支撑“浓度改变会影响化学反应速率”这一理论预测, ______ . ﻫ(3)实验目的: ______ .实验步骤:分别向试管A 和B 中加入5m L 5%H 2O2溶液后,再向试管B中加入1mL 1mol /L 的FeC l3溶液,观察实验现象.你认为方案(3)的设计是否严谨? ______ (填是或否),说明理由 ______ . 17. 请设计“以镁与不同浓度稀硫酸反应探究浓度对化学反应速率影响”的实验方案.实验中可供选择的试剂与用品:镁带(密度1.74g/cm 、宽度0.5cm 、厚度0.05c m)、砂纸、剪刀、1.0m ol/L 的硫酸、蒸馏水、恒温水浴箱、试管、量筒、秒表. ﻫ实验方案: ______ .18.乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:学习小组的同学设计了滴定的方法测定x值.①称取1.260g纯草酸晶体,将其制成100.00mL水溶液为待测液.②取25.00mL待测液放入锥形瓶中,再加入适量的稀硫酸. ﻫ③用浓度为0.1000mol/L的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00mL. ﻫ回答下列问题: 1(ﻫ)配平氧化还原反应方程式: ______H2C2O4+ ______ MnO4-+ ______ H+= ______ CO2↑+Mn2++ ______ H2O ﻫ(2)滴定时,将酸性KMnO4标准液装在如图中的______ (填“甲”或“乙”)滴定管中.(3)本实验滴定达到终点的标志是______ . ﻫ(4)通过上述数据,求x的值(写出计算过程).ﻫ(5)误差分析:①若滴定终点时俯视滴定管刻度,则由此测得的x值会______ (填“偏大”、“偏小”或“不变”,下同).②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会______ .19.10℃加热NaHCO3饱和溶液,测得该溶液的pH发生如下的变化:温度(℃)10 20 30 加热煮沸后冷却到50℃PH 8.3 8.48.5 8.8(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该水解反应的离子方程式为______ .(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度______ (填“大于”或“小于”)NaHCO3,该分解反应的方程式为______ .(3)丙同学认为甲、乙的判断都不充分.丙认为:①只要在加热煮沸的溶液中加入足量的试剂BaCl2溶液,若产生沉淀,则乙判断正确.原因是______ .能不能选用Ba(OH)2溶液?______ (答“能”或“不能”)ﻫ②将加热后的溶液冷却到10℃,若溶液的pH ______ (填“大于”、“小于”或“等于”)8.3,则______ (填“甲”或“乙”)判断正确.。
人教版高中化学选修四 化学反应原理 测试考卷 含答案

绝密★启用前人教版高中化学选修四化学反应原理测试考卷本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分,考试时间90分钟。
第Ⅰ卷一、单选题(共10小题,每小题3.0分,共30分)1.根据以下三个热化学方程式:①2H2S(g)+3O2(g)===2SO2(g)+2H2O(l) ΔH=-Q1kJ·mol-1②2H2S(g)+O2(g)===2S(s)+2H2O(l) ΔH=-Q2kJ·mol-1③2H2S(g)+O2(g)===2S(s)+2H2O(g) ΔH=-Q3kJ·mol-1判断Q1、Q2、Q3三者关系正确的是()A.Q1>Q2>Q3B.Q1>Q3>Q2C.Q3>Q2>Q1D.Q2>Q1>Q32.下列物质的水溶液中,所含微粒种类最多的是()A. NH3B. Cl2C. H2SO4D. NaOH3.下列对“改变反应条件,导致化学反应速率改变”的原因描述不正确的是( )A.增大反应物的浓度,活化分子百分数增加,反应速率加快B.增大气体反应体系的压强,单位体积中活化分子数增多,气体反应速率加快C.升高反应的温度,单位体积中活化分子数增多,有效碰撞的几率提高,反应速率增大D.催化剂通过改变反应路径,使反应所需的活化能降低,反应速率增大4.以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是()A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系C.电镀时保持电流恒定,升高温度不改变电解反应速率D.镀锌层破损后即对铁制品失去保护作用5.对于达到平衡的可逆反应:X+Y W+Z,其他条件不变时,增大压强,正、逆反应速率变化的情况如图所示。
下列对X、Y、W、Z四种物质状态的描述正确的是()A. W、Z均为气体,X、Y中只有一种为气体B. X、Y均为气体,W、Z中只有一种为气体C. X、Y或W、Z中均只有一种为气体D. X、Y均为气体,W、Z均为液体或固体6.已知298 K时,H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3 kJ·mol-1,推测含1 mol HCl的稀溶液与含1 mol NH3的稀溶液反应放出的热量()A.大于57.3 kJB.等于57.3 kJC.小于57.3 kJD.无法确定7.已知强酸与强碱的稀溶液发生中和反应的热化学方程式为H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3 kJ·,向0.1 L 0.2 kJ·的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀盐酸,恰好完全反应。
高二化学选修4_化学反应原理综合测试题

高二化学选修4 化学反应原理综合测试题一.选择题(本题包括10小题,每小题2分,共20分,每小题只有一个正确答案)1.“纯净水”、“太空水”、“蒸馏水”等商品作为日常饮用水,因缺少某些成分而不利于少年儿童身体健康,你认为在制备上述商品饮用水时至少还需要添加的微量物质是A.钙和镁的碳酸氢盐B.含碘酸盐的食盐C.漂白粉等消毒剂D.小苏打2.下列事实不能用电化学原理解释的是()A.常温条件下,在空气中铝不容易被腐蚀B.镀锌铁片比镀锡铁片更耐腐蚀C.用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜D.远洋海轮的尾部装上一定数量的锌板3.沼气是一种能源,它的主要成分是CH4。
0.5molCH4完全燃烧生成CO2和液态水时放出445kJ的热量,则下列热化学方程式中正确的是()A.2CH4(g)+4O2(g)==2CO2(g)+4H2O(l);ΔH=+890kJ·mol-1B.CH4(g)+2O2(g)== CO2(g)+2H2O(l);ΔH=+890kJ·mol-1C.CH4(g)+2O2(g)== CO2(g)+2H2O(l);ΔH=-890kJ·mol-1D.1/2CH4(g)+ O2(g)== 1/2CO2(g)+ H2O(l);ΔH=-890kJ·mol-14.铁棒与石墨棒用导线连接后,浸入0.01 mol·L-1的食盐溶液中,可能出现的现象是( )A.铁棒附近产生OH-B.铁棒被腐蚀C.石墨棒上放出Cl2D.石墨棒上放出O25.某一反应在一定条件下的平衡转化率为25.3%,当有一催化剂存在时,其转化率为()A.大于25.3% B.小于25.3% C.等于25.3% D.约等于25.3%6.反应CO+H2O(g)CO2+H2在1000 K达到平衡时,分别改变下列条件,K值发生变化的是A.将压强减小至原来的一半B.将反应温度升高至1200 K C.添加催化剂D.增大水蒸气的浓度7.用惰性电极电解M(NO3)x的水溶液,当阴极增重a克时,在阳极上同时产生b L氧气(标准状况),从而可知M 的相对原子质量为( )A.22.4ax / b B.11.2ax / b C.5.6ax / b D.2.5ax / b8.下列说法不正确的是( )A.0.2 mol·L-1的NaHCO3溶液中:[Na+]>[HCO3-]>[OH-]>[H+]B.将等体积pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的水量多C.向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:[NH4+] = [Cl-]D.pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>79.用物质的量都是0.1mol的HCN和NaCN混合后配成1L溶液,已知溶液中的c(CN-)<c(Na+),下列关系式正确的是( )A .c(H +)>c(OH -) B .c(HCN)<c(CN -) C .c(CN -)+c(OH -)=0.1mol·L -1D .c(HCN)+c(CN -) =0.2mol·L -110.在一支25mL 的酸式滴定管中盛入0.1mol ·L -1HCI 溶液,其液面恰好在5mL 的刻度处...,若把滴定管中的溶液全部放入....烧杯中,然后以0.lmol ·L -1NaOH 溶液进行滴定,则所需NaOH 溶液的体积 ( ) A .大于20 mL B .小于20 mL C .等于20 mL D .等于5mL二、选择题(本题包括10小题,每小题3分,共30分,每小题有一至两个正确答案) 11.反应2X(g)+Y(g)2Z(g);△H<0,在不同温度(T 1和T 2)下,产物Z 的物质的量n 与反应时间t 的关系如图所示,则下列判断中正确的是( ) A .T 1<T 2,P 1<P 2 B .T 1<T 2,P 1>P 2C .T 1>T 2,P 1>P 2D .T 1>T 2,P 1<P 212.为了除去ZnCl 2酸性溶液中的Fe 3+,可在加热搅拌的条件下加入一种试剂,使溶液的pH 升高,过滤后再向溶液中加入适量盐酸,这种试剂是A .ZnOB .K 2CO 3C .KOHD .ZnCO 3 13.对可逆反应4NH 3(g )+5O 2(g )4NO (g )+6H 2O (g ),下列叙述正确的是A .达到化学平衡时,4υ正(O 2)=5υ逆(NO )B .若单位时间内生成x mol NO 的同时,消耗x mol NH 3,则反应达到平衡状态C .达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大D .化学反应速率关系是:2υ正(NH 3)=3υ正(H 2O )14.X 、Y 、Z 、M 代表四种金属元素。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学选修四《化学反应原理》总复习试题第Ⅰ卷(共48分)1.下列叙述正确的是()A.O2和O3互为同素异形体,性质相似B.常温下,PH=1的水溶液中,N a+、NO3-、HCO3-、F e2+可以大量共存C.明矾和漂白粉用于自来水的净化和杀菌消毒,两者的作用原理相同D.C(石墨,s)=C(金刚石,s);△H>0,所以石墨比金刚石稳定2.已知:①1molH2分子中化学键断裂时需要吸收436kJ的能量②1molCl2分子中化学键断裂时需要吸收243kJ的能量③由H原子和C1原子形成1 mol HC1分子时释放431 kJ的能量。
下列叙述正确的是()A氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+C12(g)= 2HC1(g)B氢气和氯气反应生成2 mol氯化氢气体,反应的△H= 183 kJ·mol-1C.氢气和氯气反应生成2 mol氯化氢气体,反应的△H= -183 kJ·mol-1D.氢气和氯气反应生成1 mol氯化氢气体,反应的△H= -183 kJ·mol -13.合成氨工业对国民经济和社会发展具有重要的意义。
对于密闭容器中的反应:N2(g)+3H2(g)== 2NH3(g),673 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如图所示。
下列叙述正确的是()A.点a的正反应速率比点b的大B.点c处反应达到平衡C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样D.其他条件不变,773K下反应至t1时刻,n(H2)比图中d点的值大4.对可逆反应4NH3(g)+5O2(g)==4NO(g)+6H2O(g),下列叙述正确的是()A.达到化学平衡时,4v正(O2)=5v逆(NO)B.若单位时间内生成x mol NO的同时,消耗x molNH3,则反应达到平衡状态C.达到化学平衡时,若增加容器体积,则正反应速减小,逆反应速率增大D.化学反应速率关系是2v正(NH3)= 3v正(H2O)5.在一恒定容积的容器中充入4 mol A和2 mol B发生如下反应:2A(g)+B(g)== xC(g),达到平衡后,C的体积分数为W%。
若维持容积和温度不变,按1.2 mol A、0.6 mol B和2.8 mol C为起始物质,达到平衡后,C的体积分数仍为W%,则x的值为()A.只能为2B.只能为3C.可能为2,也可能为3D.无法确定6.一定温度下,可逆反应2NO2===2NO+O2在体积固定的密闭容器中反应,达到平衡状态的标志是()①单位时间内生成n mol O2,同时生成2n mol NO2②单位时间内生成n mol O2,同时生成2n mol NO③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1④混合气体的压强不再改变⑤混合气体的颜色不再改变⑥混合气体的平均相对分子质量不再改变A.①④⑤⑥B.①②③⑤C.②③④⑥D.以上全部7.一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g)==H2(g)+I2(g)。
若c(HI)由0.1 mol·L-1降到0. 07 mol·L-1时,需要15 s,那么c(HI)由0. 07 mol·L-1降到0.05 mol·L-1时,所需反应的时间为()A.等于5 sB.等于10 sC.大于10 sD.小于l0 s8.利用图所示装置做下面的实验:在烧杯里盛半杯乙溶液,然后用滴定管向容器中滴入甲溶液。
随着甲的滴入,电灯渐渐变暗,滴到一定量时,电灯完全熄灭,继续滴入甲溶液,电灯又会逐渐亮起来。
下列各组溶液中(甲在前,乙在后),能够产生上述现象的是()A. NH3·H2O 、AgNO3B.CH3COOH、NH3·H2OC. NaOH、AlC13D. H2SO4、Ba(OH)29.常温下,pH=10的X、Y两种碱溶液各1 mL,分别稀释至100 mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是()A.X、Y两种碱溶液中溶质的物质的量浓度一定相等B.稀释后,X溶液的碱性比Y溶液的碱性强C.分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸的体积Vx>V yD.若8<a<10,则X、Y都是弱碱10.下列各溶液中,微粒的物质的量浓度关系正确的是()A. 0. 1 mol·L-1Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)B. 0. 1 mol·L-1 NH4Cl溶液:c(NH4+)=c(Cl-)C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)D.向硝酸钠溶液中滴加稀盐酸得到的PH=5的混合溶液:c(Na+)=c(NO3-)11.物质的量浓度相同时,下列既能跟NaOH溶液反应,又能跟盐酸反应的溶液中,pH最大的是()A. Na2CO3溶液B. NH4HCO3溶液C. NaHCO3溶液D. NaHSO4溶液12.某同学按图所示的装置进行电解实验。
下列说法正确的是()A.电解过程中,铜电极上有H2产生B.电解初期,主要反应方程式为:Cu + H2SO4 ====C u SO4 + H2↑C.电解一定时间后,石墨电极上有铜析出D.整个电解过程中,H+的浓度不断增大13.某学生设计了一个“黑笔写红字”的趣味实验。
滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。
据此,下列叙述正确的是()A.铅笔端作阳极,发生还原反应B.铂片端作阴极,发生氧化反应C.铅笔端有少量的氯气产生D. a 点是负极,b 点是正极14 .在盛有稀H 2SO 4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )A.正极附近的SO 42-离子浓度逐渐增大B.电子通过导线由铜片流向锌片C.正极有O 2逸出D.铜片上有H 2逸出15.40℃时,等质量的两份饱和石灰水,一份冷却至10℃,另一份加少量CaO 并保持温度仍为40℃,这两种情况下都不改变的是( )A. Ca(OH)2的溶解度B.溶液的质量C.溶质的质量分数D.溶液中Ca 2+数目16.向Cr 2(SO 4)3的水溶液中加入NaOH 溶液,当pH =4.6时,开始出现Cr(OH)3沉淀,随着pH 的升高,沉淀增多;但当pH >13时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO 22-)。
其平衡关系如下:Cr 3++3OH -====Cr(OH)3====CrO 22- + H + + H 2O(紫色) (灰绿色) (亮绿色)向0. 05mo1·L -1 Cr 2(SO 4)3溶液50mL 中,加入1.0mol ·L -1NaOH 溶液50mL ,充分反应后,溶液中可观察到的现象是( )A.溶液为紫色B.溶液中有灰绿色沉淀C.溶液为亮绿色D.无法判断第Ⅱ卷(共52分)17.(6分)(Ⅰ)已知在448℃时,反应H 2(g )+I 2(g )===2HI (g )的平衡常数K 1为49,则该温度下反应2HI (g )===H 2(g )+I 2(g )的平衡常数K 2为_________;反应21H 2(g )+21I 2(g )===HI (g )的平衡常数K 3为__________。
(Ⅱ)在一定体积的密闭容器中,进行如下化学反应:CO 2(g )+H 2(g )===CO (g )+H 2O(g),其化学平衡常数K和温度t的关系如下表所示:回答下列问题:(1)该反应的化学平衡常数表达式为K=____________________。
(2)该反应为__________反应(填“吸热”或“放热”)。
(3)能判断该反应达到化学平衡状态的依据是()。
A.容器中压强不变B.混合气体中C(CO)不变C.V(H2)正=V(H2O)逆D. c(CO2)=c(CO)(4)某温度下,平衡浓度符合下式:C(CO2)·C(H2)=c(CO)·c(H2O),试判断此时的温度为____________℃。
18.(6分)在一定温度下将2mo1 A和2mo1 B两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g) ==2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白:(1)B的平衡浓度为______________。
(2)A的转化率为_____________。
(3) 用D表示的平均反应速率为_________。
(4)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度、平均相对分子质量________、________。
(两空均填“增大”、“减少”或“不变”)(5)如果上述反应在相同条件下从逆反应开始进行,开始加C和D各4/3 mol,要使平衡时各物质的体积分数与原平衡相等,则还应加入_________mol B物质。
19.(8分)(1)常温下,将1 mL pH=1的H2SO4溶液加水稀释至100mL,稀释后的溶液中C(H+)/C(OH-)=___________________(2)某温度时,测得0. 01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数K W=_____________。
该温度___________25℃。
(3)常温下,设pH = 5的H2SO4的溶液中由水电离出的H+浓度为C1;pH=5的A12(SO4)3溶液中由水电离出的H+浓度为C2,则C1/C2=_______(4)常温下,pH=13的Ba(OH)2溶液aL与PH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计)。
若所得混合溶液呈中性,则a:b=________。
若所得混合溶液PH=12,则a:b=___________。
(5)在(2)所述温度下,将PH=a的NaOH溶液V aL与pH=b的硫酸Vb L混合。
①若所得混合液为中性,且a=12,b=2,则Va:Vb=____________②若所得混合液的州PH=10,且a=12,b=2,则Va:Vb=____________20.(9分) DIS系统即数字化信息系统,它由传感器、数据采集器和计算机组成,某学习小组用DIS系统测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力来判断滴定终点。
实验步骤如下:(1) 用_________________(填仪器名称)量取10. 00m L的食用白醋,在______________(填仪器名称)中用水稀释后转移到100mL________(填仪器名称)中定容,然后将稀释后的溶液倒人试剂瓶中。
(2)量取20. 00 mL的上述溶液倒入烧杯中,连接好DIS 系统(如上图),向烧杯中滴加浓度为0.1000mo l·L -1的氨水,计算机屏幕上显示出溶液导电能力随氨水体积变化的曲线(见下图)。
