沉淀分离法ppt课件
合集下载
沉淀分离技术—有机溶剂沉淀法分离超氧化歧化酶(生物分离技术课件)

任务4.3 有机溶剂沉淀法分离超氧化歧化酶
学习目标
① 了解有机溶剂沉淀法分离的原理;
② 能够进行有机溶剂沉淀法操作。
重难点
重点:了解常用有机溶剂的选择和计算;
难点:了解有机溶剂沉淀法的影响因素。
目录
有机溶剂沉淀法分离的原理
常用有机溶剂的选择和计算
有机溶剂沉淀法的影响因素
有机溶剂沉淀法操作注意事项
一.有机溶剂沉淀法分离的原理
利用与水互溶的有机溶剂(如甲醇、乙醇、丙酮等)能使蛋白质在水
中的溶解度显著降低而沉淀的方法,称为有机溶剂沉淀。
一.有机溶剂沉淀法分离的原理
有机溶剂引起蛋白质沉淀的主要原因是加入有机溶剂使水溶液的介
电常数降低,因而增加了两个相反电荷基团之间的吸引力,促进了蛋白
质分子的聚集和沉淀。有机溶剂引起蛋白质沉淀的另一种解释认为与盐
析相似,有机溶剂与蛋白质争夺水化水,致使蛋白质脱除水化膜,而易
于聚集形成沉淀 。
一.有机溶剂沉淀法分离的原理
沉淀
原理1
静电作
脱水作
原理2
用
用
二.常用有机溶剂的选择和计算
1.有机溶剂的选择
水溶
性
小
无限互溶
介电
常数
致变
性
小
二.常用有机溶剂的选择和计算
1.有机溶剂的选择
毒性
低
成本
小
二.常用有机溶剂的选择和计算
2.有机溶剂的剂量的计算
V=
0 2 −1
100−2
Байду номын сангаас
三.有机溶剂沉淀法的影响因素
1.温度
三.有机溶剂沉淀法的影响因素
2.浓度
蛋白质5~20mg/mL
沉淀分离技术—等电点沉淀法分离(生物分离技术课件)

一.两性离子与等电点 2.等电点
二.等电点沉淀法的原理
等电点沉淀法是利用蛋白质在等电点时溶解度最 低而各种蛋白质又具有不同等电点的特点进行分离的 方法。
二.等电点沉淀法的原理
在等电点时,蛋白质分子以两性离子形式存在,其分子净电荷为零( 即正负电荷相等),此时蛋白质分子颗粒在溶液中因没有相同电荷的相互 排斥,分子相互之间的作用力减弱,其颗粒极易碰撞、凝聚而产生沉淀 ,所以蛋白质在等电点时,其溶解度最小,最易形成沉淀物。等电点时 的许多物理性质如黏度、膨胀性、渗透压等都变小,从而有利于悬浮液 的过滤。
二.等电点沉淀法的原理
不同的蛋白质,具有不同的等电点 同一种蛋白质在不同条件下,等电点不同 目的药物成分对pH值的要求 采用几种方法结合来实现沉淀分离
三.等电点沉淀法操作 ห้องสมุดไป่ตู้.等电点沉淀法应用
等电点 不同
初步纯 化
除杂 蛋白
酸碱性
多法结 合
任务4.2 等电点沉淀法分离RNA
学习目标
① 了解两性离子与等电点的相关知识; ② 能够进行等电点沉淀法操作。
重难点
重点:了解等电点沉淀法的原理; 难点:了解盐析沉淀的原理,掌握盐析常用中性盐的选择。
目录
两性离子与等电点 等电点沉淀法的原理
等电点沉淀法操作
一.两性离子与等电点 1.两性离子
一.两性离子与等电点 2.等电点
共沉淀分离法ppt

由于海水中各组分的含量很少,无法直接滴定测量, 要先进行预浓集。具体方法如下:
20毫克三价铁盐 HCl溶解
5升水样
氨水
氢氧化铁沉淀 三价铁盐和氨水 氢氧化铁沉淀
Ge(Li)谱仪 过 滤 组分离 灼 烧
可定量测La Sm Yb Lu等
氧化铁
共沉淀分离法的历史及优势
一种古老的分离方法 镭的发现 为放射化学发展作出了巨大贡献 后来出现了许多更优秀的分离方 法,如萃取,离子交换法等 但是由于方法简便,实验条件易 于满足,共沉淀分离法在微量元 素或放射性核素分析中仍应用广 泛。
例如: 明矾净水的原理
吸附共沉淀和混晶共沉淀的比较
选择性差 过滤和洗涤都较困难 沉淀颗粒小,比表面 大,分离富集效率高 应用广泛
吸附共沉淀 在实际测定中都需采取一定措施消除载体对微量组分 测定的干扰。
选择性好 易于过滤和洗涤 需满足一定条件才 可用(半径相似等)
混晶共沉淀
返回
(三)形成单质的共沉淀
共沉淀分离法
赵珺 03088048
什么是共沉淀?
当沉淀从溶液中析出时,溶液中的某些原本 可溶的组分被沉淀载带而混杂于沉淀中,这 种现象称为共沉淀现象。
共沉淀现象常使沉淀被污染,是重量分析中 误差的主要来源 但是,正是利用共沉淀剂对某些微痕量组分的 定量沉淀能力,产生了在分离和富集上有广泛 应用的 共沉淀分离法。
参考书目
《定量化学分离方法》 石影 訾言勤 中国矿业大学出版社,2001年12月 《化学分离法》 秦启宗 毛家骏 陆志仁 原子能出版社 1984 《分析化学》(第四版)武汉大学 编 高 等教育出版社 2000年 3月 《无机化学与化学分析》 史启祯 高等 教育出版社 2003
(一)混晶共沉淀
20毫克三价铁盐 HCl溶解
5升水样
氨水
氢氧化铁沉淀 三价铁盐和氨水 氢氧化铁沉淀
Ge(Li)谱仪 过 滤 组分离 灼 烧
可定量测La Sm Yb Lu等
氧化铁
共沉淀分离法的历史及优势
一种古老的分离方法 镭的发现 为放射化学发展作出了巨大贡献 后来出现了许多更优秀的分离方 法,如萃取,离子交换法等 但是由于方法简便,实验条件易 于满足,共沉淀分离法在微量元 素或放射性核素分析中仍应用广 泛。
例如: 明矾净水的原理
吸附共沉淀和混晶共沉淀的比较
选择性差 过滤和洗涤都较困难 沉淀颗粒小,比表面 大,分离富集效率高 应用广泛
吸附共沉淀 在实际测定中都需采取一定措施消除载体对微量组分 测定的干扰。
选择性好 易于过滤和洗涤 需满足一定条件才 可用(半径相似等)
混晶共沉淀
返回
(三)形成单质的共沉淀
共沉淀分离法
赵珺 03088048
什么是共沉淀?
当沉淀从溶液中析出时,溶液中的某些原本 可溶的组分被沉淀载带而混杂于沉淀中,这 种现象称为共沉淀现象。
共沉淀现象常使沉淀被污染,是重量分析中 误差的主要来源 但是,正是利用共沉淀剂对某些微痕量组分的 定量沉淀能力,产生了在分离和富集上有广泛 应用的 共沉淀分离法。
参考书目
《定量化学分离方法》 石影 訾言勤 中国矿业大学出版社,2001年12月 《化学分离法》 秦启宗 毛家骏 陆志仁 原子能出版社 1984 《分析化学》(第四版)武汉大学 编 高 等教育出版社 2000年 3月 《无机化学与化学分析》 史启祯 高等 教育出版社 2003
(一)混晶共沉淀
沉淀反应的应用课件

沉淀的生成和转化是化学反应中 重要的过程,通过控制条件可以 促进沉淀的生成和转化。
沉淀反应的速率
反应速率的概念
描述了化学反应的快慢,受反应物的浓度、温度、催化剂等 因素影响。
沉淀反应速率的影响因素
沉淀反应的速率受多种因素影响,如反应物的浓度、温度、 催化剂等。
沉淀反应的条件
01
02
03
04
反应物的浓度
沉淀反应的类型
根据沉淀的组成和结构,沉淀反应可分为两类:均相沉淀和多相沉淀。 均相沉淀是指沉淀的组成和结构与反应物相同,例如复分解反应生成的盐和水。
多相沉淀是指沉淀的组成和结构与反应物不同,例如通过离子交换形成的沉淀。
沉淀反应的特点
01
02
03
04
沉淀反应具有选择性,即反应 物在特定条件下才能形成沉淀
等;
2. 配制溶液
根据需要配制一定浓度的溶液;
3. 加入沉淀剂
将沉淀剂加入到溶液中,搅拌均 匀;
6. 分析鉴定
对沉淀进行分析和鉴定,如用 XRD、SEM等方法。
5. 分离沉淀
采用离心机等方法将沉淀分离出 来;
4. 视察和记录现象
视察溶液中的变化,记录沉淀的 颜色、形状、大小等;
实验结果与讨论
通过实验,视察到沉淀的颜色、形状 、大小等变化;
。
沉淀反应具有可逆性,即沉淀 可以重新溶解在溶液中。
沉淀反应具有速率快的特点, 通常可以在短时间内完成。
沉淀反应具有应用广泛的特点 ,可以用于分离、纯化、分析
、制备等许多方面。
02
沉淀反应的基本原理
沉淀反应的化学平衡
沉淀溶解平衡
描述了沉淀溶解和生成的平衡状 态,受温度、浓度、酸度等因素 影响。
沉淀反应的速率
反应速率的概念
描述了化学反应的快慢,受反应物的浓度、温度、催化剂等 因素影响。
沉淀反应速率的影响因素
沉淀反应的速率受多种因素影响,如反应物的浓度、温度、 催化剂等。
沉淀反应的条件
01
02
03
04
反应物的浓度
沉淀反应的类型
根据沉淀的组成和结构,沉淀反应可分为两类:均相沉淀和多相沉淀。 均相沉淀是指沉淀的组成和结构与反应物相同,例如复分解反应生成的盐和水。
多相沉淀是指沉淀的组成和结构与反应物不同,例如通过离子交换形成的沉淀。
沉淀反应的特点
01
02
03
04
沉淀反应具有选择性,即反应 物在特定条件下才能形成沉淀
等;
2. 配制溶液
根据需要配制一定浓度的溶液;
3. 加入沉淀剂
将沉淀剂加入到溶液中,搅拌均 匀;
6. 分析鉴定
对沉淀进行分析和鉴定,如用 XRD、SEM等方法。
5. 分离沉淀
采用离心机等方法将沉淀分离出 来;
4. 视察和记录现象
视察溶液中的变化,记录沉淀的 颜色、形状、大小等;
实验结果与讨论
通过实验,视察到沉淀的颜色、形状 、大小等变化;
。
沉淀反应具有可逆性,即沉淀 可以重新溶解在溶液中。
沉淀反应具有速率快的特点, 通常可以在短时间内完成。
沉淀反应具有应用广泛的特点 ,可以用于分离、纯化、分析
、制备等许多方面。
02
沉淀反应的基本原理
沉淀反应的化学平衡
沉淀溶解平衡
描述了沉淀溶解和生成的平衡状 态,受温度、浓度、酸度等因素 影响。
分离科学与技术第2章 沉淀分离法
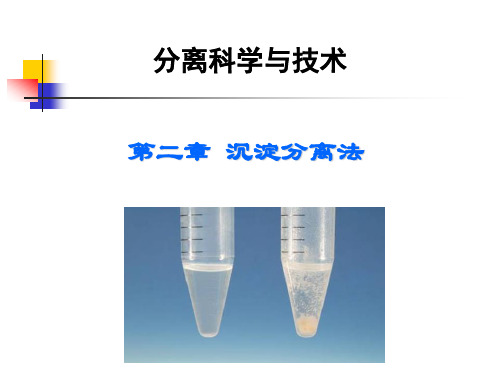
第二章 沉淀分离法
2.2 沉淀的生成过程 2.2.5 分级沉淀 分级沉淀:两种难溶盐(阳离子或阴离子相同),若 其溶度积相差足够大时,可通过加入沉淀剂将其先后分 别沉淀出来加以分离。 溶度积小的难溶盐先沉淀,如 AgI 较 AgCl 先沉淀。
第二章 沉淀分离法
2.2 沉淀的生成过程 2.2.5 分级沉淀
第二章 沉淀分离法
2.2 沉淀的生成过程 2.2.4 晶形沉淀与胶体 内因: 沉淀的性质
生成沉淀类型 外因
沉淀的形成条件
沉淀的后处理
沉淀类型:晶形沉淀、无定形沉淀、凝乳状沉淀
几种类型沉淀的比较 特点 直径 晶形沉淀 0.1~1 m 凝乳状沉淀 0.02~0.1 m 无定形沉淀 < 0.02 m
[I ] [Cl ] 6 6 10 , 10 [Cl ] [I ]
Ksp,AgI = [Ag+][I] = 9.31017 Ksp,AgCl = [Ag+][Cl] = 1.81010 当 [Cl]/[I] < 106 时,只有 AgI 析出; 当 [Cl]/[I] > 106 时,AgCl 才开始析出。
第二章 沉淀分离法
2.1 沉淀生成的条件 2.1.3 氢离子浓度及配位剂的影响 配位剂的影响: 难溶盐沉淀 + 配位剂 溶解度增大(或完全溶解)
第二章 沉淀分离法
2.1 沉淀生成的条件 2.1.4 有机溶剂的影响 有机溶剂的影响: 难溶盐沉淀 + 有机溶剂 溶解度减小(溶剂化作用较 小,介电常数较低)。如 PbSO4: 100 mL H2O: 4.0 mg, 100 mL 20% 乙醇: 4.0/10 mg 100 mL 乙醇: 4.0/1500 mg
第二章 沉淀分离法
《物质的分离》PPT课件(完美版)

操作注意点:
(1)温度计下端玻璃泡位于蒸馏烧瓶的支管口处。 (2)蒸馏烧瓶中加入碎瓷片,以防暴沸。 (3)石棉网的作用是使烧瓶受热均匀。 (4)冷凝管中水流方向:自下而上,使冷却更充分。 (5)蒸馏法的应用:海水中提取淡水。
《物质的分离》PPT课件
《物质的分离》PPT课件
把水加热至沸腾,产生的水蒸气经冷却形成液 态水的方法称为蒸馏法。用这种方法收集到的 水就是蒸馏水。
制作《净水器》
①活性炭净水器 ②简易净水器 2、河水过滤后,滤液可以喝吗? 不能,因为过滤不能去除可溶的杂质及微生物
《物质的分离》PPT课件
《物质的分离》PPT课件
鲁滨逊利用自制的过滤柱过滤泥水, 然后把已经过滤的水煮沸。
但水仍非绝 对安全饮用
鲁滨逊制取的水可以喝吗?
《物质的分离》PPT课件
《物质的分离》PPT课件
从漏斗中取出滤纸,细心观察,滤纸上留下了什 么?泥浆水发生了什么变化?
《物质的分离》PPT课件
《物质的分离》PPT课件
想一想:
1、过滤后,滤液仍然浑浊 可能的原因有那些?
(1)滤纸破损 (2)滤液边缘高于滤纸边缘 (3)仪器不干净等 应该再过滤一次,直到澄 清为止。
《物质的分离》PPT课件
《物质的分离》PPT课件
《物质的分离》PPT课件
《物质的分离》PPT课件
沉淀法:使水中的杂质沉淀到水底的方法。
原理 根据物质的溶解性不同
适用范围: 用于分离液体中有混合 的不溶性的固体杂质
凝聚剂的作用: 使水中的悬浮杂质凝聚成一些较大的 颗粒并慢慢沉到水底
明矾是一种凝聚剂
《物质的分离》PPT课件
《物质的分离》PPT课件
二低
①滤纸边缘低于漏斗边缘
(1)温度计下端玻璃泡位于蒸馏烧瓶的支管口处。 (2)蒸馏烧瓶中加入碎瓷片,以防暴沸。 (3)石棉网的作用是使烧瓶受热均匀。 (4)冷凝管中水流方向:自下而上,使冷却更充分。 (5)蒸馏法的应用:海水中提取淡水。
《物质的分离》PPT课件
《物质的分离》PPT课件
把水加热至沸腾,产生的水蒸气经冷却形成液 态水的方法称为蒸馏法。用这种方法收集到的 水就是蒸馏水。
制作《净水器》
①活性炭净水器 ②简易净水器 2、河水过滤后,滤液可以喝吗? 不能,因为过滤不能去除可溶的杂质及微生物
《物质的分离》PPT课件
《物质的分离》PPT课件
鲁滨逊利用自制的过滤柱过滤泥水, 然后把已经过滤的水煮沸。
但水仍非绝 对安全饮用
鲁滨逊制取的水可以喝吗?
《物质的分离》PPT课件
《物质的分离》PPT课件
从漏斗中取出滤纸,细心观察,滤纸上留下了什 么?泥浆水发生了什么变化?
《物质的分离》PPT课件
《物质的分离》PPT课件
想一想:
1、过滤后,滤液仍然浑浊 可能的原因有那些?
(1)滤纸破损 (2)滤液边缘高于滤纸边缘 (3)仪器不干净等 应该再过滤一次,直到澄 清为止。
《物质的分离》PPT课件
《物质的分离》PPT课件
《物质的分离》PPT课件
《物质的分离》PPT课件
沉淀法:使水中的杂质沉淀到水底的方法。
原理 根据物质的溶解性不同
适用范围: 用于分离液体中有混合 的不溶性的固体杂质
凝聚剂的作用: 使水中的悬浮杂质凝聚成一些较大的 颗粒并慢慢沉到水底
明矾是一种凝聚剂
《物质的分离》PPT课件
《物质的分离》PPT课件
二低
①滤纸边缘低于漏斗边缘
生物分离工程第四章沉淀分离法

3. 分类 – 与羧基、胺及杂环等含氮化合物结合;如Mn2+、Fe2 + 、Zn2 + 、 Cu2 +等 – 与羧基结合,不与胺及杂环等含氮化合物结合;如Ca2 + 、Ba2 + 、 Mg2 + 、Pb2 +等 – 与巯基结合;如Hg + 、Ag + 、Pb2 +等
3、特点
• 沉淀效果很好; • 选择性好 • 容易使生物分子变性 • 复合物难分解
• 丙酮(浓度40-50%) :沉析作用更强,用量省,但毒 性大,应用范围不广;
• 特点:
– 介电常数小, 60%乙醇的介电常数是48
– 容易获取
40-50%丙酮的介电常数是22
4.有机溶剂沉淀的特点
• 分辨率高; • 溶剂容易分离,并可回收使用; • 产品洁净(有机溶剂易祛除); • 容易使蛋白质等生物大分子变性失活; • 应注意在低温下操作; • 成本高
沉淀法分离蛋白质的特点有:
1 在生产的前期就可使原料液体积很快地减小10~50 倍,,从而简化生产工艺、降低生产费用;
2 使中间产物保持在一个中性温和的环境;
3 可及早地将目标蛋白从其与蛋白水解酶混合的溶液中 分离出来、避免蛋白质的降解,提高产物稳定性;
4 用蛋白质沉淀法作为色谱分离的前处理技术,可使色 谱分离使用的限制因素降到最低。
(七)选择性变性沉淀法
• 选择一定的条件使溶液中存在的某些杂质蛋白 变性沉淀下来,而与目的物分开,这种分离方 法就称为选择性变性沉淀法
• 在操作之前要对欲分离的物质中的杂蛋白等杂 质的种类、含量及其物理化学性质等有比较全 面的了解。
使用时需慎重!!!!
选择性变性的方法
• 选择性热变性:对于α-淀粉酶等热稳定性好 的酶,可以通过加热进行热处理,使大多数杂 蛋白受热变性沉淀而被除去。
3、特点
• 沉淀效果很好; • 选择性好 • 容易使生物分子变性 • 复合物难分解
• 丙酮(浓度40-50%) :沉析作用更强,用量省,但毒 性大,应用范围不广;
• 特点:
– 介电常数小, 60%乙醇的介电常数是48
– 容易获取
40-50%丙酮的介电常数是22
4.有机溶剂沉淀的特点
• 分辨率高; • 溶剂容易分离,并可回收使用; • 产品洁净(有机溶剂易祛除); • 容易使蛋白质等生物大分子变性失活; • 应注意在低温下操作; • 成本高
沉淀法分离蛋白质的特点有:
1 在生产的前期就可使原料液体积很快地减小10~50 倍,,从而简化生产工艺、降低生产费用;
2 使中间产物保持在一个中性温和的环境;
3 可及早地将目标蛋白从其与蛋白水解酶混合的溶液中 分离出来、避免蛋白质的降解,提高产物稳定性;
4 用蛋白质沉淀法作为色谱分离的前处理技术,可使色 谱分离使用的限制因素降到最低。
(七)选择性变性沉淀法
• 选择一定的条件使溶液中存在的某些杂质蛋白 变性沉淀下来,而与目的物分开,这种分离方 法就称为选择性变性沉淀法
• 在操作之前要对欲分离的物质中的杂蛋白等杂 质的种类、含量及其物理化学性质等有比较全 面的了解。
使用时需慎重!!!!
选择性变性的方法
• 选择性热变性:对于α-淀粉酶等热稳定性好 的酶,可以通过加热进行热处理,使大多数杂 蛋白受热变性沉淀而被除去。
沉淀PPT课件

速愈快,成平方关系。
因此随粒度的下降, 颗粒的沉降速度会迅 速降低。
▪ 实际水处理过程中,
u g(s L)d2 18
水流呈层去除d>20m
的颗粒。
Stokes公式应用举例:
油珠的直径为50m,密度为 800 kg/m3。试 计算油珠在20℃水中的上浮速度。
解 : 油 珠 d = 5Om=5×lO-5m , 2O℃ 水 的 粘 度 = 0.001OlPa·s,代入Stokes公式得 u=9.81(1000-800)×(5×10 - 5)2/18×1.01×10 - 3 = 2.7×10-4 m/s = 0.97 m/h
特点:沉淀过程中,颗粒的形状、粒径和沉速是变 化的。
3、区域沉淀(或成层沉淀):颗粒(强絮凝性)在 较高浓度(5000mg/L)悬浮液中的沉降。
特点:沉速受其他颗粒影响,颗粒间相对位置 保持不变。一个整体,共同下沉,形成一个清晰的 界面,发生在二沉池的后期,浓缩池的初期。 4、压缩沉淀:悬浮颗粒浓度很高。
式中λ′是雷诺数Re的函数 Re dup
当
Re 1, 24
Re
2 Re 500 , 10
Re
500 Re 10 5 , 0 .44
当颗粒粒径较小、沉速小、颗粒沉降过程中其周围
的绕流流速也小时,颗粒主要受水的粘滞阻力作用,
惯性力可以忽略不计,颗粒运动是处于层流状态。
在层流状态下, 24
u 沉;
18 当s< L时,u<0,颗粒上
2 sL
浮;
当s= L时,u=0,颗粒 既不下沉也不上浮。
Stokes公式说明的问题
(2)水的粘度愈 小,沉速愈快,成 反比关系。因粘度 与水温成反比,故 提高水温有利于颗 粒的沉降。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
往水中加入乙醇、丙酮等有机溶剂,无 机盐的溶解度会减小。 原因:减小了溶剂化作用和较低的介电 常数(ε水=78.5, ε乙醇=24 )
9
2.1.5 温度
沉淀的溶解,绝大部分是吸热反 应,其溶解度一般随温度的升高 而增大。
10
2.2 沉淀生成过程
11
vK QS S
v : 沉淀生成的初期速度
Q : 沉淀生成前沉淀物质的过饱和浓度
20
M(OH)n
Mn+ + nOH-
[M n ][OH ]n Ksp
[OH ]
n
Ksp [M n ]
pOH 1 ( pKsp p[M n ]) n
pH pKw 1 ( pKsp p[M n ]) (2 1) n
设金属离子Mn+在溶液中的起始浓度为C,沉淀完全时残
S : 沉淀的溶解度
K :常数
Q S : 沉淀开始生成时的过饱和度
(Q S)/ S : 相对过饱和度
陈化
12
2.3 沉淀类型
2.3.1 分级沉淀 2.3.2 共沉淀 2.3.3 均相沉淀
13
2.3.1 分级沉淀
两种阴离子(或阳离子)与相同的阳离子 (或阴离子)形成难溶盐,其溶度积相差 足够大时,加入沉淀剂可从混合溶液中将 其分别沉淀出来加以分离。
Al2(SO4)3 CaSO4 ,K2SO4 , Ca(NO3)2 ,Ba(NO3)2 15
2.3.3 均相沉淀
通过适当化学反应,均匀缓慢地生成沉淀剂。
①pH上升及下降法
(NH2)2CO + H2O
②直接产生沉淀剂
2NH3 + CO2
H3C C C CH3 +NH2OH.HCl
H3C C C CH3 + 2H2O + 2HCl
③ 一般的Ksp是指稀溶液中,无其它离子存在时难溶 化合物的溶度积,实际的溶度积Kap与Ksp之间有一
定差距。
因此,实际的使金属离子氢氧化物沉淀完
全的pH值高于理论计算值,必须由实验确
定。
பைடு நூலகம்
23
各种氢氧化物和含水氧化物沉淀时的pH值范围
元素 Nb,Si,Ta,W Sb(Ⅴ),Sn(Ⅳ) Mn(Ⅳ) Pb(Ⅳ) Os(Ⅳ) Ce(Ⅳ),Sb(Ⅲ),Ti,Zr Fe(Ⅲ),Hg(I),Hg(NO3)2 Sn(Ⅱ),Th U(Ⅵ) Al,Be,Cr(Ⅲ),Ir(Ⅳ) Cu,Fe(Ⅱ),Nd,Pb,Pd,Rh Ru,Sm,Y,Yb Cd,Ce(Ⅲ),Co,La,Ni,Pr,Zn HgCl2,Mn(Ⅱ),Ag Mg Ba,Ca,Sr
OO
NOH NOH
H NaNO2
N OH
NO
N
OH
16
③逐渐除去溶剂 预先加入挥发性比水大,且易将待测沉淀溶解的有 机溶剂,通过加热将有机溶剂蒸发,使沉淀均匀析 出。
④破坏可溶性络合物 用加热方法破坏络合物,或用一种离子从络合物中 置换出被测离子,以破坏被测离子络合物 。
17
2.4 沉淀操作条件
Fe3+、Mg2+ NH4Cl NH3.H2O Fe(OH)3↓,Mg2+ Ksp Fe(OH)3 = 7.1×10-40 Ksp Mg(OH)2 = 1.8×10-11
14
2.3.2 共沉淀
当沉淀从溶液中析出时,某些本来不应沉淀的 组分同时被沉淀下来的现象。
共沉淀机理:吸附、生成混晶、形成固溶体、 吸留和包藏、后沉淀等
可用于沉淀洗涤,减少损失.
5
2.1.2 盐效应
盐效应:当溶液中有 与构成沉淀的离子不 同的离子存在时,沉 淀的溶解度增大。 原因:大量的无关离 子存在时,溶液的离 子强度增大,离子的 活度系数相应减小, 使原来饱和的难溶盐 溶液变为不饱和。
6
2.1.3 氢离子浓度及络合剂
氢离子浓度对强酸盐沉淀影响小。对弱酸 盐形成的沉淀,尤其是由有机试剂生成的 沉淀影响较大。
++ -
注:++ —— 杂质可忽略不计;+ —— 纯度增大,仍有杂质残留;
0 —— 无显著变化;- —— 纯度降低
18
2.5 常量组分的沉淀分离
2.5.1 无机沉淀剂分离法 2.5.2 有机沉淀剂分离法
19
2.5.1 无机沉淀剂分离法
2.5.1.1 氢氧化物沉淀分离法
(1)氢氧化物与pH值的关系 多数金属离子能生成氢氧化物沉淀,但沉 淀的溶解度往往相差很大。 可以通过控制溶液酸度使某些金属离子彼 此分离。
第二章
沉淀分离法
separation by precipitation
1
沉淀分离法是在试料溶液中加 入沉淀剂,使某一成分以一定 组成的固相析出,经过滤而与 液相分离的方法。
2
2.1 沉淀生成的条件
2.1.1 溶度积和同离子效应 2.1.2 盐效应 2.1.3 氢离子浓度及络合剂 2.1.4 有机溶剂 2.1.5 温度
沉淀生成条件及操作
使用稀溶液 缓慢沉淀 陈化 高温 搅拌 洗涤 再沉淀 调节pH值 沉淀完迅速过滤 均相沉淀
混晶 0 +
0/ + - + 0
0/ + 0 0 +
杂质 表面吸附
+ + + + + ++ ++ 0 0 ++
形式 包藏 + + + + + 0 ++ 0 0 ++
后沉淀 0 - - - 0 0 + +
HnX + nH2O
nH3O+ + Xn- Xn-:弱酸阴离子
[X
n ]
Ka [Hn X [H3O ]n
]
7
在含难溶盐的溶液中,加入能与被测定的离子生成 络合物的络合剂时,沉淀的溶解度随络合剂添加量 的增大而增大。
AgCl Ag+ + Cl-
+2NH3 Ag(NH3)2+
8
2.1.4 有机溶剂
3
2.1.1 溶度积和同离子效应
nMm+ + mXn-
MnXm(固)
溶度积 Ksp [M m ]n[ X n ]m
Ksp是衡量沉淀溶解度的尺度 有效分离:Ksp≤10-6或更小 几种离子均可沉淀时,其Ksp要有足够的差异
4
同离子效应:
沉淀的溶解度因其共同离子的 一种过量存在而减小的现象。
主沉淀 HgS CuS CdS SnS SnS2 ZnS
共沉物质 CuS,CdS CdS ,ZnS ,FeS
ZnS NiS CoS ,FeS MnS ,CoS ,NiS ,FeS
主沉淀 Fe(OH)3 Cr(OH)3 SiO2▪nH2O Al(OH)3
BeSO4
共沉物质
Cu(OH)2 Zn(OH)2 , Mg(OH)2 Al(OH)3 , Fe(OH)3
留在溶液中的浓度应小于10-6mol▪L-1,由式(2-1)可
计算M(OH)n开始沉淀及沉淀完全时溶液的pH值。
21
22
注意:这种计算是近似的
① 氢氧化物是无定形沉淀,沉淀的溶解度和析出的沉 淀的形态、陈化情况及其它因素有关。
② 金属离子不只以一种阳离子形式存在,可能形成多 种羟基络合物及其它络合物。
9
2.1.5 温度
沉淀的溶解,绝大部分是吸热反 应,其溶解度一般随温度的升高 而增大。
10
2.2 沉淀生成过程
11
vK QS S
v : 沉淀生成的初期速度
Q : 沉淀生成前沉淀物质的过饱和浓度
20
M(OH)n
Mn+ + nOH-
[M n ][OH ]n Ksp
[OH ]
n
Ksp [M n ]
pOH 1 ( pKsp p[M n ]) n
pH pKw 1 ( pKsp p[M n ]) (2 1) n
设金属离子Mn+在溶液中的起始浓度为C,沉淀完全时残
S : 沉淀的溶解度
K :常数
Q S : 沉淀开始生成时的过饱和度
(Q S)/ S : 相对过饱和度
陈化
12
2.3 沉淀类型
2.3.1 分级沉淀 2.3.2 共沉淀 2.3.3 均相沉淀
13
2.3.1 分级沉淀
两种阴离子(或阳离子)与相同的阳离子 (或阴离子)形成难溶盐,其溶度积相差 足够大时,加入沉淀剂可从混合溶液中将 其分别沉淀出来加以分离。
Al2(SO4)3 CaSO4 ,K2SO4 , Ca(NO3)2 ,Ba(NO3)2 15
2.3.3 均相沉淀
通过适当化学反应,均匀缓慢地生成沉淀剂。
①pH上升及下降法
(NH2)2CO + H2O
②直接产生沉淀剂
2NH3 + CO2
H3C C C CH3 +NH2OH.HCl
H3C C C CH3 + 2H2O + 2HCl
③ 一般的Ksp是指稀溶液中,无其它离子存在时难溶 化合物的溶度积,实际的溶度积Kap与Ksp之间有一
定差距。
因此,实际的使金属离子氢氧化物沉淀完
全的pH值高于理论计算值,必须由实验确
定。
பைடு நூலகம்
23
各种氢氧化物和含水氧化物沉淀时的pH值范围
元素 Nb,Si,Ta,W Sb(Ⅴ),Sn(Ⅳ) Mn(Ⅳ) Pb(Ⅳ) Os(Ⅳ) Ce(Ⅳ),Sb(Ⅲ),Ti,Zr Fe(Ⅲ),Hg(I),Hg(NO3)2 Sn(Ⅱ),Th U(Ⅵ) Al,Be,Cr(Ⅲ),Ir(Ⅳ) Cu,Fe(Ⅱ),Nd,Pb,Pd,Rh Ru,Sm,Y,Yb Cd,Ce(Ⅲ),Co,La,Ni,Pr,Zn HgCl2,Mn(Ⅱ),Ag Mg Ba,Ca,Sr
OO
NOH NOH
H NaNO2
N OH
NO
N
OH
16
③逐渐除去溶剂 预先加入挥发性比水大,且易将待测沉淀溶解的有 机溶剂,通过加热将有机溶剂蒸发,使沉淀均匀析 出。
④破坏可溶性络合物 用加热方法破坏络合物,或用一种离子从络合物中 置换出被测离子,以破坏被测离子络合物 。
17
2.4 沉淀操作条件
Fe3+、Mg2+ NH4Cl NH3.H2O Fe(OH)3↓,Mg2+ Ksp Fe(OH)3 = 7.1×10-40 Ksp Mg(OH)2 = 1.8×10-11
14
2.3.2 共沉淀
当沉淀从溶液中析出时,某些本来不应沉淀的 组分同时被沉淀下来的现象。
共沉淀机理:吸附、生成混晶、形成固溶体、 吸留和包藏、后沉淀等
可用于沉淀洗涤,减少损失.
5
2.1.2 盐效应
盐效应:当溶液中有 与构成沉淀的离子不 同的离子存在时,沉 淀的溶解度增大。 原因:大量的无关离 子存在时,溶液的离 子强度增大,离子的 活度系数相应减小, 使原来饱和的难溶盐 溶液变为不饱和。
6
2.1.3 氢离子浓度及络合剂
氢离子浓度对强酸盐沉淀影响小。对弱酸 盐形成的沉淀,尤其是由有机试剂生成的 沉淀影响较大。
++ -
注:++ —— 杂质可忽略不计;+ —— 纯度增大,仍有杂质残留;
0 —— 无显著变化;- —— 纯度降低
18
2.5 常量组分的沉淀分离
2.5.1 无机沉淀剂分离法 2.5.2 有机沉淀剂分离法
19
2.5.1 无机沉淀剂分离法
2.5.1.1 氢氧化物沉淀分离法
(1)氢氧化物与pH值的关系 多数金属离子能生成氢氧化物沉淀,但沉 淀的溶解度往往相差很大。 可以通过控制溶液酸度使某些金属离子彼 此分离。
第二章
沉淀分离法
separation by precipitation
1
沉淀分离法是在试料溶液中加 入沉淀剂,使某一成分以一定 组成的固相析出,经过滤而与 液相分离的方法。
2
2.1 沉淀生成的条件
2.1.1 溶度积和同离子效应 2.1.2 盐效应 2.1.3 氢离子浓度及络合剂 2.1.4 有机溶剂 2.1.5 温度
沉淀生成条件及操作
使用稀溶液 缓慢沉淀 陈化 高温 搅拌 洗涤 再沉淀 调节pH值 沉淀完迅速过滤 均相沉淀
混晶 0 +
0/ + - + 0
0/ + 0 0 +
杂质 表面吸附
+ + + + + ++ ++ 0 0 ++
形式 包藏 + + + + + 0 ++ 0 0 ++
后沉淀 0 - - - 0 0 + +
HnX + nH2O
nH3O+ + Xn- Xn-:弱酸阴离子
[X
n ]
Ka [Hn X [H3O ]n
]
7
在含难溶盐的溶液中,加入能与被测定的离子生成 络合物的络合剂时,沉淀的溶解度随络合剂添加量 的增大而增大。
AgCl Ag+ + Cl-
+2NH3 Ag(NH3)2+
8
2.1.4 有机溶剂
3
2.1.1 溶度积和同离子效应
nMm+ + mXn-
MnXm(固)
溶度积 Ksp [M m ]n[ X n ]m
Ksp是衡量沉淀溶解度的尺度 有效分离:Ksp≤10-6或更小 几种离子均可沉淀时,其Ksp要有足够的差异
4
同离子效应:
沉淀的溶解度因其共同离子的 一种过量存在而减小的现象。
主沉淀 HgS CuS CdS SnS SnS2 ZnS
共沉物质 CuS,CdS CdS ,ZnS ,FeS
ZnS NiS CoS ,FeS MnS ,CoS ,NiS ,FeS
主沉淀 Fe(OH)3 Cr(OH)3 SiO2▪nH2O Al(OH)3
BeSO4
共沉物质
Cu(OH)2 Zn(OH)2 , Mg(OH)2 Al(OH)3 , Fe(OH)3
留在溶液中的浓度应小于10-6mol▪L-1,由式(2-1)可
计算M(OH)n开始沉淀及沉淀完全时溶液的pH值。
21
22
注意:这种计算是近似的
① 氢氧化物是无定形沉淀,沉淀的溶解度和析出的沉 淀的形态、陈化情况及其它因素有关。
② 金属离子不只以一种阳离子形式存在,可能形成多 种羟基络合物及其它络合物。
