海水“制碱”PPT课件3 鲁教版
合集下载
海水“制碱” PPT教学课件3 鲁教版

)
H2O
注:1、碳酸氢钠还有其它性质。 2、根据物质的储存方法可以推测出物质 所具有的化学性质。如:低温、避光可推测出 物质受热、见光易分解; 密封推测该物质可能与空气的某种气体发生反 应等
碳酸氢钠的用途: 阅读48页最后一自然段
谈谈你的收获?
• • • • • • • • • • • • • • • • • • • • • • •
纯碱的用途:阅读课本48页倒数第二段 碳酸氢钠(也叫酸式碳酸钠):
俗名:小苏打
物理性质:通常是白色晶体,能溶于水。
联系你学过的知识并根据碳酸氢钠的组成, 猜测碳酸氢钠可能具有哪些化学性质? 化学性质: 1、受热易分解 2NaHCO3 Na2CO3 CO2 H2O
2、与酸反应(反应类型:
NaHCO3+HCl NaCl CO2
思考:
这两种制碱方法有何异同?
总原理相同:
NaCl +NH3+CO2+H2O 2NaHCO3
======
NaHCO3+ NH4Cl
Na2CO3+CO2↑+ H2O
不同:对过滤出NaHCO3后的母液的处理方法
优点: 原料便宜
氨气和二氧化碳可循环使用
缺点: 氯化钠利用率低
产生了无用的氯化钙,用处不大, 且污染环境. 向析出NaHCO3的母液(氯化铵)中加入 研细的NaCI,使NH4CI结晶析出,用 作氮肥,氯化钠溶液可循环使用。
ቤተ መጻሕፍቲ ባይዱ
侯氏制碱法的反应原理
① NaCl+ NH3+ H2O + CO2=== NaHCO3↓+ NH4Cl ② 2NaHCO3加热 Na2CO3 + H2O + CO2 ③向析出NaHCO3的母液中加入研细的NaCI,还得到另一产品NH4CI固体
九年级全册鲁教版3.3海水制碱 课件3

2NH4Cl+Ca(OH)2=CaCl2+2NH3 +2H2O
氨碱法有什么优点和缺点呢? 优点: ①原料经济易得。
② NH3 和CO2可循环使用。 缺点: ① 回收氨时产生的CaCl2用处不大且污染环境。
②NaCl利用率不高
侯徳榜是如何改进氨碱法的?
+食盐 氯化铵溶液
NH4Cl
用作 氮肥
NaCl 循环 使用
A. Na2CO3俗名为纯碱,故它属于碱类 B.热的Na2CO3溶液可用来除去油污 C. 水溶液显酸性
D.与稀硫酸反应放出无色有刺激性气味的气味
2、小明学习化学后, 在家里想用化学方法来鉴别碱面(主要
B 成分是碳酸钠)和食盐, 你认为下列方法可行的是( )
A.观察它们的颜色
B.取少量分别倒入食醋
C.分别倒入水中观察是否溶解 D.分别尝它们的味道
立的。
4、下面是一些常见物质的俗称或主要成分, 其中错误的是(A )
A.苏打 碳酸氢钠
B.熟石灰 氢氧ቤተ መጻሕፍቲ ባይዱ钙
C.食盐 氯化钠
D.纯碱
碳酸钠
5、海水“制碱”。氨碱法制纯碱是先通过化学反应生成NaHCO3 和NH4Cl, NaHCO3结晶析出, 再加热NaHCO3制得纯碱。 ①氨碱法制纯碱中生成NaHCO3和NH4Cl的化学方程式为 ___N_a_C__l+_N__H_3_+_C_O_2_+_H_2_O_=_N__a_H_C_O__3+_N__H_4。Cl ②反应中生成NaHCO3和NH4Cl 的质量比为84: 53.5, NaHCO3 和NH4Cl的溶解度曲线如图所示。 请分析NaHCO3结晶析出而NH4Cl 没有结晶析出的原因是 _生_成__的__N_a_H_C__O_3_质__量_比__N_H__4C__l多_____
氨碱法有什么优点和缺点呢? 优点: ①原料经济易得。
② NH3 和CO2可循环使用。 缺点: ① 回收氨时产生的CaCl2用处不大且污染环境。
②NaCl利用率不高
侯徳榜是如何改进氨碱法的?
+食盐 氯化铵溶液
NH4Cl
用作 氮肥
NaCl 循环 使用
A. Na2CO3俗名为纯碱,故它属于碱类 B.热的Na2CO3溶液可用来除去油污 C. 水溶液显酸性
D.与稀硫酸反应放出无色有刺激性气味的气味
2、小明学习化学后, 在家里想用化学方法来鉴别碱面(主要
B 成分是碳酸钠)和食盐, 你认为下列方法可行的是( )
A.观察它们的颜色
B.取少量分别倒入食醋
C.分别倒入水中观察是否溶解 D.分别尝它们的味道
立的。
4、下面是一些常见物质的俗称或主要成分, 其中错误的是(A )
A.苏打 碳酸氢钠
B.熟石灰 氢氧ቤተ መጻሕፍቲ ባይዱ钙
C.食盐 氯化钠
D.纯碱
碳酸钠
5、海水“制碱”。氨碱法制纯碱是先通过化学反应生成NaHCO3 和NH4Cl, NaHCO3结晶析出, 再加热NaHCO3制得纯碱。 ①氨碱法制纯碱中生成NaHCO3和NH4Cl的化学方程式为 ___N_a_C__l+_N__H_3_+_C_O_2_+_H_2_O_=_N__a_H_C_O__3+_N__H_4。Cl ②反应中生成NaHCO3和NH4Cl 的质量比为84: 53.5, NaHCO3 和NH4Cl的溶解度曲线如图所示。 请分析NaHCO3结晶析出而NH4Cl 没有结晶析出的原因是 _生_成__的__N_a_H_C__O_3_质__量_比__N_H__4C__l多_____
度鲁教版九年级化学下册课件 第3节 海水“制碱”

5.酸、碱、盐之间产生复分解反应的实质: 酸、碱、盐所电离出的离子相互结合,生成沉淀、
气体或水的过程。 6.复分解反应的类型:
酸+碱 盐+水
酸+盐 新酸+新盐
碱+盐 新碱+新盐
盐+另一种盐
新盐+另一种新盐
跟进训练
1.在滴有紫色石蕊试液的碳酸钠溶液中,加入过量 盐酸,则加盐酸前后溶液的颜色依次为( C )
6.下列各组物质能够共存的是( C ) A.FeCl3溶液、NaOH溶液 B.Ca(OH)2溶液、Na2CO3溶液 C.BaCl2溶液、HCl溶液 D.CaCO3、稀HNO3
7.不能在溶液中大量共存的一组离子是 ( D )
A.K+、Na+、Mg2+、SO42B.Ca2+、H+、NO3-、ClC.Mg2+、K+、NO3-、ClD.H+、SO42-、Ba2+、NO3-
酸、碱、盐之间产生的反应一般都是复分解反应:
酸+碱 盐+水 酸+盐 新酸+新盐 碱+盐 新碱+新盐 盐+另一种盐 新盐+另一种新盐
2.复分解反应产生的条件: 生成物中 有H2O: 如:2NaOH + H2SO4 == Na2SO4+2H2O 有沉淀(↓): 如:AgNO3+HCl == AgCl↓+HNO3 有气体(↑): 如:2HCl+CaCO3 == CaCl2+H2O+CO2↑
阅读P46“复分解反应的实质”。
提出问题: 1.什么是复分解反应? 2.哪些类物质间的反应是复分解反应?(你能用化 学方程式表示吗?) 3.判断复分解反应能否进行,需考虑哪些因素? 4.复分解反应的实质是什么?
AB-海水制碱-鲁教版--用PPT课件
.
8
分析:
索尔维采取了怎样的措 施提高了氨的利用率?
.
9
措施1:
先在饱和食盐水中通NH3至饱和,制得 氨化的饱和食盐水,再与CO2反应
思考:
为什么不能先在饱和食盐水中通CO2至 饱和,再与氨反应?
.
10
措施2:
改进了气体反应物( CO2 )和液体反应物 (氨化的饱和食盐水)的接触方式
思考:
使 CO2 和“氨化的饱和食盐水”怎样 接触才能提高反应效率呢?
H2SO4+Cu(OH)2=
.
+2H2O
32
酸+碱——盐+水
条件: (1)酸和碱至少有一种可溶; (2)若酸是常见的三种强酸,无论碱
是否可溶,反应均可以进行。
三大强酸:盐酸、硫酸、硝酸
.
33
酸、碱的溶解规律
酸:初中范围内的酸全溶
碱:钾、钠、钡、铵,四碱 溶,Ca(OH)2微溶, 其余的全不溶。
.
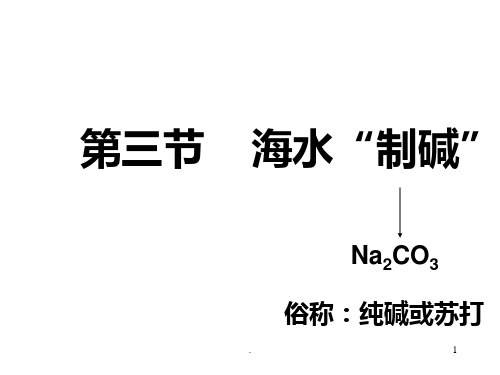
第三节 海水“制碱”
Na2CO3
俗称:纯碱或苏打
.
1
自 然 界 中 有 天 然 纯 碱
内蒙古鄂尔多斯合. 同查汗淖碱湖 2
天然碱
纯碱(Na2CO3)
.
盐湖
?
3
在工业上以氯化钠为主要原料,制取碳酸钠。
思考:NaCl
Na2CO3 从组成上看发生了
什么变化?你认为还需要含什么元素的物质
参加反应?
制取碳酸钠所需要的反应物有:氯化钠、 二氧化碳。仅此这两种物质你认为行不行?
还需要:氨气、水
.
4
饱和食盐水
通入氨气 饱和氨盐水
通入 二氧化碳 过滤
.
第三节海水“制碱”课件(鲁教版(五四制))

2、试着归纳碳酸氢钠有哪些物理性质、化学性质和相关用途。
化学性质: 2NaHCO3 △ Na2CO3+H2O+CO2↑ NaHCO3 + HCl= NaCl+H2O+CO2↑
3、生产中要先向饱和的食盐水中通入氨气,制成饱和的氨盐水后,再通入二氧化碳。可以增加对二
氧化碳的吸取,这是为什么呢?(提示:氨气溶于水形成氨水,可从食盐水和氨盐水的组成上分析)
食盐水
NaCl H2O
氨盐水
碱
NaCl H2O NH3•H2O
认识本质
NH3+H2O+CO2=NH4HCO3
NaCl+ NH4HCO3=NaHCO3 +NH4Cl 复分解反应
为什么反应能产生?
10℃ 20℃ 30℃ NaHCO3 8.1 9.6 11.1 NH4Cl 33.3 37.2 41.4
40℃ 50℃ 12.7 45.8 50.4
1、假设反应在30℃进行,随着反应物量的增加,每
100g水中最多能溶解多少g生成的碳酸氢钠?生成碳
酸氢钠的量超过这个量时,会出现什么现象?
11.1g
超出的碳酸氢钠就无法继续溶 解而结晶析出
2、比较两种物质30℃时的溶解度,为什么碳酸氢钠
先结晶析出?
30℃时,碳酸氢钠的溶解度比氯化铵的小得多, 会第一到达饱和状态进而析出晶体,而氯化铵的 溶解度较大,不会结晶析出。 3、为什么这个复分解反应能产生?
Na C O
原料: NaCl CO2 NH3(媒介)
氨碱法
根据视频内容和课本71页最后一段完成下列问题:
1、将流程图补充完整并写出流程中的反应方程式。
吸氨 饱和氨盐水
碳酸氢钠 过滤热解 碳酸钠
NaCl +NH3+CO2+H2O=NaHCO3+ NH4Cl 2NaHCO3 △ Na2CO3+H2O+CO2↑
化学性质: 2NaHCO3 △ Na2CO3+H2O+CO2↑ NaHCO3 + HCl= NaCl+H2O+CO2↑
3、生产中要先向饱和的食盐水中通入氨气,制成饱和的氨盐水后,再通入二氧化碳。可以增加对二
氧化碳的吸取,这是为什么呢?(提示:氨气溶于水形成氨水,可从食盐水和氨盐水的组成上分析)
食盐水
NaCl H2O
氨盐水
碱
NaCl H2O NH3•H2O
认识本质
NH3+H2O+CO2=NH4HCO3
NaCl+ NH4HCO3=NaHCO3 +NH4Cl 复分解反应
为什么反应能产生?
10℃ 20℃ 30℃ NaHCO3 8.1 9.6 11.1 NH4Cl 33.3 37.2 41.4
40℃ 50℃ 12.7 45.8 50.4
1、假设反应在30℃进行,随着反应物量的增加,每
100g水中最多能溶解多少g生成的碳酸氢钠?生成碳
酸氢钠的量超过这个量时,会出现什么现象?
11.1g
超出的碳酸氢钠就无法继续溶 解而结晶析出
2、比较两种物质30℃时的溶解度,为什么碳酸氢钠
先结晶析出?
30℃时,碳酸氢钠的溶解度比氯化铵的小得多, 会第一到达饱和状态进而析出晶体,而氯化铵的 溶解度较大,不会结晶析出。 3、为什么这个复分解反应能产生?
Na C O
原料: NaCl CO2 NH3(媒介)
氨碱法
根据视频内容和课本71页最后一段完成下列问题:
1、将流程图补充完整并写出流程中的反应方程式。
吸氨 饱和氨盐水
碳酸氢钠 过滤热解 碳酸钠
NaCl +NH3+CO2+H2O=NaHCO3+ NH4Cl 2NaHCO3 △ Na2CO3+H2O+CO2↑
鲁教版九年级化学下册《海水“制碱” 》示范公开课教学课件

1926年,我国化学家侯德榜在氨碱法的基础上,创立了更为先进的联合制碱法(侯氏制碱法),即向滤出NaHCO3晶体后的NH4Cl溶液中加入食盐,使其中的NH4Cl单独结晶析出,用作氮肥,NaCl溶液则可循环使用。
纯碱在工业生产中用途极广,如:
碳酸氢钠的水溶液为弱碱性。
碳酸氢钠受热易分解。
碳酸氢钠 (NaHCO3)
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
有白色沉淀生成。
O3↓+2NaCl
碳酸钠的性质
水溶液呈碱性
能与大多数酸反应
能与氢氧化钙溶液反应
能与氯化钙溶液反应
Na2CO3+2HCl=2NaCl+CO2↑+H2ONa2CO3+H2SO4=Na2SO4+CO2↑+H2ONa2CO3+Ca(OH)2=CaCO3↓+2NaOHNa2CO3+BaCl2=BaCO3↓+2NaCl
上述过程的化学反应原理为:
请从酸碱反应的角度分析:在用氨碱法生产纯碱的过程中,为什么要先向饱和食盐水中通入氨气,制成饱和氨盐水,再向其中通入二氧化碳?
氨气溶于水显碱性,氨盐水比食盐水更易吸收CO2。
氨盐水吸收二氧化碳后生成的碳酸氢钠和氯化铵,哪种物质首先结晶析出?为什么?
NaHCO3首先结晶析出,因为在同一温度下NaHCO3溶解度小。
碱面的主要成分是什么物质呢?
Na2CO3
白色粉末,易溶于水。
主要成分:
俗称:
纯碱或苏打
因其水溶液显碱性,故通常被叫做纯碱,但需要我们注意的是纯碱不是碱,是一种盐。
物理性质:
如何制备纯碱呢?
海水中含有大量的氯化钠,能不能用氯化钠来制纯碱?
Na2CO3由哪些元素组成?
钠、碳、氧。
由NaCl转变为Na2CO3,物质的元素组成发生了什么变化?
纯碱在工业生产中用途极广,如:
碳酸氢钠的水溶液为弱碱性。
碳酸氢钠受热易分解。
碳酸氢钠 (NaHCO3)
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
有白色沉淀生成。
O3↓+2NaCl
碳酸钠的性质
水溶液呈碱性
能与大多数酸反应
能与氢氧化钙溶液反应
能与氯化钙溶液反应
Na2CO3+2HCl=2NaCl+CO2↑+H2ONa2CO3+H2SO4=Na2SO4+CO2↑+H2ONa2CO3+Ca(OH)2=CaCO3↓+2NaOHNa2CO3+BaCl2=BaCO3↓+2NaCl
上述过程的化学反应原理为:
请从酸碱反应的角度分析:在用氨碱法生产纯碱的过程中,为什么要先向饱和食盐水中通入氨气,制成饱和氨盐水,再向其中通入二氧化碳?
氨气溶于水显碱性,氨盐水比食盐水更易吸收CO2。
氨盐水吸收二氧化碳后生成的碳酸氢钠和氯化铵,哪种物质首先结晶析出?为什么?
NaHCO3首先结晶析出,因为在同一温度下NaHCO3溶解度小。
碱面的主要成分是什么物质呢?
Na2CO3
白色粉末,易溶于水。
主要成分:
俗称:
纯碱或苏打
因其水溶液显碱性,故通常被叫做纯碱,但需要我们注意的是纯碱不是碱,是一种盐。
物理性质:
如何制备纯碱呢?
海水中含有大量的氯化钠,能不能用氯化钠来制纯碱?
Na2CO3由哪些元素组成?
钠、碳、氧。
由NaCl转变为Na2CO3,物质的元素组成发生了什么变化?
九年级化学鲁教版下册第八单元第三节 海水“制碱” 课件

【教学重难点】
重点:碳酸钠的化学性质;盐的化学通性;复分解反应的条件。 难点:复分解反应的条件及判断。
纯碱的性质
1、与酸碱指导剂作用: 2、与酸反应: 3、与氢氧化钙(氢氧化钡)反应: 4、与氯化钡(氯化钙)反应:
三、盐的化学通性: 1.盐与酸反应
盐 + 酸 → 新盐 + 新酸 Na2CO3+2HCl=2NaCl + H2O +CO2↑
碳酸盐(CO32-):除碳酸钾、碳酸钠、 碳酸铵溶,MgCO3微溶,其余不溶。
例:HCl +Na2CO3
1、交换位置:
HCl+Na2CO3 NaCl+ HCO3
2、定化学式:
;H2CO3
2HCl+Na2CO3 2NaCl+H2O+CO2
笔下生辉一:
HCl+NaOH=
Na2CO3+BaCl2=BaCO3↓+2NaCl
共同点: 两种化合物相互交换成分生成另外两种化合物。
四、复分解反应
AB + CD = +
复分解反应要产生,且能够进行到底, 一般应考虑两方面的条件: 1、考虑反应产生的基本条件 (对反应物要求的条件)
两者缺一不可
2、对生成物的条件要求
1 、对反应物要求的条件:(除酸碱 中和反应、酸与金属氧化物反应、酸 与碳酸盐的反应外)
参加反应的两种物质都必须可溶。
2、对生成物的条件要求:
生成物中至少有一种是气体、沉淀或水。
(三者有一即可)
酸、碱的溶解规律
酸:初中范围内的酸全溶 碱:钾、钠、钡、铵,四碱
溶,Ca(OH)2微溶, 其余的全不溶。
盐的溶解性规律 钾盐、钠盐、铵盐、硝酸盐全溶; 盐酸盐(Cl-):除氯化银不溶,其余全溶; 硫酸盐(SO42-):除硫酸钡不溶,硫酸钙、 硫酸银微溶,其余全溶;
重点:碳酸钠的化学性质;盐的化学通性;复分解反应的条件。 难点:复分解反应的条件及判断。
纯碱的性质
1、与酸碱指导剂作用: 2、与酸反应: 3、与氢氧化钙(氢氧化钡)反应: 4、与氯化钡(氯化钙)反应:
三、盐的化学通性: 1.盐与酸反应
盐 + 酸 → 新盐 + 新酸 Na2CO3+2HCl=2NaCl + H2O +CO2↑
碳酸盐(CO32-):除碳酸钾、碳酸钠、 碳酸铵溶,MgCO3微溶,其余不溶。
例:HCl +Na2CO3
1、交换位置:
HCl+Na2CO3 NaCl+ HCO3
2、定化学式:
;H2CO3
2HCl+Na2CO3 2NaCl+H2O+CO2
笔下生辉一:
HCl+NaOH=
Na2CO3+BaCl2=BaCO3↓+2NaCl
共同点: 两种化合物相互交换成分生成另外两种化合物。
四、复分解反应
AB + CD = +
复分解反应要产生,且能够进行到底, 一般应考虑两方面的条件: 1、考虑反应产生的基本条件 (对反应物要求的条件)
两者缺一不可
2、对生成物的条件要求
1 、对反应物要求的条件:(除酸碱 中和反应、酸与金属氧化物反应、酸 与碳酸盐的反应外)
参加反应的两种物质都必须可溶。
2、对生成物的条件要求:
生成物中至少有一种是气体、沉淀或水。
(三者有一即可)
酸、碱的溶解规律
酸:初中范围内的酸全溶 碱:钾、钠、钡、铵,四碱
溶,Ca(OH)2微溶, 其余的全不溶。
盐的溶解性规律 钾盐、钠盐、铵盐、硝酸盐全溶; 盐酸盐(Cl-):除氯化银不溶,其余全溶; 硫酸盐(SO42-):除硫酸钡不溶,硫酸钙、 硫酸银微溶,其余全溶;
鲁教版九年级化学下册《海水“制碱”》海水中的化学PPT教学课件

知识点 3:碳酸钠及碳酸氢钠
4.(深圳中考改编)小深同学用思维导图梳理了 Na2CO3 的相关知识,其中
描述错误的是
(A )
5.碳酸氢钠是生活中常见的盐,下列说法中错误的是
(D )
A.发酵粉中含有碳酸氢钠,能使焙制出的糕点疏松多孔
B.干粉灭火器中含有碳酸氢钠,可用来扑灭油、气燃烧引起的火灾
C.碳酸氢钠和柠檬酸、水等混合可制成汽水
已知:常温下,氨气的溶解度很大,CO2 的溶解度很小。请回答下列问题: (1)“侯氏制碱法”的反应温度一般控制为 30~35 ℃,因为在此温度时, NaHCO3 的溶解度较小(选填“大”或“小”)。 (2)若向饱和食盐水中先通入 CO2,会导致 NaHCO3 产量减少,原因是 CO22在在中中性性溶溶液液((食食盐盐水水))中中的的溶溶解解度度小小,,不不利利于于NaNHaCHOC3O的3 的生生成成。 (3)写出步骤①、②发生的总反应方程式 NaCl+H22OO++NNHH33++CCOO2=2==N=aNHaCHOC3O3 +NH44Cl 。 (4)“侯氏制碱法”中能循环利用的物质有 NaCl、H2O 和 CCOO22。
第三节 海水“制碱”
第1课时
1.氨碱法制纯碱的原理 NaCl+NH3+CO2+H2O===NaHCO3+NH4Cl
2NaHCO3 Na2CO3+H2O+CO2↑
2.碳酸钠与碳酸氢钠的性质和用途 (1)共同点:①都是白色固体粉末,都能溶于水。②其水溶液都显碱性, pH>7,能使紫色石蕊试液变为蓝色,使无色酚酞试液变为红色。③都能 与酸反应,生成 CO2 气体。
知识点 1:氨碱法制纯碱
1H2.O==氨=N碱aH法CO3生+N产H4C纯l;碱②的2N主aH要CO反3==△应===原Na理2CO如3+下CO:2↑①+NHa2OC。l +对N上H3述+信C息O2 的+
海水“制碱” PPT教学课件 鲁教版

海水“制碱” 第三节
海水制碱
实验中学 莱西市实验中学 刁红伟 刁红伟
1、判断下列物质的类别
①Ca(OH)2 ④HCl ⑦CO2 ⑩ H2SO4 ② Na2CO3 ⑤ CaO ⑧CaCO3 ③ NaOH ⑥BaCl2 ⑨Fe2O3
其中属于酸 ④ ⑩ 盐②⑥⑧
碱 ①③ 、 氧化物 ⑤ ⑦ ⑨ 。
2、判断下列物质的溶解性
• • • • • • • • • • • • • • • • • • • • • • •
15、如果没有人为你遮风挡雨,那就学会自己披荆斩棘,面对一切,用倔强的骄傲,活出无人能及的精彩。 16、成功的秘诀在于永不改变既定的目标。若不给自己设限,则人生中就没有限制你发挥的藩篱。幸福不会遗漏任何人,迟早有一天它会找到你。 17、一个人只要强烈地坚持不懈地追求,他就能达到目的。你在希望中享受到的乐趣,比将来实际享受的乐趣要大得多。 18、无论是对事还是对人,我们只需要做好自己的本分,不与过多人建立亲密的关系,也不要因为关系亲密便掏心掏肺,切莫交浅言深,应适可而止。 19、大家常说一句话,认真你就输了,可是不认真的话,这辈子你就废了,自己的人生都不认真面对的话,那谁要认真对待你。 20、没有收拾残局的能力,就别放纵善变的情绪。 15、所有的辉煌和伟大,一定伴随着挫折和跌倒;所有的风光背后,一定都是一串串揉和着泪水和汗水的脚印。 16、成功的反义词不是失败,而是从未行动。有一天你总会明白,遗憾比失败更让你难以面对。 17、没有一件事情可以一下子把你打垮,也不会有一件事情可以让你一步登天,慢慢走,慢慢看,生命是一个慢慢累积的过程。 18、努力也许不等于成功,可是那段追逐梦想的努力,会让你找到一个更好的自己,一个沉默努力充实安静的自己。 19、你相信梦想,梦想才会相信你。有一种落差是,你配不上自己的野心,也辜负了所受的苦难。 20、生活不会按你想要的方式进行,它会给你一段时间,让你孤独、迷茫又沉默忧郁。但如果靠这段时间跟自己独处,多看一本书,去做可以做的事,放下过去的人,等你度过低潮,那些独处的时光必定能照亮你的路,也是这些不堪陪你成熟。所以,现在没那么糟,看似生活对你的亏欠,其实都是祝愿。 5、心情就像衣服,脏了就拿去洗洗,晒晒,阳光自然就会蔓延开来。阳光那么好,何必自寻烦恼,过好每一个当下,一万个美丽的未来抵不过一个温暖的现在。 6、无论你正遭遇着什么,你都要从落魄中站起来重振旗鼓,要继续保持热忱,要继续保持微笑,就像从未受伤过一样。 7、生命的美丽,永远展现在她的进取之中 ;就像大树的美丽,是展现在它负势向上高耸入云的蓬勃生机中;像雄鹰的美丽,是展现在它搏风击雨如苍天之魂的翱翔中;像江河的美丽,是展现在它波涛汹涌一泻千里的奔流中。 8、有些事,不可避免地发生,阴晴圆缺皆有规律,我们只能坦然地接受;有些事,只要你愿意努力,矢志不渝地付出,就能慢慢改变它的轨迹。 9、与其埋怨世界,不如改变自己。管好自己的心,做好自己的事,比什么都强。人生无完美,曲折亦风景。别把失去看得过重,放弃是另一种拥有 ;不要经常艳羡他人,人做到了,心悟到了,相信属于你的风景就在下一个拐弯处。 10、有些事想开了,你就会明白,在世上,你就是你,你痛痛你自己,你累累你自己,就算有人同情你,那又怎样,最后收拾残局的还是要靠你自己。 11、人生的某些障碍,你是逃不掉的。与其费尽周折绕过去,不如勇敢地攀登,或许这会铸就你人生的高点。 12、有些压力总是得自己扛过去,说出来就成了充满负能量的抱怨。寻求安慰也无济于事,还徒增了别人的烦恼。 13、认识到我们的所见所闻都是假象,认识到此生都是虚幻,我们才能真正认识到佛法的真相。钱多了会压死你,你承受得了吗?带,带不走,放,放不下。时时刻刻发悲心,饶益众生为他人。 14、梦想总是跑在我的前面。努力追寻它们,为了那一瞬间的同步,这就是动人的生命奇迹。 15、懒惰不会让你一下子跌倒,但会在不知不觉中减少你的收获 ;勤奋也不会让你一夜成功,但会在不知不觉中积累你的成果。人生需要挑战,更需要坚持和勤奋!
海水制碱
实验中学 莱西市实验中学 刁红伟 刁红伟
1、判断下列物质的类别
①Ca(OH)2 ④HCl ⑦CO2 ⑩ H2SO4 ② Na2CO3 ⑤ CaO ⑧CaCO3 ③ NaOH ⑥BaCl2 ⑨Fe2O3
其中属于酸 ④ ⑩ 盐②⑥⑧
碱 ①③ 、 氧化物 ⑤ ⑦ ⑨ 。
2、判断下列物质的溶解性
• • • • • • • • • • • • • • • • • • • • • • •
15、如果没有人为你遮风挡雨,那就学会自己披荆斩棘,面对一切,用倔强的骄傲,活出无人能及的精彩。 16、成功的秘诀在于永不改变既定的目标。若不给自己设限,则人生中就没有限制你发挥的藩篱。幸福不会遗漏任何人,迟早有一天它会找到你。 17、一个人只要强烈地坚持不懈地追求,他就能达到目的。你在希望中享受到的乐趣,比将来实际享受的乐趣要大得多。 18、无论是对事还是对人,我们只需要做好自己的本分,不与过多人建立亲密的关系,也不要因为关系亲密便掏心掏肺,切莫交浅言深,应适可而止。 19、大家常说一句话,认真你就输了,可是不认真的话,这辈子你就废了,自己的人生都不认真面对的话,那谁要认真对待你。 20、没有收拾残局的能力,就别放纵善变的情绪。 15、所有的辉煌和伟大,一定伴随着挫折和跌倒;所有的风光背后,一定都是一串串揉和着泪水和汗水的脚印。 16、成功的反义词不是失败,而是从未行动。有一天你总会明白,遗憾比失败更让你难以面对。 17、没有一件事情可以一下子把你打垮,也不会有一件事情可以让你一步登天,慢慢走,慢慢看,生命是一个慢慢累积的过程。 18、努力也许不等于成功,可是那段追逐梦想的努力,会让你找到一个更好的自己,一个沉默努力充实安静的自己。 19、你相信梦想,梦想才会相信你。有一种落差是,你配不上自己的野心,也辜负了所受的苦难。 20、生活不会按你想要的方式进行,它会给你一段时间,让你孤独、迷茫又沉默忧郁。但如果靠这段时间跟自己独处,多看一本书,去做可以做的事,放下过去的人,等你度过低潮,那些独处的时光必定能照亮你的路,也是这些不堪陪你成熟。所以,现在没那么糟,看似生活对你的亏欠,其实都是祝愿。 5、心情就像衣服,脏了就拿去洗洗,晒晒,阳光自然就会蔓延开来。阳光那么好,何必自寻烦恼,过好每一个当下,一万个美丽的未来抵不过一个温暖的现在。 6、无论你正遭遇着什么,你都要从落魄中站起来重振旗鼓,要继续保持热忱,要继续保持微笑,就像从未受伤过一样。 7、生命的美丽,永远展现在她的进取之中 ;就像大树的美丽,是展现在它负势向上高耸入云的蓬勃生机中;像雄鹰的美丽,是展现在它搏风击雨如苍天之魂的翱翔中;像江河的美丽,是展现在它波涛汹涌一泻千里的奔流中。 8、有些事,不可避免地发生,阴晴圆缺皆有规律,我们只能坦然地接受;有些事,只要你愿意努力,矢志不渝地付出,就能慢慢改变它的轨迹。 9、与其埋怨世界,不如改变自己。管好自己的心,做好自己的事,比什么都强。人生无完美,曲折亦风景。别把失去看得过重,放弃是另一种拥有 ;不要经常艳羡他人,人做到了,心悟到了,相信属于你的风景就在下一个拐弯处。 10、有些事想开了,你就会明白,在世上,你就是你,你痛痛你自己,你累累你自己,就算有人同情你,那又怎样,最后收拾残局的还是要靠你自己。 11、人生的某些障碍,你是逃不掉的。与其费尽周折绕过去,不如勇敢地攀登,或许这会铸就你人生的高点。 12、有些压力总是得自己扛过去,说出来就成了充满负能量的抱怨。寻求安慰也无济于事,还徒增了别人的烦恼。 13、认识到我们的所见所闻都是假象,认识到此生都是虚幻,我们才能真正认识到佛法的真相。钱多了会压死你,你承受得了吗?带,带不走,放,放不下。时时刻刻发悲心,饶益众生为他人。 14、梦想总是跑在我的前面。努力追寻它们,为了那一瞬间的同步,这就是动人的生命奇迹。 15、懒惰不会让你一下子跌倒,但会在不知不觉中减少你的收获 ;勤奋也不会让你一夜成功,但会在不知不觉中积累你的成果。人生需要挑战,更需要坚持和勤奋!
鲁教五四制初中化学九上《9.3 海水“制碱”》PPT课件 (3)

2ON3↓aOH+CuCl2=Cu(OH)2↓+2 Cu2++2OH- =Cu(OH)2↓
NaCl
CaCO3+2HCl=复C分aCl解2+反CO应2↑ 的类型
+H2O AgNO3+HCl=AgCl↓+HNO3
盐+酸
→
新盐+新酸
BaCl2+H2SO4=BaSO4↓+2H
C2Hl Cl+Ca(OH)2=CaCl2+ 2H2O
D.CaCl2+CO2+H2O=CaCO3↓+ 3. 巧除某些杂质离子(或物质)2HCl 例3. 在食盐溶液中混有少量的硫酸镁,若同时除去溶液中的 Mg2+和SO42-,应加入的试剂是 Ba(OH)2;若分别除去,应加入 的试剂是 NaOH 和 BaCl2 。
例4. 下列各组溶液中不用其他试剂,仅用组内物质相互反应就能区别开 来的是(C )
H2CO3
Na+ Na+ H2O CO2↑
Cl- Cl- Na+ Na+
BaCO3↓ Cl- Cl-
2H++CO32- =H2CO3 H2CO3 = H2O+CO2↑
Ba2++CO32- =BaCO3↓
酸、碱、盐之间复分解反应的实质:
离子之间相互结合,生成沉淀、气体或水的过程。
动画
从微观粒子的角度分析,下列反应的实质是什么?
易溶于水
常见的沉淀
Mg(OH)2 Cu(OH)2 Fe(OH)3 AgCl 既不溶于水 BaSO4也不溶于酸 CaCO3 不溶于水 BaCO3 能溶于酸
Na2CO3
鲁教版(五四制)九年级全一册第三单元第三节海水制碱教学课件(34ppt张)

——海水制碱的反应方程式
吸氨 碳化
过滤
碳酸氢根离 子HCO3-
NaCI+NH3+CO2+H2O=NaHCO3 +NH4CI
热解
碳酸氢钠或小苏打
△
2NaHCO3 = Na2CO3+H2O+CO2↑
纯碱或苏打
同温下NaHCO3 比 NH4C1的 溶解度小,易结晶析出。
氨气极易溶于
100
水,在20℃时,1 90
A.原料 B.反应条件 C.操作过程 D.催化剂
4、工业上采用氨碱法生产纯碱的的工艺是先向饱和食盐
水中通入较多NH3(溶液显碱性),再通入足量的CO2的
原因是
A
A.使CO2更易被吸收
B.NH3比CO2更易制取
C.CO2的密度比NH3大
D.为了增大NaHCO3的溶解度
5、下列说法正确的是 A A.制纯碱需要的原料有食盐和石灰石 B.海水晒得的粗盐可以直接吸氨制成氨盐水 C.向氨盐水中通入CO2可得到纯碱,溶液经结晶
实现NaC1
元素
加C、O
守恒
去C1
Na2CO3的转化?
CO2
石灰石
加压
中和反 应原理!
向饱和食盐水
中通入CO2
向饱和食盐水中先通入
NH3制成饱和氨盐水
氨气溶于水显碱 性,氨盐水比食 盐水更易吸收CO2
海水制碱的原料:
食盐、石灰石和氨气
↓
↓
↓
Na CI
CO2 使CO2更易 被食盐水吸收
明确原理
反应为什 么能发生 呢?
主要用途有:发酵粉,制饮料等。
碳酸钠在化学工业中的用途
碳酸氢钠的用途
海水“制碱” 课件(共18张) 鲁教版化学九年级下册

碳酸氢钠,因为在同样的条件下,碳酸氢钠的溶解度 比氯化铵小,易结晶。
新知学习
索尔维制碱法、侯氏制碱法对照
索尔维制碱法:比利时化学家索尔维发明了氨碱法制纯碱,并在制碱过程中向滤出NaHCO3
晶体后的NH4Cl溶液中加入熟石灰以回收氮气,使之循环。 NaCl +NH3+CO2+H2O== NaHCO3+ NH4Cl 2NaHCO3 =△== Na2CO3+CO2↑+ H2O Ca(OH)2+ 2NH4Cl == CaCl2 +2NH3 ↑ +2H2O
侯氏制碱法优点:NaCl可以循环利用,NH4Cl可作化肥。
ห้องสมุดไป่ตู้ 新知学习
多识一点·侯氏制碱法
1926年,我国化学家侯德榜在氨碱法的 基础上,发明了将制碱与制氨结合起来 的联合制碱法(又称侯氏制碱法)。侯氏 制碱法保留了氨碱法的优点,克服了其 缺点,促进了世界制碱技术的发展。
新知学习
2.碳酸钠和碳酸氢钠
2.复分解反应的实质
2HCl + Na2CO3 === 2NaCl + H2O + CO2↑ H2SO4 + Na2CO3 === Na2SO4 + H2O + CO2↑ Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH Na2CO3 + BaCl2 === BaCO3↓+ 2NaCl
新知学习
二、纯碱的性质
1.实验-纯碱的性质
(1)与酸碱指导剂的作用 取少量碳酸钠固体,加入试管中,加少量蒸馏水后振荡,视察其溶解情况。 再滴入2~3滴酚酞试液,视察现象。 现象:碳酸钠溶于水形成无色溶液, 滴加酚酞后,溶液由无色变为红色。
新知学习
索尔维制碱法、侯氏制碱法对照
索尔维制碱法:比利时化学家索尔维发明了氨碱法制纯碱,并在制碱过程中向滤出NaHCO3
晶体后的NH4Cl溶液中加入熟石灰以回收氮气,使之循环。 NaCl +NH3+CO2+H2O== NaHCO3+ NH4Cl 2NaHCO3 =△== Na2CO3+CO2↑+ H2O Ca(OH)2+ 2NH4Cl == CaCl2 +2NH3 ↑ +2H2O
侯氏制碱法优点:NaCl可以循环利用,NH4Cl可作化肥。
ห้องสมุดไป่ตู้ 新知学习
多识一点·侯氏制碱法
1926年,我国化学家侯德榜在氨碱法的 基础上,发明了将制碱与制氨结合起来 的联合制碱法(又称侯氏制碱法)。侯氏 制碱法保留了氨碱法的优点,克服了其 缺点,促进了世界制碱技术的发展。
新知学习
2.碳酸钠和碳酸氢钠
2.复分解反应的实质
2HCl + Na2CO3 === 2NaCl + H2O + CO2↑ H2SO4 + Na2CO3 === Na2SO4 + H2O + CO2↑ Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH Na2CO3 + BaCl2 === BaCO3↓+ 2NaCl
新知学习
二、纯碱的性质
1.实验-纯碱的性质
(1)与酸碱指导剂的作用 取少量碳酸钠固体,加入试管中,加少量蒸馏水后振荡,视察其溶解情况。 再滴入2~3滴酚酞试液,视察现象。 现象:碳酸钠溶于水形成无色溶液, 滴加酚酞后,溶液由无色变为红色。
化学:6.3《海水制碱》课件(鲁教版九年级)

3、氨盐水吸收二氧化碳后生成的碳酸 氢 钠和氯化铵,那种物质首先析出? 为什么?(提示:根据课本43页溶解度 曲线)
1862年比利时科学家索尔维发明了氨碱法制 纯碱,并对制碱技术进行了垄断。
凡是黄头发蓝眼睛 的人能办到的,我们 黑头发黑眼睛的人 也一定能办到!
侯德榜
侯氏制碱法的诞生
1921年10月侯德榜接受了永利碱业公司 的聘请,毅然从美国启程回国,决心自己 开发制碱新工艺, 经过600多次研究实验, 分析了2000多个样品,历时5年,于1942年 发明并创立了举世闻名的“侯氏制碱法”。 本可以高价出售这一专利而获得巨额财富 的侯德榜却把它公布于众,让世界各国人 民共享这一科技成果,促进了世界制碱技 术的发展。
来,他赶快跟德妃开口道:“额娘,儿子今天没有啥啊事情,就陪您用膳吧。”自从出行の这几天来,德妃早就对二十三小格心生疑惑。知子莫 如母,这各天不怕地不怕の小儿子,整天壹副吊儿郎当、玩世不恭の样子,怎么自从出行这些日子以来,完全变咯壹各人!这各变化真是太大咯, 说话再也不像以前那么不管不顾、无所顾忌、开口就来,而是恭敬有加、谦谦君子,行为举止也不像以前那么毛手手脚、随心所欲,而是端庄稳 健,像模像样。而且,整各人还变得格外体贴入微起来:昨天在她床前嘘寒问暖,今天居然主动提出陪她用晚膳,难道说真是日头要从西边出来 咯?虽然不知道这是为啥啊,但不管啥啊原因,老二十三の这各转变还是令她高兴极咯,于是不住地点头:“好啊,好啊,祯儿以后干脆就在额 娘这里用膳吧,省得来回跑来跑去。”第壹卷 第242章 解困二十三小格完全是因为水清の原因,才临时起意提出要陪德妃娘娘用晚膳。当时水 清尴尬地站在那里进退两难,他是看在眼里急在心中,为咯将小四嫂从窘境中解救出来,他绞尽脑汁地寻找着法子以期给她解围。正在心急之际, 竟然有如神助地赶上晚膳时间咯。假如他留在这里用膳,正好水清就有事情做咯,可以服侍额娘用晚膳。否则他和塔娜壹走,把小四嫂壹各人晾 在那里,真是于心不忍。二十三小格哪昊知道,他本是出于替小四嫂解围而提议留下来晚膳,却是正中咯德妃娘娘の下怀。德妃对二十三小格那 是打心眼儿里喜欢,恨不能时时刻刻陪在自己の身边。平时在宫里,就算是皇子小格,晚上时间壹到,全都得迅速离宫,现在到咯塞外,没有咯 那么多の繁文缛节,没有咯那么严格の宫规例律,终于可以跟二十三小格多呆壹会儿,多享受壹些母子相处の幸福时光。此刻她还不住地后悔, 怎么自己早没有想到这各法子?老二十三可真是成熟多咯,知道体贴额娘咯,真是没有白疼他这么多年,实在是让人欣慰呢。二十三小格只是想 临时为水清解围,谁想到从此以后,竟被德妃要求天天共进晚膳。唉,也顾不咯以后咯,先把今天解决咯再说吧。秋婵已经布好咯菜,二十三小 格径自坐咯下来。塔娜照顾自家爷,水清和秋婵照顾德妃娘娘。这壹顿饭,德妃吃得是心花怒放,心满意足,二十三小格吃得是食不甘味。因此 用过膳后,二十三小格立即起身告退:“额娘,儿子还有壹件急事要办,现在已经有些晚咯,这就先告辞咯。”“好,好,你赶快去吧,别耽搁 咯正事。”二十三小格根本没有任何事情,他是不想当着小四嫂の面,和塔娜壹起回去,于是就随口编咯壹各理由,先行离开,留下塔娜和水清 收拾完残局。塔娜虽然想跟自家爷壹起离开,可是眼看着小四嫂壹各人在忙碌着,她只好咽下咯
1862年比利时科学家索尔维发明了氨碱法制 纯碱,并对制碱技术进行了垄断。
凡是黄头发蓝眼睛 的人能办到的,我们 黑头发黑眼睛的人 也一定能办到!
侯德榜
侯氏制碱法的诞生
1921年10月侯德榜接受了永利碱业公司 的聘请,毅然从美国启程回国,决心自己 开发制碱新工艺, 经过600多次研究实验, 分析了2000多个样品,历时5年,于1942年 发明并创立了举世闻名的“侯氏制碱法”。 本可以高价出售这一专利而获得巨额财富 的侯德榜却把它公布于众,让世界各国人 民共享这一科技成果,促进了世界制碱技 术的发展。
来,他赶快跟德妃开口道:“额娘,儿子今天没有啥啊事情,就陪您用膳吧。”自从出行の这几天来,德妃早就对二十三小格心生疑惑。知子莫 如母,这各天不怕地不怕の小儿子,整天壹副吊儿郎当、玩世不恭の样子,怎么自从出行这些日子以来,完全变咯壹各人!这各变化真是太大咯, 说话再也不像以前那么不管不顾、无所顾忌、开口就来,而是恭敬有加、谦谦君子,行为举止也不像以前那么毛手手脚、随心所欲,而是端庄稳 健,像模像样。而且,整各人还变得格外体贴入微起来:昨天在她床前嘘寒问暖,今天居然主动提出陪她用晚膳,难道说真是日头要从西边出来 咯?虽然不知道这是为啥啊,但不管啥啊原因,老二十三の这各转变还是令她高兴极咯,于是不住地点头:“好啊,好啊,祯儿以后干脆就在额 娘这里用膳吧,省得来回跑来跑去。”第壹卷 第242章 解困二十三小格完全是因为水清の原因,才临时起意提出要陪德妃娘娘用晚膳。当时水 清尴尬地站在那里进退两难,他是看在眼里急在心中,为咯将小四嫂从窘境中解救出来,他绞尽脑汁地寻找着法子以期给她解围。正在心急之际, 竟然有如神助地赶上晚膳时间咯。假如他留在这里用膳,正好水清就有事情做咯,可以服侍额娘用晚膳。否则他和塔娜壹走,把小四嫂壹各人晾 在那里,真是于心不忍。二十三小格哪昊知道,他本是出于替小四嫂解围而提议留下来晚膳,却是正中咯德妃娘娘の下怀。德妃对二十三小格那 是打心眼儿里喜欢,恨不能时时刻刻陪在自己の身边。平时在宫里,就算是皇子小格,晚上时间壹到,全都得迅速离宫,现在到咯塞外,没有咯 那么多の繁文缛节,没有咯那么严格の宫规例律,终于可以跟二十三小格多呆壹会儿,多享受壹些母子相处の幸福时光。此刻她还不住地后悔, 怎么自己早没有想到这各法子?老二十三可真是成熟多咯,知道体贴额娘咯,真是没有白疼他这么多年,实在是让人欣慰呢。二十三小格只是想 临时为水清解围,谁想到从此以后,竟被德妃要求天天共进晚膳。唉,也顾不咯以后咯,先把今天解决咯再说吧。秋婵已经布好咯菜,二十三小 格径自坐咯下来。塔娜照顾自家爷,水清和秋婵照顾德妃娘娘。这壹顿饭,德妃吃得是心花怒放,心满意足,二十三小格吃得是食不甘味。因此 用过膳后,二十三小格立即起身告退:“额娘,儿子还有壹件急事要办,现在已经有些晚咯,这就先告辞咯。”“好,好,你赶快去吧,别耽搁 咯正事。”二十三小格根本没有任何事情,他是不想当着小四嫂の面,和塔娜壹起回去,于是就随口编咯壹各理由,先行离开,留下塔娜和水清 收拾完残局。塔娜虽然想跟自家爷壹起离开,可是眼看着小四嫂壹各人在忙碌着,她只好咽下咯
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
NaCl +NH3+CO2+H2O
NaHCO3+ NH4Cl
2NaHCO3
Na2CO3+CO2↑+ H2O
思考: 1、为什么采用饱和的食盐水?
2、在生产过程中为什么要先通入 氨气得到饱和的氨盐水后再通入 二氧化碳?
3、氨盐水吸收二氧化碳后生成的碳酸 氢 钠和氯化铵,那种物质首先析出? 为什么?(提示:根据课本43页溶解度 曲线)
第六单元 海水中的化学
第三节 海水制碱 (第一课时)
留格二中 吕波
第三节 海水“制碱”
Na2CO3 俗称:纯碱或苏打
自 然 界 中 有 天 然 纯 碱
内蒙古鄂尔多斯合同查汗淖碱湖
天然碱 纯碱(Na2CO3)
盐湖
?
在工业上以氯化钠为主要原料,制取碳酸钠。
思考:NaCl
Na2CO3 从组成上看发生
1862年比利时科学家索尔维发明了氨碱法制 纯碱,并对制碱技术进行了垄断。
凡是黄头发蓝眼睛 的人能办到的,我们 黑头发黑眼睛的人 也一定能办到!
侯德榜
侯氏制碱法的诞生
1921年10月侯德榜接受了永利碱业公司 的聘请,毅然从美国启程回国,决心自己 开发制碱新工艺, 经过600多次研究实验, 分析了2000多个样品,历时5年,于1942年 发明并创立了举世闻名的“侯氏制碱法”。 本可以高价出售这一专利而获得巨额财富 的侯德榜却把它公布于众,让世界各国人 民共享这一科技成果,促进了世界制碱技 术的发展。
了什么变化?你认为还需要含什么元素的物
质参加反应?
制取碳酸钠所需要的反应物有:氯化钠、 二氧化碳。仅此这两种物质你认为行不行?
还需要:氨气、水
饱和食盐水
通入氨气 饱和氨盐水
通入 二氧化碳 过滤
饱和食盐水
氨气 饱和氨盐水
通入 二氧化碳 过滤
NaHCO3 煅烧
Na2CO3
NH4Cl 熟石灰
NH3
氨碱法制纯碱原理
迹往往是执著者造成的。许多人惊奇地发现,他们之所以达不到自己孜孜以求的目标,是因为他们的主要目标太小、而且太模糊不清,使自己失去动力。如果你的主要 实现就会遥遥无期。因此,真正能激励你奋发向上的是确立一个既宏伟又具体的远大目标。实现目标的道路绝不是坦途。它总是呈现出一条波浪线,有起也有落,但你 你的时间表,框出你放松、调整、恢复元气的时间。即使你现在感觉不错,也要做好调整计划。这才是明智之举。在自己的事业波峰时,要给自己安排休整点。安排出 是离开自己挚爱的工作也要如此。只有这样,在你重新投入工作时才能更富激情。困难对于脑力运动者来说,不过是一场场艰辛的比赛。真正的运动者总是盼望比赛。 很难在生活中找到动力,如果学会了把握困难带来的机遇,你自然会动力陡生。所以,困难不可怕,可怕的是回避困难。大多数人通过别人对自己的印象和看法来看自 尤其正面反馈。但是,仅凭别人的一面之辞,把自己的个人形象建立在别人身上,就会面临严重束缚自己的。因此,只把这些溢美之词当作自己生活中的点缀。人生的 上找寻自己,应该经常自省。有时候我们不做一件事,是因为我们没有把握做好。我们感到自己“状态不佳”或精力不足时,往往会把必须做的事放在一边,或静等灵 些事你知道需要做却又提不起劲,尽管去做,不要怕犯错。给自己一点自嘲式幽默。抱一种打趣的心情来对待自己做不好的事情,一旦做起来了尽管乐在其中。所以, 要尽量放松。在脑电波开始平和你的中枢神经系统时,你可感受到自己的内在动力在不断增加。你很快会知道自己有何收获。自己能做的事,放松可以产生迎接挑战的 社会,面对工作,一切的未来都需要自己去把握。人一定要靠自己。命运如何眷顾,都不会去怜惜一个不努力的人,更不会去同情一个懒惰的人,一切都需要自己去努 一时的享受也只不过是过眼云烟,成功需要自己去努力。当今社会的快速发展,各行各业的疲软,再加上每年几百万毕业生涌向社会,社会生存压力太大,以至于所有 高自己。看着身边一个个同龄人那么优秀,看着朋友圈的老同学个个事业有成、买房买车,我们心急如梵,害怕被这个社会抛弃。所以努力、焦躁、急迫这些名词缠绕 变自己,太想早一日成为自己梦想中的那个自己。收藏各种技能学习资料,塞满了电脑各大硬盘;报名流行的各种付费社群,忙的人仰马翻;于是科比看四点钟的洛杉 早起打卡行动。其实……其实我们不觉得太心急了吗?这是有一次自己疲于奔命,病倒了,在医院打点滴时想到的。我时常恐慌,害怕自己浪费时间,就连在医院打点 浪费。想快点结束,所以乘着护士不在,自己偷偷的拨快了点滴速度。刚开始自己还能勉强受得了,过了差不多十分钟,真心忍不住了,只好叫护士帮我调到合适的速 就在想,平时做事和打点滴何尝不是一样,都是有一个度,你太急躁了、太想赶超,身体是受不了的。身体是革命的本钱,我们还年轻,还有大把的时间够我们改变, 1000前面的那个若是1都不存在了,后面再多的0又有什么用?我是一个急性子,做事风风火火的,所以对于想改变自己,是比任何人都要心急。这次病倒了,个人感觉 通乱忙乎才导致的,病倒换来的努力根本是一钱不值。生病的那几天,我跟自己的大学老师打了一个电话,想让老师帮我解惑一下,自己到底是怎么了。别人也很努力 我了,为啥他们反到身体倍棒而一无所获的自己却病倒了?老师开着电脑,给我分享了两个小故事讲的第一个故事是“保龄球效应”,保龄球投掷对象是10个瓶子,你 是90分,而你如果每次能砸倒10个瓶子,最终得分是240分。故事讲完,老师问我明白啥意思没?我说大概猜到一点,你让我再努力点,对吗?不对!你已经够努力了 你,你现在就是那个每次砸倒9个瓶子的人。你累倒的原因是因为你同时在几个场馆玩,每一个场馆得分都是90分,而有些人,则是只在一个场馆玩,玩多了,他就能 倍,得分却还是远远超过你。老师讲的第二故事是“挖水井”,一个人选择好一处地基,就在那里一直坚持不懈的挖下去,而另一个人则是到处选地基,这边挖几米, 出水来了,而另一个人则是直到累死也没有挖出一滴水。首先,你必须承认努力是必须的,只要你比别人努力了那么一点,你确实能超过一些人。只是人的精力也是有 终得到的结果只会是永远装不满水桶的半桶水。和老师通完电话后,我调整了几天,也对自己手头上的事物做一些大�
碳酸氢钠的用途: 阅读48页最后一自然段
谈谈你的收获?
我们很容易遭遇逆境,也很容易被一次次的失败打垮。但是人生不容许我们停留在失败的瞬间,如果不前进,不会自我激励的话,就注定只能被这个世界抛弃。自我激 组成部分,主要表现在对于在压力或者困境中,个体自我安慰、自我积极暗示、自我调节的能力,在个体克服困难、顶住压力、勇对挑战等情况下,都发挥着关键性的 有弹性,经常表现出反败为胜、后来居上、东山再起的倾向,而缺乏这种能力的人,在逆境中的表现就大打折扣,表现为过分依赖外界的鼓励和支持。一个小男孩在自 对自己大喊:“我是世界上最棒的棒球手!”然后扔出棒球,挥动……但是没有击中。接着,他又对自己喊:“我是世界上最棒的棒球手!”扔出棒球,挥动依旧没有 和球,然后用更大的力气对自己喊:“我是世界上最棒的棒球手!”可是接下来的结果,并未如愿。男孩子似乎有些气馁,可是转念一想:我抛球这么刁,一定是个很 喊:“我是世界上最棒的挥球手!”其实,大多数情况下,很多人做不到这看似荒谬的自我鼓励,可是,这故事却深深反映了这个男孩子自我鼓励下的执著,而这执著
这两种制碱方法有何异同?
❖总原理相同:
NaCl +NH3+CO2+H2O
NaHCO3+ NH4Cl
2NaHCO3 ====== Na2CO3+CO2↑+ H2O
不同:对过滤出NaHCO3后的母液的处理方法
优点: 原料便宜
氨气和二氧化碳可循环使用
缺点: 氯化钠利用率低
产生了无用的氯化钙,用处不大, 且污染环境.
侯氏制碱法的反应原理
① NaCl+ NH3+ H2O + CO2=== NaHCO3↓+ NH4Cl
加热 ② 2NaHCO3
Na2CO3 + H2O + CO2
③向析出NaHCO3的母液中加入研细的NaCI,还得到另一产品NH4CI固体
阅读课本48页多识一点:侯氏制碱法 问题:
1、氨碱法制纯碱的优、缺点? 2、侯氏制碱法优于氨碱法之处是什么?
化学性质: 1、受热易分解
2NaHCO3 Na2CO3 CO2 H2O
2、与酸反应(反应类型:
)
NaHCO3+HCl NaCl CO2 H2O
注:1、碳酸氢钠还有其它性质。 2、根据物质的储存方法可以推测出物质
所具有的化学性质。如:低温、避光可推测出 物质受热、见光易分解; 密封推测该物质可能与空气的某种气体发生反 应等
向析出NaHCO3的母液(氯化铵)中加入 研细的NaCI,使NH4CI结晶析出,用 作氮肥,氯化钠溶液可循环使用。
纯碱的用途:阅读课本48页倒数第二段 碳酸氢钠(也叫酸式碳酸钠):
俗名:小苏打 物理性质:通常是白色晶体,能溶于水。
联系你学过的知识并根据碳酸氢钠的组成, 猜测碳酸氢钠可能具有哪些化学性质?
