物理化学(复旦大学药学院) 第一章习题答案
物理化学习题及答案[精品文档]
![物理化学习题及答案[精品文档]](https://img.taocdn.com/s3/m/7cd9e32981c758f5f61f67d5.png)
物理化学习题及答案[精品文档]-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN第一章热力学第一定律选择题1.热力学第一定律ΔU=Q+W 只适用于()(A) 单纯状态变化(B) 相变化(C) 化学变化(D) 封闭物系的任何变化答案:D2.关于热和功, 下面的说法中, 不正确的是(A) 功和热只出现于系统状态变化的过程中, 只存在于系统和环境间的界面上(B) 只有在封闭系统发生的过程中, 功和热才有明确的意义(C) 功和热不是能量, 而是能量传递的两种形式, 可称之为被交换的能量(D) 在封闭系统中发生的过程中, 如果内能不变, 则功和热对系统的影响必互相抵消答案:B2.关于焓的性质, 下列说法中正确的是()(A) 焓是系统内含的热能, 所以常称它为热焓 (B) 焓是能量, 它遵守热力学第一定律(C) 系统的焓值等于内能加体积功 (D) 焓的增量只与系统的始末态有关答案:D。
因焓是状态函数。
3.涉及焓的下列说法中正确的是()(A) 单质的焓值均等于零 (B) 在等温过程中焓变为零 (C) 在绝热可逆过程中焓变为零(D) 化学反应中系统的焓变不一定大于内能变化答案:D。
因为焓变ΔH=ΔU+Δ(pV),可以看出若Δ(pV)<0则ΔH<ΔU。
4.下列哪个封闭体系的内能和焓仅是温度的函数()(A) 理想溶液 (B) 稀溶液 (C) 所有气体 (D) 理想气体答案:D 5.与物质的生成热有关的下列表述中不正确的是()(A) 标准状态下单质的生成热都规定为零 (B) 化合物的生成热一定不为零 (C) 很多物质的生成热都不能用实验直接测量(D) 通常所使用的物质的标准生成热数据实际上都是相对值答案:A。
按规定,标准态下最稳定单质的生成热为零。
6.dU=CvdT及dUm=Cv,mdT适用的条件完整地说应当是()(A) 等容过程 (B)无化学反应和相变的等容过程 (C) 组成不变的均相系统的等容过程(D) 无化学反应和相变且不做非体积功的任何等容过程及无反应和相变而且系统内能只与温度有关的非等容过程答案:D7.下列过程中, 系统内能变化不为零的是()(A) 不可逆循环过程 (B) 可逆循环过程 (C) 两种理想气体的混合过程 (D) 纯液体的真空蒸发过程答案:D。
物理化学第一章习题及答案

物理化学第⼀章习题及答案第⼀章热⼒学第⼀定律⼀、填空题1、⼀定温度、压⼒下,在容器中进⾏如下反应:Zn(s)+2HCl(aq)= ZnCl 2(aq)+H 2(g)若按质量守恒定律,则反应系统为系统;若将系统与环境的分界⾯设在容器中液体的表⾯上,则反应系统为系统。
2、所谓状态是指系统所有性质的。
⽽平衡态则是指系统的状态的情况。
系统处于平衡态的四个条件分别是系统内必须达到平衡、平衡、平衡和平衡。
3、下列各公式的适⽤条件分别为:U=f(T)和H=f(T)适⽤于;Q v =△U 适⽤于;Q p =△H 适⽤于;△U=dT nC 12T T m ,v ?适⽤于;△H=dT nC 21T T m ,P ?适⽤于;Q p =Q V +△n g RT 适⽤于;PV r=常数适⽤于。
4、按标准摩尔⽣成焓与标准摩尔燃烧焓的定义,在C (⽯墨)、CO (g )和CO 2(g)之间,的标准摩尔⽣成焓正好等于的标准摩尔燃烧焓。
标准摩尔⽣成焓为零的是,因为它是。
标准摩尔燃烧焓为零的是,因为它是。
5、在节流膨胀过程中,系统的各状态函数中,只有的值不改变。
理想⽓体经节流膨胀后,它的不改变,即它的节流膨胀系数µ= 。
这是因为它的焓。
6、化学反应热会随反应温度改变⽽改变的原因是;基尔霍夫公式可直接使⽤的条件是。
7、在、不做⾮体积功的条件下,系统焓的增加值系统吸收的热量。
8、由标准状态下元素的完全反应⽣成1mol 纯物质的焓变叫做物质的。
9、某化学反应在恒压、绝热和只做膨胀功的条件下进⾏, 系统温度由T 1升⾼到T 2,则此过程的焓变零;若此反应在恒温(T 1)、恒压和只做膨胀功的条件下进⾏,则其焓变零。
10、实际⽓体的µ=0P T H,经节流膨胀后该⽓体的温度将。
11、公式Q P =ΔH 的适⽤条件是。
12、若某化学反应,只做体积功且满⾜等容或等压条件,则反应的热效应只由决定,⽽与⽆关。
13、常温下,氢⽓经节流膨胀ΔT 0;W 0;Q 0;ΔU 0;ΔH 0。
复旦大学物化练习题第一章

C
状态函数组合时 如量纲一致 仍是一个状态函数 如 U pV 但若量纲不一致 就不构 成状态函数 如 p UV.
20 下面说到状态和状态函数 如以体积为例 A 体系同一状态不能有不同的体积 B 体系不同状态可以有相同体积 C 体系状态变了 体积一定变了 D 体系体积变了 状态一定变了
B 面积 ⋅时间 加速度
D 面积 ⋅ 质量
压强
其量纲应是
A
压力 力 质量 ⋅ 加速度 质量 ⋅ 速度
动量
面积面积ຫໍສະໝຸດ 面积 ⋅时间 面积 ⋅时间
15 体系处于热力学平衡态时 下面哪一个结论不对 A 体系内部温度相同 B 体系内部压力相同 C 体系内部各相中物质量相同 D 体系内部组成不再变化
C
热力学平衡体系必然有
复旦大学药学院物理化学教研室编写
系 并保持恒温恒压 则体系的分类如何 A 是封闭体系 界面固定不变 B 是封闭体系 界面不断扩大 C 是敞开体系 界面基本不变 D 是敞开体系 界面不断扩大
物化练习 1000 题
和与环境界面的情况如何
第一定律
C 无
6 见图 通电后 若以水为体系 则有
A Q<0 W=0 ∆U<0 B Q=0 W<0 ∆U>0
因此体积具加和性 是容量性质
B p 总 p1 p2
道尔顿分压定律 因此压力具加和性
C T 总≠T1 T2
不具加和性 不是容量性质
D Cp m≠ Cp m(1)+Cp m(2)+ 不具加和性 不是容量性质
为容量性质
B
压力不具加和性 道尔顿分压定律中的分压是指该组分气体单独占有整个空间时压力 这种 加和不是热力学平衡体系意义上的加和
物理化学第一章课后习题解答

1.12 CO2 气体在 40℃时的摩尔体积为 0.381dm3 .mol-1 。设 CO2 为范德华气体,试 求其压力,并比较与实验值 5066.3kPa 的相对误差。
解: ,Vm =0.381× 10-3 m3 .mol-1 ,T=313.15K CO2 的范德华常数 a=364× 10-3 /Pa.m3 .mol-2 , b =42.67× 10-6 m3 .mol-1 代入方程得: P=5187.674KPa 相对误差=(5187.674-5066.3)/ 5066.3=2.4% 1.13 今有 0℃, 40530kPa 的 N2 气体,分别用理想气体状态方程及范德华方程计算 其摩尔体积.实验值为 70.3cm.mol-1 。 解:T=273.15K ,p=40530kPa N2 的范德华常数 a=140.8× 10-3 /Pa.m3 .mol-2 , b =39.13× 10-6 m3 .mol-1 =0.05603 m3 .mol-1
第一章
习题解答
1.1 物质的体膨胀系数α V 与等温压缩率κ T 的定义如下:
试导出理想气体的
、
与压力、温度的关系
解:对于理想气体: PV=nRT , V= nRT/P
求偏导:
1.2 气柜储存有 121.6kPa, 27℃的氯乙烯 (C2 H3 Cl) 气体 300m3 , 若以每小时 90kg 的流量输往使用车间,试问储存的气体能用多少小时? 解:将氯乙烯(Mw=62.5g/mol)看成理想气体: PV=nRT , n= PV/RT n=121600300/8.314300.13 (mol)=14618.6mol m=14618.662.5/1000(kg)=913.66 kg t=972.138/90(hr)=10.15hr 1.3 0℃,101.325kPa 的条件常称为气体的标准状况,试求甲烷在标准状况下的密 度? 解:将甲烷(Mw=16g/mol)看成理想气体: PV=nRT , PV =mRT/ M w 甲烷在标准状况下的密度为=m/V= PMw/RT =101.32516/8.314273.15(kg/m3 ) =0.714 kg/m3 1.4 一抽成真空的球形容器,质量为 25.0000g。充以 4 ℃水之后,总质量为 125.0000g。 若改充以 25℃, 13.33kPa 的某碳氢化合物气体, 则总质量为 25.0163g。 -3 试估算该气体的摩尔质量。水的密度按 1 g.cm 计算。 解:球形容器的体积为 V=(125-25)g/1 g.cm-3 =100 cm3 将某碳氢化合物看成理想气体:PV=nRT , PV =mRT/ M w Mw= mRT/ PV=(25.0163-25.0000)8.314300.15/(1333010010-6 ) Mw =30.51(g的空气。为进行实验时确保安全,采用同样温度 的纯氮进行置换,步骤如下:向釜内通氮直到 4 倍于空气的压力,尔后将釜内混 合气体排出直至恢复常压,重复三次。求釜内最后排气至恢复常压时其中气体含 氧的摩尔分数。设空气中氧、氮摩尔分数之比为 1:4。 解: 根据题意未通氮之前 : ,操作 n 次后, , 操作 1 次后, ,重复三次, ,V,T 一定, 故
《物理化学》课后习题第一章答案

习题解答第一章1. 1mol 理想气体依次经过下列过程:(1)恒容下从25℃升温至100℃,(2)绝热自由膨胀至二倍体积,(3)恒压下冷却至25℃。
试计算整个过程的Q 、W 、U ∆及H ∆。
解:将三个过程中Q 、U ∆及W 的变化值列表如下:过程 QU ∆ W(1) )(11,初末T T C m V - )(11,初末T T C m V -0 (2)(3) )(33,初末T T C m p - )(33,初末T T C m v - )(33初末V V p -则对整个过程:K 15.29831=末初T T = K 15.37331==初末T T Q =)(11,初末-T T nC m v +0+)(33,初末-T T nC m p=)初末33(T T nR -=[1×8.314×(-75)]J =-623.55JU ∆=)(11,初末-T T nC m v +0+)(33,初末-T T nC m v =0W =-)(33初末V V p -=-)初末33(T T nR - =-[1×8.314×(-75)]J =623.55J因为体系的温度没有改变,所以H ∆=02. 0.1mol 单原子理想气体,始态为400K 、101.325kPa ,经下列两途径到达相同的终态:(1) 恒温可逆膨胀到10dm 3,再恒容升温至610K ; (2) 绝热自由膨胀到6.56dm 3,再恒压加热至610K 。
分别求两途径的Q 、W 、U ∆及H ∆。
若只知始态和终态,能否求出两途径的U ∆及H ∆?解:(1)始态体积1V =11/p nRT =(0.1×8.314×400/101325)dm 3=32.8dm 3 W =恒容恒温W W +=0ln12+V V nRT=(0.1×8.314×400×8.3210ln +0)J =370.7JU ∆=)(12,T T nC m V -=[)400610(314.8231.0-⨯⨯⨯]J =261.9J Q =U ∆+W =632.6J H ∆=)(12,T T nC m p -=[)400610(314.8251.0-⨯⨯⨯]=436.4J (2) Q =恒压绝热Q Q +=0+)(12,T T nC m p -=463.4J U ∆=恒压绝热U U ∆+∆=0+)(12,T T nC m V -=261.9J H ∆=恒压绝热H H ∆+∆=0+绝热Q =463.4J W =U ∆-Q =174.5J若只知始态和终态也可以求出两途径的U ∆及H ∆,因为H U 和是状态函数,其值只与体系的始终态有关,与变化途径无关。
物理化学习题及解答
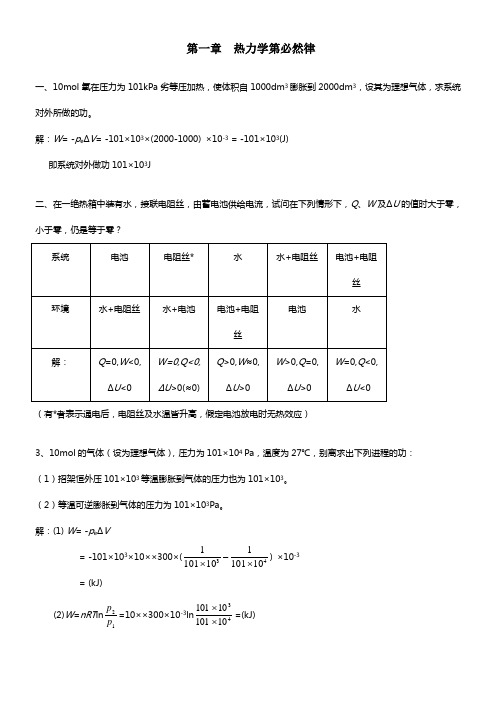
第一章 热力学第必然律一、10mol 氧在压力为101kPa 劣等压加热,使体积自1000dm 3膨胀到2000dm 3,设其为理想气体,求系统对外所做的功。
解:W = -p e ΔV = -101×103×(2000-1000) ×10-3 = -101×103(J)即系统对外做功101×103J二、在一绝热箱中装有水,接联电阻丝,由蓄电池供给电流,试问在下列情形下,Q 、W 及ΔU 的值时大于零,小于零,仍是等于零?(有*者表示通电后,电阻丝及水温皆升高,假定电池放电时无热效应)3、10mol 的气体(设为理想气体),压力为101×104 Pa ,温度为27℃,别离求出下列进程的功:(1)招架恒外压101×103等温膨胀到气体的压力也为101×103。
(2)等温可逆膨胀到气体的压力为101×103Pa 。
解:(1) W = -p e ΔV= -101×103×10××300×(43101011101011⨯-⨯) ×10-3 = (kJ)(2)W =nRT ln 12p p =10××300×10-3ln 431010110101⨯⨯=(kJ)4、在101kPa 下,气体由膨胀到,吸收了1255J 的热,求ΔU 、ΔH 、W 。
解:W = -p e ΔV = -101×103×(16-10) ×10-3 = -606(J)ΔH =Q p =1255JΔU =Q +W =1255-606=649(J)五、的水蒸气在100℃、101325Pa 下变成水,求Q 、W 、ΔU 及ΔH 。
已知水的气化热为2258J/g 。
解:Q =Q p =ΔH = -n Δvap H m = -2×2258×18×10-3 = (kJ)W = -p e ΔV = p e V g = nRT = 2××373×10-3=(kJ)ΔU =Q +W = +=(kJ)六、冰在0℃、101325Pa 下变成水,求Q 、W 、ΔU 及ΔH 。
物理化学(第一章)作业及答案

每次物理化学作业及答案§1.1 热力学基本概念第一周(1) 练习1“任何系统无体积变化的过程就一定不对环境作功。
”这话对吗?为什么?答:不对,应该是无体积变化的过程,系统就一定不对环境作体积功。
系统和环境之间交换能量的方式,除体积功外,还有非体积功,如电功,表面功等.2“凡是系统的温度下降就一定放热给环境,而温度不变时则系统既不吸热也不放热。
”这结论正确吗?举例说明之。
答:不正确。
系统的温度下降,内能降低,可以不放热给环境.例如: (13页例1-4) 绝热容器中的理想气体的膨胀过程,温度下降释放的能量,没有传给环境,而转换为对外做的体积功.而温度不变时则系统既不吸热也不放热。
不对, 等温等压相变过程,温度不变,但需要吸热(或放热), 如一个大气压下,373.15K 下,水变成同温同压的水蒸汽的汽化过程,温度不变,但需要吸热。
3在一绝热容器中盛有水,其中浸有电热丝,通电加热。
将不同对象看作系统,则上述加热过程的Q或W大于、小于还是等于零?⑴以电热丝为系统Q<0; W>0;⑵以水为系统; Q>0;W=0;⑶以容器内所有物质为系统Q=0; W>0;⑷将容器内物质以及电源和其它一切有影响的物质看作整个系统。
Q=0;W=0.4在等压的条件下,将1mol理想气体加热使其温度升高1K,试证明所作功的数值为R。
证明:∵等压过程则P1=P2=P e∴W=-p(V2-V1)=-p[ nR(T+1)/p- nRT/p]= -p×(nR/p)= -R51mol理想气体,初态体积为25dm3,温度为373.2K,试计算分别通过下列四个不同过程,等温膨胀到终态体积100dm3时,系统对环境作的体积功。
(1)向真空膨胀。
(2)可逆膨胀。
(3)先在外压等于体积50dm3时气体的平衡压力下,使气体膨胀到50dm3,然后再在外压等于体积为100dm3时气体的平衡压力下使气体膨胀到终态。
(4)在外压等于气体终态压力下进行膨胀。
(完整版)物理化学第一章课后答案

物理化学核心教程(第二版)参考答案第一章气体一、思考题1. 如何使一个尚未破裂而被打瘪的乒乓球恢复原状?采用了什么原理?答:将打瘪的乒乓球浸泡在热水中,使球壁变软,球中空气受热膨胀,可使其恢复球状。
采用的是气体热胀冷缩的原理。
2. 在两个密封、绝热、体积相等的容器中,装有压力相等的某种理想气体。
试问,这两容器中气体的温度是否相等?答:不一定相等。
根据理想气体状态方程,若物质的量相同,则温度才会相等。
3. 两个容积相同的玻璃球内充满氮气,两球中间用一玻管相通,管中间有一汞滴将两边的气体分开。
当左球的温度为273 K,右球的温度为293 K时,汞滴处在中间达成平衡。
试问:(1)若将左球温度升高10 K,中间汞滴向哪边移动?(2)若两球温度同时都升高10 K, 中间汞滴向哪边移动?答:(1)左球温度升高,气体体积膨胀,推动汞滴向右边移动。
(2)两球温度同时都升高10 K,汞滴仍向右边移动。
因为左边起始温度低,升高10 K所占比例比右边大,283/273大于303/293,所以膨胀的体积(或保持体积不变时增加的压力)左边比右边大。
4. 在大气压力下,将沸腾的开水迅速倒入保温瓶中,达保温瓶容积的0.7左右,迅速盖上软木塞,防止保温瓶漏气,并迅速放开手。
请估计会发生什么现象?答:软木塞会崩出。
这是因为保温瓶中的剩余气体被热水加热后膨胀,当与迅速蒸发的水汽的压力加在一起,大于外面压力时,就会使软木塞崩出。
如果软木塞盖得太紧,甚至会使保温瓶爆炸。
防止的方法是灌开水时不要太快,且要将保温瓶灌满。
5. 当某个纯物质的气、液两相处于平衡时,不断升高平衡温度,这时处于平衡状态的气-液两相的摩尔体积将如何变化?答:升高平衡温度,纯物的饱和蒸汽压也升高。
但由于液体的可压缩性较小,热膨胀仍占主要地位,所以液体的摩尔体积会随着温度的升高而升高。
而蒸汽易被压缩,当饱和蒸汽压变大时,气体的摩尔体积会变小。
随着平衡温度的不断升高,气体与液体的摩尔体积逐渐接近。
物理化学部分习题答案

第一章习题答案1.1 物质的体膨胀系数αV 与等温压缩率κT 的定义如下: p v TV V )(1∂∂=αT T pV V )(1∂∂-=κ试导出理想气体的V α、κT 与压力、温度的关系。
解:∵理想气体 pV=nRT∴ ()p nR T p nRT T V pp =⎪⎭⎫ ⎝⎛∂∂=⎪⎭⎫⎝⎛∂∂/ ()2/-⋅-=⎪⎪⎭⎫ ⎝⎛∂∂=⎪⎪⎭⎫ ⎝⎛∂∂p nRT p p nRT pV TT 12)(11-=-⋅-=⎪⎪⎭⎫ ⎝⎛∂∂⋅-=p p nRT V p V V T T κ 则 111-=⋅=⎪⎭⎫ ⎝⎛∂∂⋅=T pnR V T V V p V α1.5 两个容积均为V 的玻璃球泡之间用细管连接,泡内密封着标准状况下的空气。
若将其中一个球加热到100℃,另一个球则维持0℃,忽略连接细管中气体的体积,试求该容器内空气的压力。
解:始态: p 0 0℃ p 0 0℃ 末态 p ,0℃ p ,100℃以容器内的空气为系统,则两玻璃泡的体积不变,n 总不变。
211010RT pV RT pV RT V p RT V p +=+ 即 21102T p T p T p +=∴ ⎪⎪⎭⎫ ⎝⎛+=21012T T p p = ⎪⎭⎫ ⎝⎛+⨯K K kPa 15.37315.2731325.1012 = 117.0kPa1.9 如图所示一带隔板的容器中,两侧分别有同温同压的氢气和氮气,二者均可视为理想气体。
(1) 保持容器内温度恒定时抽去隔板,且隔板本身体积可忽略不计,试求两种气体混合后的压力;(2) 隔板抽去前后,H 2和N 2的摩尔体积是否相同?(3) 隔板抽去后,混合气体中H 2与N 2的分压力之比以及它们的分体积各为若干? 解:⑴ 总混混V RT n p=()总VRT n nN H 22+= p V RTRT pV RTpV N H =⎪⎪⎭⎫⎝⎛+=总22 ⑵ 对H 2: pRTn V V H Hm ==22,前 pRT n p RT n n V V H H H H m ===2222/,后∴隔板抽去前后H 2的摩尔体积相同。
物理化学第一章习题及答案

物理化学第一章习题及答案15,测得的QV,当298K SO2(g)氧化为SO3(g)时,m =-141.75 kJ·mol,并计算了该反应的Qp,m16、由下列化合物?CHm会计算吗?FHM(1)(COOH)2(2)C6H 5NH 2(3)CS2(L)17,将20dm3高压釜填充290千帕、100千帕氢气,加热后,将H2压力升至500千帕。
假设H2为理想气体,计算过程的:(1)q;(2)H2最终状态的温度18,1摩尔单原子分子理想气体b,通过可逆过程从300千帕,100.0千帕达到最终状态,压力为200.0千帕,q = 1000.0 j为过程,δh = 2078.5j(1)计算最终状态的温度、体积和W,δU(2)假设气体首先经历等压可逆过程,然后通过等温可逆过程达到最终状态,这个过程的Q,W,δU,δH是什么?19.CV,m=3/2R,初始状态202.6千帕,1摩尔单原子分子的理想气体11.2立方米通过p/T = C(常数)的可逆过程压缩到最终状态,压力405.2千帕计算:(1)最终体积和温度;(2)δU和δh;(3)工作完成情况8,综合题1,工业用乙炔火焰切割金属,请计算乙炔与压缩空气混合燃烧时的最高火焰温度。
将环境温度设置为25℃,压力设置为100千帕。
空气中氮与氧的比例是4: 125C的数据如下:物质△ fhm (kj mol) CP,m(J mol K)CO2(g)-393.51 37.1 H2O(g)-241.82 33.58 C2 H2(g)226.7 43.93 N2(g)0 29.122,乙烯制冷压缩机的入口条件为-101℃,1.196×10Pa,出口压力为19.25×10Pa(1)等温可逆压缩;(2)绝热可逆压缩(γ = 1.3)计算在上述两个过程中每压缩1磅乙烯所消耗的功3.在298K时,1摩尔的一氧化碳与0.5摩尔的氧气按照下式反应:一氧化碳+1/2 O2 = =二氧化碳生成1摩尔二氧化碳。
《物理化学》课后习题第一章答案

《物理化学》课后习题第⼀章答案习题解答第⼀章1. 1mol 理想⽓体依次经过下列过程:(1)恒容下从25℃升温⾄100℃,(2)绝热⾃由膨胀⾄⼆倍体积,(3)恒压下冷却⾄25℃。
试计算整个过程的Q 、W 、U ?及H ?。
解:将三个过程中Q 、U ?及W 的变化值列表如下:过程 QU ?W(1) )(11,初末T T C m V - )(11,初末T T C m V -0 (2)0 0(3) )(33,初末T T C m p - )(33,初末T T C m v - )(33初末V V p -则对整个过程:K 15.29831=末初T T = K 15.37331==初末T TQ =)(11,初末-T T nC m v +0+)(33,初末-T T nCmp=)初末33(T T nR -=[1×8.314×(-75)]J =-623.55JU ?=)(11,初末-T T nC m v +0+)(33,初末-T T nC m v =0 W =-)(33初末V V p -=-)初末33(T T nR -=-[1×8.314×(-75)]J =623.55J因为体系的温度没有改变,所以H ?=02. 0.1mol 单原⼦理想⽓体,始态为400K 、101.325kPa ,经下列两途径到达相同的终态:(1) 恒温可逆膨胀到10dm 3,再恒容升温⾄610K ; (2) 绝热⾃由膨胀到6.56dm 3,再恒压加热⾄610K 。
分别求两途径的Q 、W 、U ?及H ?。
若只知始态和终态,能否求出两途径的U ?及H ??解:(1)始态体积1V =11/p nRT =(0.1×8.314×400/101325)dm 3=32.8dm 3 W =恒容恒温W W +=0ln12+V V nRT=(0.1×8.314×400×8.3210ln +0)J=370.7JU ?=)(12,T T nC m V -=[)400610(314.8231.0-]J =261.9JQ =U ?+W =632.6J H ?=)(12,T T nCmp -=[)400610(314.8251.0-]=436.4J(2) Q =恒压绝热Q Q +=0+)(12,T T nCmp -=463.4JU ?=恒压绝热U U ?+?=0+)(12,T T nC m V -=261.9J H ?=恒压绝热H H ?+?=0+绝热Q =463.4J W =U ?-Q =174.5J 若只知始态和终态也可以求出两途径的U ?及H ?,因为H U 和是状态函数,其值只与体系的始终态有关,与变化途径⽆关。
物理化学习题详细答案

葛华才等编.《物理化学》(多媒体版)配套部分章节的计算题解.高等教育出版社第一章热力学第一定律第二章热力学第二定律第三章多组分系统第四章化学平衡第五章相平衡第六章化学动力学第七章电化学第八章界面现象第九章胶体化学第十章统计热力学第一章热力学第一定律计算题1. 两个体积均为V 的密封烧瓶之间有细管相连,管内放有氮气。
将两烧瓶均放入100℃的沸水时,管内压力为50kPa。
若一只烧瓶仍浸在100℃的沸水中,将另一只放在0℃的冰水中,试求瓶内气体的压力。
解:设瓶内压力为p′,根据物质的量守恒建立如下关系:(p′V/373.15)+ (p′V/273.15)= 2(pV/373.15)即p′=2×50 kPa/(1+373.15/273.15)=42.26 kPa2. 两个容器A 和B 用旋塞连接,体积分别为1dm3 和3dm3,各自盛有N2 和O2(二者可视为理想气体),温度均为25℃,压力分别为100kPa 和50kPa。
打开旋塞后,两气体混合后的温度不变,试求混合后气体总压及N2 和O2的分压与分体积。
解:根据物质的量守恒建立关系式p 总(V A+V B)/ 298.15=( p A V A /298.15)+ (p B V B /298.15)得p 总= ( p A V A+ p B V B)/ (V A+V B) = (100×1+50×3) kPa/(1+3)=62.5 kPan(N2)= p A V A /RT A= {100000×0.001/(8.315×298.15)}mol = 0.04034 moln(O2)= p B V B /RT B= {50000×0.003/(8.315×298.15)}mol = 0.06051 mol葛华才编.《物理化学》(多媒体版)配套部分章节的计算题解.高等教育出版社-3 y (N 2)= n (N 2)/{ n (N 2)+ n (O 2)}= 0.04034/(0.04034+0.06051)=0.4y (O 2)=1- y (N 2)=1-0.4=0.6分压p (N 2)= y (N 2) p 总 = 0.4×62.5 kPa= 25 kPap (O 2)= y (O 2) p 总 = 0.6×62.5 kPa= 37.5 kPa分体积 V (N 2)= y (N 2) V 总 = 0.4×4 dm 3 = 1.6 dm 3V (O 2)= y (O 2) V 总 = 0.6×4 dm 3 = 2.4 dm 33. 在 25℃,101325Pa 下,采用排水集气法收集氧气,得到 1dm 3 气体。
物理化学课后习题答案(全)

6. 1mol N2 在 0℃时体积为 70.3cm3,计算其压力,并与实验值 40.5 MPa 比较: (1) 用理想气体状态方程; (2) 用范德华方程; (3) 用压
缩因子图。
解:(1) p = RT Vm
=
⎜⎛ ⎝
8.3145× 273.15 70.3 ×10 −6
⎟⎞ ⎠
Pa
=
32.3 ×10 6
=
−
1 1672
=
−0.06 %
(3) 1 g 水蒸气的体积
V
=
nRT
=
⎡ ⎢ ⎢
1 18.02
×
8.3145
×
(100
+
273.15)
⎤ ⎥ ⎥
m
3
p⎢
101325
⎥
⎢⎣
⎥⎦
= 1.699 ×10−3 m 3 = 1699cm3
[ ] W = − 101325 × (1699 − 1.044) × 10−6 × 18.02 J
及 101325Pa 时 1g 水的体积为 1.044cm3,1 g 水蒸气的体积为 1673cm3。
(1) 试求此过程的功; (2) 假定略去液态水的体积,试求结果的百分误
差; (3) 假定把水蒸气当作理想气体,试求结果的百分误差; (4) 根
据(2)、(3)的假定,证明恒温下若外压等于液体的饱和蒸气压,则物质
Pa
=
32.3
MPa
(2) 由表 1–6 查得, a = 0.141 Pa ⋅ m6 ⋅ mol−2 ,
b = 0.0391 × 10−3 m3 ⋅ mol −1 ,则
p = RT − a Vm − b Vm2
药学本科《物理化学》考试(含答案)

药学本科《物理化学》上学期参考试卷及答案一、是非题1.熵增加的过程都是自发过程。
( )2.根据热力学第一定律,因为能量不能无中生有,所以一个系统若要对外作功,必须从外界吸收热量。
( )3.气体经绝热自由膨胀后,因Q=0,W=0,所以∆U=0,气体的温度不变。
( )4.若一个过程是可逆过程,则该过程中的每一步都是可逆的。
( )5.在298K 下,氢气的标准燃烧焓就是水的标准生成焓。
( )6.任何化学反应的Q p 总是大于Q v 。
( )7.不作非体积功的等容过程的热只由系统的始、终态决定。
( )8.反应A+B = C+D 达平衡时,各物质的化学势一定相等。
( )9.计算绝热不可逆过程的熵变,可以在相同的始、终态间设计一条绝热可逆途径来计算。
( )10.理想气体向真空膨胀Q=0,所以∆S=0。
( )11.对于纯组分,化学势等于其摩尔吉布斯能。
( )12.热是由于温差而传递的能量形式,它总是倾向于从含热较多的高温物体流向含热较少的低温物体。
( )13.恒容条件下,一定量的理想气体,温度升高时,热力学能将增加。
( )14.一个已达平衡的化学反应,只有当标准平衡常数改变时,平衡才会移动。
( )15.任意体系经一循环过程则其∆U ,∆H ,∆S ,∆G ,∆A 均为零。
( )16.相图中的点都是代表系统状态的点。
( )17.根据二元液系的p-x 图可以准确地判断该系统的液相是否为理想液体混合物。
( )18.任何一个化学反应都可以用r m G θ∆来判断其反应进行的方向。
19.在等温、等压、只作体积功的条件下,反应的∆G m <0时,若其数值越小,反应自发进行的趋势也越强,反应进行得越快。
( )20.恒沸物的组成不变。
( )二、单选题1. 对实际气体的节流膨胀过程,有( )A. △H = 0B. △S = 0C. △G = 0D. △U = 02. 下列纯物质两相平衡有关的描述,不正确的是( )A.沸点将随压力增加而升高B. 熔点将随压力增加而升高C.蒸气压将随温度升高而加大D. 升华温度将随压力增大而升高3. NH 4HS(s) 和任意量的 NH 3(g) 及 H 2S(g) 达平衡时有( )A. K = 2,φ= 2,f = 2B. K = 1,φ= 2,f = 1C. K = 2,φ= 3,f = 2D. K = 3,φ= 2,f = 34.使一过程的△G=0应满足的条件是 ( )A.可逆绝热过程B.等容绝热且只做膨胀功的过程C.等温等压且只做膨胀功的可逆过程D.等温等容且只做膨胀功的可逆过程5.对于理想气体,下列关系式中哪个不正确?( ) A. 0)(=∂∂V T U B. ()0T U V ∂=∂ C.0)(=∂∂T P H D. 0)(=∂∂T PU 6.在298K 时反应C 6H 5COOH (l )+7.5O 2(g )=7CO 2(g )+3H 2O (l ),设各气体皆为理想气体,则等压反应热∆H 与等容反应热∆U 之差等于(KJ ⋅mol -1)( )。
物理化学(复旦大学药学院) 第一章习题答案

第一章 习题解答1. (1) Q =∆U -W =200-160=40 kJ (2) ∆U =Q +W =260-100=160 kJ2.()pR T T p nRp nRT p nRT V =-=-=∆1212∴W =-p ∆V =-R3. (1) W =-p ∆V =-p (V g –V l )≈-pV g =-nRT =-1⨯8.314⨯373.15=-3102 J(2) W =-p ∆V =-p (V s –V l )J 160100101801092001801013251133l s.....M p -=⎪⎪⎭⎫⎝⎛⨯-⨯-=⎪⎪⎭⎫ ⎝⎛--=ρρ4.在压力p 和房间容积V 恒定时,提高温度,部分空气溢出室外,因此室内气体量n 是温度的函数,TR pV n 1⋅=。
kJ7721288298ln 32960100000ln 12m m 2121.R .**T T C R pV T dT C R pV dT nC Q ,p T T m ,p T T ,p p =====⎰⎰5. (1)恒温可逆膨胀 J 429902501023********-=⨯-=-=..ln..V V ln RT W (2)真空膨胀 W = 0(3)恒外压膨胀 W =-p 外(V 2–V 3) = ()122V V V RT--⎪⎪⎭⎫ ⎝⎛--=211V V RT ⎪⎭⎫ ⎝⎛-⨯⨯-=100250123733148....= -2327 J(4)二次膨胀W =W 1 + W 2⎪⎪⎭⎫ ⎝⎛--⎪⎪⎭⎫⎝⎛--=322111V V RT V V RTJ 310310050105002501-=⎪⎭⎫ ⎝⎛--⎪⎭⎫ ⎝⎛--=..RT ..RT以上结果表明,功与具体过程有关,不是状态函数。
6. (1) 理想气体为系统,等压过程, Q =∆H >0(2) 电热丝+理想气体为系统,等压过程,Q =0,∆U =W '>0,∆H =∆U +∆(pV )>07.∆H =n ⋅∆H m,汽化=40670 J∆U =∆H –∆(pV )=∆H –p (V g -V l )=40670–101325(30200–1880)⨯10-6 =40670–3058=37611 J 8.9.C p,m =29.07–0.836⨯103T +2.01⨯10-6T 2(1) Q p =∆H 10003003623m 1001231108360210729d 21⎥⎦⎤⎢⎣⎡⨯⨯+⨯⨯-==--⎰T .T ..T C n T T ,p=20349–380+625=20.62 kJ(2) Q V =∆U =∆H –∆(pV )=∆H –(p 2V 2–p 1V 1) =∆H –nR (T 2–T 1)=20.62–R (1000-300)⨯10-3=14.80 kJ10.(1)等温可逆膨胀 ∆U =∆H = 0Q =-W J 163115ln 102106506ln 33211121=⨯⨯⨯===-.p p V p p p ln nRT(2)等温恒外压膨胀∆U =∆H =0Q = -W = p 2 (V 2–V 1) = p 2V 2–p 2V 1= p 1V 1–p 2V 1= (p 1–p 2)V 1 =(506.6-101.3)⨯103⨯2⨯10-3 = 810 J11. (1)常压蒸发:Q =∆H =40.7 kJ W =-p (V g –V l )≈-pV g ≈-RT =-8.314⨯373=-3.1 kJ ∆U =Q +W =37.6 kJ (2) 真空蒸发:∆H =40.7 kJ W =0 ∆U =Q =37.6 kJ12.K 2273111.nRV p T == (1) p 1T 1=p 2T 2K 51362112.p T p T ==3222m 0028045136.R.p nRT V ===(2) ∆U =nC V ,m (T 2–T 1)=J 17022273513623-=-)..(R ∆H =nC p ,m (T 2–T 1)=J 28372273513625-=-)..(R(3) 以T 为积分变量求算:pT =C (常数)T C p =C nRT T /C nRT p nRT V 2===T T CnRdV d 2⋅= J 227022d 2d 12=--=-=⋅⋅-=-=⎰⎰⎰)T T (nR dT nR T CnRT T C V p W也可以用p 或V 为积分变量进行求算。
复旦大学物理化学笔记(附例题)

物理化学笔记(附例题)第一章溶液和胶体溶液和胶体是物质的不同存在形式,在自然界中普遍存在,与工农业生产以及人类生命活动过程有着密切的联系。
广大的江河湖海就是最大的水溶液,生物体和土壤中的液态部分大都为溶液或胶体。
溶液和胶体是物质在不同条件下所形成的两种不同状态。
例如NaCl溶于水就成为溶液,把它溶于酒精则成为胶体。
那么,溶液和胶体有什么不同呢?它们各自又有什么样的特点呢?要了解上述问题,需要了解有关分散系的概念。
1.1分散系及其分类1.1.1 分散系的概念一种或几种物质分散在另一种物质里所形成的系统称为分散系统,简称分散系。
例如粘土分散在水中成为泥浆,水滴分散在空气中成为云雾,奶油、蛋白质和乳糖分散在水中成为牛奶等都是分散系。
在分散系中,被分散的物质叫做分散质(或分散相),而容纳分散质的物质称为分散剂(或分散介质)。
在上述例子中,粘土、水滴、奶油、蛋白质、乳糖等是分散质,水、空气就是分散剂。
分散质和分散剂的聚集状态不同,分散质粒子大小不同,分散系的性质也不同。
我们可以按照物质的聚集状态或分散质颗粒的大小将分散系进行分类。
1.1.2分散系的分类物质一般有气态、液态、固态三种聚集状态,若按分散质和分散剂的聚集状态进行分类,可以把分散系分为九类,见表1-1。
表1-1 分散系分类(一)若按分散质粒子直径大小进行分类,则可以将分散系分为三类,见表1-2。
表1-2 分散系分类(二)分子与离子分散系统中,分散质粒子直径<1nm,它们是一般的分子或离子,与分散剂的亲和力极强,均匀、无界面,是高度分散、高度稳定的单相系统。
这种分散系统即通常所说的溶液,如蔗糖溶液、食盐溶液。
胶体分散系中,分散质粒子直径为1~100nm ,它包括溶胶和高分子化合物溶液两种类型。
一类是溶胶,其分散质粒子是由许多一般的分子组成的聚集体,这类难溶于分散剂的固体分散质高度分散在液体分散剂中,所形成的胶体分散系称为溶胶。
例如氢氧化铁溶胶、硫化砷溶胶、碘化银溶胶、金溶胶等。
物理化学习题及答案

物理化学习题及答案篇一:物理化学课后习题答案第1章化学热力学基本定律1.1mol双原子理想气体在300 K、101 kPa下,经恒外压恒温压缩至平衡态,并从此状态下恒容升温至370 K、压强为1 010 kPa。
求整个过程的?U、?H、W及Q。
(答案:△U = 1455 J,△H = 2037 J,W=17727 J,Q = -16272 J)解:第一步:恒外压恒温压缩至平衡态,?U=0,?H=0V1=×300/101=,此平衡态的体积就是末态的体积V2, V2=×370/1010=此平衡态的压强P’=×300/(×10-3)=W=-P’(V2-V1)=-×103×()×10-3 =17727 J= kJ-Q=W= kJ Q=- kJ第一步:因恒容W=0?U=Qv=Cv,m(T2-T1) =×(370-300)= J= kJ?H=(+R)×70= J= kJ整个过程:W= kJ;Q= -+= - kJ;?U= kJ ;?H= kJ。
2.设有 kg N2,温度为 K,压强为101325 Pa,分别进行下列过程,求?U、?H、Q及W。
(1) 恒容加热至压强为 Pa; (2) 恒压膨胀至原体积的2倍;(3) 恒温可逆膨胀至原体积的2倍; (4) 绝热可逆膨胀至原体积的2倍。
(答案:①△U = QV = ×104 J,△H = ×104 J,W = 0;②△H = QP = kJ,△U = kJ,W= - kJ;③ Q = 5622 J ,W = -5622 J,△H = △U = 0 J;④ Q = 0,W = △U = -4911 J,△H = - 6875 J)解:将N2 气视为双原子理想气体,则Cp,m= J·mol-1·K-1;Cv,m= J·mol-1·K-1(1) W=0, 末态温度 T2==× K∴?U=Qv=n Cv(T2-T1) =(100/28)××(×)=×104 J?H= n Cp(T2-T1) =(100/28)××(×)=×104 J(2) 末态温度 T2=2T1=2×?H=Qp= n Cp(T2-T1) =(100/28)××(2×) =28388 J= kJ?U=n Cv(T2-T1) =(100/28)×× = 20201 J= kJW= -P?V= -101325×(100/28)××/101325= -8110J= -(3) 理想气体恒温,?H=?U=0,W= -Q= -(100/28)×××ln2= -5622 J= - kJ(4) 运用理想气体绝热过程方程:?T2=(1/2)×T1=(1/2)× =207 K;Q=0W=?U= n Cv,m?T= (100/28)××()= -4911 J= - kJ?H= (100/28)××()=-6875 J= - kJ3.在 K、101325 Pa下,1 mol水缓慢蒸发。
【精品】药学专业中的物理化学课后习题答案.docx

第五章化学平衡三•思考题参考答案1.反应达到平衡时,宏观和微观特征有何区别?答:反应到达平衡时,宏观上反应物和生成物的数量不再随时间而变化,好像反应停止了。
而微观上,反应仍在不断的进行,反应物分子变为生成物分子,而生成物分子又不断变成反应物分子,只是正、逆反应的速率恰好相等,使反应物和生成物的数量不再随吋间而改变。
2.为什么化学反应通常不能进行到底?答:严格讲,反应物与产物处于同一系统的反应都是可逆的,不能进行到底。
只有逆反应与止反应相比小到对以忽略不计的反应,对以粗略地认为町以进行到底。
这主耍是rh于存在混合Gibbs自由能的缘故,反应物与产物混合,会使系统的Gibbs自市能降低。
如果没有混合Gibbs 0山能,在Gibbs自山能对反应进度的变化曲线上,应该是一根不断下降的直线,不会出现最低点。
如果将反应在van^ Hoff平衡箱屮进行,反应物与生成物的压力都保持不变,反应物与生成物也不发生混合,反应物反应掉一个分子,向平衡箱屮补充一个分子。
生成一个生成物分子,则从平衡箱中移走一个分子,这样才能使反应进行完全。
3.什么是复相化学反应?其平衡常数有何特征?答:有气相和凝聚相(液相、固体)共同参与的反应称为复相化学反应。
对凝聚相,只考虑是纯态的情况,纯态的化学势就是它的标准态化学势,所以复相化注反应的标准平衡常数只与气态物质的压力有关。
4.什么是物质的解离压?答:在一定温度下,某纯的固体物质发生解离反应,如果只产生一种气体,达到平衡吋, 这气体的压力就称为该固体在该温度吋的解离压。
如果产生的气体不止--种,达到平衡吋, 所有气体压力的总和称为该固体在该温度时的解离压。
显然物质的解离压在定温下有定值。
5.什么是标准摩尔生成Gibbs自由能?答:因为Gibbs Qrh能的绝对值不知道,所以只能用相对值,需耍规定一个共同的相对标准。
即将标准压力下稳定单质(包括纯的理想气体,纯的固体或液体)的牛成Gibbs 口rh 能看作零,在标准床力下,反应温度时,山稳定单质生成计量系数v B=l的物质B时,标准摩尔Gibbs 自由能的变化值称为物质B的标准摩尔生成Gibbs自由能,川符号A f G^(B,P,T)表示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物理化学(复旦大学药学院)第一章习题答案第一章 习题解答1. (1) Q =∆U -W =200-160=40 kJ (2) ∆U =Q +W =260-100=160 kJ2.()pR T T p nRp nRT p nRT V =-=-=∆1212 ∴W = -p ∆V = -R3. (1) W = -p ∆V = -p (V g –V l )≈ -pV g = -nRT = -1⨯8.314⨯373.15= -3102 J (2) W = -p ∆V = -p (V s –V l )J 160100101801092001801013251133ls.....M p -=⎪⎪⎭⎫ ⎝⎛⨯-⨯-=⎪⎪⎭⎫ ⎝⎛--=ρρ4. 在压力p 和房间容积V 恒定时,提高温度,部分空气溢出室外,因此室内气体量n 是温度的函数,TR pV n 1⋅=。
kJ 7721288298ln 32960100000ln 12m m 2121.R .**T T C R pV T dT C R pV dT nC Q ,p T Tm ,p T T,p p =====⎰⎰5. (1) 恒温可逆膨胀 J 429902501023*******2-=⨯-=-=..ln..VVln RT W(2) 真空膨胀 W = 0(3) 恒外压膨胀 W = -p外(V 2–V 3) =()122V V VRT--⎪⎪⎭⎫ ⎝⎛--=211V V RT ⎪⎭⎫ ⎝⎛-⨯⨯-=100250123733148....= -2327 J(4) 二次膨胀 W =W 1 + W 2 ⎪⎪⎭⎫ ⎝⎛--⎪⎪⎭⎫⎝⎛--=322111VV RT VV RTJ310310050105002501-=⎪⎭⎫ ⎝⎛--⎪⎭⎫ ⎝⎛--=..RT ..RT以上结果表明,功与具体过程有关,不是状态函数。
6. (1) 理想气体为系统,等压过程, Q =∆H >0 (2) 电热丝+理想气体为系统,等压过程,Q =0,∆U =W '>0,∆H =∆U +∆(pV )>07. ∆H =n ⋅∆H m,汽化=40670 J∆U =∆H –∆(pV )=∆H –p (V g -V l )=40670–101325(30200–1880)⨯10-6 =40670–3058=37611 J 8.9. C p,m =29.07–0.836⨯103T +2.01⨯10-6T 2(1) Q p =∆H 10003003623m1001231108360210729d 21⎥⎦⎤⎢⎣⎡⨯⨯+⨯⨯-==--⎰T .T ..T C n T T ,p=20349–380+625=20.62 kJ(2) Q V =∆U =∆H –∆(pV )=∆H –(p 2V 2–p 1V 1) =∆H –nR (T 2–T 1)=20.62–R (1000-300)⨯10-3 =14.80 kJ10.(1)等温可逆膨胀 ∆U =∆H = 0Q = -W J 163115ln 102106506ln 33211121=⨯⨯⨯===-.p p V p p p ln nRT (2)等温恒外压膨胀 ∆U =∆H =0Q = -W = p 2 (V 2–V 1) = p 2V 2–p 2V 1= p 1V 1–p 2V 1= (p 1–p 2)V 1=(506.6-101.3)⨯103⨯2⨯10-3 = 810 J11. (1)常压蒸发:Q =∆H = 40.7 kJ W = -p (V g –V l )≈ -pV g ≈ -RT = -8.314⨯373= -3.1 kJ ∆U =Q +W =37.6 kJ(2) 真空蒸发:∆H =40.7 kJ W =0 ∆U =Q =37.6 kJ 12.K 2273111.nRV p T ==(1) p 1T 1=p 2T 2 K 51362112.p T p T ==3222m 0028045136.R.p nRT V ===(2) ∆U =nC V ,m (T 2–T 1)=J 17022273513623-=-)..(R ∆H =nC p ,m (T 2–T 1)=J 28372273513625-=-)..(R (3) 以T 为积分变量求算: pT =C (常数) TCp =CnRT T /C nRT p nRT V 2===T T CnRdV d 2⋅=J 227022d 2d 12=--=-=⋅⋅-=-=⎰⎰⎰)T T (nR dT nR T CnRT T C V p W也可以用p 或V 为积分变量进行求算。
13.∆U =nC V ,m (T 2–T 1)=20.92⨯(370–300)=1464 J ∆H =nC p ,m (T 2–T 1)=(20.92+R )⨯(370–300)=2046 J始态体积 3111m 02460.p RT V == 体积变化:33332m 0030260.pRTV V === 压力Pa 821554222==V RT pW =W 1+W 2= -p 2(V 2–V 1)+0=-821554⨯(0.003026–0.0246)= 17724 J Q=∆U -W =1464–17724=–16260 J14. (1) ∆H =C p ,m (T 2–T 1)20922273252=-=).T (R T 2=373.8 K121122nRT nRT V p V p =2273837321052..p =⨯ p 2=0.684⨯105 Pa∆U = C V ,m (T 2–T 1)12552273837323=-=)..(R J W =∆U –Q =1255–1674=–419 J (2)2121状态=恒容,中间状态恒温,状态−−−−−−→−−−−−→−W W状态函数变化同上 ∆U =1255 J ∆H =2092 JW =W 112VV ln nRT -==–8.314⨯273.2⋅ln2=–1574 JQ =∆U –W =1255+1574 = 2829 J15. 双原子分子 R C ,V 25m = 41.C C m.V m ,p ==γγγγγ--=122111p T p TK1224655032510122734141112112....p p T T ..=⎪⎭⎫ ⎝⎛=⎪⎪⎭⎫ ⎝⎛=--γγW =∆U =nC V ,m (T 2–T 1)()J 10202273122425-=-=..R16. (1)等温可逆膨胀 ∆U =∆H = 0Q = W J 1822412250ln 1527312-=-=-=.R .V V ln nRT (2)绝热可逆膨胀 C p .m =20.79 C V .m = C p .m -R =12.4766661476127920...C C m,V m ,p ===γTV γ-1=常数 K06160504122152731666112112...V V T T .=⎪⎭⎫⎝⎛=⎪⎪⎭⎫ ⎝⎛=--γQ =0∆U =W =nC V ,m (T 2–T 1)=12.476⨯(160.06–273.15)= -1411 J∆H =nC p ,m (T 2–T 1)= 20.79⨯(160.06–273.15)= -2351 J17. (1) 4061828828mm .R..C C .V ,p =-==γmol 1755029843199303111.R..RT V p n =⨯==γγ2211V p V p =kPa 71148624319930340612112....V V p p .=⎪⎭⎫ ⎝⎛=⎪⎪⎭⎫ ⎝⎛=γK 92242122.RT V p T ==(2) ∆U =nC V ,m (T 2–T 1)=0.1755⨯(28.8–R )⨯(224.9–298)= -263 J ∆H =nC p ,m (T 2–T 1)=0.1755⨯28.8⨯(224.9–298))= -369 J18. 设物质量为1mol415253.R.R.C C m,V m ,p ===γ 始态温度:6240314810101025111...nR V p T =⨯⨯⨯== K 求终态温度:122111--=γγV T VT1553010624014112112..V V T T .=⎪⎭⎫⎝⎛=⎪⎪⎭⎫⎝⎛=--γK1779624001552512-=-=-=∆)..(R )T T (nC U m ,V J 2490624001552712-=-=-=∆)..(R )T T (nC H m ,p J Q =0 W =∆U = -1779 J若设物质量为n mol ,可如下计算:始态温度n .nR V p T 6240111==, 终态温度n.V V T T 015512112=⎪⎪⎭⎫ ⎝⎛=-γ 在计算∆U 、∆H 、W 时n 可消去,得相同的结果。
19. 证明 U =H –pV pppppT V p C T V p T H T U ⎪⎭⎫⎝⎛∂∂-=⎪⎭⎫ ⎝⎛∂∂-⎪⎭⎫ ⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂20. 证明 ⎥⎦⎤⎢⎣⎡⎪⎭⎫ ⎝⎛∂∂-⎪⎭⎫ ⎝⎛∂∂-⎪⎭⎫ ⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂-⎪⎭⎫⎝⎛∂∂=-V V p V p V p T p V T H T H T U T H C C (1)H =f (T ,p )dp p H dT T H dH Tp ⎪⎪⎭⎫ ⎝⎛∂∂+⎪⎭⎫⎝⎛∂∂=V 不变,对T 求导 VT p VT p p H T H T H ⎪⎭⎫⎝⎛∂∂⎪⎪⎭⎫ ⎝⎛∂∂+⎪⎭⎫⎝⎛∂∂=⎪⎭⎫⎝⎛∂∂ 代入(1)⎥⎥⎦⎤⎢⎢⎣⎡-⎪⎪⎭⎫⎝⎛∂∂⎪⎭⎫ ⎝⎛∂∂-=⎪⎭⎫ ⎝⎛∂∂+⎪⎭⎫ ⎝⎛∂∂⎪⎪⎭⎫ ⎝⎛∂∂-=-V p H T p T p V T p p H C C T V V V T V p21. 发酵反应 C 6H 12O 6(s) −→ 2C 2H 5OH(l) +2CO 2(g) ∆n =2∆U =∆H -∆nRT = -67.8 -2R ⨯298⨯10-3 = -72.76 kJ ⋅mol -122. n Q V +C ∆T =005817594210050=⨯+..Q .V Q V =–4807200 JC 7H 16(l) + 11O 2(g) = 8H 2O(l) + 7CO 2(g) ∆n =–4∆c H m = Q V + ∆nRT =–4807200–4R ⨯298 = –4817100 J ⋅mol –1=–4817.1 kJ ⋅mol -123.(1) 2H 2S(g)+SO 2(g) = 8H 2O(l) + 3S(斜方) ∆n =–3 Q V =–223.8 kJ∆r H m = Q V + ∆nRT = –223.8 + (–3)RT ⨯10-3 = –231.2 kJ(2) 2C(石墨) + O 2(g) = 2CO(g) ∆n = 1 Q V =–231.3 kJ∆r H m = Q V + ∆nRT = –231.3 +RT ⨯10–3 = –228.8 kJ(3) H 2(g)+Cl 2(g) = 2HCl (g) ∆n =0 Q V =–184 kJ ∆r H m = Q V =–184 kJ24. (1) ξ=4 mol (2) ξ=2 mol (3) ξ=8 mol25.2NaCl(s) + H2SO4(l) = Na2SO4(s) + 2HCl(g)∆f H O m(kJ⋅mol-1) –411 –811.3 –1383–92.3∆r H O m=∑(n∆f H O m)产物–∑(n∆f H O m)反应物= (–1383–2⨯92.3)–(–811.3–2⨯411) = 65.7 kJ⋅mol-1∆r U O m=∆r H︒m–∆nRT=65.7–2RT⨯10-3=60.7 kJ⋅mol-126.生成反应7C(s) + 3H2(g) + O2(g) = C6H5COOH(l)∆c H O m(kJ⋅ mol-1) –394 –286 –3230 ∆r H O m=∑(n∆c H O m)反应物–∑(n∆c H O m)产物= [7⨯(–394) + 3⨯(–286)] – (–3230)= –386 kJ⋅mol-127. 反应C(石墨) → C(金刚石)∆c H O m(kJ⋅mol-1) –393.5 –395.4∆r H O m=∆c H O m,石墨–∆c H O m,金刚石=–393.5–(–395.4)=1.9 kJ⋅mol-128. 3C2H2 (g) = C6H6 (l)∆f H O m (kJ⋅mol-1) 226.73 49.04∆c H O m (kJ⋅mol-1) –1299.6 –3267.5由生成热数据计算:∆r H O m=49.04–3⨯226.73=–631.15 kJ⋅mol-1∆r U O m=∆r H O m–∆nRT=–631.15+3⨯8.314⨯298.2⨯10-3= -623.71 kJ⋅mol-1 由燃烧热数据计算:∆r H O m=3⨯(–1299.6)–(–3267.5) =–631.3 kJ⋅mol-1∆r U O m=∆r H O m–∆nRT=–631.3+3⨯8.314⨯298.2⨯10-3= -623.86 kJ⋅mol-129. 反应KCl(s) → K+(aq, ∞) + Cl-(aq, ∞) ∆f H O m(kJ⋅mol-1) –435.87 ? –167.44 ∆r H O m=17.18 kJ⋅mol-1∆r H O m=∑(n∆f H O m)产物–∑(n∆f H O m)反应物17.18=[∆f H O m (K+,aq, ∞)–167.44]–(–435.87)∆f H O m (K+,aq, ∞)=–251.25 kJ⋅mol-130. 生成反应H2(g) + 0.5O2(g) = H2O(g)∆r H O m,298=–285.83 kJ⋅mol-1C p,m(J⋅K-1⋅mol-1) 28.824 29.355 75.291∆C p =75.291–(28.824+0.5⨯29.355)=31.79 J ⋅K -1 ⎰∆+∆=∆T C H H p d O m ,298r O m ,373r =–285.83+31.79⨯(373–298)⨯10-3 =–283.45 kJ ⋅mol -131. 反应N 2(g) + 3H 2(g) = 2NH 3(g) ∆r H O m,298=–92.88 kJ ⋅mol -1a b ⨯103 c ⨯107 N 2(g)26.98 5.912 –3.376 H 2(g)29.07 –0.837 20.12 NH 3(g)25.89 33.00 –30.46 ∆ –62.41 62.599 –117.904 ⎰∆+∆=∆T C H H p d O m ,298r O m ,398r ()⎰∆+∆+∆+∆=T cT bT a H d 2O m ,298r39829832O m,298r 3121⎥⎦⎤⎢⎣⎡∆+∆+∆+∆=cT bT aT H 3982983723O m,298r )109117(31)10662(21)4162(⎥⎦⎤⎢⎣⎡⨯-+⨯+-+∆=--T .T .T .H=–92880+[–6241+2178–144]= –97086 J ⋅mol -132.-1⋅mol -1 ⋅mol -1 r m ,473∆H H2=nC p,m∆T=3.5R(473–291)=5296 J∆H HI=nC p,m∆T=2⨯3.5R(473–291)=10592 J∆H I2=∆H1(s,291→386.7K) + ∆H2(s→l) + ∆H3(l,1386.7→457.5K) + ∆H4(l→g)+ ∆H5(g,457.5→473K)=55.64⨯(386.7–291)+16736+62.76⨯(457.5–386.7)+42677+3.5R⨯(473–457.5)=69632 J∆H H2+∆H I2+∆r H O m,473=∆r H O m,291+∆H HI5296+69632+∆r H O m,473=49455+10592∆r H O m,473=–14.881 kJ ⋅mol-1。
