九年级化学化学计算题题型汇总
九年级化学化学计算题题20套(带答案)及解析
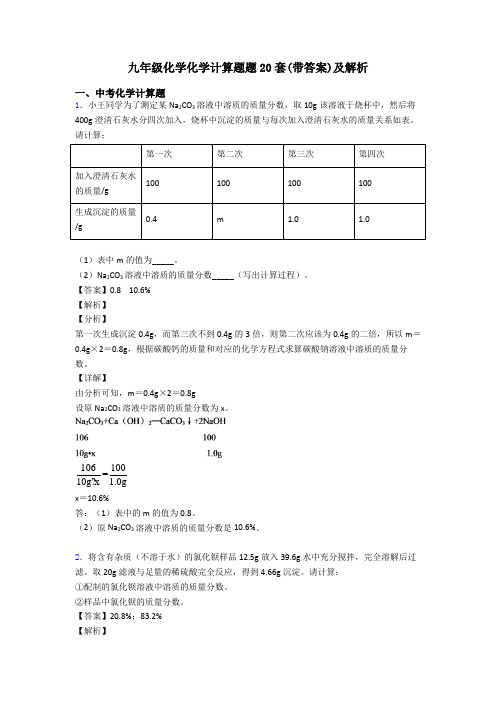
九年级化学化学计算题题20套(带答案)及解析一、中考化学计算题1.小王同学为了测定某Na2CO3溶液中溶质的质量分数,取10g该溶液于烧杯中,然后将400g澄清石灰水分四次加入,烧杯中沉淀的质量与每次加入澄清石灰水的质量关系如表。
请计算:第一次第二次第三次第四次加入澄清石灰水100100100100的质量/g生成沉淀的质量0.4m 1.0 1.0/g(1)表中m的值为_____。
(2)Na2CO3溶液中溶质的质量分数_____(写出计算过程)。
【答案】0.8 10.6%【解析】【分析】第一次生成沉淀0.4g,而第三次不到0.4g的3倍,则第二次应该为0.4g的二倍,所以m=0.4g×2=0.8g,根据碳酸钙的质量和对应的化学方程式求算碳酸钠溶液中溶质的质量分数。
【详解】由分析可知,m=0.4g×2=0.8g设原Na2CO3溶液中溶质的质量分数为x。
106100=10g?x 1.0gx=10.6%答:(1)表中的m的值为 0.8。
(2)原Na2CO3溶液中溶质的质量分数是10.6%。
2.将含有杂质(不溶于水)的氯化钡样品12.5g放入39.6g水中充分搅拌,完全溶解后过滤。
取20g滤液与足量的稀硫酸完全反应,得到4.66g沉淀。
请计算:①配制的氯化钡溶液中溶质的质量分数。
②样品中氯化钡的质量分数。
【答案】20.8%;83.2%【解析】【详解】①设参加反应的氯化钡的质量为x 。
2244BaCl +H SO =BaSO +2H 208233x4Cl.66g208233=x 4.66gx= 4.16g则配制的氯化钡溶液中溶质的质量分数为 :4.16g20g×100%=20.8% ②由于20g 溶液中含有4.16g 氯化钡,则可设样品中氯化钡的质量为y 。
则4.16g y=20g-4.16g 39.6gy=10.4g样品中氯化钡的质量分数为:10.4g12.5g×100%=83.2%答:①氯化钡溶液中溶质的质量分数为20.8% ②样品中氯化钡的质量分数为83.2%。
初中中考化学计算题题型汇总

题型分析(一)有关化学式计算题类型:第一种类型:标签型化学式计算题:1、在现代生活中,人们越来越注重微量元素的摄取。
碘元素对人体健康有至关重要的作用。
下表是某地市场销售的一种“加碘食盐”包装袋上的部分说明。
请回答下列问题:(1)由食用方法和贮藏指南可推测碘酸钾(KIO3)的化学性质之一是;(2)计算碘酸钾(KIO3)中,钾元素、碘元素、氧元素的质量比;(3)计算碘酸钾(KIO3)中,碘元素的质量分数是多少?(计算结果精确到0.01,下同)(4)计算1kg这样的食盐中,应加入______g碘酸钾(用最高含碘量计算)第二种类型:叙述型化学式计算题:1、蛋白质是由多种氨基酸[丙氨酸:CH3CH(NH2)COOH等]构成的极为复杂的化合物,人体通过食物获得蛋白质,在胃肠道里与水发生反应,生成氨基酸,试计算:(1)丙氨酸分子中氮原子与氧原子的个数比_________。
(2)丙氨酸的相对分子质量_________。
(3)丙氨酸中碳、氢、氧、氮元素的质量比_________。
2、抗震救灾,众志成城。
用于汶川震后防疫的众多消毒剂中,有一种高效消毒剂的主要成分为三氯异氰尿酸(C3O3N3Cl3),又称高氯精。
下列有关高氯精的说法不正确的是()A.高氯精由4种元素组成B.高氰精中C、O、N、Cl的原子个数比为1∶1∶1∶1 C.高氯精中C、N两种元索的质量比为12∶14 D.高氯精中氯元素的质量分数为25%第三种类型:综合型化学式计算题:1、青少年正处于生长发育时期,每天需要摄取足量的蛋白质,蛋白质的代谢产物主要是尿素[CO(NH2)2]。
若从食物中摄取的蛋白质经体内新陈代谢后完全转化为尿素排出体外,每人每天相当于排出尿素30g。
(1)30g尿素中含氮元素多少克?(2)已知蛋白质中氮元素的平均质量分数为16%,则每人每天至少应从食物里摄取的蛋白质为多少克?(3)请你根据下表中几种常见食物的蛋白质含量,计算出每天至少应摄人多少克下列食物才能满足你对决了施肥比例不合理问题,提高了产量,减少了环境污染。
【化学】九年级化学化学计算题题20套(带答案)

20套(带答案)【化学】九年级化学化学计算题题一、中考化学计算题1.某纯碱样品中含有少许氯化钠。
现称量该样品放入烧杯中,再向此中加入必定溶质质量分数的稀盐酸至100g时恰巧完整反响。
此时烧杯内的物质质量为111g。
试计算:1)碳酸钠中钠元素、碳元素、氧元素的质量比为__________;(化为最简比)2)反响后生成的气体质量为_________g;(3)恰巧完整反响时所得溶液中溶质的质量分数________。
(计算结果精准到0.1%)【答案】23:6:24。
;14.9%【分析】【剖析】【详解】(1)碳酸钠化学式为Na2CO3,此中钠元素、碳元素、氧元素的质量比=23×2:12×1:16×3=23:6:24;2)碳酸钠和盐酸反响生成氯化钠、水和二氧化碳,依据质量守恒定律,生成二氧化碳气体的质量=+100g-111g=g;3)假定样品中碳酸钠质量为x,生成的氯化钠质量为y,则有:==解得,故样品中氯化钠质量,反响后溶液中溶质为氯化钠,故恰巧完整反响时所得溶液中溶质的质量分数,其总质量=×100%≈14.9%。
2.将必定质量的NaCl和Na2SO4固体混淆物完整溶于水后,加入必定质量分数的BaCl2溶液208g,恰巧完整反响,过滤,获得积淀,经测定滤液中含氯元素的质量为(不考虑过滤过程中物质质量的损失)。
计算:(1)所加BaCl溶液的溶质质量分数_______。
2(2)原固体混淆物中NaSO的质量________。
24(3)原固体混淆物中NaCl的质量__________。
【答案】10%【分析】【剖析】由题可知生成硫酸钡的质量是23.3g,依据化学方程式列比率求出Na242SO的质量,BaCl的质量,由化学式求出BaCl2中氯元素的质量,可得出原固体混淆物中NaCl中氯元素的质量,进而求得NaCl的质量;【详解】设BaCl2的质量是xg,Na2SO4的质量是yg,Na2SO4+BaCl2=2NaCl+BaSO4↓142208233yx,BaCl溶液的溶质质量分数==10﹪2BaCl中氯元素的质量=2原固体混淆物中NaCl中氯元素的质量=21.原固体混淆物中NaCl的质量3.某同学向必定质量的石灰石中加入7.3%的稀盐酸来制取二氧化碳,测得反响过程中溶液的pH与加入的稀盐酸的关系如图1所示。
九年级化学计算题大全

设1600t Fe2O3可炼出铁的质量为x,则
Fe2O3+3CO 2Fe+3CO2
160 112
1600t x
解:设:可以得到氧气的质量为x
2KMnO4 K2MnO4 + MnO2 + O2↑
△
316
32
答:可以得到0.32g氧气。
【解题步骤】
(1)设未知数
(2)写出反应的化学方程式
(3)计算相关物质的质量比
(4)标出已知量、未知量
(5)列比例式
(6)解比例式
(7)简明地写出答案
4.9g氯酸钾完全分解可生成多少克氧气?
27g水电解产生多少克氢气和氧气?
练习:
2、已知生成物的质量求反应物的质量
工业上,高温煅烧石灰石(CaCO3)可制得生石灰
(CaO)和二氧化碳。如果要制取10t氧化钙,需要碳
酸钙多少吨?
解:设制取10吨氧化钙需要碳酸钙的质量为X
CaCO3
高温
CaO + CO2↑
35.5×2
=
100 g
2×36.5
2
X
随 堂 评 价
在“绿色氧化剂”双氧水(H2O2)的溶液中加入二氧化锰后,常温下即可产生大量氧气,若制取48g氧气需消耗纯净的双氧水多少克?
答:略。
X=
2×34×48g
32
= 102g
解:设:需要碳酸钙的质量为x
CaCO3
CaO + CO2↑
100
56
x
10t
56
10t
=
100
x
=
100×10t
=17.9t
2023-2024学年九年级上册化学期末专题复习:计算题

(2)苹果酸的相对分子质量为。
(3)苹果酸中碳、氧两种元素的质量比是。(填最简整数比)
(4)402g苹果酸中所含氢元素的质量与多少g醋酸( )中所含氢元素的质量相等?(写出计算过程)
7.为了测定大理石中CaCO3的含量,取大理石样品12.5g,加入盛有100g稀盐酸的烧杯中,两者恰好完全反应(假设其他杂质不与盐酸反应,也不溶解),烧杯内物质的质量变为108.1g。试计算:
(1)产生二氧化碳气体的质量是g。
(2)大理石样品中CaCO3的质量分数?
8.某同学量取一定质量的过氧化氢溶液放入烧杯中,再加入2g二氧化锰,此时烧杯中物质的总质量为36g。待恰好不再产生气体时,再次称量,烧杯内物质的总质量为34.4g。
(1)则上述反应生成氧气的质量为g。
(2)此反应中生成水的质量是g。(写出计算过程)
x=80%
答:大理石样品中碳酸钙的质量分数为80%
8.(1)由质量守恒定律可知,反应后生成氧气的质量为: ;
(2)设反应生成的水的质量是
答:反应生成的水的质量是1.8g。
9.(1)N2
(2)设该运载火箭燃烧掉的偏二甲肼(C2H8N2)的质量是x。
x=150kg
答:该运载火箭燃烧掉的偏二甲肼(C2H8N2)的质量是150千克。
17.(1) 318 7:32
(2)解:设质量为 的酚酞中含有氧元素的质量为32mg
答: 酚酞中含有氧元素的质量为32mg。
18.(1)17.6
(2)设石灰石中碳酸钙的质量为x,则
解得x=40g
碳酸钙的质量分数为: 。
答:该石灰石中碳酸钙的质量分数为80%。
3.在实验室中,将含有13.6g过氧化氢的溶液与少量二氧化锰混合,过氧化氢完全分解。
初三化学化学计算题题20套(带答案)含解析

初三化学化学计算题题20套(带答案)含解析一、中考化学计算题1.我市东部山区盛产石灰石,某校课外活动小组为了解石灰石资源的品质,采用两种方案对当地石材进行化学分析:方案一: 取10g 石灰石粉末样品置于下图所示装置,充分加热至质量恒定,冷却后称得固体质量为8.12g方案二:另取10g 同质地石灰石颗粒样品,置于烧杯中加足量稀盐酸,充分反应后称得混合物的总质量减少了4.27g相关资料:当地石灰石含有的主要杂技为二氧化硅,其化学性质稳定,加热不易分解且不与盐酸发生化学反应.计算出两种方案测得的石灰石中碳酸钙的质量分数:(1)方案一中碳酸钙的质量分数是_______________________;(2)方案二中碳酸钙的质量分数是_______________________.(精确到0.1%)比较两方案测量的结果,分析两方案误差较大的可能原因?______【答案】42.7% 97% 石灰石分解需要高温,两方案误差较大的原因可能是酒精灯火焰温度偏低,石灰石粉末未能充分分解,引起误差较大.【解析】【分析】【详解】(1)生成二氧化碳的质量为10g-8.12g=1.88g设生成1.88g 二氧化碳需碳酸钙的质量为x32CaCO CaO +10044x 1.88CO g高温 10044=x 1.88gx=4.27g石灰石样品中碳酸钙的质量分数为4.27g100%=42.7% 10g⨯(2)混合物的总质量减少了4.27g说明生成了4.27g二氧化碳设样品中的碳酸钙的质量为y3222CaCO+2HCl=CaCl+H O+CO10044y 4.27g↑10044=y 4.27gy=9.7g石灰石样品中碳酸钙的质量分数为9.7g100%=97% 10g⨯石灰石分解需要高温,两方案误差较大的原因可能是酒精灯火焰温度偏低,石灰石粉末未能充分分解,引起误差较大。
2.我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献,工业上用侯氏制碱法制得的纯碱中含有一定量的氯化钠杂质。
九年级化学计算题

九年级化学计算题
题目:现有一定质量的锌粉加入到盛有200g稀硫酸的烧杯中,恰好完全反应,反应后烧杯内物质总质量为209.8g。
求:(1)生成氢气的质量;(2)稀硫酸中溶质的质量分数。
解析:
1. 计算氢气质量
- 根据质量守恒定律,反应前物质的总质量等于反应后物质的总质量。
反应前锌粉和稀硫酸的总质量,反应后是烧杯内剩余物质和氢气的总质量。
- 设生成氢气的质量为公式。
- 反应前锌粉和公式稀硫酸的总质量,反应后烧杯内物质总质量为公式,则公式,因为锌与稀硫酸反应公式
,所以公式。
- 生成氢气的质量公式,由于锌粉的质量在计算氢气质量时不需要单独求出,根据质量守恒定律,公式
,所以公式。
2. 计算稀硫酸中溶质的质量分数
- 设稀硫酸中溶质公式的质量为公式。
- 根据化学方程式公式,可得公式
(公式的相对分子质量为公式,公式的相对分子质量为公式)。
- 解得公式。
- 稀硫酸中溶质的质量分数公式。
人教版九年级化学上册期末考试计算题专项练习-附带答案

人教版九年级化学上册期末考试计算题专项练习-附带答案可能用到的相对原子质量:C:12 H:1 O:16 N:14 Ca:40 S:32 Mg:24 Mn:55一、计算题。
1.空气中氧气的体积分数约为21%,氮气的体积分数约为78%.小江老师让同学往集气瓶装入半瓶水,再用排水法收集集气瓶的氧气,发现瓶中的氧气也能使带火星的木条复燃。
请计算:(1)本实验中瓶内氧气约占瓶总体积的百分比是(结果保留整数)(2)另一同学需要 2.5g氮气(氮气密度为 1.25g/L),理论上她大致需要空气多少升?(结果保留一位小数)。
2.现有200升空气,问其中含有氧气多少升,氮气多少升?氧气与氮气的质量比为多少?(写成分数)(已知氧气的密度为1.429克/升,氮气的密度为1.250克/升)3.学生体育测试后,常会感到肌肉酸痛,这是因为运动后产生了乳酸的原因。
乳酸的化学式为C x H6O3,已知乳酸的相对分子质量为90。
请计算:(1)C x H6O3中x=。
(2)乳酸中碳、氢、氧三种元素的质量比为(填最简整数比)。
(3)乳酸中氧元素的质量分数为(结果精确到0.1%)(4)180g乳酸中含碳元素多少g?(写出计算过程)4.高温煅烧贝壳(主要成分是碳酸钙)可以生成氧化钙和二氧化碳。
现煅烧含有200kg碳酸钙的贝壳,最多可得到氧化钙多少千克?5.在通常情况下,氧气的密度是1.429克/升,空气的密度是1.293克/升。
①空气的成分按体积计算,氮气占,氧气占。
②则按质量分数计算,氧气占多少?③一个成年人每天需要氧气大约是8.4升,则相当于需要空气多少升呢?6.用如图所示的装置测定空气中氧气含量,集气瓶的容积为350mL,装置气密性良好,实验前止水夹关闭。
实验前预先在集气瓶中放入30mL水,烧杯中盛有足量水,用凸透镜引燃燃烧匙中的红磷,冷却后打开止水夹,测得烧杯中的水少了64mL。
(1)请出红磷燃烧的符号表达式;(2)计算空气中氧气的体积分数。
初中化学反应计算题

初中化学反应计算题计算题型一:文字叙述型1.黄铜是铜和锌的合金,在20g黄铜样品中加入足量稀盐酸使其完全反应,生成氢气0.2g,求样品中铜的质量分数?2.把7g含杂质的锌片(杂质不与硫酸反应)放在盛有100g足量的稀硫酸的烧杯里,反应停止后称得烧杯里物质的总质量为106.8g。
(1)计算反应后生成的氢气的质量;(2)计算不纯的锌片中单质锌的质量分数。
3、用氯酸钾和二氧化锰的混合物16g,加热制取氧气,待完全反应,冷却后称量,得到11.2g固体物质,计算原混合物中二氧化锰的质量?4、取34克过氧化氢溶液再加入0.5克二氧化锰后至质量不减小时,所得剩余物的质量33.7克。
求:(1)根据质量守恒定律,反应生成氧气的质量为。
(2)计算该过氧化氢溶液中溶质的质量分数。
5.某化学活动小组需要用溶质质量分数为19.6%的稀硫酸和锌粒反应来制取氢气,但实验室现有的是溶质质量分数为98%的浓硫酸。
试计算:(1)硫酸中氢、硫、氧元素的质量比为:_______________(2)将10g浓硫酸配制成所需的稀硫酸,需要水的质量为多少?(3)取上述配制好的稀硫酸20g与足量锌粒充分反应,能制得氢气质量为多少?计算题型二:图像呈上升趋势型1.在一烧杯中盛有22.3 g Na2CO3和NaCl组成的固体混合物,加足量水溶解,配成溶液。
向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示。
请根据题意回答问题:(1)当滴加了73 g稀盐酸时,放出气体的总质量为___________g。
(2)当滴加稀盐酸至图中B点时,烧杯中溶液里的溶质是___________。
(3)当滴加了73 g稀盐酸时(即A点时),烧杯中为不饱和溶液,试通过计算求出其中含溶质的质量。
2.现取13.4g含氯化钙的氯化钠固体样品,全部溶于96.6g水中,向所得的混合溶液中滴加溶质质量分数为10.6%的碳酸钠溶液,记录了如图所示的曲线关系。
九年级化学化学计算题题20套(带答案)含解析
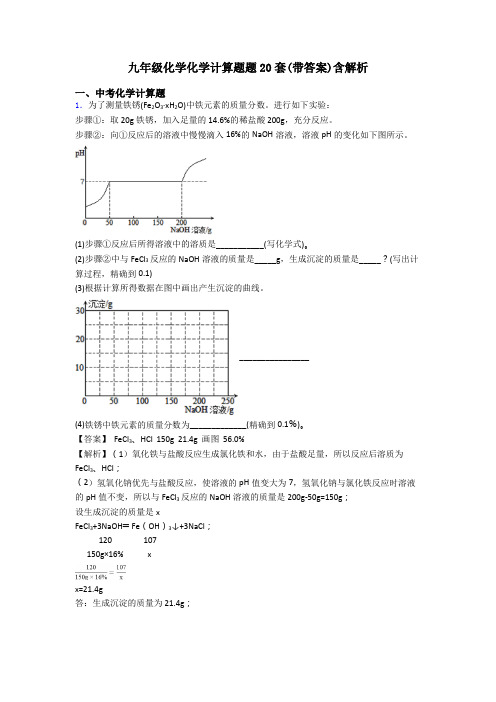
九年级化学化学计算题题20套(带答案)含解析一、中考化学计算题1.为了测量铁锈(Fe2O3·xH2O)中铁元素的质量分数。
进行如下实验:步骤①:取20g铁锈,加入足量的14.6%的稀盐酸200g,充分反应。
步骤②:向①反应后的溶液中慢慢滴入16%的NaOH溶液,溶液pH的变化如下图所示。
(1)步骤①反应后所得溶液中的溶质是___________(写化学式)。
(2)步骤②中与FeCl3反应的NaOH溶液的质量是_____g,生成沉淀的质量是_____?(写出计算过程,精确到0.1)(3)根据计算所得数据在图中画出产生沉淀的曲线。
________________(4)铁锈中铁元素的质量分数为_____________(精确到0.1%)。
【答案】 FeCl3、HCl 150g 21.4g 画图 56.0%【解析】(1)氧化铁与盐酸反应生成氯化铁和水,由于盐酸足量,所以反应后溶质为FeCl3、HCl;(2)氢氧化钠优先与盐酸反应,使溶液的pH值变大为7,氢氧化钠与氯化铁反应时溶液的pH值不变,所以与FeCl3反应的NaOH溶液的质量是200g-50g=150g;设生成沉淀的质量是xFeCl3+3NaOH═Fe(OH)3↓+3NaCl;120 107150g×16% xx=21.4g答:生成沉淀的质量为21.4g;(3)所以产生沉淀的曲线为;(4)所以铁锈中铁的质量分数为 =56%。
2.某化学兴趣小组对某铜锌合金样品进行探究实验,称取样品10.0 g,再用100.0 g稀硫酸溶液逐滴滴入,实验情况如图所示。
求:(1)铜锌合金中,Zn的质量分数是________。
(2)所用稀硫酸溶液中溶质的质量分数是__________?【答案】65% 19.6%【解析】试题分析:(1)铜锌合金与稀硫酸反应,其中只有锌与硫酸反应,故固体减少的量即为锌的质量=10g-3.5g=6.5g,则Zn%=6.5g/10g×100%=65%(2)解:设所用稀硫酸中溶质的质量分数为xZn+H2SO4=ZnSO4+H2↑65 986.5g 50gx65/98=6.5g/50gxx=19.6%答:锌的质量是65%;所用稀硫酸中溶质的质量分数为19.6%考点:合金、化学方程式计算3.某炼铝工厂想测定铝土矿中A12O3的含量,将矿石粉碎(其中杂质不溶于水,不与酸反应,且不含铝元素),进行如下实验,第一步反应的物质质量关系如坐标图所示:(1)上述实验过程中发生反应的化学方程式是_____;(2)根据已知条件列出求解第一步实验铝土矿中参加反应的A12O 3质量(x)的比例式_____ (3)铝土矿样品中A12O 3的含量_____;(4)坐标图中B 点所示溶液中溶质的化学式是_____;(5)在第二步实验结束后所得溶液中溶质的质量分数是_____(6)用1700t 此铝土矿冶炼得到540t 的铝,则在冶炼中,铝土矿的利用率是_____。
题型04化学计算题(教师版) 备战2024-2025学年九年级化学上学期期中真题分类汇编(安徽专用)

题型04 化学计算题1.(2023-2024九上·安庆市·期中)完成下列问题(1)小王同学现要收集含氧气的体积分数约为60.5%的气体100mL ,操作如下:下图在集气瓶里装满水,塞紧胶塞并打开弹簧夹通入氧气,当量筒内的水达到自己设定的体积V 后再通入通常情况下的空气,使量筒中水的体积达到100mL 时,立即关闭弹簧夹。
推算小王同学设定的体积V 约是___________mL 。
(2)已知相对原子质量:铜64,铁56、镁24,则等质量铜、铁,镁中所含原子个数比___________。
【答案】(1)50; (2)21:24:56【解析】(1)集气瓶中空气的体积是(100-V )mL ,氧气的体积为VmL ,则通入的空气中氧气体积为21%(100-V )mL ,通入的空气中的氧气和直接通入的氧气总体积应为100mL ×60.5%=60.5 mL ,所以21%(100-V )mL +VmL=60.5mL ,解得V=50。
(2)设铜、铁,镁的质量均为10g ,根据相对原子质量的计算公式可知,1个原子的质量=相对原子质量×1个碳12原子的质量×112,因此10g 铜、铁、镁中原子个数比为C 10g 16412´´m ∶C 10g 15612´´m :C 10g12412´´m =21∶24∶56。
2.(2023-2024九上·安庆外国语学校·期中)在探究铁丝在氧气中燃烧的实验时,小科进行了如下的实验:图1的集气瓶中装有80%的水,用排水法收集氧气后,集气瓶中仍留有15%的水,如图2所示。
(1)铁丝在氧气中燃烧的实验时,集气瓶中仍留有少量水的原因是_____。
(2)铁丝在氧气中燃烧的文字表达式是_____,该反应的基本反应类型_____。
(3)图2集气瓶气体中氧气的体积分数是_____(保留一位小数)。
(完整)九年级化学计算题专题复习.docx

计算题专题一.有关化学式的计算(书本 87 页 )。
类型 1、计算相对分子质量。
2、化学式中各元素的质量比。
3、计算物质中某元素的质量分数。
4、计算物质中某元素的质量。
5、化学式中原子总数,原子个数比。
例题:地沟油中含有一种强烈致癌物黄曲霉素 B 2( C17H 14O 6),长期食用会引起消化道癌变,请回答:(1) 黄曲霉素 B2的相对分子质量为;⑵黄曲霉素 B2中各元素质量比为;(3) 黄曲霉素 B2中碳、氢、氧三种元素的原子个数比为;(4) 黄曲霉素 B2中氧元素的质量分数为;⑸ 15.7g 黄曲霉素 B 2中含有g 氧元素。
二、利用化学方程式的简单计算。
常见题型1.题目中直接给出一种反应物(或生成物)的质量,求另一种生成物(或反应物)的质量。
某实验室中需要 1.6g 氧气进行实验。
若用电解水的方法制取这些氧气,需要消耗水多少克?同时可生成氢气多少克?2.已知反应物(或生成物)的质量(或密度、体积),如何求另一反应物(或生成物)的质量(或体积)。
中国登山协会为纪念我们首次攀登珠穆朗玛峰成功50 周年,再次组织攀登珠峰活动。
阿旺扎西等一行登山运动员于2003 年 5 月 21 日 13:40 成功登顶。
假如每位运动员冲顶时消耗自带液氧的质量等于标况下 3.36L 氧气(标准状况下氧气密度为 1.43g/L )若在实验室用高锰酸钾为原料制取相同质量的氧气,需要多少千克的高锰酸钾?3、描述性计算题。
钙是人体中含量较高的常量元素之一,缺钙可能导致幼儿及青少年发育不良,严重时还会患佝偻病.李明的父亲为他买回一瓶补钙保健品,他仔细阅读了标签上的说明(如图),为了验证该保健品中碳酸钙的含量,取出 5片药品,加入足量的稀盐酸,充分反应后收集到 3.3g 二氧化碳(假定除碳酸钙外其他成分不与盐酸反应)( 1)已知碳酸钙的相对分子质量是100,则钙元素的相对原子质量为。
2 克× 200( 2)通过计算验证:该保健品主要原料含量是否属实(写出计算过程)?( 3)李明按照说明服用一个月(30 天),理论上吸收了钙元素。
初三化学考试 计算题25道(附答案)

25基础计算1.在一个实验室中发现一橡胶球可以漂浮在0.5mol/L的NaCl溶液表面,求该NaCl溶液的密度。
答案:1.018g/mL。
解析:根据阿威休斯定律得到:Fb=FgρVg=m*gρ=m/V=(Vg*g)/V=(Fg/Ag*g)/V=(4πr^3/3*g)/[(4/3)*π*r^3]=3/4*r*g=7.35*10^-5*g其中,Ag为橡胶球跟水接触的面积,r为橡胶球半径,g为重力加速度。
因此,NaCl溶液的密度为:ρNaCl=ρwater+ρball=1.000g/mL+7.35*10^-5*g/mL=1.018g/mL。
2.一种饱和食盐水的密度为1.20g/mL,问在哪个温度下它的浓度为26%。
答案:56.8°C。
解析:首先,要知道饱和食盐水在不同温度下的密度变化情况,参考表格得出如下数据:温度(°C)密度(g/mL)01.091101.078201.064301.049401.033501.015600.996700.975800.951900.9241000.895然后,根据浓度的定义可知:浓度=质量/总质量总质量=质量/浓度因为食盐水是饱和的,所以其浓度为100%。
设实验时食盐水的质量为m,则总质量为m/1.20,其中1.20为食盐水的密度。
根据题意,浓度为26%,所以食盐的质量为0.26*(m/1.20)。
由此0.26*(m/1.20)=m/(1.20+Δρ)其中Δρ为实验时食盐水的密度与需要求的密度的差值。
将参考表格中的数据代入上式计算,得到Δρ为0.325g/mL。
解方程得出:Δρ=0.325=0.26*m/(1.20+Δρ)m=68.45g因此,实验时食盐水的质量为68.45g。
而在哪个温度下其密度为1.20*0.26=0.312g/mL呢?查表可得,在56.8°C时,食盐水的密度约为0.312g/mL,因此答案为56.8°C。
九年级化学计算题专项训练

一、计算题专题(1)气体叙述型:1.(2011.徐州市)(7分)医学上常用双氧水来清洗创口和局部抗菌。
小美同学为了测定一瓶医用双氧水溶液的溶质质量分数,取该双氧水69g放入烧杯中,然后加入2g二氧化锰,完全反应后,称得烧杯内剩余物质的总质量为69.04g。
请回答下列问题;(1)二氧化锰在反应中的作用是,生成的氧气为 g。
(2)该双氧水溶液的溶质质量分数。
(写出计算过程)2.(2011.河南省)称取12.5g石灰石(主要成分是CaCO3,杂质不参加反应)放人烧杯中,向其中加入50g 稀盐酸,二者恰好完全反应。
反应结束后称量烧杯中剩余物质的总质量为58.1g(不包括烧杯的质量,且气体的溶解忽略不计)。
试计算石灰石中杂质的质量分数。
3.(2011.达州市)(7分)26g黄铜(Cu-Zn合金)与100g稀硫酸在烧杯中恰好完全反应,反应后测得烧杯中剩余物的总质量为125.8克。
求:⑴黄铜中铜的质量分数;⑵反应后所得溶液中溶质质量分数。
(计算结果精确到0.1%)4.(2011.鄂州市)(5分)为测定某石灰石样品中碳酸钙的含量,取10.0克于烧杯中再向其中加入稀盐酸50.0克,恰好完全反应(杂质不反应),反应后烧杯中物质总质量为56.7克。
(1)生成CO2的质量。
(2)求石灰石样品中碳酸钙的质量分数(写出计算过程)。
5.(2011.鸡西市)为测定某黄铜样品中锌的含量,某同学称取20g黄铜(铜和锌的合金)样品于烧杯中,向其中加入稀硫酸至不再产生气泡为止,共消耗100g质量分数为9.8%的稀硫酸,请计算:(1)该黄铜样品中锌的质量。
(2)反应后所得溶液的溶质质量分数(计算结果保留0.1%)。
6.(2011.沈阳市)(6分)黄铜是铜和锌的合金,可以用来制造机器、电器零件及日常用品。
为了测定某黄铜样品中铜的质量分数,取20g该样品向其中加入一定量的10%的稀硫酸,恰好完全反应,产生氢气0.2g。
请解答一下问题:(1)黄铜属于材料;(2)该黄铜样品中铜的质量分数;(3)完全反应后所得溶液的质量分数。
人教版九年级化学计算专题练习(含答案)

人教版九年级化学计算专题练习(含答案)1.已知氧原子质量为2.657×10^-26 kg,碳-12的质量为1.993×10^-26 kg,求氧原子的相对原子质量。
改写:已知氧原子质量和碳-12质量,求氧原子的相对原子质量。
2.已知某氧原子的相对原子质量为16,某硫原子的相对原子质量为32.若硫原子的质量为m,则氧原子的质量为多少?改写:已知氧原子的相对原子质量和硫原子的相对原子质量,求氧原子的质量。
3.已知作为相对原子质量基准的1个碳原子的质量为1.66×10^-27 kg,一个铝原子的质量为4.482×10^-26 kg,镁的相对原子质量为24.1) 铝的相对原子质量。
2) 一个镁原子的质量。
改写:已知碳原子的质量和铝原子的质量,以及镁的相对原子质量,求铝的相对原子质量和镁原子的质量。
4.某物质MO3中,含氧元素为60%,则MO3中的相对分子质量为多少?M的相对原子质量是多少?改写:已知MO3中含氧元素的百分比,求MO3的相对分子质量和M的相对原子质量。
5.已知A原子的原子质量是3.986×10^-26 kg,A原子的质子数与中子数相等。
碳-12原子的质量为1.993×10^-26 kg。
1) A原子的相对原子质量是多少?2) A原子的中子数是多少?3) A原子的电子数是多少?改写:已知A原子的原子质量和碳-12原子的质量,求A 原子的相对原子质量、中子数和电子数。
6.俄罗斯科学家最近合成了核电荷数为139元素的原子,经测定该原子质量为4.×10^-25 kg(已知碳原子质量为1.993×10^-26 kg)。
1) 则该原子的相对原子质量是多少?2) 该原子中子数为多少?3) 中子数与电子数之差是多少?改写:已知该原子的质量和碳原子的质量,求该原子的相对原子质量、中子数和中子数与电子数之差。
7.计算下列化学式的相对分子质量(或相对分子质量总和)。
九年级化学化学计算题常见题型及答题技巧及练习题(含答案)含解析

九年级化学化学计算题常见题型及答题技巧及练习题(含答案)含解析一、中考化学计算题1.某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸。
请你计算:(1)若要清洗1000kg的这种石油产品,需要_____kg的NaOH。
(2)该石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸。
每处理1000kg这种产品,他们可以节约多少经费_____?请你写出具体的计算过程。
工业级的NaOH和Ca(OH)2的最新市场批发价如下表:试剂Ca(OH)2NaOH价格(元/kg) 1.00 6.00(3)请你在图中画出氢氧化钠和氢氧化钙处理1000kg该石油产品时,残余硫酸溶质的质量变化曲线;氢氧化钠用虚线表示,氢氧化钙用实线表示。
_____(请你注明具体的坐标)【答案】40 203元【解析】【详解】1000kg的这种石油产品所含硫酸的质量为1000kg×4.9%=49kg设消耗的氢氧化钠的质量为x,消耗的氢氧化钙的质量为y根据2NaOH+H2SO4=Na2SO4+2H2O和Ca(OH)2+H2SO4=CaSO4+2H2O可得关系式为242 2NaOH H SO Ca(OH)809874x49kg y::809874==x49kg yx=40kgy=37kg每处理1000kg这种产品,他们可以节约经费为6.00元/kg×40kg-1.00元/kg×37kg=203元图中画出用氢氧化钠和氢氧化钙处理1000kg该石油产品时,残余硫酸溶质的质量变化曲线;氢氧化钠用虚线“…”表示,氢氧化钙用实线“一”表示,答:(1)若要清洗1000kg的这种石油产品,需要 40kg的NaOH。
(2)该石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸。
每处理1000kg这种产品,他们可以节约203元经费。
(3)残余硫酸溶质的质量变化曲线;氢氧化钠用虚线“…”表示,氢氧化钙用实线“一”表示,2.实验室现有氯化镁和硫酸钠的固体混合物样品,小明同学想测定样品中氯化镁的质量分数。
(化学)九年级化学化学计算题常见题型及答题技巧及练习题(含答案)

(化学)九年级化学化学计算题常见题型及答题技巧及练习题(含答案)一、中考化学计算题1.氧化亚铜(Cu 2O )可用于生产船底防污漆,防止海生物对船舶设备的污损。
现将Cu 2O 和Cu 的固体混合物20g 放入烧杯中,加入质量分数为24.5%的稀硫酸50g ,恰好完全反应。
已知:Cu 2O+H 2SO 4═CuSO 4+Cu+H 2O .计算:(1)所加稀硫酸中溶质的质量为_____g 。
(2)原混合物中Cu 2O 与Cu 的质量比_____(写出计算过程,结果用最简整数比表示) (3)在图中画出向20g Cu 2O 和Cu 的固体混合物中逐滴加入24.5%的稀硫酸至过量,铜的质量变化曲线_____。
【答案】12.25 9: 1 。
【解析】【分析】根据加入的硫酸中溶质的质量和对应的化学方程式求算氧化亚铜的质量,进而求算对应的比值以及画图。
【详解】(1)所加稀硫酸中溶质的质量为24.5%×50g =12.25g ;故填:12.25(2)设原混合物中Cu 2O 的质量为x ,生成的铜的质量为y 。
224421449864x 12.Cu O+H SO CuSO +C 2u +H 5O g y═ 1449864==x 12.25g y解得:x =18 g ;y =8g ; 原混合物中Cu 2O 与Cu 的质量比为18 g :(20 g ﹣18 g )=9:1;故填:9:1(3)没加入硫酸时,铜的质量为2g ,加入到50g 稀硫酸时铜的质量为2g+8g =10g 。
如下图所示;故填:【点睛】根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
2.取24g氢氧化钠和碳酸钠的固体混合物,加136g水完全溶解后,再缓慢加入石灰乳(氢氧化钙和水的混合物)至恰好完全反应,过滤得到4g沉淀和10%的氢氧化钠溶液.试计算反应中应加入石灰乳的质量是______________?【答案】73.6g【解析】【详解】设:24g样品中碳酸钠的质量为x,生成的氢氧化钠的质量为yCa(OH)2 + Na2CO3=CaCO3 + 2NaOH106 100 80x 4g yx= 4.24 g y = 3.2 g .得到的10%NaOH溶液的质量为(24 g – 4.24 g + 3.2 g) ÷10% = 229.6 g加入石灰乳的质量为 229.6 g + 4 g - 136 g -24 g = 73.6 g答:应加入石灰乳的质量是73.6 g。
初中化学九年级下计算题 汇总

初中化学九年级下计算题汇总一.计算题(共50小题)1.用铁矿石冶炼铁是一个复杂的过程。
现有含氧化铁60%的赤铁矿100t,理论上可得到含杂质4%的生铁的质量是多少?2.某炼铁厂用含Fe2O380%的赤铁矿石冶炼生铁,现有该赤铁矿石400t,计算理论上可炼出纯铁多少吨?3.我市铁矿资源十分丰富,有“铁迁安”之美誉。
长城钢铁公司采用一氧化碳在高温下与四氧化三铁反应生成铁和二氧化碳,若每天生产生铁(含铁95%)800t,则该公司每天需要含Fe3O4 90%的磁铁矿石的质量是多少?4.现有含Fe2O3 78%的赤铁矿2500t,可炼出含杂质4%的生铁的质量的表达式为:。
5.改革开放40年来,我国钢铁工业飞速发展,近年来钢铁产量已经稳居世界首位。
某钢铁厂采用赤铁矿(主要成分是Fe2O3)炼铁,请回答下列问题:(1)炼铁过程中,碳的作用是。
(2)若该厂每天需消耗5000t含三氧化二铁80%的赤铁矿石,理论上可日产纯铁的质量是多少?(要求根据化学方程式计算并写出过程)6.现有1000t含Fe2O380%的赤铁矿石(杂质中不含铁元素),试计算:(1)该赤铁矿石含Fe2O3的质量是t;(2)该赤铁矿石含铁元素的质量是t;(3)理论上能得到含杂质8%的生铁的质量是t(计算结果精确到0.1t)。
7.为了测定某赤铁矿石中氧化铁的质量分数,取矿石样品40g,加入足量稀盐酸,充分反应,过滤、洗涤、干燥后得到滤渣8 g(矿石中的杂质既不溶于水也不与盐酸反应)。
计算:(1)该赤铁矿石中氧化铁的质量分数。
(2)现有这种赤铁矿石1000 t,用一氧化碳完全还原,理论上可炼出含铁96%的生铁多少吨?8.某钢铁公司用2000t含氧化铁80%的赤铁矿石炼铁,最多可炼出含杂质2.5%的生铁多少吨?(请写出计算过程)9.装修材料阀门主要成分是黄铜,黄铜是一种合金材料。
合金是由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
九年级化学科辅导讲义(第讲)学生姓名:授课教师:授课时间:专题初中化学计算题题型汇总目标掌握各种类型的化学计算题的解题思路与方法重难点各种类型的化学计算题的解题思路与方法知识点一介绍:有关化学式的计算用元素符合来表示物质组成的式子叫做化学式。
本知识块的计算关键是抓住这一概念,理解概念的含义,并要深刻理解化学式中各符号及数字的意义,处理好部分与整体之间的算术关系。
1.计算相对分子质量:相对分子质量是指化学式中各原子的相对原子质量的总和。
【例】计算5CuSO4·5H2O的相对分子质量总和。
5CuSO4·5H2O=5×[64+32+16×4+5×(1×2+16)]=5×[160+5×18]=12502.计算化合物中各元素的质量比:计算的依据是所含元素的质量比,等于微观上每个分子(即化学式)中各种原子的个数与其原子量的乘积之比。
【例】计算氧化铁中铁元素和氧元素的质量比。
氧化物的化学式:Fe2O3,则Fe∶O=56×2∶16×3=112∶48=7∶33.计算化合物中某元素的质量分数:宏观上化合物中某元素的质量分数等于微观上化合物的每个分子中,该元素的原子的相对原子质量总和与化合物的相对分子质量之比,【例】计算硝酸铵(NH4NO3)中,含氮元素的质量分数。
w(N)= ×100%=35%练习将一定量某种铁的氧化物用足量H2还原后,得到33.6g铁,生成14.4g水,如果氧化物中铁与氧的原子个数比为最简比,试求该铁的氧化物的化学式.知识点二介绍:有关化学方程式的计算1.有关反应物和生成物的计算:这是化学方程式计算中最基础的题型,要深刻理解化学方程式的含义,理解反应物质和生成物质在微观上和质量上的关系。
【例如】将一氧化碳在空气中点燃后生成二氧化碳的化学反应中,它们的关系:2CO+O2=2CO2微粒比:2∶1∶2质量比:2×28∶32∶88(7∶4∶11)2.不纯物的计算:纯净物的质量=不纯物的质量×纯净物的质量分数【例】用含Fe2O3 75%的赤铁矿石20吨,可炼出含杂质4%的生铁多少吨?解:20吨赤铁矿石中含纯Fe2O3的质量为:20吨×75%=15吨设可炼出含杂质4%的生铁质量为xFe2O3+3CO=2Fe+3CO2160 11215吨(1-4%)xx==12.5吨3.选量(过量)计算:化学方程式计算的理论依据就是质量守恒定律。
在质量守恒定律中,“参加反应的各物质的质量总和,等于反应生成的各物质的质量总和”。
要着重理解“参加”两个字的含义,即没有“参加”反应的物质,就不应计算在内。
【例】今有氢气与氧气的混合气共20克,在密闭的容器中点燃,生成水18克,则下列分析正确的是() (A)氢气10克,氧气10克(B)氢气2克,氧气18克(C)氢气4克,氧气16克(D)氢气1克,氧气19克4.多步反应的计算:从一个化学反应中求出的质量,用此量再进行另一个化学反应或几个化学反应的连续计算,求最后一个化学反应的量,一般称之为多步反应的计算。
【例】计算用多少克的锌跟足量稀硫酸反应生成的氢气,能跟12.25克的氯酸钾完全分解后生成的氧气恰好完全反应生成水。
本题涉及三个化学反应:Zn+H2SO4(稀)=ZnSO4+H2↑ 2KClO3=2KCl+3O2↑ 2H2+O2=2H2O可以用三个化学方程式中的微粒关系,找出它们的已知量与未知量的关系式:2KClO3~3O2~6H2~6Zn即KClO3~3Zn关于化学方程式计算的解题要领可以归纳为:化学方程式要配平,需将纯量代方程;量的单位可直接用,上下单位应相同;遇到有两个已知量,应找不足来进行;遇到多步的反应时,关系式法有捷径。
知识点三介绍:有关溶液的计算:溶质质量+溶剂质量=溶液质量1.溶解度的计算固体物质溶解度的概念是:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
2.溶液中溶质质量分数的计算:溶液中溶质质量分数的计算式如下:溶质质量分数的计算题可以有:(1)已知溶质和溶剂的质量,求溶液的质量分数。
(2)已知溶液的质量和它的质量分数,求溶液里所含溶质和溶剂的质量。
(3)将一已知浓度的溶液加入一定量的水进行稀释,或加入固体溶质,求稀释后或加入固体后的溶液的质量分数。
【典型例题】例1一定质量的KClO3和MnO2的混合物中,MnO2的质量分数为20%,加热后,剩余的固体混合物中MnO2的质量分数升高至25%,则KClO3的分解率是多少?63.8%例2 将4gH2和O2的混和气体点燃,使其充分反应,得到1.8g水蒸气,则反应前混合物中O2不少于g,不超过g. O2不少于1.6g,不超过3.8g.例3质量相同的下列金属分别和足量盐酸反应,产生H2最多的是( )A.MgB.AlC.ZnD.Fe规律:在金属质量相同时产生H2质量与该金属的化合价与相对原子质量之比成正比例40.92g金属Cu与CuO的混合物被H2完全还原后,得到0.752g固体剩余物.求原混合物中含CuO的质量分数?91.3%【同步练习】1、学习了酸和碱的知识后,小松知道了白醋的主要成分是醋酸(CH3COOH)。
为了测定白醋中醋酸的质量分数,他把4%的NaOH溶液滴加到30 g白醋中,待反应恰好完全时(假定其他成分不参加反应),共用去NaOH 溶液25 g。
(1)已知反应的化学方程式为:CH3COOH+NaOH=CH3COONa+H20,该反应的类型是____________。
(2)请计算白醋中醋酸的质量分数。
(5%)3、(广东汕头)某同学为探究铁合金中铁的质量分数,先后进行了三次实验,实验数据如下表:实验次数第一次第二次第三次项目所取合金的质量/g 20 20 40所加稀硫酸的质量/g 100 120 80生成氢气的质量/g 0.4 0.4 0.4根据该同学的实验,试回答以下问题:(1)上表三次实验中,合金里的铁恰好完全反应时,消耗稀硫酸溶液的质量是______g。
(2)该铜铁合金中铁的质量分数是多少?(3)第三次实验所得溶液溶质质量分数为____________(结果保留至0.1%)。
((1)80g(2)56%(3)33.5%)4、(河北)某钢铁厂检验员为了检测赤铁矿石中氧化铁的质量分数,取矿石样品20g,加入稀盐酸,完全反应后,共用去稀盐酸219g,过滤得到滤渣4g(假设杂质既不溶于水也不跟酸发生反应)。
请你和检验员一起完成下列计算:(1)赤铁矿石中氧化铁的质量分数;(2)稀盐酸中溶质的质量分数。
赤铁矿石中氧化铁的质量分数为80%,稀盐酸中溶质的质量分数是10%5、(济南)在一烧杯中盛有100gBaCl2和HCl的混合溶液,向其中逐渐滴加溶质质量分数为10%的Na2CO3溶液,混合溶液的质量与所滴入Na 2CO 3溶液的质量关系曲线如图所示: 请根据题意回答问题:(1)在实验过程中,有气体放出,还可以看到的明显实验现象是 。
(2)在实验过程中放出气体的总质量为 g 。
(3)当滴入Na 2CO 3溶液至图中B 点时,通过计算求此所得不饱和溶液中溶质质量分数是多少?(计算结果精确到0.1%)(1)生成白色沉淀 (2)4.4 (3)8.1%6、(济宁)东方中学课外活动小组在测定由氯化钠和硫酸钠形成混合物的组成时,进行了以下实验:取20g 混合物全部溶于水,将得到的溶液等分为4份,然后分别加入一定量未知质量分数的氯化钡溶液,实验数据见下表:第一份 第二份 第三份 第四份 加入氯化钡溶液质量(g ) 15 20 25 30 反应得到沉淀的质量(g )1.401.862.332.33若有关的化学反应为:Na 2SO 4+BaCl 2=BaSO 4↓+2NaCl ,请计算: ⑴未知氯化钡溶液的质量分数为多少。
⑵原混合物中硫酸钠的质量分数是多少。
(精确到0.01) ⑴未知氯化钡溶液的质量分数为8.32%。
⑵原混合物中硫酸钠的质量分数是28.4% 8、(荆州)镁易被空气中的氧气氧化成氧化镁。
现有一卷标签上标明120 g 的镁带,称其质量为136 g(假设除镁被氧化外,没有发生其他任何变化,且氧化是均匀的)。
试计算(1)被氧化的镁的质量是多少克?烧杯中溶液的质量/g 0 106g 212g 滴入Na 2CO 3溶液的质量/g A B(2)称取上述变质的镁带6.8 g 加入到足量的盐酸溶液中反应,试计算反应产生氢气的质量是多少克?(24g 0.4g)【提升练习】一、选择题(6×10=60分)1.甲、乙两人各取2克锌分别与足量的稀H2SO4和稀HCl反应制得的氢气是()A.甲的多B.一样多C.乙的多D.无法比较2.氧化铜跟氢气反应时,如果生成36克水,则被还原的CuO的质量是()A.40克B.60克C.80克D.160克3.完全分解等质量的下列物质:水、KClO3、KMnO4、HgO、得到O2最多的是()A.KClO3B.KMnO4C.HgOD.H2O4.2.4g镁、2.7g铝、5.6g铁、6.5g锌分别与足量的稀H2SO4反应,得到H2的质量比依次是( )A. 1∶1∶1∶1 B.2∶3∶2∶2C.3∶1∶1∶2 D.1∶2∶2∶35.金属X与盐酸反应能生成XCl2,已知9.6g该金属与足量盐酸反应放出0.8gH2,则金属X的相对原子质量是()A.24B.40C.56D.656.有A和B两种物质,在一定条件下反应生成C和D,已知2克A能和5克B恰好完全反应,生成4克C和3克D,现有6克A和20克B经充分反应后,下列说法正确的是( ) A.生成C和D质量之和为26克B.生成12克CC.有1克A剩余D.生成10克D二、填空题(2×10=20分)7.每份质量P与份质量O2充分反应生成份质量的P2O5.8.加热克KMnO4可生成6.4克O2,完全反应后剩余固体是和___________,其质量分别是和.三、计算题(2×10=20分)9.将109铁与509稀H2SO4反应完毕后,取出剩余的铁,洗涤、干燥后,称其质量为3g.试回答:可制得氢气多少升?(标况下ρH2 = 0.09g/L)10.将铜和氧化铜的混合物209,用足量的H2还原,待反应完全,得到固体铜16.8g,求:(1)反应用掉的H2质量是多少?。
(2)原混合物里CuO的质量分数?【素质优化训练】3.将锌和ZnSO4的混合物20.8g,放入179.6g稀H2SO4中,完全反应后得到200gZnSO4溶液.求:(1)原混合物中Zn的质量分数?(2)把200gZnSO4液中的水蒸干,可得到ZnSO4固体多少g?【知识验证实验】甲、乙两同学在实验室用氯酸钾加热制取氧气的过程中,假如没有二氧化锰,可以加少量高锰酸钾,同样可以使氨酸钾很快放出氧气.甲同学认为是高锰酸钾起了催化作用,乙同学认为是高锰酸钾分解产生的二氧化锰起了催化作用.你同意谁的观点?并用化学方程式表达你的观点.【知识探究学习】难题巧解:锌、铁、镁的混合物4g,与足量的稀H2SO4完全反应,蒸发水份后,得到固体物质1g,试计算生成的氢气的质量?教师批改日期针对性意见。
