2020-2021年初三化学化学计算题测试卷(有答案)经典
2020-2021年初三化学化学方程式的计算测试卷(有答案)

2020-2021年初三化学化学方程式的计算测试卷(有答案)一、中考化学方程式的计算1.欲测得某块大理石中所含碳酸钙的含量,现取该大理石加入到足量稀盐酸中(杂质不与稀盐酸反应),产生CO2的质量与稀盐酸的质量关系如图所示,请计算。
(1)该实验中最多制得CO2的质量为_____。
(2)该大理石中所含碳酸钙的质量_____(写出计算过程)。
【答案】8.8g 20g【解析】【分析】碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳。
【详解】(1)由图像可知,该实验中最多制得CO2的质量为8. 8g。
(2)设该大理石中碳酸钙的质量为x3222CaCO+2HCl=CaCl+H O+CO10044x8.8g100x=448.8gx=20g答:大理石中所含碳酸钙的质量为20g。
2.铝被称为“年轻的金属”,工业上用电解氧化铝的方法制取金属铝。
反应的化学方程式为2Al2O3通电4Al+3O2↑。
请计算生成1.08t金属铝,理论上需要氧化铝的质量是多少____?【答案】2.04t【解析】【分析】【详解】解:设生成1.08t金属铝,理论上需要氧化铝的质量为x2322AlO 4Al +3O 204108x 1.08t↑通电 204x =108 1.08tx=2.04t答:生成1.08t 金属铝,理论上需要氧化铝的质量为2.04t 。
3.用稀盐酸和溶质质量分数为40%的氢氧化钠进行中和反应的实验,将稀盐酸逐滴加入到10.0g 氢氧化钠溶液中,边滴加边搅拌,随着稀盐酸的滴加,溶液的pH 变化情况如图所示(不考虑反应过程中热量散失):(1)当pH=7时,烧杯中的溶质是________。
(2)计算稀盐酸中溶质的质量分数(精确到0.1%)____。
【答案】NaCl 36.5%【解析】【分析】【详解】(1)当pH=7时,氢氧化钠溶液与稀盐酸恰好反应完全产生氯化钠溶液,烧杯中的溶质是:NaCl ;(2)设:稀盐酸中溶质的质量为x 。
2HCl +NaOH =NaCl +H O36.540x 10.0g 40%⨯36.540x 10.0g 40%=⨯ x=3.65g稀盐酸中溶质的质量分数=3.65g 100%=36.5%10g⨯。
2020-2021年化学计算题中考经典题型带答案经典

2020-2021年化学计算题中考经典题型带答案经典一、中考化学计算题1.镁在国产大飞机“C919”的制造中大显身手。
实验室模拟“海水制镁”的原理来富集镁,将20g氯化钠和氯化镁的固体混合物全部溶解于盛有100g水的烧杯中,然后向其中加入80g氢氧化钠溶液,恰好完全反应,过滤,称量滤液质量为194.2g,请计算:(1)图象中m=_____g;(结果精确到0.1g)。
(2)滤液中溶质的质量分数是多少?_____(结果精确到0.1%)【答案】5.8; 11.4%【解析】【详解】解:(1)m为反应结束后生成沉淀的质量,根据质量守恒定律,图象中m=20g+100g+80g-194.2g=5.8g。
(2)设氯化镁质量为x,反应生成氯化钠质量为y,22 MgCl+2NaOH=2NaCl+Mg OH9511758x y 5.8g()9511758==x y 5.8g解得:x=9.5g,y=11.7g,滤液中溶质的质量分数是:20g-9.5g+11.7g×100%194.2g≈11.4%,答:滤液中溶质的质量分数是11.4%。
2.向盛有氢氧化钠溶液的试管中加入一定量白色的硫酸铜固体粉末,恰好完全反应,过滤,得到溶质质量分数为14.2%的无色溶液10g。
请计算:(1)所得溶液中溶质的质量是_____________;(2)实验前试管中氢氧化钠溶液的溶质质量分数。
(计算结果保留到0.1%)__________【答案】1.42g 8.5%【解析】【分析】【详解】(1)10 g×14.2%=1.42g(2) 解:设实验前氢氧化钠溶液中的溶质质量为X,生成Cu(OH)2的质量为Y,白色的硫酸铜固体粉末的质量为W。
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓2×40 160 142 98X W 1.42g Y2×40 : 142=X :1.42g 解得X=0.8g180 :142= W :1.42g 解得W=1.6g142 :98 = 1.42g :Y 解得Y="0.98g."氢氧化钠溶液的质量为:10 g+0.98g- 1.6g=9.38g实验前试管中氢氧化钠溶液的溶质质量分数为:0.8g÷9.38g=8.5%3.某小组同学将530 g碳酸钠溶液加入到280 g石灰乳(水和氢氧化钙的混合物)中,使之恰好完全反应,所得溶液中溶质的质量分数为1%,计算加入的碳酸钠溶液中溶质的质量分数。
初中化学计算题大全(含答案及解析)

2024年中考化学《必考经典》计算题大全(含答案及解析)1.实验室欲测定一瓶标签破损的稀硫酸中溶质的质量分数,现取10g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化情况如图所示。
分析并计算:(1)a点溶液中含有的离子是_____。
(2)当pH=7时,消耗氢氧化钠溶液中NaOH质量为_____g。
(3)计算稀H2SO4中溶质的质量分数。
_____(4)计算恰好完全反应时所得溶液的溶质质量分数。
_____【答案】Na+、H+、SO42- 0.8 稀H2SO4的溶质质量分数是9.8%;恰好完全反应时所得溶液的溶质质量分数是5.5%。
【解析】【详解】(1)由图示可知,在a点时溶液的pH小于7,说明加入的NaOH完全反应,有剩余的硫酸,所以,溶液中含有的离子为:Na+、H+、SO42-;(2)由图示可知,在溶液的pH等于7,消耗的NaOH溶液的质量为16g,溶质的质量为:16g×5%=0.8g;(3)10g稀硫酸样品含有H2SO4的质量为x,生成的硫酸钠的质量为y2NaOH+H SO=Na SO+2H O2424280981420.8g x y解得:x=0.98g y=1.42g稀H2SO4的溶质质量分数为:×100%=9.8%;(4)恰好完全反应时所得溶液的溶质质量分数:×100%≈5.5%。
2.某小组同学将530 g碳酸钠溶液加入到280 g石灰乳(水和氢氧化钙的混合物)中,使之恰好完全反应,所得溶液中溶质的质量分数为1%,计算加入的碳酸钠溶液中溶质的质量分数。
【答案】2%【解析】【详解】设原碳酸钠溶液中溶质的质量为xNa2CO3+ Ca(OH)2=CaCO3↓+ 2NaOH106 100 80X则解得x =10.6g所以加入的碳酸钠溶液中溶质的质量分数为答:加入的碳酸钠溶液中溶质的质量分数为2%。
3.取一定量的氯化钠与氢氧化钠的混合物,加一定量的水配成溶液,然后向其中滴加溶质质量分数为7.3%稀盐酸,直至恰好反应,共消耗稀盐酸50g。
2020-2021中考化学计算题综合经典题附答案

一、中考初中化学计算题1.现有10%的Na2CO3溶液,请按下面要求计算:(1)106 g上述溶液中所含溶质量为 g;(2)106 g 上述溶液与足量10%的盐酸反应,最多可生成CO2多少克?(3)向106 g 上述溶液中逐滴加入10%的盐酸并不断搅拌,此时发生的反应为:Na2CO3 + HCl =NaHCO3+ NaCl;当Na2CO3 全部转化为NaHCO3后,再加入盐酸才开始放出CO2 。
请在“题25图”中画出产生气体的曲线。
(4)另取10% Na2CO3溶液边搅拌边加入10%的盐酸,有关反应物与生成物的量如下表:物质Na2CO3HCl X NaCl CO H2O质量/g31.814.616.823.4 4.4m则m=;该反应的化学方程式为。
【答案】(1)10.6 g;(2)4.4g;(3);(4)1.8;3Na2CO3+ 4HCl=2NaHCO3+4NaCl+H2O + CO2↑【解析】【分析】【详解】(1)106g溶液中所含溶质的质量=106g×10%=10.6g,故填:10.6。
(2)设生成二氧化碳的质量为x,消耗的盐酸溶液中溶质的质量为a,则有2322Na CO +2HCl =2NaCl+H O+CO 106734410.6g 10610.6g=7310610.6g=44a xa xx =4.4g ,a =7.3g ;答:最多生成二氧化碳的质量为4.4g 。
(3)设全部转化为碳酸氢钠需要盐酸溶液中溶质的质量为y233Na CO +HCl =NaHCO +NaCl 10636.510.6g 10610.6g=36.5y yy =3.65g 盐酸溶液的质量为3.65g=36.5g 10%碳酸钠完全反应消耗盐酸的质量为:7.3g=73g 10%故碳酸氢钠完全反应生成二氧化碳消耗盐酸的质量为73g-36.5g=36.5g ,故曲线为:。
(4)根据表格提供的数据,生成4.4g 二氧化碳,需要碳酸钠的质量是10.6g ,生成氯化钠的质量是11.7g ,说明给出的碳酸钠有一部分转化生成了碳酸氢钠和氯化钠,X 为NaHCO 3,碳酸钠和HCl 是反应物,碳酸氢钠、氯化钠、二氧化碳和水是生成物,根据质量守恒定律可得31.8g+14.6g=16.8g+23.4g+4.4g+m ,m=1.8g ; 设反应方程式为aNa 2CO 3+bHCl ═cNaHCO 3+dNaCl+eH 2O+fCO 2↑31.6g 14.6g 16.8g 23.4g 1.8g 4.4ga:b:c:d:e:f=:::::=3:4:2:4:1:110635.58458.51844方程式为3Na 2CO 3+4HCl ═2NaHCO 3+4NaCl+H 2O+CO 2↑。
2020-2021中考化学计算题-经典压轴题含答案

一、中考初中化学计算题1.小新用20g含碳酸钠53%的天然碱制取氢氧化钠用于制作“叶脉书签”(杂质不参加反应)。
操作过程如下:请计算:(1)20g样品中碳酸钠的质量为__________g;(2)反应后所得滤液中氢氧化钠的质量分数为多少?__________(写出计算过程)(3)将200g滤液浓缩制成“叶脉书签”所需质量分数为10%的氢氧化钠溶液,需蒸发水__________g.【答案】10.6 4% 120【解析】【分析】【详解】(1)20g样品中碳酸钠的质量为20g×53%=10.6 g(2)解:设反应生成氢氧化钠的质量为x;Na CO+Ca(OH)=CaCO+2NaOH23231068010.6g x106/10.6g=80/x 解得x=8 g氢氧化钠的质量分数=8g/200g×100%=4%答:反应后所得滤液中氢氧化钠的质量分数为4% 。
(3)将200g滤液浓缩制成“叶脉书签”所需质量分数为10%的氢氧化钠溶液,需蒸发水的质量为X根据溶液稀释前后溶质的质量不变有:200g ×4%=(200g-X) ×10%X=120g2.把2.4g镁加入到一定质量的硫酸中,反应完毕后,向溶液中滴加质量分数为10%的NaOH溶液,一段时间后有白色沉淀生成。
加入NaOH溶液与生成沉淀质量的关系如图。
(1)计算与2.4g镁反应的H2SO4的质量是多少?________(请在答题卡上写出计算过程)(2)加入NaOH溶液____g时,开始生成沉淀;图中a的数值为____。
(3)利用上述计算结果,若将NaOH溶液改用Ba(OH)2溶液并逐滴加入上述镁与硫酸反应后的溶液中至不再产生沉淀为止,过滤、洗涤、烘干,得到沉淀的质量为____g。
【答案】9.8g8016052.4【解析】【分析】Mg+H SO==MgSO+H↑,根据反应的质量比即可计算出参(1)利用化学方程式:2442加反应的硫酸的质量;(2)镁与稀硫酸反应后的溶液中滴加氢氧化钠溶液,一段时间后才产生白色沉淀,说明与镁反应的稀硫酸是过量的,氢氧化钠先与稀硫酸反应,再与硫酸镁反应生成氢氧化镁沉淀。
2020-2021年 化学计算题练习题(含答案)

2020-2021年化学计算题练习题(含答案)一、中考化学计算题1.取CaCl2和CaCO3的混合物12.5g于烧杯中,向其中滴加一定溶质质量分数的稀盐酸,请加稀盐酸的质量与产生气体质量的关系如图所示。
求:(1)混合物CaCO3中的质量为_______;(2)稀盐酸中的溶质质量分数为________;(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数为________?(写出计算过程,计算结果精确到0.1%)【答案】10g7.3%12.6%【解析】试题分析:盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,由图可知:二氧化碳的质量为4.4g设碳酸钙的质量为x,稀盐酸中的溶质质量为z,生成氯化钙的质量为y。
CaCO3+2HCl=CaCl2+H2O+CO2↑100 73 111 44x z y 4.4gx=10g z=7.3g y=11.1g(1)混合物CaCO3中的质量为10g;(2)稀盐酸中的溶质质量分数为100%=7.3%;(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数=100%≈12.6%。
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算2.取一定量的氯化钠与氢氧化钠的混合物,加一定量的水配成溶液,然后向其中滴加溶质质量分数为7.3%稀盐酸,直至恰好反应,共消耗稀盐酸50g。
反应后得到83.5g质量分数为10%的溶液。
求:(1)加水的的质量。
(2)混合物中氯化钠的质量分数。
【答案】27.0g ;38.5%【解析】【详解】(1)设参加反应的氢氧化钠的质量为x ,生成氯化钠的质量为y 。
200NaOH +HCl =NaCl +H O4036.558.5507.3x g y⨯ 004036.558.5==x 50g 7.3y⨯ x=4.0gy=5.85g反应后得到氯化钠的质量为:83.5g ×10%=8.35g混合物中氯化钠的质量为:8.35g-5.85g=2.5g需要加水的质量为:83.5g-50g-4.0g-2.5g=27.0g(2)混合物中氯化钠的质量分数= 2.5g 100%4.0g+2.5g⨯≈38.5%% 答:(1)加水的的质量为27.0g ;(2)混合物中氯化钠的质量分数为38.5%。
2020-2021年人教版中考化学化学计算题经典.docx

2020-2021 年人教版中考化学化学计算题经典一、中考化学计算题1.著名科学家诺贝尔经过长期试验,研制出安全炸药。
炸药三硝酸甘油酯(C3H5N3O9)发生爆炸的化学方程式为:4C3539222H N O12CO↑+10HO↑+6X ↑+O↑(1)推断 X 的化学式为 ______________。
(2)若生成13.2 g 二氧化碳,则同时生成氧气的质量是多少?______【答案】 N20.8g【解析】【分析】【详解】(1)根据质量守恒定律中的元素种类不变、原子个数不变的规律可以得出X 的化学式为N2。
(2)设生成O2的质量为xx=0.8g2.将一定质量的NaCl 和 Na2SO4固体混合物完全溶于水后,加入一定质量分数的BaCl2溶液 208g,恰好完全反应,过滤,得到23.3g 沉淀,经测定滤液中含氯元素的质量为21.3g (不考虑过滤过程中物质质量的损失)。
计算:(1)所加 BaCl 溶液的溶质质量分数 _______。
2(2)原固体混合物中Na SO 的质量 ________。
24(3)原固体混合物中NaCl 的质量 __________。
【答案】 10% 14.2g23.4g【解析】【分析】由题可知生成硫酸钡的质量是23.3g,根据化学方程式列比例求出Na2SO4的质量, BaCl2的质量,由化学式求出BaCl2中氯元素的质量,可得出原固体混合物中NaCl 中氯元素的质量,从而求得 NaCl 的质量;【详解】设 BaCl2的质量是 xg,Na2SO4的质量是 yg,Na2SO4+BaCl2=2NaCl+BaSO4↓142208233y x23.3g142/y=208/x=233/23.3gy=14.2g, x=20.8gBaCl2溶液的溶质质量分数==10﹪BaCl2中氯元素的质量=g=7.1g原固体混合物中NaCl 中氯元素的质量=21.3g-7.1g=14.2g原固体混合物中 NaCl 的质量 =14.2g=23.4g3.兴趣小组的同学为了测定某铜锌合金中锌的质量分数,小明同学利用该合金与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下(实验中的误差忽略不计)第一次第二次第三次所取合金的质量 /g252550所用稀硫酸的质量 /g120100100反应后烧杯中物质的质量 /g144.6124.6149.6①上表数据分折,第_____次中的锌与稀硫酸中的硫酸恰好完全反应②试计算该铜锌合金中锌的质量分数为_____③恰好完全反应后所得溶液中溶质的质量分数____(保留 0.1%)【答案】二52% 28.6%【解析】【分析】锌和稀硫酸反应生成硫酸锌和氢气。
2020-2021年化学计算题专题(含答案)(word)

2020-2021年化学计算题专题(含答案)(word )一、中考化学计算题1 .将含有NaCl 杂质的某烧碱样品10 g 完全溶于90 g 水中,再向所得溶液中慢慢滴入溶质 质量分数为7.3%的稀盐酸。
在实验过程中,溶液的pH 与滴入稀盐酸的质量关系如图所 示。
⑴求10 g 该样品中氢氧化钠的质量。
(2)求a 点时,溶液中溶质的质量分数(计算结果精确到0.1%)。
当恰好完全反应时消耗的盐酸溶液的质量为 100g,对应的HCl 的质量为100gX 7.3%=7.3g设氢氧化钠的质量为 x,生成的氯化钠的质量为yNaOH+HCLNaCl+H 2O 40 36.5 58.5 x7.3g yx 7. 3? yx=8g答:(1) 10g 该样品中氢氧化钠的质量为8g.(2)a 点时,溶液中溶质的质量分数约为6.9%2.为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止。
反应过程中生成的气体与所用硫酸溶液的质 量关系如图所示。
试计算:(1)样品中铜的质量分数;y=11.7ga 点时,溶液中溶质的质量分数为x 100%Q 6.9%«气的质量g0.15 。
一【解析】0.10稀硫酸的质童g(2)反应所消耗的硫酸溶液质量;(3) 反应后所得溶液质量。
【答案】(1) 67. 5%; (2) 50g ; (3) 53. 15g 【解析】根据锌与硫酸反应的化学方程式,由图中最多生成的氢气质量 0.10g,可以计算出:(1) 参加反应的锌的质量,进而计算出样品中铜的质量分数;(2)参加反应的硫酸的质量,进而计算出硫酸溶液的质量;(3)生成硫酸锌的质量,进而计算出所得硫酸锌溶液的溶质质 量分数。
解:设样品中铜的质量分数为X,消耗硫酸溶液的质量为 y 。
Zn + H 2SC 4 = ZnSQ + H 2 f 6598210g (1-X ) y x 9.8%0.10g65 10g (1-X ) —= 2 0.10g(3)所得溶液的质量为: 50g+10gx (1-67.5%) -0.10g=53. 15g答:(1)样品中铜的质量分数为67.5%;(2) 消耗硫酸溶液的质量为 50g ;(3)所得溶液的溶质质量分数为 53. 15g 。
2020-2021年 中考化学化学计算题20篇(附带答案解析)

2020-2021年中考化学化学计算题20篇(附带答案解析)一、中考化学计算题1.下图所示为实验室中常见的气体制备、干燥、收集和性质实验的部分仪器。
试根据题目要求,回答下列问题:⑴请写出能用装置A制备的一种气体的化学反应方程式_____,该气体可选用装置_____来收集(填装置序号),其选择依据是_____。
⑵小颖同学欲用干燥..、纯净..的一氧化碳气体还原某氧化铜样品(杂质只有铜),并测定其纯度。
(查阅资料)将草酸(H2C2O4)晶体与浓硫酸混合加热,会产生一氧化碳等气体,其反应原理为:H2C2O4浓硫酸CO↑+CO2↑+H2O。
①若小颖同学选用草酸来制取CO,其发生装置她应选择_____(填装置序号)。
(定量实验)②小颖同学先用电子秤称取了1.00g氧化铜样品,放入装置C中的玻璃管内并组装好所有相关仪器,再将草酸分解得到的气体产物按照以下仪器的连接顺序进行实验:混合气体→D→C→E→H,最后,通过测量反应前后装置E的质量变化进行计算。
(已知:CO+CuO ΔCu+CO2)实验过程中,在装置C的大玻璃管内可观察到的现象是_____。
③请你分析上述实验方案存在的不足之处及.对应的改进方法_____。
④实验改进后,小颖同学对实验所得的正确数据进行分析处理(设所发生的反应均完全进行):通过测定,当装置C中的氧化铜全部被还原后,装置E的质量增加了0.33g,则该样品中氧化铜的质量分数为_____(结果精确至0.1%)。
⑤小黄同学提出了异议,他认为若②中实验方案不加以改进,也能正确测算出该样品中氧化铜的纯度,他的计算依据或方法为:_____。
【答案】CaCO3 + 2HCl == CaCl2 + H2O + CO2↑ F 二氧化碳密度比空气大 B 黑色固体变成红色应该装置D前连接装置一个装置E,吸收混合气体中的二氧化碳 60.0% 根据H2C2O4浓硫酸CO↑+CO2↑+H2O,生成的一氧化碳和二氧化碳的分子个数比为1:1的关系,装置E增加的质量的一半就是氧化铜和一氧化碳反应生成的二氧化碳的质量,再根据步骤④的计算方法计算出氧化铜的质量即可 【解析】 【分析】 【详解】⑴装置A 为固液不加热型,可用于实验室制取二氧化碳,化学反应方程式为:CaCO 3 + 2HCl = CaCl 2 + H 2O + CO 2↑;该气体可选用装置F 来收集,选择依据是二氧化碳密度比空气大。
2020-2021年化学计算题中考选择题(难)(word)

2020-2021年化学计算题中考选择题(难)(word)一、中考化学计算题1.将20.0g稀盐酸逐滴加入到10.0g溶质质量分数为40%的氢氧化钠溶液中,边滴加边搅拌,随着稀盐酸的滴加,溶液的pH变化情况如图所示,溶液的温度变化如表所示(不考虑反应过程中热量散失)反应时间0 10 20 30 40 5060(s)溶液温度20.5 20.6 20.7 20.8 20.920.8 20.7(℃)(1)当稀盐酸与氢氧化钠溶液恰好完全反应时,溶液的温度是_____℃(2)计算稀盐酸中溶质的质量分数_________(精确到0.1%)【答案】20.936.5%【解析】【分析】根据图表可知当反应时间为40秒时,溶液的温度最高,所以当40秒时,反应恰好完全反应。
当pH为7的时候,恰好完全反应,根据氢氧化钠的质量可以求出盐酸的质量分数。
【详解】(1)因为中和反应是放热反应,所以温度最高时恰好完全反应,所以恰好完全反应时的温度从表上可知为20.9℃(2)设参加反应的盐酸的质量为xx=3.65g36.5%所以参加反应的盐酸的质量是36.5%。
2.向盛有氢氧化钠溶液的试管中加入一定量白色的硫酸铜固体粉末,恰好完全反应,过滤,得到溶质质量分数为14.2%的无色溶液10g。
请计算:(1)所得溶液中溶质的质量是_____________;(2)实验前试管中氢氧化钠溶液的溶质质量分数。
(计算结果保留到0.1%)__________【答案】1.42g 8.5%【解析】【分析】【详解】(1)10 g×14.2%=1.42g(2) 解:设实验前氢氧化钠溶液中的溶质质量为X,生成Cu(OH)2的质量为Y,白色的硫酸铜固体粉末的质量为W。
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓2×40 160 142 98X W 1.42g Y2×40 : 142=X :1.42g 解得X=0.8g180 :142= W :1.42g 解得W=1.6g142 :98 = 1.42g :Y 解得Y="0.98g."氢氧化钠溶液的质量为:10 g+0.98g- 1.6g=9.38g实验前试管中氢氧化钠溶液的溶质质量分数为:0.8g÷9.38g=8.5%3.欲测定盐酸与氯化钙的混合溶液中氯化钙的质量分数,进行了如下实验:取混合溶液100g于锥形瓶中,向其中逐渐加入一定溶质质量分数的碳酸钠溶液(如图一),并不断测定锥形瓶中溶液的pH.反应过程中所得溶液的pH与锥形瓶中物质的总质量的关系如图二所示。
2020-2021年 化学计算题本章综合与测试(解析版)经典

2020-2021年化学计算题本章综合与测试(解析版)经典一、中考化学计算题1.阿司匹林(分子式为C9H8O4)是一种常用解热镇痛药,用于治疗感冒、发烧、头痛等疾病。
某阿司匹林肠溶片说明书的部分内容如图所示。
(1)阿斯匹林的相对分子质量是_____,其中氢、氧元素的质量比是_____。
(2)阿斯匹林中碳元素的质量分数_____;25mg阿斯匹林中含碳元素的质量_____;(3)治疗不稳定性心绞痛时,病人每天服用阿斯匹林肠溶片的最大量是_____片。
【答案】180 1:8 60% 15mg 12【解析】(1)根据相对分子质量为构成分子的各原子的相对原子质量之和、化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答;(2)根据化合物中元素的质量分数=⨯相对原子质量原子个数相对分子质量×100%,化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答;(3)不稳定性心绞痛时,每天阿斯匹林的剂量为75~300mg,据此进行分析解答。
解:(1)阿斯匹林的相对分子质量为12×9+1×8+16×4=180;其中氢、氧元素的质量比为(1×8):(16×4)=1:8。
(2)阿斯匹林中碳元素的质量分数为129180⨯×100%=60%;25mg阿斯匹林中含碳元素的质量为25mg×60%=15mg;(3)不稳定性心绞痛时,每天阿斯匹林的剂量为75~300mg,则病人每天服用阿斯匹林肠溶片的最大量是300mg÷25mg=12片。
点睛:结合标签新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力。
2.某炼铝工厂想测定铝土矿中A12O3的含量,将矿石粉碎(其中杂质不溶于水,不与酸反应,且不含铝元素),进行如下实验,第一步反应的物质质量关系如坐标图所示:(1)上述实验过程中发生反应的化学方程式是_____;(2)根据已知条件列出求解第一步实验铝土矿中参加反应的A12O 3质量(x)的比例式_____(3)铝土矿样品中A12O 3的含量_____;(4)坐标图中B 点所示溶液中溶质的化学式是_____;(5)在第二步实验结束后所得溶液中溶质的质量分数是_____(6)用1700t 此铝土矿冶炼得到540t 的铝,则在冶炼中,铝土矿的利用率是_____。
2020-2021全国中考化学计算题的综合中考模拟和真题汇总附答案

一、中考初中化学计算题1.将Na2CO3和NaCl固体混合物32.9g放入烧杯中,此时总质量为202.9g,加入326.9g盐酸,恰好完全反应,待没有气泡逸出后再次称量,总质量为521.0g.计算所得溶液中溶质的质量分数______(CO2的溶解忽略不计).【答案】10【解析】【分析】首先根据质量守恒定律:化学反应前后,物质的质量不变,可先求出产生的气体二氧化碳的质量=202.9g+326.9g-521.0g=8.8g,再根据化学反应方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑可知,反应后所得溶液中溶质是NaCl,但NaCl来自两部分,一是反应生成的,二是原固体混合物中含有的,生成的NaCl可通过化学方程式来求解,原固体混合物中含有的NaCl可通过混合物32.9g减去Na2CO3的质量【详解】解:根据质量守恒定律,反应生成的CO2质量=202.9g+326.9g-521.0g=8.8g设Na2CO3的质量为x,生成的NaCl的质量为y。
2322Na CO+2HCl=2NaCl+H O+CO10611744x y8.8g↑10611744==x y8.8g解得x=21.2g y=23.4g所得溶液中溶质的质量分数=23.4g+32.9g-21.2g100% 32.9g+326.9g-8.8g⨯ =10%答:所得溶液中溶质的质量分数为10%。
2.在我国青海湖地区有一种说法,冬天捞碱,夏天晒盐。
这里的碱是指Na2CO3,盐是指NaCl。
人们从盐湖中捞得的碱会含有少量的NaCl。
某研究性学习小组称取含NaCl的Na2CO3固体25.0g,将其配制成溶液,再向其中逐滴加入足量的溶质质量分数为7.3%的稀盐酸,使气体完全放出,共收集到8.8gCO2气体。
试计算:(1)原固体中Na2CO3的质量分数________。
(2)反应中消耗盐酸的总质量______。
【答案】(1)84.8%.(2)200g.【解析】解:(1)设碳酸钠的质量为x,盐酸溶液中溶质的质量为yNa2CO3+2HCl=2NaCl+H2O+CO2↑106 73 44x y 8.8gx=21.2g,y=14.6g所以原固体中碳酸钠的质量分数为 ×100% =84.8%(2)反应中消耗盐酸的总质量为: =200g答:(1)原固体中Na2CO3的质量分数为84.8%;(2)反应中消耗盐酸总质量为200g。
2020-2021年 化学计算题 章末测试经典

2020-2021年化学计算题章末测试经典一、中考化学计算题1.徐州地区石灰石资源丰富。
某化学兴趣小组称取4.0g石灰石样品,把40g稀盐酸分4次加入样品中(假设杂质不反应也不溶解),得实验数据如下:请计算:(1)4.0g石灰石样品中碳酸钙的质量是____g。
(2)10g稀盐酸能与_____g碳酸钙正好完全反应。
(3)求稀盐酸的溶质质量分数为_________(写出计算过程,结果精确到0.1%)【答案】3.4 1.0 7.3%【解析】(1)根据质量守恒定律可知,4.0g石灰石样品中碳酸钙的质量=4.0g-0.6g=3.4g;(2)由第一次加入10g稀盐酸,剩余固体3.0g,第二次加入10g稀盐酸,剩余固体2.0g可知,10g稀盐酸能与1.0g碳酸钙正好完全反应;(3)第一次加入10g稀盐酸消耗碳酸钙的质量为4.0g-3.0g=1.0g;设第一次加入10g稀盐酸中溶质质量为x。
CaCO3 + 2HCl= CaCl2 + H2O + CO2↑100 731.0g x100731.0g xx=0.73g稀盐酸的溶质质量分数=0.73g10g×100%=7.3%;答:稀盐酸的溶质质量分数为7.3%。
2.若要生产含杂质4%的生铁100t,需要含氧化铁60%的赤铁矿石的质量是多少________?(要求写出计算过程,计算结果保留小数点后1位)【答案】228.6t【解析】试题分析:含杂质物质的计算要把混合物的质量转化为纯物质的质量,即纯物质质量=含杂质物质质量×纯度,再把纯物质的质量带入化学方程式计算。
最后再把计算出的纯物质质量转换为含杂质物质的质量。
[解]设:需要向炼铁高炉中投入这种铁矿石的质量为xFe2O3+ 3CO2Fe + 3CO2160 11260%x (1-4%)×100 t=x=" 228.6" t答:需要向炼铁高炉中投入这种铁矿石的质量为228.6t。
2020-2021年化学计算题专项练习经典(word)

2020-2021年化学计算题专项练习经典(word)一、中考化学计算题1.某小组同学将530 g碳酸钠溶液加入到280 g石灰乳(水和氢氧化钙的混合物)中,使之恰好完全反应,所得溶液中溶质的质量分数为1%,计算加入的碳酸钠溶液中溶质的质量分数。
【答案】2%【解析】【详解】设原碳酸钠溶液中溶质的质量为xNa2CO3+ Ca(OH)2=CaCO3↓+ 2NaOH106 100 80X则解得x =10.6g所以加入的碳酸钠溶液中溶质的质量分数为答:加入的碳酸钠溶液中溶质的质量分数为2%。
2.某实验小组用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液,测定Na2CO3溶液中溶质的质量分数。
他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示。
(1)在加入Na2CO3溶液的过程中,开始时没有发现沉淀生成,说明滤液中的溶质有________。
(2)计算Na2CO3溶液中溶质的质量分数________。
(计算结果精确到0.1%)(反应的方程式:Na2CO3+CaCl2=CaCO3↓+2NaCl)【答案】CaCl2、HCl 26.5%【解析】【分析】碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,稀盐酸和碳酸钠反应生成氯化钠和水和二氧化碳。
【详解】(1)根据已知条件可知,开始时没有发现沉淀生成,说明滤液中除了CaCl2还有其他物质,由第一个实验可以推断,这种物质是稀盐酸。
(2)分析图意可知,有20g23Na CO溶液与氯化钙溶液全部反应,生成5g碳酸钙沉淀,根据反应的化学方程式,设20gNa2CO3溶液中溶质的质量为x,2323Na CO+CaCl=CaCO+2NaCl106100x5g↓106x=1005gx 5.3g=Na2CO3溶液中溶质的质量分数为5.3g25g-5g100%26.5%⨯=答:Na2CO3溶液中溶质的质量分数为26.5%。
2020-2021年中考化学化学计算题100篇及答案经典
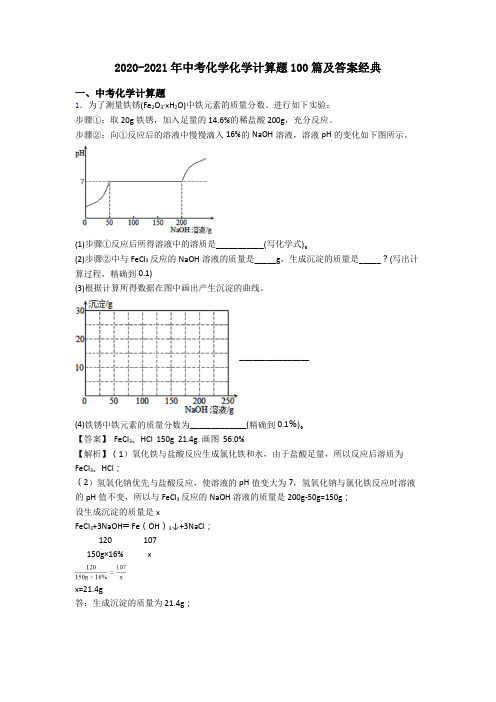
2020-2021年中考化学化学计算题100篇及答案经典一、中考化学计算题1.为了测量铁锈(Fe2O3·xH2O)中铁元素的质量分数。
进行如下实验:步骤①:取20g铁锈,加入足量的14.6%的稀盐酸200g,充分反应。
步骤②:向①反应后的溶液中慢慢滴入16%的NaOH溶液,溶液pH的变化如下图所示。
(1)步骤①反应后所得溶液中的溶质是___________(写化学式)。
(2)步骤②中与FeCl3反应的NaOH溶液的质量是_____g,生成沉淀的质量是_____?(写出计算过程,精确到0.1)(3)根据计算所得数据在图中画出产生沉淀的曲线。
________________(4)铁锈中铁元素的质量分数为_____________(精确到0.1%)。
【答案】 FeCl3、HCl 150g 21.4g 画图 56.0%【解析】(1)氧化铁与盐酸反应生成氯化铁和水,由于盐酸足量,所以反应后溶质为FeCl3、HCl;(2)氢氧化钠优先与盐酸反应,使溶液的pH值变大为7,氢氧化钠与氯化铁反应时溶液的pH值不变,所以与FeCl3反应的NaOH溶液的质量是200g-50g=150g;设生成沉淀的质量是xFeCl3+3NaOH═Fe(OH)3↓+3NaCl;120 107150g×16% xx=21.4g答:生成沉淀的质量为21.4g;(3)所以产生沉淀的曲线为;(4)所以铁锈中铁的质量分数为 =56%。
2.某校化学兴趣小组为了测定某一碳酸钠样品中碳酸钠的质量分数,进行如下实验,取13.25g碳酸钠样品(杂质既不溶于酸也不溶于水)放入烧杯中,加入95.8g水使其完全溶解,再向其中加入稀盐酸,测得反应放出气体的总质量与所加入稀盐酸的质量关系曲线如图所示,请回答:(1)当加入212g稀盐酸时,放出气体的质量为_____g。
(2)碳酸钠样品中碳酸钠的质量分数为多少?_____(写出计算过程)(3)加入106g稀盐酸(即A点)时烧杯中溶液的溶质质量分数为多少?_____(写出计算过程)【答案】4.4g 80% 5.6%【解析】【分析】【详解】(1)根据图像,可以看出当加入106g稀盐酸的时候,反应就结束,产生气体质量为4.4g,所以当加入212g稀盐酸时,放出气体的质量仍然为4.4g(2)发生反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑,根据方程式中碳酸钠与二氧化碳的质量关系可算出碳酸钠的质量,进而可以计算碳酸钠样品中碳酸钠的质量分数,反应后得到的是NaCl溶液,所以也可根据方程式中NaCl与二氧化碳的质量关系,求出溶液中溶质的质量解:设碳酸钠的质量为x,生成的NaCl质量为y。
2020-2021年初三化学化学计算题测试卷(有答案)(word)

2020-2021年初三化学化学计算题测试卷(有答案)(word)一、中考化学计算题1.为了测量铁锈(Fe2O3·xH2O)中铁元素的质量分数。
进行如下实验:步骤①:取20g铁锈,加入足量的14.6%的稀盐酸200g,充分反应。
步骤②:向①反应后的溶液中慢慢滴入16%的NaOH溶液,溶液pH的变化如下图所示。
(1)步骤①反应后所得溶液中的溶质是___________(写化学式)。
(2)步骤②中与FeCl3反应的NaOH溶液的质量是_____g,生成沉淀的质量是_____?(写出计算过程,精确到0.1)(3)根据计算所得数据在图中画出产生沉淀的曲线。
________________(4)铁锈中铁元素的质量分数为_____________(精确到0.1%)。
【答案】 FeCl3、HCl 150g 21.4g 画图 56.0%【解析】(1)氧化铁与盐酸反应生成氯化铁和水,由于盐酸足量,所以反应后溶质为FeCl3、HCl;(2)氢氧化钠优先与盐酸反应,使溶液的pH值变大为7,氢氧化钠与氯化铁反应时溶液的pH值不变,所以与FeCl3反应的NaOH溶液的质量是200g-50g=150g;设生成沉淀的质量是xFeCl3+3NaOH═Fe(OH)3↓+3NaCl;120 107150g×16% xx=21.4g答:生成沉淀的质量为21.4g;(3)所以产生沉淀的曲线为;(4)所以铁锈中铁的质量分数为 =56%。
2.取一定量的木炭在氧气中燃烧,生成23.2 g气体(氧气已完全反应)。
将气体通入过量的澄清石灰水中,生成40 g沉淀。
计算:(1)生成气体的成分及质量___________。
(2)生成气体中碳元素的质量分数_________。
【答案】CO、CO2的混合气体,其中CO为5.6g,CO2为17.6g 31%【解析】【详解】(1)设生成二氧化碳的质量为x2232Ca(OH)+CO=CaCO+H O44100x40g↓44100=x40g, x=17.6gCO的质量=23.2g-17.6g=5.6g;(2)生成气体中碳元素的质量分数= (17.6g× 12100%44⨯+5.6g×1228×100%)÷23.2 g ≈31%;答:此气体为CO、CO2混合气体,其中CO为5.6g,CO217.6g;气体中碳元素的质量分数为31%。
2020-2021年 化学计算题综合测试(含答案)

9.将 1.17g 氯化钠固体放入烧杯中,加入 51.7g 水充分溶解后得到常温下氯化钠的不饱和 溶液,再向所得溶液中逐滴滴入 100g 一定溶质质量分数的硝酸银溶液。实验过程中生成沉 淀的质量与滴入硝酸银溶液的质量关系如图所示:
84 73 95
44
x
y
z
4.4g
84 = 73 = 95 = 44 x y z 4.4g
x=8.4g y=7.3g z=9.5g
样品中杂质的含量为 2.1g 100%=10.5% 20g
所得溶液中溶质的质量分数为 20g-2.1g-8.4g+9.5g 100%=9.5% 20g-2.1g+100g-4.4g+86.5g
实验:
(1)取 2.62g 固体混合物加水完全溶解后,加入氯化钡溶液至不再产生沉淀为止,过滤干
燥后,称得沉淀的质量为 2.33g.求 2.62g 固体混合物中硫酸钠的质量是多少?
(2)另取等质量的固体混合物溶于 56.38g 水后,再加入 12g 一定质量分数的稀硫酸,恰
好完全反应,试计算反应后所得溶液中溶质的质量分数.
量,将氢气的质量代入化学方程式 Fe+2HCl=FeCl2+H2↑,就可计算出样品中铁的质量,即可
计算出样品。
解:根据质量守恒定律可知:
生铁与酸反应时生成的氢气的质量是:6.0+54.0g-59.8g=0.2g
设生铁中铁的质量是 x
Fe + 2HCl = FeCl2 + H2↑
56
2
X
0.2g
x=
生铁中铁的质量分数是: 答:实验中产生氢气的质量是 0.2g,生铁样品中铁的质量分数是 93.3%。
400g 澄清石灰水分四次加入,烧杯中沉淀的质量与每次加入澄清石灰水的质量关系如表。 请计算:
2020-2021年化学计算题试题和答案

(2)该同学把制取气体后的废液过滤,向滤液中加入 10.6%的 Na2CO3 溶液,测得加入的 Na2CO3 溶液与产生的沉淀数据如下:
Na2CO3 溶液质量/g
10
20
30
40
50
60
70
沉淀质量/g
0
1
n
3
4
5
m
则 m=__________。
加入 10gNa2CO3 溶液后发生反应的化学方程式是 ____________________________________。
【分析】
纯碱中碳酸钠与稀盐酸反应放出二氧化碳,根据质量守恒定律,利用反应前后物质总质量
差即反应放出二氧化碳的质量;根据反应的化学方程式,计算出纯碱中碳酸钠的质量和反
应后溶液中溶质氯化钠的质量。
【详解】
反应放出的 CO2 的质量为:64.4g+50g+11g-121g=4.4g 设参加反应的 Na2CO3 质量为 x,生成 NaCl 的质量为 y Na2CO3+2HCl=2NaCl+H2O+CO2↑ 106 117 44
CuSO4 + 2NaOH = Cu(OH)2 Na2SO4
160
98
x
9.8g
160 = 98 x 9.8g
x=16g
硫酸铜溶液溶质质量分数为 16g 100%=16% 100g
答:硫酸铜溶液溶质质量分数为 16%。 考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算
9.实验室有化学实验考试后留下混有少量食盐的小苏打( NaHCO3)样品。现称取样品 10 克,加入某溶质质量分数的稀盐酸 90 克,至充分反应不再有气泡产生为止,称得剩余溶液 质量为 96.04 克。求: (1)生成气体的质量; (2)样品中 NaHCO3 的质量分数。 【答案】3.96g;75.6%。 【解析】 【详解】 (1):根据质量守恒:反应前后质量相等,故生成二氧化碳的质量为 10+9096.04=3.96g;(2):碳酸氢钠与稀盐酸反应方程式为:NaHCO3+HCl=NaCl+H2O+CO2 根据差 值法可知:每由 84g 碳酸氢钠反应,就会生成 44g 二氧化碳,现在已知生成 3.96g 二氧化 碳,故有 3.96/44*84=7.56g 反应,故质量分数为 7.56/10*100%=75.6%。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020-2021年初三化学化学计算题测试卷(有答案)经典一、中考化学计算题1.20g含杂质(杂质不溶于水,也不溶于酸)的锌样品,与一定质量的稀硫酸恰好完全反应,所得溶液质量为80.5g,同时生成氢气0.4g。
试计算:(1)样品中锌的质量分数是_____;(2)完全反应后生成溶液中溶质的质量分数是_____;(3)所用稀硫酸的质量分数是_____(计算结果保留到0.01%)。
【答案】65% 40% 28.87%【解析】【分析】样品中的锌能与稀硫酸反应生成硫酸锌和氢气。
【详解】设样品中锌的质量为x;生成的硫酸锌的质量为y;硫酸中溶质的质量为z;2442Zn+H SO=ZnSO+H65981612x z y0.4g↑65981612===x z y0.4gx=13gy=32.2gz=19.6g(1)样品中锌的质量分数为13g×100%=65% 20g(2)完全反应后生成溶液中溶质的质量分数为32.2g×100%=40% 80.5g(3)所用稀硫酸的质量分数为19.6g×100%28.87% 80.5g+0.4g-13g≈答:样品中锌的质量分数为65%,完全反应后生成溶液中溶质的质量分数为40%,所用稀硫酸的质量分数为28.87%。
【点睛】利用化学方程式根据锌与生成的氢气的质量比求出锌的质量;反应后的溶液是硫酸锌溶液,利用化学方程式可计算出溶质硫酸锌的质量。
2.某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图(1)纯碱恰好完全反应时,生成CO 2的质量为___g(2)计算该样品中含杂质的质量分数是多少?(计算结果保留一位小数,下同)____________(3)计算当盐酸与纯碱恰好完全反应时,所得溶液的溶质质量分数是多少?____________ 【答案】4.4g 11.7% 16.3% 【解析】 【分析】(2)根据题意可知:已知量为二氧化碳的质量,未知量为样品中含杂质的质量分数。
解题思路为:可根据反应中二氧化碳与碳酸钠的质量关系求出碳酸钠的质量。
进一步可求出样品中含氯化钠的质量分数。
(3)根据题意可知:已知量为二氧化碳的质量,未知量为所得溶液中溶质的质量分数。
解题思路为:所得溶液为氯化钠溶液,可根据反应中二氧化碳与氯化钠的质量关系求出生成氯化钠的质量。
再加上样品中原有氯化钠的质量,即为所得溶液中的溶质的质量。
再根据质量守恒定律可求出所得溶液的质量。
最后可计算出所得溶液中溶质的质量分数。
具体过程如下: 【详解】(1)纯碱样品中的主要成分为碳酸钠,可与盐酸反应生成二氧化碳气体。
根据图示可知:当加入73g 稀盐酸时,生成气体的质量达到了最大值,即此时碳酸钠恰好完全反应。
所以恰好完全反应时生成二氧化碳的质量为4.4g 。
(2)解:设样品中含碳酸钠的质量为x ,反应生成氯化钠的质量为y2322Na CO 2HCl 2NaCl H O +=++CO 10611744xy4.4g↑106x=44 4.4gx=10.6g117y=44 4.4gy=11.7g样品中含杂质的质量分数为:12g-10.6g×100%11.7%12g≈(3)所得溶液中溶质的质量分数为:12g-10.6g+11.7g×100%16.3% 12g+73g-4.4g答:(1)生成二氧化碳的质量为4.4g;(2)样品中含杂质的质量分数为11.7%;(3)所得溶液中溶质的质量分数为16.3%。
3.某纯碱样品中含有少量氯化钠。
现称量该样品15.4g放入烧杯中,再向其中加入一定溶质质量分数的稀盐酸至100g时恰好完全反应。
此时烧杯内的物质质量为111g。
试计算:(1)碳酸钠中钠元素、碳元素、氧元素的质量比为__________;(化为最简比)(2)反应后生成的气体质量为_________g;(3)恰好完全反应时所得溶液中溶质的质量分数________。
(计算结果精确到0.1%)【答案】23:6:24。
4.4; 14.9%【解析】【分析】【详解】(1)碳酸钠化学式为Na2CO3,其中钠元素、碳元素、氧元素的质量比=23×2:12×1:16×3=23:6:24;(2)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,根据质量守恒定律,生成二氧化碳气体的质量=15.4g+100g-111g=4.4 g;(3)假设样品中碳酸钠质量为x,生成的氯化钠质量为y,则有:==解得x=10.6g,y=11.7g故样品中氯化钠质量=15.4g-10.6g=4.8g,反应后溶液中溶质为氯化钠,其总质量=4.8g+11.7g=16.5g,故恰好完全反应时所得溶液中溶质的质量分数=×100%≈14.9%。
4.请根据如图所示的实验过程和提供的数据计算。
(1)a、b的数值分别为_____、_____。
(2)合金中锌的质量分数为_____。
(3)第二次加入ag 14.6%的稀盐酸充分反应后所得溶液中溶质的质量分数。
_____(写出计算过程,计算结果精确至0.1%)【答案】50 8.5 90% 24.2%【解析】【分析】 【详解】解:(1)由题意可知,第一次和第二次加入稀盐酸后锌有剩余,稀盐酸完全反应,即2ag14.6%的稀盐酸消耗锌粒15g ﹣2g =13g ;故b =15g ﹣13g2=8.5g ;由题意可知: 22+=+65736.514.6%Zn 2HCl ZnCl H g ag ↑⨯65 6.57314.6%g ag =⨯ a =50(2)合金中锌的质量分数为15 1.515g gg- ×100%=90%;(3)设第二次加入ag 14.6%的稀盐酸充分反应后所得溶液中溶质的质量为x ,生成氢气质量为y ,22+=Zn 2HCl Zn +6513621l 52C H g gxy↑-651362152g g x y==-x =27.2g y =0.4g第二次加入ag 14.6%的稀盐酸充分反应后所得溶液中溶质的质量分数:27.2(152)5020.4gg g g g-+⨯-×100%≈24.2%。
答案:(1)50;8.5;(2)90%;(3)第二次加入ag 14.6%的稀盐酸充分反应后所得溶液中溶质的质量分数为24.2%。
5.碳酸钠和碳酸氢钠的固体混合物充分加热至恒重,其质量变化如下图所示。
另取相同质量的该混合物溶于水得到106.6 g 溶液,向该溶液中加入100 g 7.3% 的稀盐酸,恰好完全反应。
(已知:2NaHCO 3ΔNa 2CO 3+CO 2↑+H 2O ,碳酸钠受热不易分解。
)计算:(1)混合物与盐酸反应生成二氧化碳的质量_________。
(2)所得溶液中溶质的质量分数_________。
【答案】6.6g 5.85%【解析】【详解】(1)设混合物中碳酸氢钠的质量为x;碳酸氢钠与盐酸反应生成二氧化碳的质量为y、碳酸钠与盐酸反应生成二氧化碳的质量为z2NaHCO3Na2CO3+CO2↑+H2O2×84 (44 + 18)x 3.1 gx = 8.4gNaHCO3+HCl =NaCl + CO2↑+H2O84 448.4 g yy = 4.4g混合物中碳酸钠的质量为:13.7g -8.4g = 5.3gNa2CO3+2HCl =2NaCl + CO2↑+H2O106 445.3 g zz = 2.2g13.7 g混合物与稀盐酸反应生成二氧化碳的总质量是6.6 g(2)反应后溶液的质量:106.6 g+100 g-6.6 g =200g,根据氯元素守恒,设反应生成氯化钠的质量为mHCl ~ NaCl36.5 58.5100 g× 7.3% mm= 11.7g氯化钠溶液中氯化钠的质量分数=答:(1)混合物与盐酸反应生成二氧化碳的质量为6.6g;(2)与盐酸反应后溶液中氯化钠的质量分数是5.85%。
6.某炼铝工厂想测定铝土矿中A12O3的含量,将矿石粉碎(其中杂质不溶于水,不与酸反应,且不含铝元素),进行如下实验,第一步反应的物质质量关系如坐标图所示:(1)上述实验过程中发生反应的化学方程式是_____;(2)根据已知条件列出求解第一步实验铝土矿中参加反应的A12O3质量(x)的比例式_____(3)铝土矿样品中A12O3的含量_____;(4)坐标图中B点所示溶液中溶质的化学式是_____;(5)在第二步实验结束后所得溶液中溶质的质量分数是_____(6)用1700t此铝土矿冶炼得到540t的铝,则在冶炼中,铝土矿的利用率是_____。
【答案】Al2O3+6HCl=2AlCl3+3H2O 102x=21921.9(或21921.9=102x) 80% AlCl3、HCl 10%75% 【解析】【详解】(1)上述实验过程中发生反应是氧化铝和盐酸反应生成氯化铝和水,其化学方程式是Al 2O 3+6HCl=2AlCl 3+3H 2O ;故填:Al 2O 3+6HCl=2AlCl 3+3H 2O(2)设第一步实验铝土矿中参加反应的Al 2O 3质量为x ;第一步参加反应的HCl 的质量为300g 7.3%=21.9g ⨯2332102219x 2Al O +6HCl =21.AlCl +g3H 9O102x =21921.9;x=10.2g ;故填:102x =21921.9(或21921.9=102x) (3)根据图可知此时氧化铝完全反应,所以铝土矿样品中铝土矿样品中A12O 3的含量为:10.2g100%=80%12.75g⨯;故填:80% (4)坐标图中B 点盐酸有剩余,所以所示溶液中溶质为生成的氯化铝和剩余的盐酸,对应的化学式是:AlCl 3、HCl ;故填:AlCl 3、HCl(5)在第二步实验结束后盐酸恰好完全反应,设生成的氯化铝的质量为y 。
2332219267400g 7.Al O +6HCl =2AlCl +3%y3H O⨯219400g 7.3%=267y⨯;y=35.6g 所得溶液中溶质的质量分数是:35.6g100%=10%10.2g+3.4g+400g-57.6g⨯;故填:10% (6)用1700t 此铝土矿冶炼得到540t 的铝,则在冶炼中,铝土矿的利用率为:540t×100%=75%2721700t 272+163⨯⨯⨯⨯;故填:75%【点睛】根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
7.某兴趣小组对石灰石样品进行如下实验分析:取12g 样品放入烧杯中,将100g 稀盐酸分4次加入到烧杯中,充分反应后(杂质不溶于水,也不与酸反应),测得剩余固体的质量记录如下。
