物理化学第五版课件
(完整版)傅献彩《物理化学》第五版课件及习题答案习题课2

解析 取1mol锡作为体系,设计如下过程:
Sn(白)283K 283K, p
G, H , S
1G
1H
1S
Sn(白)298K
298K,p
G, H, S
Sn(灰)283K
2G 2H 2S
Sn(灰)298K
298K,p下: Hm 2197J mol1
Sm (44.76 52.30)J K 1 mol 1
Gm H T S (2197 298 7.54)J mol1
49.9J mol1
Gm >0,由Gibbs自由能减少原理可知,298K、 p 下白锡稳定。那么在283K、p 下哪一种晶型 稳定呢?这属于由一个温度下的 求另一个 温度下的 Gm。其计算方法一般有两种:
解法1
Hm 1Hm 2Hm 2Hm
1. G 计算小结
(从G H TS及dG SdT Vdp
出发,可以导出下列公式) (1) 等温封闭体系,无其他功的过程
• 理想气体 G nRT ln( p2 / p1), G H T S
• 实际体系(g,l, s) G V p2 dp p1
(2) 变压变温过程
G H (T2S2 T1S1)
p T
v
S V
p
p T
S
T
Cp V T
p
,
S T
p
Cp T
以上各偏微商中有关 T、p、V 的只要知道
物态方程其结果就很容易知道。另外,实验上
很容易测的量是 Cp , , , 因此有时又把这些
关系式写出与它们有关的形式,如
U V
T
T
p,
H
p
T
TV
V
等。
傅献彩《物理化学》第五版课件及习题答案_10电解与极化作用
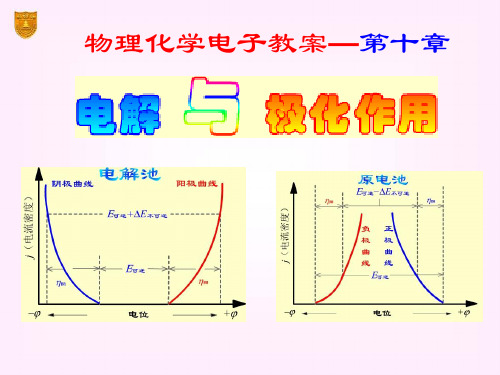
§10.2 极化作用
例如电解一定浓度的硝酸银溶液 阴极反应
Ag + (mAg+ ) e Ag(s)
可逆
电解时
RT 1 Ag |Ag ln F aAg+
阴
可逆 > 不可逆 阳极上有类似的情况,但 可逆 < 不可逆
动势达极大值 Eb,max。
电 流 I
3
再增加电压,使I 迅速增 加。将直线外延至I = 0 处, 得E(分解)值,这是使电解
2 1
池不断工作所必需外加的 最小电压,称为分解电压。
E分解
电压E
测定分解电压时的电流-电压曲线
实际分解电压
要使电解池顺利地进行连续反应,除了克服作
为原电池时的可逆电动势外,还要克服由于极化在
生消耗氧的还原反应:
O2 (g)+4H+ 4e 2H2O
(O2 |H2O,H+ )
RT 1 ln 4 4F aO2 aH +
1.229 V
设 aO2 1, aH+ 107 , 则 (O2 |H2O,H+ ) 0.816V
这时与 E(Fe2+ |Fe) (-0.617V)阳极组成原电池的电动 势为 1.433 V 显然耗氧腐蚀比析氢腐蚀严重得多。
所以铁很快腐蚀形成铁锈。
CO2 SO2
Fe2+
H 2或 H 2O
O2
O2
H
Cu
+
H2 O
Fe
2e-
H2 O
H+
Cu
电化学腐蚀示意图
物理化学第五版第五章课件

第五章第五章化学平衡问题:1.在一定条件下,反应物能否按预期的反应变成产物?2.如何提高产物的量?3.在一定条件下,反应的极限产率为多少?4.极限产率怎样随条件变化?研究的内容:1.化学平衡是研究化学反应方向和限度的关键。
2.本章讨论应用热力学第二定律的平衡条件来处理化学平衡问题。
3.将用热力学方法推导化学平衡时温度、压力、组成间的关系,并计算平衡组成。
4.如何改变条件可得到更大的产率?将通过热力学计算讨论温度、压力、组成等条件如何影响平衡。
1、摩尔反应Gibbs 函数与化学反应亲和势§5.1化学反应的等温方程在T,p一定的条件下,对0 = ΣνB B的化学反应进行时,∆r G m与系统组成的关系。
吉布斯函数判据:∆≤pT,G< 自发= 平衡(恒T,p,及W ’= 0)定义:()5.1.1a ∆mr G A −=表示在恒T ,p ,及W ’= 0时,化学反应进行的推动力。
≥T,p A > 正向自发= 平衡< 逆向自发(恒T ,p ,及W ’= 0)化学反应亲和势(简称亲和势)由吉布斯判据:2.∆r G m 与反应进度的关系,平衡条件某一化学反应0 = Σv B B ,在恒T ,p 下:()5.1.2a d d BBB ∑=n µG ξνn d d B B =Q ()5.1.2b d d BB B ∑=ξµνG ()∑==⎟⎠⎞⎜⎝⎛∂∂B B B m r 5.1.3∆µνG ξG pT,()5.1.1b ∆m r pT,ξG G A ⎟⎠⎞⎜⎝⎛∂∂−=−=定义{G }N 2(g) +3H 2(g) = 2NH 3(g)恒T ,p 下,均相化学反应0 = Σv B B ,如:0⎛⎞∂<⎜⎟∂ξ⎝⎠T,pG 0⎛⎞∂>⎜⎟∂ξ⎝⎠T,pG 0⎛⎞∂=⎜⎟∂ξ⎝⎠T,pG {G }{ξ}反应系统G~ξ关系示意图A>0A<0A=03.化学反应的等温方程恒T 、恒p ,且W´= 0时,对于理想气体间的化学反应∑=BB B 0ν其任一组分的化学势是:⎟⎟⎠⎞⎜⎜⎝⎛+=p p RT µµB B B ln ()5.1.4a ln ∆B B B B B B m r ⎟⎟⎠⎞⎜⎜⎝⎛+=∑∑p p νRT µνG ∑=BB B mr ∆µνG 代入BBB B B B ln ln ννp p RT RT p p ⎛⎞⎛⎞=∑∏⎜⎟⎜⎟⎝⎠⎝⎠()r m B BB∆ 5.1.5G νµ=∑压力商J p它仅是温度的函数。
傅献彩物理化学电子教桉-第五版物理化学总复习省名师优质课赛课获奖课件市赛课一等奖课件

QP
r
H
m
(773K
)
61.2kJ.mol 1
rU
m
(773K
)
r
H
m
(773K
)
B (g)RT
61.2 (111) 8.314 773103 kJ.mol 1
67.6kJ.mol 1
W
rU
m
(773K
)
Q
(67.6 61.2)kJ.mol 1 6.4kJ.mol 1
或者
均活度系数、离子强度旳计算; 3、电池电动势、电极电势及电池反应旳
rGm , r H m , r Sm , Qr,Ka 旳计算;
4、会将简朴反应设计成原电池等。
1. 298K时电池: Zn(s)|ZnCl2 -1 ) | AgCl(s)|Ag(s) 电动势为 E=1.156V (1)写出电极反应和电池反应;
第三定律熵:
ST
T Qr
0K T
偏摩尔量、化学势及化学势判据:
Z nB
T ,P,nc
Z B,m
Z U , H ,V , A,G, S
B
G nB
T ,P,nc
GB,m
有可能发生过程
BB 0
可逆过程
3. 基本过程、基本公式
W、Q、U、H、S 、A及G旳计算:
理想气体自由膨胀
W Q U H 0
,298K
)
反应旳恒压热效应与恒容热效应旳关系:
r
H
m
(298K
)
rU
m
(298K
)
B (g)RT
如反应 H2 (g) 0.5O2 (g) H2O(l)
B (g)RT (0 0.5 1)RT 1.5RT
最新[理学]傅献彩第五版物理化学课件 06章 化学平衡教学讲义ppt
![最新[理学]傅献彩第五版物理化学课件 06章 化学平衡教学讲义ppt](https://img.taocdn.com/s3/m/f5d2ae50a32d7375a517805c.png)
aB B
B
B
RTlnKa
溶液中反应的平衡常数
(2)在理想稀溶液中,溶质服从Henry定律:
B ( T ,p ,x B )B * ( T ,p ) R T ln x B
为什么化学反应通常不能进行到底?
R
因使D自、由E能混降合低
P
G
因D、生E成、F后F混合
后的自由能降低
S
T
1
nD
0
系统的Gibbs自由能在反应 过程中的变化(示意图)
为什么化学反应通常不能进行到底?
若要使反应进行到底,需在van‘t Hoff 平衡箱 中进行,防止反应物之间或反应物与产物之间的任 何形式的混合,才可以使反应从R点直接到达S点。
0 BB
B
G
T,p
BBrGmA
B
A> 0 A< 0 A= 0
反应正向进行 反应逆向进行 反应达平衡
§6.2 化学反应的平衡常数和等温方程式
气相反应的平衡常数——化学反应的等温方程式 液相中反应的平衡常数
混合理想气体中B的化学势表达式为:
B(T,p)B(T)RTlnp pB
pB pxB
B(T,p)B(T)RTlnppxB
用化学反应等温式判断反应方向
化学反应等温式也可表示为: rG m R T ln K f R T ln Q f
对理想气体
rG m R T lnK p R T ln Q p
K pQ p rG m0 反应向右自发进行 K pQ p rG m0 反应向左自发进行 K pQ p rG m0 反应达平衡
(rGm)T,p 0
BB = 0 B
反应达到平衡
判断化学反应的方向与限度
物理化学第五版课件

相平衡状态
当单组分系统满足相平衡条件时 ,系统将处于一种稳定状态,各
相之间不会发生相互转化。
二组分系统的相平衡
定义
二组分系统是由两种不同物质组成的系统,其相平衡是指这两种 物质在气、液、固三相之间达到平衡状态的过程。
相平衡条件
二组分系统的相平衡需要满足一定的条件,如温度、压力、各相的 化学势以及两种物质的摩尔分数相等。
平衡常数的定义
在一定温度下,可逆反应达到平 衡时各生成物浓度的系数次幂的 乘积与各反应物浓度的系数次幂
的乘积之比。
平衡常数的表达式
根据化学反应方程式的书写方式不 同,平衡常数的表达式也不同。
平衡常数的意义
表示反应正向进行的程度,平衡常 数越大,反应正向进行的程度越大 。
化学反应的等温方程式
等温方程式的定义
电化学
05
电导和电导率
电导
表示物质导电能力的物理量,定 义为当施加电场时,单位时间内 通过单位面积的电流。
电导率
表示物质导电能力的参数,定义 为电导与物质厚度的比值。
电极电势和电池反应
电极电势
表示电极上发生的氧化或还原反应的 难易程度,与电极反应的自由能变化 有关。
电池反应
由两个电极反应组成的可逆反应,其 总反应为两电极反应的相反数之和。
了解反应达到平衡时的物质组成,为 实际生产和科学实验提供理论依据。
平衡组成的计算方法
通过代入化学反应方程式和平衡常数 表达式,解出各物质的平衡浓度或分 压。
相平衡
04
单组分系统的相平衡
定义
单组分系统是由一种物质组成的 系统,其相平衡是指该物质在气 、液、固三相之间达到平衡状态
的过程。
物理化学课件(天大第五版)-真实气体

真实气体在相变过程中的 特性
REPORTING
相变过程的概念
相变过程
物质从一种相态转变为另一种相 态的过程,如气态转变为液态或 固态,液态转变为固态或气态,
固态转变为液态或气态。
相变点
物质发生相变的温度和压力点, 如水的冰点为0°C和1个大气压。
相平衡
在一定的温度和压力下,物质的 不同相态可以共存,形成一个平
REPORTING
真实气体的内能
总结词
真实气体的内能是指气体内部所有分子动能和势能的 总和,与温度、体积和物质的量有关。
详细描述
真实气体的内能是气体热力学状态的重要参数之一,它 反映了气体内部微观粒子所具有的能量。根据热力学的 知识,真实气体的内能与温度、体积和物质的量有关。 当温度升高时,气体分子的平均动能增大,导致内能增 加;而当体积增大时,分子间的平均距离增大,势能增 大,也会导致内能增加。物质的量越大,气体的内能也 越大。因此,在等温、等压条件下,真实气体的内能随 物质的量增加而增加。
反应速率
物质在相变过程中反应速率的快 慢,表示物质化学反应速度的变 化。
2023
REPORTING
THANKS
感谢观看
衡状态。
相变过程中的热力学性质
热容
在相变过程中,物质吸收或释放热量时温度的变 化,表示物质热稳定性的变化。
熵
物质在相变过程中熵的变化,表示物质内部无序 度的变化。
焓
物质在相变过程中焓的变化,表示物质能量的变 化。
相变过程中的动力学性质
扩散系数
物质在相变过程中扩散系数的变 化,表示物质传递速度的变化。
无序程度增加,因此气体的熵也随物质的量增加而增加。
物理化学第五版课件

Ω –1 Ω –1 . m –1 Ω –1 . m2 . mol –1
c
GK K c R c
二、电导的测定: ①惠斯通 Wheatstone 交流电桥:
D Rs A R1 C Rx R2 B
C、D 间电流为 0,电位相等 电桥达到平衡:
Rs R AC 1 Rx R2 CB
Gx
1 1 AC Rx Rs CB
②电导(率)仪: 完全不同于交流电桥,它是基于电阻分 压原理的一种不平衡测量方法。稳压器输出稳定的直流电 压,供振荡器和放大器使用。振荡器输出的电压不随电导池 电阻 Rx 的变化而改变,从而为电阻分压回路(由电导池 Rx 和 测量电阻箱 Rs 串联而成)提供一个稳定的音频标准电压 E。
二、离子强度 ionic strength
在稀溶液中,影响 γ± 的因素主要是浓度和价型。
I
1 bi zi2 2 i
lg
I
(P17)例: 试分别求算下列溶液的离子强度I和质量摩尔浓度b之间的关系:KCl、 MgCl2、FeCl3、ZnSO4、Al2(SO4)3。 (P18)例: 同时含0.1 mol . kg –1 KCl和0.01 mol . kg –1 BaCl2的水溶液,其离子强 度是多少?
三、德拜—休克尔极限公式 Debye-Hückel’s limiting law
(P19)例: 用德拜—休克尔极限公式计算25℃时 b = 0.005 mol . kg –1 ZnCl2 水溶液中,ZnCl2的γ±、b±、a±、a、γ。
例: 试用德拜—休克尔极限公式计算25℃时BaSO4在 (1)纯水;(2)0.01 mol . dm –3 ZnCl2;(3)0.01 mol . dm –3 Na2SO4中的溶解度。 已知BaSO4在水中的溶度积Ksp = 0.916×10 –10 。 例: 试比较AgCl在下列液体中的溶解度: (a)H2O (b)0.1cø NaNO3 (c) 0.1cø NaCl (d) 0.1cø Ca(NO3)2
物理化学第五版课件

A p
对于任何可逆过程有:
δ Qi = S A − SB ∑ i Ti R , B → A
R
I
δ Qi SB − S A > ∑ i Ti I , A→ B
B δ Qi ∆S A→ B − ∑ >0 A Ti I
B
O V
∆S A→ B − ∑
I
W
Q '1 − W
低温热源
Tc
所以有, ηR ≥ η I
可逆机R 驱动可逆机R 可逆机 1驱动可逆机 2时, 高温热源
Q
' 1
Th Q1 W
ηR ≤ ηR
1
2
R1
W
' 1
可逆机R 驱动可逆机R 可逆机 2驱动可逆机 1时, R2
Q1 − W
Q −W
ηR ≤ ηR
2
:η R1=η R2
V
∫
B
+ ∫B =0 A T R1 T R2
B
δQ
A
δQ
A
p
R2 R1
A δQ B δQ δQ ∫A T R = −∫B T R = ∫A T R 1 2 2
B
δQ ∆S = S B − S A = ∫ A T R
这是热力学第一与第二定律的联合公式,也称为热力学 这是热力学第一与第二定律的联合公式,也称为热力学 基本方程。 基本方程。
熵是热力学能和体积的函数, 熵是热力学能和体积的函数,即 S = S (U , V )
∂S ∂S dS = dU + dV ∂U V ∂V U
物理化学第五版课件

p2
C N2 2
N
1
C ln 2
p1 1
2
N
1
2
L
S 2 S 1 C ln
P2 P1
L
L C ln 2
R ln 2
C R
L
k
§3.10
Helmholtz自由能和Gibbs自由能
一、 Helmholtz自由能
dS
Q
T su r
0 或 T su r d S Q
G G dG dT T p p T
G 3 f R T ln
pF pF
'
g R T ln
pG pG
'
r G m G 1 r G m, 2
G3
p F pG pD pE
d e f g
R T ln
p p
'f F 'd D
p p
'g G 'e E
R T ln
p p
'f F 'd D
p p
'g G 'e E
则由式 d (U T S ) W ,有:
W d A
或 W A
在等温过程中,一个封闭体系所能做的最大功等于其 Helmholtz自由能的减少。若过程是不可逆的,则体系所做 的功小于亥姆霍兹能的减少。
若系统在等温、等容且无其他功的情况下,则:
W 0
A 0
H
T2
T1
C p d T 3 .5 R ( T 2 T1 ) 5 7 9 7 .1 J
天津大学第五版物理化学课件

rGm rG RT ln J 0
$ m eq p $ eq rGm RT ln J p RT ln K $
K称为热力学平衡常数,它仅是温度的函数,在
数值上等于平衡时的压力商,是无量纲的量。因
为它与标准摩尔反应吉布斯函数有关,所以又称
为标准平衡常数。
1. 标准平衡常数
(1) C(s) O2 (g) CO2 (g)
(2) CO(g) 1 O2 (g) CO2 (g) 2
$ r Gm (1)
$ r Gm (2)
(1) - 2×(2) 得(3)
(3) C(s) CO2 (g) 2CO(g)
$ $ $ r Gm (3) r Gm (1) 2 r Gm (2)
例题
例题 298K时,正辛烷C8H18(g)的标准燃烧焓是 –5512.4 kJ· –1 ,CO2(g)和液态水的标准生成焓分别 mol 为–393.5和–285.8 kJ· –1 ;正辛烷,氢气和石墨的标 mol 准熵分别为463.71,130.59和5.69 J· –1· –1。 K mol ⑴ 试求算298K时正辛烷生成反应的K。 ⑵ 增加压力对提高正辛烷的产率是否有利?为什 么? ⑶ 升高温度对提高其产率是否有利?为什么? ⑷ 若在298K及标准压力下进行此反应,达到平衡 时正辛烷的物质的量分数能否达到0.1?若希望正辛烷 的物质的量分数达0.5,试求算298K时需要多大压力才 行?
例题
6. 其它的平衡常数
eq K p ( pB ) B B
一般有单位
对于理想气体
eq pB B $ eq B $ B K ( $ ) ( pB ) /( p ) p B B
物理化学第五版下册PPT课件

n(始) 1.1276 g/159.62 g mol1 7.0643 103 mol
n(终) 1.109 g/159.62 g mol1 6.9476 103 mol
阴极上Cu2+ 还原,使 Cu2+ 浓度下降 Cu2+ 2e Cu(s)
Cu2+ 迁往阴极,迁移使阴极区 Cu2+ 增加,
n(终) n(始) n(迁) n(电)
n(迁) 7.10 105 mol
t(Cu2+ )
n(迁) n(电)
0.38
t(SO24 ) 1 t 0.62
上一内容 下一内容 回主目录
返回
2024/7/30
例题
解法2
先求
SO24-
的迁移数,以
1 2
SO24-
为基本粒子。
阴极上 SO24- 不发生反应,电解不会使阴极区 SO24- 离子
第七章 电化学
§7.1 电解质溶液的导电机理及法拉第定律 §7.2 离子的迁移数 §7.3 电导、电导率和摩尔电导率 §7.4 平均离子活度因子及德拜-休克尔极限公式 §7.5 可逆电池及其电动势的测定 §7.6 原电池热力学 §7.7 电极电势和液体接界电势 §7.8 电极的种类 §7.9 原电池设计举例
上一内容 下一内容 回主目录
返回
2024/7/30
1.离子迁移数的定义
上一内容 下一内容 回主目录
返回
2024/7/30
1.离子迁移数的定义
设离子都是一价的,当通入4 mol电子的电量时, 阳极上有4 mol负离子氧化,阴极上有4 mol正离子还原。
两电极间正、负离子要共同承担4 mol电子电量的 运输任务。
返回
物理化学上册-天津大学编写-第五版完整ppt课件

(1)从宏观到微观 (2)从体相到表相 (3)从定性到定量
(4)从单一学科到交叉学科
(5)从研究平衡态到研究非平衡态
精选ppt课件2021
10
当今科学研究的四大方向:
能源、材料 、环境、生命
学科间相互渗透、 相互结合,形成了许
化学与材料
多极具生命力的边缘 学科,
化学与能源
物理化学
Physical Chemistry
物理化学多媒体课件 孙雯
精选ppt课件2021
1
绪论
Preface
精选ppt课件2021
2
一、什么是物理化学?
无机化学
分析化学
有机化学 化学 物理化学
生物化学
高分子化学
物理化学是化精学选ppt课学件202科1 的一个分支 3
温度变化 压力变化 体积变化 状态变化
❖ 南京大学物理化学教研室 傅献彩
❖ 《物理化学》上、下册 (第四版)胡英
❖ 《物理化学练习500例》 (第二版)李大珍
❖ 《物理化学解题指精南选p》pt课件2021 李文斌(天大)
12
第一章 气体的 pVT 性质
Chapter1 the pVT relationships of gases
物质的聚集状态
ppt课件2021
16
R=8.314 J·K-1·mol-1 =0.08206 atm·l ·K-1·mol-1 =1.987 cal ·K-1·mol-1
理想气体状态方程也可表示为: pVm=RT pV = (m/M)RT
以此可相互计算 p, V, T, n, m, M, (= m/ V)
精选ppt课件2021
物理化学第五版课件

在常温下,只有在15000 atm以上,石墨转变为金刚石 在常温下,只有在 以上, 以上 的反应才是自发的。 的反应才是自发的。
化学反应的速率和机理 速率和机理的问题 二、 化学反应的速率和机理的问题
一个化学反应的速率究竟有多大? 一个化学反应的速率究竟有多大?反应是经过什么样的机 理(或历程)进行的?外界条件(如温度、压力、浓度、 或历程)进行的?外界条件(如温度、压力、浓度、 催化剂等)对反应速率有什么影响? 催化剂等)对反应速率有什么影响?怎样才能有效地控制 化学反应,抑制副反应的发生, 化学反应,抑制副反应的发生,使之按我们所需要的方向 和适当的速率进行等等。 和适当的速率进行等等。 研究这一类的问题构成物理化学中的另一部分叫做化学 研究这一类的问题构成物理化学中的另一部分叫做化学 动力学。它主要解决反应的速率和历程的问题。 速率和历程的问题 动力学。它主要解决反应的速率和历程的问题。它的任 务就是把热力学上可能发生的反应变为现实。 务就是把热力学上可能发生的反应变为现实。
绪
论
§0.1 物理化学的目的和内容
1. 物理变化与化学变化具有密切联系 a. 化学变化常伴随着物理变化。(体积、压力、 化学变化常伴随着物理变化。(体积、压力、 。(体积 热效应、 热效应、电效应和光效应等 )
CH 4 + 2O2 = CO2 + 2 H 2 O 放热
Zn + CuSO4 = ZnSO4 + Cu 放电
3. 热力学平衡态
热力学平衡态:在一定的条件下, 热力学平衡态:在一定的条件下,如果一个系统所有的状 态函数(宏观性质)有确定值,且不随时间而改变, 态函数(宏观性质)有确定值,且不随时间而改变,则称 这个系统处于热力学平衡态。 这个系统处于热力学平衡态。
5版物理化学02章-热力学第一定律课件(3)

§2.3 热力学的一些基本概念
系统与环境
系统(system)
在科学研究时必须先确定
研究对象,把一部分物质与其
环境
余分开,这种分离可以是实际 系统
的,也可以是想象的。
这种被划定的研究对象称 为系统,亦称为体系或物系。
环境(surroundings)
与系统密切相关、有相互作用或 影响所能及的部分称为环境。
m
V
Um
U n
Vm
V n
Sm
S n
热力学平衡态 当系统的诸性质不随时间而改变,则系统
就处于热力学平衡态,它包括下列几个平衡: 热平衡(thermal equilibrium) 系统各部分温度相等
力学平衡(mechanical equilibrium) 系统各部的压力都相等,边界不再移动。如 有刚壁存在,虽双方压力不等,但也能保持力学 平衡
现在,国际单位制中已不
用cal,热功当量这个词将逐
渐被废除。
§2.4 热力学第一定律
能量守恒定律
到1850年,科学界公认能量守恒定律是自 然界的普遍规律之一。能量守恒与转化定律可 表述为:
自然界的一切物质都具有能量,能量有各 种不同形式,能够从一种形式转化为另一种形 式,但在转化过程中,能量的总值不变。
环境
无物质交换 封闭系统
有能量交换
经典热力学主要研究封闭系统
系统的分类 根据系统与环境之间的关系,把系统分为三类: (3)隔离系统(isolated system) 系统与环境之间既无物质交换,又无能量交换, 故又称为孤立系统。
环境 无物质交换
隔离系统(1)
无能量交换
系统的分类
根据系统与环境之间的关系,把系统分为三类:
傅献彩第五版物理化学ppt课件第13章表面物理化学

或碳环有机化合物。亲水基团进入水中,憎水基团企图离开 水而指向空气,在界面定向排列。 表面活性物质的表面浓度大于本体浓度,增加单位面积 所需的功较纯水小。非极性成分愈大,表面活性也愈大。
稀溶液的
c 曲线的三种类型
Ⅱ
d 曲线Ⅰ: 0 表面活性物质 dc 曲线Ⅱ:d > 0 非表面活性物质 dc 曲线Ⅲ:d 0 表面活性剂 dc
入水中,非表面活性物质在表面的浓度低于在本体的浓度。
如果要增加单位表面积,所作的功中还必须包括克服静 电引力所消耗的功,所以表面张力升高。 表面活性物质
加入后能使水的表面张力明显降低的溶质称为表面活性物质。
§13.1 表面张力及表面Gibbs自由能
溶液的表面张力与溶液浓度的关系
表面活性物质 这种物质通常含有亲水的极性基团和憎水的非极性碳链
dU TdS pdV dAs B dnB U U S ,V , As , nB
所以考虑了表面功的热力学基本公式为
B
B
从基本公式可得
U H As S ,V ,nB As S , p ,nB A G As T ,V ,nB As T , p ,nB
表面和界面
界面是指两相接触的约几个分子厚度的过渡区,若其中 一相为气体,这种界面通常称为表面。 严格讲表面应是液体或固体与其饱和蒸气之间的界面, 但习惯上把液体或固体与空气的界面称为液体或固体的表面。 气-液界面,气-固界面,液-液界面,液-固界面,固-固界面。
界面现象的本质
界面层分子与内部分子相比所处的环境不同,因此,界
§13.2 弯曲表面上的附加压力和蒸气压
弯曲表面上的蒸汽压——Kelvin公式
5版物理化学上册第二章_热力学第一定律课件

QV
U
δQV dU
恒容热与过程的热力学能变在量值上相等。
2. 恒压热 (Qp) 及焓 恒压过程:系统的压力与环境的压力相等且恒定不变,即
p pamb 常数 对于封闭系统,W =0 时的恒压过程,有
W
pamb V2 V1
p V2 V1 p1V1 p2V2
由热力学第一定律可得
Qp
UW
= U2 p2V2
代入,有
C p ,m
1 n
H Tp
Hm Tp
—— Cp,m 定义式
单位: J mol 1 K 1
(2) 应用——计算单纯pVT 过程H
恒压过程: Qp
非恒压过程:
H Q
n
T2 T1
C
p,
m
dT
H
理想气体:
H
n
T2 T1
C
p,
m
dT
—— 理想气体H f T 的必然结果
凝聚态物质:
H
n
T2 T1
C
p,
U f T,V
dU
U T
V
dT
U V
T
dV
U 的绝对值无法求,但U 可求。 U只取决于始末态的状态,与途径无关。例:1始态
2
末态
3
不同途径,W,Q 不同,但
U
U1
U2
U3
§2.2 热力学第一定律
1. 热力学第一定律
热力学第一定律的本质是能量守恒原理,即隔离系统无论 经历何种变化,其能量守恒。
热力学第一定律的其他说法: 不消耗能量而能不断对外做功的机器——第一类永动机是 不可能造成的。
理想气体向真空膨胀:W 0 ,
过程中水温未变:Q 0 ,
物理化学第五版课件

xB gpB/ppB *xB l /p
6
定温
l
定压
a
pB* TA
b
a
b
g
P
L
cG
T
L
c
G
g+l d
g+l
e
d
p *A
g
e
l
TB
A
xB
BA
xB
B
液相线—泡点线,气相线—露点线。通常,露点高于泡点。 系统点—表示系统状态的点,相点—表示相的状态点。
s
A
xB
B
Au
Ag
无最低、最高熔点的完全互溶固溶体
如 Sb-Bi,Cu-Pd,Cu-Ni,Co-Ni,
PbCl2-PbBr2,NH4SCN-KSCN 等
18
l
l
l+s l+s
T
T
s
l+s
l+s
s
A
xB
B
Cu
Au
有最低熔点的完全互溶固溶体
A
xB
B
d-C10H14=NOH l-C10H14=NOH
有最高熔点的完全互溶固溶体
19
Sn
Pb Hg
Cd
有低共熔点的部分互溶固溶体 有转变(转熔)温度的部分互溶固溶体
如Ag-Cu,Cd-Zn,Pb-Sb,
如Pt-W,AgCl-LiCl等
AgCl-CuCl,KNO3-NaNO3等
§6.10 固态完全不互溶且生成化合物的 二元凝聚系统的液—固平衡相图
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
n
x B ,? ? x B ,?
n? ? x B ? x B ,?
n
x B ,? ? x B ,?
也可用质量m和质量分数w表示。
当组成不同的两种混合物相互混合形成一新的混合物时,新混合物的 组成也一定介于原两混合物的组成之间,且原两混合物的数量之比符 合杠杆规则。
三相平衡 α + β γ 时,γ相的组成也一定介于α相和β相的组成之间,且α和β两相的 量的变化符合杠杆规则,即
B
T
单相区:气、液、固 双相区(线):OA_水的气化; OB_冰的升华; OC_冰的熔化 克拉佩龙方程 ——dT / dp = TΔV / ΔH 压力每升高 10MPa ,冰点下降约 1K。压力越大,冰点越低。 三相区(点):273.16K 水在其自身蒸气压力 610.62Pa 下的凝固点
正常冰点: 273.15K 101.325kPa 下被空气所饱和的水的凝固点
若系统只受温度的影响,则
F = C -P + 1
若系统同时受温度、压力、电场、磁场、重力场等n个因素的影响,则
F = C -P + n
§6.2 杠杆规则 lever rule
以定温定压下,两组分 (A、B)的两相 (α、β)平衡为例 :
系统 α相 β相
组成
χB
物质的量 n
χB,α
χB,β
nα
nβ
B组分的量 nB
p ? pA ? pB ? p*AxlA ? p*BxlB ? p*A ? ( pB* ? p*A)xBl
xBg ? pB / p ? p*B xBl / p
定温
l
定压
a
p*B TA
b
a
b
g
P
L
cG
TL
c
G
g+l d
g+l
e
d
p*A
g
e
l
TB
A
xB
BA
xB
B
液相线—泡点线,气相线—露点线。通常,露点高于泡点。 系统点—表示系统状态的点,相点—表示相的状态点。
§6.5 非理想的完全互溶双液系 的气—液平衡相图
一、蒸气总压与液相组成的 关系曲线
定温
定温
P
P
A
xB
BA
xB
一般正偏差系统如苯—丙酮
偏差系统如氯仿—乙醚
B
一般负
定温
定温
P
P
A
xB
BA
xB
最大正偏差系统如甲醇—氯仿
偏差系统如氯仿—丙酮
B
最大负
二、气—液平衡相图
定温
l
g+l
P
g+l
定温
l P
g
g+l
§6.3 单组分系统相图 phase diagram
单组分系统 F = C - P + 2 = 3 - P F最大为2
水的相图 (p- T 图):
C (203MPa,253K)
A(22.1MPa,647K) 临界点 critical point
水
p e dc b a
冰
水蒸气
D
O(610.62Pa,273.16K) 三相点 triple point
三、小结——完全互溶双液系的气 —液平衡
相图
系统 压力—组成图 (定温) (定温)
温度—组成图 (定压 ) 气相组成—液相组成图
理想系统
l
g
P
T
yB
g
l
A
xB
BA
xB
BA
xB
B
一般正偏差
l P
g
T
yB
g
l
A
xB
BA
xB
BA
xB
B
一般负偏差
l
P
T
g
yB
g
l
A
xB
BA
xB
BA
xB
A
xB
最大正偏差
l
BA
n B,α
n B,β
nχB
n αχB,α n βχB,β
显然,(nα + nβ) χB = nχB = n αχB,α + n βχB,β
得
n? ? xB ,? ? x B n ? x B ? x B ,?
χB,α
χB χB,β
α
β
O
两相物质的量反比于
nα
系统点到两个相点的距离
nβ
还可表示为:
n? ? x B,? ? x B
g+l
g
A
xB
BA
xB
B
最大正偏差系统的压力—组成图
最
大负偏差系统的压力—组成图
液相线和气相线在最高 (低)点处相切,此点将气 —液两相区分成左、右两部分。
定压
T
g+l
l
g
g+l
定压
g
g+l g+l
T l
A
xB
BA
xB
B
最大正偏差系统的温度—组成图
最
大负偏差系统的温度—组成图
一般正(负)偏差系统的压力—组成图与理想系统的相似,只 是液相线不是直线,而是略向上凸(下凹)。一般正(负)偏差 系统的温度—组成图与理想系统的类似。
xB
BA
xB
B
g
P
T
yB
g
l
A
xB
BA
xB
BA
xB
B
最大负偏差
l P
T g
g
yB
l
A
xB
BA
xB
BA
xB
B
气相组成—液相组成图上,对角线上(下)方表示组分B的气相含量大(小)于它的液相含量。
*§6.6精馏rectification(分馏fractional distillation)原理
精馏:液态混合物同时经多次部分气化和部分冷凝而使之分离的操作,实际 即多次简单蒸馏的组合。
CO2 P
s
l g
硫
P
正交
l
单斜
g
T
T
§6.4 理想的完全互溶双液系
的气—液平衡相图 二组分系统 F = C - P + 2 = 4 - P F最大为3 常固定温度得压力—组成图,或固压力得温度—组成图
双液系:完全互溶:理想的 非理想的:一般正偏差,一般负偏差,
最大正偏差,最大负偏差。 部分互溶 完全不互溶 双固系:完全不互溶 完全互溶 部分互溶 生成化合物:稳定化合物,不稳定化合物。
定压 g
g+l
T
L
M
G
l
a
A
xB
B
精馏过程中的温度—组成示意图
二、相律
自由度数(独立变量数) = 总变量数 – 独立方程式数
只受温度和压力影响的相平衡系统的相律:
F = C - P + 2 吉布斯相律(1875)
自由度数 组分数 相数
V = E - F + 2 欧拉定理(简单多面体)
顶点数 棱边数 面数F = C - P + n
vertex edge face
第六章 相平衡 phase equilibrium
§6.1 相律 phase rule
一、有关术语
相数
P phase
(独立)组分数 C (independent) component
自由度数 F degree of freedom
(独立)组分数 = 物种数 – 独立化学平衡数 – 独立限制条件数
C = S - R - R?
? n? ? x B ,? ? x B,? ? n ? x B,? ? x B,?
? n? ? ? n? ? ? n? ? 0
(P257)例: 甲苯和苯能形成理想溶液,两者在90℃时的饱和蒸气压分 别为54.22kPa和136.12kPa。求:
(1) 90℃、101.325kPa下甲苯—苯系统成气—液平衡时的两相组成; (2)若系统由100.0g甲苯和200.0g苯构成,则在上述条件下气相和液 相的质量各是多少?
