大学二年级物理化学(AB)课件-物理化学习题(含答案)
物理化学习题-含答案
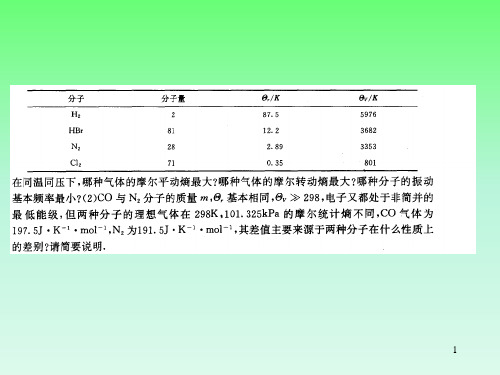
基态是单态。计算在298K、1atm下一氧化碳气体的 摩尔熵值。
7
解:由于CO气体为非定位体系,其熵公式为:
ln Q Q NkT S k ln N! T
N
ln Q Nk ln Q k ln N! NkT T
可将其看成是体系的平动熵、转动熵、振动熵及电子熵等之 和。可先分别求出各运动形式的熵、再求和而得体系的总熵 。上式的-k lnN! 项归入平动熵计算。
32
将题中给出的数据直接代入上式得:
Q转
2 8 1.1461045 1.381023 298 (3.1416 )
2 (6.62610
34 2
)
424
5
(3)如果将分子看成是谐振子,则有
Q振 1 1 e h kT 1 1 e h c kT
由题意知,
565cm1 565102 m1
~
1 代入上式得: Q振 6.6261034 565102 2.998108 1 exp[ ] 23 1.3810 298
1
1 e
2.73
1.07
6
计算题
2.已知一氧化碳分子的转动惯量是
I 1.451046 kg m2 ~ 1 基本振动波数 2170cm ,分子量为 28.0,其电子
2170cm1 217000 m1
ln Q h c e h c kT T kT2 1 e h c kT
12
将数据代入得
ln Q振 T
计算题
10.5 e10.5 0 10.5 298 (1 e )
S振 R ln Q振 RT T 8.314 ln 1 8.314 298 0 0
大学物理化学 第二章 热力学第二定律学习指导及习题解答

3.熵可以合理地指定
Sm$
(0K)
0
,热力学能是否也可以指定
U
$ m
(0K)
0
呢?
答:按能斯特热定理,当温度趋于0K,即绝对零度时,凝聚系统中等温变化过
程的熵变趋于零,即
, 只要满足此式,我们就可以任意
选取物质在0K时的任意摩尔熵值作为参考值,显然 Sm$ (0K) 0 是一种最方便的
选择。但0K时反应的热力学能变化并不等于零,
(2)变温过程
A.等压变温过程 始态 A(p1,V1,T1) 终态 B(p 1,V2,T2)
S
T2
δQ R
T T1
T2 Cp d T T T1
Cp
ln
T2 T1
B.等容变温过程 始态 A(p1,V1,T1) 终态 B(p2,V1,T2)
S
T2
δQ R
T T1
C.绝热过程
T2 CV d T T T1
,所以不
能指定
U
$ m
(0K)
0
。
4.孤立系统从始态不可逆进行至终态S>0,若从同一始态可逆进行至同
一终态时,则S=0。这一说法是否正确?
答:不正确。熵是状态函数与变化的途径无关,故只要始态与终态一定S
必有定值,孤立系统中的不可逆过程S>0,而可逆过程S=0 是毋庸置疑的,
问题是孤立系统的可逆过程与不可逆过程若从同一始态出发是不可能达到相同
4.熵 (1)熵的定义式
dS δ QR T
或
S SB SA
B δ QR AT
注意,上述过程的热不是任意过程发生时,系统与环境交换的热量,而必须是在
可逆过程中系统与环境交换的热。
物理化学课后习题答案(全)

第1章 物质的pVT 关系和热性质习 题 解 答1. 两只容积相等的烧瓶装有氮气,烧瓶之间有细管相通。
若两只烧瓶都浸在100℃的沸水中,瓶内气体的压力为0.06MPa 。
若一只烧瓶浸在0℃的冰水混合物中,另一只仍然浸在沸水中,试求瓶内气体的压力。
解: 21n n n +=2212112RT V p RT V p RT V p +=⋅2111121222112p T p T T p T T T T =+⎛⎝⎜⎞⎠⎟=+ ∴112222p T T T p ⋅+=MPa0.0507=MPa 06.02)15.273100()15.2730(15.2730⎥⎦⎤⎢⎣⎡××++++=2. 测定大气压力的气压计,其简单构造为:一根一端封闭的玻璃管插入水银槽内,玻璃管中未被水银充满的空间是真空,水银槽通大气,则水银柱的压力即等于大气压力。
有一气压计,因为空气漏入玻璃管内,所以不能正确读出大气压力:在实际压力为102.00kPa 时,读出的压力为100.66kPa ,此时气压计玻璃管中未被水银充满的部分的长度为25mm 。
如果气压计读数为99.32kPa ,则未被水银充满部分的长度为35mm ,试求此时实际压力是多少。
设两次测定时温度相同,且玻璃管截面积相同。
解:对玻璃管中的空气,p V p V 2211=kPa 0.96=kPa )66.10000.102(35251212−×==p V V p ∴ 大气压力 = kPa 28.100kPa )96.032.99(=+·28· 思考题和习题解答3. 让20℃、20 dm 3的空气在101325 Pa 下缓慢通过盛有30℃溴苯液体的饱和器,经测定从饱和器中带出0.950 g 溴苯,试计算30℃时溴苯的饱和蒸气压。
设空气通过溴苯之后即被溴苯蒸气所饱和;又设饱和器前后的压力差可以略去不计。
(溴苯Br H C 56的摩尔质量为1mol g 0.157−⋅)解:n pV RT 131013252010831452027315==×××+⎡⎣⎢⎤⎦⎥−().(.) mol =0.832 mol n m M 209501570==..mol =0.00605mol p py p n n n 22212101325732==+=×= Pa 0.006050.832+0.00605 Pa4. 试用范德华方程计算1000 g CH 4在0℃、40.5 MPa 时的体积(可用p 对V 作图求解)。
大学物理化学2-热力学第二定律课后习题及答案

热力学第二定律课后习题答案习题1在300 K ,100 kPa 压力下,2 mol A 和2 mol B 的理想气体定温、定压混合后,再定容加热到600 K 。
求整个过程的∆S 为若干?已知C V ,m ,A = 1.5 R ,C V ,m ,B = 2.5 R[题解]⎪⎩⎪⎨⎧B(g)2mol A(g)2mol ,,纯态 3001001K kPa,()−→−−−−混合态,,2mol A 2mol B100kPa 300K 1+==⎧⎨⎪⎪⎩⎪⎪p T 定容()−→−−2混合态,,2mol A 2mol B 600K 2+=⎧⎨⎪⎩⎪T ∆S = ∆S 1 + ∆S 2,n = 2 mol∆S 1 = 2nR ln ( 2V / V ) = 2nR ln2 ∆S 2 = ( 1.5nR + 2.5nR ) ln (T 2 / T 1)= 4nR ln2 所以∆S = 6nR ln2= ( 6 ⨯ 2 mol ⨯ 8.314 J ·K -1·mol -1 ) ln2 = 69.15 J ·K -1 [导引]本题第一步为理想气体定温定压下的混合熵,相当于发生混合的气体分别在定温条件下的降压过程,第二步可视为两种理想气体分别进行定容降温过程,计算本题的关键是掌握理想气体各种变化过程熵变的计算公式。
习题22 mol 某理想气体,其定容摩尔热容C v ,m =1.5R ,由500 K ,405.2 kPa 的始态,依次经历下列过程:(1)恒外压202.6 kPa 下,绝热膨胀至平衡态; (2)再可逆绝热膨胀至101.3 kPa ; (3)最后定容加热至500 K 的终态。
试求整个过程的Q ,W ,∆U ,∆H 及∆S 。
[题解] (1)Q 1 = 0,∆U 1 = W 1, nC V ,m (T 2-T 1))(1122su p nRT p nRT p --=, K400546.2022.405)(5.11221211212====-=-T T kPa p kPa p T p T p T T ,得,代入,(2)Q 2 = 0,T T p p 3223111535325=-=-=--()γγγγ,, T T 320.42303==-()K(3)∆V = 0,W 3 = 0,Q U nC T T V 3343232831450030314491==-=⨯⨯⨯-=∆,()[.(.)].m J kJp p T T 434350030310131671==⨯=(.).kPa kPa 整个过程:Q = Q 1 + Q 2+ Q 3 =4.91kJ ,∆U = 0,∆H = 0,Q + W = ∆U ,故W =-Q =-4.91 kJ∆S nR p p ==⨯=--ln (.ln ..).141128314405616711475J K J K ··[导引]本题的变化过程为单纯pVT 变化,其中U 、H 和S 是状态函数,而理想气体的U 和H 都只是温度的函数,始终态温度未变,故∆U = 0,∆H = 0。
物理化学课件及考试习题 试卷 答案第一次习题课 (热力学第一定律、第二定律)讲解

4. 什么是自发过程?自发过程的共同 特征是什么?
在一定条件下,能够自动进行的过程就 是自发过程。 特点: 一切自发过程都有一定的方向和限度, 不可能自动发生其逆过程; 要使发生自发过程的系统复原,环境中 必然留下热功转化的痕迹; 自发过程是不可逆过程。
5. 熵是量度系统无序度的热力学状态函数。下列情 况哪一种物质的摩尔熵值更大?(1)室温下的纯铁 和碳钢;(2)0℃的液态水和固体冰。
溶化过程:ΔU1=ΔH1=nΔfusHm=1×6008 J· mol-1=6.008KJ 升温过程:ΔU2=ΔH2=NCv,m(T2-T1) =1mol×75J· K-1· mol· -1×(373.15-273.15)=7.5KJ 蒸发过程:ΔH3=nΔvapHm=1mol×44011J· mol-1=44.011KJ 假设水蒸气为理想气体:ΔU3=ΔH3-PΔV 液体体积可以忽略:PΔV= PV气 =nRT=1×8.314×373.15=3.102 KJ ΔU3=ΔH3-PΔV=44.011-3.102=40.909KJ ΔU=ΔU1+ΔU2+ΔU3=6.008+7.5+40.909=54.417 KJ ΔH=ΔH1+ΔH2+ΔH3=6.008+7.5+44.011=57.519KJ
(2) 对反抗恒外压的绝热不可逆膨胀过程,根据 热力学第一定律及体积功的定义有:
W=ΔU=nCv,m(T2-T1)=-Psur(V2-V1) =- Psur(V2-V1) =-101.325(11.95-nRT1/P1)
=- 101.325(11.95-1×8.314×298.2/607.95)
=-797.6 J T2=T1-797.6/(1.5×8.314) =298.2-64.0 =234.2K
物理化学习题详细答案

第一章热力学第一定律第二章热力学第二定律第三章多组分系统第四章化学平衡第五章相平衡第六章化学动力学第七章电化学第八章界面现象第九章胶体化学第十章统计热力学第一章热力学第一定律计算题1. 两个体积均为V 的密封烧瓶之间有细管相连,管内放有氮气。
将两烧瓶均放入100℃的沸水时,管内压力为50kPa。
若一只烧瓶仍浸在100℃的沸水中,将另一只放在0℃的冰水中,试求瓶内气体的压力。
解:设瓶内压力为p′,根据物质的量守恒建立如下关系:(p′V/373.15)+ (p′V/273.15)= 2(pV/373.15)即p′=2×50 kPa/(1+373.15/273.15)=42.26 kPa2. 两个容器A 和B 用旋塞连接,体积分别为1dm3 和3dm3,各自盛有N2 和O2(二者可视为理想气体),温度均为25℃,压力分别为100kPa 和50kPa。
打开旋塞后,两气体混合后的温度不变,试求混合后气体总压及N2 和O2的分压与分体积。
解:根据物质的量守恒建立关系式p 总(V A+V B)/ 298.15=( p A V A /298.15)+ (p B V B /298.15)得p 总= ( p A V A+ p B V B)/ (V A+V B) = (100×1+50×3) kPa/(1+3)=62.5 kPan(N2)= p A V A /RT A= {100000×0.001/(8.315×298.15)}mol = 0.04034 moln(O2)= p B V B /RT B= {50000×0.003/(8.315×298.15)}mol = 0.06051 moly(N2)= n(N2)/{ n(N2)+ n(O2)}= 0.04034/(0.04034+0.06051)=0.4y(O2)=1- y(N2)=1-0.4=0.6分压p(N2)= y(N2) p 总= 0.4×62.5 kPa= 25 kPap(O2)= y(O2) p 总= 0.6×62.5 kPa= 37.5 kPa分体积V(N2)= y(N2) V 总= 0.4×4 dm3 = 1.6 dm3V(O2)= y(O2) V 总= 0.6×4 dm3 = 2.4 dm33. 在25℃,101325Pa 下,采用排水集气法收集氧气,得到1dm3 气体。
(完整版)物理化学习题答案

《物理化学》作业习题物理化学教研组解2009,7第一章 热力学第一定律与热化学1. 一隔板将一刚性决热容器分为左右两侧,左室气体的压力大于右室气体的压力。
现将隔板抽去左、右气体的压力达到平衡。
若以全部气体作为体系,则ΔU 、Q 、W 为正为负或为零解:0===∆W Q U2. 试证明1mol 理想气体在衡压下升温1K 时,气体与环境交换的功等于摩尔气体常数R 。
证明:R T nR V V p W =∆=-=)(123. 已知冰和水的密度分别为:×103kg ·m -3,现有1mol 的水发生如下变化: (1) 在100o C ,下蒸发为水蒸气,且水蒸气可视为理想气体; (2) 在0 o C 、下变为冰。
试求上述过程体系所作的体积功。
解:(1) )(m 1096.11092.010183633--⨯⨯⨯==冰V )(m 1096.1100.110183633--⨯⨯⨯==水V )(10101.3373314.81)(3J nRT V V p W e ⨯=⨯⨯===冰水- (2) )(16.0)108.11096.1(101325)(55J V V p W e =⨯-⨯⨯=-=--水冰4. 若一封闭体系从某一始态变化到某一终态。
(1)Q 、W 、Q -W 、ΔU 是否已经完全确定。
(2)若在绝热条件下,使体系从某一始态变化到某一终态,则(1)中的各量是否已完全确定为什么解:(1) Q -W 与ΔU 完全确定。
(2) Q 、W 、Q -W 及ΔU 均确定。
5. 1mol 理想气体从100o C 、0.025m 3 经过下述四个过程变为100o C 、0.1m 3: (1) 恒温可逆膨胀; (2) 向真空膨胀;(3)恒外压为终态压力下膨胀;(4)恒温下先以恒外压等于气体体积为0.05m 3时的压力膨胀至0.05 m 3,再以恒外压等于终态压力下膨胀至0.1m 3。
求诸过程体系所做的体积功。
大学二年级物理化学(AB)课件-物理化学公式集(傅献彩_南京大学第5版)

感谢喧嚣 把你高高卷起 砸向这一处静逸 惊翻了我的万卷 和其中的一字一句 幸遇只因这一次
被你拥抱过,览了 被你默诵过,懂了 被你翻开又合起 被你动了奶酪和心思
不舍你的过往 和过往的你 记挂你的现今 和现今的你 遐想你的将来 和将来的你 难了难了 相思可以这一世
【幸遇•书屋】
你来,或者不来 我都在这里,等你、盼你 等你婉转而至 盼你邂逅而遇
你想,或者不想 我都在这里,忆你、惜你 忆你来时莞尔 惜你别时依依
你忘,或者不忘 我都在这里,念你、羡你 念你袅娜身姿 羡你悠然书气
人生若只如初见 任你方便时来 随你心性而去 却为何,有人 为一眼而愁肠百转 为一见而不远千里
nR -1
(T1—T2)
热机效率:η= T2-T1 T2
冷冻系数:β=-Q1/W
可逆制冷机冷冻系数:β= T1 T2- T1
焦汤系数:
μJ-T=
T p
H
=-
H p
Cp
T
实际气体的ΔH和ΔU:
ΔU= U dT + U dV
T V
V T
ΔH=
H T
P
dT
+
H p
T
d
p
化学反应的等压热效应与等容热效应的关系:Qp=QV+ΔnRT
dT
RT 2
(3)外压对蒸汽压的影响:ln
pg
p
g
= Vm l
RT
p
e-p
g
pg是在惰性气体存在总
压为pe时的饱和蒸汽压。
吉不斯-杜亥姆公式:SdT-Vdp+ n Bd B =0 B
dU=TdS-pdV+ n Bd B B
大学二年级物理化学(AB)课件-物理化学概念及术语

感谢喧嚣 把你高高卷起 砸向这一处静逸 惊翻了我的万卷 和其中的一字一句 幸遇只因这一次
被你拥抱过,览了 被你默诵过,懂了 被你翻开又合起 被你动了奶酪和心思
不舍你的过往 和过往的你 记挂你的现今 和现今的你 遐想你的将来 和将来的你 难了难了 相思可以这一世
厦门大学二年级
物理化学AB
课件
----------------------------- 赠予 ------------------------
----------------------------- 谢谢 ------------------------
物理化学概念及Βιβλιοθήκη 语ABC D E F G H I JK LM N O PQ R ST U VWX YZ
概念及术语.......................................................................................................................................................................16 BET 公式 BET formula....................................................................................................................................... 16 DLVO 理论 DLVO theory...............................................................
物理化学课件及考试习题 试卷 答案第4章 多组分系统热力学习题及答案

第三章多组分系统热力学一、填空题1、只有系统的____性质才具有偏摩尔量.而偏摩尔量自身是系统的____性质。
偏摩尔量的值与系统中各组分的浓度____。
混合适物系统中各组分的同一偏摩尔量间具有两个重要的性质,分别是____与____。
2、如同温度是热传导的推动力一样,化学势是____传递的推动力.在恒温恒压下多相平衡的条件是________________.以焓表示的组分i的化学势可写成µi=____.3、混合理想气体中任一组分B的化学势________;理想溶液中任一组分B的化学势________;稀溶液中溶剂A的化学势________。
4、由纯组分在恒温恒压下组成理想混合物时,△mix S=__0;△mix G__0;△mix H__0;△ix V__0。
5、理想溶液混合时,∆mix V,∆mix S,∆mix G,∆mix H。
6、比较水的化学势的大小(此处p=101。
325kPa):(填〉、〈或=)①μ(l,100℃,p)____μ(g,100℃,p)②μ(l,100℃,p)____μ(l,100℃,2p)③μ(g,100℃,p)____μ(g,100℃,2p)④μ(l,100℃,2p)____μ(g,100℃,2p)⑤μ(l,101℃,p)____μ(g,101℃,p)7、非理想溶液溶质的化学势表示式____,其标准态为____。
8、在一定的温度及压力下,某物质液汽两相达平衡,则两相的化学势μB(l)与μB(g)_____若维持压力不变,升高温度,则μB(l)和μB(g)都______;但μB(l)比μB(g)______。
9、理想溶液中任意组分B的化学势:μB=_______________.10、298K、101。
325kPa,有两瓶萘的苯溶液,第一瓶为2升,溶有0.5mol萘,第二瓶为1升,溶有0.25mol 萘,若以μ1和μ2表示两瓶中萘的化学势,则它们的关系为__________。
物理化学习题及答案

物理化学习题及答案篇一:物理化学课后习题答案第1章化学热力学基本定律1.1mol双原子理想气体在300 K、101 kPa下,经恒外压恒温压缩至平衡态,并从此状态下恒容升温至370 K、压强为1 010 kPa。
求整个过程的?U、?H、W及Q。
(答案:△U = 1455 J,△H = 2037 J,W=17727 J,Q = -16272 J)解:第一步:恒外压恒温压缩至平衡态,?U=0,?H=0V1=×300/101=,此平衡态的体积就是末态的体积V2, V2=×370/1010=此平衡态的压强P’=×300/(×10-3)=W=-P’(V2-V1)=-×103×()×10-3 =17727 J= kJ-Q=W= kJ Q=- kJ第一步:因恒容W=0?U=Qv=Cv,m(T2-T1) =×(370-300)= J= kJ?H=(+R)×70= J= kJ整个过程:W= kJ;Q= -+= - kJ;?U= kJ ;?H= kJ。
2.设有 kg N2,温度为 K,压强为101325 Pa,分别进行下列过程,求?U、?H、Q及W。
(1) 恒容加热至压强为 Pa; (2) 恒压膨胀至原体积的2倍;(3) 恒温可逆膨胀至原体积的2倍; (4) 绝热可逆膨胀至原体积的2倍。
(答案:①△U = QV = ×104 J,△H = ×104 J,W = 0;②△H = QP = kJ,△U = kJ,W= - kJ;③ Q = 5622 J ,W = -5622 J,△H = △U = 0 J;④ Q = 0,W = △U = -4911 J,△H = - 6875 J)解:将N2 气视为双原子理想气体,则Cp,m= J·mol-1·K-1;Cv,m= J·mol-1·K-1(1) W=0, 末态温度 T2==× K∴?U=Qv=n Cv(T2-T1) =(100/28)××(×)=×104 J?H= n Cp(T2-T1) =(100/28)××(×)=×104 J(2) 末态温度 T2=2T1=2×?H=Qp= n Cp(T2-T1) =(100/28)××(2×) =28388 J= kJ?U=n Cv(T2-T1) =(100/28)×× = 20201 J= kJW= -P?V= -101325×(100/28)××/101325= -8110J= -(3) 理想气体恒温,?H=?U=0,W= -Q= -(100/28)×××ln2= -5622 J= - kJ(4) 运用理想气体绝热过程方程:?T2=(1/2)×T1=(1/2)× =207 K;Q=0W=?U= n Cv,m?T= (100/28)××()= -4911 J= - kJ?H= (100/28)××()=-6875 J= - kJ3.在 K、101325 Pa下,1 mol水缓慢蒸发。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
() () () () ()
30、绝热过程 Q = 0,即
,所以 dS = 0。
()
31、可以用一过程的熵变与热温熵的大小关系判断其自发性。
()
32、绝热过程 Q = 0,而由于 H = Q,因而 H 等于零。
()
33、按 Clausius 不等式,热是不可能从低温热源传给高温热源的。
()
34、在一绝热体系中,水向真空蒸发为水蒸气 (以水和水蒸气为体系),该过程 W>0,U
()
12、 系统从同一始态出发,经绝热不可逆过程到达的终态,若经绝热可逆过程,则一定达
不到此终态。
()
13、 热力学第二定律的克劳修斯说法是:热从低温物体传到高温物体是不可能的。( )
14、系统经历一个不可逆循环过程,其熵变> 0。
()
15、系统由状态 1 经定温、定压过程变化到状态 2,非体积功 W’<0,且有 W G 和 G <0,
(
)
5、 系统处于热力学平衡态时,其所有的宏观性质都不随时间而变。
()
6、 若系统的所有宏观性质均不随时间而变,则该系统一定处于平衡态。
()
7、 隔离系统的热力学能是守恒的。
()
8、隔离系统的熵是守恒的。
()
9、 一定量理想气体的熵只是温度的函数。
()
10、 绝热过程都是定熵过程。
()
11、 一个系统从始态到终态,只有进行可逆过程才有熵变。
晨起凭栏眺 但见云卷云舒 风月乍起 春寒已淡忘 如今秋凉甚好 几度眼迷离
感谢喧嚣 把你高高卷起 砸向这一处静逸 惊翻了我的万卷 和其中的一字一句 幸遇只因这一次
被你拥抱过,览了 被你默诵过,懂了 被你翻开又合起 被你动了奶酪和心思
不舍你的过往 和过往的你 记挂你的现今 和现今的你 遐想你的将来 和将来的你 难了难了 相思可以这一世
绝热压缩过程的终态体积 V’,则 V’
V。(选择填> 、= 、< )
2、已知 fHmΘ(CH3OH,l,298K)= -238.57kJ/mol,fHmΘ(CO,g,298K)= -110.525kJ/mol
则 反 应 CO(g)+2H2(g)==CH3OH(l) 的 rHm Θ (298K)=
, rHm Θ
【幸遇•书屋】
你来,或者不来 我都在这里,等你、盼你 等你婉转而至 盼你邂逅而遇
你想,或者不想 我都在这里,忆你、惜你 忆你来时莞尔 惜你别时依依
你忘,或者不忘 我都在这里,念你、羡你 念你袅娜身姿 羡你悠然书气
Hale Waihona Puke 人生若只如初见 任你方便时来 随你心性而去 却为何,有人 为一眼而愁肠百转 为一见而不远千里
>0。
()
35、体系经过一不可逆循环过程,其 S 体>0。 36、对于气态物质,Cp-CV = nR。
() ()
37、在一绝热体系中有一隔板,两边分别是空气和真空,抽去隔板,空气向真空膨胀,此时
Q = 0,所以 S=0。
()
二、填空题:
1、 一定量的理想气体由同一始态压缩至同一压力 p,定温压缩过程的终态体积为 V,可逆
节流膨胀前温度。(第二空选答高于、低于或等于)
5、理想气体在定温条件下向真空膨胀,U
0, H
0,S
0。(选
择填>, <, =)
6、热力学第三定律的普朗克说法的数学表达式为
21、焓的增加量 H 等于该过程中体系从环境吸收的热量。
()
22、一个绝热过程 Q = 0,但体系的 T 不一定为零。
()
23、对于一定量的理想气体,温度一定,热力学能和焓也随之确定。
()
24、某理想气体从始态经定温和定容两过程达终态,这两过程的 Q、W、U 及 H 是相等的。
()
1
25、任何物质的熵值是不可能为负值和零的。 26、功可以全部转化为热,但热不能全部转化为功。 27、不可逆过程的熵变是不可求的。 28、某一过程的热效应与温度相除,可以得到该过程的熵变。 29、在孤立体系中,一自发过程由 A→B,但体系永远回不到原来状态。
则此状态变化一定能发生。
()
16、绝热不可逆膨胀过程中 S >0,则其相反的过程即绝热不可逆压缩过程中 S <0。( )
17、 临界温度是气体加压液化所允许的最高温度。
()
18、可逆的化学反应就是可逆过程。
()
19、Q 和 W 不是体系的性质,与过程有关,所以 Q + W 也由过程决定。
()
20、焓的定义式 H = U + pV 是在定压条件下推导出来的,所以只有定压过程才有焓变。( )
热力学
一、判断题:
1、在定温定压下,CO2 由饱和液体转变为饱和蒸气,因温度不变, CO2 的热力学能和焓也
不变。
(
)
2、25℃时 H2(g)的标准摩尔燃烧焓等于 25℃时 H2O(g)的标准摩尔生成焓。
(
)
3、稳定态单质的ΔfHmΘ(800K)=0 。
(
)
4、dU=nCv,mdT 公式对一定量的理想气体的任何 pVT 过程都适用。
----------------------------- 谢谢 ------------------------
《物理化学》学习辅导材料之一
物理化学学习指导书
(《物理化学》备课组)
编者的话:为了更好地帮助同学复习巩固所学的基本概念、基本理论和基本知识,我们选 编了一些“复习思考题”供同学们选作,请同学们发现问题后及时向我们提出来,对于 不够完善之处今后将逐步完善,对于错误之处将予以修正。
(298K)=
。
3、25 ℃ C2H4(g)的 cHmΘ= -1 410.97kJ/mol ;CO2(g)的 fHmΘ= -393.51kJ/mol ,H2O(l)
的 fHmΘ= -285.85kJ/mol;则 C2H4(g)的 fHmΘ=
。
def 4、焦耳-汤姆孙系数 J-T
,J-T>0 表示节流膨胀后温度
厦门大学二年级
物理化学AB
课件
----------------------------- 赠予 ------------------------
