晶面和体心立方晶体
三种晶体结构的最密排晶面和最密排晶向

三种晶体结构的最密排晶面和最密排晶向1.引言1.1 概述晶体是具有长程有序排列的原子、离子或分子的固体物质。
晶体的结构是由最密排列的晶面和晶向构成的。
最密排晶面是指在晶体结构中,原子、离子或分子最紧密地靠近的面,而最密排晶向则指的是在晶体中最紧密地排列的方向。
本文将分析三种不同的晶体结构,探讨它们各自的最密排晶面和最密排晶向。
通过深入研究这些结构的排列方式,可以更好地理解晶体的性质和行为。
第一种晶体结构是立方晶系,也是最简单的晶体结构之一。
它的最密排晶面是(111)晶面,最密排晶向则是[110]晶向。
这些晶面和晶向在晶体中具有紧密的排列,使晶体的结构呈现出高度的对称性。
第二种晶体结构是六方晶系,它相对于立方晶系而言稍复杂一些。
在六方晶系中,最密排晶面是(0001)晶面,最密排晶向是[10-10]晶向。
与立方晶系不同,六方晶系具有六方对称性,呈现出更复杂的晶体结构。
第三种晶体结构是四方晶系,它也是一种常见的晶体结构。
在四方晶系中,最密排晶面是(100)晶面,最密排晶向是[110]晶向。
四方晶系的晶体结构与立方晶系相似,但具有更多的对称性和排列方式。
通过对这三种晶体结构的最密排晶面和最密排晶向进行研究,我们可以更好地理解晶体的基本结构和性质。
这对于材料科学、凝聚态物理和相关领域的研究具有重要意义,同时也有助于开发新材料和改进现有材料的性能。
1.2文章结构文章结构部分的内容可以包括以下几个方面的介绍:1.2 文章结构本文主要分为引言、正文和结论三个部分。
引言部分概述了晶体结构和最密排晶面、最密排晶向的研究背景和重要性,并提出了本文研究的目的和意义。
正文部分分为三个小节,分别介绍了三种晶体结构的最密排晶面和最密排晶向。
每个小节将首先介绍该种晶体结构的一般特点和常见应用,然后详细讨论最密排晶面和最密排晶向的确定方法和规律,并给出具体的实例和数据进行说明。
结论部分对于每种晶体结构的最密排晶面和最密排晶向进行总结和回顾,并指出各种晶体结构最密排晶面和最密排晶向的综合特点和应用前景。
晶面和体心立方晶体

当外部条件(如温度、压力)发生变化时,晶体可能会发生相变 ,即晶体结构发生改变。
影响晶体形成的因素
杂质
熔体或气相中的杂质可能会影响晶体的形成,如改变晶体的成分、 影响晶体的生长速度等。
温度梯度
熔体或气相中的温度梯度会影响原子或分子的扩散速度,从而影响 晶体的生长。
压力梯度
熔体或气相中的压力梯度会影响原子或分子的流动速度,从而影响晶 体的生长。
晶面是晶体结构中的基本单元之一, 它决定了晶体材料的物理和化学性质 。
分类
Hale Waihona Puke 根据晶面与晶体轴向之间的关系,晶面可以分为极面和非极 面两类。极面是指与晶体轴向平行的晶面,而非极面则与晶 体轴向垂直。
根据晶面与晶体表面之间的关系,晶面又可以分为切面、磨 面和抛光面等类型。切面是指将晶体切开后形成的平面,磨 面是指通过研磨获得的平面,抛光面则是指通过抛光技术获 得的平面。
晶面与体心立方晶体的应用
材料科学
利用晶面和体心立方晶体独特的物理、化学和机 械性质,可以开发新型材料和器件。
电子学
某些特定晶面的导电性能优异,可用于制造高性 能电子器件。
催化领域
具有特定晶面的体心立方晶体可以作为催化剂, 提高化学反应的效率和选择性。
04
CATALOGUE
体心立方晶体的形成
形成条件
在物理科学研究中的应用
01
固体物理
体心立方晶体结构是固体物理研究的重要对象之一,通过对体心立方晶
体的研究,可以深入了解晶体的能带结构、电子结构和光学性质等。
02
原子分子物理
体心立方晶体结构中的原子或分子的排列方式,可以模拟和研究原子分
子之间的相互作用和运动规律。
常见的晶体结构及其原胞晶胞

§1-2 常见的晶体结构及其原胞、晶胞1) 简单晶体的简单立方(simple cubic, sc) 它所构成的晶格为布喇菲格子。
例如氧、硫固体。
基元为单一原子结构的晶体叫简单晶体。
其特点有: 三个基矢互相垂直(),重复间距相等,为a,亦称晶格常数。
其晶胞=原胞;体积= ;配位数(第一近邻数) =6。
(见图1-7)图1-7简单立方堆积与简单立方结构单元2) 简单晶体的体心立方( body-centered cubic, bcc ) , 例如,Li,K,Na,Rb,Cs,αFe,Cr,Mo,W,Ta,Ba等。
其特点有:晶胞基矢, 并且,其惯用原胞基矢由从一顶点指向另外三个体心点的矢量构成:(见图1-9 b)(1-2)其体积为;配位数=8;(见图1-8)图1-8体心立方堆积与体心立方结构单元图1-9简单立方晶胞(a)与体心立方晶胞、惯用原胞(b)3) 简单晶体的面心立方( face-centered cubic, fcc ) , 例如,Cu,Ag,Au,Ni,Pd,Pt,Ne, Ar, Xe, Rn, Ca, Sr, Al等。
晶胞基矢,并且每面中心有一格点, 其原胞基矢由从一顶点指向另外三个面心点的矢量构成(见图1-10 b):(1-3)其体积=;配位数=12。
,(见图1-10)图1-10面心立方结构(晶胞)(a)与面心立方惯用原胞(b)4) NaCl结构(Sodium Chloride structure),复式面心立方(互为fcc),配位数=6(图1-11 a)。
表1-1 NaCl结构晶体的常数5) CsCl结构(Cesuim Chloride structure),复式简单立方(互为sc),配位数=8(图1-11 b)。
表1-2 CsCl结构晶体的常数图1-11 NaCl结构和CsCl结构6) 金刚石结构(Diamond structure), 两套fcc格子相互沿对角线位移1/4处套合。
体心立方晶胞特征

二、 固溶体
4、 间隙固溶体 (1)组成:原子半径较小(小于0.1nm)的非 金属元素溶入金属晶体的间隙。 (2)影响因素:原子半径和溶剂结构。 (3)溶解度:一般都很小,只能形成有限固 溶体。
二、固溶体
5、 固溶体的性能 无论置换固溶体,还是间隙固溶体,由于溶质原 子的存在都会使晶格发生畸变,使其性能不同于 原纯金属。
常见金属
具有这种晶格的金属有镁(Mg)、镉(Cd)、 锌(Zn)、铍(Be)等。
原子个数
晶胞原子数:6
原子半径
原子半径: R=a/2
致密度:0.74 (74%) 配位数:12 空隙半径: 四面体空隙 其半径为: r四=0.225r原子 八面体空隙 其半径为: r八=0.414r原子
单晶体与多晶体
第三节 合金的相结构
一、基本概念
1 合金 (1)合金:两种或两种以上的金属与金属, 或金属与非金属经一定方法合成的具有金属特性 的物质。 (2)组元:组成合金最基本的物质。可以是 元素,也可以是化合物。 (如一元、二元、三元 合金〕 (3)合金系:给定合金以不同的比例而合成 的一系列不同成分合金的总称。如Fe-C,Fe-Cr等。
晶胞(或晶格)中有68%的体积被原子所占据, 其余为 空隙。
间隙半径
若在晶胞空隙中放入刚 性球, 则能放入球的最大 半径为空隙半径。体心 立方晶胞中有两种空隙。 四面体空隙 其半径为: r四=0.29r原子 八面体空隙 其半径为: r八=0.15r原子
2、面心立方晶格( FCC) 原子排列方式 常见金属 原子个数 原子半径 配位数 致密度
平行晶面:指数相同,或数字相同但正负
号相反;
晶面族
晶 面 族 : 晶体 中具 有 相 同 条 件( 原子 排 列 和 晶 面间 距完 全 相 同 ) ,空 间位 向不同的各组晶面。 用 {hkl} 表示。 如在 立方晶胞中 (111) 、 ( 111 ) 、 (111 ) 、 ( 111 ) 同属{111}晶 面族。
晶体学习题与答案

一、 名词解释(1)阵点;(2)(空间)点阵;(3)晶体结构;(4)晶胞;(5)晶带轴;二、填空(1)晶体中共有 种空间点阵,属于立方晶系的空间点阵有 三种。
(2)对于立方晶系,晶面间距的计算公式为 。
(3){110}晶面族包括 等晶面。
(4){h 1k 1l 1}和{h 2k 2l 2}两晶面的晶带轴指数[u v w]为 。
(5)(110)和(11-0)晶面的交线是 ;包括有[112]和[123]晶向的晶面是 。
三、计算及简答(1)原子间的结合键共有几种?各自有何特点?(2)在立方晶系的晶胞中,画出(111)、(112)、(011)、(123)晶面和[111]、[101]、[111-]晶向。
(3)列出六方晶系{101-2} 晶面族中所有晶面的密勒指数,并绘出(101-0)、(112-0)晶面和〔112-0〕晶向。
(4)试证明立方晶系的〔111〕晶向垂直于(111)晶面。
(5)绘图指出面心立方和体心立方晶体的(100)、(110)、及(111)晶面,并求其面间距;试分别指出两种晶体中,哪一种晶面的面间距最大?(6)在立方晶系中,(1-10)、(3-11)、(1-3-2)晶面是否属于同一晶带?如果是,请指出其晶带轴;并指出属于该晶带的任一其他晶面。
(7)写出立方晶系的{111}、{123}晶面族和<112>晶向族中的全部等价晶面和晶向的具体指数。
(8)计算立方晶系中(111)和〔111-〕两晶面间的夹角。
(9)若采用四轴坐标系标定六方晶体的晶向指数,应该有什么约束条件?为什么?答 案二、填空(1)14 简单、体心、面心(2)222hkl d h k l =++(3) (110)、(101)、(011)、(1-10)、(1-01) 、(01-1) (4)1122k l u k l =;1122l h v l h =;1122h k w h k = (5)〔001〕 (111-)三、简答及计算(1)略(2)(3){101-2}晶面的密勒指数为(101-2)、(1-012)、(01-12)、(011-2)、(1-102)、(11-02)。
西南工业大学材料科学与基础第三版(刘智恩)习题解析

第一章原子排列1. 作图表示立方晶系中的(123),(012),(421)晶面和[102],[211],[346]晶向.附图1-1 有关晶面及晶向2. 分别计算面心立方结构与体心立方结构的{100},{110}和{111}晶面族的面间距, 并指出面间距最大的晶面(设两种结构的点阵常数均为a).解由面心立方和体心立方结构中晶面间的几何关系, 可求得不同晶面族中的面间距如附表1-1所示.附表1-1 立方晶系中的晶面间距显然, FCC中{111}晶面的面间距最大, 而BCC中{110}晶面的面间距最大.注意: 对于晶面间距的计算, 不能简单地使用公式, 应考虑组成复合点阵时, 晶面层数会增加.3. 分别计算fcc和bcc中的{100},{110}和{111}晶面族的原子面密度和<100>,<110>和<111>晶向族的原子线密度, 并指出两种结构的差别. (设两种结构的点阵常数均为a)解原子的面密度是指单位晶面内的原子数; 原子的线密度是指晶面上单位长度所包含的原子数. 据此可求得原子的面密度和线密度如附表1-2所示.附表1-2 立方晶系中原子的面密度和线密度可见, 在BCC 中, 原子密度最大的晶面为{110}, 原子密度最大的晶向为<111>; 在FCC 中, 原子密度最大的晶面为{111}, 原子密度最大的晶向为<110>. 4. 在(0110)晶面上绘出[2113]晶向. 解 详见附图1-2.附图1-2 六方晶系中的晶向5. 在一个简单立方二维晶体中, 画出一个正刃型位错和一个负刃型位错. 试求: (1) 用柏氏回路求出正、负刃型位错的柏氏矢量.(2) 若将正、负刃型位错反向时, 说明其柏氏矢量是否也随之反向.(3) 具体写出该柏氏矢量的方向和大小.(4) 求出此两位错的柏氏矢量和.解 正负刃型位错示意图见附图1-3(a)和附图1-4(a).(1) 正负刃型位错的柏氏矢量见附图1-3(b)和附图1-4(b).(2) 显然, 若正、负刃型位错线反向, 则其柏氏矢量也随之反向.(3) 假设二维平面位于YOZ坐标面, 水平方向为Y轴, 则图示正、负刃型位错方向分别为[010]和[010], 大小均为一个原子间距(即点阵常数a).(4) 上述两位错的柏氏矢量大小相等, 方向相反, 故其矢量和等于0.6. 设图1-72所示立方晶体的滑移面ABCD平行于晶体的上下底面, 该滑移面上有一正方形位错环. 如果位错环的各段分别与滑移面各边平行, 其柏氏矢量b // AB, 试解答:(1) 有人认为“此位错环运动离开晶体后, 滑移面上产生的滑移台阶应为4个b”, 这种说法是否正确? 为什么?(2) 指出位错环上各段位错线的类型, 并画出位错移出晶体后, 晶体的外形、滑移方向和滑移量. (设位错环线的方向为顺时针方向)图1-72 滑移面上的正方形位错环附图1-5 位错环移出晶体引起的滑移解 (1) 这种看法不正确. 在位错环运动移出晶体后, 滑移面上下两部分晶体相对移动的距离是由其柏氏矢量决定的. 位错环的柏氏矢量为b, 故其相对滑移了一个b 的距离.(2) A ′B ′为右螺型位错, C ′D ′为左螺型位错, B ′C ′为正刃型位错, D ′A ′为负刃型位错. 位错运动移出晶体后滑移方向及滑移量见附图1-5.7. 设面心立方晶体中的(111)晶面为滑移面, 位错滑移后的滑移矢量为[110]2a.(1) 在晶胞中画出此柏氏矢量b 的方向并计算出其大小.(2) 在晶胞中画出引起该滑移的刃型位错和螺型位错的位错线方向, 并写出此二位错线的晶向指数.解 (1) 柏氏矢量等于滑移矢量, 因此柏氏矢量的方向为[110], /2. (2) 刃型位错与柏氏矢量垂直, 螺型位错与柏氏矢量平行, 晶向指数分别为[112]和[110], 详见附图1-6.附图1-6 位错线与其柏氏矢量、滑移矢量 8. 若面心立方晶体中有[101]2ab =的单位位错及[121]6ab =的不全位错, 此二位错相遇后产生位错反应.(1) 此反应能否进行? 为什么?(2) 写出合成位错的柏氏矢量, 并说明合成位错的性质. 解 (1) 能够进行. 因为既满足几何条件:[111]3abb==∑∑后前, 又满足能量条件: .22222133ba ba =>=∑∑后前.(2) [111]3ab =合, 该位错为弗兰克不全位错.9. 已知柏氏矢量的大小为b = 0.25nm, 如果对称倾侧晶界的取向差θ = 1° 和10°, 求晶界上位错之间的距离. 从计算结果可得到什么结论? 解 根据bD θ≈, 得到θ = 1°,10° 时, D ≈14.3nm, 1.43nm. 由此可知, θ = 10° 时位错之间仅隔5~6个原子间距, 位错密度太大, 表明位错模型已经不适用了. 第二章 固体中的相结构1. 已知Cd, In, Sn, Sb 等元素在Ag 中的固熔度极限(摩尔分数)分别为0.435, 0.210, 0.130, 0.078; 它们的原子直径分别为0.3042 nm, 0.314 nm, 0.316 nm, 0.3228 nm; Ag 的原子直径为0.2883 nm. 试分析其固熔度极限差异的原因, 并计算它们在固熔度极限时的电子浓度.答: 在原子尺寸因素相近的情况下, 熔质元素在一价贵金属中的固熔度(摩尔分数)受原子价因素的影响较大, 即电子浓度e/a 是决定固熔度(摩尔分数)的一个重要因素, 而且电子浓度存在一个极限值(约为1.4). 电子浓度可用公式A B B B (1)c Z x Z x =-+ 计算. 式中, ZA, ZB 分别为A, B 组元的价电子数; xB 为B 组元的摩尔分数. 因此, 随着熔质元素价电子数的增加, 极限固熔度会越来越小.Cd, In, Sn, Sb 等元素与Ag 的原子直径相差不超过15%(最小的Cd 为5.5%, 最大的Sb 为11.96%), 满足尺寸相近原则, 这些元素的原子价分别为2, 3, 4, 5价, Ag 为1价, 据此推断它们的固熔度极限越来越小, 实际情况正好反映了这一规律; 根据上面的公式可以计算出它们在固熔度(摩尔分数)极限时的电子浓度分别为1.435, 1.420, 1.390, 1.312.2. 碳可以熔入铁中而形成间隙固熔体, 试分析是α-Fe 还是γ-Fe 能熔入较多的碳. 答: α-Fe 为体心立方结构, 致密度为0.68; γ-Fe 为面心立方结构, 致密度为0.74. 显然, α-Fe中的间隙总体积高于γ-Fe, 但由于α-Fe的间隙数量多, 单个间隙半径却较小, 熔入碳原子将会产生较大的畸变, 因此, 碳在γ-Fe中的固熔度较α-Fe的大. 3. 为什么只有置换固熔体的两个组元之间才能无限互熔, 而间隙固熔体则不能? 答: 这是因为形成固熔体时, 熔质原子的熔入会使熔剂结构产生点阵畸变, 从而使体系能量升高. 熔质原子与熔剂原子尺寸相差越大, 点阵畸变的程度也越大, 则畸变能越高, 结构的稳定性越低, 熔解度越小. 一般来说, 间隙固熔体中熔质原子引起的点阵畸变较大, 故不能无限互熔, 只能有限熔解.第三章凝固1. 分析纯金属生长形态与温度梯度的关系.答: 纯金属生长形态是指晶体宏观长大时固-液界面的形貌. 界面形貌取决于界面前沿液相中的温度梯度.(1) 平面状长大: 当液相具有正温度梯度时, 晶体以平直界面方式推移长大. 此时, 界面上任何偶然的、小的凸起深入液相时, 都会使其过冷度减小, 长大速率降低或停止长大, 而被周围部分赶上, 因而能保持平直界面的推移. 长大过程中晶体沿平行温度梯度的方向生长, 或沿散热的反方向生长, 而其它方向的生长则受到限制.(2) 树枝状长大: 当液相具有负温度梯度时, 晶体将以树枝状方式生长. 此时, 界面上偶然的凸起深入液相时, 由于过冷度的增大, 长大速率越来越大; 而它本身生长时又要释放结晶潜热, 不利于近旁的晶体生长, 只能在较远处形成另一凸起. 这就形成了枝晶的一次轴, 在一次轴成长变粗的同时, 由于释放潜热使晶枝侧旁液体中也呈现负温度梯度, 于是在一次轴上又会长出小枝来, 称为二次轴, 在二次轴上又长出三次轴……由此而形成树枝状骨架, 故称为树枝晶(简称枝晶).2. 简述纯金属晶体长大机制及其与固-液界面微观结构的关系.答: 晶体长大机制是指晶体微观长大方式, 即液相原子添加到固相的方式, 它与固-液界面的微观结构有关.(1) 垂直长大方式: 具有粗糙界面的物质, 因界面上约有50%的原子位置空着, 这些空位都可以接受原子, 故液相原子可以进入空位, 与晶体连接, 界面沿其法线方向垂直推移, 呈连续式长大.(2) 横向(台阶)长大方式: 包括二维晶核台阶长大机制和晶体缺陷台阶长大机制, 具有光滑界面的晶体长大往往采取该方式. 二维晶核模式, 认为其生长主要是利用系统的能量起伏, 使液相原子在界面上通过均匀形核形成一个原子厚度的二维薄层状稳定的原子集团, 然后依靠其周围台阶填充原子, 使二维晶核横向长大, 在该层填满后, 则在新的界面上形成新的二维晶核, 继续填满, 如此反复进行.晶体缺陷方式, 认为晶体生长是利用晶体缺陷存在的永不消失的台阶(如螺型位错的台阶或挛晶的沟槽)长大的. 第四章 相图1. 在Al-Mg 合金中, xMg 为0.15, 计算该合金中镁的wMg 为多少.解 设Al 的相对原子量为MAl, 镁的相对原子量为MMg, 按1mol Al-Mg 合金计算, 则镁的质量分数可表示为Mg MgMg Al Al Mg Mg100%x M w x M x M =⨯+.将xMg = 0.15, xAl = 0.85, MMg = 24, MAl = 27代入上式中, 得到wMg = 13.56%.2. 根据图4-117所示二元共晶相图, 试完成:(1) 分析合金I, II 的结晶过程, 并画出冷却曲线.(2) 说明室温下合金I, II 的相和组织是什么, 并计算出相和组织组成物的相对量.(3) 如果希望得到共晶组织加上相对量为5%的β初 的合金, 求该合金的成分.图4-117 二元共晶相图 附图4-1 合金I 的冷却曲线 附图4-2 合金II 的冷却曲线解 (1) 合金I 的冷却曲线参见附图4-1, 其结晶过程如下:1以上, 合金处于液相;1~2时, 发生匀晶转变L →α, 即从液相L 中析出固熔体α, L 和α的成分沿液相线和固相线变化, 达到2时, 凝固过程结束;2时, 为α相;2~3时, 发生脱熔转变, α→βII.合金II 的冷却曲线参见附图4-2, 其结晶过程如下:1以上, 处于均匀液相;1~2时, 进行匀晶转变L →β;2时, 两相平衡共存, 0.50.9L β;2~2时,剩余液相发生共晶转变0.50.20.9L βα+;2~3时, 发生脱熔转变α→βII.(2) 室温下, 合金I 的相组成物为α + β, 组织组成物为α + βII.相组成物相对量计算如下:αβ0.900.20100%82%0.900.050.200.05100%18%0.900.05w w -=⨯=--=⨯=-组织组成物的相对量与相的一致.室温下, 合金II 的相组成物为α + β, 组织组成物为β初 + (α+β).相组成物相对量计算如下:αβ0.900.80100%12%0.900.050.800.05100%88%0.900.05w w -=⨯=--=⨯=-组织组成物相对量计算如下:β(α+β)0.800.50100%75%0.900.500.900.80100%25%0.900.50w w -=⨯=--=⨯=-初(3) 设合金的成分为wB = x, 由题意知该合金为过共晶成分, 于是有β0.50100%5%0.900.50x w -=⨯=-初所以, x = 0.52, 即该合金的成分为wB = 0.52.3. 计算wC 为0.04的铁碳合金按亚稳态冷却到室温后组织中的珠光体、二次渗碳体和莱氏体的相对量, 并计算组成物珠光体中渗碳体和铁素体及莱氏体中二次渗碳体、共晶渗碳体与共析渗碳体的相对量.解 根据Fe-Fe3C 相图, wC = 4%的铁碳合金为亚共晶铸铁, 室温下平衡组织为 P + Fe3CII + Ld ′, 其中P 和Fe3CII 系由初生奥氏体转变而来, 莱氏体则由共晶成分的液相转变而成, 因此莱氏体可由杠杆定律直接计算, 而珠光体和二次渗碳体则可通过两次使用杠杆定律间接计算出来. Ld ′ 相对量: dL 4 2.11100%86.3%4.3 2.11w '-=⨯=-.Fe3CII相对量:3II Fe C 4.34 2.110.77100% 3.1%4.3 2.11 6.690.77w --=⨯⨯=--.P相对量:P 4.34 6.69 2.11100%10.6%4.3 2.11 6.690.77w --=⨯⨯=--.珠光体中渗碳体和铁素体的相对量的计算则以共析成分点作为支点, 以wC = 0.001%和wC = 6.69%为端点使用杠杆定律计算并与上面计算得到的珠光体相对量级联得到. P 中F 相对量:F P 6.690.77100%9.38%6.690.001w w -=⨯⨯=-.P 中Fe3C 相对量:3Fe C 10.6%9.38% 1.22%w =-=.至于莱氏体中共晶渗碳体、二次渗碳体及共析渗碳体的相对量的计算, 也需采取杠杆定律的级联方式, 但必须注意一点, 共晶渗碳体在共晶转变线处计算, 而二次渗碳体及共析渗碳体则在共析转变线处计算. Ld ′ 中共晶渗碳体相对量: dCm L 4.3 2.11100%41.27%6.69 2.11w w '-=⨯⨯=-共晶Ld ′ 中二次渗碳体相对量: dCm L 6.69 4.3 2.110.77100%10.2%6.69 2.11 6.690.77w w '--=⨯⨯⨯=--IILd ′ 中共析渗碳体相对量:dCm L 6.69 4.3 6.69 2.110.770.0218100% 3.9%6.69 2.11 6.690.77 6.690.0218w w '---=⨯⨯⨯⨯=---共析4. 根据下列数据绘制Au-V 二元相图. 已知金和钒的熔点分别为1064℃和1920℃.金与钒可形成中间相β(AuV3); 钒在金中的固熔体为α, 其室温下的熔解度为wV = 0.19; 金在钒中的固熔体为γ, 其室温下的熔解度为wAu = 0.25. 合金系中有两个包晶转变, 即1400V V V 1522V V V (1) β(0.4)L(0.25)α(0.27)(2) γ(0.52)L(0.345)α(0.45)w w w w w w =+===+==℃℃解 根据已知数据绘制的Au-V 二元相图参见附图4-3.附图4-3 Au-V 二元相图 第五章 材料中的扩散1. 设有一条直径为3cm 的厚壁管道, 被厚度为0.001cm 的铁膜隔开, 通过输入氮气以保持在膜片一边氮气浓度为1000 mol/m3; 膜片另一边氮气浓度为100 mol/m3. 若氮在铁中700℃时的扩散系数为4×10-7 cm2 /s, 试计算通过铁膜片的氮原子总数. 解设铁膜片左右两边的氮气浓度分别为c1, c2, 则铁膜片处浓度梯度为7421510010009.010 mol /m 110c c c c x x x --∂∆-≈===-⨯∂∆∆⨯根据扩散第一定律计算出氮气扩散通量为722732410(10)(9.010) 3.610 mol/(m s)cJ Dx---∂=-=-⨯⨯⨯-⨯=⨯∂于是, 单位时间通过铁膜片的氮气量为3-22-63.610(310) 2.5410 mol/s4J A π-=⨯⨯⨯⨯=⨯最终得到单位时间通过铁膜片的氮原子总数为-62318-1A () 2.5410 6.02102 3.0610 s N J A N =⨯=⨯⨯⨯⨯=⨯第六章 塑性变形1. 铜单晶体拉伸时, 若力轴为 [001] 方向, 临界分切应力为0.64 MPa, 问需要多大的拉伸应力才能使晶体开始塑性变形?解 铜为面心立方金属, 其滑移系为 {111}<110>, 4个 {111} 面构成一个八面体, 详见教材P219中的图6-12.当拉力轴为 [001] 方向时, 所有滑移面与力轴间的夹角相同, 且每个滑移面上的三个滑移方向中有两个与力轴的夹角相同, 另一个为硬取向(λ = 90°). 于是, 取滑移系(111)[101]进行计算.ks cos cos cos cos 0.64 1.57 MPa.m mϕλϕλτσ=========即至少需要1.57 MPa 的拉伸应力才能使晶体产生塑性变形.2. 什么是滑移、滑移线、滑移带和滑移系? 作图表示α-Fe, Al, Mg 中的最重要滑移系. 那种晶体的塑性最好, 为什么?答: 滑移是晶体在切应力作用下一部分相对于另一部分沿一定的晶面和晶向所作的平行移动; 晶体的滑移是不均匀的, 滑移部分与未滑移部分晶体结构相同. 滑移后在晶体表面留下台阶, 这就是滑移线的本质. 相互平行的一系列滑移线构成所谓滑移带. 晶体发生滑移时, 某一滑移面及其上的一个滑移方向就构成了一个滑移系.附图6-1 三种晶体点阵的主要滑移系α-Fe具有立方体心结构, 主要滑移系可表示为{110}<111>, 共有6×2 = 12个; Al 具有面心立方结构, 其滑移系可表示为{111}<110>, 共有4×3 = 12个; Mg具有密<>, 共有1×3 = 3个. 晶体的塑性与其滑排六方结构, 主要滑移系可表示为{0001}1120移系的数量有直接关系, 滑移系越多, 塑性越好; 滑移系数量相同时, 又受滑移方向影响, 滑移方向多者塑性较好, 因此, 对于α-Fe, Al, Mg三种金属, Al的塑性最好, Mg 的最差, α-Fe居中. 三种典型结构晶体的重要滑移系如附图6-1所示.3. 什么是临界分切应力? 影响临界分切应力的主要因素是什么? 单晶体的屈服强度与外力轴方向有关吗? 为什么?答: 滑移系开动所需的作用于滑移面上、沿滑移方向的最小分切应力称为临界分切应力.临界分切应力τk的大小主要取决于金属的本性, 与外力无关. 当条件一定时, 各种晶体的临界分切应力各有其定值. 但它是一个组织敏感参数, 金属的纯度、变形速度和温度、金属的加工和热处理状态都对它有很大影响.如前所述, 在一定条件下, 单晶体的临界分切应力保持为定值, 则根据分切应力与外加轴向应力的关系: σs = τk / m, m为取向因子, 反映了外力轴与滑移系之间的位向关系, 因此, 单晶体的屈服强度与外力轴方向关系密切. m越大, 则屈服强度越小, 越有利于滑移.4. 孪生与滑移主要异同点是什么? 为什么在一般条件下进行塑性变形时锌中容易出现挛晶, 而纯铁中容易出现滑移带?答: 孪生与滑移的异同点如附表6-1所示.附表6-1 晶体滑移与孪生的比较锌为密排六方结构金属, 主要滑移系仅3个, 因此塑性较差, 滑移困难, 往往发生孪生变形, 容易出现挛晶; 纯铁为体心立方结构金属, 滑移系较多, 共有48个, 其中主要滑移系有12个, 因此塑性较好, 往往发生滑移变形, 容易出现滑移带. 第七章 回复与再结晶1. 已知锌单晶体的回复激活能为8.37×104 J/mol, 将冷变形的锌单晶体在-50 ℃进行回复处理, 如去除加工硬化效应的25% 需要17 d, 问若在5 min 内达到同样效果, 需将温度提高多少摄氏度?解 根据回复动力学, 采用两个不同温度将同一冷变形金属的加工硬化效应回复到同样程度, 回复时间、温度满足下述关系:122111exp t Q t R T T ⎛⎫⎛⎫=-- ⎪ ⎪ ⎪⎝⎭⎝⎭整理后得到221111ln T t RT Q t =+.将41211223 K,/5/(172460),8.3710 J/mol, 8.314 J/(mol K)4896T t t Q R ==⨯⨯==⨯=⋅代入上式得到2274.7 K T =.因此, 需将温度提高21274.722351.7 T T T ∆=-=-=℃.2. 纯铝在553 ℃ 和627 ℃ 等温退火至完成再结晶分别需要40 h 和1 h, 试求此材料的再结晶激活能.解 再结晶速率v 再与温度T 的关系符合阿累尼乌斯(Arrhenius)公式, 即exp()Q v A RT=-再其中, Q 为再结晶激活能, R 为气体常数.如果在两个不同温度T1, T2进行等温退火, 欲产生同样程度的再结晶所需时间分别为t1, t2, 则122112122111exp[()]ln(/)t Q t R T T RT T t t Q T T =--⇒=- 依题意, 有T1= 553 + 273 = 826 K, T2 = 627 + 273 = 900 K, t1 = 40 h, t2 = 1 h, 则58.314826900ln(40/1)3.0810J/mol900826Q ⨯⨯⨯=⨯-3. 说明金属在冷变形、回复、再结晶及晶粒长大各阶段的显微组织、机械性能特点与主要区别.答: 金属在冷变形、回复、再结晶及晶粒长大各阶段的显微组织、机械性能特点与主要区别详见附表7-1.附表7-1 金属在冷变形、回复、再结晶及晶粒长大各阶段的显微组织、机械性能。
体心立方的晶面间距计算

体心立方的晶面间距计算
设简单立方的晶格常数为a,我们都知道,其晶面间距与晶面指数的关系为:
只要知道晶面指数,晶格常数,代入公式计算就行了,不会出错。
但是,面心立方和体心立方却不能直接用这个公式,用了可能就会出错。
例如,我们知道面心立方的(100)晶面间距是a/2,而用上面的公式计算结果是a,这显然是不对的。
体心立方和面心立方的晶面间距应该按照如下方法计算。
面心立方晶体(FCC)晶面间距与点阵常数a之间的关系为:
若h、k、l均为奇数,则
否则
体心立方晶体(BCC)晶面间距与点阵常数a之间的关系:
若h+k+l=偶数,则
否则
例如,分别求体心立方的(100)、(110)、(111)晶面的面间距,并指出晶面间距最大的晶面。
对于面心立方,情况如何呢?我们算一下。
第一章晶体结构解析

r0
4r0
3a
a 2r0
a
△=0.31r0
注:体心立方晶格一个平面内的原子球并不是最紧密排列。
1.3 密堆积结构
六角密排结构(hcp) (Be,Mg,Zn,Ti,Cd,Zr等)
立方密排(面心立方fcc) (Cu,Ag,Au,Pb,Ni,γ-Fe,Al等)
1、 密堆积结构的主要特征
• 特点:每两个球均相切,且每个球与六个球相 切;三个球心构成等边三角形;每个球周围有 六个空隙。
a2 =a/2(
i Βιβλιοθήκη j k )a3=a/2( i j k )
3、维格纳—赛兹原胞
• 定义:以某一格点为中心,作它与最近邻、次近邻等格
点的垂直平分面,由这些面所围成的封闭多面体称维格 纳—赛兹原胞,也满足原胞的要求,而且每个维格纳— 赛兹原胞只含有一个格点并位于原胞的中心,故其外形
的对称性高于平行六面体原胞。
结构特征
结构图示
(1) 两个面心结构套构 (四条体对角线的 四分之一处加一个C 原子);
(2) 配位数为4。
1.5 化合物晶体结构
(1)NaCl结构 特征:
似简立方结构,每一 行上Na离子与Cl离 子相间排列。 举例:
LiF,LiCl,NaF,NaBr,KCl, KBr,AgCl,MgO,CaO,Sr O,BaO等等
▪ 配位数为6; ▪ 立方体边长a定
义为晶格常数。
a 简立方
1.2 体心立方晶格
• 在简立方结构的体心处 加上一个原子球。 a
• 结构特征:原子球占据 8个顶角和体心位置, 配位数为8。
体心立方
典型晶体:碱金属(Li,Na,K,Rb,Cs); 过渡金属(α-Fe,Cr,Mo,W)等。
7大晶系

一、立方晶系立方晶系的三个轴的长度是一样的,即X=Y=Z,且互相垂直,即α=β=γ=90°,对称性最强。
具有4个立方体对角线方向三重轴特征对称元素的晶体归属立方晶系。
属于立方晶系的有:面心立方晶胞、体心立方晶胞、简单立方晶胞。
这个晶系的晶体并不是只有狭义的正方体一种形状,四面体、八面体、十二面体形状的晶体都属于立方晶系。
它们从不同角度看高低宽窄都差不太多,相对晶面和相邻晶面都相似,横截面和竖截面一样。
最典型立方晶系的晶体为:氯化钠。
二、四方晶系四方晶系四方晶系的三条晶轴互相垂直,即α=β=γ=90°。
其中两个水平轴(X轴、Y轴)长度一样,Z轴的长度可长可短,通俗的说:四方晶系的晶体大多是四棱的柱状体,有的是长柱体,有的是短柱体,即其晶胞必具有四方柱的形状。
横截面为正方形,四个柱面是对称的,即相邻和相对的柱面都是一样的,但和顶端不对称。
所有主晶面交角都是90。
特征对称元素为四重轴。
如果Z轴发育,它就是长柱状甚至针状;如果两个横轴(X轴、Y轴)发育大于Z轴,那么晶体就会呈现四方板状,最有代表的就是磷酸二氢钠和硫酸镍β了。
三、斜方晶系斜方晶系的晶体中三个轴的长短完全不相等,它们的交角仍然是互为90度垂直。
即X≠Y≠Z。
Z轴和Y轴相互垂直90°。
X轴与Y轴垂直,但是不与Z轴垂直,即α=γ=90,β>90°与正方晶系直观相比,区别就是:x轴、y轴长短不一样。
如果围绕z轴旋转,四方晶系旋转九十度即可使x轴y轴重合,旋转一周使x轴y轴重合四次(使另两轴重合的次数多于两次,该轴称“高次轴”),四方晶系有一个高次轴,也叫“主轴”。
斜方晶系围绕z 轴旋转,需180度才可使x轴y轴重合,旋转一周只重合两次,属低次轴。
也就是说,斜方晶系的对称性比四方晶系要低。
特征对称元素是二重对称轴或对称面。
其实,斜方晶系的晶体如果围绕x轴或y轴旋转,情况与围绕z轴旋转相同。
换句话说,斜方晶系没有高次轴,或曰没有理论上的主轴。
体心立方晶格与面心立方晶格
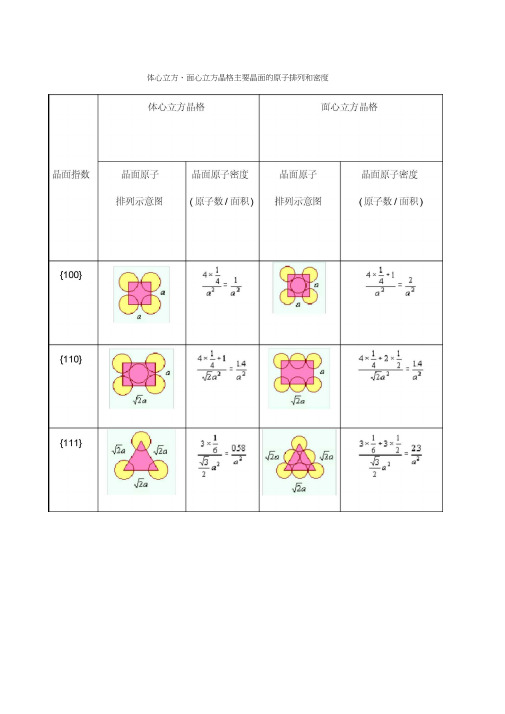
体心立方、面心立方晶格主要晶面的原子排列和密度体心立方、面心立方晶格主要晶面的原子排列和密度第1章小结体心立方晶格(胞): 晶格常数a 、90 °晶胞原子数为2个,1.三种常见金属的晶体结构 原子半径: 5面心立方晶格(胞): 晶格常数a 、90 °晶胞原子数为4个, 致密度为68%,最大空隙半径 「四=0.29「原子,配位数为8原子半径:厂.,致密度为74% ,最大空隙半径r八=0.414 r原子,配位数为12。
密排六方晶格(胞):晶格常数a、c、90 ° 120 °晶胞原子数为6个,1r原子半径:匕致密度为74%,最大空隙半径r八=0.414 r原子,配位数为12。
2 .晶面与晶向可用晶面指数与晶向指数来表达。
不同晶面、不同晶向上的原子排列情况不同。
体心立方晶格的最密面为{110},最密方向为<111>。
面心立方晶格的最密面为{111}最密方向为<110>。
密排六方晶格的最密面为{0001},最密方向为^刀“‘。
3 .实际金属中含有点缺陷(空位、间隙原子、异类原子)、线缺陷(位错)、面缺陷(晶界、亚晶界)三类晶体缺陷,位错密度增加,材料强度增加。
晶界越多,晶粒越细,金属的强度越高,同时塑性越好(即细晶强化)。
4 .合金中有两类基本相:固溶体和金属化合物。
固溶强化是金属强化的一种重要形式。
细小弥散分布的金属化合物可产生弥散强化或第二相强化。
材料的微观组成和微观形貌称组织,材料的组织取决于化学成分和工艺过程。
5.金属材料的性能特点是:强度高,韧性好,塑性变形能力强,综合机械性能好,通过热处理可以大幅度改变机械性能。
金属材料导电、导热性好。
不同的金属材料耐蚀性相差很大,钛、不锈钢耐蚀性好,碳钢、铸铁耐蚀性差。
6.高分子材料结构由大分子链组成,大分子链之间的相互作用力为分子键,分子链的原子之间、链节之间的相互作用力为共价键。
高分子材料的大分子链结构与聚集态及其性能密切相关。
体心立方(112)晶面的原子面密度

体心立方(112)晶面的原子面密度一、体心立方结构简介体心立方是一种晶体结构,由于其具有密排的结构和较好的热稳定性,在工程材料领域得到广泛应用。
在体心立方结构中,原子以一定的规律排列,形成晶格。
体心立方晶格的基本单元包含一个原子在每个晶胞的中心和八个原子分别位于八个顶点上。
这种排列方式使得体心立方结构具有较高的密度和较好的机械性能。
二、体心立方(112)晶面简介在体心立方结构中(112)晶面是一个重要的晶面,它具有特殊的原子排列方式和性质。
通过研究体心立方(112)晶面的原子面密度,可以更好地了解该结构的物理性质和应用潜力。
三、体心立方(112)晶面的原子排列体心立方(112)晶面的原子排列方式是指晶面上原子的位置关系。
体心立方结构的晶面排列方式决定了晶体的表面性质和物理化学行为。
通过对体心立方(112)晶面的原子排列进行研究,可以揭示其在材料科学和工程技术中的应用潜力。
四、体心立方(112)晶面的原子面密度计算方法体心立方(112)晶面的原子面密度是指单位面积上原子的数量。
计算方法一般包括通过晶体结构参数和晶胞参数进行计算。
通过计算可以得到体心立方(112)晶面的原子面密度,从而为材料设计和应用提供重要参考。
五、体心立方(112)晶面的原子面密度实验测定除了计算方法,实验测定也是研究体心立方(112)晶面的原子面密度的重要手段之一。
通过实验测定,可以获得更真实和准确的数据,对体心立方结构的表面性质和晶体稳定性有更深刻的认识。
六、体心立方(112)晶面的原子面密度在材料设计中的应用体心立方(112)晶面的原子面密度对材料设计具有重要意义。
通过对其进行深入研究和应用,可以开发出具有优异性能和广泛用途的新型材料,为材料科学和工程技术提供新的发展方向。
七、总结体心立方(112)晶面的原子面密度是晶体结构中重要的研究内容之一,对于深入理解晶体的物理性质和开发新型材料具有重要意义。
通过系统的研究和应用,可以推动材料科学和工程技术领域的发展,为人类社会进步做出贡献。
第3章 晶体学基础 - 晶体结构、晶向、晶面

LOGO
21
LOGO
1.动画--晶面指数的确定方法
22
2.晶面指数特点与规律:
LOGO
(1)与原点位置无关;每一晶面符号对应一组相互平行的晶面。 晶面符号代表在原点同一侧的一组相互平行且无限大的 晶面,而不是某一晶面。 (2) 若晶面指数相同,但正负符号相反,则两晶面是以点为 对称中心,且相互平行的晶面。如(110)和(110)互 相平行。
2014-9-26 此处添加公司信息 3
3.1.1 晶体与非晶体
LOGO
准晶:是一种介于晶体和非晶体之间的固体。 准晶具有完全有序的结构,然而又不具有晶 体所应有的平移对称性,因而可以具有晶体所不允 许的宏观对称性。准晶是具有准周期平移格子构造 的固体,其中的原子常呈定向有序排列,但不作周 期性平移重复,其对称要素包含与晶体空间格子不 相容的对称(如5次对称轴) 瑞典皇家科学院将2011年诺贝尔化学奖授予 以色列科学家达尼埃尔· 谢赫特曼,以表彰他“发 现了准晶”这一突出贡献。准晶的发现从根本上改 变了以往化学家对物体的构想。
Total: 24
29
LOGO
{123} (123) ( 1 23) (123) (12 3) (132) ( 1 32) (1 3 2) (132) (231) ( 231) (2 3 1) (23 1 ) (213) ( 213) (2 1 3) (21 3) (312) ( 3 12) (3 1 2) (312) (321) ( 3 21) (321) (32 1 )
28
立方晶系: {111}=?
LOGO
Total:? 立方晶系:
{112} (112) ( 1 12) (1 1 2) (112) (121) ( 1 21) (121) (12 1 ) (211) ( 211) (2 1 1) (21 1 )
第3章 晶体学基础 - 晶体结构、晶向、晶面

(3) 晶面指数是截距系数的倒数,因此,截距系数越大, 则相应的指数越小,而当晶面平行某一晶轴时,其截距 系数为∞,对应的指数为1/∞=0.
23
(100)与 [100]有何关系?
LOGO
(4)立方晶系中:相同指数(指数和符号均相同)的晶向和 晶面互相垂直,即同指数的晶向是晶面的法线方向。如: [111] ⊥(111)、[110] ⊥(110)、[100] ⊥(100)。 该规律适用于三根晶轴相互垂直时,如果三轴不相互垂直, 则(hkl)与[hkl]不垂直。
LOGO
21
LOGO
1.动画--晶面指数的确定方法
22
2.晶面指数特点与规律:
LOGO
(1)与原点位置无关;每一晶面符号对应一组相互平行的晶面。 晶面符号代表在原点同一侧的一组相互平行且无限大的 晶面,而不是某一晶面。 (2) 若晶面指数相同,但正负符号相反,则两晶面是以点为 对称中心,且相互平行的晶面。如(110)和(110)互 相平行。
(3)如果是非立方晶系,改变晶向指数的顺序所表 示的晶向可能不等同。如正交晶系[100]、[010]、 [001] 19
LOGO
<U V W>晶向族:等价晶向 e.g., <100>=[100]+[010]+[001] +[100]+[010]+[001] (立方晶体)
20
3.3.2 晶面指数的标定
28
立方晶系: {111}=?
LOGO
Total:? 立方晶系:
{112} (112) ( 1 12) (1 1 2) (112) (121) ( 1 21) (121) (12 1 ) (211) ( 211) (2 1 1) (21 1 )
固体物理知识概要

第一章(2)体心立方(body- centered cubic,bcc):原胞基矢每个晶胞有2个等效格点。
常见金属:碱金属晶体,过渡金属晶体,Cr ,Mo, W.体心立方原胞体积为: a1 ⋅ ( a2⨯a3 ) = a3/2最近邻原子数:8个(3)面心立方(face-centered cubic,fcc) 原胞基矢每个晶胞有4个等效格点。
常见金属:贵金属Cu、Ag、Au、Al、Ni、Pb等。
面心立方原胞体积为: a1 ⋅ ( a2⨯a3 ) = a3/4最近邻原子数:12个7大晶系,14种布拉菲格子,32种宏观对称操作。
密堆积配位数配位数:一个原子周围最近邻的粒子数。
致密度:晶胞中粒子所占的体积与晶胞体积之比。
比值越大,堆积越密。
粒子被看作为有一定半径的刚性小球。
最近邻的小球互相相切。
两球心间的距离等于两最近邻粒子间的距离。
1.同种粒子构成的晶体原子半径相同,刚球半径也相同。
一般采用密堆积。
配位数为12、8。
2. 不同粒子组成的晶体(1)氯化铯(CsCl)Cs+离子半径为r,Cl-离子半径为R,则r = 0.73R 配位数为8。
(2)氯化钠(NaCl), Na+离子半径为r,Cl-离子半径为R,则r = 0.41R 配位数为6。
晶列、晶面、密勒指数;晶向:晶格可看成是在任意方向上由无穷多的平行直线组成的,所有的格点都落在这些直线上。
每一条这样的直线称为晶格的一个晶列。
晶列的方向称为晶格的晶向。
晶向的表示:晶向指数 [ l1l2l3 ]:任取一个格点作为原点O。
作晶胞基矢a、b、c,考虑某晶列上的一个格点P,该格点的位矢为:l1a1+ l2a2+ l3a2且l1 l2 l3 为三个互质整数。
则该晶向指数为[ l1 l2 l3 ]。
晶面:晶格可在任意方向上分割成无穷多的平行平面组成,使得所有的格点都落在这些平面上。
所有互相平行的平面构成一族,称为晶格的晶面。
晶面的表示:在晶胞基矢a、b、c下,一晶面与它们的截距分别为 l'a、m'b、n'c若有互质整数 l、m、n 使(lmn)称为晶体的密勒指数(Millerindices)。
第01章 晶体结构

1、体心立方晶格
① 体心立方晶格的晶胞(见右图)是由 八个原子构成的立方体,并在其立方 体的中心还有一个原子 ② 因其晶格常数 a=b=c ,通常只用常数 a 表示。由图可见,这种晶胞在其立方 体对角线方向上的原子是彼此紧密相 接触排列着的,则立方体对角线的长 度为31/2a,由该对角线长度31/2a上所分 布的原子数目(共2个),可计算出其 原子半径的尺寸r= 31/2a /4。 ③ 在体心立方晶胞中,因每个顶点上的 原子是同时属于周围八个晶胞所共有, 实际上每个体心立方晶胞中仅包含有: 1/8×8+1=2个原子。 ④ 属于这种晶格的金属有铁(<912℃, α-Fe) 、 铬 ( Cr ) 、 钼 ( Mo ) 、 钨 (w)、钒(V)等。
4 3 2 a 3 4 体心立方致密度= =68% 3 a
3
1.晶格的致密度及配位数
配位数:指晶格中任一原子周围所紧邻的最近且等距离的原子 数。配位数越大,原子排列也就越紧密。在体心立方晶格中, 以立方体中心的原子来看,与其最近邻等距离的原子数有8个, 所以体心立方晶格的配位数为8。面心立方晶格的配位数为12。 密排六方的配位数为12。
确定晶向指数的方法2
1. 建立坐标系 结点为原点,三棱 为方向,点阵常数为单位 ; 2. 在晶向上任两点的坐标(x1,y1,z1) (x2,y2,z2)。(若平移晶向或坐标, 让在第一点在原点则下一步更简 单); 3. 计算x2-x1 : y2-y1 : z2-z1 ; 4. 化成最小、整数比u:v:w ; 5. 放在方括号[uvw]中,不加逗号, 负号记 晶格模型
(C) 体心立方晶胞原子数
2、面心立方晶格
① 面心立方晶格的晶胞见右图也是由八个原 子构成的立方体,但在立方体的每一面的 中心还各有一个原子。 ② 在面心立方晶胞中,在每个面的对角线上 各原子彼此相互接触,其原子半径的尺寸 为r=21/2a/4。 ③ 因每一面心位置上的原于是同时属于两个 晶胞所共有,故每个面心立方晶胞中包含 有:1/8×8+1/2×6=4个原子。 ④ 属于这种晶格的金属有铝(Al)、铜(Cu )、镍(Ni)、铅(Pb)等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1-3 常见的晶体结构
3. 密排六方结构
(1)晶胞模型 (2)单胞原子数 (3)原子半径 (4)配位数和致密度 (5)原子面密度 (6)重要的晶面和晶向 (7)具有密排六方结构的典型金属
1-3 常见的晶体结构
思考题: 1. 分别画出面心立方、体心立方、密排六方
晶胞,并分别计算面心立方、体心立方、密排 六方晶体的致密度。
-Al2O3型晶体结构
1-3 常见的晶体结构
三、共价晶体(原子晶体)结构
a
b
金刚石型晶体结构(配位数为4)
a — 共价键; b — 晶胞
1-3 常见的晶体结构
三、共价晶体(原子晶体)结构
As、Sb、Bi的晶体结构(配位数为3)
Se和Te的晶体结构(配位数为2)
1-3 常见的晶体结构
思考题: 1. 何谓金属的多晶型性? 2. 分别计算面心立方和体心立方结构中八面
体和四面体间隙的大小。
1-3 常见的晶体结构
3. 体心立方结构中的晶格间隙
(1)八面体间隙
A
(2)四面体间隙
C
F
E
D
B
1-3 常见的晶体结构
4.密排六方结构中的晶格间隙 (1)八面体间隙 (2)四面体间隙
1-3 常见的晶体结构
(四) 多晶型性与同素异构转变
1. 多晶型性(同素异构性) 2. 铁的多晶型性 3. 同素异构转变
1-3 常见的晶体结构
二、离子晶体结构 (一)AB型化合物的晶体结构
CsCl型晶体结构
NaCl型晶体结构
立方ZnS型晶体结构
1-3 常见的晶体结构
(二)AB2型化合物的晶体结构
c
CaF2型晶体结构
a
a
Ti 4+
O2-O2-
-方石英型晶体结构
1-3 常见的晶体结构
(三)A2B3型化合物的晶体结构
1-3 常见的晶体结构
一、金属晶体结构 (一)三种典型金属晶体结构
1. 面心立方结构 (1)晶胞模型 (2)单胞原子数 (3)原子半径 (4)配位数和致密度 (5)原子面密度 (6)重要的晶面和晶向 (7)具有面心立方结构的典型金属
1-3 常见的晶体结构
2. 体心立方结构
(1)晶胞模型 (2)单胞原子数 (3)原子半径 (4)配位数和致密度 (5)原子面密度 (6)重要的晶面和晶向 (7)具有体心立方结构的典型金属
2. 分别计算面心立方晶体{111}晶面和体心 立方晶体{110}晶面原子面密度。
1-3 常见的晶体结构
(二) 金属晶体中的原子堆垛方式
刚球密堆模型 面心立方晶体的堆垛顺序 密排六方晶体的堆垛顺序
A
A
A
A
A
A
A
1-3 常见的晶体结构
(三) 晶格间隙
1. 晶格间隙:晶体中未被原子占据的空间 2. 面心立方结构中的晶格间隙 (1)八面体间隙 (2)四面体间隙
