干细胞移植治疗视网膜色素变性研究进展
糖尿病视网膜病变研究进展

临床表现
视力下降
患者可能出现不同程度的视力 下降,严重时可导致失明。
视物模糊
由于视网膜血管病变,患者可 能出现视物模糊的症状。
眼前黑影
视网膜血管阻塞或出血可能导 致患者眼前出现黑影。
视野缺损
随着病情发展,患者可能出现 视野缺损的情况。
02 糖尿病视网膜病变的流行 病学研究
全球流行情况
糖尿病视网膜病变是糖尿病最常见的微 血管并发症之一,全球范围内患病率较 高。
干细胞治疗
干细胞治疗是一种具有前景的治疗方法,通过将干细胞移植到病变部位, 促进视网膜细胞的再生和修复。目前干细胞治疗在糖尿病视网膜病变中 仍处于临床试验阶段。
05 糖尿病视网膜病变的预防 与控制策略
生活方式干预
定期检查
定期进行眼科检查,以便早期发现视网膜病 变。
健康饮食
遵循低糖、低脂、高纤维的饮食原则,控制 体重。
在亚洲地区,糖尿病视网膜病变的患病率较高,特别是在中国和印度等人 口众多的国家。
在非洲地区,由于糖尿病控制不佳和医疗资源有限,糖尿病视网膜病变的 患病率也较高。
影响因素
糖尿病视网膜病变的发生和发展受多种因素的影响,包括血糖控制情况、 高血压、高血脂、病程长短、遗传因素等。
其中,血糖控制不良是最重要的危险因素之一,长期血糖升高会损伤视 网膜血管,导致血管通透性增加、血-视网膜屏障破坏等病理改变。
血流动力学异常
糖尿病影响视网膜血流动力学,包括血流速度 减慢、血管阻力增加等。
视网膜缺氧
血流动力学异常导致视网膜缺氧,进一步加重视网膜病变。
视网膜神经元损伤
神经元细胞凋亡
长期高血糖状态导致视网膜神经元细胞凋亡, 使神经元数量减少。
黄斑变性的临床表现与治疗方法

黄斑变性的临床表现与治疗方法黄斑变性是一种常见的视网膜疾病,主要影响中央视力,给患者的生活质量带来很大影响。
本文将深入探讨黄斑变性的临床表现以及可行的治疗方法。
一、黄斑变性的临床表现1.1 视力下降黄斑是人眼最重要的区域之一,在视觉信息处理和识别中起到至关重要的作用。
因此,当黄斑发生退化或损伤时,患者的视力会逐渐下降。
在早期阶段,患者可能仅出现近距离物体模糊不清或对细节感知能力下降;随着病情进展,即使在日常活动中也可能出现远距离物体看不清楚、辨认字迹困难等情况。
1.2 中央视野减弱黄斑变性主要影响眼睛正前方的区域,特别是视网膜最敏感、细致度最高、颜色最明亮的部分。
因此,在黄斑变性患者中,中央视野逐渐减弱成为常见表现。
患者可能会感觉到中央的物体模糊、失去清晰度,常需要通过偏转视线来补偿丧失的中央视野。
1.3 影像变化黄斑变性通常伴随着黄斑区域的色素沉着和凹陷,这些改变可以通过眼底检查或影像学方法进行观察。
典型的影像改变包括黄斑病变、视网膜萎缩和脉络膜血管变细等。
二、黄斑变性的治疗方法2.1 营养补充营养对于黄斑区域的保护和维持功能起着重要作用。
一些研究表明摄入适量的叶黄素、玛卡素等营养物质可以减缓黄斑变性的发展。
因此,合理饮食并添加富含这些营养物质的食物或保健品是一种有效的治疗方法。
2.2 抗氧化剂治疗氧化应激被认为是导致黄斑变性发生和进展的一个重要因素。
抗氧化剂可以通过中和有害自由基来降低氧化损伤,从而减缓疾病的进程。
例如,维生素C、E等都具有抗氧化作用,可以作为治疗方法的一部分。
2.3 抗血管内皮生长因子(VEGF)药物治疗近年来,抗血管内皮生长因子药物(Anti-VEGF drugs)已成为黄斑变性治疗的重要手段。
这些药物通过抑制血管异常增生和渗漏,改善视力和阻止病情进展。
常见的药物包括阿昔单胺注射液和卢芙兰注射液。
2.4 视网膜干细胞移植视网膜干细胞移植是目前新兴的治疗方法之一。
该技术主要通过将健康的视网膜干细胞移植到受损区域,以恢复黄斑区域正常功能。
干细胞在眼科领域中的应用与研究

干细胞在眼科领域中的应用与研究近年来,干细胞技术的发展为医学领域带来了巨大的希望和可能性。
干细胞具有自我复制和分化为多种类型细胞的潜能,可以用于再生组织和器官。
在眼科领域中,干细胞的应用已经取得了一定的突破,并展现出了广阔的应用前景。
本文将介绍干细胞在眼科领域中的应用及其相关研究。
首先,干细胞在眼表疾病的治疗中发挥着重要的作用。
干细胞可以分化为结缔组织细胞和上皮细胞,这些细胞有助于修复和再生受损的眼表组织。
例如,干细胞可以用于治疗干眼症,这是一种眼表疾病,由于泪液分泌不足或质量下降导致眼表组织受损。
干细胞移植可以促进眼表组织的再生,增加泪液分泌,改善患者的症状。
此外,干细胞还可以用于治疗角膜溃疡、球结膜炎等眼表疾病。
其次,干细胞在角膜疾病的治疗中也有着重要的应用价值。
角膜是眼睛的透明层,常常受到外界伤害和疾病的侵袭。
当角膜受损时,干细胞可以分化为角膜细胞,帮助修复受损的角膜组织。
例如,干细胞移植可以用于治疗角膜炎、角膜溃疡、角膜瘢痕等疾病。
通过将干细胞注入患者的受损角膜区域,可以促进角膜组织的再生,恢复视力和视觉质量。
这种治疗方法已经在实际临床中得到了广泛应用,并取得了显著的疗效。
除了眼表疾病和角膜疾病的治疗,干细胞还可以在视网膜疾病的研究和治疗中发挥重要的作用。
视网膜是眼睛中感光细胞的组织,与人眼的视力密切相关。
一些视网膜疾病,如老年性黄斑变性和视网膜色素变性,会导致视网膜细胞的死亡和视力损失。
干细胞可以分化为视网膜细胞,替代受损的细胞,恢复视网膜的功能。
目前,研究人员正在探索利用干细胞治疗视网膜疾病的方法,并取得了一些初步的进展。
然而,由于视网膜的复杂结构和功能,该领域的研究仍面临许多挑战,需要进一步的研究和探索。
此外,干细胞还可以用于治疗其他眼部疾病,如青光眼、眼部外伤等。
干细胞在这些疾病中的应用虽然尚处于研究阶段,但已经展示出了巨大的潜力。
通过干细胞的再生和分化,可以修复受损的眼部组织,改善患者的症状和生活质量。
“全能”干细胞,黄斑变性治疗新思路

最近,美国罗彻斯特大学医学中心首次利用干细胞建 立了患者源性黄斑变性模型,来帮助我们更好地理解黄斑 变性的发展过程。在这个模型中,研究人员提取了遗传性 黄斑变性患者的皮肤细胞后将这些细胞转化成了干细胞,
. A然l后l利R用i这g些h干ober
如何利用干细胞治疗黄斑变性?
相比于其他器官,眼睛是非常适合利用干细胞疗法来 治疗的,因为相对独立而较少需要其他部位配合来发挥正 常功能,所以细胞很难通过重重阻碍跑到身体的其他部位 中去。另外,我们已经有足够的工具来观察眼睛的内部状 况和有效的方法来测量视觉功能了。研究人员还可以在同
一个患者身上比较接受过治疗的眼睛和没有接受治疗的眼 睛,从而更好地监控治疗效果。
视网膜是位于眼球壁内层由神经组织构成的一层透明 薄膜,光转化为视觉的过程正是从视网膜开始的。黄斑则 位于视网膜的后极部,因为黄斑部的黄斑中心凹有大量的 视锥细胞(一种视敏度高的视觉细胞,又被称为昼视细胞), 所以黄斑中心凹是视网膜上视觉最敏锐的部位,对于阅 读、驾驶和面部识别这类日常活动来说是十分重要的。黄 斑部除了有视锥细胞外,还有视杆细胞(一种对光的强弱敏 感但视敏度较低的视觉细胞,又被称为夜视细胞),视锥细 胞和视杆细胞在接收光刺激后将其转化为电信号并通过视
为地使这些视网膜上皮色素细胞老化到一定程度时,就会 像黄斑变性患者的视网膜上皮色素细胞一样出现沉淀。但 不同的是,我们能够在实验室中观察到整个过程。而且相 比于利用健康成年人眼部细胞构造的模型,利用存在会导 致黄斑变性突变的细胞构建的模型产生沉淀的成分和真实 患者的更加接近。
利用这一模型,研究人员首次证明了不需要其他细 胞或视网膜组成部分,功能存在缺陷的视网膜上皮色素 (RPE)细胞本身就能够导致黄斑变性的一些特征性变化, 这也说明视网膜上皮色素细胞功能不全,可能是导致黄斑 变性的关键因素。不仅如此,未来的研究还可以利用这种 通过患者自身细胞建立的模型来试药,从而制定出更适合 患者本身的治疗方案。
视网膜色素变性病的治疗新进展

视网膜色素变性病的治疗新进展视网膜色素变性病(retinitis pigmentosa,RP)是一种遗传性视网膜疾病,其特征是视网膜色素层变性和萎缩,导致渐进性视力丧失。
该疾病是不可逆的,目前尚无根治方法。
传统治疗方法主要是辅助性治疗,如佩戴视力辅助器、使用药物、手术治疗等。
近年来,随着基因治疗和干细胞技术的发展,视网膜色素变性病的治疗也迎来了新的进展。
一、基因治疗视网膜色素变性病的发病机理与多种遗传突变相关。
因此,基因治疗成为治疗RP的新方向。
基因治疗是利用基因工程技术将正常基因或修复性基因导入病人体内,通过激活或抑制某些功能,达到治疗目的。
目前,基因治疗主要分为替换型、增强型和修复型三种。
替换型基因治疗是利用载体将正常基因导入视网膜内,使其恢复正常功能。
增强型基因治疗是增强已有基因的功能。
修复型基因治疗是通过基因编辑技术修复病变基因。
已有许多基因治疗试验证明,基因治疗是治疗RP的有效方法。
例如AVXS-201和UPC-2A等途径,均使RP患者的视力得到显著改善。
基因治疗的发展将为RP患者带来更为广阔的治疗前景。
二、干细胞技术干细胞技术也是治疗RP的新方向之一。
干细胞是一类全能性细胞,可分化成各种类型的细胞。
RP导致视网膜细胞死亡和萎缩,如果通过干细胞能够重建视网膜的组织结构,就有望恢复视力。
目前,干细胞技术主要分为胚胎干细胞和诱导多能性干细胞两类。
胚胎干细胞来源于胚胎的内细胞团,目前仍存在一些伦理和法律问题。
因此,诱导多能性干细胞成为RP治疗中备受关注的一个方向。
诱导多能性干细胞是指通过基因重编程和特定培养条件将成体细胞转化为全能性干细胞。
通过这种技术,RP患者的皮肤细胞、血液细胞等常见组织中提取的细胞就能转化为干细胞,再实现分化成视网膜细胞。
对于RP的治疗,干细胞技术的精准度和可操作性是其最大的优势。
但需要注意的是,干细胞技术更为复杂,仍存在不少技术难题待解决。
三、治疗前景目前,基因治疗和干细胞技术的发展仍处于探索阶段,临床应用还需要时间的检验和积累。
骨髓间充质干细胞治疗视网膜疾病的实验进展

骨髓间充质干细胞治疗视网膜疾病的实验进展骨髓间充质干细胞治疗视网膜疾病的实验进展1.福建医科大学第一临床医学院 2.福建卫生职业技术学院王珊珊1.2徐国兴1各种视网膜疾病,如视网膜色素变性(RP)、年龄相关性黄斑病变(AMD)等,视网膜光感受器的损伤可导致不可逆的视力丧失。
对于此类疾病,人们尝试了很多方法来修复视网膜细胞变性,阻止视网膜光感受器的丧失,其中包括营养支持治疗、基因治疗、神经生长因子、以及人工眼等。
然而,这些方法都未能取得确切的临床疗效,因此人们开始转向寻找合适的细胞源作为移植物,通过视网膜的细胞移植来代替丢失的细胞或者起到支持细胞的作用,以阻止更进一步的细胞丢失。
随着干细胞应用技术不断突破,为我们最终有效的治疗这些眼病,恢复患者的视功能提供了一个良好的契机。
再加上眼睛的解剖结构明确,并具有透明的屈光介质、便于操作定位及观察的特点,使得与其他神经系统疾病相比,视网膜疾病在细胞移植方面发展得更为迅速。
1间充质干细胞具有优势干细胞是生物个体生长发育中具有自我更新、增殖和多向分化潜能的细胞群体,分为胚胎干细胞和成体干细胞。
目前研究较多用于视网膜移植的干细胞包括胚胎干细胞(ESC)和成体干细胞中的间充质干细胞(mesenchymal stemcells,MSCs)、神经干细胞(NSC)和视网膜干细胞/祖细胞(RPC)等。
但由于MSCs易于获得,且无胚胎干细胞或神经干细胞的伦理障碍,同时也避免了异体移植的免疫排斥反应,在目前临床前试验和临床应用中尚未见致畸作用的发生。
因此,MSCs 在干细胞移植方面具有优势,也是目前研究相对深入的一群具有多向分化潜能的成体干细胞。
然而,要想实现MSCs的临床应用,就必须克服MSCs 的选择、培养扩增、体外标记、植入体内及植入后的融合等一系列技术难题。
目前,MSCs移植主要以大鼠骨髓间充质干细胞实验对象,已进入动物实验的阶段,虽取得了一些突破,但同时也存在不少难题。
干细胞移植治疗视网膜色素变性研究进展

干细胞移植治疗视网膜色素变性研究进展【关键词】视网膜色素变性;干细胞移植;视网膜干细胞视网膜色素变性(RP)是一组遗传性退行性视网膜疾病,主要影响视杆细胞和视网膜色素上皮细胞(RPE)。
早期特征性临床表现为夜盲和周边视野的丧失,最终导致中心视力的丧失,目前尚无有效治疗方法。
近年来干细胞移植治疗视网膜色素变性取得了一些进展,下面就对其进行综述。
1 胚胎干细胞移植胚胎干细胞为源于受精胚泡的内细胞团,具有多能性,能够自我更新并产生特殊类型的细胞[1]。
其可以发育成外胚层、中胚层及内胚层任何组织类型的细胞,在特异性组织环境中,能分化成特定类型的细胞[2]。
胚胎干细胞诱导分化为视网膜前体细胞胚胎干细胞分化必须依靠相应微环境所提供的各种营养因子来完成。
Sugie等[3]利用维甲酸法将EB3鼠的胚胎干细胞与胚胎第6天的鸡胚视网膜组织联合培养10 d后,发现视紫红质免疫阳性细胞明显增加,而对照组中则未发现视紫红质免疫阳性细胞。
Ikeda等[4]应用改良的无血清培养法(SFEB/DLFA),高效诱导出Rx+/Pax6+视网膜前体细胞,对这种细胞进行视锥视杆同源盒基因转染后,细胞还可以自体激活,获得了表达视紫红质的能力。
有学者对培养方法进行改良,采用经典培养方法或非经典培养方法与多种生长因子、新生胚胎视网膜组织或视网膜基质细胞联合培养胚胎干细胞,使干细胞定向诱导的特异性及诱导效率均有明显提高[5,6]。
供体视网膜前体细胞与受体视网膜组织作用的可能机制研究表明,细胞之间有相互识别和选择性黏着的能力,同类细胞间相互识别并黏着,形成细胞群体,不同细胞群体之间按一定的规律排列,这种细胞行为称为细胞类聚。
细胞类聚在胚胎发育中具有重要作用,在视网膜前体细胞眼内移植的研究中,这一现象也已得到证实。
Ikeda等[7]在器官培养中也观察到类似的现象,他们发现,体外培养的胚胎干细胞源性视紫红质阳性细胞准确无误地进入光感受器细胞层并存活;Ikeda 等提出了另外的解释,他认为未成熟的视网膜前体细胞可能在进入外核层后,优先分化为光感受器细胞。
骨髓间充质干细胞诱导分化视网膜神经样细胞的研究进展

骨髓间充质干细胞诱导分化视网膜神经样细胞的研究进展作者:王珊珊徐国兴来源:《海峡科学》2010年第05期视网膜色素变性及老年性黄斑变性是严重威胁视力的疾病,目前临床上缺乏有效的治疗方法。
骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs) 有跨胚层分化能力,在一定的条件下可以向神经细胞分化。
大鼠骨髓间充质干细胞诱导分化成为视网膜色素细胞的研究为此类疾病的治疗带来了希望,成为近年来该领域的研究热点。
本文对近年来不同培养条件对大鼠骨髓间充质干细胞定向诱导分化的影响以及视网膜前体细胞眼内移植的进展综述如下。
1 BMSCs体外诱导实验BMSCs向某一特定细胞的分化,必须依靠相应微环境所提供的各种营养因子来完成。
原始视网膜发育的微环境是最适宜的微环境,这种微环境提供了BMSCs定向诱导分化所具备的各种生长因子以及营养成分。
人工诱导分化干细胞的方法,就是对这种微环境的模拟。
模拟的准确性越高,分化效率也就越高。
1.1单用诱导介质1.1.1碱性成纤维细胞生长因子(bFGF):碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)诱导方法是诱导BMSCs向神经元方向分化的经典方法,其优点是可以获得较多的神经元样细胞,分化的阳性率为78%。
刘东宁等[1]用bFGF诱导后结果与Woodbury一致。
用bFGF诱导后细胞GFAP表达阴性,认为主要是向成熟神经元方向分化,而不是神经胶质细胞。
诱导后从形态学上在细胞间建立了突触联系,但诱导后细胞难以长期存活,需联合其他神经营养因子进行维持培养,才利于长期存活。
在培养中,刘东宁等用含10 ng/mL bFGF进行接触性的诱导,有报道是用20 ng/mL bFGF进行接触性的诱导。
1.1.2乳鼠视网膜细胞:采用新出生1~3天的乳鼠视网膜细胞作为诱导剂。
有学者把将视网膜神经细胞培养换液的上清液收集于干净玻璃瓶中,真空抽滤后按2∶3比例与DMEM培养液混合后备用。
干细胞移植恢复实验鼠视力 视网膜疾病有望被攻克

干细胞移植恢复实验鼠视力视网膜疾病有望被攻克
佚名
【期刊名称】《中华细胞与干细胞移植(电子版)》
【年(卷),期】2010(002)001
【摘要】美国哥伦比亚大学医学中心科学家所领导的国际研究小组表示,他们利用实验鼠胚胎干细胞取代受损视网膜细胞,成功地帮助患色素性视网膜炎的实验鼠恢复了视力。
该研究成果有望用于开发治疗人类色素性视网膜炎的新方法。
【总页数】1页(P7-7)
【正文语种】中文
【中图分类】R392.11
【相关文献】
1.Q瞬间永久恢复视力技术有望年内上市 [J],
2.植入式偏心透镜有望恢复盲人视力 [J],
3.基因疗法有望助失明者恢复视力 [J],
4.科学家用培养皿制造视网膜有望恢复盲人视力 [J],
5.胚胎干细胞移植助患病实验鼠恢复视力 [J],
因版权原因,仅展示原文概要,查看原文内容请购买。
干细胞与视网膜移植的研究现状

干细胞与视网膜移植的研究现状干细胞具有自我分裂增殖和多向分化潜能。
现有研究结果表明,胚胎干细胞、成体干细胞及诱导多功能干细胞均可体外培养分化成具有视网膜细胞标志的各种细胞,给许多视网膜变性疾病提供了新的途径。
本文就干细胞视网膜移植的研究现状作一综述。
标签:干细胞;移植;视网膜近年来,视网膜干细胞移植成为人们研究的热点。
目前处于研究阶段的干细胞主要有胚胎干细胞、成体干细胞及诱导多功能干细胞等。
一胚胎干细胞胚胎干细胞,简称ES或EK细胞,是早期胚胎或原始性腺分离出来的一类细胞,它具有体外培养无限增殖、自我更新和多向分化的特性。
近年来,关于诱导ES细胞定向分化或形成特定的组织已经成为研究热点。
曹明哲等抑制Nodal信号通路,将ES细胞诱导分化为中脑细胞,随后添加activin 和血清,可诱导分化成Rx+、Pax6+的视网膜前体细胞。
将这些细胞与发育阶段的视网膜组织共培养,即可得到各种视网膜细胞[1]。
EirakuM等成功地利用人类胚胎干细胞生成第一个类似于胚眼的杯状结构,包含六种不同的视网膜神经元细胞和Müller胶质细胞,并且分层排列[2]。
多项研究表明,胚胎干细胞可以体外培养,特异性分化成视网膜细胞并形成类似的视网膜组织。
目前已有研究发现,干细胞移植可以存活、整合并优先分化成视网膜感光细胞和神经节细胞,对疾病治疗具有重要意义。
但时至今日,胚胎干细胞的移植研究仍然面临很多问题,如细胞的来源问题,伦理学的问题以及胚胎干细胞的致瘤性等。
二成体干细胞迄今发现的成体干细胞主要有视网膜干细胞、造血干细胞、神经干细胞、间充质干细胞等。
视网膜干细胞是其中唯一眼源性干细胞。
最早Vincent等研究发现小鼠眼内的单纯色素睫状缘细胞可以在体外分裂增殖,分化为视网膜细胞,包括视杆细胞、Müller胶质细胞和双极细胞,据此发现了视网膜干细胞。
现有研究证实,移植入受体视网膜下腔的视网膜干细胞能分裂、分化并形成特征性的感光细胞居内、双极细胞、放射状胶质细胞和无长突细胞居外的玫瑰花球状细胞团。
干细胞移植在眼科疾病治疗中的应用方法总结

干细胞移植在眼科疾病治疗中的应用方法总结引言:眼科疾病是指影响眼睛和其周围结构的疾病,如白内障、青光眼、黄斑病变等。
传统的治疗方法在某些情况下可能无法完全恢复视力,因此科学家们转向了新的治疗方法——干细胞移植。
干细胞能够自我复制并分化为多种细胞类型,这使得它们成为一种重要的治疗方法。
本文将介绍干细胞移植在眼科疾病治疗中的应用方法,并探讨其现状和前景。
一、干细胞的来源:干细胞的来源有多种,包括:1. 脂肪组织:脂肪组织中含有丰富的成体干细胞,可以通过抽取脂肪组织获得。
2. 骨髓:骨髓中的造血干细胞是最常见的干细胞来源之一。
3. 脐带血:脐带血中的造血干细胞也是一种常用的来源,由于脐带血的获取方便和无侵入性,受到了广泛的关注。
4. 胚胎:胚胎干细胞具有极高的分化潜能,但由于伦理和道德问题,胚胎干细胞的研究和应用存在限制。
二、干细胞移植方法:1. 自体干细胞移植:自体干细胞移植是指将患者自身的干细胞提取和移植回其身体,从而避免免疫排斥反应。
该方法需要在初始阶段收集和储存患者的干细胞。
常用的方法包括:- 脂肪组织提取法:通过脂肪组织提取获得干细胞,然后培养和增殖后移植回患者体内。
- 自体骨髓提取法:通过骨髓穿刺提取骨髓中的干细胞,然后进行培养和移植。
2. 异体干细胞移植:异体干细胞移植是指将他人捐赠的干细胞移植到患者身体中。
该方法需要进行组织相容性配型以确保移植物不被免疫系统排斥。
常用的方法包括: - 骨髓移植:将捐赠者的骨髓中的干细胞移植到患者体内,以替代患者异常的造血系统。
- 脐带血移植:将捐赠者的脐带血中的干细胞移植到患者体内,以重建患者的免疫系统和造血系统。
三、干细胞在眼科疾病治疗中的应用:1. 干细胞移植治疗角膜疾病:- 干细胞角膜移植:将自体干细胞移植到患者受损的角膜上,以恢复角膜的透明度和功能。
该方法已成功用于治疗多种角膜疾病,如角膜溃疡、干眼症等。
- 异体干细胞角膜移植:将异体干细胞移植到患者角膜上,以恢复角膜正常结构和功能。
多能干细胞治疗视网膜退行性疾病:从实验室到临床转化的现状与挑战

浙江理工大学学报,第51卷,第1期,2024年1月J o u r n a l o f Z h e j i a n g S c i -T e c h U n i v e r s i t yD O I :10.3969/j.i s s n .1673-3851(n ).2024.01.015收稿日期:2023-06-18 网络出版日期:2023-11-02基金项目:企业委托研发项目(21040400-J)作者简介:郭 艳(1998 ),女,甘肃通渭人,硕士研究生,主要从事多能干细胞方面的研究㊂多能干细胞治疗视网膜退行性疾病:从实验室到临床转化的现状与挑战郭 艳1,鲍 莉1,纪 猛2,吴月红1(1.浙江理工大学生命科学与医药学院,杭州310018;2.浙江泉生生物工程有限公司,杭州310018) 摘 要:视网膜色素上皮细胞(R e t i n a l p i g m e n t e pi t h e l i a l c e l l s ,R P E )是位于视网膜底部致密的细胞层,其损伤导致年龄相关性黄斑变性(A g e -r e l a t e d m a c u l a r d e g e n e r a t i o n ,A M D )㊁S t a r g a r d t 病(S t a r g a r d t m a c u l a r d y s t r o p h y,S T G D )和色素性视网膜炎(R e t i n i t i s p i gm e n t o s a ,R P )等视网膜疾病,R P E 移植已成为治疗R P E 损伤性疾病的有效方案㊂来源于人多能干细胞(H u m a n p l u r i po t e n t s t e m c e l l s ,h P S C )的视网膜色素上皮细胞,具有与人原代R P E 相似的功能和容易制备等优点,已成为R P E 移植的最主要细胞来源之一㊂文章对h P S C -R P E 治疗视网膜退行性疾病的临床试验进展进行了总结和归纳,并阐述了目前面临的挑战与风险㊂关键词:人多能干细胞;视网膜色素上皮细胞;年龄相关性黄斑变性;S t a r ga r d t 病;色素性视网膜炎;细胞治疗中图分类号:Q 291文献标志码:A文章编号:1673-3851(2024)01-0130-15引文格式:郭艳,鲍莉,纪猛,等.多能干细胞治疗视网膜退行性疾病:从实验室到临床转化的现状与挑战[J ].浙江理工大学学报(自然科学),2024,51(1):130-144.R e f e r e n c e F o r m a t :G U O Y a n ,B A O L i ,J I M e n g ,e t a l .P l u r i p o t e n t s t e m c e l l s i n t h e t r e a t m e n t o f r e t i n a l d e ge n e r a t i v e d i s e a s e s :C u r r e n t s i t u a t i o n a n d c h a l l e n g e sf r o m b e n c h t o b e d s i d e [J ].J o u r n a l o f Z h e j i a ng S c i -T e ch U ni v e r s i t y,2024,51(1):130-144.P l u r i p o t e n t s t e m c e l l s i n t h e t r e a t m e n t o f r e t i n a l d e ge n e r a t i v e d i s e a s e s :C u r r e n t s i t u a t i o n a n d c h a l l e n ge sf r o m b e n c h t o b e d s i d e G U O Y a n 1,B A O L i 1,J I M e n g 2,W U Y u e h o n g1(1.C o l l e g e o f L i f e S c i e n c e a n d M e d i c i n e ,Z h e j i a n g S c i -T e c h U n i v e r s i t y ,H a n gz h o u 310018,C h i n a ;2.A s i a S t e m C e l l T h e r a p e u t i c s C o .,L t d .,H a n gz h o u 310018,C h i n a ) A b s t r a c t :R e t i n a l p i g m e n t e p i t h e l i a l (R P E )c e l l s a r e l o c a t e d i n a d e n s e l a y e r o f c e l l s a t t h e b o t t o m o f t h e r e t i n a ,a n d t h e i r d a m a g e c a n r e s u l t i n a g e -r e l a t e d m a c u l a r d e g e n e r a t i o n (A M D ),S t a r ga r d t m a c u l a r d y s t r o p h y (S T G D ),R e t i n i t i s p i g m e n t o s a (R P )a n d o t h e r r e t i n a l d e ge n e r a t i v e d i s e a s e s .R P E t r a n s pl a n t a t i o n h a s b e c o m e a n e f f e c t i v e t r e a t m e n t f o r s u c h d i s e a s e s a t p r e s e n t .R P E c e l l s d e r i v e d f r o m h u m a n p l u r i p o t e n t s t e m c e l l s (h P S C ),n a m e l y hP S C -R P E ,h a v e b e c o m e t h e m a i n s o u r c e o f R P E t r a n s p l a n t a t i o n b e c a u s e o f t h e i r s i m i l a r f u n c t i o n a n d e a s y p r e p a r a t i o n t o h u m a n p r i m a r y RP E .T h i s a r t i c l e s u m m a r i z e s t h e c l i n i c a l t r i a l s o f h P S C -R P E i n t h e t r e a t m e n t o f r e t i n a l d e g e n e r a t i v e d i s e a s e s ,a n d e x po u n d s t h e c h a l l e n g e s a n d r i s k s w e a r e f a c i n g a t pr e s e n t .K e y w o r d s :h u m a n p l u r i p o t e n t s t e m c e l l s ;r e t i n a l p i g m e n t e p i t h e l i u m ;a g e -r e l a t e d m a c u l a r d e g e n e r a t i o n ;s t a r g a r d t m a c u l a r d y s t r o p h y ;r e t i n i t i s p i g m e n t o s a ;c e l l t h e r a p y0 引 言年龄相关性黄斑变性(A ge -r e l a t e d m a c u l a r d e ge n e r a t i o n ,A M D )㊁色素性视网膜炎(R e t i n i t i s p i g m e n t o s a ,R P )和S t a r g a r d t 病(S t a r ga r d t m a c u l a r d y s t r o p h y,S T G D )[1-3]为常见的视网膜退行性疾病,是近些年导致失明的主要眼部疾病㊂A M D㊁R P 和S T G D是由视网膜感光细胞或视网膜色素上皮细胞(R e t i n a l p i g m e n t e p i t h e l i a l c e l l s,R P E)的退化和死亡引起[4],目前尚未有根治的方法㊂变性或死亡的R P E很难修复和再生[5];细胞治疗可以替代受损的R P E来恢复视觉功能,相关治疗方法已有大量报道[6-8]㊂人多能干细胞(H u m a n p l u r i p o t e n t s t e m c e l l s,h P S C)为细胞治疗提供新的细胞来源,目前的临床数据表明,来源于人多能干细胞的视网膜色素上皮细胞(H u m a n p l u r i p o t e n t s t e m c e l l s d e r i v e d r e t i n a l p i g m e n t e p i t h e l i a l c e l l s,h P S C-R P E)安全有效[6-8],但干细胞疗法仍面临很多风险与挑战㊂本文对h P S C-R P E治疗视网膜退行性疾病的临床试验进展及目前面临的风险和挑战进行综述㊂概述视网膜退行性疾病的发生及目前的治疗方案,总结R P E细胞治疗的研究进展,归纳h P S C-R P E 治疗的现状以及面临的风险和挑战等㊂1视网膜退行性疾病R P E为致密的单层细胞,位于光感受器和脉络膜之间,呈 鹅卵石 形状,富含色素颗粒,对于支持光感受器细胞的营养㊁结构和代谢不可或缺[9]㊂R P E在维持视网膜功能方面具有重要作用,包括与感光细胞接触并为其提供营养㊁代谢废物的吞噬等,且参与构成血-视网膜屏障防止物质从脉络膜非特异性扩散等功能[10-11]㊂R P E细胞的损伤和缺失会引起继发性视网膜感光细胞耗竭,从而导致视网膜退行性病变[4]㊂1.1年龄相关性黄斑变性A M D又称为老年性黄斑变性,是欧美国家老年人群中引起失明的主要眼部疾病[12]㊂目前全球超过2.00亿人患A M D,预计在2040年将增加到2.88亿人,并且约有10%的人处于疾病晚期[13]㊂年龄是导致A M D发生的主要因素,在欧洲人群中85岁以上的患病率约为30%[14];吸烟和饮食等生活方式也是导致A M D发生的因素[15];基因突变也与A M D患病率的增加相关[16-18]㊂晚期A M D包括干性A M D和湿性A M D㊂干性A M D是由于B r u c h 膜上脂褐素的过度积累和慢性炎症导致R P E以及感光细胞氧化损伤以及退化,使得视力急剧下降甚至失明[19];湿性A M D是因为脉络膜血管过度增殖到视网膜中,导致视力急剧下降,严重时也会导致失明[20]㊂目前湿性A M D的治疗可以通过注射抗血f a c t o r,V E G F)衍生药物缓解视力衰退,在临床上常用治疗药物为雷珠单抗㊁贝伐单抗和阿柏西普等[21],但这些药物不能完全阻止视网膜内持续的血液和液体渗漏,从而导致慢性视网膜下间隙的纤维化,最终引起黄斑萎缩[22]㊂A M D患者中超过80%患有干性A M D,目前临床上还没有针对干性A M D 的有效治疗方法,也未见获批的治疗药物㊂通过补体抑制㊁神经保护和抗炎因子等多种靶点来治疗A M D的研究已见报道,但均未获得较好的治疗效果[23-24]㊂1.2S t a r g a r d t病S T G D是儿童和青少年常见的致盲性眼病,平均每8000~10000人中有1人患病[25]㊂S T G D是一种常染色体隐性遗传病,由A B C A4突变引起[26-27]㊂A B C A4基因编码的A B C A4蛋白在视网膜感光细胞和视网膜色素上皮细胞中特异性表达, A B C A4的突变会导致有毒的N-视黄醛-N-视黄乙醇胺(A2E)在视网膜底部积聚,使得R P E萎缩和视网膜感光细胞死亡[28]㊂S T G D患者通常经历快速的双眼中央视力丧失,并伴有视功能障碍和中央暗点㊂目前对于S T G D的治疗策略是修复或替换A B C A4,基于腺病毒的基因替换治疗已经成功地应用于一些眼部疾病,但因A B C A4基因较大无法用腺病毒载体递送[28]㊂1.3色素性视网膜炎R P是一种罕见的遗传性视网膜退行性疾病,发病率约为1/4000,通常发生在青少年中[29]㊂R P通常是遗传类眼部疾病,包括X连锁隐性遗传(5%~ 15%)㊁常染色体显性遗传(30%~40%)和常染色体隐性遗传(40%~60%)㊂光转导级联㊁纤毛运输和纤毛结构的80多个基因的突变导致视网膜感光细胞的功能障碍和死亡,使得R P E细胞的功能紊乱和在视网膜内迁移,从而导致R R的发生[30]㊂R P患者多见于20~30岁,出现夜盲和进行性视野丧失,晚期为完全失明㊂治疗R P可通过对常染色体隐性和X连锁隐性R P患者的基因补充以及对常染色体显性R P患者进行基因组编辑,但该技术只能对黄斑没有明显光感受器丢失和已确定致病突变基因的患者有效[31-32]㊂综上可知,A M D㊁R P和S T G D均未获得有效治疗方案,细胞治疗可以替代受损的R P E㊂h P S C-R P E为细胞治疗提供了充足的细胞来源,目前h P S C-R P E治疗A M D㊁R P和S T G D已进入临床试131第1期郭艳等:多能干细胞治疗视网膜退行性疾病:从实验室到临床转化的现状与挑战图1 临床上人多能干细胞靶向治疗的视网膜退行性疾病2 R P E 细胞治疗研究进展目前应用于细胞治疗的R P E 来源主要为人自体或异体R P E ㊁胎儿R P E 和来源人多能干细胞的R P E (见表1)㊂1991年首次进行了人R P E 临床移植试验,第一位A M D 患者在切除黄斑下的增生组织后进行了自体R P E 细胞移植,移植后部分患者视力有所提高;第二位A M D 患者进行同种异体R P E移植,但结果未显示对视力有所改善[36]㊂湿性A M D 患者在脉络膜新生血管膜(C h o r o i d a ln e o v a s c u l a r i z a t i o n ,C N V )移除后移植人胎儿R P E细胞片层,术后患者发生了免疫排斥反应[37]㊂W e i s z 等[38]尝试将胎儿R P E 细胞悬浮液注射在干性A M D 患者视网膜底部,发现患者视力无明显改善,并且观察到移植区域有进行性视网膜下纤维化㊂D e l P r i o r e 等[39]将湿性A M D 患者的C N V 膜摘除后移植了同种异体来源的R P E 细胞,但视力并没有得到很好的改善㊂使用同种异体R P E 移植的湿性A M D 患者,由于C N V 膜去除导致血-视网膜屏障受损,均表现出免疫排斥反应和视力下降;2012年首次公布了h P S C -R P E 细胞的临床试验结果[40],证明了h P S C -R P E 移植的安全性与可行性,随之h P S C -R P E 移植在多个临床Ⅰ/Ⅱ期应用研究相继展开㊂表1 临床移植R P E 细胞来源及其优缺点R P E 细胞来源优点缺点文献人自体R P E 容易获得㊁无免疫排斥反应数量有限㊁移植伴有高并发症㊁R P E功能缺失[36]人异体R P E 容易获得免疫排斥反应㊁数量有限㊁移植伴有高并发症㊁R P E 一些功能会缺失[36-39]胎儿R P E容易获得免疫排斥反应㊁伦理等问题㊁数量有限[38]人胚胎干细胞来源R P E 充足的来源㊁功能长期保持稳定㊁改善视力㊁可达到临床认证的质量与纯度免疫排斥反应㊁伦理等问题[34,41-42]人诱导多能干细胞来源R P E自体来源无免疫排斥反应㊁充足的来源㊁功能长期保持稳定㊁改善视力㊁可达到临床认证的质量与纯度自体来源成本昂贵㊁耗时长㊁伴有基因突变风险[34,41-44]3 h P S C -R P E3.1 h P S Ch P S C 是可以无限增殖的具有分化能力的多能性细胞,分为人胚胎干细胞(H u m a n e m b r yo n i c s t e m c e l l s ,h E S C )和人诱导多能干细胞(H u m a ni n d u c e d p l u r i po t e n t s t e m c e l l s ,h i P S C )㊂1998年T h o m s o n 等[45]从人受精囊胚内的细胞团中分离并建立了h E S C ,发现h E S C 能够分化成所有类型的细胞和组织㊂2006年T a k a h a s h i 等[46]通过逆转录病毒介导的转基因技术,将4个转录因子O c t 3/4㊁(M o u s e e m b r yo n i c f i b r o b l a s t ,M E F ),获得了与h E S C 形态相似㊁分化能力相当的细胞,命名为诱导性多能干细胞㊂T a k a h a s h i 等[47]和Y u 等[48]进一步获得了来源于人成纤维细胞(H u m a n f i b r o b l a s t,H F )的h i P S C 细胞㊂目前研究已证实,由h P S C 诱导分化的视网膜细胞,包括R P E [49]㊁视网膜神经节细胞(R e t i n a l g a n gl i o n c e l l ,R G C )[50]和视网膜感光细胞[51],可为A M D ㊁S T G D 和R P 等视网膜疾病的治疗提供新的细胞来源㊂3.2 h P S C -R P E2004年首次提出将h E S C 自发分化为R P E 细231浙江理工大学学报(自然科学)2024年 第51卷子和小分子化合物,如N i c o t i n a m i d e㊁A c t i v i n A㊁C H I R99021㊁N o g g i n和S B431542等,来缩短分化时间和提高分化效率[53-55]㊂目前进入临床试验所用的分化方法有拟胚体和单层分化法两种,H i r a m i 等[56]将h i P S C在含有D k k-1(100n g/m L)和L e f t y A(500n g/m L)的无血清培养基进行拟胚体悬浮培养,第20天将拟胚体接种在涂有多聚D-赖氨酸㊁层粘连蛋白和纤维连接蛋白的载玻片上,第40天可见到典型的R P E形态;L u等[57]利用h E S C系M A01和M A09进行分化,在含有B-27补充剂的培养液中拟胚体悬浮培养7d,接种在明胶包被的培养板中培养直到出现R P E;L i u等[58]利用Q-C T S-h E S C-2细胞系单层自发向R P E分化,以上分化获得的R P E已进入人的临床试验[56-58],其他临床级别的分化方案已见报道[59-60]㊂3.3h P S C-R P E治疗视网膜退行性疾病h P S C-R P E具有与人原代R P E细胞相似的功能,且比原代培养的R P E细胞更容易制备等优势,已成为视网膜退行性疾病细胞治疗的主要来源,h P S C-R P E治疗视网膜退行性疾病的策略(见图2)㊂已证实h P S C-R P E在视网膜下间隙发挥免疫调节作用:抑制T细胞激活,增加T细胞凋亡,并促进某些抗炎细胞因子的分泌[61]㊂h P S C-R P E细胞具有以下特点,更适合临床应用[34]:a)具有所需的功能;b)能够提供足够数量的移植细胞;c)可以达到临床级别质量认证和临床纯度标准㊂因此,多能干细胞,尤其是h P S C-R P E细胞,在眼科领域的临床应用中已显示出巨大潜力㊂4h P S C-R P E的临床应用研究进展4.1h E S C-R P E的临床应用研究进展2012年S c h w a r t z等[40]公布了首个h E S C-R P E 临床试验结果,将h E S C来源的R P E细胞产品M A09-h R P E移植到1名干性A M D患者(注册号: N C T01344993)和1名S T G D患者(注册号: N C T01345006)的视网膜下腔,每只眼睛注射50000个细胞㊂在随后的4个月观察中两位患者未出现过度增殖㊁致瘤性㊁异位组织形成或明显排斥的现象, S T G D患者的最佳矫正视力(B e s t-c o r r e c t e d v i s u a l a c u i t y,B C V A)有所提高,干性A M D患者的视力也有所改善[40]㊂2015年S c h w a r t z等[62]又对9名干性A M D患者(年龄>55岁)(注册号: N C T01344993)和9名S T G D患者(年龄>18岁) (注册号:N C T01345006)进行了2项前瞻性的临床Ⅰ/Ⅱ期研究,将M A09-h R P E分别以50000㊁100000个和150000个细胞的剂量注射到患者的视网膜腔下进行22个月随访检查㊂在18名患者中,1名患者术后4d出现了严重的玻璃体炎症,通过在玻璃体内注射抗生素㊁抗生素滴眼液和停用免疫抑制剂2个月后炎症消失;在观察期内所有患者均未发生不良增殖㊁注射部位移植组织生长畸胎瘤㊁异位组织或其他与h E S C-R P E相关的明显眼部不良安全事件;患者也没有发生视网膜脱离㊁增殖性玻璃体视网膜病变或微血管阻塞;所有患者中10名患者B C V A提高,7名患者B C V A有微弱的提高或者保持不变,1名患者B C V A有所下降[62]㊂2018年M e h a t等[63]针对h E S C-R P E移植区域视网膜结构和功能检测开启了另一项临床Ⅰ/Ⅱ期试验(注册号:N C T01469832),将h E S C-R P E悬液移植到12名晚期S T G D病患者,全身免疫抑制治疗13周,12名患者随访1年内均未出现移植不良反应,视力均保持稳定㊂A I R M有1项h E S C-R P E临床试验被撤回,注册号为N C T02563782,原因是改变研究设计与细胞系;O c a t a T h e r a p e u t i c s公司有1项临床试验被撤回,注册号为N C T02122159,原因是研究待修订㊁未来计划待定(h t t p s://c l i n i c a l t r i a l s.g o v/)㊂S o n g等[64]将h E S C-R P E细胞悬液分别注射到2名干性A M D患者(注册号:N C T01674829)和2名S t a r g a r d t病患者(注册号:N C T01625559)的视网膜下,每只眼睛注射40000个细胞,随访1年未发现与移植细胞相关的严重安全问题例如不良增殖㊁致瘤331第1期郭艳等:多能干细胞治疗视网膜退行性疾病:从实验室到临床转化的现状与挑战体问题经专家鉴定均与手术无关;3名患者B C V A 提高,1名患者B C V A保持稳定,进一步证明了h E S C来源的细胞可以作为一种潜在的安全的再生医学新的细胞来源㊂Y o u n g j e等[65]公布了针对3名S t a r g a r d t病患者的临床Ⅰ期试验结果(注册号: N C T01625559),将50000个h E S C-R P E细胞悬液注射到患者眼中,随访3年未观察到任何严重的全身不良事件以及与h E S C-R P E细胞相关的严重眼部不良事件,也未发现畸胎瘤形成等异常增生以及严重的眼部炎症或明显的免疫排斥症状;有1名患者术后19周发生了视网膜脱落,但经鉴定认为与h E S C-R P E细胞移植无关,1名患者B C V A提高,而其他患者B C V A保持稳定㊂L i u等[58]报道h E S C-R P E移植的临床研究(注册号:N C T02749734),3名湿性A M D患者先进行脉络膜新生血管切除,视网膜底部注射h E S C-R P E悬液,术后9个月出现了白内障等不良反应事件;在术后12个月的随访期间没有观察到病变区域有任何新的渗出性新血管生成㊁血管渗漏或持续的局部视网膜炎症,视觉功能有所改善,实验数据为使用h E S C-R P E细胞缓解早期湿性A M D的策略提供了支撑㊂为了确定移植细胞的长期存活能力和视觉功能的进一步发展变化,L i 等[66]针对N C T02749734临床试验将h E S C-R P E 细胞治疗扩展到7名早期S T G D患者,患者随访5年以评价h E S C-R P E治疗的远期安全性和有效性,发现除1名患者术后出现短暂性高眼压外,其余患者均无全身性或局部不良反应,7只手术眼在移植后1至4个月均有短暂的视觉功能增加或稳定㊂2018年M o o r f i e l d s眼科医院公布了h E S C-R P E贴片P F-05206388(注册号为:N C T01691261)植入2名急性湿性A M D和近期快速视力下降患者的安全性和可行性的临床Ⅰ期研究结果[67],该研究发生了3起严重的不良事件,包括用于免疫抑制的氟松龙植入物的缝合线暴露㊁视网膜脱离以及口服强的松龙后糖尿病的恶化,但与h E S C-R P E贴片移植无关;移植后12个月,2名患者的B C V A均有15个字母以上的改善㊂随后该临床试验又招募10位患者,正在进行中(h t t p s://c l i n i c a l t r i a l s.g o v/)㊂2018年R e g e n e r a t i v e P a t c h T e c h n o l o g i e s g公布的一项Ⅰ/Ⅱa期临床研究结果显示:使用由在微聚苯乙烯膜上培养的单层h E S C-R P E细胞组成的复合植入物C P C B-R P E1(注册号:N C T02590692)治疗5名年龄在69~85岁之间患有晚期干性A M D和G A 植,1名患者因为术中视网膜下间隙中存在纤维蛋白碎片没有接受移植;对4名患者进行120~365d 随访,发现C P C B-R P E1的整体外观包括色素沉着㊁位置和大小没有变化,位置稳定未发生移位;所有患者均未出现与移植㊁手术或免疫抑制相关的意外严重不良事件,接受移植的患者视力均保持稳定,没有恶化,其中1名患者B C V A改善了17个字母[68]㊂2021年该团队又对16名患者进行移植C P C B-R P E1治疗并长达一年随访观察[69],结果显示,其中15名患者接受了复合体移植,有4名患者出现严重的眼部不良事件,包括视网膜下出血㊁水肿㊁局灶性视网膜脱离或R P E脱离,出血原因为在手术中和术后从视网膜切开部位漏出,通过修改手术方案这些症状得到缓解;15名患者接受移植后一年没有发生与移植㊁手术或免疫抑制相关的意外严重不良事件,也没有发生移植物迁移的迹象;5名患者B C V A提高了5个字母以上㊂2022年该团队为了检测C P C B-R P E1移植后是否产生免疫反应,在移植2年后进行了一系列检测[70],发现移植时经过短期的免疫抑制药物治疗可以避免视网膜炎㊁玻璃体炎㊁血管炎㊁脉络膜炎等免疫反应临床症状的发生㊂2023年F e d e r a l U n i v e r s i t y o f São P a u l o公布了临床Ⅰ期研究结果(注册号:N C T02903576)[71],该研究将h E S C-R P E悬液移植到12名晚期S T G D患者中㊂术后未发生眼部炎症㊁眼内炎㊁视网膜脱离㊁眼出血㊁眼压升高㊁角膜水肿等手术相关不良事件㊂在1年的随访中未发生与h E S-R P E移植相关的不良反应,即异常增生㊁排斥反应或严重的眼部或全身安全问题,所有患者手术眼的B C V A均无明显改善,可能与该疾病是晚期有关㊂2014年L i n e a g e C e l l T h e r a p e u t i c s进行了一项Ⅰ/Ⅱa期临床试验(注册号:N C T02286089),将制备的h E S C-R P E产品O p R e g e n治疗24名干性A M D患者以评估其移植的安全性和耐受性(h t t p s://c l i n i c a l t r i a l s.g o v/)㊂A l l e n等[72]公布临床结果,所有患者中有9名患者在最后一次随访时B C V A保持稳定,目前的临床数据说明O p R e g e n具有良好的耐受性,长达5年的随访正在进行㊂2021年12月,L i n e a g e C e l l T h e r a p e u t i c s和H o f f m a n n-L a R o c h e(O T C Q X: R H H B Y)的子公司G e n e n t e c h达成了独家全球合作和许可协议,用于开发和商业化O p R e g e n用于治疗眼部疾病,交易金额高达6.7亿美元㊂根据协议, L i n e a g e C e l l T h e r a p e u t i c s将继续负责R G6501431浙江理工大学学报(自然科学)2024年第51卷开发和商业化,目前正在开展G A晚期干性A M D 患者临床试验(注册号:N C T05626114)㊂截至目前h E S C-R P E的临床数据表明,h E S C-R P E移植是安全,未发生移植细胞产生的严重不良事件,且大部分患者视力保持稳定或提高㊂h E S C-R P E 在R P患者中也开始临床试验,2019年C e n t r e D'e t u d e D e s C e l l u l e s S o u c h e s启动临床Ⅰ/Ⅱ期研究(注册号: N C T03963154),在R P患者视网膜下移植h E S C-R P E 贴片以评估安全性与耐受性㊁贴片位置是否移动㊁视觉功能的改善等(h t t p s://c l i n i c a l t r i a l s.g o v/)㊂2020年中国北京同仁医院启动临床Ⅰ期研究(注册号: N C T03944239),在10名R P患者(18~80岁)视网下注射150000个h E S C-R P E,为期1年随访以评估不良事件的发生和视觉功能的改善(h t t p s://c l i n i c a l t r i a l s.g o v/)㊂其他临床试验正在进行,目前所有h E S C-R P E的临床试验共有23项(见表2)㊂表2h E S C-R P E临床试验试验注册号开展机构状态疾病类型参与者数量细胞剂量/个随访时间/月初步临床结果视力改善不良事件参考文献N C T01345006 P h a s eⅠ/Ⅱ安斯泰来再生医学研究所完成S M D15ˑ1044移植后患者未表现出过度增殖㊁成瘤㊁异位组织形成或明显排斥的迹象1位患者视力提高无不良严重反应[40]95ˑ104/1ˑ105/1.5ˑ10522移植后未出现不良增殖㊁排斥反应或严重的眼部或全身安全问题6位患者视力提高;3位患者视力保持稳定1位患者出现严重的玻璃体炎症[62]N C T01344993 P h a s eⅠ/Ⅱ安斯泰来再生医学研究所完成D r y-A M D15ˑ1044移植后患者未表现出过度增殖㊁成瘤㊁异位组织形成或明显排斥的迹象1位患者视力提高无严重不良事件[40]95ˑ104/1ˑ105/1.5ˑ10522移植后未出现不良增殖㊁排斥反应或严重的眼部或全身安全问题4位患者视力提高;4位者视力保持稳定;1位患者视力下降无严重不良事件[62]N C T01469832 P h a s eⅠ/Ⅱ安斯泰来再生医学研究所完成S M D125ˑ104/1ˑ105/1.5ˑ105/2ˑ10512没有发生移植细胞的增殖以及有关的炎症反应12位患者视力均保持稳定1位患者出现视网膜裂孔;2位患者视网膜下出血;5位患者出现与免疫抑制相关的不良反应[63]N C T02463344 P h a s eⅠ/Ⅱ安斯泰来再生医学研究所完成A M D115ˑ104/1ˑ105/1.5ˑ105/2ˑ10548h t t p s://c l i n ic a l t r i a l s.g o v/N C T02445612 P h a s eⅠ/Ⅱ安斯泰来再生医学研究所完成S M D135ˑ104/1ˑ105/1.5ˑ105/2ˑ10548h t t p s://c l i n ic a l t r i a l s.g o v/531第1期郭艳等:多能干细胞治疗视网膜退行性疾病:从实验室到临床转化的现状与挑战续表试验注册号开展机构状态疾病类型参与者数量细胞剂量/个随访时间/月初步临床结果视力改善不良事件参考文献N C T03167203 P h a s eⅠ/Ⅱ安斯泰来再生医学研究所邀请注册黄斑变性36h t t p s://c l i n ic a l t r i a l s.g o v/N C T02941991 P h a s eⅠ/Ⅱ安斯泰来再生医学研究所完成S M D125ˑ104/1ˑ105/1.5ˑ105/2ˑ105h t t p s://c l i n ic a l t r i a l s.g o v/N C T02563782 P h a s eⅡ安斯泰来再生医学研究所撤回D r y-A M D02ˑ10518h t t p s://c l i n ic a l t r i a l s.g o v/N C T01625559 P h a s eⅠC H A B i ot e c hC O.,L t d.未知S M D24ˑ10412没有出现与移植细胞相关的不良增殖㊁致瘤性㊁异位组织形成或其他严重的安全性问题2位患者视力均提高1位患者右臂出现疱疹囊泡[64]35ˑ10436未出现任何严重的全身不良事件以及与h E S C-R P E细胞相关的严重眼部不良事件;也未有畸胎瘤形成的异常增生以及严重的眼部炎症或明显的免疫排斥症状1位患者视力提高;1位患者视力保持稳定1位患者视网膜脱落[65]N C T01674829 P h a s eⅠ/ⅡC H A B i ot e c hC O.,L t d.未知D r y-A M D24ˑ10412没有出现与移植细胞相关的不良增殖㊁致瘤性㊁异位组织形成或其他严重的安全性问题1位患者视力提高1位患者出现肺炎,可能与免疫抑制剂有关[64]N C T02749734P h a s eⅠ/Ⅱ重庆西南医院未知W e t-A M D31ˑ106121年随访期内移植的细胞没有出现不良反应2位患者视力提高;1位患者视力保持稳定无严重不良事件[58] S M D71ˑ10560移植的细胞是安全的,耐受性良好,疗效良好7位患者视力保持稳定2位患者术后出现高眼压[66]N C T02286089 P h a s eⅠ/ⅡL i n e a g eC e l lT h e ra p e u t i c s,完成D r y-A M D245ˑ104/2ˑ105移植的细胞具有良好的耐受性9位患者视力保持稳定[72]631浙江理工大学学报(自然科学)2024年第51卷续表试验注册号开展机构状态疾病类型参与者数量细胞剂量/个随访时间/月初步临床结果视力改善不良事件参考文献N C T05626114 P h a s eⅡG e n e nt e c h,I n c.招募D r y-A M D602ˑ1053h t t p s://c l i n ic a l t r i a l s.g o v/N C T03963154 P h a s eⅠ/ⅡC e n t r ed'E t u d ed e sC e l l u l e sS o u c h e s未招募R P712.89h t t p s://c l i n ic a l t r i a l s.g o v/N C T01691261 P h a s eⅠM o o r f i-e l d s E y eH o s p i t a l招募W e t-A M D212发生了与移植细胞无关的严重不良眼部事件2位患者视力提高用于免疫抑制的氟松龙植入物的缝合线暴露;视网膜脱离;口服强的松龙后糖尿病的恶化[67]N C T02590692 P h a s eⅠ/ⅡR e g e n e ra t i v eP a t c hT e c h n ol o g i e s,L L C未知r y-A M D/G A51ˑ10512移植体的整体外观包括色素沉着㊁位置和大小在随访过程中没有改变1位患者视力提高了;3位患者视力保持稳定1位患者发生视网膜下出血[68]161ˑ10512未发生意外的严重不良事件5位患者视力提高4位患者有严重的眼部不良事件,包括视网膜出血㊁水肿㊁局灶性视网膜脱离或R P E脱离㊂[69]161ˑ10524移植体2年后仍存活,未引起眼内炎症或急性排斥反应5位患者视力提高无严重不良事件[70]N C T02903576 P h a s eⅠ/ⅡF e d e r a lU n i v e r s i t yo f SãoP a u l o完成S M D121ˑ10612未发生细胞迁移㊁排斥反应㊁炎症㊁眼部或全身肿瘤12位患者视力保持稳定无严重不良事件[71]N C T02122159 P h a s eⅠ/ⅡO c a t aT h e r ap e u t i c s撤回近视性黄斑变性5ˑ104/1ˑ105/1.5ˑ105/2ˑ10512h t t p s://c l i n ic a l t r i a l s.g o v/N C T03102138M o o rf i e l d sE y eH o s p i t a l未招募A M D1048h t t p s://c l i n ic a l t r i a l s.g o v/C h i C T R 2200055625重庆西南医院眼科招募高度近视黄斑裂孔12h t t p s://w w w.c h i c t r.o r g.c n/i n d e x.h t m l731第1期郭艳等:多能干细胞治疗视网膜退行性疾病:从实验室到临床转化的现状与挑战续表试验注册号开展机构状态疾病类型参与者数量细胞剂量/个随访时间/月初步临床结果视力改善不良事件参考文献N C T03944239P h a s eⅠ北京同仁医院未知R P101.5ˑ10512h t t p s://c l i n ic a l t r i a l s.g o v/N C T03046407 P h a s eⅠ/Ⅱ郑州第一大学附属医院未知D r y-A M D10h t t p s://c l in i c a l t r i a l s.g o v/N C T02755428P h a s eⅠ/Ⅱ北京同仁医院未知D r y-A M D1012h t t p s://c l i ni c a l t r i a l s.g o v/注:A M D表示年龄相关性黄斑变性;S M D表示S t a r g a r d t病;R P表示色素性视网膜炎;D r y-A M D表示干性年龄相关性黄斑变性;W e t-A M D表示湿性年龄相关性黄斑变性;G A表示地理萎缩;空白表示无此项或未测量㊂4.2h i P S C-R P E的临床应用研究进展S o u i e d等[43]首次将患者皮肤成纤维细胞来源的h i P S C分化为R P E,h i P S C-R P E细胞片层移植到2名晚期湿性A M D患者视网膜底部(临床备案号: U M I N000011929);77岁女性患者术后1年的观察中未发现免疫排斥反应以及其他不良反应,视力没有得到很大改善但也没有恶化,初次证明了h i P S C-R P E治疗的安全性,68岁男性患者因为检测到h i P S C-R P E的3个基因缺失突变,没有接受手术治疗;2019年T a k a g i等[73]针对U M I N000011929临床试验公布了77岁女性患者的术后4年随访结果,移植眼的h i P S C-R P E在4年后仍存活,没有发生任何不良事件及免疫排斥反应,视力保持稳定,没有显著改善可能是术前感光层严重受损,并含有纤维化瘢痕,使视力恢复的潜力有限㊂同时T a k a g i等也通过彩色眼底摄影㊁O C T㊁荧光素血管造影㊁吲哚青绿血管造影等评估77岁女性患者移植部位h i P S C-R P E的功能,发现具备支持脉络膜生长等功能㊂2023年M a e d a等[44]针对U M I N000011929这一临床试验公布77岁女性患者5年随访结果,术后5年h i P S C-R P E存活,未观察到术中并发症㊁肿瘤发生㊁移植失败㊁排斥反应或其他移植细胞严重并发症等㊂相比于自体移植,异体移植可以减少制备时间和降低成本㊂2020年,S u g i t a等[42]从h i P S C库中制备人类白细胞抗原(H u m a n l e u k o c y t e A n t i g e n s, H L A)纯合子同种异体的h i P S C-R P E移植到具有相同H L A单倍型特征的5名湿性A M D患者(临床备案号:U M I N000026003),建立了两个评估和管理异体R P E移植免疫排斥反应的测试系统,即淋巴细胞移植物免疫反应(L G I R)测试和血清中R P E特异性抗体检测(R S A试验)㊂通过L G I R测试和R S A试验,疫排斥症状,在联合使用局部类固醇药物后症状缓解㊂移植的h i P S C-R P E在1年观察期内是存活的,但部分患者观察到息肉样病变,而且由于移植的位置没有控制好,无法判断该治疗方法的疗效㊂美国国家眼科研究所(N a t i o n a l E y e I n s t i t u t e, N E I)正在进行一项Ⅰ/Ⅱa期试验(注册号: N C T04339764)(h t t p s://c l i n i c a l t r i a l s.g o v/),将患者的血细胞来源h i P S C分化为R P E,h i P S C-R P E细胞片层移植到A M D患者视网膜底部以评估安全性㊂2022年8月第一例干性A M D患者已完成移植(h t t p s://w w w.n e i.n i h.g o v)㊂E y e s t e m R e s e a r c h是一家印度细胞治疗公司,异体h i P S C-R P E移植在动物模型中证明是安全的,并已首次开始人干性A M D患者临床试验(h t t p s://e y e s t e m.c o m/)㊂法国T r e e F r o g T h e r a p e u t i c s(h t t p s://t r e e f r o g.f r/)和日本H e a l i o s K.K.(h t t p s://w w w.h e a l i o s.c o.j p/e n/)公司也开始尝试h i P S C-R P E治疗干性A M D患者㊂截至目前h i P S C-R P E临床试验数据表明, h i P S C-R P E自体或异体移植是安全和可行的,没有移植h i P S C-R P E带来严重事件,且患者视力有所提高㊂其他h i P S C-R P E临床试验正在进行,目前h i P S C-R P E临床试验共有9项(见表3)㊂综上所述,基于h i P S C-R P E的细胞移植治疗视网膜退行性疾病安全可行,但其治疗的有效性㊁长期性尚需有更多的临床试验数据支持㊂5h P S C-R P E治疗的风险及挑战h P S C-R P E为视网膜退行性疾病的治疗提供了新的思路,并初步显示出一定的发展前景,h P S C-R P E已经用于开展临床试验研究,但治疗的有效性和长期安全性的数据还远远不够,并且仍存在风险831浙江理工大学学报(自然科学)2024年第51卷。
北联世纪神经干细胞(NSC)移植治疗视神经萎缩,再生视网膜,恢复视力!
视神经萎缩是一种常见的眼科疾病,是指视神经纤维因各种原因受损而变薄的过程。
这种疾病会导致视力下降,视野缺损,色觉异常和照明适应性减弱等问题。
因此,寻求有效的治疗方法一直是医学界的热点话题。
近年来,随着神经干细胞研究的不断深入,越来越多的研究者开始探索神经干细胞治疗视神经萎缩的潜力。
本文将介绍神经干细胞治疗视神经萎缩的现状和未来发展趋势。
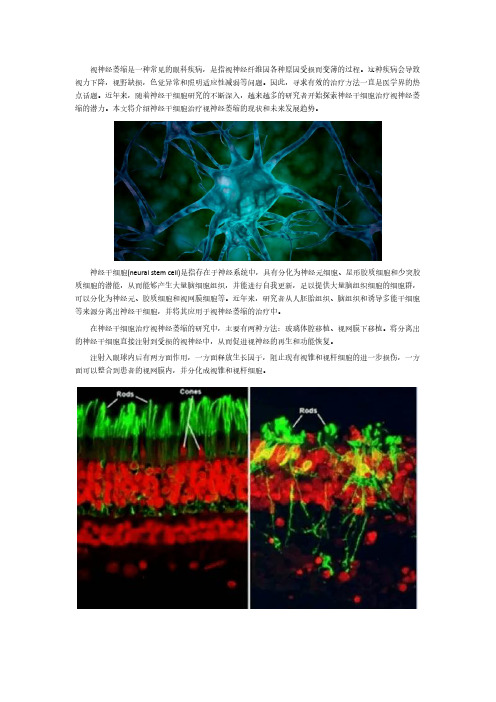
神经干细胞(neural stem cell)是指存在于神经系统中,具有分化为神经元细胞、星形胶质细胞和少突胶质细胞的潜能,从而能够产生大量脑细胞组织,并能进行自我更新,足以提供大量脑组织细胞的细胞群,可以分化为神经元、胶质细胞和视网膜细胞等。
近年来,研究者从人胚胎组织、脑组织和诱导多能干细胞等来源分离出神经干细胞,并将其应用于视神经萎缩的治疗中。
在神经干细胞治疗视神经萎缩的研究中,主要有两种方法:玻璃体腔移植、视网膜下移植。
将分离出的神经干细胞直接注射到受损的视神经中,从而促进视神经的再生和功能恢复。
注射入眼球内后有两方面作用,一方面释放生长因子,阻止现有视锥和视杆细胞的进一步损伤,一方面可以整合到患者的视网膜内,并分化成视锥和视杆细胞。
左图是正常视网膜,绿色为视杆细胞,红色为视锥细胞。
右图是视网膜色素变性患者的视网膜,可见受损的视锥和视杆细胞。
将神经干细胞移植到视网膜下腔,神经干细胞具有分化为神经元、星形胶质细胞和少突胶质细胞的能力,与宿主神经组织融合良好,并能长期存活。
神经干细胞移植后能向病变组织渗透融合、替代损伤细胞、重建神经环路,与宿主神经组织互相作用促进神经营养因子生成,生长出神经纤维伸入视神经起始端,启动宿主内源性修复机制,分化为新的视网膜神经细胞替代损伤细胞。
并且眼睛是人类的免疫豁免器官,并不会产生排斥,移植后也不需要服用抗排斥药物。
历时3分钟,无痛苦,门诊治疗,无需住院。
早在2017年11月的眼科创新峰会上,就发表了它为期12个月的临床1/2a期试验结果。
干细胞移植治疗视网膜退行性疾病的研究进展

干细胞移植治疗视网膜退行性疾病的研究进展
李雪丽;范吉平;梁丽娜
【期刊名称】《中国中医眼科杂志》
【年(卷),期】2015(0)6
【摘要】干细胞移植治疗视网膜退行性疾病的研究近年来受到广泛关注,这些研究通过移植胚胎干细胞、脐带干细胞、骨髓来源干细胞以及诱导多能干细胞等促进受损视网膜修复并改善视功能,个别研究已进入临床试验阶段,为视网膜色素变性和年龄相关性黄斑变性等患者带来复明的希望.本文对这一领域的研究现状予以综述,并就其发展前景和面临的挑战予以讨论.
【总页数】4页(P444-447)
【作者】李雪丽;范吉平;梁丽娜
【作者单位】中国中医科学院博士后流动站,北京100700;中国中医科学院眼科医院;中国中医科学院眼科医院;中国中医科学院;中国中医科学院眼科医院
【正文语种】中文
【中图分类】R774.6
【相关文献】
1.神经干细胞移植治疗神经退行性疾病的研究进展 [J], 龚亮;陈秀生;彭红波;丁嵬
2.干细胞来源的RPE细胞移植治疗视网膜退行性疾病的研究进展 [J], 曹天玥;江双红;晏晨;艾明
3.神经干细胞移植术治疗视网膜退行性疾病 [J], 黄文志;唐罗生
4.电刺激在视网膜退行性疾病治疗中的研究进展 [J], 于莎莎;汤欣;赵云;李永康;赵
健
5.视网膜类器官治疗视网膜退行性疾病的研究进展 [J], 奚惠雨;茅希颖;孙洁;袁松涛;刘庆淮
因版权原因,仅展示原文概要,查看原文内容请购买。
干细胞移植对于眼科疾病治疗的前景展望

干细胞移植对于眼科疾病治疗的前景展望眼科疾病对人们的视力和生活质量产生了重大影响,而干细胞移植作为一种前沿的治疗方法,为眼科疾病的治疗带来了新的希望。
干细胞移植利用人体自身的干细胞,能够修复和再生受损的眼部组织,恢复视力。
它不仅可以改善传统医疗手段无法解决的视力问题,而且还可以为一些不可逆眼疾带来新的曙光。
一、干细胞移植的原理与技术干细胞是一类具有自我更新和多向分化能力的细胞,是治疗眼科疾病的理想选择。
干细胞移植包括胚胎干细胞(ESC)和成体干细胞(ASC)两种类型。
胚胎干细胞来源于早期胚胎,具有较强的增殖和分化能力。
它们可以在体外培养中被鉴定、扩增,并通过特定的诱导分化以形成眼部细胞如视网膜上皮细胞、视杯细胞等,治疗疾病如黄斑病变、视网膜色素变性等。
成体干细胞来源于成年人的成体组织,具有较弱的增殖和分化能力。
它们可以从体内或体外获取,如脂肪、骨髓等组织。
成体干细胞可以分化为角膜上皮细胞、角膜内皮细胞等眼部细胞,治疗角膜疾病如干眼症、角膜溃疡等。
干细胞移植过程中,先获取干细胞,然后通过准确的移植手术将其注入患者受损的眼部组织,帮助其再生恢复。
干细胞移植技术的发展为许多眼科疾病的治疗提供了新的选择。
二、干细胞移植在眼科疾病治疗中的应用1. 黄斑病变治疗黄斑病变是一种与年龄相关的眼疾,在老年人群中较为常见。
传统治疗方法如激光治疗、抗血管内皮生长因子药物注射等只能减缓疾病进程,无法恢复受损的黄斑组织。
而干细胞移植可以通过替代和修复受损的黄斑细胞,恢复视力。
一些研究表明,胚胎干细胞或成体干细胞可以分化为具有成熟视网膜细胞特征的细胞,并成功移植到黄斑病变患者的眼部,使其视力得到改善。
2. 角膜疾病治疗角膜疾病是世界范围内患盲主因之一,传统治疗方法如角膜移植术存在供体匮乏、术后排斥等问题。
干细胞移植为角膜疾病的治疗带来了新的机遇。
通过在患者自身的角膜中移植干细胞,可以促进角膜上皮细胞再生,恢复其正常状态。
干细胞移植技术大大减少了供体需求,并提高了移植的成功率。
在视网膜色素变性中抑制细胞凋亡的研究进展

组成 复方制剂对先天性视网膜色 素变性动 物模型 ( ) 鼠, r小 d
采用原位 末端 转移 酶标记 ( L 方法 及组 织 病理 学 技 Tl J ) NE 术, 观察复方制剂 作用后 小 鼠视 网膜感 光细 胞凋亡 的变化 。
网膜电流图异常甚至熄灭为主要特 征。R P是 较为常见 的眼
陶涛等【 ] 1 研究显示 , 2 金纳多对皇家外科学院大 鼠( C ) R S 的感 光细胞早期凋亡有抑制作用 。梁丽娜 等L n 以黄芪等药 J
科遗传病 , 发病 率为 1 00 , / 0 [ 目前 己分离 出 的致病 基 因达 4
在视 网膜 色 素 变性 中抑 制 细胞 凋亡 的研 究 进展
郝小 波 徐 辉 王桂 红 , , ( . 西 中 医学院第 一 附属 医院 , 西 南 宁 50 2 ;. 西 中 医学 院 20 研 究生 , 西 南宁 500 ) 1广 广 30 32 广 06级 广 30 1
关 键 词 : 网膜 色素 变性 ; 视 细胞 凋 亡 ; 述 综
结果显示 中药复方制剂可以延缓 r 小 鼠视 网膜 色素变 性过 d 程 中感光 细胞凋亡 的发展 。钙离子 拮抗剂 可增强 视 网膜视
亡为共 同特点 _ 。虽然 目前还 没有 可有效 阻止 病变 进展和 3 J
恢复视网膜功能的特效治疗 方法 _ 但近年来 在防治视 网 5, J
膜方面取得了一些 可喜 的进 展 , 现就在 抑制视 网膜色素变性
比例研究 中证实 , 石斛 散具有 抵抗谷 氨酸 损伤 , 延缓视 网膜
凋亡的作 用。张蕾 等_ 研究提示 , 红细胞生成 素预处理 对 8 J 促 人视网膜 色素上皮 细胞氧 化损伤 具有 保护 作用 。骨 髓干 细 胞( MS ) B C 可塑性的发现使人们开 始研究 其在 R P的治疗上
干细胞在眼科临床和基础研究中的相关进展

干细胞在眼科临床和基础研究中的相关进展发表时间:2019-01-21T10:51:06.640Z 来源:《大众医学》2018年11月作者:王新乔[导读] 干细胞是一种多潜能细胞,其特性是具有定向分化与增殖的能力,如果机体内环境发生变化时,干细胞的分化潜能可以被体内不同信号途径所激活并定向分化为不同细胞和组织,因此干细胞有万能细胞之称。
摘要:干细胞是一种多潜能细胞,其特性是具有定向分化与增殖的能力,如果机体内环境发生变化时,干细胞的分化潜能可以被体内不同信号途径所激活并定向分化为不同细胞和组织,因此干细胞有万能细胞之称。
在眼科领域,干细胞为眼内功能障碍细胞的修复再生带来了希望,对角膜瘢痕、非新生血管性黄斑变性、色素性视网膜炎及斯特格氏病具有一定的治疗价值。
关键词:干细胞;眼科临床;基础研究;相关进展、1眼科研究中涉及的相关干细胞研究1.1角膜缘干细胞角膜缘干细胞的主要存在场所为角膜缘基地细胞,与角膜上皮更新有着紧密的联系。
相关学者通过对角膜缘干细胞的研究后发现,其所具备的“V ogt”栅栏结构特性主要存在与角膜基底部并与其关系密切。
干细胞不但可以增殖、分化为常丕细胞还可以形成一道屏障,用来阻滞结膜上皮细胞的移动并可以组个结膜上皮细胞进入到角膜表面,确保角膜可以有正常的功能与透明性。
当角膜出现白斑、溃疡或是化学烧伤等疾病时可以降低角膜缘干细胞的数量。
在眼科临床治疗中单眼疾病的患者可以通过角膜缘干细胞实现移植治疗;而双眼疾病的患者可以利用亲属干细胞进行角膜缘干细胞的移植。
1.2结膜干细胞结膜干细胞移植的主要位置为结膜上窟窿部位,利用组织培养可以实现结膜干细胞的扩增,当羊膜载体扩增到一定程度是时可以治疗结膜滤过泡渗漏。
1.3小梁网干细胞在猴子的Schwalbe利用小梁网干细胞可知,其可与角膜内皮细胞相连接,角膜内皮细胞密度要低于中央角膜细胞。
在进行青光眼患者治疗时可以使用小梁网干细胞移植方式,可有效的改善防水外流的情况。
干细胞来源的RPE细胞移植治疗视网膜退行性疾病的研究进展

干细胞来源的RPE细胞移植治疗视网膜退行性疾病的研究进展曹天玥;江双红;晏晨;艾明【摘要】在视网膜退行性疾病中,年龄相关性黄斑变性(age-related macular degeneration,ARMD)和Stargardt黄斑营养不良(SMD)分别是威胁老年人和青少年人群视力最常见的疾病.目前仍缺乏可改善干性ARMD和Stargardt黄斑营养不良患者视力的确切疗法.近年来,干细胞(stem cells)技术不断发展,干细胞来源的RPE细胞移植疗法成为视网膜退行性疾病治疗的热点及新方向,本文将对该研究领域的最新研究进展作一综述.%·Age - related macular degeneration ( ARMD ) and Stargardt's macular dystrophy ( SMD ) are two kinds of degenerative retinal diseases that respectively lead to irreversible vision loss of the elderly and juvenile population. However, the severe visual impairment in dry ARMD and SMD remains untreatable. In recent years, with the advancement of stem cell technology, stem cell-derived RPE cell transplantation therapy of retinal degeneration has become new research hotspot and direction. This article reviewed the progress of stem cell based approaches for treating retinal degenerative diseases and discussed the prospect and challenges in this field.【期刊名称】《国际眼科杂志》【年(卷),期】2017(017)012【总页数】3页(P2260-2262)【关键词】视网膜退行性疾病;年龄相关性黄斑变性;干细胞疗法;视网膜色素上皮【作者】曹天玥;江双红;晏晨;艾明【作者单位】430060 中国湖北省武汉市,武汉大学人民医院眼科;430060 中国湖北省武汉市,武汉大学人民医院眼科;430060 中国湖北省武汉市,武汉大学人民医院眼科;430060 中国湖北省武汉市,武汉大学人民医院眼科【正文语种】中文在视网膜退行性疾病中,年龄相关性黄斑变性(age-related macular degeneration,ARMD)和Stargardt 黄斑营养不良(SMD)分别是威胁老年人和青少年人群视力最常见的疾病。
视网膜色素变性治疗进展

三 药物治疗
6 米诺环素:研究发现在rd小鼠RP的早期可以延缓感光细胞丢 失,但不能完全阻止RP的发生。
7 钙通道阻滞剂:细胞内钙浓度升高可以诱导凋亡的发生,因 此钙通道阻滞剂可能抑制感光细胞的凋亡。
三 药物治疗
8 中药治疗:我国传统中医称RP为高风雀目,治疗药方以改善 循环,促进眼底和眼球周围的气血运行,疏通及儒养眼底脉 络为主。代表有夜明方(黄芪,丹参,枸杞子,当归,山萸 肉等)
6色觉改变:多数患者童年时色觉正常,以后逐渐出现异常, 典型改变为蓝色盲,红绿色障碍较少。
视网膜各层及电生理检查
视网膜电图
a波起源于光感受器外段;b波起源于内核层的mǖller细胞 或双极细胞
眼底检查所见 ——典型的改变
1 视乳头萎缩:发生于病程晚期,色淡而略显黄色,称为“蜡 样视乳头”,边缘稍稍模糊,偶有似被一层薄纱遮盖的朦胧 感。
2暗适应:初期视网膜视锥细胞功能尚正常,视杆细胞功能下 降,使视锥细胞曲线终末值升高,造成光色间差缩小。最后 视杆细胞功能丧失,视锥细胞值亦升高,形成高位的单相曲 线。
临床表现——症状:
3 视野:早期有环形暗点,位置与赤道部病变相符,其后环形 暗点向中心和周边逐渐扩大而成管状视野。
4中心视力:早期正常或接近正常,随着病程的发展而逐渐减 退,最终完全失明。
三 药物治疗
3 重组人促红细胞生成素:对中枢神经系统缺氧的神经元有保 护作用。
4 钙蛋白酶抑制剂:RP患者体内钙蛋白酶含量增高,而钙蛋白 酶可能是造成感光细胞凋亡的因素之一。
5 视杆细胞源性视锥细胞生成因子:典型的RP患者,其视杆细 胞凋亡是由于基因突变,而视锥细胞凋亡是由于体内缺乏视 杆细胞生成因子。
视野缩窄
临床表现——症状:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
