人教版高中化学必修一课件高一化学化学计量物质的量ppt
合集下载
高一化学人教版必修一物质的量浓度 .ppt

3、从1L 1mol/L蔗糖溶液中分别取出100mL、 10mL、1mL,取出的溶液中蔗糖的物质的 量浓度及物质的量各是多少?
100mL C(mol/L) n(mol) 10mL 1mL
1 0.1
1 0.01
1 0.001
从某溶液取出任意体积的溶液,其溶质的物质 的量浓度都相同,但所含溶质物质的量因体积 不同而不同。 (溶液是均一的、稳定的)
二、物质的量浓度的有关计算
1.有关溶质的计算
nB = cB · Vaq mB = nB · MB
例:配制250mL1.6mol/LNaCl溶液,需要 NaCl的质量是多少?
巩固练习:
1. 2mol/L的NaCl溶液1000mL,含溶质NaCl的 物质的量为 2 mol 。 2. 配制500mL,2mol/L的Na2SO4溶液,需要
(1)溶液体积相同,物质的量浓度也相同的任何
溶液里,含有溶质的物质的量 相同 ,但是 溶质的质量一般不相同 。
特 点
(2)从溶液中取出任意质量的 溶液,取出的这部分溶液中 溶质的质量分数没有发生变 化,和原溶液中溶质的质量 分数相等。但溶质的质量随 取出溶液的质量不同而不同
(2)从某溶液取出任意体积的溶液,其溶质的 物质的量浓度 相同 ,但所含溶质物质的 量随取出溶液的体积不同而不同 。
Na2SO4· 10H2O的质量为:322g。
2. 有关稀释(浓缩)的计算
在物质的量浓度溶液中,稀释(浓缩)前后:
溶质的物质的量
不变。
c(浓) ·V(浓) = c(稀) ·V(稀)
溶质的质量 在质量分数浓度溶液中,稀释(浓缩)前后: 不变。
m1(aq) · w1= m2(aq) · w2
例:配制250mL 1mol/L HCl溶液,需12mol/L
人教版高中化学高一化学必修一PPT课件化学计量在实验中的应用

cd
[思考与交流]下列叙述正确的(C )
A、物质的量就是物质的质量 B、物质的量指物质的数量 C、物质的量是国际单位制中的一个基 本物理量 D、物质的量是描述物质多少的
[思考与交流:]
2、判断并分析下列三种说法是否正
确( A、B、E )
A、0.5mol O B、2 molNa+ C、2 mol氧元素 D、1mol汽车 E、5mol电子
解:
0.012kg
碳原子数=
≈ 6.02×1023
1.993 × 10-23kg
国际上规定, 1mol粒子集体所含的粒子 数与0.012kg 12C中所含的碳原子数相同, 约为6.02×1023,把6.02×1023mol -1叫做 阿伏加德罗常数。
(二)阿伏加德罗常数
1、符号:NA 单位:mol-1 2、 NA=6.02×1023mol-1 3、思考:n 、 NA 、N三者之间的 关系?
观的粒子、使用时指明微粒种类(一般后 面跟化学式)
3、阿伏加德罗常数近似6.02×1023mol-1 4、摩尔质量数值等于相对分子质量或相 对原子质量
物质的量、质量、粒子数三者之间的关系
物质的量nB(mol)=-摩-质-尔-量-质-m-B量(-g-M)-B(-g-/mol) 微粒数N(个)
=------------------NA(个/mol)
[想一想]
1、曹冲称象的故事中解决问题的主导思想是什么? (化整为零,化大为小) (积小成大,聚微为宏)
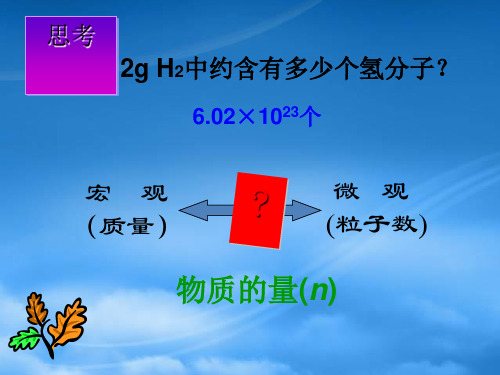
2、你能用托盘天平称一粒米的质量吗? 3、你知道20g或20ml水中有多少个水分子吗?
物质的量是把微观粒子和宏观物质 联系起来的一座桥梁.
物质的量
化学反应
微观粒子
不可见 不可数
[思考与交流]下列叙述正确的(C )
A、物质的量就是物质的质量 B、物质的量指物质的数量 C、物质的量是国际单位制中的一个基 本物理量 D、物质的量是描述物质多少的
[思考与交流:]
2、判断并分析下列三种说法是否正
确( A、B、E )
A、0.5mol O B、2 molNa+ C、2 mol氧元素 D、1mol汽车 E、5mol电子
解:
0.012kg
碳原子数=
≈ 6.02×1023
1.993 × 10-23kg
国际上规定, 1mol粒子集体所含的粒子 数与0.012kg 12C中所含的碳原子数相同, 约为6.02×1023,把6.02×1023mol -1叫做 阿伏加德罗常数。
(二)阿伏加德罗常数
1、符号:NA 单位:mol-1 2、 NA=6.02×1023mol-1 3、思考:n 、 NA 、N三者之间的 关系?
观的粒子、使用时指明微粒种类(一般后 面跟化学式)
3、阿伏加德罗常数近似6.02×1023mol-1 4、摩尔质量数值等于相对分子质量或相 对原子质量
物质的量、质量、粒子数三者之间的关系
物质的量nB(mol)=-摩-质-尔-量-质-m-B量(-g-M)-B(-g-/mol) 微粒数N(个)
=------------------NA(个/mol)
[想一想]
1、曹冲称象的故事中解决问题的主导思想是什么? (化整为零,化大为小) (积小成大,聚微为宏)
2、你能用托盘天平称一粒米的质量吗? 3、你知道20g或20ml水中有多少个水分子吗?
物质的量是把微观粒子和宏观物质 联系起来的一座桥梁.
物质的量
化学反应
微观粒子
不可见 不可数
2.3物质的量 课件(共28张ppt)高中化学人教版2019高中化学必修一

④集体化 物质的量可以表示多个微粒的特定组合或集合体,如 1 mol NaCl, 0.5 mol H2SO4
判断:
1mol大米 × 1 摩尔氧 × 1 摩尔氧原子 √ 3 摩尔 H2O √ 0.5 摩尔二氧化碳分子 √ 物质的量即是物质的质量,也是物质的数量 × 摩尔是7个基本物理量之一 ×
注意事项:
①专有化 “物质的量”四个字是一个整体,不能拆开,也不能添字。 如不能说成“物质量”或“物质的数量”等
②微观化 只用来描述微观粒子,如原子、分子、离子、中子、质子、 电子等,不能表示宏观的物质,如米
③具体化 必须指明具体粒子的种类,常用化学式表示,如“1 mol O”“2 mol O2”“1.5 mol O3”;不能说“1 mol 氧”
1 mol 粒子 = NA 个粒子 ≈ 6.02×1023个粒子
注意事项:
(1)阿伏加德罗常数是一个物理量,有单位,而不是纯数。 (2)不能认为1 mol粒子等于6.02×1023个,也不能认为 6.02×1023就是阿伏加德罗常数 (3)在计算时采用近似值6.02×1023mol-1
一个惊人的数字
这些物质中粒子数目非常庞大,不可能一个一个去数
生活中的计生量活中物品以什么方式计量?
大件物品以单个方式计量
情境引入 生活中物品以什么方式计量?
小件物品按一定的标准打包为一个集合体
微观粒子
物质的量
是国际单位制七个基本物理 量之一。
X个
物理量 长度 时间
物质的量 热力学温度
电流 发光强度
质量
......
8g
C: 12g/mol
2 molC
24g
H2O: 18g/mol 10 molH2O
180g
判断:
1mol大米 × 1 摩尔氧 × 1 摩尔氧原子 √ 3 摩尔 H2O √ 0.5 摩尔二氧化碳分子 √ 物质的量即是物质的质量,也是物质的数量 × 摩尔是7个基本物理量之一 ×
注意事项:
①专有化 “物质的量”四个字是一个整体,不能拆开,也不能添字。 如不能说成“物质量”或“物质的数量”等
②微观化 只用来描述微观粒子,如原子、分子、离子、中子、质子、 电子等,不能表示宏观的物质,如米
③具体化 必须指明具体粒子的种类,常用化学式表示,如“1 mol O”“2 mol O2”“1.5 mol O3”;不能说“1 mol 氧”
1 mol 粒子 = NA 个粒子 ≈ 6.02×1023个粒子
注意事项:
(1)阿伏加德罗常数是一个物理量,有单位,而不是纯数。 (2)不能认为1 mol粒子等于6.02×1023个,也不能认为 6.02×1023就是阿伏加德罗常数 (3)在计算时采用近似值6.02×1023mol-1
一个惊人的数字
这些物质中粒子数目非常庞大,不可能一个一个去数
生活中的计生量活中物品以什么方式计量?
大件物品以单个方式计量
情境引入 生活中物品以什么方式计量?
小件物品按一定的标准打包为一个集合体
微观粒子
物质的量
是国际单位制七个基本物理 量之一。
X个
物理量 长度 时间
物质的量 热力学温度
电流 发光强度
质量
......
8g
C: 12g/mol
2 molC
24g
H2O: 18g/mol 10 molH2O
180g
人教课标版高中化学必修一《物质的量》PPT课件33

=______。
试一试
1、3.5molNaOH的质量是多少?
140 g
2、求19.6g硫酸的物质的量?
0.2 mol
已经知道: 1mol 物质含有6.02*1023(即NA)个微粒; 1mol物质的质量在数值上=物质的式量
结论:
质量 ÷M
(m) ×M
物质的量 ×NA
(n)
÷NA
微粒数
(N)
物质的量是联系肉眼看不见的微 粒和宏观可称量的物质的桥梁。
粒多少的一个物理量。
符号:n
单位:摩尔(mol)
物质的量:专用名词,是一个 整体,不能简化或添加。
阿佛加德罗常数 (符号:NA,单位:mol-1)
1mol物质所含的微粒数
科学规定
12g12C所含的碳原子个数
实验测得
NA≈6.02×1023 mol-1
阿佛加德罗常数就是6.02×1023, 对吗?
章物质的量
C
+
O2 点燃
CO2
1个碳原子 1个氧分子 1个二氧化碳分子 微观
12克
32克
44克
宏观
物理量
长 度(l) 质 量(m) 时 间(t) 电 流(I) 热力学温度(T) 发光强度(I)
物质的量
பைடு நூலகம்
单位
米 千克 秒 安培 开尔文 坎德拉
摩尔
单位符号 m Kg s A K cd
mol
一、物质的量——表示物质所含微
假如现有阿佛加德罗常数个 鸡蛋,平均分给全世界的人 (约60亿),每人每天吃一 个,可以吃__2_7_亿____年。
把6.02×1023个面值为人民币1元的硬币 排成一行,将能来回于地球和太阳之间 240.8。亿如次果全世界的人来数,每人 每秒数一枚,那么要数约 32万。年
试一试
1、3.5molNaOH的质量是多少?
140 g
2、求19.6g硫酸的物质的量?
0.2 mol
已经知道: 1mol 物质含有6.02*1023(即NA)个微粒; 1mol物质的质量在数值上=物质的式量
结论:
质量 ÷M
(m) ×M
物质的量 ×NA
(n)
÷NA
微粒数
(N)
物质的量是联系肉眼看不见的微 粒和宏观可称量的物质的桥梁。
粒多少的一个物理量。
符号:n
单位:摩尔(mol)
物质的量:专用名词,是一个 整体,不能简化或添加。
阿佛加德罗常数 (符号:NA,单位:mol-1)
1mol物质所含的微粒数
科学规定
12g12C所含的碳原子个数
实验测得
NA≈6.02×1023 mol-1
阿佛加德罗常数就是6.02×1023, 对吗?
章物质的量
C
+
O2 点燃
CO2
1个碳原子 1个氧分子 1个二氧化碳分子 微观
12克
32克
44克
宏观
物理量
长 度(l) 质 量(m) 时 间(t) 电 流(I) 热力学温度(T) 发光强度(I)
物质的量
பைடு நூலகம்
单位
米 千克 秒 安培 开尔文 坎德拉
摩尔
单位符号 m Kg s A K cd
mol
一、物质的量——表示物质所含微
假如现有阿佛加德罗常数个 鸡蛋,平均分给全世界的人 (约60亿),每人每天吃一 个,可以吃__2_7_亿____年。
把6.02×1023个面值为人民币1元的硬币 排成一行,将能来回于地球和太阳之间 240.8。亿如次果全世界的人来数,每人 每秒数一枚,那么要数约 32万。年
化学计量在实验中的应用物质的量课件人教版高中化学必修一34ppt

(4) 物质的量的数值可以是整数,也可以是小数。
化学计量在实验中的应用物质的量课 件人教 版高中 化学必 修一34p pt
化学计量在实验中的应用物质的量课 件人教 版高中 化学必 修一34p pt
课堂练习一
1、判断正误:下面叙述是否正确?原因?
×(1)摩尔是七个物理量之一。 摩尔是物质的量的单位,不是七个基本物理量之一
2.如果把 6.02×1023 粒米给全球60亿人吃,每人每天吃一斤,要吃14万年。
3.假想把1摩尔(6.02×1023个)水分子(分子直径2×10-10m)一个挨一个地摆在地球赤 道上(周长为4万千米),可以绕地球赤道300万周!
注意 摩尔只能描述微观粒子,不能描述宏观物质。
化学计量在实验中的应用物质的量课 件人教 版高中 化学必 修一34p pt
B、数值上等于物质的相对原子(分子)质量
C、单位:g/mol(克/摩尔) 、kg/mol
课堂练习四 求出下列物质的摩尔质量?
1.Fe 2.O2 3.NaCl 4.H2SO4 5.Ca质的质量、物质的量、摩尔质量之间的关系
n = 物质的量
(单位:mol)
课堂练习一
2、判断正误 ①1mol瓜子
×( )
②1mol氧原子就是 6.02×1023 个
③1molH2O ④1molOH⑤1molFe
√( ) √( ) √( )
化学计量在实验中的应用物质的量课 件人教 版高中 化学必 修一34p pt
×( )
化学计量在实验中的应用物质的量课 件人教 版高中 化学必 修一34p pt
×(2)物质的量就是等于物质的质量。 物质的量是一个专有名词,不能与质量混淆
×(3)1mol沙子。 物质的量只适用于微观粒子,不能用来说明宏观物质
化学计量在实验中的应用物质的量课 件人教 版高中 化学必 修一34p pt
化学计量在实验中的应用物质的量课 件人教 版高中 化学必 修一34p pt
课堂练习一
1、判断正误:下面叙述是否正确?原因?
×(1)摩尔是七个物理量之一。 摩尔是物质的量的单位,不是七个基本物理量之一
2.如果把 6.02×1023 粒米给全球60亿人吃,每人每天吃一斤,要吃14万年。
3.假想把1摩尔(6.02×1023个)水分子(分子直径2×10-10m)一个挨一个地摆在地球赤 道上(周长为4万千米),可以绕地球赤道300万周!
注意 摩尔只能描述微观粒子,不能描述宏观物质。
化学计量在实验中的应用物质的量课 件人教 版高中 化学必 修一34p pt
B、数值上等于物质的相对原子(分子)质量
C、单位:g/mol(克/摩尔) 、kg/mol
课堂练习四 求出下列物质的摩尔质量?
1.Fe 2.O2 3.NaCl 4.H2SO4 5.Ca质的质量、物质的量、摩尔质量之间的关系
n = 物质的量
(单位:mol)
课堂练习一
2、判断正误 ①1mol瓜子
×( )
②1mol氧原子就是 6.02×1023 个
③1molH2O ④1molOH⑤1molFe
√( ) √( ) √( )
化学计量在实验中的应用物质的量课 件人教 版高中 化学必 修一34p pt
×( )
化学计量在实验中的应用物质的量课 件人教 版高中 化学必 修一34p pt
×(2)物质的量就是等于物质的质量。 物质的量是一个专有名词,不能与质量混淆
×(3)1mol沙子。 物质的量只适用于微观粒子,不能用来说明宏观物质
高中化学必修一物质的量课件.ppt

) )
28 56
=0.5__mol铁原子。
② 水的式量是_1_8_,摩尔质量是_1_8_g_/_m_o;l 2mol的水是36克;90g水是_91_08__=_5mol
“非典”肆虐时期,过氧乙酸(C2H4O3) 是被人们广泛使用的消毒剂。
相对原子质量:C:12 H:1 O:16
①过氧乙酸的式量是_7_6_ ; 摩尔质量是 76g/mol__;
害!
我一口气能喝36克水,
我才厉害!
小结 :
1.物质的量是一种基本物理量,它实际上表示含有一定 数目粒子的集体,符号为n。 2.摩尔是物质的量的单位,含有6.02×1023 个粒子的任 何粒子集体计量为1摩尔。摩尔简称摩,符号为mol。 3.6.02×1023 mol-1叫做阿伏加德罗常数,是个物理量, 符号为NA。 4.单位物质的量的物质所具有的质量叫做摩尔质量,符 号为M。任何物质的摩尔质量以g/mol为单位时,在数值 上与该粒子的相对原子质量或相对分子质量相等。 5.粒子数(N)、物质的量(n)和质量(m)之间的关系:
2 NA,为 1.204×1024 个。
1. 下列说法正确的是
(
A. Na的摩尔质量为23g
B. Na的摩尔质量为23
C. Na的摩尔质量为23g/mol
D. Na的摩尔质量为23g×10-2kg/mol
2.下列气体中所含分子数目最多的是(
A.1gH2 C.30gCl2
B.10gCO2 D.17g NH3
(来源于拉丁文“moles”,表示大量和堆量的意思,是含
有相同个数的分子、原子等微粒的巨大集合体)
1打铅笔:12只 1双袜子:2只 1世纪: 100年
1mol某种微粒是多 少个呢?
高中化学物质的量在化学方程式计算中的应用课件新人教必修1.ppt
单位应 上下一致
0.1mol
V (H2)
1mol
22.4L
0.1mol = V (H2)
V(H2)=
0.1 mol × 22.4 L 1mol
= 2.24 L
(1)化学方程式所表示的是实际参加反 应的物质之间量的关系。
(2)单位应上下一致。
Zn + 2HCl == ZnCl2 + H2
65g 2mol
H22↑
:
2
:
2
:1
微粒数之比 2个 : 2个 : 2个 : 1个
扩大NA倍
2NA : 2NA : 2NA : NA
物质的量(n)之比 2mol : 2mol :2mol : 1mol
化 学 计 量 数 之 比 =物 质 的 量 之 比
【例 题 】 实验室用6.5g Zn与足量盐酸完全反应。
求:① Zn的物质的量;②参加反应HCl的物质的量;
(要求的量用n(B)或设未知数x、y等代表)
(4)根据计量关系进行计算。
解: Zn + 2HCl == ZnCl2 + H2
1
2
1
怎样计算生成 H2的体积?
0.1mol n (HCl)
n (H2)
1 = 0.1 mol
2
n(HCl)
1 = 0.1 mol
1
n(H2)
n(HCl)= 0.2 mol
n(H2)= 0.1 mol
2、取两份物质的量相等的铝粉,分别与足量的盐酸、
浓氢氧化钠溶液反应,在相同状态下产生的气体体积之
比是(A )
A.1:1 B.1:2
C. 1:3
D. 3:2
3、0.16 g氢氧化钠恰好与20 mL的盐酸完全反应,则盐
高中化学人教版必修一课件:1.2.1物质的量 (共21张PPT)

小结:
物质的量的意义:是联系宏观和微观的纽 带或桥梁。表达式:
M
m
M
NA
n NA
宏观物体 质量
桥梁
N
微观粒子 个数
6.02×1023×1.993×10-23g =12g
很好称
6.02×1023是个很神奇的数据!!!
国 际 上 规 定 : 1mol 任 何 粒 子 所 含 的 粒 子 数 与 0.012kg 12C中所含的碳原子数相同。
0.012kg 12C
碳原子
已知:一个碳原子的质量为 1.993×10-23g
求: 0.012kg12C中所含的碳原子数?
12g 解: 碳原子数=
1.993 × 10-23g
≈ 6.02×1023
二、阿伏加德罗常数
符号:NA
意大利科学家
1:等于0.012kg 12C所含的原子数。
2:定义:1mol任何粒子的粒子数,叫阿伏加德 罗常数,即NA。
3:约为6.02×1023mol-1
= 6.02 × 1023 答:O2的氧原子数为6.02 × 1023个。
1mol物质的质量到底有多大?
实践体验
粒子符号 物质的式 每个粒子的质 1摩物质含有的 1摩物质质
量
量(g/个) 粒子数(个) 量(g)
C
12
1.993X10-23 6.02 × 1023 12
Fe
56
9.032X10-23 6.02 × 1023 56
m(H2SO4)
24.5克
n(H2SO4)==
==
M(H2SO4)
98克/摩
== 0.25mol
n(o)=4n(H2SO4)=1.0mol
物质的量【新】人教版高中化必修一PPT课件

(× ) (√) (× )
(× )
(√ )
(× )
㈡ 、阿伏加德罗常数 1、定义:1mol任何粒子的粒子数叫做阿伏加德罗常数 2、符号: NA (NA≈6.02 ×1023mol-1) 3、单位:mol-1
特别提醒:
⑴、阿伏加德罗常数不是一个常数,而是一个物理量。 ⑵、1mol不同物质中所含的粒子数是相同的,但由于 不同粒子的质量不同,所以1mol不同物质的质量不同
⑵ 物质的量只能用来表示微观粒子的多少,不能用来表示宏 观物质的多少。
⑶ 根据摩尔的规定,1mol任何粒子集合体所含的粒子数都约为 6.02×1023,如1molO2所含氧分子数为6.02×1023
小试牛刀 1、判断下列说法是否正确,并说明理由 ⑴ 1mol氧 ⑵ 0.25mol CO2 ⑶ 摩尔是七个基本物理量之一 ⑷ 0.25mol H2中含有3.01×1023个氢分子 ⑸ 3mol NH3中含有3molN和9molH ⑹ 1mol细菌
当堂练习:
1、3.01×1023个CO2的物质的量是多少? 0.5mol
2、1.204×1024个H2O 的物质的量是多少? 2mol
3、2 mol Mg变成Mg2+时失去电子数是多少? 2×2×6.02×1023 个
[名师课堂教学]物质的量【新】人 教版高 中化必 修一PPT 课件( 完整版 PPT)
4、物质的量(n)、粒子数(N)、阿伏伽德罗常数(NA) 三者之间的关系:
物质的量(n)
粒子数(N)
1mol H
2mol H
NA个H
2×NA个H
… …
… …
n mol H
N = n × NA
n×NA个H
n=
N NA
人教版高中化学必修1课件:1.2化学计量在实验中的应用(第1课时) (共26张PPT)

人教版七年级上册Unit4 Where‘s my backpack?
超级记忆法-记忆方法
TIP1:在使用场景记忆法时,我们可以多使用自己熟悉的场景(如日常自己的 卧 室、平时上课的教室等等),这样记忆起来更加轻松; TIP2:在场景中记忆时,可以适当采用一些顺序,比如上面例子中从上到下、 从 左到右、从远到近等顺序记忆会比杂乱无序乱记效果更好。
含有 1.204 1024 个CO2分子。 6、 3 mol H2O中含有的氧原子数与1.5 mol CO2 中含有的氧原子数相同。
一、物质的量的单位——摩尔
知识链接
C + O2
微粒个数 1个 1个
△
==
CO2
1个
物质的量 1mol
2H2
微粒个数 2个
1mol
+ O2
1个
1mol
△
== 2H2O
什么是学习力
什么是学习力-你遇到这些问题了吗
总是 比别人 学得慢
一看就懂 一 做就错
看得懂,但不 会做
总是 比别人学得差 不会举一反三
什么是学习力-含义
管理知识的能力 (利用现有知识 解决问题)
学习知识的能力 (学习新知识 速度、质量等)
长久坚持的能力 (自律性等)
什么是学习力-常见错误学习方式
一、物质的量的单位——摩尔
阿伏加德罗常数 (约6.02×1023mol-1)
N = NA × n
粒子个数
物质的量
一、物质的量的单位——摩尔
公式一:
物质的量( n ) 、粒子个数( N )和阿伏 加德罗常数( NA )三者之间的关系:
n= N NA
物质的量
(n)
变换为
×NA
超级记忆法-记忆方法
TIP1:在使用场景记忆法时,我们可以多使用自己熟悉的场景(如日常自己的 卧 室、平时上课的教室等等),这样记忆起来更加轻松; TIP2:在场景中记忆时,可以适当采用一些顺序,比如上面例子中从上到下、 从 左到右、从远到近等顺序记忆会比杂乱无序乱记效果更好。
含有 1.204 1024 个CO2分子。 6、 3 mol H2O中含有的氧原子数与1.5 mol CO2 中含有的氧原子数相同。
一、物质的量的单位——摩尔
知识链接
C + O2
微粒个数 1个 1个
△
==
CO2
1个
物质的量 1mol
2H2
微粒个数 2个
1mol
+ O2
1个
1mol
△
== 2H2O
什么是学习力
什么是学习力-你遇到这些问题了吗
总是 比别人 学得慢
一看就懂 一 做就错
看得懂,但不 会做
总是 比别人学得差 不会举一反三
什么是学习力-含义
管理知识的能力 (利用现有知识 解决问题)
学习知识的能力 (学习新知识 速度、质量等)
长久坚持的能力 (自律性等)
什么是学习力-常见错误学习方式
一、物质的量的单位——摩尔
阿伏加德罗常数 (约6.02×1023mol-1)
N = NA × n
粒子个数
物质的量
一、物质的量的单位——摩尔
公式一:
物质的量( n ) 、粒子个数( N )和阿伏 加德罗常数( NA )三者之间的关系:
n= N NA
物质的量
(n)
变换为
×NA
高中化学人教版高一必修一1.2化学计量在实验中的应用物质的量浓度课件(共23张PPT)

D、20ml 1mol/L AlCl3
eg3、下列各溶液中,Na+ 浓度最大的是 (
)
A、4L 0.5mol/L NaCl溶液 C、0.8L 0.4mol/L NaOH溶液
B、1L 0.3mol/L Na2SO4溶液 D、2L 0.15mol/L Na3PO4溶液
结论:溶液各处浓度相等,与体积或质量多少无关
3、现有质量分数为98%、密度为1.84g/mL的硫酸溶液, 求此溶液中硫酸的物质的量浓度?
4、标准状况下,将448L NH3溶于1L水中,得到密度为 0.9g/cm3的氨水,求此氨水的物质的量浓度。
练习四
eg1、1000ml 2mol/L Na2SO4溶液中,C( Na+)=
,
C(SO42-)=
eg4、50mL 0.5mol/L BaCl2溶液和100mL0.5mol/L NaCl溶液 混合后,求溶液中Cl-的物质的量浓度(设溶液体积变化 忽略不计)。
eg5、将0.3mol NaCl、0.2mol Na2SO4、0.1mol ZnSO4混合配 成2L溶液,求溶液中各种离子的物质的量浓度。
• 4、未用蒸馏水洗涤用过的烧杯和玻璃棒,所配溶液浓度偏
• 5、溶液在移入容量瓶时有少量溅出,所配溶液浓度偏
• 6、定容时加水超过了刻度线。偏
。
• 7、定容后摇匀,发现凹液面低于刻度线。偏
。
• 8、定容时仰视读刻度,所配溶液浓度偏
,俯视偏
• 9、用量筒量取液体时,俯视读数,使所读溶液体积偏
• 10、配制硫酸时,用蒸馏水洗涤了量筒,所配溶液浓度偏
浓度
→ 一定量的溶液里所含溶质的多少。
=质量分数
= 体积分数
=质量-体积浓度
=物质的量浓度
人教版高中化学必修一课件第一课时物质的量.ppt

解:1个硫酸分子中含有4个O,O的 质量是:
m(O)= n(O) ×M(O)
=2 mol×4×16g/mol = 128g 答:氧元素的质量为128g.
[例题] 0.5molX物质,质量为16g,求X的摩尔质 量是多少?
解: M(X)= m(X)÷n(X)
=16g ÷0.5mol
= 32g/mol
空白演示
在此输入您的封面副标题
§1.2化学计量在实验中的应用
第一课时 物质的量的单位---摩尔
打
定义:表示一定数 量物质的集合体
一打铅笔
物质的量(摩尔) 定义:表示一定数 量粒子的集合体
一个分子(很小, 不方便表示)
一“堆”分 子
(可以看见)
一、物质的量
定义:表示含有一定数目粒子的集合体的一 个物理量,符号为n。
6.02 × 1023
18g
从上表可以看出,1mol任何粒子或物质所具 有的质量有什么特点呢?
摩尔质量
定义:单位物质的量的物质所具有的质量
符号:M,常用单位为:g/mol(或g·mol-1)。
数值:等于物质或粒子的式量(相对原子质量或相对分
子质量)。摩尔质量M=源自m 物质的质量 n 物质的量
公式变形:
3、下列说法中,不正确的是( A )
A.1 mol任何物质都含有6.02×1023个原子
B. 0.012kg 12C约含有6.02×1023个碳原子
C. 0.2 mol H2O所含的H原子数为0.4 NA D. 使用摩尔这一单位时必须指明微粒的名
称
1mol的物质中含有粒子数相同, 那1mol不同物质的质量相同吗?
1molO2中含O2分子6.02×1023个 2molO2中含O2分子__2_×__6_._0_2_×__1_0_23__个 那么3molN2含N2分子_3_×_6_._0_2_×__1_0_23___个
m(O)= n(O) ×M(O)
=2 mol×4×16g/mol = 128g 答:氧元素的质量为128g.
[例题] 0.5molX物质,质量为16g,求X的摩尔质 量是多少?
解: M(X)= m(X)÷n(X)
=16g ÷0.5mol
= 32g/mol
空白演示
在此输入您的封面副标题
§1.2化学计量在实验中的应用
第一课时 物质的量的单位---摩尔
打
定义:表示一定数 量物质的集合体
一打铅笔
物质的量(摩尔) 定义:表示一定数 量粒子的集合体
一个分子(很小, 不方便表示)
一“堆”分 子
(可以看见)
一、物质的量
定义:表示含有一定数目粒子的集合体的一 个物理量,符号为n。
6.02 × 1023
18g
从上表可以看出,1mol任何粒子或物质所具 有的质量有什么特点呢?
摩尔质量
定义:单位物质的量的物质所具有的质量
符号:M,常用单位为:g/mol(或g·mol-1)。
数值:等于物质或粒子的式量(相对原子质量或相对分
子质量)。摩尔质量M=源自m 物质的质量 n 物质的量
公式变形:
3、下列说法中,不正确的是( A )
A.1 mol任何物质都含有6.02×1023个原子
B. 0.012kg 12C约含有6.02×1023个碳原子
C. 0.2 mol H2O所含的H原子数为0.4 NA D. 使用摩尔这一单位时必须指明微粒的名
称
1mol的物质中含有粒子数相同, 那1mol不同物质的质量相同吗?
1molO2中含O2分子6.02×1023个 2molO2中含O2分子__2_×__6_._0_2_×__1_0_23__个 那么3molN2含N2分子_3_×_6_._0_2_×__1_0_23___个
第一章第2节化学计量在实验中的应用2021-2022高中化学人教版必修1课件(25张ppt)

3.下列说法正确的是( )
(A)在标准状况下,1mol水和1molH2的体积都 约是22.4L (B)2gH2和44gCO2的体积相等 (C)1mol某气体的体积为22.4L,则该气体一定处于标准状
况
(D)在标准状况下,1gH2和11.2LO2的物质的量相等 [答案] (D)
4.NA代表阿伏加德罗常数,下列说法正确的是(D ) A. 标准状况下,22.4 L氦气与22.4 L氧气所含原子数均为2 NA B. 1 mol MgCl2中含有的离子数为2 NA C. 在常温常压下,11.2L氮气所含的原子数为NA D. 17g氨气所含电子数目为10 NA
,
压强之比为
, 分子数目之比为
。
1个乒乓球所占的体积和1个篮球所占的体积哪个大?
10个乒乓球所占的体积和1个乒乓球所占的体积哪 个大?
10个紧密排列在一起的乒乓球所占的体积和10个松散排列在一 起的乒乓球所占的体积哪个大?
思考交流
对于1mol不同的固体和液体物质,为什么它们的体积各不相同, 而相同条件(标准状况)下,1mol不同的气体体积基本相同呢?
人教版 必修一
从实验学化学 第一章
第2节 化学计量在实验中的应用
目录
01 质 量 ( m )
N n
NA
02 物 质 的 量 ( n ) 03 微 粒 数 ( N )
n m M
04 物 质 的 体 积 ( V )
思考交流
物质 1 mol该物质的 密度(g·cm-3) 1 mol物质具有
质量(g)
的体积(L)
固体物质
液体物质
气体物质
分子的直径为0.4nm 分子之间的平均距离为4nm
小结
➢ 固体、液体物质粒子间间隔很小,在粒子数目相同的情况下, 固体、液体的体积主要由粒子本身大小决定。
人教版化学必修一第二节化学计量在实验中的应用物质的量教学课件

÷M
(m)
人教版化学必修一第二节化学计量在 实验中 的应用 物质的 量
【练习】1、 P13 “学与问”
2.填空题
(1)4 mol O2中含有______8___mol O原子;
(2)0.5mol Na2SO4中所含的Na+离子数为 6_._0_2_ㄨ_ 1023 (3) 2mol CO2中含有 2 mol C 和 4 mol O,
B正确; C错误。大米不是微观粒子。
人教版化学必修一第二节化学计量在 实验中 的应用 物质的 量
碳单质
0.012kg 12C
1mol
碳原子数约为
6.02×1023
【趣味小知识】
如果把6.02×1023个直径为2.5cm的硬币排成一 行,可以来回于地球与太阳之间240.8亿次。 如果把 6.02×1023 粒米给全球60亿人吃,每人 每天吃一斤,要吃14万年。
解:O2的分子数为 N = n × NA =0.5 mol× 6.02 ×1023mol-1 = 3.01 × 1023
答:O2的分子数为3.01 × 1023个。
人教版化学必修一第二节化学计量在 实验中 的应用 物质的 量
人教版化学必修一第二节化学计量在 实验中 的应用 物质的 量
疑问:
国际上为什么
要把 0.012Kg 12C中所含的碳原子数大约
为6.02×1023 个粒子的任何粒子集
体定为1摩尔呢? 这样规定有什么好处呢?
人教版化学必修一第二节化学计量在 实验中 的应用 物质的 量
人教版化学必修一第二节化学计量在 实验中 的应用 物质的 量
探索发现
粒子 相对分子或 1个分子或原子的 1摩尔物
含有 1.204 1024 个CO2分子。
物质的量 高中化学必修一教学课件PPT 人教版

课堂达标
3.假设1gN2含a个分子,则阿伏加德罗常数可以表示为( C )
A.a/28 mol-1
B.a mol-1
C.28a mol-1 D.a/14 mol-1
解析:根据公式n=m/M,可以计算出1g氮气的物质的量是1/28mol, 则根据公式n=N/NA,可知,阿伏加德罗常数可以表示成n/N,即表示为 28a mol-1,因此选C。
思考·讨论
用摩尔作为计量原子、离子或分子等微观粒子的“物质的量”的单 位。那么1mol可以代表多少粒子呢?
国际规定,1mol粒子集合体所含的粒子数约为6.02×1023。
1mol粒子
6.02×1023个粒子
新课讲解
阿伏伽德罗常数
概念:1mol任何粒子的粒子数,符号NA。通常用 6.02×1023 mol-1表示。
①计算物质的量或质量的问题,要使用公式进行求解。 ②计算物质所含粒子数量,要使用公式进行求解。
课堂达标
1、在0.5molNa2SO4中含有Na+的数目约为( B )个。 A.3.01×1023
B.6.02×1023
C.0.5
D.1
解 析 : 0.5molNa2SO4 中 钠 离 子 的 物 质 的 量 为 0.5mol×2=1mol , 由 N=n×NA 可 知 , 钠 离 子 的 个 数 为 1mol×NAmol-1=NA≈6.02×1023,因此选B。
思考·讨论
1molH2O质量如何计算?
根据物质的量、质量与摩尔质量之间存在的关系:
可以列出式子m(H2O) = n(H2O)×M(H2O)
= 1mol×18g/mol
= 18g 因此1molH2O的质量是18g。
M(H2O)=2×1+1×16 =18g/mol
物质的量【新教材】人教版高中化学必修一PPT课件

原子太小
集体
求商
“集体”的数目选择多少呢?
1个O原子
2.6578×10-23g
不好称
1万个O原子
104×2.6578×10-23g = 2.6578×10-18g
不好称
13g = 2.6578g
能称 但不方便
6.02×1023个O原子 6.02×1023×2.6578×10-23g 很好称 =16g
答: 0.5 mol O2的氧原子数为6.02 × 1023个
物质的量【新教材】人教版高中化学 必修一P PT课件
物质的量【新教材】人教版高中化学 必修一P PT课件
当堂练习:
1、3.01×1023个CO2的物质的量是多少? 0.5mol
2、1.204×1024个H2O 的物质的量是多少? 2mol
高中化学必修第一册
第二章 海水中的重要元素—钠和氯 第三节 物质的量
第1课时 物质的量的单位—摩尔
课标要点: 1、了解物质的量及其相关物理量的含义和应用 2、阿伏伽德罗定律及其推论 3、物质的量浓度的概念及计算 4、配置一定物质的量浓度的溶液
曹冲称象的故事
1、曹冲解决问题的方法?
象太大
分割
求和
2、怎样称一个原子?
⑵ 摩尔的规定:
国际上规定:1mol粒子集合体所含粒子数约为6.02×1023
物质的量【新教材】人教版高中化学 必修一P PT课件
物质的量【新教材】人教版高中化学 必修一P PT课件
特别提醒: ⑴ 在表述微观粒子的物质的量时,必须指明微观粒子的种类, 例如:1molH 、1molH2 、1molH+都正确,但1mol氢因为未指明 微观粒子的种类而错误。 ⑵ 物质的量只能用来表示微观粒子的多少,不能用来表示宏 观物质的多少。 ⑶ 根据摩尔的规定,1mol任何粒子集合体所含的粒子数都约为 6.02×1023,如1molO2所含氧分子数为6.02×1023
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1. 仪器: ⑴ 用固体配制溶液需用的仪器: 托盘天平(带砝码)、烧杯、玻璃棒、容量瓶 、胶头滴管
其它:药匙、称量纸
⑵ 用液体配制溶液需用的仪器:
酸式滴定管(或碱式滴定管)、烧杯、玻璃棒、 容量瓶、胶头滴管
其它:滴定管夹
2. 操作步骤 ⑴ 计算
⑵ 称量(如是液体就用滴定管量取)
⑶ 溶解(少量水,搅拌,注意冷却)
③
⑵ NaOH有腐蚀性,称量NaOH固体,正确的方法是____( 填写序号) ① 将固体放在称量纸上
② 将固体直接放在天平的托盘上
③ 将固体放在烧杯中 ⑶没有影响 若容量瓶中有少量蒸馏水,对所配溶液的浓度有何影响 ?____________(填“偏大”、“偏小”或“没有影响”)。
练
习
1.某同学欲用 12 mol·L-1 的浓盐酸配制 1 mol·L-1 的盐酸 250 mL。
粒子数 N
÷ NA × NA
物质的质量 m(g)
溶质的质 量分数
电解质
物质的量 N(mol)
÷V液 ×V液
的电离
关系式
物质的 量浓度 CB(mol· L-1)
物质的组 成与结构
方程式中的 系数比等于 物质的量之比
在相同的温度 和压强下,相 同体积的任何 气体都含有相 同数目的分子 。
三、配制一定物质的量浓度的溶液
积的任何气体都含有相同数目的分子。
4.物质的量浓度(CB)
以单位体积溶液里所含溶质B的物质的量来表示溶 液组成的物理量,叫做溶质B 的物质的量浓度。
注意的问题:
⑴ 计算公式:
⑵ 物质的量浓度的单位:mol· L-1
⑶ 同一溶液,体积不等,浓度相等,所含溶质的物
质的量、质量不相等。
标准状况下 气体的体积 V (L)
22g
4.4g
18g
6.下列关于 2 mol O2的叙述,正确的是
A. 质量是 32 g
B. 体积是 44.8 L C. 分子数约是 2 × 6.02×1023 A. D. 电子数是 32
答案:C
7.式量为 M 的某物质在室温下的溶解度为 S g /100g 水,此时测得饱和溶液的密度为d g· cm-3。则该 饱和溶液的物质的量浓度是 A. B. C. D.
注意的问题:
⑴ 专有名词;
⑵ 描述的对象是粒子的集体;应用化学式指明粒
子的种类。
⑶阿伏加德罗常数:NA 表示,通常使用
6.02×1023 mol-1 这个近似值。
2. 物质的质量与摩尔质量的区别和联系 物质的质量
摩尔质量
区 数值任意,单位 别 通常是g 或 kg
数值是该物质的相对 分子质量,单位是 g·mol-1 或kg·mol
数。
×4.
将 58.5 g NaCl 溶于 1 L 水中,所得溶液的物质的量浓 度为 1 mol· L-1,从其中分别取出 5 mL和 50 mL,其 物质的量浓度分别为 0.005 mol· L-1 和 0.05 mol· L-1。
1.物质的量(n):表示含有一定数目粒子
的集体的物理量。 单位—— 摩尔(mol)
化学计量—物质的量
一、基本概念及概念辨析
例1 判断正误,分析原因。
× 1.
摩尔是表示物质微粒数量的单位,1 mol H2中含有 6.02×1023个氢分子。
2 -1
mol 。 × 2. 1 mol O 的质量为32 g· × 3. ⑴ 在标准状况下,1 mol任何物质的体积都约为 22.4 L × ⑵ 22.4 L气体所含分子数一定大于 11.2 L气体所含分子
④所含碳原子个数相等
其中正确的是:
A. ①②③④
C. ③④
B. ②③④
D. ③
答案:C
4. 在体积为 V L 的密闭容器中通入 a mol NO 和 b mol O2,反应后容器内氮原子数 和氧原子数之比为 A. B.
C.
D.
答案:C
5.在反应 X+3Y == R + 2M 中,已知 R 和 M 的摩尔 质量之比为 22∶9,当 1.6g X 与 Y 完全反应后, 生成 4.4 g R,则在此反应中 Y 和 M 的质量之比为 A. 16∶9 【解析】 X 8g 1.6g 答案:A B. 23∶9 + 32g C. 32∶9 2M D. 46∶9 3Y == R +
⑷ 转液(容量瓶要先检漏,玻璃棒引流)
⑸ 洗涤(洗涤液一并转移到容量瓶中)
⑹ 振摇
⑺ 定容
⑻ 摇匀
3. 误差分析:
引起误差的一些操作 溶质质量 溶液体积 溶液浓度
向容量瓶中注液时少量流出
未洗烧杯和玻璃棒 未冷却到室温就注入容量瓶 定容时加水多,用滴管吸出
减小
减小 —— ——
——
—— 减小 增大
偏小
B. B. 2 NA 个 CO2 的质量为 44 g C. C.0.1 mol ·L-1 NaCl 溶液中,Na+与 Cl-离 子总数为 0.2 NA
D. D. 17 g NH3 中所含原子数为 NA
答案:A
3. 关于同温同压下等体积的 CO2 和 CO的叙述 : ① 质量相等
② 密度相等
③ 所含分子数相等
偏小 偏大 偏小
定容时仰视读数
定容时俯视读数 容量瓶或烧杯中未干燥
——
—— ——
增大
减小 ——
偏小
偏大 无影响
例4 欲配制100mL 1mol· L-1 的 NaOH 溶液,请回答
:
④
② 50 mL容量瓶
④ 100 mL容量瓶
⑴ 必须用到的仪器是_________(填写序号)
① 50 mL量筒
③ 100 mL量筒
【解析】解法一:n=
mol
解法二: 解法三:推测
答案:B
ቤተ መጻሕፍቲ ባይዱ
②③④ (填序 ⑴ 操作时,必须用到的仪器是_______
号) ① 500 mL容量瓶 ②250 mL容量瓶 100 mL烧杯 ④25 mL酸式滴定管 25 mL 碱式滴定管 ③ ⑤
⑵ 操作中,将洗涤烧杯后的洗液也注入容量
保证溶质全部转移到容量瓶中 瓶,其目的是_________________________
⑶ 用胶头滴管往容量瓶中加水时,不小心液 ④ (填 面超过了刻度,处理的方法是_______ 序号) ① 吸出多余的液体,使凹液面与刻度线相切
② 小心加热容量瓶,经蒸发后,使凹液面与 刻度线相切
③ 经计算加入一定量的盐酸 ④ 重新配制
2. 设 NA 为阿伏加德罗常数,下列说法中正确的 是
A. 2.4 g 金属镁与足量盐酸完全反应,失电子总 数为 0.2 NA
-1
联 单位物质的量的物质所具有的质量叫 系 做摩尔质量。
3.气体摩尔体积(Vm)
单位物质的量的气体所占的体积叫做气体摩尔体积。
在标准状况下,约为22.4L· mol-1 。
注意的问题:
⑴ 研究对象是气体;
⑵ 通常将温度为0℃,压强为 101 kPa时的状
况称为标准状况;
⑶ 一条定律:在相同的温度和压强下,相同体
其它:药匙、称量纸
⑵ 用液体配制溶液需用的仪器:
酸式滴定管(或碱式滴定管)、烧杯、玻璃棒、 容量瓶、胶头滴管
其它:滴定管夹
2. 操作步骤 ⑴ 计算
⑵ 称量(如是液体就用滴定管量取)
⑶ 溶解(少量水,搅拌,注意冷却)
③
⑵ NaOH有腐蚀性,称量NaOH固体,正确的方法是____( 填写序号) ① 将固体放在称量纸上
② 将固体直接放在天平的托盘上
③ 将固体放在烧杯中 ⑶没有影响 若容量瓶中有少量蒸馏水,对所配溶液的浓度有何影响 ?____________(填“偏大”、“偏小”或“没有影响”)。
练
习
1.某同学欲用 12 mol·L-1 的浓盐酸配制 1 mol·L-1 的盐酸 250 mL。
粒子数 N
÷ NA × NA
物质的质量 m(g)
溶质的质 量分数
电解质
物质的量 N(mol)
÷V液 ×V液
的电离
关系式
物质的 量浓度 CB(mol· L-1)
物质的组 成与结构
方程式中的 系数比等于 物质的量之比
在相同的温度 和压强下,相 同体积的任何 气体都含有相 同数目的分子 。
三、配制一定物质的量浓度的溶液
积的任何气体都含有相同数目的分子。
4.物质的量浓度(CB)
以单位体积溶液里所含溶质B的物质的量来表示溶 液组成的物理量,叫做溶质B 的物质的量浓度。
注意的问题:
⑴ 计算公式:
⑵ 物质的量浓度的单位:mol· L-1
⑶ 同一溶液,体积不等,浓度相等,所含溶质的物
质的量、质量不相等。
标准状况下 气体的体积 V (L)
22g
4.4g
18g
6.下列关于 2 mol O2的叙述,正确的是
A. 质量是 32 g
B. 体积是 44.8 L C. 分子数约是 2 × 6.02×1023 A. D. 电子数是 32
答案:C
7.式量为 M 的某物质在室温下的溶解度为 S g /100g 水,此时测得饱和溶液的密度为d g· cm-3。则该 饱和溶液的物质的量浓度是 A. B. C. D.
注意的问题:
⑴ 专有名词;
⑵ 描述的对象是粒子的集体;应用化学式指明粒
子的种类。
⑶阿伏加德罗常数:NA 表示,通常使用
6.02×1023 mol-1 这个近似值。
2. 物质的质量与摩尔质量的区别和联系 物质的质量
摩尔质量
区 数值任意,单位 别 通常是g 或 kg
数值是该物质的相对 分子质量,单位是 g·mol-1 或kg·mol
数。
×4.
将 58.5 g NaCl 溶于 1 L 水中,所得溶液的物质的量浓 度为 1 mol· L-1,从其中分别取出 5 mL和 50 mL,其 物质的量浓度分别为 0.005 mol· L-1 和 0.05 mol· L-1。
1.物质的量(n):表示含有一定数目粒子
的集体的物理量。 单位—— 摩尔(mol)
化学计量—物质的量
一、基本概念及概念辨析
例1 判断正误,分析原因。
× 1.
摩尔是表示物质微粒数量的单位,1 mol H2中含有 6.02×1023个氢分子。
2 -1
mol 。 × 2. 1 mol O 的质量为32 g· × 3. ⑴ 在标准状况下,1 mol任何物质的体积都约为 22.4 L × ⑵ 22.4 L气体所含分子数一定大于 11.2 L气体所含分子
④所含碳原子个数相等
其中正确的是:
A. ①②③④
C. ③④
B. ②③④
D. ③
答案:C
4. 在体积为 V L 的密闭容器中通入 a mol NO 和 b mol O2,反应后容器内氮原子数 和氧原子数之比为 A. B.
C.
D.
答案:C
5.在反应 X+3Y == R + 2M 中,已知 R 和 M 的摩尔 质量之比为 22∶9,当 1.6g X 与 Y 完全反应后, 生成 4.4 g R,则在此反应中 Y 和 M 的质量之比为 A. 16∶9 【解析】 X 8g 1.6g 答案:A B. 23∶9 + 32g C. 32∶9 2M D. 46∶9 3Y == R +
⑷ 转液(容量瓶要先检漏,玻璃棒引流)
⑸ 洗涤(洗涤液一并转移到容量瓶中)
⑹ 振摇
⑺ 定容
⑻ 摇匀
3. 误差分析:
引起误差的一些操作 溶质质量 溶液体积 溶液浓度
向容量瓶中注液时少量流出
未洗烧杯和玻璃棒 未冷却到室温就注入容量瓶 定容时加水多,用滴管吸出
减小
减小 —— ——
——
—— 减小 增大
偏小
B. B. 2 NA 个 CO2 的质量为 44 g C. C.0.1 mol ·L-1 NaCl 溶液中,Na+与 Cl-离 子总数为 0.2 NA
D. D. 17 g NH3 中所含原子数为 NA
答案:A
3. 关于同温同压下等体积的 CO2 和 CO的叙述 : ① 质量相等
② 密度相等
③ 所含分子数相等
偏小 偏大 偏小
定容时仰视读数
定容时俯视读数 容量瓶或烧杯中未干燥
——
—— ——
增大
减小 ——
偏小
偏大 无影响
例4 欲配制100mL 1mol· L-1 的 NaOH 溶液,请回答
:
④
② 50 mL容量瓶
④ 100 mL容量瓶
⑴ 必须用到的仪器是_________(填写序号)
① 50 mL量筒
③ 100 mL量筒
【解析】解法一:n=
mol
解法二: 解法三:推测
答案:B
ቤተ መጻሕፍቲ ባይዱ
②③④ (填序 ⑴ 操作时,必须用到的仪器是_______
号) ① 500 mL容量瓶 ②250 mL容量瓶 100 mL烧杯 ④25 mL酸式滴定管 25 mL 碱式滴定管 ③ ⑤
⑵ 操作中,将洗涤烧杯后的洗液也注入容量
保证溶质全部转移到容量瓶中 瓶,其目的是_________________________
⑶ 用胶头滴管往容量瓶中加水时,不小心液 ④ (填 面超过了刻度,处理的方法是_______ 序号) ① 吸出多余的液体,使凹液面与刻度线相切
② 小心加热容量瓶,经蒸发后,使凹液面与 刻度线相切
③ 经计算加入一定量的盐酸 ④ 重新配制
2. 设 NA 为阿伏加德罗常数,下列说法中正确的 是
A. 2.4 g 金属镁与足量盐酸完全反应,失电子总 数为 0.2 NA
-1
联 单位物质的量的物质所具有的质量叫 系 做摩尔质量。
3.气体摩尔体积(Vm)
单位物质的量的气体所占的体积叫做气体摩尔体积。
在标准状况下,约为22.4L· mol-1 。
注意的问题:
⑴ 研究对象是气体;
⑵ 通常将温度为0℃,压强为 101 kPa时的状
况称为标准状况;
⑶ 一条定律:在相同的温度和压强下,相同体
