光动力综述
光动力ppt课件

光敏剂选择性地和血管内皮细胞结合,氧化 毛细血管的有关蛋白和脂质,产生氧化应激,破坏 血管内皮细胞膜、线粒体、溶酶体和其他细胞器。 破坏的血管内皮细胞失去正常连接,暴露基 底膜,进而血小板附着聚集、血栓形成,血栓机化, 血管闭塞。
光 动 力 简 介
最大特性:
组织选择性好、靶向性强
操作简单、安全可靠 作用表浅,是一种局部治疗方法 全身副作反应少,疗效肯定
光动力治疗中配合
配制好的溶液必须避光保存,并且在4 小时内使用。 用合适的注射泵和过滤器,以每分钟3ml 的速度在10 分钟 完全经静脉输注完毕。 激光治疗自输注开始后15 分钟,用波长689nm 激光照射患 者。
光动力治疗中配合
光动力治疗中配合
不良反应的观察 光敏剂渗漏会引起局部肿胀、疼痛、变色、 炎症等。 应停止注射,尽快选好的静脉继续注射,第2次输液后15 min进行激光治疗,同时局部冷敷或冰敷24h。 一旦发现患者皮肤变色,至少要避光2天。请皮肤科医生 在需要时及时提供会诊。
眼底有许多疾病与全身性疾病有关,如:糖尿病、肾病、高
血压、细菌性疾病、寄身虫、以及颅脑疾病等。
眼 底 病 概 述
常见疾病 视神经疾病 视乳头炎;视乳头水肿;视神经萎缩; 眼底血管性疾病 视网膜中央动脉阻塞;视网膜中央静脉阻塞; 黄斑部疾病 中心性浆液性脉络膜视网膜病变;老年黄斑变性; 视网膜脱离 孔源性视网膜脱离;挫伤性视网膜脱离; 眼底肿瘤 视乳头黑色素细胞瘤;视网膜母细胞瘤; 眼外伤 黄斑穿孔;脉络膜破裂;挫伤性脉络膜出血;
光 动 力 简 介
不良反应 光动力学疗法的主要不良反应是光过敏反应,表现 为皮肤局部出现红疹或水泡。有时在治疗数天后,治疗部位 出现局部的暂时的反应性水肿,并伴随一些不适,如胸、背 或腹部的疼痛,以及其他的一些副反应如发烧、便秘等,一 般因具体的治疗病变部位和病情而异,大多数不严重,持续 时间也较短,常可通过常规处理得以缓解。总之,毒副作用 是极其轻微的。
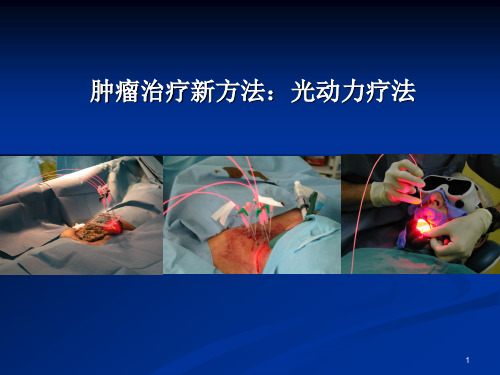
肿瘤光动力(PDT)疗法综述

肿瘤光动力(PDT)疗法综述光动力学疗法光动力学疗法(photodynamic therapy, PDT)是光敏剂与相应波长的光相作用发生光动力反应,产生单态氧,从而杀死肿瘤细胞的治疗方法。
目前用于治疗支气管癌、食管癌、贲门癌、胃、直肠癌、胆管癌、喉癌、乳腺癌、喉癌、宫颈癌、皮肤癌、膀胱癌等皮肤表浅及空腔肿瘤,不仅可以作为姑息性治疗,而且对某些早期肿瘤,可达到治愈目的。
光动力学疗法发展史光动力学疗法属于光医学范畴。
早在4000年前的古埃及时代,人们就发现植物中的补骨脂灵口服后会积聚在皮肤中,日光照射后导致皮肤色素沉着,应补骨脂灵加紫外线照射可治疗皮肤白斑。
嗣后,相继应用类似方法治疗包括痤疮、湿疹、单纯疱疹和牛皮癣等多种皮肤病。
1903年Niels Finsen因发明紫外线辐射治疗皮肤结核病而获得诺贝尔医学奖。
PDT应用于肿瘤始于1903年Jesionek和Tappeiner应用伊红致敏肿瘤,引起肿瘤细胞破坏。
1976年Kelly 和Snell应用一种血卟啉衍生物(hematoporphyrin,HpD)治疗膀胱肿瘤成功,由此开创了PDT。
近年来由于光敏物质、光激活装置和导光系统的发展和进步,PDT已逐步成为肿瘤的基本治疗手段之一[1](表1)。
光敏剂光敏剂是能吸收和重新释放特殊波长的卟啉类分子,具有四吡咯基结构。
第一代光敏剂有血卟啉衍生物(Photosensitzers derivative,HpD)、二血卟啉酯(dihaematoporphyrin ether,DHE)或porfimer sodinm(Photofrin) [5]。
Photofrin是第一个被批准应用的光敏剂,静脉注射后,组织内分布最高在肝,其后依次为脾、肾上腺、膀胱和肾以及皮肤。
从体内排除主要途径是肠道,从尿排除量仅4%。
在肿瘤、皮肤、以及网状内皮系统包括肝脾等器官内存留时间较长。
体内半寿期100小时以上。
从肿瘤内清除较之从正常组织为慢,最大的肿瘤/正常组织浓度比见于48~72小时。
光动力疗法及光动力治疗研究应用

光动力疗法及光动力治疗研究应用随着光动力的研究、光敏剂和光源的不断发展,光动力治疗在肿瘤治疗中的应用已日趋成熟。
光动力疗法的基础与理论研究,以及新产品的不断上市,也给患者带来了福音。
笔者总结今年光动力基础研究和临床研究,并阐述相关观点。
标签:肿瘤;光动力治疗;光敏剂;光源光动力学治疗的定义是人体注入光敏剂后,其在恶性肿瘤内特异积聚与储留,经过一段时间后采用特定波长光照使癌细胞内的光敏剂激发,产生光化学反应杀伤癌细胞,此时正常组织中吸收的光敏剂已排泄掉,光照无光化反应,因此光动力学治疗有选择性杀伤肿瘤作用,光敏剂属于特殊抗癌药,本身无抗癌作用,必经光照激活才发挥疗效,所以不同于一般化疗药也不应列入激光治癌范围[1],激发光是低光能量仅起光化学效应,癌细胞内不存在光敏剂时仅有光照无治疗作用,这与利用高功率热效应的Nd-YAG激光治疗肿瘤不同。
对这种新治疗技术定名为光动力学疗法(photodynamic therapy,PDT)。
1?光动力治疗肿瘤的机制光动力反应又称光化学效应是PDT的原理,这与大多数化学抗癌药杀伤作用不同,完成光动力反应必须具备三要素;光敏剂、照射光与组织内含氧,肿瘤组织吸收了光敏剂,通过特定波长的激光照射使光敏剂激发,激发态的光敏剂将能量传递给组织中氧分子(基态氧,ground state O2),形成激发态的单态氧分子(singlet oxygen),作用于细胞构成各部分产生不可逆的氧化反应[2-4]。
HpD积聚于肿瘤组织中有被特定波长(514.9 nm)激光(绿色)激发发出红色荧光,目测(经滤色镜),荧光放大或荧光光谱显示记录系统可用于肿瘤定位与鉴别诊断,并有助于判定癌灶境界协助决定照射范围。
2?光敏药物(phtosensitizer)光敏剂从静脉注射后分布在人体各种组织中,在正常组织中快速排泄出体外,而在肿瘤中特异积聚与潴留,在48~72 h仍有高浓度,而正常组织大部排出,利用时间差、浓度差照光,使癌细胞内光敏剂激发产生光动力反应,发挥细胞毒作用,正常组织中光敏剂几乎排空光照不会发生光化效应,仅有光化作用的低光能量激光(数百mW/cm2,仅为高功率的百分之一)照射不会损伤正常细胞[5-6]。
光动力作用

光动力作用首先须有受作用的物质,即基质。
可以是正常或异常的结构中的一些主要生物物质,也可以是细胞代谢产物甚至氧化形成的毒性物质;主要是蛋白质、酶和核酸等生物大分子及其组成的氨基酸和碱基等。
对光动力作用敏感的是蛋白质的侧链二硫键,而核酸内则以鸟嘌呤最敏感,氨基酸中则以芳香氨基酸敏感。
可是氨基酸内只有色氨酸、酪氨酸、组氨酸、蛋氨酸及半胱氨酸等才是对光动力作用敏感的物质。
1简介光动力作用(photodynamic action)亦称光力学作用,是指生物体内同时具有氧和色素时,在可见光(该色素的吸收光)的照射下,生物体内分子产生的氧化作用。
常用的色素是甲基蓝和荚氮蒽等,它们能使核酸和蛋白质受到损伤。
一般认为,这主要是由于鸟便嘌呤和组氨酸容易受伤所致,但其详细过程还不十分清楚。
现在由于有了可利用的比紫外线穿透力更强的可见光,只要用适宜的色素将生物组织块染色,用强的细激光光束照射,就能使所注意的靶的物质很有选择性的失活,这是很有利用前途的方法。
据说,一部分皮肤癌可能是由于日光的动力作用造成的。
[1]2光敏剂临床应用的光敏剂应该是无毒的,能选择性地集中在癌组织中,并能被穿透组织能力强的光(600nm-800nm)所激发。
要求光敏剂不但其光化作用光谱波较长,而且能进入细胞与细胞的光敏基质紧密结合。
尽管已经研究了上千种不同类型的光敏化剂,但迄今临床光动力治癌用的药物,在国内外还是20世纪60年代初研制的血卟啉衍生物HpD和80年代初研制的光敏素Ⅱ(PhotofrinⅡ,商品名PorfimerSodium),这是第一代光敏剂,因为药物诸多不足,副作用明显,光敏剂第二代已经广泛用于临床。
国内有代表性的光敏剂主要有:上海复旦张江生物医药股份有限公司研发生产的艾拉(5-ALA,外用盐酸氨酮戊酸散)、海姆泊芬(Hemoporfin)3光动力疗法的优势与手术、化疗、放疗等常规治疗手段相比,光动力治疗具有许多重要的优点:★疗效确切:由于治疗过程基于较强的药物定位效应,光化学作用可以在630nm激光照射时自动产生于所有肿瘤和癌变细胞,并能同时增强机体免疫系统对肿瘤的抵抗力,所以治疗彻底、复发率低,对多数早期癌症可达到根治目的。
光动力治疗鲜红斑痣原理

光动力治疗鲜红斑痣原理全文共四篇示例,供您参考第一篇示例:光动力治疗(PDT)是一种利用光敏剂和特定波长的光照射来治疗皮肤疾病和损伤的方法。
在这种治疗中,光敏剂会在受光照射后产生氧化反应,从而导致局部细胞损伤和凋亡。
鲜红斑痣是一种常见的皮肤疾病,它往往会给患者带来诸多不便和烦恼。
光动力治疗在治疗鲜红斑痣方面取得了显著的效果,下面将揭示光动力治疗鲜红斑痣的原理。
光动力治疗鲜红斑痣的原理主要涉及到光敏剂和光照射两个方面。
首先是光敏剂,光动力治疗需要使用可吸收特定波长光的光敏剂。
对于鲜红斑痣而言,一般会选用ALA(δ-氨基酸)或者MAL(甲氧基伏苯甲酸)等光敏剂。
这些光敏剂会在局部组织中的异常血管和组织中积聚,而正常组织中的光敏剂含量较低。
当选择合适的光敏剂后,就需要将局部区域暴露在特定波长的光照射下。
针对鲜红斑痣,常用的激光波长为630nm至700nm范围内的红色光。
这种波长的光照射下,光敏剂会被激发产生活性氧,从而引发炎性反应、栓塞和局部组织的缺血坏死。
这种治疗方式还可以帮助减少毛细血管扩张和增生,从而减轻鲜红斑痣的症状。
在治疗过程中,医生会根据患者的具体情况和病变部位来确定光照射的时间和强度。
通常情况下,光动力治疗的照射时间较短,但是由于局部组织对光敏剂的吸收和代谢差异,治疗反应也会存在差异。
而且,由于光敏剂的生物学特性,光动力治疗后局部组织对可见光和紫外线的敏感性也会增加,因此术后需要避免或者减少太阳光的直射。
光动力治疗鲜红斑痣的原理是通过特定波长的光照射到局部组织中的光敏剂,激发产生活性氧,从而导致炎性反应和血管栓塞,达到消除鲜红斑痣的疗效。
虽然这种治疗方法在治疗鲜红斑痣方面取得了一定的效果,但在术前术后的护理和操作中仍需要患者和医生共同努力,避免引起其他并发症和不良反应。
随着医疗技术的不断创新和发展,希望能够为更多鲜红斑痣患者带来更好的治疗体验和效果。
第二篇示例:鲜红斑痣是一种常见的皮肤疾病,它在患者的脸部和颈部等区域出现,给患者的外貌和心理带来不适。
光动力 张向化

光动力张向化:光动力是现代医疗临床中,进行疾病诊断和治疗的一种新技术。
主要是依靠特定波长光源照射激活组织中的光敏剂产生具有生物毒性的单态氧等活性氧物质(Reactive oxygen species,ROS),进而氧化损伤病毒感染细胞及其他过度增殖细胞、激活抗病毒免疫、损伤血管,杀伤细菌、真菌、病毒,消除炎症。
光动力疗法(Photodynamic Therapy,PDT)是一种有氧分子参与伴随生物效应的光敏化反应,通过特定波长的激光照射使组织吸收的光敏剂激发,氧分子通过能量传递,产生自由基和单态氧等活性氧,产生细胞毒性的作用,从而导致肿瘤细胞受损乃至死亡的治疗方法。
张向化,中国光动力疗法的领军人物,对光动力疗法的发展和应用作出了巨大贡献。
他的研究领域涉及光动力作用基础研究、光动力治疗新方法和新技术、光动力在重大疾病诊断和治疗中的应用等。
他在光动力疗法的基础研究和临床应用方面取得了许多创新性的成果,为推动光动力疗法的发展和应用作出了杰出的贡献。
肿瘤的光动力治疗研究进展

肿瘤的光动力治疗研究进展近年来,肿瘤的光动力治疗作为一种新兴的非侵入性治疗方法,在肿瘤治疗领域中受到了广泛的。
本文将介绍肿瘤光动力治疗的基本原理、研究进展及未来发展方向。
肿瘤光动力治疗是一种利用光敏剂和特定波长的光线作用于肿瘤组织,引发光化学反应,产生毒性自由基,从而杀伤肿瘤细胞的治疗方法。
光敏剂是一种在特定波长光线照射下能够产生光化学反应的化合物,常用于肿瘤光动力治疗的光敏剂有血卟啉衍生物、荧光染料等。
当光敏剂被肿瘤组织吸收后,再接受特定波长的光线照射,会产生单线态氧等毒性自由基,从而杀伤肿瘤细胞。
光动力治疗还可通过热效应等方式对肿瘤组织造成损伤。
近年来,肿瘤光动力治疗已经在临床上得到了广泛的应用。
研究结果表明,肿瘤光动力治疗对多种肿瘤类型均具有较好的治疗效果,如皮肤癌、肺癌、膀胱癌等。
同时,与传统的肿瘤治疗方法相比,光动力治疗具有创伤小、恢复快、毒副作用低等优点。
研究人员还探索了多色光动力治疗、组织工程等前沿技术在肿瘤治疗中的应用,为进一步提高肿瘤光动力治疗的疗效和安全性提供了新的思路。
尽管肿瘤光动力治疗具有许多优点,但仍存在一些不足之处。
光敏剂的敏感性不足,影响了治疗效果。
光动力治疗的疗效受到光线照射剂量和深度的限制,对一些深层肿瘤的治疗效果不佳。
光动力治疗的价格相对较高,限制了其在临床上的广泛应用。
肿瘤光动力治疗作为一种具有较大潜力的治疗方法,在临床实践中取得了较好的疗效和安全性。
然而,还需要进一步探索和研究以解决其存在的不足之处。
随着科技的不断发展,相信未来会有更多的创新和突破,为肿瘤患者带来更多的治疗选择和更好的生活质量。
光动力疗法(Photodynamic Therapy,PDT)是一种新型的肿瘤治疗方法,其主要原理是利用特定波长的光激活肿瘤组织中的光敏剂,产生化学反应杀伤肿瘤细胞。
与传统的肿瘤治疗方法相比,光动力疗法具有创伤小、针对性强、术后恢复快等优点,因此在临床肿瘤治疗中具有广泛的应用前景。
光动力的主要原理

光动力的主要原理
光动力学的主要原理可以概括为以下几点:
一、光动力学定义
光动力学是利用光能激发染料分子产生生物效应的现象,应用于疾病的光学诊断与治疗。
二、光敏剂作用
特定的光敏剂经光照射后从基态激发到单重激发态,然后产生各种生物效应。
三、活性氧的产生
激发态光敏剂可以与组织中的氧分子反应,生成高活性的单线态氧或自由基。
四、细胞效应
活性氧可直接破坏细胞组分引起细胞坏死,实现光动力杀灭细胞。
五、光动力诊断
光照可以使正常和病变组织中光敏剂发生萤光,通过检测萤光定位病变。
六、光动力治疗
光动力杀死病变细胞实现治疗,广泛用于肿瘤、黄斑变性等疾病。
七、影响因素
光强度、照射时间、给药剂量等因素可以影响治疗效果。
八、新技术发展
应用新型光敏剂、新光源和给药系统不断扩大光动力学的应用范围。
综上所述,这就是光动力学治疗的基本原理,即通过光激发实现对病变组织的靶向作用。
光动力疗法对胃癌患者生活质量的影响研究

光动力疗法对胃癌患者生活质量的影响研究摘要:胃癌是一种常见的恶性肿瘤,其发病率逐年上升,给患者的生活质量带来了严重的影响。
根据全球癌症统计数据,胃癌是人类常见的癌症之一,对患者的健康和生活产生了重大的负面影响。
胃癌患者常常面临身体虚弱、营养不良、心理压力大等多种问题,其生活质量受到了严重的损害。
光动力疗法作为一种新兴的肿瘤治疗方法,通过将光敏剂注射到体内后,利用光与光敏剂的作用,消灭肿瘤细胞。
光动力疗法具有操作简便、无创伤、恢复快速等优点,被广泛应用于胃癌治疗领域。
然而,关于光动力疗法对胃癌患者生活质量的影响以及其相关因素的研究还比较有限。
关键词:光动力疗法;胃癌患者;生活质量;影响导言:为了探究光动力疗法对胃癌患者生活质量的影响及其相关因素,本研究拟通过综合文献综述、实验研究和数据分析的方法,对光动力疗法在胃癌治疗中的应用进行全面的探讨。
首先,我们将回顾已有的研究成果,梳理光动力疗法在胃癌治疗中的应用情况;接着,通过实验研究,我们将进一步验证光动力疗法的疗效,并分析其对胃癌患者生活质量的长期影响;最后,我们将分析并提取影响胃癌患者生活质量的因素,为胃癌患者的治疗和康复提供新的思路和方法。
1光动力疗法在胃癌治疗中的应用1.1光动力疗法的原理和优势光动力疗法(PhotodynamicTherapy,PDT)是一种新兴的肿瘤治疗方法,基于光敏剂和特定波长的激光光源的相互作用。
其治疗原理为,先靶向性给予患者光敏剂,再利用特定波长的激光照射患者体内的光敏剂,激发光敏剂释放出活性氧,从而造成肿瘤细胞的损伤和死亡。
光动力疗法具有以下几个优势。
首先,光动力疗法是一种非侵入性的治疗方法,可以通过内镜等方式将光源和光敏剂直接引导到肿瘤部位,减少对正常组织的损害。
其次,光动力疗法具有局部治疗的特点,能够精确地治疗肿瘤部位,减少对身体其他部位的影响。
此外,光动力疗法还可以与化疗、放疗等传统治疗方法联合应用,提高治疗效果。
光动力疗法进展与综述

光动力疗法进展与综述08级药学2班陈昌斌1 引言光动力疗法可定义为这样一种操作:对身体遭受损害(常常但并不总是由于癌变)的病人系统的或者局部的施用一种被称作光敏剂的无毒药物或者染料,接着在一段时间后用可见光(通常是长波的红外光)直接照射受损部位,在氧存在的条件下,产生细胞毒物质,从而导致细胞死亡和组织凋亡[1]。
在这里首先要区分三个基本概念:光疗(phototherapy),光化学疗法(photochemotherapy)以及光动力疗法(photodynamic therapy, PDT)。
光疗是一种包含光诱导这种光化学现象的治疗方式,用于治疗各种疾病。
光化学疗法是光疗的一种形式,除光之外还使用一种化学物质。
而在光动力疗法中,联合使用了O2,光以及光敏剂。
因此PDT既是光疗的一种形式,又是光化学疗法的一种形式[2]。
PDT是一种主要影响目标组织具有双重选择性的治疗方式。
其双重选择性是基于光敏剂在正常组织和目标组织中浓度的差异,以及通过空间限制和聚焦的方式使光对目标组织直接照射。
光敏剂在注射3-96小时后积聚在目标组织,具体时间取决于所用光敏剂。
在积聚期间,用光直接照射目标组织以活化光敏剂,活化的光敏剂将能量传递给基态氧(3O2, 3∑g-)从而形成各种形式的活性氧,损伤细胞重要的结构和功能,进而导致组织的破坏[2, 3]。
生物体系中光敏化的,氧依赖的反应称为光动力作用(photodynamic action)[4]。
光动力疗法这个概念源自于二十世纪早期工人们利用一些染料比如曙红与光结合治疗皮肤癌的实践[5]。
血卟啉第一次被使用也是在这个时期[6],直到二十世纪六十年代才出现关于卟啉在肿瘤细胞中选择性聚集以及暴露在可见光下症状恢复的零星报道[3]。
现代对PDT兴趣的急剧增加源自于1960年Lipson和Baldes对血卟啉衍生物(HpD)的发现[4],Dougherty等人在基础科学和临床应用方面的开创性研究大大推动了这一趋势[5-7]。
光动力治疗的基本原理(3篇)

第1篇一、光动力治疗的起源与发展光动力治疗起源于20世纪60年代,当时美国科学家经过研究发现,某些光敏剂在特定波长的光照下,可以产生光动力效应。
此后,光动力治疗逐渐发展成为一门独立的学科。
经过几十年的发展,光动力治疗已经广泛应用于肿瘤、皮肤疾病、眼科疾病等领域。
二、光动力治疗的基本原理光动力治疗的基本原理是:在光敏剂的作用下,生物组织在特定波长的光照下发生光动力反应,产生单线态氧(singlet oxygen,1O2)等活性氧,从而对靶细胞产生杀伤作用。
1. 光敏剂的选择光动力治疗中,光敏剂的选择至关重要。
光敏剂应具备以下特点:(1)在生物体内能被有效吸收;(2)具有特定的光吸收光谱;(3)对靶细胞有较高的亲和力;(4)在光照下产生足够的光动力效应;(5)对正常细胞毒性低。
目前,常用的光敏剂有:血卟啉类、卟啉类、酞菁类等。
2. 光照条件光照条件是光动力治疗的关键因素之一。
光照条件包括:(1)光源:常用的光源有激光、LED等;(2)波长:不同光敏剂对光的吸收光谱不同,因此需要选择与光敏剂光吸收光谱相匹配的波长;(3)光照强度:光照强度越高,光动力效应越强,但过高的光照强度会导致正常细胞损伤;(4)照射时间:照射时间应根据具体情况调整,以确保靶细胞受到足够的光动力杀伤,同时减少正常细胞损伤。
3. 光动力反应光动力反应是指光敏剂在光照下发生的一系列化学反应。
以血卟啉类光敏剂为例,其在光照下发生以下反应:(1)光敏剂吸收光能,从基态跃迁到激发态;(2)激发态光敏剂与生物体内的氧气分子反应,产生单线态氧(1O2);(3)单线态氧具有高度的氧化性,可以氧化靶细胞内的蛋白质、DNA等生物大分子,导致靶细胞死亡。
4. 光动力治疗的疗效机制光动力治疗的疗效机制主要包括以下几个方面:(1)直接杀伤靶细胞:光动力反应产生的单线态氧可以氧化靶细胞内的生物大分子,导致靶细胞死亡;(2)诱导细胞凋亡:光动力反应可以激活细胞凋亡信号通路,诱导靶细胞凋亡;(3)抑制肿瘤血管生成:光动力反应可以抑制肿瘤血管内皮细胞的增殖,从而抑制肿瘤血管生成;(4)增强免疫反应:光动力治疗可以增强机体对肿瘤细胞的免疫反应,提高治疗效果。
光动力疗法进展与综述

光动力疗法进展与综述08级药学2班陈昌斌1 引言光动力疗法可定义为这样一种操作:对身体遭受损害(常常但并不总是由于癌变)的病人系统的或者局部的施用一种被称作光敏剂的无毒药物或者染料,接着在一段时间后用可见光(通常是长波的红外光)直接照射受损部位,在氧存在的条件下,产生细胞毒物质,从而导致细胞死亡和组织凋亡[1]。
在这里首先要区分三个基本概念:光疗(phototherapy),光化学疗法(photochemotherapy)以及光动力疗法(photodynamic therapy, PDT)。
光疗是一种包含光诱导这种光化学现象的治疗方式,用于治疗各种疾病。
光化学疗法是光疗的一种形式,除光之外还使用一种化学物质。
而在光动力疗法中,联合使用了O2,光以及光敏剂。
因此PDT既是光疗的一种形式,又是光化学疗法的一种形式[2]。
PDT是一种主要影响目标组织具有双重选择性的治疗方式。
其双重选择性是基于光敏剂在正常组织和目标组织中浓度的差异,以及通过空间限制和聚焦的方式使光对目标组织直接照射。
光敏剂在注射3-96小时后积聚在目标组织,具体时间取决于所用光敏剂。
在积聚期间,用光直接照射目标组织以活化光敏剂,活化的光敏剂将能量传递给基态氧(3O2, 3∑g-)从而形成各种形式的活性氧,损伤细胞重要的结构和功能,进而导致组织的破坏[2, 3]。
生物体系中光敏化的,氧依赖的反应称为光动力作用(photodynamic action)[4]。
光动力疗法这个概念源自于二十世纪早期工人们利用一些染料比如曙红与光结合治疗皮肤癌的实践[5]。
血卟啉第一次被使用也是在这个时期[6],直到二十世纪六十年代才出现关于卟啉在肿瘤细胞中选择性聚集以及暴露在可见光下症状恢复的零星报道[3]。
现代对PDT兴趣的急剧增加源自于1960年Lipson和Baldes 对血卟啉衍生物(HpD)的发现[4],Dougherty等人在基础科学和临床应用方面的开创性研究大大推动了这一趋势[5-7]。
光动力疗法

光动力疗法光动力疗法光动力疗法(Photodynamic Therapy, PDT )是二十世纪七十年代末问世而在近几年来迅速发展起来的一种针对(血管)增生性病变组织的选择性治疗新技术,该疗法是完全不同于手术、放疗、化疗和免疫治疗之后的又一种正在研究、快速发展中的崭新疗法,已成为世界肿瘤防治科学中最活跃的研究领域之一。
编辑摘要目录[隐藏 ]1 简介2 治疗眼疾1 2.1 治疗原理1 2.2 治眼过程1 2.3 治疗费用3 治疗癌症4 优势光动力疗法 - 简介光动力疗法光动力作用是指在光敏剂参与下,在光的作用下,使有机体细胞或生物分子发生机能或形态变化,严重时导致细胞损伤和坏死作用,而这种作用必须有氧的参与,所以又称光敏化-氧化作用,在化学上称这种作用为光敏化作用,在生物学及医学上称之为光动力作用,用光动力作用治病的方法,称为光动力疗法(photodynamic therapy, PDT)。
光动力疗法是以光、光敏剂和氧的相互作用为基础的一种新的疾病治疗手段,光敏剂(光动力治疗药物)的研究是影响光动力治疗前景的关键所在。
光敏剂是一些特殊的化学物质,其基本作用是传递能量,它能够吸收光子而被激发,又将吸收的光能迅速传递给另一组分的分子,使其被激发而光敏剂本身回到基态。
随着第一个光敏剂Porfimer Sodium于1993--1997年在美国、加拿大、欧盟、日本及韩国陆续被批准上市,PDT领域的研究、开发和应用迅速活跃起来。
近年来,随着新的光动力治疗药物的研发成功及激光设备技术的提高,PDT又迎来了前所未有的发展高峰。
国际上,已批准上市或正在临床研究的新的光敏剂近十种。
同时,PDT也被用于非肿瘤型疾病,如尖锐湿疣、牛皮癣、鲜红斑痣、类风湿关节炎、眼底黄斑病变、血管成型术后再狭窄等疾病的治疗。
[1]光动力疗法(photodynamic therapy, PDT)是消除黄斑脉络膜新生血管的国际高端技术。
各种黄斑病颁的脉络膜新生血管形成(CNV)是致盲的主要原因,传统热激光在治疗CNV的同时也损伤眼底正常组织,而PDT采用长波长冷激光技术,光敏剂维替泊芬特异性与脉络膜新生血管的低密度脂蛋白结合,在长波长激光照射下闭塞CNV,不损伤周围的正常视网膜组织,从而达到治疗目的。
光动力去疣原理

光动力去疣原理近年来,光动力疗法逐渐成为一种常见的去疣方法。
光动力疗法是一种利用光能和光敏剂配合使用的治疗技术,它可以治疗各种皮肤病,包括疣。
那么,光动力去疣的原理是什么呢?光动力疗法的原理可以简单地概括为“光敏剂吸光,产生活性氧,破坏疣组织”。
首先,医生会在疣上涂抹一种光敏剂,这种光敏剂会被疣组织吸收。
接下来,医生会用特定波长的光照射疣部位,光敏剂在光的作用下会产生活性氧,活性氧能破坏疣组织细胞,从而达到去疣的效果。
光敏剂在光照射下产生活性氧的过程是一个复杂的化学反应过程。
一般来说,光敏剂会吸收特定波长的光能,这个波长通常是红光或蓝光。
吸收光能后,光敏剂的电子会被激发到一个高能级,然后通过一系列的反应,这些高能电子会与氧分子结合,产生活性氧。
活性氧具有高度的活性,它可以破坏疣组织细胞的结构和功能,从而达到治疗的效果。
光动力去疣的原理看似简单,但实际上涉及到了许多复杂的生物化学过程。
首先,光敏剂的选择非常重要。
不同的光敏剂对光的吸收能力和产生活性氧的效率不同,因此选择合适的光敏剂对于治疗效果至关重要。
其次,光的选择也是一个关键因素。
不同波长的光对光敏剂的激发能力不同,因此选择适合的光波长也会影响治疗效果。
此外,光的强度和照射时间也需要控制在适当的范围内,以免对皮肤造成伤害。
光动力去疣作为一种非侵入性的治疗方法,具有许多优势。
首先,光动力去疣不会引起疤痕,对皮肤的损伤较小。
其次,光动力去疣的治疗过程较短,通常只需几分钟到十几分钟即可完成。
此外,光动力去疣的治疗效果较好,可以有效去除疣病灶,减少复发的可能性。
然而,光动力去疣也存在一些限制和注意事项。
首先,光敏剂可能引起过敏反应,因此在治疗前需要进行过敏测试。
其次,光敏剂在治疗后会使皮肤对光敏感,因此在治疗后需要避免阳光直射。
此外,光动力去疣对于较大的疣病灶效果可能不理想,需要多次治疗才能达到满意的效果。
总结起来,光动力去疣利用光敏剂吸光产生活性氧的原理,通过破坏疣组织细胞达到去疣的效果。
光动力疗法历史回顾及发展现状

(一)光动力疗法的发展简史从临床医学的角度纵观光动力疗法的发展历史,大致可以分为四个阶段:1. 现象探索阶段(二十世纪40年代以前)尽管早在4000年前古埃及人就通过口服含光敏剂的植物后照光来治疗白癜风,但有关光动力疗法的科学探索则始于二十世纪初。
在二十世纪的前40余年中,人们通过对某些染料(丫啶橙、伊红等)和粗品血卟啉(Hp)的研究,发现了光动力疗法中的一些重要现象、作用和基本规律,为现代光动力疗法奠定了基础。
此后,光动力疗法的发展更主要的则是技术方面的突破、应用方法的改进和作用对象的拓展。
这一时期的重要事件:1841年,Scherer用浓硫酸处理干血粉得到不含铁的代色产物,后来被Hoppe-Seyler称为血卟啉(haematoporphyrin,Hp)。
1900年,Raab发现丫啶橙(Acridine orange)染色使草履虫发生光敏致死现象。
1904年,Tappeine首次提出光动力作用(Photodynamic effect)的概念。
1913年,Meyer-Betz在给自己注射200mg Hp后,发生了强烈的光过敏反应,这一症状持续了几个月。
这是人类首次观察到Hp导致人体皮肤的光敏现象。
1924年,Policard首次在肿瘤组织观察到Hp的荧光。
1942年,Auter和Figge给大鼠注射Hp后,观察到Hp能优先在肿瘤组织等新生组织中富集,当用紫外光照射时肿瘤区产生桔红色荧光,当用日光照射时可以损伤肿瘤组织。
这是人类首次发现Hp对肿瘤组织光敏杀伤作用。
2. 肿瘤诊断阶段(二十世纪50年代-60年代)在二十世纪50年代,人们开始将光动力反应用于肿瘤的早期诊断,称之为肿瘤荧光定位诊断(Tumor-Photolocatization),标志着光动力疗法开始进入了临床实用阶段。
同期还研制开发出血卟啉衍生物(HPD)。
这是人类在光敏剂研究方面取得的最关键进展,对于PDT的发展和普及产生了至关重要的促进作用。
光动力简介
该药物现已进入III期临床研究阶段 。
21பைடு நூலகம்
国外光敏剂研究现况
PhotoCure 公司的第二个光敏剂产品;
Hexvix®
用于荧光膀胱镜检查膀胱癌;
国
cystoscopy
外
Hex vix® 已 完成一项多中心的三期临床 实验。
光
敏
剂
26
配合柱状光纤使用的充气囊
用于肺部肿瘤照射
用于食管肿瘤照射 用于子宫肿瘤照射
27
光导纤维的选择 – 柱状头光纤
柱状头光纤 光纤头部带柱状发光头 根据不同治疗需要,可选择从0.5-9厘米不同长度的柱状发光头
理想的管腔内照射效果 适用于消化道等管腔类肿瘤照射,如食管癌、大肠癌、支气管癌、胆
右侧支气管远照
After PDT
右侧支气管近照
44
PDT 穿刺治疗肿瘤
laser
fibre tumor
45
肝癌的光动力治疗
图1. 治疗前
图2 PDT术后1个月复查
46
PDT穿刺治疗 胰腺癌
47
PDT 治疗胰腺癌
治疗前
治疗后5天
48
谢谢 !!
49
18
国产光敏剂 - 艾拉(5-ALA 外用盐酸氨酮戊酸)
5-盐酸氨酮戊酸(5-ALA)是上海复旦张江生物医药股份有限公 司近年来开发的第2代光敏剂,是一种体内血红蛋白合成过程的 前体物。
艾拉目前临床适应症:尖锐湿疣。
19
国产光敏剂 - 喜泊分 HiPorfin
重庆市华鼎现代生物制药有限责任公司独家生产经营。 国家一类化学新药新一代血卟啉衍生物 。
光动力的作用

光动力的作用
嘿,你问光动力的作用啊?那咱就来唠唠。
这光动力啊,作用还真不少嘞。
一个作用就是可以治疗皮肤病哇。
比如说有些皮肤病,像尖锐湿疣、痤疮啥的,用普通的方法治疗起来可能比较麻烦,效果也不一定好。
这时候光动力就派上用场了。
它能通过特定的光线照射,让药物在病变的部位发挥作用,把那些坏家伙给消灭掉。
就像个小战士,专门对付那些捣乱的皮肤病。
还有哇,光动力可以用来检测癌症呢。
有些癌症在早期的时候很难发现,但是用光动力的方法就可以让它们现形。
医生会给病人注射一种特殊的药物,然后用特定的光线照射身体。
如果有癌症的地方,就会发出特殊的光芒,这样医生就能发现癌症的位置了。
就像个小侦探,能把隐藏的癌症找出来。
另外呢,光动力还能在美容方面发挥作用哦。
比如说有些人脸上有皱纹、色斑啥的,用光动力的方法可以让皮肤变得更加光滑、细腻。
它能刺激皮肤细胞的再生,让皮肤恢复弹性。
就像给皮肤做了个美容护理,让咱变得更加漂亮。
光动力还可以消毒杀菌呢。
有些地方需要特别干净,不能有细菌和病毒。
这时候用光动力的方法就可以把它们都杀死。
就像个小卫士,保护着我们的健康。
总之啊,光动力的作用可多啦。
治疗皮肤病、检测癌症、美容、消毒杀菌,到处都能看到它的身影。
它就像个小能手,能在不同的领域发挥不同的作用。
嘿嘿。
光动力治疗原理.ppt

常用光敏药物
第一代光敏药物----血卟啉衍生物 第二代光敏药物----成分更单一、吸收峰向长波长
移动 改良卟啉衍生物:苯并卟啉类衍生物与5-氨基
乙酰丙酸 绿素降解产生衍生物 藻胆蛋白 竹红菌素 富勒烯 五氮齿 酞菁染料
血卟啉的来源
动物(牛或猪)血中的血红蛋白(HP) (降解)
氯化血红素 (溴化)
光动力治疗 过程示意图
光动力治疗发展史
古中国、埃及、印度人治疗白癜风。 1898年,Moller报告可见光对某些皮肤病有治疗作
用 1900年,Raad发现用丫啶橙染色以后的草履虫对光
敏感,可导致草履虫死亡。 1904年,Tappeiner进行了大量研究,第一次提出了
“光动力学作用(Photodynamic)”这个术语,用 来描述生物组织中需要氧气、光敏剂和光的反应。 1909年,Hausman第一个描述了光动力作用,他用 光照射注射了卟啉(Hematoporphyrin,HP)的老鼠, 发现反应程度直接依赖于光敏剂剂量和光剂量。
自由基学说
认为激发态血卟啉钠盐直接与生物分子作用或将能量 转移给氧和水,使之形成自由基,通过自由基引起生 物分子的一系列连锁反应,造成肿瘤细胞的死亡。
单态氧细胞毒理学说
1976年,Weishaupt等报导用620~640nm光辐照含有 血卟啉钠盐的癌组织时,在能量的转移过程中,由光 动力学作用产生单态氧
690nm,体表病灶可直接用滤光片观察,选择合适波 长的光源;
光化学反应:PDT药物在光的诱导下产生单态氧杀死 癌细胞
药物清除,降低光敏反应
光动力反应破坏细胞的机制
PDT 药物
吸收光单重态系ຫໍສະໝຸດ 转换三重态I型反应过程
3P*+H2O *OH或H2O2
光动力学治疗用于治疗皮肤癌的研究

光动力学治疗用于治疗皮肤癌的研究随着科技的快速发展,医学界也得以受益。
其中,光动力学治疗(Photodynamic Therapy, PDT)作为一种非侵入性的治疗方法,近年来备受关注。
在皮肤癌的治疗中,光动力学治疗被认为是一种有前景的疗法。
本文将介绍光动力学治疗用于治疗皮肤癌的研究进展,包括其原理、应用场景、疗效评价以及可能的副作用。
光动力学治疗是一种将光敏剂注射到人体内,然后激活光敏剂释放出的活性氧分子来破坏癌细胞的治疗方法。
光敏剂是一种可溶于水的化合物,在激活光的照射下,能够吸收光能产生活性氧分子。
在光动力学治疗中,先通过注射或者外用的方式将光敏剂引入癌细胞内,然后通过特定波长的光照射激活光敏剂,使其产生的活性氧分子破坏癌细胞。
光动力学治疗在皮肤癌的治疗中具有独特的地位。
首先,光动力学治疗是一种选择性靶向治疗,可以针对特定区域的皮肤癌细胞进行治疗,避免对正常组织的损伤。
其次,光动力学治疗可以在局麻或者局部麻醉的情况下进行,减少了患者的痛苦和手术风险。
另外,光动力学治疗无需切割手术,恢复期短,并且可以重复治疗,降低了治疗失败的风险。
许多研究表明,在不同类型的皮肤癌中,光动力学治疗都显示出一定的疗效。
例如,基底细胞癌是皮肤癌最常见的类型,而且高度侵袭性。
一项针对基底细胞癌的研究表明,光动力学治疗能够有效杀死癌细胞,并且对正常皮肤细胞的损伤极小。
另外,对于患有恶性黑色素瘤的患者来说,传统的治疗方法难以实现完全治愈。
然而,有研究显示,光动力学治疗对于恶性黑色素瘤的治疗也具有一定的潜力。
通过控制光敏剂的选择和照射参数,可以准确破坏黑色素瘤细胞,同时保护周围正常组织。
除了基底细胞癌和恶性黑色素瘤外,光动力学治疗还被用于其他类型的皮肤癌治疗中。
例如,鳞状细胞癌、皮肤附属器癌等。
尽管目前的研究还没有达到完全治愈的效果,但是光动力学治疗仍然给患有皮肤癌的患者带来了新的希望。
当然,光动力学治疗在治疗皮肤癌时也存在一些副作用和安全问题。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
手术、放疗和化疗是传统的三治疗肿瘤手段,后2方法在杀伤肿瘤细胞的同时,也不可避免的会损伤正常细胞,甚至带来些严重的并发症光动力学疗法(Photodyˉnamic the rapy,PDT)是上世纪70年代初发展起来的一种治疗肿瘤的新型疗法[1],是指光敏剂(Photosensitizer)通过静脉注射进入人体后,在一段时间里会在肿瘤组织中形成相对高浓度的积聚,此时用特定波长激光照射肿瘤组织,将激活其中的光敏剂分子,在肿瘤组织内引发一系列光化学反应,生成活性很强的单态氧,进而和生物大分子发生氧化反应,产生细胞毒直接杀死肿瘤细胞。
同时,光动力反应还广泛破坏肿瘤组织内的微血管,进一步导致病变组织的缺血性坏死,后者在肿瘤治疗过程中常常起着关键性作用。
另外,也有证据提示光动力学疗法能启动抗肿瘤免疫反应[2,3]。
本文就光动力学疗法的研究历史、原理、适应证、安全性与局限性以及光动力学疗法中的两关键要素———光敏剂和照射光的研究现状做一综述,旨在让大家对光动力学疗法有一个全面深入的了解。
1 光动力学疗法研究历史光动力学疗法属于光医学范畴。
1903年Niels Finsen因发明紫外线辐射治疗皮肤结核病而获得诺贝尔医学奖。
光动力学疗法应用于肿瘤治疗始于1903年,Jesionek和Tappei ner用伊红致敏肿瘤,引起肿瘤细胞破坏。
1976年Kelly和Snell应用一种血卟啉衍生物(h ematoporphyrin derivaˉtives,HpD)治疗膀胱癌成功,由此开创了光动力学疗法。
近年来由于光敏物质、光激活装置以及导光系统的发展和进步,光动力学疗法已逐步成肿瘤的基本治疗手段之一[4]。
总之,可归纳为3个阶段[5]:(1)经验性应用阶段(萌芽阶段):时间约从3000余年直到19世纪。
此阶段以应用天然的物质结合阳光来治疗皮肤疾病为主。
(2)实验室研究阶段(光动力学治疗形成阶段):时间从19世纪至20世纪7 0年代。
此阶段开始提取各种光敏剂,提出光动力学效应的概念,并开展以实验室为主的各种研究。
(3)临床应用研究阶段(光动力学治疗形成阶段):时间从20世纪70年代至90年代。
此阶段开展用光动力学疗法对种肿瘤进行治疗的临床研究,同时激光也开始应用于临床,代替原来的传统光源,有利于腔内肿瘤开展光动力学治疗。
2 光动力学原理光动力学疗法是一种冷光化学反应,其基本要素是氧、光敏剂和可见光(常用激光)。
首先肿瘤组织选择性摄取光敏剂,并储于其内,随后在适当波长光局部照射下,光敏剂被激活,从而产生光敏效应。
2.1 光动力效应光动力疗法的作用基础是光动力效应,是一种有氧分子参与的伴随生物效应的光敏化反应。
其过程是:特定波长的激光照射使组织吸收的光敏剂受到激发,激发态的光敏剂又把能量传递给周围的氧,生成活性很强的单态氧,单态氧和相邻的生物大分子发生氧化反应,产生细胞毒作用而导致细胞受损乃至死亡。
2.2 光动力效应所需的基本条件氧、光敏剂和可见光是光动力效应发生的基本条件。
由于光动力治疗是在活体上进行的,活体组织又是含氧的,所以光敏剂和与之相匹配的特定波长光便成为光动力效应的两个关键因素。
光敏剂的光动力活性、光吸收特性和靶向特性,决定了其临床可用性和适用范围。
照射光的波长必须与光敏剂相匹配才能产生强烈的光动力效应。
另外照射光输出稳定性和投照可靠性也是决定治疗效果的重要可控因素。
2.3 光动力效应能够用于治病的前提条件光动力效应能够用于疾病治疗有两个前提:其一是特定病变组织能较多地摄取和存留光敏剂;其二是靶部位较易受到光照射。
通常,实体恶性肿瘤、某些癌前病变及一些良性病变可较多地摄取和存留光敏剂,只要这些病灶处于激光光纤的照射范围,光动力效应就能发生。
2.4 光动力学疗法的治疗步骤光动力学疗法治疗肿瘤可分为2步来完成:首先是给患者注射光敏剂,然后是对病灶区进行激光照射。
3 光敏剂与光敏药物3.1 光敏剂与光敏药物光敏剂是指能吸收特定波长光的能量并传递给周围的分子,从而产生活性氧等毒性物质的一类化学物质。
由光敏剂引发的光化学反应称为光敏反应。
一般把有氧分子参与的伴随生物效应的光敏反应称为光动力反应。
把可引发光动力反应破坏细胞结构的药物称为光动力药物,即光敏药物。
3.2 光敏药物与一般化疗药物的区别3.2.1 作用原理不同光敏药物经注射进入人体以后,很快会在不同的组织中形成不同的浓度分布,然后又以不同的速率下降,并在天后大部分排出体外。
摄取了药物的人体第一代光敏剂有:血卟啉衍生物(hematoporphyrin derivaˉtive,HPD)、二血卟啉醚d ihaematoporphyrin ether,DHE)和Porˉfimer sodium(PhotofrinⅡ,也即PHOTOFRIN R ○ )。
已获多国政府的药监部门批准应用于临床。
多为混合制剂,在体内的滞留时间长,避光时间需4周以上,其最长激发波长在630nm,此波长穿透的组织深度有限(0.5cm以下),限制了光动力学疗法在较大肿瘤上的应用[13~15]。
第二代光敏剂有:5-ALA(5-氨基酮戊酸)、间-四羟基苯基二氢卟酚(meso-tetrahydro xyphenyl chlorin,m-THˉPC)、初卟啉锡(tin etiopurpurin,SnEtz)、亚甲基兰(meth ylene blue)和亚甲苯兰(toluidine blue)、苯卟啉(benzoporphyrin)衍生物以及luteliu m texaphyrins(Lu-Tex)、苯并卟啉衍生物单酸(BPD-MA,vertoporfin)、酞青类(Pht halocyanines)、得克萨卟啉(Texaphyrins)、N-天门冬酰基二氢卟酚(N-aspartyl chlor in e6,Npe6)、金丝桃素(hypercin)、血啉甲醚(Herˉmimether,HMME)[16~19]。
基本已进入临床研究阶段,尚未批准正式临床应用。
部分地克服了第一代光敏剂的缺点,加符合理想光敏剂的特点,表现为光敏期短,作用的光波波长较大,因而增加了作用的深度,产生的单态氧也较多,对肿瘤更有选择性[13,20]。
第三代光敏剂有:与各种物质交联的Npe6和酞青类,尚处在动物研究阶段。
这是在第二代光敏剂的基础上交联上某些特殊的化学物质,进一步提高了肿瘤组织的选择性,这些物质简单的如多聚体(Polymers)和脂质体(Liposomes);复杂的如肿瘤组织表达的抗原或受体的相应抗体和配体等[11]。
4 照射光及激光机照射光常采用可见红光。
大多数光敏剂能强烈吸收630nm或波长长于630nm的光。
激光是最方便和可携带性光源,具凝聚性和单色性,可产生高能量的单一波长的光波,输出功率可被精确调控,能直接通过纤维光缆,引导到中空器官和深入到体内深部进行治疗。
二极管激光比金属蒸汽激光或色调激光便宜,可携带,因此是较实用的光源[4,6]。
4.1 光动力治疗中的激光照射与通常的激光手术不同光动力治疗中的激光照射,只起激活光敏剂的作用,能量无需太集中,不会造成照射区的温度明显升高,更不会造成组织的热损伤;而通常的激光手术,是利用高能激光束所产生的局部高温,来切割、气化或凝固病弥漫性病变也有良好效果,特别适用于不能手术、其他治疗有禁忌或失败的患者[13]。
另一方面,光动力疗法近期在动脉粥样硬化、老年性眼底黄斑病变、鲜红斑痣、病毒和细菌性感染性病变、类风湿性关节炎等常规手段难以奏效的良性疾病的治疗研究中也取得一系列进展,其应用领域得到很大的延伸和扩展[7,23~25]。
这又将造福于越来越多的良性疾病患者。
光动力学疗法作为一种肿瘤治疗的新技术,在欧美日等许多发达国家,已经获得政府药品主管机构的审查批准,在越来越多的医院成为一种新的常规治疗手段,临床应用不断加深。
就光动力学疗法的基础研究来说,许多科研人员和敏感的企业家正着手进行新型光敏药物和与之配套的光动力激光机的研发。
我国学者哈文、邹进早在20世纪80年代初就将光动力学疗法引进中国,并在全国范围内开展了协作攻关研究[25]。
国内目前仍有部分单位正在继续进行此疗法的基础与临床研究,并取得了卓越的成绩。
基础研究方面如厦门大学抗癌研究中心光动力医学室;临床方面有3个光动力治疗中心,分别为:北京军区总医院肿瘤光动力治疗中心;南方医院肿瘤光动力治疗研究培训中心;国际肿瘤诊治研究中心(在香港)。
总之,这一涉及相关药物、设备制造业和医疗服务业的新的肿瘤治疗方法,将为我国在这一领域里开展光敏药物研究、医学基础研究与临床应用研究提供了广阔的探索空间,而且有很大的学术上意义和社会效益,其将会产生的经济价值也是相当可观的。
参考文献1 Dougherty TJ.Photodynamic therapy of neoplastic disease.Photochem Photobi ol,1993,58:895-900.2 Dougherty TJ,Gomer CJ,Henderson BW,et al.Photodynamic theraˉpy.J Nat l Cancer Inst,1998,90:889-905.3 Korbelik M.Induction of tumor immunity by photodynamic therapy.J Clin Laser Med Surg,1996,14:329-334.4 Sibata CH,Colussi VC,Oleinick NL,et al.Photodynamic therapy in oncology. Expert Opin Pharmacother,2001,2:917-927.5 丁新民,徐勤枝,顾瑛,等.光动力学治疗肿瘤的简史和现状.中国肿瘤,2003,12(3):151-155.6 Hopper C.Photodynamic therapy:a clinical reality in the treatment of cancer.L ancet Oncol,2000,1:212-219.7 美国抗盲基金会.治疗老年性黄斑退化的新药,2002,10.8 Nadis,Steve.A new light on cancer.Technology review,1997,100(6):61-6 5.9 Photodynamic therapy brings hope to patients with macular diseases.Press c onference on May22,2001.10 Gottlieb,Carrie,Moore,et al.Red light that stops cancer.Fortune,1995,13 1(5):171.11 丁新民,顾瑛,刘凡光.胰腺癌的光动力治疗.世界华人消化杂志,2003,11(10): 1621-1623.12 徐克成,牛立志,郭子倩,等.光动力疗法及其在消化系肿瘤治疗中的应用.胃肠病学,2003,8(2):110-115.13 Selvasekar CR,Birbeck N,McMillan T,et al.Photodynamic therapy and the alimentary tract.Aliment Pharmacol Ther,2001,15:899-915.14 Moore JV,West CM,Whitehurst C.The biology of photodynamic therapy.Ph ys Med Biol,1997,42:913-935.15 Schroder T,Chen IW,Sperling M,et al.Hematoporphyrin derivative uptake and photodynam ic therapy in pancreatic carcinoma.J Surg Onˉcol,1988,38:4-9.16 Donnett R.Photosensitizers of the porphyryin and phthalocyanine series for photodynamic therapy.Chem Soc Rev,1995,24:19-33.17 Diwu ZJ.Novel therapeutic and diagnostic applications of hypocrellins and hy pericins.Photochem Photobiol,1995,61:529-539.18 许德余,陈文晖,张浩,等.光动力治癌新药血卟啉单甲醚(HMME)研究.中国激光医学杂志,1993,2(1):1.19 陈文晖,余建鑫.第二代肿瘤光动力治疗药物的研究进展.国外医药-合成药、生化药、制剂分册,1996,17(2):81-85.20 Sharman WM,Allen CM,Van LJE.Photodynamic therapeutics:basic principle s and clinical applications.DDT,1999,4:507-517.21 Mc Caughan JS Jr.Photodynamic therapy:a review.Druga Aging,1999,15:4 9-68.22 杨栋.肿瘤光动力治疗研究进展.解放军医学杂志,2003,28(8)(增刊):S61-S6 5.23 Neil MB,Susan BB.Photodynamic therapy with verteporfin(Visuˉdyne):imp act on ophthalmology and visual sciences.Invest Opbtbalmol Vis Sci,2000,41:624-628.24 顾瑛,刘凡光,王开,等.光动力学疗法治疗鲜红斑痣1216例临床分析.中国激光医学杂志,2001,10:86-89.25 周传农.光动力医学的进展与前景.解放军医学杂志,2003,18(8)(增刊):S38-S40.作者单位:100050中国医学科学院中国协和医科大学药物研究所。
