乳酸环丙沙星氯化钠注射液半成品含量测定方法的建立
一种乳酸环丙沙星氯化钠注射液的制备方法[发明专利]
![一种乳酸环丙沙星氯化钠注射液的制备方法[发明专利]](https://img.taocdn.com/s3/m/f1aa7c3926fff705cd170a75.png)
专利名称:一种乳酸环丙沙星氯化钠注射液的制备方法专利类型:发明专利
发明人:钟明,王万平
申请号:CN201811048186.2
申请日:20180910
公开号:CN108938636A
公开日:
20181207
专利内容由知识产权出版社提供
摘要:本发明涉及医药注射液制备技术领域,具体涉及一种乳酸环丙沙星氯化钠注射液的制备方法。
所述植被方法包括注射用水制备、溶质称量、浓配、稀配灌封、灭菌、灯检、包装等制备工艺;选用特殊的注射用水配制和适宜的乳酸环丙沙星注射液配方,在特殊的浓配和稀配混合作用下,有效提高各溶质在注射用水中的溶解均匀度;再历经高温高压杀菌,严密的质检,合格的包装,使得加工出的乳酸环丙沙星注射液纯度为99.0±0.2%,保质期24个月,在保质期内不会出现絮状物或任何可见悬浮物,且药用价值和品质均不会任何变化。
申请人:贵州天地药业有限责任公司
地址:562400 贵州省黔西南布依族苗族自治州兴义市凤仪路1号
国籍:CN
代理机构:贵阳索易时代知识产权代理事务所(普通合伙)
代理人:管宝伟
更多信息请下载全文后查看。
高效液相色谱法测定乳酸环丙沙星注射液的含量
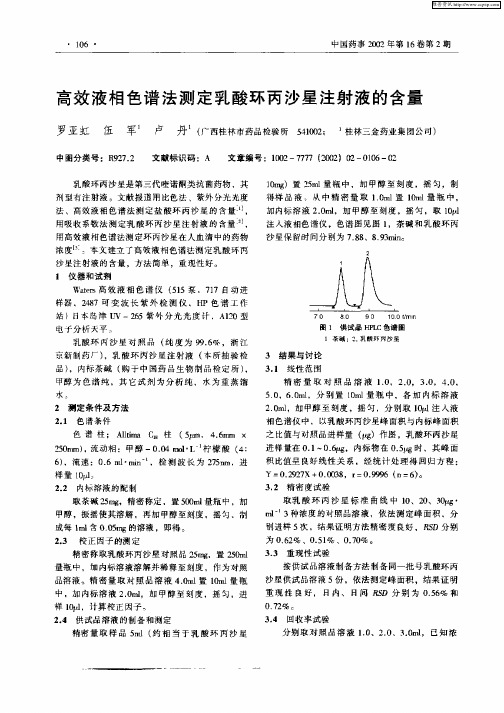
色 谱 柱 ; Alm c8柱 ( , 46m × lia I t 5 .na
20 m) 流 动相 :甲醇 一00 o- 柠 檬 酸 ( : 5r , a .4m lL 4
6 ,流 速 :0 6m ・ i~, 检 测 波 长 为 2 5 m, 进 ) . l mn 7n 样 量 1 。 0
电子 分析天平 。
注 入液 相色谱 仪 ,色谱 囝见 图 1 ,茶碱 和乳 酸环 丙
沙 星保 留时 间分别为 7 8 、8 9 mn .8 .3 i
70
80
90
1 0 0 Uml 几
圈 1 供试品 H L P C色 谱 固
1 荼 碱 ;2 乳 酸 环 丙 星 .
22 内标 溶液 的配制 .
取茶 碱 2m ,精 密称定 ,置 50 l 瓶 中 ,加 5g 0m 量 甲醇 ,振摇 使其溶解 ,再 加 甲醇至刻 度 ,摇 匀 ,制 成每 l l 00r m 含 .5a g的溶液 ,即得 。
23 校 正 因子 的 测 定 .
m 3种浓 度 的对 照品溶 液 ,依 法测定 峰 面积 ,分 l 别进样 5次 ,结果证 明方法 精密 度 良好 .R D分别 S
3 结果 与讨论
3 1 线性 范围 . 精 密 量 取 对 照 品 溶 液 10 .,3 0 . , . ,20 .,40 50 .m ,分 别 置 1m 量瓶 中,各 加 内标 溶液 . ,6 0 l 0l 20 l .m ,加 甲醇 至刻 度 ,摇 匀 ,分 别取 1v 入液 Oa注
2 测定 条 件及方法 2 1 色谱 条件 .
乳酸 环 丙 沙 星对 照 品 ( 度 为 9 .% ,浙 江 纯 96
京新 制 药厂 ) ,乳酸 环 丙 沙 星注 射液 ( 所抽 验 检 本 品) ,内标茶碱 ( 购于 中 国药 品生 物 制 品检 定所 ) ,
直线回归紫外分光光度法测定乳酸环丙沙星注射液的含量

直线回归紫外分光光度法测定乳酸环丙沙星注射液的含量杨赤杰;查晚平
【期刊名称】《时珍国医国药》
【年(卷),期】2003(14)12
【摘要】目的 :建立乳酸环丙沙星注射液含量测定的简便方法。
方法 :采用直线回归紫外分光光度法 ,在 2 77nm处测定乳酸环丙沙星的含量 ,建立标准曲线。
结果 :环丙沙星最后稀释浓度在 3.0~6 .0μg/ ml范围内 ,与吸收度的线形关系良
好 ,r=0 .9995 ,平均回收率为 99.8% ,相对标准偏差为 0 .5 8%。
结论 :采用直线回归紫外分光光度法测定乳酸环丙沙星注射液的含量 ,快速简便 ,结果准确。
【总页数】2页(P734-735)
【关键词】乳酸环丙沙星;直线回归分光光度法
【作者】杨赤杰;查晚平
【作者单位】大冶有色金属公司总医院
【正文语种】中文
【中图分类】R284.2
【相关文献】
1.HPLC法和UV法测定乳酸环丙沙星注射液含量的比较 [J], 曹均告;谭永红;金伟华
2.差示紫外分光光度法测定乳酸环丙沙星滴眼液的含量 [J], 白建伟;晋援朝;晋薇;王雨生;王海燕
3.紫外分光光度法测定双唑星栓中乳酸环丙沙星和甲硝唑的含量 [J], 武洋;张素范;王沪凯;武军
4.差示紫外分光光度法测定乳酸环丙沙星注射液的含量 [J], 卜家福
因版权原因,仅展示原文概要,查看原文内容请购买。
乳酸环丙沙星原料药的含量测定方法探讨

乳酸环丙沙星原料药的含量测定方法探讨
潘莹;江海燕;吴小燕
【期刊名称】《广西医学》
【年(卷),期】2003(025)008
【摘要】目的:考察乳酸环丙沙星的含量测定方法.方法:采用紫外分光光度法及双相滴定法测定乳酸环丙沙星原料药的含量.结果:紫外分光光度法回归方程为
A=0.01163+0.1283C,平均回收率为(99.7±0.40)%,双相滴定法测得平均回收率为(100.4±0.11)%.结论:两种方法结果均较好且无显著区别,有利手医院制剂室的检测.【总页数】3页(P1384-1386)
【作者】潘莹;江海燕;吴小燕
【作者单位】广西区人民医院药剂科,530021;广西中医学院药学院,530001;广西中医学院第一附属医院,530023
【正文语种】中文
【中图分类】R944
【相关文献】
1.乳酸环丙沙星注射液配制方法探讨 [J], 樊莉莉;巨小梅
2.高效液相色谱法用于前列栓中乳酸环丙沙星的含量测定 [J], 张建苹;运委;张松
3.乳酸环丙沙星滴眼液的配制及含量测定 [J], 徐敏;姜丽丽
4.乳酸环丙沙星滴眼液的含量测定及稳定性试验 [J], 任峻青;赵秀花;王晓云;徐今宁
5.乳酸环丙沙星原料药含量测定方法的探讨 [J], 李淑芹
因版权原因,仅展示原文概要,查看原文内容请购买。
乳酸环丙沙星检验SOP

GMP管理文件一、目的:建立乳酸环丙沙星检验的标准操作规程,保证正确操作。
二、依据:《兽药质量标准》(2003版)。
三、适用范围:适用于乳酸环丙沙星的检验。
四、责任者:QC检验员五、正文:1.质量标准:(见乳酸环丙沙星质量标准)。
2.试剂:2.01 碘化铋钾试液 2.02盐酸溶液(0.1mol/L)2.03 五氧化二磷 2.04 溴试液2.05 稀硫酸 2.06 硫酸铵2.07 10%亚硝基铁氰化钾的稀硫酸溶液 2.08 浓氨试液2.09 0.025mol/L磷酸溶液 2.10 乙腈2.11 三乙胺 2.12 冰醋酸2.13 结晶紫指示液 2.14高氯酸滴定液(0.1mol/L)3.仪器与用具3.01 紫外分光光度计 3.02 坩埚3.03 酸度计 3.04 高效液相色谱仪3.05 电热干燥箱 3.06 滴定管4.操作步骤:4.1 性状本品为类白色或微黄色结晶性粉末;无臭,味苦;有引湿性。
本品在水中易溶,在冰醋酸中略溶,在氯仿中几乎不溶。
则判定该项合格。
4.2 鉴别:(1)取本品约50mg,加水适量使溶解,加碘化铋钾试液,即生成橙黄色沉淀。
(2)取本品,加0.1mol/L盐酸溶液制成每1ml中含8μg的溶液,照分光光度法(详见紫外可见分光光度法标准操作规程)测定,在220nm~300nm波长范围内测定,在277nm的波长处有最大吸收。
(3)本品的红外光吸收图谱应与对照图谱一致。
(委托检验)(4)取本品约25mg,加水5ml溶解,置试管中,加溴试液1ml与稀硫酸0.5ml,置水浴上加热,并用玻棒小心搅拌至褪色,加硫酸铵4g,混匀,沿管壁逐滴加入10%亚硝酸铁氰化钾的稀硫酸溶液0.2ml和浓氨试液1ml,使成两液层;在放置30分钟内,两液层的接界面处出现一暗绿色环。
4.2.1 结果判定:上述(1)(4)应呈正反应(2)(3)应符合规定,则判定该项合格。
4.3 检查4.3.1 酸度取本品0.50g,加水20ml溶解后,照pH值测定法(详见pH值测定法标准操作规程),pH值应为4.5~5.5,则判定该项合格。
乳酸环丙沙星氯化钠注射液生产工艺规程

技术标准本品为乳酸环丙沙星与氯化钠制成的灭菌水溶液1 品名: 乳酸环丙沙星氯化钠注射液2 剂型: 大容量注射剂3 规格: 100ml:0.2g(以C17H18FN3O3计)4 代码:Y6065 处方:5·1基准处方乳酸环丙沙星 2.54g氯化钠9.0g注射用水至1000ml5·2 标准生产量:1100000 ml/批所用的原辅料及数量名称代码数量乳酸环丙沙星Y120 2.794Kg(理论投料量)氯化钠Y102 9.9Kg针用活性炭F101 220g依地酸钙钠F109 55g10%乳酸F104 1.8L注射用水F108 至1100000 ml乳酸环丙沙星原料折算公式:实际投料量=理论投料量含量×(1-干燥失重)6 生产工艺及操作要求:6·1 配制(万级、温度18~26℃、湿度45~65%):本工序包括称量、浓配、稀配等。
6·1·1 称量:在备料间根据指令核对原辅料品名、规格、批号、生产厂家、数量,与本公司检验报告单一致。
称量前校准天平、电子秤并检查是否在效期内。
按处方要求进行原辅料的称量,并填写称量记录。
剩余原辅料扎紧袋口,标明原辅料名称、批号、剩余量、使用人,放置于暂存架。
换品种清场时,将剩余料密封,贴上卡片,标明名称、规格、批号、数量、日期,退回脱包间,返至仓库。
6·1·2 浓配:取规定量氯化钠在浓配间投入到放有适量注射用水(70~85℃)的SH-Ⅰ浓配罐中,搅拌溶解,使成20%~22%的浓溶液,加入0.01%(g/ml,以稀配体积计)的针用活性炭,搅拌混匀,煮沸(100℃)15分钟,稍冷,用钛棒过滤器加压过滤,内循环10分钟,泵入稀配罐。
6·1·3 稀配:在稀配间向SH-Ⅰ稀配罐中加注射用水至全量的约80%,加入规定量乳酸环丙沙星,加0.005%(g/ml,以稀配体积计)的依地酸钙钠,用10%乳酸0.9L/Kg(以环丙沙星计)调节pH值,加0.01%(g/ml,以稀配体积计)的针用活性炭,补加注射用水至全量,搅拌、回流15分钟,测pH值(3.8~4.2)、含量(以环丙沙星计为98.0%~101.0%)符合规定后,降温至40~50℃,用钛棒过滤器和0.22μm的膜滤芯加压过滤,终端用0.22μm的膜滤芯过滤至灌装。
显色基质法检测乳酸环丙沙星氯化钠注射液的细菌内毒素

显色基质法检测乳酸环丙沙星氯化钠注射液的细菌内毒素目的比较显色基质法与凝胶法检测乳酸环丙沙星氯化钠注射液的细菌内毒素的效果。
方法采用样品稀释法研究显色基质鲎试剂对不同批号乳酸环丙沙星氯化钠注射液的干扰,并与凝胶法鲎试剂对样品的干扰试验比较。
结果显色基质法标准曲线的线性相关系数≥ 0.98,乳酸环丙沙星氯化钠注射液在0.5 mg/mL浓度时无干扰作用,明显高于凝胶法无干扰浓度(0.125 mg/mL)。
结论与凝胶法比较,显色基质法有灵敏、快速、能定量、重复性好的特点,可用于乳酸环丙沙星氯化钠注射液内毒素含量的测定。
标签:显色基质鲎试剂法;凝胶法;细菌内毒素;干扰试验;乳酸环丙沙星氯化钠注射液注射用乳酸环丙沙星具有广谱抗菌作用,是较早应用于临床的喹诺酮类药物,尤其对需氧革兰阴性杆菌引起的感染有效,由于其价格低廉,疗效明确,因此在临床上被广泛应用。
2010年版《中国药典》规定乳酸环丙沙星氯化钠注射液热原检测采用家兔法[1],国家药典委员会于2012年8月3日已经公布的《关于注射用乳酸环丙沙星的国家标准草案的公示》,其中规定了“细菌内毒素检查”,用0.06 EU/mL或更高灵敏度的鲎试剂凝胶法检查(《中国药典》2010版二部附录ⅪE[1]),每毫克环丙沙星中含内毒素的量应小于0.50 EU。
在凝胶法检查基础上,笔者依显色基质法规定,通过试验进行乳酸环丙沙星氯化钠注射液中显色基质法检查的方法学研究,以期为环丙沙星检测内毒素寻求较为合适的方法。
细菌内毒素检查法是检测供试品中细菌内毒素的限量的方法,主要方法分为凝胶法和光度测定法,后者包含浊度法和显色基质法。
法定标准规定越来越多的注射制剂采用此法控制药品中热原的含量。
近年来,药典委员會要求各地药检部门做了很多工作,研究细菌内毒素检测方法的合理性和可靠性。
笔者对乳酸环丙沙星氯化钠注射液的细菌内毒素检测进行方法学研究,建立了显色基质法检测该药中细菌内毒素方法,相比凝胶法,更快速准确。
乳酸环丙沙星原料药含量测定方法的探讨

有 效措施 ,随着 抗菌药 物的长 期广泛 使用 ,以往对猪 胸 膜 肺 炎放 线 杆 菌有 效 的 抗 菌药 物 如 内酰 胺类 、林 可 霉 素、卡那 霉素等 在世 界许多地 方都 出现 了不 同程度 的耐
药性 。 5 卅
在 对2 1年9 1 月商丘市 疑似猪 传染 性胸 膜肺 炎发 0 1 —2 病 猪进行 细菌分 离鉴 定和药敏 试验 的基础上 ,笔者选 用 敏 感抗菌 药物进 行临床 疗效试验 ,取 得 了较 好临床 治疗
01 . 5
根据 以上数据统计RS D符合精密度试验要求 。
23 线 性 关系 .
将上述对 照品溶液稀释 不 同浓度 ,依次进样对应5 个
不 同 的吸 收 度 ,结 果 见 表 2 。
表2 样 品浓 度 与吸收 度 的关系
1 材料与方法
11 材 料 .
111 药 品 试 剂 乳 酸 环 丙 沙 星 : 含 量 9 .% , 批 号 .. 96
死 亡率很 高 。3 型和6 型毒力较低 。我 国当前猪 群 中流 行
的 血 清 型 主 要 为 1 5 型 , 其 次 是 血 清 2 3 4 1 、 、7 、 、 、 0 型 。 6 1周 龄 的猪 易 感 染 ,尤 以3 龄 的 猪 发 病 率 最 高 , ~6 月 可 达 8 % 0 %,死 亡 率 5 %E 0 10 0 卜。 长 期 以 来 抗 菌 药 物 是 临 床 治 疗 猪 传 染 性 胸 膜 肺 炎 的
量 ,现 将 两种 方 法 测 得 的情 况 总 结 如 下 :
1
( %)
6 RD S
01 . 7
2
3
4
5
04 8 04 7 04 7 0 3 0 3 04 7 . .3 . . 6 3 3 4 .8 4 .3
2%乳酸环丙沙星可溶性粉半成品检验SOP

GMP管理文件
一、目的:建立乳酸环丙沙星可溶性粉检验的标准操作规程,保证正确操作。
二、依据:《乳酸环丙沙星可溶性粉半成品内控质量标准》。
三、适用范围:适用于乳酸环丙沙星可溶性粉半成品的检验。
四、责任者:QC检验员
五、正文:
1.检验项目和指标
2.检验方法:
除特别注明外,试验中所用试剂为分析纯试剂,水为纯化水,仪器设备为一般实验室仪器设备。
2.1 性状
取供试品5袋,肉眼在自然光下观察颜色,为白色或微黄色粉末,则判定该项合格。
2.2 酸度:取本品5.0g,加水20ml溶解后,依法测定(详见PH值测定法标准操作规程),pH值应为4.5~5.5。
则判定该项合格。
2.3 溶液性:取本品50mg,加水100ml,搅拌,应溶解。
则判定该项合格。
2.4 细度:取混合后的半成品约50g,应能通过五号筛(详见细度检查法标准操作规程)。
则判定该项合格。
2.5 外观均匀度取本品适量置光滑纸上,平铺约5cm2,将其表面压平,在亮处观察,应呈现均匀的色泽,无花纹、色斑。
则判定该项合格。
乳酸环丙沙星注射液内控质量标准

GMP管理文件一.目的:制定乳酸环丙沙星注射液内控质量标准,规范公司乳酸环丙沙星注射液的生产过程。
二.适用范围:适用于乳酸环丙沙星注射液的生产和质检。
三.责任者:生产部经理、质管部经理、检验员四.正文:乳酸环丙沙星注射液本品为乳酸环丙沙星的灭菌水溶液。
含乳酸环丙沙星按环丙沙星(C17H18FN3O3)计算,应为标示量的92.0%~108.0%。
本品中加有氯化钠调节等渗。
【性状】本品为无色或几乎无色的澄明液体。
【鉴别】(1)在含量测定项下记录的色谱图中,供试品峰的保留时间应与对照品峰的保留时间一致。
(2)取本品50ml,置水浴上蒸干,残渣加0.1mol/L盐酸溶液2.5ml,搅拌使溶解,滤过,滤液显乳酸盐的鉴别反应。
(3)本品显钠盐的氯化物的鉴别反应。
【检查】PH值应为3.5~4.5 。
颜色取本品,加水制成每1ml中含环丙沙星2mg的溶液,照分光光度法,在430nm的波长处测定,吸收度不得大于0.03 。
有关物质照高效液相色谱法测定。
色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂,0.025mol/L磷酸溶液-乙腈(87:13)用三乙胺调节PH值至3.0为流动相,检测波长为277nm。
理论板数按环丙沙星峰计算应不低于2000,环丙沙星峰与内标物质峰的分离度应符合要求,拖尾引子应不大于2.5。
内标溶液的制备取恩诺沙星对照品25mg,精密称定,置100ml 量瓶中,加流动相溶解并稀释至刻度,摇匀,即得。
测定法取本品,用流动相分别定量稀释制成每1ml中含环丙沙星0.2mg的溶液(1)与0.003mg的溶液(2)。
取乳酸环丙沙星对照品约25mg,精密称定,置100ml量瓶中,加流动相溶解并稀释至刻度,摇匀;精密量取该溶液与内标溶液各5ml,置25ml量瓶中,用流动相稀释至刻度,摇匀,取20ul注入液相色谱仪,调节检测灵敏度,使主成分峰高为记录仪的满量程。
再分别取溶液(1)和溶液(2)各20ul注入液相色谱仪,记录色谱图至主成分峰保留时间的2倍。
乳酸环丙沙星注射液开发及其质量标准的制定

乳酸环丙沙星注射液开发及其质量标准的制定程怀灵(昌河飞机工业公司职工医院,江西景德镇333200)[摘要] 综合了乳酸环丙沙星注射液的制备方法、工艺选择及分光光度法进行含量测定,并阐述了医院制剂室开发此药的意义。
[关键词] 乳酸环丙沙星注射液制备生产工艺含量测定乳酸环丙沙星)环丙氟哌酸,Ciprofloxacin)为第三代广谱高效喹诺酮类抗菌剂,是目前同类药物中作用最强的一个品种,具有高效、低毒、抗菌谱广、起效快和耐药性低等特点。
乳酸环丙沙星注射液由德国拜耳(Bayer)公司在1987年研制成功并上市,商品名为Ciproxin[1]。
我国最早研制并生产乳酸环丙沙星注射液的是广东侨光制药厂,于1992年6月29日申请报批,正式品名为:乳酸环丙沙星注射液,商品名为:希普欣。
1992年11月12日颁发四类新药证书和批准文号,保护期三年,。
至1995年11月11日已到期[2]。
随后哈尔滨制药六厂[3]等近十家企业研制并生产[4]。
目前许多大医院也自行研制并生产。
1994年、1995年的统计资料表明,北京地区的医院用药中,环丙沙星用药量位居6~8位[5];最新预测资料表明,2000年环丙沙星的产值将位居于抗感染药物的首位[6]。
医院开发乳酸环丙沙星注射液会带来极大的经济效益和社会效益。
本文就此药的开发和质量标准的制定作一综述。
1生产过程1.1 处方[7]环丙沙星 2.0g乳酸适量盐酸 2.5g氯化钠9.0g注射用水加至1000ml。
1.2 制备过程[8]按处方将环丙沙星与药用乳酸加入适量的注射用水中,加热,温度控制在80~90℃,1h后加入氯化钠,搅拌溶解,再加配料量0.1%注射用活性炭,继续加热搅拌0.5h,加入盐酸并加注射用水至足量,搅拌均匀后送检,中间品检验合格后,精滤,灌封,115℃灭菌30min 即得。
1.3 原辅料的来源和质量要求1.3.1 环丙沙星C17H18FN3O3 321.24 山西太原制药厂或天津中央制药厂按干燥品计算,含C17H18FN3O3不得少于98.5%.1.3.2 乳酸C3H6O3 90.08性状:本品为无色或淡黄色稠厚液体。
乳酸环沙星氯化钠注射液处方工艺开发简述

乳酸环沙星氯化钠注射液处方工艺开发简述1.摘要:确定乳酸环丙沙星氯化钠注射液处方工艺;配制方法:乳酸在酸性条件下加热回流14小时,使乳酸含量图谱中的杂峰全部转化为乳酸,再加入其他原辅料;结果与讨论:此处方工艺可生产符合质量标准的样品。
关键词:乳酸环丙沙星;处方;配制过程。
2.开发过程本品拟开发注射剂,对处方进行了开发,根据国家药品监督管理局公示的仿制药参比制剂目录,乳酸环丙沙星氯化钠注射液参比制剂选择德国Bayer Vital GmbH的进口原研药品(国内上市),规格为:按环丙沙星计100ml:环丙沙星0.2g与氯化钠0.9g。
拟定合理的处方组成及工艺,对自制品和上市样品进行了全面的质量对比研究,在各主要质量指标等同于原研上市品的基础上确定了本品的处方组成和工艺。
在处方工艺开发过程中发现,灭菌前后乳酸含量变化较大,而且在乳酸含量图谱中,参比制剂仅有乳酸和环丙沙星2个峰,无其他杂峰,自研产品在开发前期的乳酸含量图谱中除乳酸和环丙沙星外有杂峰,故开发中需除去多余的杂峰。
在开发过程中发现:无论灭菌参数为多少(如未灭菌,灭菌15分钟,灭菌60分钟)乳酸加上其他杂峰后的总峰面积几乎一致,再结合乳酸的生产制备工艺(发酵浓缩,浓缩时乳酸会脱水形成乳酸酐)推断,杂峰为乳酸酐,由于乳酸为多元羧酸,浓缩时可能会有二聚体、三聚体或多聚体等物质,故未灭菌的样品的乳酸图谱中会有多个杂峰,而且在去除乳酸酐时各杂峰的去除时间也有差异,并且酸酐也可以在酸或碱性条件下水解成相应的酸,也间接证明杂峰为乳酸酐。
经对参比进行解析,通过检测结果得出参比制剂PH值4.20,乳酸含量为0.63mg/ml,再根据氯化钠和环丙沙星用量得出基础处方。
配制500ml药液处方如下:环丙沙星1g、氯化钠4.5g、乳酸0.325g、调pH值至3.9~4.5之间,加水至500ml定容。
因此,拟定1000ml制工艺:取约800g纯化水,加入乳酸约0.72g,搅拌均匀,移至1000ml容量瓶中定容,再移至三口烧瓶中煮沸回流,在1h、2h、3h、4h、5h、6h、8h、10h、12h、14h取样检测乳酸含量,乳酸含量在煮沸回流到14h小时后达到100%,自制品只有乳酸和环丙沙星2个峰,无其他杂峰,煮沸14小时后乳酸杂峰可消除,其结果如下表:根据以上乳酸杂峰的消除时间及加入环丙沙星和氯化钠搅拌溶解后,121℃,灭菌30min,乳酸的含量达到100.00%,达到工艺要求,确定以下最终处方工艺过程。
乳酸环丙沙星注射液的制备工艺研究

将 其稀 释至 刻度 ,摇 匀 ,取 20 l注入 高效 液相 色谱 仪 ,记 录色谱 注射 液的含量fJ].中国药品标 准,2000,1(1):42—43.
中(温度为 40—5O℃ ),再按照 配制量加 0.05% 针剂用 活性炭,搅匀 , 体温度等因素。 静置 10min,过滤脱炭,合并滤 液后向其加入适 量的注射用水 使成 本 文通过线 性范 围的考察 、精密 度试验 、稳定性 试验和 回收率 100L,搅匀 ,用乳 酸调 解 pH 值 4.0-4.2,取样 测定 含量 ,合格 后 精 试 验等对建立 的测定方法进行 了验证 。结果 表明 ,本实验方法重现
成样 品 ,含 环丙沙 星相 当于标示 量 的 80%,100%,120%,并 按照上
3.1 处 方 。 乳 酸 环 丙 沙 星 254g,氯 化 钠 900g,l% 乳 酸 适 量 , 述确定 的色谱 条件来进行测 定 ,将样 品注入高效液相 色谱仪 ,以峰
注射用水加 至 100L。
面积计算含量 ,得平均 回收率为 99.66%,RSD=0.19%fn=9)。
腈 一0.025mol/L磷 酸溶液 (13:87)(用三 乙胺 调节 pH值 至 3.0±0.1),
参 考 文 献
检测波长为 276nm,流速 为 1.2 ml/min,进样量 :2O l。
【1]吴汉斌 L酸环 丙 沙星注射 液 生产 工 艺改进研 究[J】.中国药业 ,
4.2制备对照品溶液。精 密称取 20mg的环丙沙星对照 品,将其 1999,8(1 2】:64.
3B 型精密 pH 计 ,uV一754 分光 光度计 ,电子分析天平 ,HH—S恒 6.0 ml,然后将其分 别置于 10ml的容量瓶 中,加入适量 的流 动相 使
乳酸环丙沙星原料药的含量测定方法探讨

Appl i ca ti on of preopera ti ve i n terven ti on che m otherapy and rad i a l hysterecto m y to cerv i ca l cancerL iu Cui,Xu Xujun,X ie Shuying,et al.T he R ed C ro ss Ho s p ital of Yulin C ity,Guangx i(Yulin537000) Abstract O bjective:To evaluate the therapeutic effects in patien ts w ith cervical cancer after in terven ti onal che mo therapy and radial hystrectom y1M ethods:T h rough the bilateral feeding arteries,17cases of cervical cancer( A~ B stage)w ere per2 fo r m ed the arterial perfusi on w ith DD P(o r Carbop latin)and EP I,and w ere operated che moe m bo lizati on w ith gelfoam particles.A fter in terven ti onal che mo therapy,th is case w ho w ere suit fo r operati on w ere perfo r m ed ex ten sive to tal hysterectom y1R esults:In all cases,the size of focal lesi on in cervix w ere di m in ished about2110%~100%(average:8812%),radial hysterectom y w ere per2 fo r m ed s moo th ly in14of17patien ts1Conclusi on:T he p reoperative in terven ti onal che mo therapy is p roved to be effective in reduc2 ing tumo r binati on w ith radial hysterectom y,14cases had reached CR1 Key W ords Cervical cancer;In terven ti onal che mo therapy;DD P;Carbop latin;EP I;T herapeutic effect乳酸环丙沙星原料药的含量测定方法探讨广西区人民医院药剂科(530021) 潘 莹广西中医学院药学院(530001) 江海燕广西中医学院第一附属医院(530023) 吴小燕 摘要 目的:考察乳酸环丙沙星的含量测定方法。
高效液相色谱仪乳酸环丙沙星含量测定实验报告

高效液相色谱仪乳酸环丙沙星含量测定实验报告介绍如下:
实验目的:
使用高效液相色谱仪(HPLC)测定乳酸环丙沙星的含量,评价其分析方法的准确性和可靠性。
实验原理:
本实验采用反相高效液相色谱法(RP-HPLC)测定乳酸环丙沙星的含量。
反相色谱法是一种以极性固定相为填料的色谱分离技术,它可用于分离大多数非极性、微极性有机物和药物。
实验步骤:
1.样品制备:取一定量的乳酸环丙沙星药物,加入适量的乙腈溶解,并用0.22 μm的
滤器过滤掉杂质。
2.HPLC条件设置:使用反相色谱柱(C18),流动相为甲醇/水(55:45),流速为1 mL/min,
柱温为30℃,检测波长为278 nm。
3.样品测定:将制备好的样品注入HPLC进行测定,记录峰面积并计算乳酸环丙沙星
的含量。
实验结果:
样品峰面积:14035.2
乳酸环丙沙星含量:97.8%
实验结论:
本实验采用反相高效液相色谱法测定乳酸环丙沙星的含量,准确性和可靠性良好。
该方法可以用于乳酸环丙沙星的含量测定和质量控制。
乳酸环丙沙星氯化钠注射液.

乳酸环丙沙星氯化钠注射液Rusuan Huanbingshaxing Lühuana Zhusheye Ciprofloxacin Lactate and Sodium ChlorideInjection本品为环丙沙星与乳酸和氯化钠或乳酸环丙沙星与氯化钠制成的灭菌水溶液。
含乳酸环丙沙星按环丙沙星(C17H18FN3O3)计算,应为标示量的90.0%~110.0%。
【性状】本品为无色或几乎无色的澄明液体。
【鉴别】 [1](1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)取本品适量,加盐酸溶液(9→1000)制成每1ml中含环丙沙星5μg的溶液,照紫外-可见分光光度法(附录Ⅳ A)测定,在277nm的波长处有最大吸收。
(3)取本品作为供试品溶液;取乳酸适量,加水制成每1ml 中约含乳酸0.4mg的溶液,作为对照溶液①;另取乳酸、琥珀酸和马来酸适量,用水溶解并稀释制成每1ml中各约含0.4mg的混合溶液,作为对照溶液②。
照薄层色谱法(附录Ⅴ B)试验,吸取上述三种溶液各10μl,分别点于同一硅胶G薄层板上,以甲苯-乙酸乙酯-乙醚-甲酸(6:3:2:1)为展开剂,展开,晾干,在105℃加热20分钟后,放冷,喷以显色剂(含0.075%溴甲酚绿和0.025%溴酚蓝的无水乙醇溶液)显色。
对照溶液②应显三个完全分离的斑点,供试品溶液所显主斑点的颜色和位置应与对照溶液①主斑点的颜色和位置相同,且供试品溶液所显主斑点的颜色不应浅于对照溶液①主斑点的颜色。
(4)本品显钠盐和氯化物(1)(附录Ⅲ)的鉴别反应。
[2] (1)取本品作为供试品溶液,照盐酸环丙沙星片项下的鉴别[2](1)、(2)、(3)和(4)试验,显相同的反应。
(2)量取本品适量,用乙醇稀释制成每1ml中含环丙沙星1mg的溶液,作为供试品溶液,照盐酸环丙沙星片项下的鉴别[2](5)试验,显相同的结果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
乳酸环丙沙星氯化钠注射液半成品含量测定方法的建立
发表时间:2016-09-28T14:41:36.483Z 来源:《健康世界》2016年第16期作者:徐林儿徐雷柯云翠[导读] 通过分析处理,可以将 UV法作为测定该制剂环丙沙星的中间体含量的内控标准。
杭州民生药业有限公司杭州 311100 摘要:目的建立UV法测定乳酸环丙沙星氯化钠注射液半成品含量。
方法采用UV法在 272nm处测定环丙沙星的含量。
结果 UV法测定环丙沙星的含量较2005年版药典HPLC法高 2.71%。
结论采用紫外分光光度法测定乳酸环丙沙星氯化钠注射液中环丙沙星的含量,快速简便、线性、回收率良好,通过分析处理,可以将 UV法作为测定该制剂环丙沙星的中间体含量的内控标准。
关键词:乳酸环丙沙星注射液;紫外分光光度法(UV);HPLC法;环丙沙星含量乳酸环丙沙星是第三代喹诺酮类抗菌药物,其注射液为无色或几乎无色的澄明液体,适用于治疗由多种革兰氏阳性和革氏阴性细菌感染的疾病,以及两种或两种以上的细菌混合感染,也可用于多重耐药菌株引起的感染。
抗菌谱广,体外抗菌活性为目前临床应用喹诺酮类中最强。
乳酸环丙沙星氯化钠注射液的质量标准中(中国药典2005年版)环丙沙星的含量测定HPLC法,而我们在大生产半成品测定中采用HPLC法不是很实用,相关文献中有用 UV法测定本品含量[1][2][3],我们现建立UV法测定方法含量并作方法学验证,同时将二种方法作一对比考察,比较UV与 HPLC法测定结果间的具体差距,同时建立大生产半成品最简便的测定方法。
1 仪器和药品 TU1800型紫外可见分光光度计;Waters高效液相色谱仪,DK-8B型电热鼓风干燥箱,AG285 型Mettler toledo电子分析天平,320型Mettler Toledo PH计。
环丙沙星对照(含量为 84.9%,中国药品生物制品检定所),乳酸环丙沙星注射液(本公司自制,,规格为100ml:0.2g以环丙沙星计),0.05 moL /L枸橼酸溶液,乙腈(色谱纯),三乙胺,0.05moL /LNaOH。
2 UV法测定环丙沙星含量
精取乳酸环丙沙星氯化钠注射液 5mL置于 100mL量瓶中,加水稀释至刻度,摇匀后,精取 5mL置于 100mL量瓶中,加0.05moL /L NaOH液至刻度,摇匀,得 5ug/mL的环丙沙星溶液,以 0.05moL /L NaOH液作空白,照分光光度法在 272nm波长处测定吸光度,代入方程 c(%)=(9.84735 * A-0.03059)/25计算含量。
2.1 专属性试验
取0.9%氯化钠溶液、0.2%环丙沙星溶液、乳酸环丙沙星氯化钠注射液,各取5ml,分别置3个100ml量瓶中,加0.05mol/L NaOH液至刻度,以 0.05moL /L NaOH液作空白,照分光光度法在 200nm-400nm波长范围内扫描,环丙沙星在271nm处有最大吸收,且0.9%氯化钠溶液在此波长处无吸收(不干扰环丙沙星的测定) 2.2线性试验
取乳酸环丙沙星原料加0.05moL /L NaOH液,配制一系列浓度的溶液(1、2.5、5、6、10ug/ml),在272nm处测定吸收度以浓度为横坐标、吸光度为纵坐标作图,线性方程为:Y=0.0978X+0.0001,R=1,说明环丙沙星浓度在1~10ug/ml的范围内,浓度与吸光度呈良好的线性关系。
3 HPLC法测定样品中环丙沙星含量
3.1 色谱条件色谱柱:C18柱(
4.6 ×250,5 μm);柱温:30℃;流动相:0.05moL /L枸缘酸溶液-乙腈( 82:18)(用三乙胺调 pH3.5);检测波长 277nm;流速:1mL /min;进样量:10uL。
3.2 含量测定精密称定环丙沙星对照品25mg,置 50mL量瓶中,加流动相溶解并稀释至刻度,摇匀,作为对照品溶液。
另精密量取乳酸环丙沙星注射液 2.5mL置于 10mL量瓶中,用流动相稀释至刻度,摇匀,得样品溶液。
各精密量取 10uL注入液相色谱仪,记录色谱图。
按外标法以峰面积计算样品中环丙沙星含量。
3.3 按HPLC法测定三批大生产样品,测定结果见下表4
5 讨论 5.1本实验使用的 HPLC法是 2005年版药典中乳酸环丙沙星注射液里质量标准中的方法,UV法为相关文献中的方法。
我们对UV法进了方法学验证考察,专属性、线性、回收率均良好。
5.2 UV法和 HPLC法测定乳酸环丙沙星注射液中环丙沙星的含量,UV法比HPLC法偏高2.71%。
采用UV法测定环丙沙星的含量更快速、简便,可以用 UV法做为该制剂的半成品内控质量标准。
参考文献:
[1]李伊庆管恩杰等 pH值对乳酸环丙沙星注射液质量的影响药学实践杂志,2001,19(1):61~62。
[2]曹均告谭永红等UV法和 HPLC法测定乳酸环丙沙星注射液中环丙沙星含量的比较西南军医,2007,9(2):32~33。
[3]乳酸环丙沙星氯化钠注射液国家药典委员会编中国药典 [M ] 二部北京:化学工业出版社,2005,304~305。
作者简介:徐林儿(1978-)性别:女民族:汉籍贯:桐庐单位:杭州民生药业有限公司职务:工程师职称:工程师研究方向:方
法比对。
