食品化学课件第六章酶学习资料
合集下载
食品化学 第六章_酶

第三节
固定化酶
固定化酶是通过吸附、偶联、交联和包埋等物理或 化学的方法把酶连接到某种载体上,做成仍具有酶 催化活性的水不溶性酶。
作用特点:稳定性提高,易分离,可反复使用,提 高操作的机械强度。
1.固定化酶的制备
2.固定化酶在食品工业中的应用
酶的化学本质是蛋白质,其最大弱点是不稳定性,对
体。
酶和一般催化剂的共性:
◦ 加快反应速度;
◦ 不改变平衡常数;
◦ 自身不参与反应。
专一性:即酶只能对特定的一种或一类底物起作用。 可分为:
◦ 绝对专一性:有些酶只作用于一种底物,催化 一个反应,而不作用于任何其它物质。 ◦ 相对专一性:这类酶对结构相近的一类底物都 有作用。包括键的专一性和基团的专一性。 ◦ 立体异构专一性:这类酶只对底物的某一种构 型起作用,而不催化其他异构体。包括旋光异 构专一性和几何异构专一性。
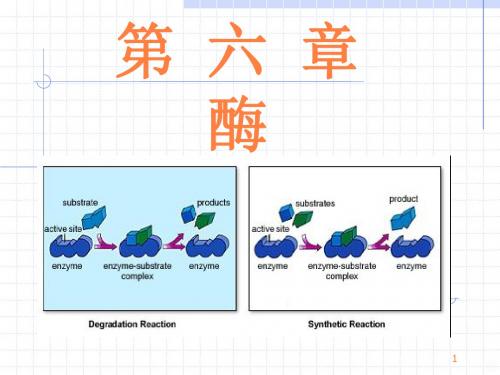
生成不稳定的中间络合物
(ES),再分解成产物( P)并释放出酶,使反应
E1
能 量 水 平
ES
E2
E+S
G
沿一个低活化能的途径进
行,降低反应所需活化能 ,所以能加快反应速度。
P+ E
反应过程
酶原:没有活性的酶的前体。 酶原的激活:酶原在一定条件下经适当的物质作用
可转变成有活性的酶。酶原转变成酶的过程称为酶
原的激活。
本质:酶原的激活实质上是酶活性部位形成或暴露
的过程。
第二节
影响酶活力的因素
一、底物浓度对酶活力的影响
在酶浓度,pH,温度等条件 不变的情况下研究底物浓度 和反应速度的关系。如右图 所示: 在低底物浓度时, 反应速度 与底物浓度成正比,表现为 一级反应特征。 当底物浓度达到一定值,几 乎所有的酶都与底物结合后, 反应速度达到最大值 (Vmax),此时再增加底 物浓度,反应速度不再增加, 表现为零级反应。
食品酶简介PPT课件

人们已基本达到共识,认为酶是由活生命机 体产生的具有催化活性的生物大分子物质。在 生物体内,除少数几种酶为核酸(DNA 或RNA) 分子外,大多数的酶类都是蛋白质。
• 2.2 酶的催化特性
酶作用条件温和;酶的催化效率高;酶作 用的专一性(specificity)强 ;酶活性具有可调
节性 。
4
• 2.3 酶的分类与命名
• 酶在含水量相当低的条件下仍具有活性。例如,
脱水蔬菜需于干制前热烫,否则会很快产生干草 味,不宜贮藏。干燥的燕麦食品,如未能使酶失 活,则经过贮藏后会产生苦味。面粉在低水分 (14%以下)时,脂酶能很快使脂肪分解成脂肪 酸和醇类。水分活度对酶促反应的影响是不一致 的,不同的反应,其影响也不相同。
13
性随着介质的pH值变化而变化。每一种酶只能在 一定pH值范围内表现出它的活性。使酶的活性达 到最高时的pH值称为最适 pH值(optimum pH)。 在最适pH值的两侧酶活性骤然下降,所以一般酶 促反应速度的pH值曲线呈钟形。一般酶的最适pH 值在4.5-8.0之间。
12
• 2.5 水分活度的影响
• 在果酒酿造中,常添加酸性蛋白酶、淀粉酶、果胶酶,用
以消除浑浊或改善压汁操作。
• 在白酒、乙醇生产中以糖化酶代替麸曲可提高出酒率(2
%-7%),节约粮食,简化设备节省厂房场地。
21
• 2.2 在动物性食品加工中的应用
• 1)乳品工业 • ①凝乳酶—制造干酪。②过氧化氢酶—牛奶
消毒。③溶菌酶—添加于婴儿奶粉。④乳糖 酶—分解乳糖。⑤脂肪酶—黄油增香。
使用。也可用于终端改善烘培及蒸煮制品的质量。
35
• 3 果胶酶LEKenzyme-99 • 3.1概述 • 果胶酶LEKenzyme-99是高效表达的微生
• 2.2 酶的催化特性
酶作用条件温和;酶的催化效率高;酶作 用的专一性(specificity)强 ;酶活性具有可调
节性 。
4
• 2.3 酶的分类与命名
• 酶在含水量相当低的条件下仍具有活性。例如,
脱水蔬菜需于干制前热烫,否则会很快产生干草 味,不宜贮藏。干燥的燕麦食品,如未能使酶失 活,则经过贮藏后会产生苦味。面粉在低水分 (14%以下)时,脂酶能很快使脂肪分解成脂肪 酸和醇类。水分活度对酶促反应的影响是不一致 的,不同的反应,其影响也不相同。
13
性随着介质的pH值变化而变化。每一种酶只能在 一定pH值范围内表现出它的活性。使酶的活性达 到最高时的pH值称为最适 pH值(optimum pH)。 在最适pH值的两侧酶活性骤然下降,所以一般酶 促反应速度的pH值曲线呈钟形。一般酶的最适pH 值在4.5-8.0之间。
12
• 2.5 水分活度的影响
• 在果酒酿造中,常添加酸性蛋白酶、淀粉酶、果胶酶,用
以消除浑浊或改善压汁操作。
• 在白酒、乙醇生产中以糖化酶代替麸曲可提高出酒率(2
%-7%),节约粮食,简化设备节省厂房场地。
21
• 2.2 在动物性食品加工中的应用
• 1)乳品工业 • ①凝乳酶—制造干酪。②过氧化氢酶—牛奶
消毒。③溶菌酶—添加于婴儿奶粉。④乳糖 酶—分解乳糖。⑤脂肪酶—黄油增香。
使用。也可用于终端改善烘培及蒸煮制品的质量。
35
• 3 果胶酶LEKenzyme-99 • 3.1概述 • 果胶酶LEKenzyme-99是高效表达的微生
食品化学第六章-酶课件.ppt

(一)粘度 ❖ 冷冻中,90%以上的自由水被冻结 ❖ 未冻结相的粘度会显著提高 ❖ 酶和底物分子的移动性降低 ❖ 酶活力下降
2024/11/24
第二节
53
第二节
(二)压力
一般压力不致于高到使酶失活 几种处理方式相结合时,导致酶失活 ➢压力-高温处理 ➢压力-高剪切处理 高压灭酶
2024/11/24
改变,或者当底物存在时,结合的酶可能会解
吸。
2024/11/24
61
(二)共价连接
第三节
两种处理方法:
➢化学试剂和载体(聚丙烯酰胺、葡聚糖、纤维素、
硅胶等)通过化学反应使酶分子上游离的羧基或 氨基共价结合到载体上。
➢双官能试剂(如戊二醛)将酶分子连接起来。酶
分子通过双官能试剂彼此相连接,形成了共价键, 同时酶的以部分起着载体的作用。
教学目的与要求
了解酶的化学本质、分类、酶催化的机理和酶 的反应动力学;酶的固定化方法。
掌握影响酶活力的因素;固定化酶的特点。
掌握各种酶的作用特点,包括脂肪氧合酶、多 酚氧化酶、果胶酶、蛋白酶、淀粉酶、纤维素 酶、过氧化物酶等;哪些酶可作为食品质量的 指示剂。
2024/11/24
1
教学目的与要求
2024/11/24
7
第一节引论
酶被反复使用 酶的周转率(Turnover)
在酶被完全饱和条件下,单位时间内底物 被每个酶分子转变成产物的分子数。
大多数酶,1×104s-1 少量的酶(昂贵)~大量的生物转化
2024/11/24
8
第一节引论
酶具有专一性或特异性(specificity)
酶作为催化剂的机制不完全清楚
部位上去 酶的专一性或特异性可扩展到键的类型上。
2024/11/24
第二节
53
第二节
(二)压力
一般压力不致于高到使酶失活 几种处理方式相结合时,导致酶失活 ➢压力-高温处理 ➢压力-高剪切处理 高压灭酶
2024/11/24
改变,或者当底物存在时,结合的酶可能会解
吸。
2024/11/24
61
(二)共价连接
第三节
两种处理方法:
➢化学试剂和载体(聚丙烯酰胺、葡聚糖、纤维素、
硅胶等)通过化学反应使酶分子上游离的羧基或 氨基共价结合到载体上。
➢双官能试剂(如戊二醛)将酶分子连接起来。酶
分子通过双官能试剂彼此相连接,形成了共价键, 同时酶的以部分起着载体的作用。
教学目的与要求
了解酶的化学本质、分类、酶催化的机理和酶 的反应动力学;酶的固定化方法。
掌握影响酶活力的因素;固定化酶的特点。
掌握各种酶的作用特点,包括脂肪氧合酶、多 酚氧化酶、果胶酶、蛋白酶、淀粉酶、纤维素 酶、过氧化物酶等;哪些酶可作为食品质量的 指示剂。
2024/11/24
1
教学目的与要求
2024/11/24
7
第一节引论
酶被反复使用 酶的周转率(Turnover)
在酶被完全饱和条件下,单位时间内底物 被每个酶分子转变成产物的分子数。
大多数酶,1×104s-1 少量的酶(昂贵)~大量的生物转化
2024/11/24
8
第一节引论
酶具有专一性或特异性(specificity)
酶作为催化剂的机制不完全清楚
部位上去 酶的专一性或特异性可扩展到键的类型上。
食品化学-06酶

(2)酸处理法 ) • 多数酚酶最适 =6~7,PH < 3失活。 多数酚酶最适PH= ~ , 失活。 失活 • 常用的酸有:柠檬酸、苹果酸、磷酸、抗坏血酸、混合酸。 常用的酸有:柠檬酸、苹果酸、磷酸、抗坏血酸、混合酸。 • 柠檬酸可降低 ,还可络合酚酶辅基 2+,但单独用效果不大。常 柠檬酸可降低pH,还可络合酚酶辅基Cu 但单独用效果不大。 与抗坏血酸、亚硫酸合用。 与抗坏血酸、亚硫酸合用。 • 实践证明:0.5%柠檬酸 + 0.3%抗坏血酸效果好。 实践证明: 抗坏血酸效果好。 柠檬酸 抗坏血酸效果好 • 抗坏血酸还可使酚酶失活,且可耗氧。 抗坏血酸还可使酚酶失活,且可耗氧。
5
酶的固定方法 2. 共价连接
利用酶与载体形成共价键固定酶 此法载体与酶结合牢固、半衰期长。 此法载体与酶结合牢固、半衰期长。 形成共价键的反应剧烈,常常引起酶蛋白高级结构发生变化, 形成共价键的反应剧烈,常常引起酶蛋白高级结构发生变化,因 此酶活力回收一般较低。 此酶活力回收一般较低。 共价结合法使用的载体主要有: 共价结合法使用的载体主要有: 纤维素、琼脂糖凝胶、葡聚糖凝胶、甲壳素及其衍生物、 纤维素、琼脂糖凝胶、葡聚糖凝胶、甲壳素及其衍生物、氨基酸 共聚物、甲基丙烯酸(或醇)共聚物、多孔玻璃等。 共聚物、甲基丙烯酸(或醇)共聚物、多孔玻璃等。
17
b.钙离子激活中性蛋白酶 分离出两种:CANPⅠ和CANPⅡ 分离出两种:CANPⅠ和CANPⅡ 都是二聚体 都是二聚体 含有相同的较小亚基(MW=30,000)和较大的亚基(MW=80,000, 含有相同的较小亚基(MW=30,000)和较大的亚基(MW=80,000,免疫性 质不同)。 )。 质不同)。 完全激活:50~ μmol/L CANP I 完全激活:50~100 μmol/L Ca2+ 的激活: mmol/L CANP II 的激活:1~2 mmol/L Ca2+ 活性部位中含有半胱氨酸残基的巯基,被归属于巯基蛋白酶 活性部位中含有半胱氨酸残基的巯基, CANPS的作用 CANPS的作用 • 通过分裂特定的肌原纤维蛋白质影响肉的嫩化 • 同溶菌体蛋白酶协同作用 • 死后僵直的肌肉缓慢松弛,这样产生的肉具有良好的质构 死后僵直的肌肉缓慢松弛,
《食品中的酶》课件

在食品加工中的效果和效率。
酶在食品工业中的可持续发展
01
酶在绿色食品加工中的应用
利用酶法替代化学法,减少食品加工中的有害物质残留,提高食品的安
全性和品质。
02
酶在资源回收和环境保护中的应用
利用酶法处理废弃物和废水,实现资源回收和环境保护,促进食品工业
的可持续发展。
03
酶在新型食品开发中的应用
利用酶的特殊催化功能,开发新型食品和功能性食品,满足消费者对食
凝乳酶
用于生产奶酪,使牛奶凝结并分 离出乳清。
蛋白酶
可以改变牛奶中蛋白质的结构, 提高奶酪的质感和口感。
脂肪酶
可以水解牛奶中的脂肪,提高奶 酪的风味和口感。
酶在果汁加工中的应用
果胶酶
用于分解果肉中的果胶,提高果汁的出汁率。
纤维素酶
可以分解果肉中的纤维素,使果汁更加清澈。
氧化酶
可以氧化果汁中的某些成分,提高果汁的色泽和 风味。
可分为单体酶、寡聚酶和多聚酶等。
根据酶的作用性质分类
可分为氧化还原酶、水解酶、裂合酶 、异构酶和转移酶等。
02
酶在食品中的作用
酶与食品加工
酶在食品加工中具有重要作用,能够 催化食品中的化学反应,改善食品的 口感、色泽和质地。
酶还可以用于制作酶解食品,如酱油 、醋和味精等,通过酶解过程将大分 子物质转化为小分子物质,提高食品 的消化吸收率。
酶可以用于制作发酵食品,如酸奶、 面包和酒类等,通过发酵过程促进食 品中糖类、蛋白质等物质的分解和转 化。
酶在食品加工中还有助于去除杂质、 提高食品的纯度等。
酶与食品保鲜
酶可以用于延长食品的保鲜期,通过催化食品中的氧化反应,延缓食品的氧化变质 。
食品生物化学---第6章学习PPT教案

二、酶的催化特点
1.高效性
食品生物化学
2.高度专一性 3.反应条件温和 4.酶活性的可调控性
三、酶的化学本质与组成
1.酶的化学本质 酶的化学本质是蛋白质。不能说所有蛋白质都是酶,只是具有催化作用的蛋白质, 才称为酶。 一些核糖核酸物质也表现有一定的催化活性。如果仅仅把酶定义为生物催化剂, 则有催化活性的核糖核酸也应看成是酶。绝大多数酶是蛋白质,少数是核酶。
3.单体酶、寡聚酶和多酶复合体系
根据蛋白质结构上的特点,酶可分为三类 。
食品生物化学
(1)单体酶 只有一条多肽链的酶称为单体酶,它们不能解离为更小的单位。其 分子量为13,000~35,000。属于这类酶的为数不多,而且大多是促进底物发生水解反 应的酶,即水解酶,如溶菌酶、蛋白酶及核糖核酸酶等。
(2)寡聚酶 由几个或多个亚基组成的酶称为寡聚酶。寡聚酶中的亚基可以是相 同的,也可以是不同的。亚基间以非共价键结合,容易为酸、碱、高浓度的盐或其它 的变性剂分离。寡聚酶的分子量从35,000到几百万。如3-磷酸甘油醛脱氢酶等。
例如催化下述乳酸脱氢反应中的乳酸脱氢酶的系统命名为 L-乳酸:NAD氧化还原 酶,分类编号为EC1.1.1.27,其中EC为国际酶学委员会的缩写,前三个数字分别表示 所属大类、亚类、亚亚类,根据这三个标码可判断酶的催化类型和催化性质,第四个 数值则表示该酶在亚亚类中占有的位置,根据这四个数字可以确定具体的酶。
1.氧化还原酶类
催化氧化还原反应的酶称为氧化还原酶。此类酶中包括有脱氢酶、加氧酶、氧化 酶、还原酶、过氧化物酶等。催化反应通式为:
AH2 + B
A + BH2
例如乳酸脱氢酶催化乳酸氧化成丙酮酸。
食品生物化学
2.转移酶类
催化基团转移的酶称为转移酶。催化反应通式为:
1.高效性
食品生物化学
2.高度专一性 3.反应条件温和 4.酶活性的可调控性
三、酶的化学本质与组成
1.酶的化学本质 酶的化学本质是蛋白质。不能说所有蛋白质都是酶,只是具有催化作用的蛋白质, 才称为酶。 一些核糖核酸物质也表现有一定的催化活性。如果仅仅把酶定义为生物催化剂, 则有催化活性的核糖核酸也应看成是酶。绝大多数酶是蛋白质,少数是核酶。
3.单体酶、寡聚酶和多酶复合体系
根据蛋白质结构上的特点,酶可分为三类 。
食品生物化学
(1)单体酶 只有一条多肽链的酶称为单体酶,它们不能解离为更小的单位。其 分子量为13,000~35,000。属于这类酶的为数不多,而且大多是促进底物发生水解反 应的酶,即水解酶,如溶菌酶、蛋白酶及核糖核酸酶等。
(2)寡聚酶 由几个或多个亚基组成的酶称为寡聚酶。寡聚酶中的亚基可以是相 同的,也可以是不同的。亚基间以非共价键结合,容易为酸、碱、高浓度的盐或其它 的变性剂分离。寡聚酶的分子量从35,000到几百万。如3-磷酸甘油醛脱氢酶等。
例如催化下述乳酸脱氢反应中的乳酸脱氢酶的系统命名为 L-乳酸:NAD氧化还原 酶,分类编号为EC1.1.1.27,其中EC为国际酶学委员会的缩写,前三个数字分别表示 所属大类、亚类、亚亚类,根据这三个标码可判断酶的催化类型和催化性质,第四个 数值则表示该酶在亚亚类中占有的位置,根据这四个数字可以确定具体的酶。
1.氧化还原酶类
催化氧化还原反应的酶称为氧化还原酶。此类酶中包括有脱氢酶、加氧酶、氧化 酶、还原酶、过氧化物酶等。催化反应通式为:
AH2 + B
A + BH2
例如乳酸脱氢酶催化乳酸氧化成丙酮酸。
食品生物化学
2.转移酶类
催化基团转移的酶称为转移酶。催化反应通式为:
食品化学:酶

即:酶的非蛋白质组分称为酶的辅助 因子。
• 六、酶制剂 酶制剂—酶的工业化制剂。酶制剂应
用方便,易获得。
七 酶的分类
1971年国际生化协会酶命名委员会根据酶所催化 的反应类型将酶分为六大类,即氧化还原酶类、转移 酶类、水解酶类、裂解酶类、异构酶类和合成酶类, 分别用1、2、3、4、5、6的编号来表示,再根据底物 中被作用的基团或键的特点将每一大类分为若干个亚 类,每个亚类可再分若干个亚-亚类,仍用1、2、 3、……编号。故每一个酶的分类编号由用“.”隔 开的四个数字组成。编号之前是酶学委员会的缩写EC。 酶编号的前三个数字表明酶的特性:反应性质、反应 物(或底物)性质、键的类型,第四个数字则是酶在 亚-亚如类乙醇中脱的氢顺酶 序号。
根据组成酶蛋白分子的肽链数量及其组装特点, 又可将酶分为三类:
单体酶 单体酶只有一条多肽链,属于这一类的酶很少,一般都
是催化水解的酶,分子量在13 000~35 000之间,如溶菌 酶、胰蛋白酶等
寡聚酶 寡聚酶由几个甚至几十个亚基组成,这些亚基可以是相
同的多肽链,也可以是不同的多肽链。亚基之间不是共价 结合,彼此很容易分开。
食品中的酶能影响食品品质,在食 品加工中要使用酶。 • 三、本质 具有催化作用的蛋白质、酶具有活 性中心。
四、特性 • 1高效性
为一般催化剂的1000万倍~10万亿倍。 • (2)专一性(specificity)
酶对底物具有高度专一性。(绝对、 相对、立体)
• 五、酶的辅助因子
许多酶在作用时,需要一个非蛋白 质组分,酶的这个非蛋白质组分称为酶 的辅助因子。
反应速率 的因素
8.1酶的化学本质: 酶的化学组成主要是蛋白性成分。 根据其化学组成可将酶分为:
简单蛋白酶 即那些只需要其蛋白质部分就具有催化功能的酶。
• 六、酶制剂 酶制剂—酶的工业化制剂。酶制剂应
用方便,易获得。
七 酶的分类
1971年国际生化协会酶命名委员会根据酶所催化 的反应类型将酶分为六大类,即氧化还原酶类、转移 酶类、水解酶类、裂解酶类、异构酶类和合成酶类, 分别用1、2、3、4、5、6的编号来表示,再根据底物 中被作用的基团或键的特点将每一大类分为若干个亚 类,每个亚类可再分若干个亚-亚类,仍用1、2、 3、……编号。故每一个酶的分类编号由用“.”隔 开的四个数字组成。编号之前是酶学委员会的缩写EC。 酶编号的前三个数字表明酶的特性:反应性质、反应 物(或底物)性质、键的类型,第四个数字则是酶在 亚-亚如类乙醇中脱的氢顺酶 序号。
根据组成酶蛋白分子的肽链数量及其组装特点, 又可将酶分为三类:
单体酶 单体酶只有一条多肽链,属于这一类的酶很少,一般都
是催化水解的酶,分子量在13 000~35 000之间,如溶菌 酶、胰蛋白酶等
寡聚酶 寡聚酶由几个甚至几十个亚基组成,这些亚基可以是相
同的多肽链,也可以是不同的多肽链。亚基之间不是共价 结合,彼此很容易分开。
食品中的酶能影响食品品质,在食 品加工中要使用酶。 • 三、本质 具有催化作用的蛋白质、酶具有活 性中心。
四、特性 • 1高效性
为一般催化剂的1000万倍~10万亿倍。 • (2)专一性(specificity)
酶对底物具有高度专一性。(绝对、 相对、立体)
• 五、酶的辅助因子
许多酶在作用时,需要一个非蛋白 质组分,酶的这个非蛋白质组分称为酶 的辅助因子。
反应速率 的因素
8.1酶的化学本质: 酶的化学组成主要是蛋白性成分。 根据其化学组成可将酶分为:
简单蛋白酶 即那些只需要其蛋白质部分就具有催化功能的酶。
酶的基本性质及其作用ppt课件
1.加工工艺上的应用
啤酒发酵,奶酪生产。
2.应用于食品成分分析
利用酶的敏感性和专一性测定食品原料和成 品的成分变化。
3.在控制食品产品和原料的贮藏性和品 质方面的应用。
6
6.1.5 酶具有特异性(Specificity)
酶作为催化剂的机制 Emil Fischer提出的“锁和钥匙”模式
钥匙
有益的:皱胃酶、蛋白酶 、乳糖酶 有害的:果胶酶、脂酶
有效地使用和控制内源酶和外源酶。
3
6.1.2 酶的本质
定义(1979年)Dixon、Webb
酶是具有催化性质的蛋白质,其催化性质源 自于它特有的激活能力。
目前
并非所有具有催化能力的生物分子都是蛋白 质。
小分子核糖核酸酶。
4
6.1.3 酶是生物催化剂
16
1、酶促褐变的机制
过氧化物酶催化的酶促褐变
1. 2. 3. 4.
黑色素
黑色素
17
1、酶促褐变的机制
酪氨酸的酶促褐变
18
1、酶促褐变的机制
酪氨酸的酶促褐变
土豆褐变、毛发中黑色素形成机制; 目前发现的唯一一条动植物共有的褐
变途径。
19
1、酶促褐变的机制
绿原酸的酶促褐变
°ë Èé ÌÇ È© Ëá ÆÏ ÌÑ ÌÇ
ø
a-µí ·Û ø ¡¢ Ö§Á´ µí ·Û ø
a-µí ·Û ø ¡¢ ÆÏ ÌÑ ÌÇ µí ·Û ø
a-µí ·Û ø ¡¢ ÆÏ ÌÑ ÌÇ µí ·Û ø ¡¢ ÆÏ ÌÑ ÌÇ Òì ¹ ø »·×´ ºý ¾« ÆÏ ÌÑ ÌÇ »ù ת ÒÆ Ã¸ ºÍ Ö§Á´ µí ·Û ø ת »¯ ø b-ÆÏ ÌÑ ÌÇ »ù ת ÒÆ Ã¸ ºÍ Òì Âó Ñ¿ ¹Ñ ÌÇ ºÏ ³É ø b-°ë Èé ÌÇ ÜÕ Ã¸
啤酒发酵,奶酪生产。
2.应用于食品成分分析
利用酶的敏感性和专一性测定食品原料和成 品的成分变化。
3.在控制食品产品和原料的贮藏性和品 质方面的应用。
6
6.1.5 酶具有特异性(Specificity)
酶作为催化剂的机制 Emil Fischer提出的“锁和钥匙”模式
钥匙
有益的:皱胃酶、蛋白酶 、乳糖酶 有害的:果胶酶、脂酶
有效地使用和控制内源酶和外源酶。
3
6.1.2 酶的本质
定义(1979年)Dixon、Webb
酶是具有催化性质的蛋白质,其催化性质源 自于它特有的激活能力。
目前
并非所有具有催化能力的生物分子都是蛋白 质。
小分子核糖核酸酶。
4
6.1.3 酶是生物催化剂
16
1、酶促褐变的机制
过氧化物酶催化的酶促褐变
1. 2. 3. 4.
黑色素
黑色素
17
1、酶促褐变的机制
酪氨酸的酶促褐变
18
1、酶促褐变的机制
酪氨酸的酶促褐变
土豆褐变、毛发中黑色素形成机制; 目前发现的唯一一条动植物共有的褐
变途径。
19
1、酶促褐变的机制
绿原酸的酶促褐变
°ë Èé ÌÇ È© Ëá ÆÏ ÌÑ ÌÇ
ø
a-µí ·Û ø ¡¢ Ö§Á´ µí ·Û ø
a-µí ·Û ø ¡¢ ÆÏ ÌÑ ÌÇ µí ·Û ø
a-µí ·Û ø ¡¢ ÆÏ ÌÑ ÌÇ µí ·Û ø ¡¢ ÆÏ ÌÑ ÌÇ Òì ¹ ø »·×´ ºý ¾« ÆÏ ÌÑ ÌÇ »ù ת ÒÆ Ã¸ ºÍ Ö§Á´ µí ·Û ø ת »¯ ø b-ÆÏ ÌÑ ÌÇ »ù ת ÒÆ Ã¸ ºÍ Òì Âó Ñ¿ ¹Ñ ÌÇ ºÏ ³É ø b-°ë Èé ÌÇ ÜÕ Ã¸
第6章 酶化学

3.国际酶学委员会(Enzyme Commision) 根据酶催化反应的类型分类
(1) 、氧化还原酶 (2)、转移酶 (3)、水解酶 (4)、裂解酶 (5)、异构酶 (6)、合成酶
酶的命名与分类
酶的编号
EC 为 Enzyme Commision 酶学委员会缩写
(一)酶的分类
1. 氧化还原酶类:主要是催化氢的转移或电子传递的氧化 还原反应。
系统名:
① 根据酶催化反应的类型分为六大类:分别用1,2,3,4,5, 6编号:
1、氧化还原酶类 2、转移酶类 3、水解酶类 4、裂分酶类 5、异 构酶类 6、合成酶类
② 根据底物的性质和反应键的性质,每一类又可分为若干亚类 及次亚类。仍然用1,2,3,…编号。
③ 在次亚类中编号。
乳酸脱氢酶 EC 1. 1. 1. 27 EC(Enzyme Commision)
的一个裂隙。
酶促反应机理
溶菌酶活性中心
酶促反应机理
(四)研究酶活性中心的方法:
1、通过研究专一性底物判断确定E活性中 心的结构;
2、用化学修饰法共价修饰E分子的一些功 能基团,以查出哪些基团是活性必需的;
3、X-衍射直接探明活性中心。
二、酶原的激活
没有活性的酶的前体称为酶原。酶原转变成有活 性的酶的过程称为酶原的激活。这个过程实质上 是酶活性部位形成和暴露的过程。
酶作用的 专一性
结构专一性
族(基团)专一性 绝对专一性
立体异构专一性
族(基团)专一性:可作用于一类或一些结构很相似
的底物。
O
酯酶:R—C—O—R′ + H2O
RCOO- +R′ OH + H+
CH2OH
(1) 、氧化还原酶 (2)、转移酶 (3)、水解酶 (4)、裂解酶 (5)、异构酶 (6)、合成酶
酶的命名与分类
酶的编号
EC 为 Enzyme Commision 酶学委员会缩写
(一)酶的分类
1. 氧化还原酶类:主要是催化氢的转移或电子传递的氧化 还原反应。
系统名:
① 根据酶催化反应的类型分为六大类:分别用1,2,3,4,5, 6编号:
1、氧化还原酶类 2、转移酶类 3、水解酶类 4、裂分酶类 5、异 构酶类 6、合成酶类
② 根据底物的性质和反应键的性质,每一类又可分为若干亚类 及次亚类。仍然用1,2,3,…编号。
③ 在次亚类中编号。
乳酸脱氢酶 EC 1. 1. 1. 27 EC(Enzyme Commision)
的一个裂隙。
酶促反应机理
溶菌酶活性中心
酶促反应机理
(四)研究酶活性中心的方法:
1、通过研究专一性底物判断确定E活性中 心的结构;
2、用化学修饰法共价修饰E分子的一些功 能基团,以查出哪些基团是活性必需的;
3、X-衍射直接探明活性中心。
二、酶原的激活
没有活性的酶的前体称为酶原。酶原转变成有活 性的酶的过程称为酶原的激活。这个过程实质上 是酶活性部位形成和暴露的过程。
酶作用的 专一性
结构专一性
族(基团)专一性 绝对专一性
立体异构专一性
族(基团)专一性:可作用于一类或一些结构很相似
的底物。
O
酯酶:R—C—O—R′ + H2O
RCOO- +R′ OH + H+
CH2OH
食品化学课件7酶

环境条件
• • • • pH 温度 水分活度 抑制剂
6.2 酶促褐变
褐变现象:水果和蔬菜,如苹果、香蕉、土豆等。当它们的组
织被碰伤、切开、削皮后放置在空气中颜色很快变暗。 酶促褐变 :是在有氧的条件下,酚酶催化酚类物质形成醌及其聚 合物的反应过程。 酶促褐变作用机理:
植物组织中含有酚类物质,当细胞组织被破坏后,氧就大量侵
(2)酸处理法 多数酚酶最适PH=6~7,PH < 3失活。 常用的酸有:柠檬酸、苹果酸、磷酸、抗坏血酸、混合酸。 柠檬酸可降低pH,还可络合酚酶辅基Cu2+,但单独用效果不大。 常与抗坏血酸、亚硫酸合用。 实践证明:0.5%柠檬酸 + 0.3%抗坏血酸效果好。 抗坏血酸还可使酚酶失活,且可耗氧。
钙离子激活中性蛋白酶
两种:CANPⅠ和CANPⅡ
• 都是二聚体 • 含有相同的较小亚基(MW=30,000)和较大的亚 基(MW=80,000,免疫性质不同)。
活性部位中含有半胱氨酸残基的巯基,被归 属于半胱氨酸(巯基)蛋白酶
CANPS的作用
CANP I 完全激活:50~100 µmol/L Ca2+ CANP II 的激活:1~2 mmol/L Ca2+ 肌肉中的活力是很低的 通过分裂特定的肌原纤维蛋白质影响肉的嫩化 同溶菌体蛋白酶协同作用 死后僵直的肌肉缓慢松弛,这样产生的肉具有良好 的质构
3)酶在肉蛋鱼类加工中的应用
肉类嫩化 老龄动物中的胶原蛋白因交联作用呈交链状、 网状,肉粗糙、坚韧,故需进行嫩化处理。主要 用到的酶有木瓜蛋白酶、菠萝蛋白酶和米曲蛋白 酶,可以水解胶原蛋白,使肌肉嫩化。 蛋白酶水解废弃的动物血、杂鱼、鱼刺鱼骨、 碎肉中的蛋白质,提取其中的可溶性蛋白,以供 食用或饲料,以及制取一些功能性多肽和氨基酸。 葡萄糖氧化酶和过氧化氢酶除去禽蛋中的葡 萄糖,消除禽蛋干制时褐变的发生。
《食品生物化学》第六章 酶化学

立体异构专一性
四.诱导契合学说
1.“锁和钥匙学说”
(1)内容: 底物的结构必须与酶活性中心的结构
非常吻合 → 二者紧密结合,形成中间产 物。
1.“锁和钥匙学说” (图6-4左)
底物
酶-底物 酶
(2)缺点:不能解释可逆反应
乳酸脱氢酶
乳酸
丙酮酸
2H
底物 酶
酶-底物 产物
2.诱导契合学说(图6-4右)
1.竞争性抑制作用
抑制剂(I)与酶作用的底物(S)结构 相似,可与底物共同竞争酶的活性中心。
琥珀酸脱氢酶
琥珀酸
延胡索酸
丙二酸
琥珀酸脱氢酶
COOH
CH2 CH2 COOH 琥珀酸
COOH CH2 COOH 丙二酸
抑制剂(I)与酶作用的底物(S)结构相似, 可与底物共同竞争酶的活性中心。
1.竞争性抑制作用
V1
V2
V3
V4
V5
底物浓 底物浓 底物浓 底物浓 底物浓
度很低 度低
度稍髙 度高
度很高
(1)
(2)
制得相对平 滑的曲线
V
(3) ..
.
.
. (4)
(5)
[S]与V之间
的关系曲线
0 1 2 3 4 5 [S]
三.底物浓度对酶促反应的影响
1.底物浓度与酶促反应速率的关系
[S]与V之间 的关系曲线
图6-8
Km值最小的底物称为酶的最适 底物。
蔗糖酶
蔗糖
葡萄糖+果糖
Km=28mmol/L
蔗糖酶的最适 底物是蔗糖
蔗糖酶
棉子糖
葡萄糖+果糖-半乳糖
Km=350mmol/L
(4)Vmax值
四.诱导契合学说
1.“锁和钥匙学说”
(1)内容: 底物的结构必须与酶活性中心的结构
非常吻合 → 二者紧密结合,形成中间产 物。
1.“锁和钥匙学说” (图6-4左)
底物
酶-底物 酶
(2)缺点:不能解释可逆反应
乳酸脱氢酶
乳酸
丙酮酸
2H
底物 酶
酶-底物 产物
2.诱导契合学说(图6-4右)
1.竞争性抑制作用
抑制剂(I)与酶作用的底物(S)结构 相似,可与底物共同竞争酶的活性中心。
琥珀酸脱氢酶
琥珀酸
延胡索酸
丙二酸
琥珀酸脱氢酶
COOH
CH2 CH2 COOH 琥珀酸
COOH CH2 COOH 丙二酸
抑制剂(I)与酶作用的底物(S)结构相似, 可与底物共同竞争酶的活性中心。
1.竞争性抑制作用
V1
V2
V3
V4
V5
底物浓 底物浓 底物浓 底物浓 底物浓
度很低 度低
度稍髙 度高
度很高
(1)
(2)
制得相对平 滑的曲线
V
(3) ..
.
.
. (4)
(5)
[S]与V之间
的关系曲线
0 1 2 3 4 5 [S]
三.底物浓度对酶促反应的影响
1.底物浓度与酶促反应速率的关系
[S]与V之间 的关系曲线
图6-8
Km值最小的底物称为酶的最适 底物。
蔗糖酶
蔗糖
葡萄糖+果糖
Km=28mmol/L
蔗糖酶的最适 底物是蔗糖
蔗糖酶
棉子糖
葡萄糖+果糖-半乳糖
Km=350mmol/L
(4)Vmax值
《食品酶学》课件

添加副标题
食品酶学PPT课件大纲
汇报人:
目录
CONTENTS
01 添加目录标题
02 食品酶学概述
03 酶的分类和性质
04 食品酶的生产和应 用
05 食品酶学的研究进 展
06 食品酶学的发展前
酶的定义和作用
酶是一种生物催化 剂,能够加速生物 化学反应的进行
酶的作用是降低 反应的活化能, 提高反应速率
酶在食品加工中 的作用:提高食 品品质,改善食 品口感,延长食 品保质期
酶在食品加工中 的应用领域:面 包、饼干、糖果、 饮料、乳制品、 肉类、水产品等
酶在食品加工中 的应用实例:淀 粉酶、蛋白酶、 脂肪酶、果胶酶、 纤维素酶等
酶在食品加工中 的应用前景:绿 色环保,提高生 产效率,降低生 产成本,提高产 品质量
度、抑制剂等
温度对酶活性的影响:在 一定范围内,温度升高, 酶活性增强;超过一定范
围,酶活性降低
pH值对酶活性的影响:每 种酶都有其最适pH值,偏 离最适pH值,酶活性降低
底物浓度对酶活性的影响: 底物浓度增加,酶活性增 强;超过一定范围,酶活
性不再增加
酶浓度对酶活性的影响: 在一定范围内,酶浓度增 加,酶活性增强;超过一 定范围,酶活性不再增加
感谢您的耐心观看
汇报人:
酶在食品保鲜中的作用
酶在食品保鲜中的作用:酶可以分解食品中的有害物质,提高食品的保鲜效果
酶在食品保鲜中的应用:酶可以应用于食品的保鲜、防腐、抗氧化等方面
酶在食品保鲜中的优势:酶具有高效、安全、环保等优点,可以替代传统的化学保鲜 剂
酶在食品保鲜中的挑战:酶的稳定性、活性、成本等问题需要进一步研究和解决
抑制剂对酶活性的影响: 抑制剂可以降低酶活性,
食品酶学PPT课件大纲
汇报人:
目录
CONTENTS
01 添加目录标题
02 食品酶学概述
03 酶的分类和性质
04 食品酶的生产和应 用
05 食品酶学的研究进 展
06 食品酶学的发展前
酶的定义和作用
酶是一种生物催化 剂,能够加速生物 化学反应的进行
酶的作用是降低 反应的活化能, 提高反应速率
酶在食品加工中 的作用:提高食 品品质,改善食 品口感,延长食 品保质期
酶在食品加工中 的应用领域:面 包、饼干、糖果、 饮料、乳制品、 肉类、水产品等
酶在食品加工中 的应用实例:淀 粉酶、蛋白酶、 脂肪酶、果胶酶、 纤维素酶等
酶在食品加工中 的应用前景:绿 色环保,提高生 产效率,降低生 产成本,提高产 品质量
度、抑制剂等
温度对酶活性的影响:在 一定范围内,温度升高, 酶活性增强;超过一定范
围,酶活性降低
pH值对酶活性的影响:每 种酶都有其最适pH值,偏 离最适pH值,酶活性降低
底物浓度对酶活性的影响: 底物浓度增加,酶活性增 强;超过一定范围,酶活
性不再增加
酶浓度对酶活性的影响: 在一定范围内,酶浓度增 加,酶活性增强;超过一 定范围,酶活性不再增加
感谢您的耐心观看
汇报人:
酶在食品保鲜中的作用
酶在食品保鲜中的作用:酶可以分解食品中的有害物质,提高食品的保鲜效果
酶在食品保鲜中的应用:酶可以应用于食品的保鲜、防腐、抗氧化等方面
酶在食品保鲜中的优势:酶具有高效、安全、环保等优点,可以替代传统的化学保鲜 剂
酶在食品保鲜中的挑战:酶的稳定性、活性、成本等问题需要进一步研究和解决
抑制剂对酶活性的影响: 抑制剂可以降低酶活性,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(如氧化还原酶等)
胞外酶----由细胞产生后分泌到细胞外起作用的酶。
如水解酶类
三、酶的本质
(一)酶的化学本质
绝大部分酶是由生物细胞产生的, 具有催化活性和高度专一性的特殊蛋白 质。因此,酶的化学本质是蛋白质。
具有催化功能的核酸是特例。
这种具有催化活性的RNA命名为核酶、核糖酶 或酶性RNA等
(二)酶的催化作用与活化能
基、金属离子)。
➢ 酶蛋白----与底物结合,决定反应的专一性和高效率。 ➢ 辅助因子----直接对电子、原子或某些化学基团起传递
作用,决定反应的类型。
第二节 影响活力的因素
一、底物浓度对反应速度的影响
反应级数
1. 当底物浓度较低时,v与[S] 成正比,为一级反应, 即v = k[S];
2. 当底物浓度继续增加时,反应速度不再与底物浓度成正 比而升高,为混合级反应;
酶反应初速度与酶浓度关系
反应初速度 v
80 70 60 50 40 30 20 10
0 0
10 20 30 40 50 60 70
酶浓度[E]
三、温度对反应速度的影响
• 一般来说,酶促反应速度随温度的增高 而加快。但当温度增加达到某一点后, 由于酶蛋白的热变性作用,反应速度迅 速下降,直到完全失活。
四、酶的命名
1. 习惯命名法——推荐名称 2. 系统命名法——系统名称
(一)习惯命名法
1.根据被作用的底物命名; 2.根据催化反应的性质命名; 3.将酶的作用底物和催化反应的性质结合 起来命名; 4.将酶的来源与作用底物结合起来命名;
(二)系统命名法
酶的系统命名由两部分组成:
➢ 酶所作用的底物的名称 ➢ 酶所催化的反应的类型
3. 当底物浓度很高时,v逐渐趋近极限值Vmax ,为零级反 应
底物浓度对酶促反应速度的影响是非线性的。 中间产物学说解释v---[S]关系曲线:
E + S ES E + P;
底物对酶促反应的饱和现象:
(二)米氏方程式: Michaelis & Menten 于1913年推导出了上述 矩形双曲线的数学表达式,即著名的米氏方程。
加速反应的本质--降低活化能
活化能: 活泼态与常态之间的能量差,即使反应物由常态变成
活化态所需要的能量。
使反应达到其能阈的两个途径:
➢ 为反应物分子提供所需的活化能(外加能量) ➢ 降低反应的活化能,使本来不具活化水平的分子成
为活化分子。
酶促反应的活化能
(三)酶与底物形成中间络合物的方式(理论)
(二)抑制作用的机制
1. 与酶结合成稳定的络合物,减低或破坏酶的活力。 2.破坏酶或辅基活性基团或改变活性部位的构象; 3.抑制剂与酶的激活剂结合; 4.夺取酶与底物结合的机会,从而降低[ES];
四、pH对反应速度的影响
• 观察pH对酶促反应速度 的影响,通常为一“钟形” 曲线,即pH过高或过低 均可导致酶催化活性的下 降。
• 酶催化活性最高时溶液的 pH 值 就 称 为 酶 的 最 适 pH(optimum pH)。
人体内大多数酶的最适pH在6.5~8.0之 间
pH值影响酶活性的机制
1.环境过酸、过碱能使酶变性失活—pH值 影响酶的稳定性
2.pH值影响酶分子活性部位上有关基团的 解离
pH改变酶活性部位上有关基团的解离状态; pH值改变影响中间产物ES的形成或进一步分解; pH影响了维持酶分子空间结构的有关基团的解离;
3.pH值能影响底物的解离;
五. 抑制剂对反应速度的影响
(一)抑制作用的概念 1.失活作用:
(1) 锁钥假说
(lock and key hypothesis) 整个酶分子的天然构象是具有刚性
结构的,酶表面具有特定的 形状。酶与底物的结合如同 一把钥匙对一把锁一样。
(2) 诱导契合假说
(induced–fit hypothesis): 酶表面并没有一种与底物互补的固
定形状,而只是由于底物的 诱导才形成了互补形状.
由于酶蛋白变性而引起酶活力丧失的作用。
2.抑制作用:
使酶活性部位的结构和性质改变,从而酶活力下降或 丧失,酶蛋白一般并未变性。 抑制剂:能引起酶抑制作用的物质,用I表示; 抑制剂对酶有一定的选择性;
3.抑制剂的种类
氰化物、重金属离子、一氧化碳、硫化氢、 生物碱、砷化物、麻醉剂、表面活性剂及 磺胺类药物
Vmax • [S] υ=
Km + [S]
二. 酶浓度对反应速度的影响
• 根据中间产物学说,酶反应式为: E + S ES P + E
酶反应速度用产物P的生成速度表示,产物 的生成与中间产物ES的浓度成正比,当底物 量足够时,ES的量就与酶的浓度成正比,因 此,酶促反应初速度与酶浓度的关系呈正比关 系。
第六章 酶
Chapter 6 Enzyme
第一节 引言
一、酶对食品科学的重要性
米饭为啥越嚼越甜? 当人的胆囊被切除后,为什么就要少吃肥肉? 消化不良的人为啥要多吃多酶片?
二、酶的来源与分布
酶是由生物细胞产生的,然后按照需要分布在细胞 内和细胞外。根据酶的活动部位,一般把酶分成:
胞内酶----由细胞产生并在细胞内部起作用的酶。
EC•1•1•1•27乳酸脱氢酶:
表示该酶为氧化还原酶类,底物上发生氧化的供 体基团是醇基(亚类),氢的受体是NAD(次亚 类),流水编号为27。
五、酶的辅助因子
全酶 = 酶蛋白 + 辅助因子
酶蛋白----不能单独表现催化活性的蛋白质部分。 辅助因子----结合酶中的非蛋白质部分(包括辅酶、辅
例如:L-乳酸:NAD+氧化还原酶 乳酸 + NAD+ 丙酮酸 + NADH + H&•1•1
EC----表示国际酶学委员会
第一个数字表示酶所属的大类(1-6大类) 第二个数字表示酶在该大类中所属的亚类 第三个数字表示酶所属的次亚类 第四个数字表示酶在所属次亚类中的流水编号
• 酶促反应速度随温度升高而达到一最大 值时的温度就称为酶的最适温度 (optimum tempe-rature)。
(一)温度对酶反应影响的原因
1. 温度加速酶反应—影响中间产物的形成与分解 温度影响反应体系的能量水平、酶和底物分子的运动
及其反应基团的解离状态,从而影响ES的形成与 分解,随温度升高,反应速度加快。 2. 温度降低反应—影响酶的稳定性 随温度升高,酶分子稳定性下降,酶蛋白变性,活性 中心被破坏,酶失去活性,酶促反应速度降低。
胞外酶----由细胞产生后分泌到细胞外起作用的酶。
如水解酶类
三、酶的本质
(一)酶的化学本质
绝大部分酶是由生物细胞产生的, 具有催化活性和高度专一性的特殊蛋白 质。因此,酶的化学本质是蛋白质。
具有催化功能的核酸是特例。
这种具有催化活性的RNA命名为核酶、核糖酶 或酶性RNA等
(二)酶的催化作用与活化能
基、金属离子)。
➢ 酶蛋白----与底物结合,决定反应的专一性和高效率。 ➢ 辅助因子----直接对电子、原子或某些化学基团起传递
作用,决定反应的类型。
第二节 影响活力的因素
一、底物浓度对反应速度的影响
反应级数
1. 当底物浓度较低时,v与[S] 成正比,为一级反应, 即v = k[S];
2. 当底物浓度继续增加时,反应速度不再与底物浓度成正 比而升高,为混合级反应;
酶反应初速度与酶浓度关系
反应初速度 v
80 70 60 50 40 30 20 10
0 0
10 20 30 40 50 60 70
酶浓度[E]
三、温度对反应速度的影响
• 一般来说,酶促反应速度随温度的增高 而加快。但当温度增加达到某一点后, 由于酶蛋白的热变性作用,反应速度迅 速下降,直到完全失活。
四、酶的命名
1. 习惯命名法——推荐名称 2. 系统命名法——系统名称
(一)习惯命名法
1.根据被作用的底物命名; 2.根据催化反应的性质命名; 3.将酶的作用底物和催化反应的性质结合 起来命名; 4.将酶的来源与作用底物结合起来命名;
(二)系统命名法
酶的系统命名由两部分组成:
➢ 酶所作用的底物的名称 ➢ 酶所催化的反应的类型
3. 当底物浓度很高时,v逐渐趋近极限值Vmax ,为零级反 应
底物浓度对酶促反应速度的影响是非线性的。 中间产物学说解释v---[S]关系曲线:
E + S ES E + P;
底物对酶促反应的饱和现象:
(二)米氏方程式: Michaelis & Menten 于1913年推导出了上述 矩形双曲线的数学表达式,即著名的米氏方程。
加速反应的本质--降低活化能
活化能: 活泼态与常态之间的能量差,即使反应物由常态变成
活化态所需要的能量。
使反应达到其能阈的两个途径:
➢ 为反应物分子提供所需的活化能(外加能量) ➢ 降低反应的活化能,使本来不具活化水平的分子成
为活化分子。
酶促反应的活化能
(三)酶与底物形成中间络合物的方式(理论)
(二)抑制作用的机制
1. 与酶结合成稳定的络合物,减低或破坏酶的活力。 2.破坏酶或辅基活性基团或改变活性部位的构象; 3.抑制剂与酶的激活剂结合; 4.夺取酶与底物结合的机会,从而降低[ES];
四、pH对反应速度的影响
• 观察pH对酶促反应速度 的影响,通常为一“钟形” 曲线,即pH过高或过低 均可导致酶催化活性的下 降。
• 酶催化活性最高时溶液的 pH 值 就 称 为 酶 的 最 适 pH(optimum pH)。
人体内大多数酶的最适pH在6.5~8.0之 间
pH值影响酶活性的机制
1.环境过酸、过碱能使酶变性失活—pH值 影响酶的稳定性
2.pH值影响酶分子活性部位上有关基团的 解离
pH改变酶活性部位上有关基团的解离状态; pH值改变影响中间产物ES的形成或进一步分解; pH影响了维持酶分子空间结构的有关基团的解离;
3.pH值能影响底物的解离;
五. 抑制剂对反应速度的影响
(一)抑制作用的概念 1.失活作用:
(1) 锁钥假说
(lock and key hypothesis) 整个酶分子的天然构象是具有刚性
结构的,酶表面具有特定的 形状。酶与底物的结合如同 一把钥匙对一把锁一样。
(2) 诱导契合假说
(induced–fit hypothesis): 酶表面并没有一种与底物互补的固
定形状,而只是由于底物的 诱导才形成了互补形状.
由于酶蛋白变性而引起酶活力丧失的作用。
2.抑制作用:
使酶活性部位的结构和性质改变,从而酶活力下降或 丧失,酶蛋白一般并未变性。 抑制剂:能引起酶抑制作用的物质,用I表示; 抑制剂对酶有一定的选择性;
3.抑制剂的种类
氰化物、重金属离子、一氧化碳、硫化氢、 生物碱、砷化物、麻醉剂、表面活性剂及 磺胺类药物
Vmax • [S] υ=
Km + [S]
二. 酶浓度对反应速度的影响
• 根据中间产物学说,酶反应式为: E + S ES P + E
酶反应速度用产物P的生成速度表示,产物 的生成与中间产物ES的浓度成正比,当底物 量足够时,ES的量就与酶的浓度成正比,因 此,酶促反应初速度与酶浓度的关系呈正比关 系。
第六章 酶
Chapter 6 Enzyme
第一节 引言
一、酶对食品科学的重要性
米饭为啥越嚼越甜? 当人的胆囊被切除后,为什么就要少吃肥肉? 消化不良的人为啥要多吃多酶片?
二、酶的来源与分布
酶是由生物细胞产生的,然后按照需要分布在细胞 内和细胞外。根据酶的活动部位,一般把酶分成:
胞内酶----由细胞产生并在细胞内部起作用的酶。
EC•1•1•1•27乳酸脱氢酶:
表示该酶为氧化还原酶类,底物上发生氧化的供 体基团是醇基(亚类),氢的受体是NAD(次亚 类),流水编号为27。
五、酶的辅助因子
全酶 = 酶蛋白 + 辅助因子
酶蛋白----不能单独表现催化活性的蛋白质部分。 辅助因子----结合酶中的非蛋白质部分(包括辅酶、辅
例如:L-乳酸:NAD+氧化还原酶 乳酸 + NAD+ 丙酮酸 + NADH + H&•1•1
EC----表示国际酶学委员会
第一个数字表示酶所属的大类(1-6大类) 第二个数字表示酶在该大类中所属的亚类 第三个数字表示酶所属的次亚类 第四个数字表示酶在所属次亚类中的流水编号
• 酶促反应速度随温度升高而达到一最大 值时的温度就称为酶的最适温度 (optimum tempe-rature)。
(一)温度对酶反应影响的原因
1. 温度加速酶反应—影响中间产物的形成与分解 温度影响反应体系的能量水平、酶和底物分子的运动
及其反应基团的解离状态,从而影响ES的形成与 分解,随温度升高,反应速度加快。 2. 温度降低反应—影响酶的稳定性 随温度升高,酶分子稳定性下降,酶蛋白变性,活性 中心被破坏,酶失去活性,酶促反应速度降低。
