酯酶同工酶电泳技术
水稻种子酯酶同工酶电泳法操作技巧

水稻种子酯酶同工酶电泳法操作技巧摘要电泳测定品种纯度主要利用电泳技术对品种的同工酶及蛋白质的组分进行分析,找出品种间差异的生化和分子指标,以此区分不同品种。
利用该法测定水稻种子纯度具有省时快速、成本低廉、方法简单易行、能在不同实验室重演,避免了因品种纯度问题而造成的损失,对企业生产和销售具有重要的参考意义。
关键词水稻种子;酯酶电泳法;操作技巧加强对特优组合种子纯度的鉴定,提高种子质量,发挥其增产优势,对农民增产增收具有十分重要的意义。
尤其是20 世纪70 年代杂交水稻的大面积推广,为中国粮食做出了重大贡献。
中国人多地少,加之近年来我国人口数量急剧增加,而耕地面积却日益减少,人地矛盾愈显突出。
因此,进一步发展杂交水稻,充分发挥杂交稻的高产优势,对解决我国粮食问题具有十分重要的意义。
与常规稻不同,杂交稻是由不育系和恢复系配制而成的,种子纯度是衡量杂交稻种子质量的主要指标,因此加强对杂交稻种子纯度的鉴定,是良种生产的关键。
1溶液配制1.1配制要求所用药品最好为分析纯,并且未变质失效;所有玻璃容器应洁净;称量应准确无误,不能漏称和错称药品;所配溶液应放在冰箱保存,过硫酸铵不超过2周;在配制过程中,如有不溶物需过滤,贴好标签。
1.2分离胶配制分离胶(A∶B∶C∶D = 1∶2∶1∶4)。
A:36.6g三羟甲基氨基甲烷+ 0.46g四甲基乙二胺(TENED)+ 48mL盐酸(1moL/L),稀释至100mL;B:28g丙烯酰胺(Acr)+ 0.735g甲叉丙烯酰胺(Bis),稀释至100mL;C:蒸馏水;D:0.4g过硫酸铵+10mL蒸馏水。
配制分离胶缓冲液时要戴一次性手套,因丙烯酰胺具有致癌性和对生殖、神经系统有损伤作用,凝胶后毒性消失。
灌入分离胶后需在上层加蒸馏水,目的是隔离空气中的氧并能消除液柱表面的弯月面,使凝胶表面平坦,加入水层后静置,使之进行聚合反应。
温度控制在20℃以下,20~40min内完成聚合,纠正聚合过快或过慢的最容易方法是改变聚合催化剂浓度。
同工酶检测方法

同工酶检测方法
同工酶检测方法是一种用于确定酶活性和酶的存在性的常用实验技术。
同工酶是指具有相似化学结构但在酶活性和功能上有差异的酶。
通过检测同工酶的存在和活性,我们可以了解酶的功能差异和其在生物体内的重要作用。
同工酶检测方法主要包括以下几种:
1. 凝胶电泳法:这是最常用的同工酶检测方法之一。
通过将样品中的酶进行凝胶电泳分离,然后在凝胶上加入适当的底物和染色剂,可以观察到酶的活性带和相应的颜色变化。
根据活性带的位置和颜色变化,可以确定酶的存在和活性差异。
2. 免疫学方法:同工酶也可以通过免疫学方法进行检测。
这种方法利用特异性抗体与酶结合,形成免疫复合物,然后通过染色或荧光标记的抗体检测酶的存在和活性。
这种方法具有高灵敏度和高特异性,适用于复杂样品的检测。
3. 分子生物学方法:随着分子生物学技术的发展,同工酶的检测也可以通过PCR、测序和基因表达等方法进行。
这些方法可以直接检测目标酶基因的序列差异或转录水平的变化,从而确定不同同工酶的存在和表达差异。
除了以上常用的方法外,还有一些新兴的技术被应用于同工酶的检测,例如质谱分析、表面等离子共振和生物传感器等。
这些方法具有高灵敏度和高通量的特点,可以快速、准确地检测同工酶的存在和活性。
总之,同工酶检测方法在生物学研究和临床诊断中起着重要的作用。
不同的方法可以根据研究目的和样品类型选择使用,从而更好地了解同工酶的功能和生物学意义。
同工酶电泳结果

同工酶电泳结果同工酶电泳是一种常用于生物学研究中的分析技术,它通过检测特定酶在不同个体间的差异来研究其遗传变异。
这种技术基于同工酶的概念,即在不同个体中存在着同一种酶的多个等电酶形式。
通过对这些等电酶进行电泳分离,可以在凝胶上观察到一系列的酶带,每个带代表着一种等电酶形式。
这些酶带的数量和迁移距离的差异可以反映出个体间的差异,从而提供了研究遗传变异的一种方法。
同工酶电泳的原理是利用凝胶电泳的原理和酶的特性,通过变化凝胶的条件来实现对同工酶的分离。
凝胶电泳是一种根据带电粒子在电场中的迁移速率来分离它们的方法。
在同工酶电泳中,选择合适的凝胶类型和电泳条件,可以使得不同的等电酶形式在凝胶上产生清晰的分离带,从而可以对它们进行检测和分析。
常用的凝胶类型包括聚丙烯酰胺凝胶和琼脂糖凝胶。
聚丙烯酰胺凝胶主要用于分离较小分子量的酶,而琼脂糖凝胶则适合分离较大分子量的酶。
选择凝胶类型时,需要考虑待测酶的特性和分离要求。
在电泳过程中,凝胶中的带电粒子会在电场作用下迁移,迁移速率与其带电量和分子量有关。
酶的带电量和分子量不同,因此它们会在凝胶上形成不同的迁移带。
为了实现对同工酶的分离,电泳过程需要进行一系列的优化。
首先是凝胶的制备,凝胶的浓度和pH值需要根据待测酶的特性进行调整。
然后是样品的制备,样品通常需要进行蛋白质提取和酶活性检测,以确定最佳的应用浓度。
接下来是电泳条件的选择,包括电场强度和电泳时间等。
这些条件的选择和优化都是根据待测酶的特性和分离要求进行的。
在同工酶电泳的实际操作中,通常先将样品和载体混合,然后通过注射或浸泡的方式将混合物加入凝胶槽中,接着在恒定的电场下进行电泳。
电泳结束后,凝胶需要经过染色和显影的步骤,以观察和分析酶带的特征。
通过同工酶电泳,我们可以得到一系列的酶带图谱。
每个酶带代表着一种等电酶形式,其迁移距离越远代表其分子量越大。
通过对不同个体的酶带图谱进行比较和分析,可以发现个体间的差异和遗传变异。
同工酶凝胶电泳

*表的行数根据情况可以调整。
@写出检测同工酶的原理。
一级带
带型绘制方法 二级带 三级带 四级带 一级带
二级带
三级带 四级带
同台两组共用一电泳槽。 注入两玻璃夹缝中,胶面上加1cm蒸馏水(自 然凝胶后倾出)。
本次实验涉及: 酯酶(Est): 催化酯类化合物水解的酶系. 催化乳酸脱氢反应的酶.
乳酸脱氢酶(LDH):
过氧化物酶(PO):催化过氧化物水解 应用: 1) 遗传育种 2)基因定位 ……
同工酶分析的过程
材料的采集 低温研磨、酶提取 凝胶制备 酶的保存
专一底物和特殊染料染色进行分析。
为节省时间,先做:架好胶板
电泳原理介绍 教师分头指导操作
配制分离胶(7.5%)(两组的量):
双蒸水/mL 1.5mol/LTris· HCl(pH8.8)/mL Acr/Bis(30%)/mL TEMED/μL 10%Aps/μL 总体积/mL
9 mL 5 mL 5 mL 20 μL 100 μL 20 mL
染色约20分钟。
PO染液[第3桌配,60mL]
联苯胺 冰乙酸
1.0 g 9.0 mL
溶,可研磨
水
A液
36 mL
5.4 mL 0.6mL
A液
30% H2O2 水 54mL
混合成为染色液
染色5~10分钟,水洗停止反应。
五、方法步骤(合理分工、协调时间)
1. 提取酶液
每份材料(普通果蝇40只、大果蝇10只、或其他材料0.2g)
活性电泳
催化底物水解,染料复合显色酶谱的记录与分析带的位置,酶分子量差异、带的颜色深浅(反映酶的活性)
LDH染色原理
乳酸 LDH 丙酮酸 NADH NAD+ NBT(黄) PMS(氢递体) NBTH(蓝紫)
植物同工酶凝胶电泳实验

植物同工酶凝胶电泳实验一、实验目的和意义同功酶专指受遗传体系决定的酶的不同分子形式。
从作用上看,分子形式不同的酶能做一样的工作,即催化同样的生化反应,所以把同功酶改称为同工酶。
由于蛋白质分子的结构归根结底是由基因的DNA分子结构决定的,因此,同工酶就成为鉴定生物基因型是否有差别的可靠指标,在遗传育种,生长发育,物种起源,生理卫生等领域的研究中成为一种重要的工具;此外,同工酶还与植物抗性有一定联系,可用来鉴定抗性的强弱。
本实验的实验目的主要是让学生掌握聚丙烯酰胺凝胶电泳分析植物同工酶的原理及方法、步骤。
提高学生的实际操作及动手能力。
培养学生对实验结果的分析能力。
二、实验原理带电粒子在电场中向带有相反电荷的电极移动,叫做电泳。
在一定的pH条件下,每一种分子都具有一定的电荷、大小与形状,在相同的电场经一定时间的电泳,便会集中到特定的位置上而形成紧密的泳动带。
不同组分的蛋白质(包括同工酶)分子组成、结构、大小、形状均有所不同,在溶液中所带的电荷多寡不同,在电场中的运动速度也不同。
因此经过电泳便会分成不同的区带。
然后用适当的染料着色,这样就可以在凝胶上展现出蛋白质或同工酶的谱带。
聚丙烯酰胺凝胶电泳(PAGE)是以聚丙烯酰胺凝胶作支持介质的一种电泳方法。
它是由丙烯酰胺单体(Acr)和交联剂甲叉双丙烯酰胺(Bis)在催化剂的作用下,聚合交联而成的三维网状结构凝胶。
当Acr 和Bis遇到自由基时,便能聚合。
Acr和Bis的浓度、交联度可以决定凝胶的密度、粘度、弹性、机械强度以及孔径大小。
三、材料新旧小麦种子、锦带花上下枝叶片四、实验器材与试剂1.器材:电泳仪一套(稳压电源,垂直电泳槽和凹槽玻璃);台式高速离心机;烧杯;微量进样器;注射器;皮头滴管;刻度吸;培养皿(染色用)。
2.试剂:丙烯酰胺(Arc);甲叉丙烯酰胺(Bis);四甲基乙二胺(TEMED);过硫酸铵(AP);三羟甲基氨基甲烷(Tris);甘氨酸(Gly);琼脂粉;溴酚蓝;甘油;联苯胺;醋酸;α-醋酸萘酯;β-醋酸萘酯;牢蓝RR盐;冰醋酸。
实验十 同工酶分析

实验四同工酶分析同工酶概述酶是以蛋白质为主要成分的生物催化剂。
在生物体内,有一些酶催化相同的反应,但其结构不同。
它们对底物的浓度、pH、温度等的最适要求不同,酶活力的调控反应及其所在的细胞分布也不一样。
把催化相同反应而结构和理化性质不同的酶的分子类型称为同工酶(isozyme)。
同工酶概念的提出,揭示了不同生物、同一生物不同器官和不同组织起源的酶可作用于同一底物,催化相同的反应,但在其他性质方面可以不尽相同。
大量研究表明,同工酶在生物界是广泛存在的。
在动植物和微生物体中、同一物种的不同个体、同一个体的不同器官、组织和细胞、同一细胞的不同部位、生长发育的不同阶段、不同的代谢条件下,都有不同的同工酶分布。
现在已发现的酶中,有一半以上的酶已经发现有同工酶存在。
可以进行同工酶分析的酶已有100多种。
不同同工酶可以根据电泳迁移率予以区别和编号,以向阳极方向泳动最快的编为同工酶1。
从分子结构上看,同工酶的形成有以下学说或原因:(一)亚单位结构学说亚单位结构学说是研究同工酶理论并对作用机理阐述的较为透彻的学说之一。
该学说认为同工酶是由不同亚基按不同方式结合而成的。
这个学说有广泛的实验证据。
如已经证明乳酸脱氢酶(LDH)是由A、B两个亚基,按不同比例结合成的四聚体,所以有5种同工酶:LDH1(A4)、LDH2(A3B1)、LDH3(A2B2)、LDH4(A1B3)、LDH5(B4)。
(二)不同基因编码由不同的基因或等位基因编码会形成一级结构完全不同或有个别氨基酸残基不同的多肽链。
因而产生同工酶。
由不同基因引起的同工酶存在于同一物种的所有个体中,而由等位基因引起的同工酶以一定比率存在于同一族中。
(三)单一亚单位聚合程度不同有些同工酶的亚单位是完全相同的,如胆碱脂酶(ChE),但不同的酶分子中,亚基数目不同,这就形成分子量不同的5种同工酶。
经研究发现,目前发现的100多种同工酶,其组成比例不同,但以单体(26%)、二聚体(52%)、四聚体(20%)较多,三聚体极少。
酯酶同工酶电泳技术
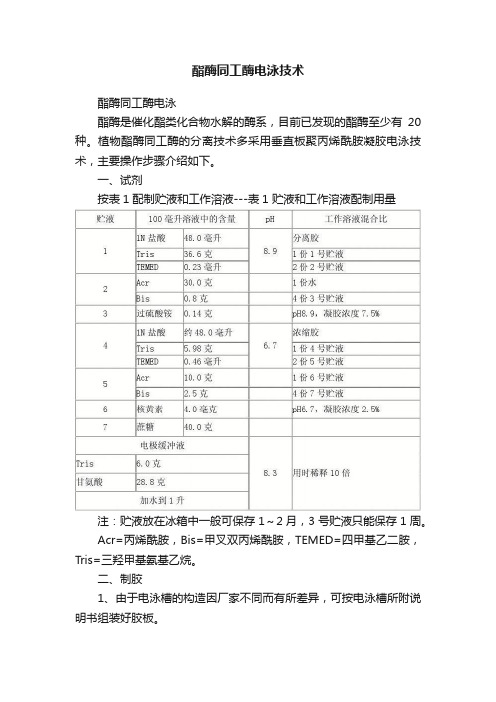
酯酶同工酶电泳技术酯酶同工酶电泳酯酶是催化酯类化合物水解的酶系,目前已发现的酯酶至少有20种。
植物酯酶同工酶的分离技术多采用垂直板聚丙烯酰胺凝胶电泳技术,主要操作步骤介绍如下。
一、试剂按表1配制贮液和工作溶液---表1 贮液和工作溶液配制用量注:贮液放在冰箱中一般可保存1~2月,3号贮液只能保存1周。
Acr=丙烯酰胺,Bis=甲叉双丙烯酰胺,TEMED=四甲基乙二胺,Tris=三羟甲基氨基乙烷。
二、制胶1、由于电泳槽的构造因厂家不同而有所差异,可按电泳槽所附说明书组装好胶板。
2、按上表配制好分离胶工作液,快速混匀,立即用带长针头的注射器吸取一定量的胶液,沿着玻璃板壁加入胶板间,至板顶3cm即可;然后沿着玻璃板壁缓慢加入3~5mm蒸馏水层。
刚加水时看出有界面,后逐渐消失;等到再看到界面时表明凝胶已经聚合(一般约30分钟);再静置30分钟使聚合完全。
3、用注射器吸去分离胶上的水层,用滤纸条吸去残留的水液。
按上表配制好浓缩胶工作液,快速混匀,立即用带长针头的注射器吸取一定量的胶液,沿着玻璃板壁加入胶板间以冲洗分离胶的顶部。
迅速吸出,立即灌注浓缩胶,当灌至凹型玻璃口3mm处停灌,立即插入样品梳,使凝胶液面高出玻璃1~2mm。
然后在距日光灯管10cm处照射进行光聚合。
当看到浓缩胶显乳白色(一般6~7分钟),表明聚合开始。
继续半小时,使聚合完全。
三、电泳1、样品提取取烟苗0.2克,加0.5毫升提取缓冲液(含0.075M Tris-HCl,pH7.5,0.01M KCl,0.01M MgCl,0.001EDTA,5%蔗糖,0.1%巯基乙醇,5%PVP-2聚乙烯基吡咯烷酮),冰块上研磨成匀浆,低温下12000rpm离心15分钟,取上清液置于冰箱中备用。
提取缓冲液种类较多,这里介绍的提取缓冲液本实验室曾采用过,可据需要参看其他提取方法。
2、点样拔出样品梳,吸取样品槽中的水分。
用微量移液器加入适量样品液(一般50微升左右)。
酯酶同工酶

酯酶同工酶的醋酸萘酯-铁氰化钾染色法的研究摘要:酯酶可将@-醋酸萘酯和ß-醋酸萘酯水解生成醋酸和萘酚,利用萘酚能与铁氰化钾反应生成有色物质萘醌的性质可对电泳凝胶上的酯酶同工酶进行染色。
关键词:酯酶同工酶;醋酸萘酯;铁氰化钾;染色法经典的酯酶同工酶的染色方法的原理是,酯酶催化醋酸萘酯水解产生萘酚,而萘酚可与坚牢蓝反应生成蓝紫色物质,因而在电泳后的凝胶上含有酯酶同工酶的地方可以染出蓝紫色的酶带。
经过摸索,本文介绍一种新的酯酶同工酶的染色方法———醋酸萘酯N 铁氰化钾染色法,其原理是酯酶催化醋酸萘酯水解产生萘酚,而萘酚可被铁氰化钾氧化成萘醌,因而在电泳后的凝胶上含有酯酶同工酶的地方可以染出酶带。
一 材料与方法1.1实验材料以新鲜的肉鸡肝脏为材料。
1.2试剂Acr 为广东省汕头化学试剂厂产品,Bis 、坚牢蓝RR 盐为上海化学试剂公司产品,TEMED 为上海前进试剂厂产品,溴酚蓝为上海试剂三厂产品,@-醋酸萘酯为上海青浦合成试剂厂产品,ß-醋酸萘酯为上海试剂一厂产品, Tris,HCL,NaCL,2Na HP 4o ,磷酸二氢钠,三氯醋酸,乙醇,甘油,丙酮,丙酮、铁氰化钾、过硫酸铵等均为国产分析纯。
1.3仪器设备研钵、电泳仪与电泳槽、冰箱、离心机、微量加样器、恒温水浴锅、染色盒、67$紫外光栅分光光度计等。
1.4实验方法(1)样品制备:取一定量的新鲜鸡肝,按一定比例加入8*9:1的磷酸缓冲液后进行研磨,经4000r/min,15min 离心后取上清液,置于1?冰箱中保存备用。
(2)酯酶活力的测定:参照禹邦超等人的方法进行。
(3)聚丙烯酰胺凝胶电泳:参照赵永芳的方法进行。
(4)酯酶同工酶的染色方法有:经典法:(即醋酸萘酯-固蓝RR 盐染色法)染色液:称取ß-醋酸萘酯与@-醋酸萘酯、坚牢蓝RR 各200mg ,分别用10mL 丙酮溶解后,混合,再用磷酸缓冲液定容至200mL 。
不同品系果蝇酯酶同工酶的分析

不同品系果蝇酯酶同工酶的分析内蒙古师范大学毕业论文不同品系果蝇酯酶同工酶的分析生命科学与技术学院2001生物技术班柴锦彪指导教师耿星河摘要: 本文将用聚丙烯酰胺凝胶电泳的方法来分析黑体果蝇和黑檀体果蝇以及残翅果蝇的酯酶同工酶~通过酶谱分析发现黑体果蝇和黑檀体果蝇的酯酶同工酶在条带数目~分区以及强弱程度上都有很大的相同之处~通过对其迁移率和分子量以及各酶的含量的比较发现它们在迁移率和分子量上有一定的差别~特别是在各酶带的含量上相差特别大。
至于残翅与前两种不仅表现在迁移率和分子量以及酶的含量上有不同~更重要的是它的酶的条带数以及分区也与前两种有明显的不同。
关键词:果蝇,同工酶,电泳迁,移率1 概念及意义1895年Fisher提出了同工酶的概念,是指生物体内一些结构不同但催化作[1]用相同的酶称之为同工酶。
分析同一物种不同品种之间的同工酶电泳谱带可以从分子水平上得知它们的关系。
因为同工酶的遗传学基础是通过DNA转录为RNA再翻译成酶蛋白,这就是说组成酶蛋白的多肽链中的氨基酸的种类和顺序是由多[2]个核苷酸决定的。
因此,使用同工酶资料的最根本依据是酶在电场里移动性的改变反映了编码DNA顺序上的改变。
所以通过分析果蝇同工酶的电泳谱带可以从分子水平上得知不同品系果蝇间的差别。
2 电泳技术的发展及原理2.1 电泳技术的发展同工酶的分离技术有:电泳法,酶学法和免疫学法,其中以电泳法应用的最为广泛。
Tiselius(1937)第一次应用电泳技术区分在电流作用下迁移的血清蛋白。
在以后的几十年里,电泳技术有了很大的改进,它包括现在广泛应用的凝胶1 柴锦彪 11/2/2010内蒙古师范大学毕业论文电泳的发展及组织化学染色方法的应用,使得可以对酶蛋白进行电泳变异的研究。
当前电泳的种类因支持物的不同可分为纸电泳和凝胶电泳。
分离同工酶技术主要用凝胶电泳。
常用的凝胶有:淀粉凝胶;醋酸纤维薄膜和聚丙烯酰胺凝胶,其中聚丙烯酰胺凝胶具有电渗作用小,不易与样品相互作用,需要样品量少,凝胶具有一定的弹性且易于保存,对热稳定,无色透明,纯度大等优点而被广泛应[3]用。
酯酶同工酶的一种新染色法的初步研究

文章编号:1000-2286(2002)03-0380-03酯酶同工酶的一种新染色法的初步研究赵赣1,钱芳2,曹永长3江典峰13,陈国栋13,李明珠133,李晓渝133 (1.华南农业大学生命科学院,广东广州510642; 2.广州卫生学校基础部,广东广州510180; 3.华南农业大学动物科学系,广东广州510642)摘要:酯酶可将α-醋酸萘酯和β-醋酸萘酯水解生成醋酸和萘酚,利用KMnO 4可与萘酚反应生成有色物质的性质可对酯酶同工酶进行染色。
关键词:酯酶同工酶;醋酸萘酯;KMnO 4;染色法中图分类号:Q946.5 文献标识码:AA Preliminary Study on Staining Method of Esterase IsozymesUsing N aphthylacetate and KMnO 4ZHAO Gan 1,Q IAN Fang 2,CAO Y ong -chang 3J IAN G Dian -feng 1,CHEN G Guo -dong 1,L I Ming -zhu 1,L I Xiao -yu 1 (1.College of Life Science ,South China Agricultural University ,Guangzhou 510642,China ;2.De 2partment of Rudiments ,Guangzhou Health School ,Guangzhou 510180,China ;3.College of Animal Sci 2ence ,South China Agricultural University ,Guangzhou 510642,China ) Abstract :Esterase isozymes can hydrolyze α-naphthylacetate and β-naphthylacetate resulting in naphthol.Then the naphthol can react with KMnO 4resulting in the colored substance which can stain the isozymes.K ey w ords :esterase isozyme ;naphthylacetate ;KMnO 4;staining method经典的酯酶同工酶染色法的原理是,在酯酶催化α-醋酸萘酯和β-醋酸萘酯发生水解得到萘酚后,利用萘酚与固蓝RR 盐(又称坚牢蓝RR 盐)发生反应生成有色物质这一性质在电泳凝胶上观察到酯酶同工酶的染色位置[1]。
同工酶电泳

利用同工酶电泳分析种(属)间亲缘关系POD和EST(酯酶)1.原理1.1 同工酶(isozyme,isoenzyme)是指催化反应相同而结构及理化性质不同的一组酶,它们几乎存在于所有生物中。
同工酶作为一类蛋白质,广泛存在于生物的同一种属,同一个体的不同组织,同一组织或同一细胞中。
根据同工酶来源和结构的不同,从遗传学的角度可将它分为4类:①单基因决定的同工酶;②多基因决定的同工酶;③复等位基因决定的同工酶;④修饰同工酶或次生同工酶。
在生物进化过程中,同工酶是为了适应细胞代谢的多方面需求而产生的,其功能在生理上表现为对代谢的调节作用。
在遗传上,当一种酶同时受几个基因控制时,更容易适应环境的变化,一个基因由于突变而无用时,其它基因的存在仍然可以产生类似作用的同工酶,这有助于机体减小基因突变造成不利后果的影响广义。
1.2同工酶分析技术是通过电泳和组织化学方法进行特异性染色而把酶蛋白分子分离,并将其位置和活性直接在染色区带以酶谱的形式标记出来的技术。
同工酶是基因分子水平的表现型,基因的微小变化都会引起同工酶的变化。
因此可以从同工酶谱的变化揭示种间的亲缘关系。
同工酶分析技术已在植物系统学研究中广泛应用于研究植物间的亲缘关系,并获得了较为准确的结果。
2. 同工酶分析技术2.1同工酶分离方法同工酶分离方法主要有电泳法、层析法、酶学法和免疫学法等,其中以电泳法应用最为广泛。
其原理在于同工酶是功能相同但结构不同的一组酶,由于其结构中氨基酸序列或组成有差异,致使同工酶在电泳时,其迁移率也存在差异_7 J。
2.2同工酶分离的常用电泳技术2.2.1淀粉凝胶电泳法这是最古老的电泳方法之一,其优点在于便宜,无化学毒性物质,可以迅速筛分不同活性的酶,但其分辨率不高。
2.2.2聚丙烯酷胺凝胶电泳(PAGE)PAGE在分离蛋白质和核酸上应用广泛。
实践中采用不连续电泳,即通过浓缩胶的收缩效其中聚丙烯酰胺凝胶电泳由于方法简单、分辨率较高、同工酶不易失活而使用最为普遍。
同工酶的检测方法和原理

同工酶的检测方法和原理同工酶是指在氨基酸序列相同但功能不同的蛋白质之间的酶。
在不同的物种中,由于进化的压力和不同的生理需要,可能会形成具有相同功能但结构和氨基酸序列不同的酶,这些酶被称为同工酶。
同工酶的存在使得生物体能适应不同的环境和生理需求。
检测同工酶的方法可以分为直接方法和间接方法,下面将分别介绍。
直接方法主要是通过电泳技术进行测定,包括凝胶电泳和等电聚焦电泳。
1. 凝胶电泳:是一种常用的同工酶检测方法。
凝胶电泳是将样品分离成带状,在电场作用下,带状样品经由电泳从一端移动到另一端。
电泳分离的原则是根据同工酶的电荷和分子大小的差异。
凝胶电泳通常使用聚丙烯酰胺凝胶或琼脂糖凝胶,将样品施加在凝胶表面形成样品带状条带。
样品通过电泳迁移时,在凝胶中形成不同迁移距离的带状物,通过对不同带状物进行染色,可以检测到同工酶。
2. 等电聚焦电泳:等电聚焦电泳是根据同工酶的等电点差异进行分离。
等电聚焦电泳是一种高分辨率电泳技术,利用一个有缓冲液梯度的平板进行分离。
在平板两端施加电场,使样品中的蛋白质在不同的等电点处停留。
等电聚焦完成后,通过其他电泳技术如SDS PAGE等对蛋白质进行分离和检测。
间接方法主要是通过特定底物的测定来检测同工酶的活性。
1. 酶活性测定:通过酶的催化反应来测定同工酶的活性。
这种方法通常使用特定底物,底物与酶发生催化反应后,产生某种可检测的物质,例如:酶联免疫吸附测定法(ELISA)通过酶催化反应来检测同工酶的存在和活性。
2. 免疫学检测:使用特异的抗同工酶抗体进行检测。
抗体与酶形成复合物,然后通过标记系统如酶标记二抗、荧光标记等来检测复合物的存在和活性。
典型的方法如免疫印迹(Western Blotting)可以通过抗体和抗原相互作用来检测同工酶的存在。
同工酶检测的原理是通过不同的分离和检测技术来找到同工酶的差异。
这些差异可以是电荷、分子大小以及底物的反应等。
通过对同工酶的差异进行测定和分析,我们可以了解同工酶的分布、活性和功能等。
玉米DH系的表现及其同工酶电泳分析

摘
要
以孤 雌 生殖诱 导 系高诱 1号诱 导的 单
倍体植 株 为材料 , 由单 倍 体 加倍 后 获 得 的 D 系性 H 状上 表现 高度 一致 , 中一 些 D 系的 长 势 和 果穗 其 H
性状 达到 了育种 上 的要 求 。D 系的过 氧 化 物酶 和 H
色糊粉 层 , 色胚 芽 的 单倍 体 子 粒 , 植 于 田 问 , 无 种 得 到 单倍 体植株 。
题 , 用 常 规 育 种 方 法 , 到 自交 系 需 要 经 过 利 得 5~ 代 的 自交 , 6 而利 用 单倍 体 加倍 后得 到 的双 单倍 体 在一个 世代 就可 得 到纯 合 重 组体 , 这对 于 缩 短 育
种 年限 , 快 育 种 进 程 , 高 选 择 效 率 具 有 重 要 意 加 提
作 物 杂志
Co s rp
2 1 . 00 1
玉 米 D 系 的表 现 及 其 同工 酶 电泳 分 析 H
魏 俊 杰 陈梅 香 刘 志增 陈景 堂 祝 丽英
( 保 定 学 院 ,70 1 河北 保 定 ; 河北 农 业 大 学 农 学 院 ,7 0 1 河 北 保定 ) 0 10 , 0 10 ,
完毕用醋酸 联苯铵 ( .% w v 法染 色 , 01 /) 酶带清 晰 后 , 清水 冲洗 , 相 , 制成 干板 。 用 照 并 12 4 酯 酶 同工酶 电泳 分离 胶浓 度 7 5 , 联 .. .% 交 度 2 5 ; 缩胶 浓度 3 5 , 联 度 4 3 ; 他 操 .% 浓 .% 交 .% 其 作 同过 氧 化 物酶 同工 酶 程 序 。 电泳 完 毕 用 乙 酸一- 萘酯 , 乙酸一 B萘酯 , 坚牢 兰 R R盐 (.% w v 染 色 , 01 / ) 3 ̄ 7C保温 3 mn 酶带 呈 褐色 后 , 0 i, 冲洗 , 照相 , 并制 成
关于甜叶菊

不同激素对甜叶菊生根过程中POD和酯酶同工酶表达的影响农学专业学生:金帮翠指导老师:张子学摘要:以甜叶菊组织培养苗为材料,采用聚丙烯酰胺凝胶电泳研究激素对甜叶菊生根中POD和EST 同工酶表达的影响。
结果表明:不同处理间同工酶活性表达上有明显的不同。
NAA和IBA对调节甜叶菊生根中POD、EST同工酶活性的表达有明显的影响,而对培养30天的不同处理EST同工酶的种类的表达也有明显的差异。
另外,激素NAA和IBA对调节甜叶菊生根中POD和EST同工酶活性方面存在相互作用,并且IBA对甜叶菊生根中POD和EST同工酶表达的影响比NAA强。
关键词:甜叶菊;激素;POD;酯酶;同工酶甜叶菊原产于南美洲,为亚热带多年生宿根系菊科植物[2]。
其叶片中含有甜叶菊糖苷,甜度相当于蔗糖的300倍,但所含热量仅为蔗糖的1/300左右,是目前已知最甜的天然糖料,以作为天然的甜味添加剂应用于食品工业,如在饮料糖果糕点等生产上的应用,而且其成本比蔗糖低50%以上[1][2]。
另外甜叶菊糖苷在人体内不会代谢,也不会残留或产生副作用,对肥胖症、低血糖、糖尿病、小儿龋齿、高血压、心脏病等具有一定的防治效果和辅助疗效[3][4]。
甜叶菊一般以种子育苗法简便宜行,成活率高,但繁殖周期长,繁殖系数小,不能满足生产上对甜叶菊的需求[5]。
同时,目前推广的甜叶菊品种多为杂交种,后代分离范围大产量品质下降。
采用组织快繁技术,既可保持优良品种的固有特征,又可加速优良品种的繁殖,适应甜叶菊产业化的需求。
同工酶是指能催化同一化学反应,但其酶蛋白本身的分子结构却有所不同的一组酶[6]。
同工酶电泳图谱的多态性变化反映了蛋白质水平的差异,这种差异是由于基因表达的不同引起的,它是基因表达的产物,在一定程度上能够判断基因的存在及表达规律[7][8][9]。
过氧化物酶(POD)和酯酶(EST)在高等植物体内普遍存在。
POD作为酶防御系统的重要保护酶,能抑制膜脂过氧化作用,延缓细胞衰老;EST是生物体内催化羧酸酯类化合物水解和合成的一类酶,被认为可能在生理功能上有转酯作用[10]。
茶树诱变育种中酯酶同工酶的研究

茶树诱变育种中酯酶同工酶的研究篇一咱这搞茶树诱变育种研究的,一开始就像没头的苍蝇,到处乱撞。
不过,咱有股子不服输的劲儿,就想着一定要把这酯酶同工酶的事儿给琢磨透。
记得有一回,我和几个伙伴去茶园采样。
那茶园在一个小山坳里,路不太好走,我们深一脚浅一脚地进了茶园。
看着那一垄垄的茶树,绿油油的,心里还挺美。
我手里拿着剪刀,瞅准那些长得壮实的茶树叶子,“咔嚓咔嚓”就剪了起来。
这活儿看着简单,其实也有讲究,得挑合适的部位,还不能剪太多,不然茶树该心疼了。
采完样回到实验室,就开始处理这些茶叶样本。
先是把叶子洗干净,然后放到研钵里捣碎,那股子茶叶的清香一下子就弥漫开来。
我一边捣着,一边跟旁边的小李说:“你说这酯酶同工酶到底藏在这叶子的啥地方呢?”小李笑着说:“咱捣完了就知道了。
”接下来就是提取酶液,这一步可关键了。
我小心翼翼地把各种试剂加进去,眼睛紧紧盯着试管,生怕出一点差错。
有一次,我不小心手抖了一下,多滴了一滴试剂,当时心里就“咯噔”一下,想着这可坏了。
不过,幸好最后结果没受太大影响,不然我得懊恼死。
提取完酶液,就要开始电泳了。
把样本点到凝胶上,通上电,看着那些酶分子在电场里跑起来,心里别提多奇妙了。
就好像它们是一群运动员,在赛场上奋力冲刺。
我守在电泳仪旁边,眼睛都不敢眨一下,就怕错过哪个关键的变化。
等电泳结束,把凝胶放到染色液里染色。
这时候,神奇的事情发生了,一条条清晰的酶带就显现出来了。
我兴奋地叫起来:“快来看,这就是酯酶同工酶的谱带!”大家都围过来,七嘴八舌地讨论着。
有的酶带颜色深,有的浅,有的宽,有的窄,这些不同的样子到底代表着什么呢?我们开始查阅各种资料,请教专家,一点点地分析。
那几天,我满脑子都是这些酶带。
吃饭的时候想着,睡觉的时候也梦到。
有一回,我半夜突然想到一个可能的解释,赶紧爬起来把想法记下来,生怕第二天忘了。
经过这一番折腾,我们对茶树诱变育种中酯酶同工酶有了初步的认识。
虽然还有很多问题没搞清楚,但这就像打开了一扇门,让我们看到了里面的一点光亮。
食用菌菌种纯度的同工酶电泳测定

食用菌菌种纯度的同工酶电泳测定
谢宝恩;慕兰;王金荣;胡京枝
【期刊名称】《河南农业科学》
【年(卷),期】2001(000)005
【摘要】同工酶是基因表达的直接产物,与物种的遗传和变异有直接关系,近年来已在动植物分类,病理,遗传育种等方面获得日益广泛的应用,但利用同工酶对食用菌进行分类研究的报道还很少,本实验旨在探求不同菌种酶谱差异,从而界定其亲缘关系,改善目前市场上食用菌菌种管理混乱,分类不清,甚至同种异名的现状,实验选取目前销售,应用;较为广泛,代表性强的平菇和香菇菌种,测定其液培菌丝的酯酶和过氧化物酶谱带,此方法简便准确,对检测食用菌菌种纯度,并深入研究食用菌的遗传代谢将起到重要作用。
【总页数】3页(P29-31)
【作者】谢宝恩;慕兰;王金荣;胡京枝
【作者单位】河南省农业科学院科学实验中心,郑州,450002;河南省土壤肥料站;河南省农业科学院科学实验中心,郑州,450002;河南省农业科学院科学实验中心,郑州,450002
【正文语种】中文
【中图分类】S6
【相关文献】
1.同工酶电泳技术在杂交水稻种子纯度鉴定中的应用探析 [J], 庄淑芳
2.酯酶同工酶电泳鉴定天优122、培杂双七种子纯度研究 [J], 黎杰强;彭艺;徐翔飞;邓翀;刘晖;张顺佳;范红超
3.酯酶同工酶电泳技术在玉米品种真实性和纯度测定中的应用研究 [J], 苏菊萍;亢银萍
4.食用菌菌种纯度的酯酶同工酶电泳测定 [J], 杨立红;黄清荣;刘新海;卜庆梅;蔡德华;刘连兴
5.用同工酶电泳快速鉴定甜瓜品种的真实性与纯度研究 [J], 郑伟华;王富兰;陈贺因版权原因,仅展示原文概要,查看原文内容请购买。
辣椒疫霉可溶性蛋白和酯酶同工酶电泳分析

辣椒疫霉可溶性蛋白和酯酶同工酶电泳分析
李萍;叶涛;郑婷;高智谋
【期刊名称】《安徽农业大学学报》
【年(卷),期】2015(42)6
【摘要】采用SDS-聚丙烯酰胺凝胶电泳技术(SDS-PAGE)和PAGE电泳技术分别对安徽不同地区的46个辣椒疫霉进行可溶性蛋白和酯酶同工酶分析,从蛋白质和酶学水平上分析辣椒疫霉的生理生化特征。
可溶性蛋白电泳表明,每个辣椒疫霉分离出了25~37条谱带,平均31.5条。
其中具有多态性的条带共有24条,多态性比率达64.9%,可溶性蛋白图谱与地理来源相关,但与致病力不相关。
酯酶同工酶PAGE电泳显示辣椒疫霉菌株各有1~8条条带,Rf值为0.05~1.00,不同辣椒疫霉菌株间某些同工酶谱带数和同一迁移率谱带的颜色和宽度差异显著,其中弱致病力菌株的条带数为1~3条,说明菌株的致病力差异可在酯酶同工酶水平上得到反映。
【总页数】6页(P915-920)
【作者】李萍;叶涛;郑婷;高智谋
【作者单位】安徽农业大学植物保护学院;安庆职业技术学院园林园艺系
【正文语种】中文
【中图分类】S436.418.1
【相关文献】
1.黄颡鱼雌、雄个体血清蛋白、酯酶同工酶及血红蛋白的电泳分析
2.双孢蘑菇菌丝体酯酶同工酶及可溶性蛋白的电泳分析
3.木霉工程菌株酯酶同工酶和可溶性蛋白
的电泳分析4.栝楼不同居群可溶性蛋白质和酯酶同工酶电泳分析5.浙贝母低温解除休眠过程中酯酶同工酶和可溶性蛋白质的电泳分析
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酯酶同工酶电泳
酯酶是催化酯类化合物水解的酶系,目前已发现的酯酶至少有20种。
植物酯酶同工酶的分离技术多采用垂直板聚丙烯酰胺凝胶电泳技术,主要操作步骤介绍如下。
一、试剂
按表1配制贮液和工作溶液---表1 贮液和工作溶液配制用量
注:贮液放在冰箱中一般可保存1~2月,3号贮液只能保存1周。
Acr=丙烯酰胺,Bis=甲叉双丙烯酰胺,TEMED=四甲基乙二胺,Tris=三羟甲基氨基乙烷。
二、制胶
1、由于电泳槽的构造因厂家不同而有所差异,可按电泳槽所附说明书组装好胶板。
2、按上表配制好分离胶工作液,快速混匀,立即用带长针头的注射器吸取一定量的胶液,沿着玻璃板壁加入胶板间,至板顶3cm即可;然后沿着玻璃板壁缓慢加入3~5mm蒸馏水层。
刚加水时看出有界面,后逐渐消失;等到再看到界面时表明凝胶已经聚合(一般约30分钟);再静置30分钟使聚合完全。
3、用注射器吸去分离胶上的水层,用滤纸条吸去残留的水液。
按上表配制好浓缩胶工作液,快速混匀,立即用带长针头的注射器吸取一定量的胶液,沿着玻璃板壁加入胶板间以冲洗分离胶的顶部。
迅速吸出,立即灌注浓缩胶,当灌至凹型玻璃口3mm处停灌,立即插入样品梳,使凝胶液面高出玻璃1~2mm。
然后在距日光灯管10cm处照射进行光聚合。
当看到浓缩胶显乳白色(一般6~7分钟),表明聚合开始。
继续半小时,使聚合完全。
三、电泳
1、样品提取
取烟苗0.2克,加0.5毫升提取缓冲液(含0.075M Tris-HCl,pH7.5,0.01M KCl,0.01M MgCl
,0.001EDTA,5%蔗糖,0.1%巯基乙醇,5%PVP-
2
聚乙烯基吡咯烷酮),冰块上研磨成匀浆,低温下12000rpm离心15分钟,取上清液置于冰箱中备用。
提取缓冲液种类较多,这里介绍的提取缓冲液本实验室曾采用过,可据需要参看其他提取方法。
2、点样
拔出样品梳,吸取样品槽中的水分。
用微量移液器加入适量样品液(一般50微升左右)。
用移液器缓慢加入电极缓冲液,以覆盖样品。
3、电泳
按说明书在电泳槽上下两极加入适量电极缓冲液,连接到电泳仪上。
先调节电压120V;1小时后调高到240V。
待指示剂迁移到距分离胶边缘1cm处停止电泳。
条件允许时,最好置于冰箱中电泳。
四、染色
卸板,剥下凝胶,放入染色液中进行染色。
染色液的配制:称0.15克固兰RR盐溶于150ml 0.1M、pH6.4的磷酸缓冲液中,过滤后加70%内含0.1克醋酸-1-萘酯、0.05克醋酸-1-萘酯的丙酮溶液5 ml。
37℃下染色至条带清晰(约1小时),然后加入7%醋酸溶液中脱色、固定。
染色液配制并不局限于这里所介绍的方法,可据需要参看其他方法。
用玻璃纸或干胶仪制成干胶永久保存。
酯酶活性高低可据酶带的强弱进行描述,如分为强、中、弱;还可利用专门的图像处理系统进行扫描,通过观察其峰值高低来度量。
