纯碱的工业生产
纯碱的化工用途有

纯碱的化工用途有纯碱(氢氧化钠)是一种重要的化工原料,具有广泛的应用。
下面将详细介绍纯碱的化工用途。
1. 玻璃工业:纯碱是制造玻璃的重要原料。
在玻璃制造过程中,纯碱能够降低玻璃的熔点,改善玻璃的透明度和稳定性,同时还能去除玻璃中的杂质和气泡。
2. 碱性电池:纯碱被广泛用于制造碱性电池。
纯碱作为电解液中的主要成分,能够提供电池中的离子导体,从而使电池能够产生电能。
3. 纺织工业:纯碱是纺织工业中常用的改性剂。
它能够调节织物的酸碱度和pH 值,使纤维具有更好的柔软性和耐久性。
4. 化妆品工业:纯碱在化妆品工业中用作乳化剂和中和剂。
它能够使化妆品中的油性成分与水性成分混合,并调节化妆品的酸碱度,提高产品的稳定性和延展性。
5. 油脂工业:纯碱被用作油脂工业中的脱蜡剂和碱炼剂。
它能够去除油脂中的杂质和不纯物质,提高油脂的质量和纯度。
6. 纸浆和纸张工业:纯碱常被用于制造纸浆和纸张。
它能够调节纸张的酸碱度,改善纸张的强度和印刷性能。
7. 石化工业:纯碱是石化工业中常用的中和剂。
它能够中和酸性物质,并调节石化工艺中的酸碱度,保护设备的安全和延长其使用寿命。
8. 纺织品染色工业:纯碱常被用于纺织品染色过程中。
它能够改善染料的溶解性和渗透性,使染色效果更加均匀和鲜艳。
9. 冶金工业:纯碱在冶金工业中具有多个用途。
它可以用来中和和去除矿石中的杂质和硫化物,提高冶金过程中的产率和纯度。
10. 食品工业:纯碱被广泛用于食品工业中作为增稠剂和膨松剂。
它能够增加食品的口感和质地,使食品更加美味和可口。
11. 制浆工业:纯碱在制浆工业中用作去除树脂和脂肪酸的脱脂剂。
它能够改善纸浆的质量和纯度,提高纸张的强度和光泽度。
12. 污水处理:纯碱可以用来调节污水的酸碱度和pH值,中和酸性废水,净化废水,达到环境保护的目的。
除了以上列举的用途外,纯碱还被广泛应用于医药工业、电子工业、农业和环保等领域。
纯碱的化工用途广泛且多样,对各行各业的生产和生活都有着重要的影响。
纯碱工业制作方法

纯碱工业制作方法纯碱即苏打(soda),化学式为Na2CO3,是一种重要的化工原料,是食品、造纸、制药、玻璃、肥皂、印染等工业乃至人民日常生活的必需品。
一:布兰制碱法:古代,人们从草木灰中提取碳酸钾,后来又从盐碱地和盐湖等天然资源中获取碳酸钠,但量太小。
远不能满足化工生产需求,1791年法国医生路布兰首先获得制碱专利,以食盐为原料制碱,称路布兰制碱法,该法分三布:①用氯化钠与硫酸反应制硫酸钠:2NaCl+H2SO4=Na2SO4+2HCl;②用焦炭还原硫酸钠得硫化钠:Na2SO4+4C=Na2S+4CO↑③用硫化钠与石灰石反应制碳酸钠:Na2S+CaCO3=Na2CO3+CaS缺点:;该方法生产时需要高温,硫酸对设备腐蚀严重,CaS废弃物长期堆积臭气四溢,加之成本较高,后被氨碱法代替。
二: 氨碱法即索尔维制碱法,是1862年,比利时人索尔维以食盐、氨、二氧化碳原料发明的制碱法,其反应也分三步进行:①NH3+CO2+H2O=NH4HCO3②NH4HCO3+NaCl=NaHCO3+NH4Cl③2NaHCO3=Na2CO3+CO2↑+H2O反应生成的C O2可回收利用,NH4Cl又可与生石灰反应重新生成氨气:2NH4Cl+CaO=2NH3↑+CaCl2+H2O缺点:该法实现了连续化生产,食盐利用率得到提高,使纯碱价格大大降低,并且产品质量纯净,故被称纯碱。
三: 候氏制碱法对上述方法做了较大的改进,此法的最大特点是不从固体碳酸氢铵(NH4HCO3),而是由盐卤先吸收氨后再碳酸化以进行连续生产,此法的原理是:低温下用氨饱和的饱和食盐水通入二氧化碳(CO2)可析出碳酸氢钠(NaHCO3),此时母液中N a+减少而Cl-相对多,此时再加入细盐末,因同离子效应,低温氯化铵(NH4Cl)溶解度突然降低,而食盐(NaCl)的溶解度变化不大,所以氯化铵(NH4Cl)析出而食盐不析出,再用氨饱和后通二氧化碳(CO2),结果往返析出NaHCO3和NH4Cl,其中氨由氮与水中的氢化合制成,CO2是提取氢气和氮气的半水煤气之副产品,这样巧妙的把氮气工业和制碱工业联合起来,故候氏制碱法又称联合制碱法。
纯碱工业制法

纯碱工业制法全文共四篇示例,供读者参考第一篇示例:纯碱,化学名为碳酸氢钠,也称碳酸钠,是一种重要的化工原料,广泛应用于玻璃、肥料、洗涤剂等行业。
纯碱工业制法主要分为两种,一种是氢氧化钠法,另一种是自然碱法。
本文将重点介绍氢氧化钠法制备纯碱的工艺流程及相关知识。
氢氧化钠法制备纯碱的工艺流程包括若干步骤,主要包括矿石选矿、石灰石碳化、氢氧化钠提取、碳酸化及回收利用等。
首先是矿石选矿,通常采用天然碱矿石,如矿石中含有氯化钠、氯化钾、硫酸钠等。
选矿过程中,将含碱物质的矿石从其他杂质中分离出来,以确保最终产品的纯度。
接下来是石灰石碳化,将选矿得到的碱矿石和石灰石研磨混合,并在高温下进行反应,生成氢氧化钠。
这一步骤是制备纯碱的关键环节,影响着产品的质量和产量。
然后是氢氧化钠提取,将碳化生成的氢氧化钠进行提取分离,得到高纯度的氢氧化钠溶液。
在纯碱工业制法中,氢氧化钠是十分重要的中间体,它不仅是制备纯碱的关键原料,也广泛应用于其他化工领域,如造纸、皮革、食品等。
氢氧化钠的生产工艺和技术水平也直接影响着纯碱的制备质量和成本。
除了氢氧化钠法,纯碱的另一种制备方法是自然碱法。
自然碱是指天然产生的碳酸盐矿石,如矿砂、矿泉水等。
自然碱法制备纯碱的工艺流程相对简单,主要是通过碳酸盐矿石的热分解、碱液处理等步骤获得纯碱产品。
与氢氧化钠法相比,自然碱法的纯碱产量较低,且质量也不如氢氧化钠法制备的产品。
纯碱工业制法是一个复杂而重要的化工过程,其工艺流程和技术水平直接影响着产品的质量和生产效率。
随着科技的不断进步和发展,纯碱工业制法也在不断创新和改进,以满足市场需求和提高生产效益。
希望通过本文的介绍,读者可以更加全面地了解纯碱的制备工艺及相关知识,进一步推动纯碱工业的发展和进步。
第二篇示例:纯碱,即氢氧化钠,是一种重要的化工产品,广泛用于制造玻璃、肥料、皂类、造纸、化纤等行业。
纯碱工业制法主要是通过电解食盐溶液,制取氢氧化钠和氯气,再通过碱液处理,得到纯碱产品。
纯碱的生产工艺流程

纯碱的生产工艺流程
纯碱,也被称为氢氧化钠或苛性钠,是一种重要的化工原料,在工业中被广泛应用。
下面将介绍纯碱的生产工艺流程。
1.原料准备
纯碱的主要原料是氯化钠(NaCl)。
在工艺流程中,还需要添加一定量的石灰石(CaCO3)和纯碱矾。
2.碳化反应
首先,将氯化钠与石灰石混合,形成碳酸钙(CaCO3)和氯化氢(HCl)。
碳酸钙与石灰石反应的化学方程式为:
NaCl+CaCO3→CaCl2+Na2CO3
3.碱化反应
碳酸钙与纯碱矾反应,生成纯碱(氢氧化钠)和二氧化碳(CO2)。
碱化反应的化学方程式为:
CaCO3+Na2SO4→Na2CO3+CaSO4
4.氯化反应
抽取产生的氯化氢,与纯碱反应生成氯化钠和水。
氯化反应的化学方程式为:
HCl+Na2CO3→NaCl+H2O+CO2
5.结晶
将产生的溶液进行结晶处理,通过控制温度和浓度,使纯碱结晶分离出来。
结晶过程中会产生一定量的固体废弃物,如硫酸钙(CaSO4),需要进行妥善处理。
6.干燥
将纯碱结晶体进行干燥,除去其中的水分,获得纯碱的固体产物。
7.精制
通过进一步的处理,去除其中的杂质,得到高纯度的纯碱产品。
8.包装
将纯碱产品按照一定规格进行包装,以备销售和运输使用。
需要注意的是,纯碱的生产工艺流程可以根据不同的生产条件和要求进行调整和改进。
在工业实践中,还使用了其他辅助工艺和设备,如溶液浓缩、晶体分离、蒸发等。
此外,纯碱的生产过程中产生的废水和废气也需要进行处理和排放控制,以确保环境的安全和可持续发展。
工 业 制 纯 碱
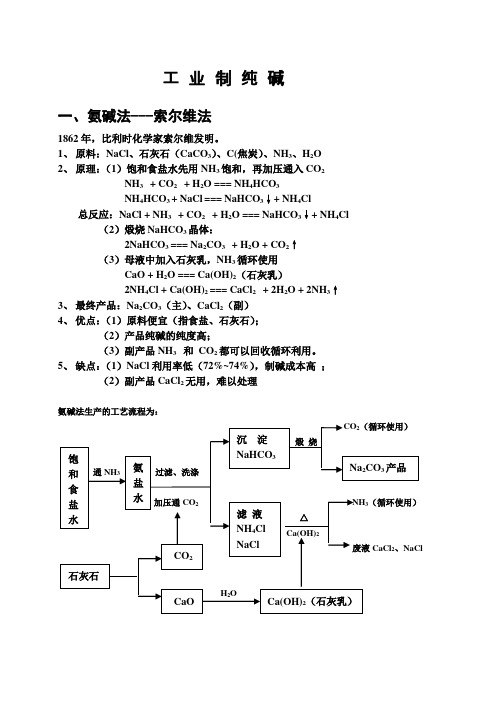
工业制纯碱一、氨碱法---索尔维法1862年,比利时化学家索尔维发明。
1、原料:NaCl、石灰石(CaCO3)、C(焦炭)、NH3、H2O2、原理:(1)饱和食盐水先用NH3饱和,再加压通入CO2NH3 + CO2 + H2O === NH4HCO3NH4HCO3 + NaCl=== NaHCO3↓+ NH4Cl 总反应:NaCl + NH3 + CO2 + H2O === NaHCO3↓+ NH4Cl (2)煅烧NaHCO3晶体:2NaHCO3 === Na2CO3 + H2O + CO2↑(3)母液中加入石灰乳,NH3循环使用CaO + H2O === Ca(OH)2(石灰乳)2NH4Cl + Ca(OH)2 === CaCl2 + 2H2O + 2NH3↑3、最终产品:Na2CO3(主)、CaCl2(副)4、优点:(1)原料便宜(指食盐、石灰石);(2)产品纯碱的纯度高;(3)副产品NH3 和CO2都可以回收循环利用。
5、缺点:(1)NaCl利用率低(72%~74%),制碱成本高;(2)副产品CaCl2无用,难以处理氨碱法生产的工艺流程为:二、联合制碱法---侯氏制碱法1924年,中国化学家侯德榜发明1、原料:NaCl、空气、C(焦炭)、H2O2、原理:(1)、(2)步及反应式同索尔维法;(3)滤去NaHCO3晶体后,母液在降温(-5℃)后加入磨细的NaCl粉末(直径0.5mm以下,以降低NH4Cl的溶解度),并充分搅拌,使NH4Cl大量结晶出来,新母液循环使用。
(NH4Cl作氮肥,供应市场)注意:此法是将氨碱法和合成氨法两种工艺联合起来制碱厂的CO2、NH3来源于合成氨厂:C + H2CO + H2CO+ H2 2 + H2N2+3H2催化剂高温高压2NH33、最终产品:Na2CO3(主)、NH4Cl(副)4、优点:(1)NaCl的利用率高(95%~98%)(2)成本低,产品纯度高;(3)副产品NH4Cl可作化肥,无副产品CaCl2。
纯碱的工业制法

纯碱的工业制法
纯碱的工业制法主要有氯碱法、天然石碱法和氨法。
1. 氯碱法:氯碱法是目前主要用于纯碱生产的工业制法。
该方法是通过电解食盐水(氯化钠溶液)制取氯气和氢气,然后利用氯气和氢气的反应生成氢氧化钠(苛性钠),随后将苛性钠与二氧化碳反应制取纯碱。
2. 天然石碱法:天然石碱法是通过矿石石碱(纯碱矿石)进行加热和浸出制取纯碱。
首先,将天然石碱进行粉碎,并加热到一定温度,使其中的碳酸钠分解为氧化钠和二氧化碳。
然后,将氧化钠与水进行浸出,得到纯碱溶液。
随后,通过蒸发水分、结晶和干燥等步骤,将纯碱从溶液中提取出来。
3. 氨法:氨法是利用氨和二氧化碳的反应制取纯碱的方法。
首先,将氨气和二氧化碳气体通入硝酸铵溶液中,发生化学反应生成尿素。
接着,对尿素进行加热分解,生成碳酸氢铵。
最后,将碳酸氢铵与钠盐反应,得到纯碱。
需要注意的是,不同的工业制法可能在不同地区或企业中使用,具体的工业制法也可能会因为技术的进步而有所变化。
以上是一般情况下常见的纯碱工业制法的简要介绍。
纯碱生产工艺

纯碱生产工艺纯碱,也叫做氢氧化钠,是一种化学物质,化学式为NaOH。
它是一种白色固体,易溶于水,具有强碱性。
纯碱被广泛应用于制造肥皂、玻璃、纸张、纤维素等工业生产过程中。
在这篇文章中,我们将探讨纯碱的生产工艺。
纯碱的生产工艺主要分为两个步骤:氯碱法和碱液蒸发法。
下面将详细介绍这两种工艺。
氯碱法是目前纯碱的主要生产方法之一。
该工艺通过电解食盐水溶液来生产纯碱。
首先,将食盐(氯化钠)溶解在水中,形成食盐水溶液。
然后,将食盐水溶液经过电解槽,通过电流的作用,将其分解成氢气、氯气和氢氧化钠。
氯气在阳极生成,氢气在阴极生成,而氢氧化钠则溶解在水中。
最后,通过蒸发和结晶的方法,从溶液中得到纯碱。
氯碱法生产纯碱的优点是工艺成熟、生产效率高,但同时也会产生大量的氯气,对环境造成污染。
碱液蒸发法是另一种纯碱生产工艺。
该工艺通过将食盐水溶液进行蒸发来得到纯碱。
首先,将食盐水溶液加热至一定温度,使其部分水分蒸发。
随着蒸发的进行,水分中的食盐浓度逐渐增加,直到达到饱和。
此时,蒸发器中的溶液中含有饱和度较高的食盐。
然后,将饱和溶液进行冷却,使溶液中的纯碱结晶析出。
最后,通过过滤和干燥的方法,从溶液中得到纯碱。
碱液蒸发法生产纯碱的优点是工艺简单、操作方便,但由于纯碱的生产过程中需要大量的能源供应,因此能源消耗较高。
纯碱的生产工艺中还有一些辅助工艺,如纯碱的粉碎、筛分和包装。
这些工艺主要是为了提高纯碱的质量和产品的使用便利性。
在粉碎过程中,纯碱固体被破碎成较小的颗粒,以提高其溶解速度。
在筛分过程中,纯碱颗粒按照一定的大小范围进行分类,以满足不同场合的使用需求。
在包装过程中,将纯碱装入袋子或容器中,并进行密封,以保证其质量和储存寿命。
纯碱的生产工艺在不断进步和创新中。
随着科学技术的发展,新的工艺和方法不断出现,以提高纯碱的生产效率和质量。
例如,有些研究人员正在探索使用膜分离技术来提取纯碱,以减少对环境的污染和能源的消耗。
此外,一些研究还致力于改进纯碱的生产工艺,以减少废物的产生和资源的浪费。
纯碱工业制法

纯碱工业制法
氯化钠、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱。
先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液。
将经过滤、洗涤得到的NaHCO3微小晶体,再加热煅烧制得纯碱产品。
放出的二氧化碳气体可回收循环使用。
含有氯化铵的滤液与石灰乳[Ca(OH)2]混合加热,所放出的氨气可回收循环使用。
氨碱法的优点是:原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合于大规模生产。
但氨碱法也有许多缺点:首先是两种原料的成分里都只利用了一半——食盐成分里的钠离子和石灰石成分里的碳酸根离子结合成了碳酸钠,可是食盐的另一成分氯离子和石灰石的另一成分钙离子却结合成了没有多大用途的氯化钙,因此如何处理氯化钙成为一个很大的负担。
氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%,其余的食盐都随着氯化钙溶液作为废液被抛弃了,这是一个很大的损失。
NaCl +NH3+H2O +CO2=NaHCO3+NH4Cl 。
2NaHCO3=Na2CO3+H2O +CO2。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
纯碱工业的第一次飞跃——索尔维法
发明者 1862年,比利时人索尔维(1838—1922)
生产史
自1863年投入生产,1867年在巴黎世博会上获得 铜制奖章,被正式命名为索尔维法。到1915年全 面取代路布兰法,并一直广泛采用至今。
原料
食盐、石灰石、氨(又称为氨碱法)
原料:氨气、食盐、石灰石
原料:氨气、二氧化碳、食盐
直接来自于制氨厂
核 1)NH3+CO2+H2O→NH4HCO3
心 反
2)NH4HCO3 +NaCl→NaHCO3↓+NH4Cl
应 3)2NaHCO3→Na2CO3+CO2↑+H2O
循环利用
循环利用措施:
CaO + H2O → Ca(OH)2
2NH4Cl+Ca(OH)2→CaCl2+2NH3↑+2H2O
工
业 生
1.经济性原则: 原料 能量 条件
产 的
2.加强三废治理,坚持科学发展观
基 本
3. 生产规模大型化
原 则
(联合生产,综合利用)
。
请你搜集一些不文明生产的资料, 对照它违背了什么样生产原则?
NH3
蒸氨
CaCl2(NaCl)
滤液(NH4Cl 和 NaCl) 产品:Na2CO3
资料阅读(一)
评价标准: ——绿色化学(Green Chemistry)
原子经济性原则:原子利用率100% 预防废物的生成,实现废物的“零排放”
请你评价(二)
根据评价标准,结合自己的认识,请你谈谈:
氨碱法的缺点有哪些?
35.9 21.7 9.6
37.2 21.5
通入二氧化碳后, C(HCO3-)大大增加
NH3+CO2+H2O→NH4HCO3 NH4HCO3+NaCl →NaHCO3↓+NH4Cl NaHCO3溶解度较小 NaHCO3(S) Na+ + HCO3—
正向进行
逆向移动 析出晶体
复分解反应总是向着离子浓度减小的方向进行
绿色化学 原子经济性原则:
原子利用率100% 预防废物的生成,
实现废物的“零排放”
资料阅读(二)
侯徳榜在1960年《制碱工学》中一段论述:
“它(指氨碱法)也存在着严重的缺点。首先是它所用 的原料(食盐)太不经济了,大厂的食盐利用率至多只有 73—75%,小厂则不到70%,故盐有25—30%被损失掉。 这还不包括净化即处理淤泥的损失。
将母液中的NH4Cl和NaCl分离,得 到NH4Cl制成氮肥,剩下的NaCl 再次利用。
请你评价:
对照氨碱法, 你觉得侯氏制碱法的优点
有哪些? 母液循环使用
设备简单, 大规模联合生产 提高了食盐的利用率
“废物”零排放 在得到产品的同时,生 成氯化铵作氮肥
资料阅读(三)
《氯化钙的故事该改写了》
程 (3)_2N_aH_C_O_3→_N_a2_CO_3+_C_O2_+_H2O
讨论 (NH4HCO3+NaCl→NaHCO3+NH4Cl)
根据所提供的数据和已学知识,分析NaHCO3为 什么会析出?
20℃时,相关物质物质的溶解度s/(g/100g水)
NaCl NH4HCO3 NaHCO3
NH4Cl Na2CO3
用氨碱法生产碳酸钠得到的氯化钙是一种令人头痛的副产 物,它堆积成山,找不到用途。然而,如今这个故事已经陈 旧了。1999年,仅北美对氯化钙的需求量就达到900000t。
北美氯化钙有哪些主要市场?据道化学公司统计 (1999),21%和27%分别用于道路融化冰雪和防治固体尘 埃,加起来达48%,是氯化钙的主要用户,用得多少受每年 气 候 形 势 制 约 。 此 外 , 20 % 用 于 油 气 开 采 ( 为 注 入 液 的 成 分),13%用于工业加工过程,10%为混凝土添加剂,还剩 下9%为其他用途,包括食品加工、汽车轮胎、煤炭解冻、盐 卤防冻等等。看来氯化钙的用途还是不少的,并非废物。
其次是吸氨塔废液(主要成分是CaCl2)难以处理。废 液量甚大,大厂每生产1吨纯碱有9~10吨废液,小厂则有 10~13吨,需要处理。废液需要大片土地来堆积…废液中 氯化钙渗入地下,玷污水源…索尔维法还有第三个缺点,即 盐中的Cl-完全未能利用,不符合原料综合利用的原则.”
氨碱法(索尔CaCO3
CaO
CO2
NaCl
盐水精制
吸氨塔 碳酸塔 过滤机 煅烧炉
NH3
蒸氨
CaCl2(NaCl)
滤液(NH4Cl 和 NaCl) 产品:Na2CO3
请你评价(一):
氨碱法的被广泛使用的成功之处有哪些?
CaCO3
CaO
CO2
NaCl 盐水精制
小组讨论 交流发言
吸氨塔 碳酸塔 过滤机 煅烧炉
具 (1)_____________
体 过
(2)_____________
程 (3)_____________
复习
请将氨碱法的具体过程用化学方程式表述。
具 (1)N_H_3+_C_O2_+H_2O_→_N_H_4H_CO_3_
体 过
(2)N_H_4H_C_O3_+N_aC_l_→_Na_H_CO_3↓_+NH4Cl
