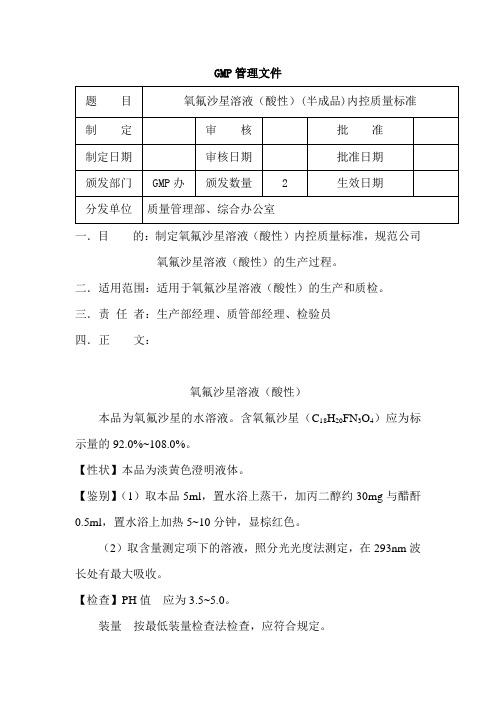
氧氟沙星溶液(碱性)成品质量标准
氧氟沙星溶液(酸性)(半成品)内控质量标准
GMP管理文件
一.目的:制定氧氟沙星溶液(酸性)内控质量标准,规范公司氧氟沙星溶液(酸性)的生产过程。
二.适用范围:适用于氧氟沙星溶液(酸性)的生产和质检。
三.责任者:生产部经理、质管部经理、检验员
四.正文:
氧氟沙星溶液(酸性)
本品为氧氟沙星的水溶液。
含氧氟沙星(C18H20FN3O4)应为标示量的92.0%~108.0%。
【性状】本品为淡黄色澄明液体。
【鉴别】(1)取本品5ml,置水浴上蒸干,加丙二醇约30mg与醋酐0.5ml,置水浴上加热5~10分钟,显棕红色。
(2)取含量测定项下的溶液,照分光光度法测定,在293nm波长处有最大吸收。
【检查】PH值应为3.5~5.0。
装量按最低装量检查法检查,应符合规定。
【含量测定】精密量取本品适量(约相当于氧氟沙星50mg),置250ml 量瓶中,加0.1mol/L盐酸溶液稀释至刻度,摇匀;精密量取2ml,置100ml量瓶中,加0.1mol/L盐酸溶液稀释至刻度,摇匀,照分光光度法,在293nm波长处测定吸收度;另取氧氟沙星对照品50mg,同法测定;计算,即得。
【规格】4%。
输液成品 质量标准

输液成品质量标准输液是临床常见的治疗手段之一,而输液成品的质量标准对于患者的治疗效果和安全性至关重要。
本文将从输液成品的外观、理化性质、微生物限度、稳定性等方面,介绍其质量标准的相关要求。
一、外观。
输液成品的外观是直接影响患者接受治疗的第一印象,因此其外观质量必须符合一定的标准。
一般来说,输液成品应该清澈透明,无悬浮物、沉淀物和色素沉淀,无异物和霉变现象,无渗漏和破裂等缺陷。
此外,包装应完整无损,标签应清晰易辨。
二、理化性质。
输液成品的理化性质包括pH值、渗透压、溶解度等指标。
其pH值应在4.5~7.0之间,渗透压应与人体血浆渗透压相近,溶解度应符合药典规定。
此外,输液成品的含量应稳定,不应有明显的沉淀和析出现象。
三、微生物限度。
输液成品作为直接进入人体血液循环的药品,其微生物限度的要求非常严格。
一般来说,输液成品在生产过程中应符合无菌条件,微生物限度应符合药典规定,如细菌总数、霉菌和酵母菌的限度等。
此外,对于特殊病情的患者,如免疫功能低下的患者,微生物限度的要求会更加严格。
四、稳定性。
输液成品在储存和使用过程中,应保持其药效成分的稳定性。
对于不同的输液成品,其稳定性测试的要求会有所不同,但一般都包括在不同温度下的稳定性测试、光照稳定性测试等。
稳定性测试的结果应符合药典规定,确保输液成品在有效期内保持其药效成分的稳定性。
总结。
输液成品的质量标准是保障患者安全和治疗效果的重要保障。
外观、理化性质、微生物限度和稳定性等方面的要求,都是为了确保输液成品的质量稳定、安全有效。
因此,在输液成品的生产和质量控制过程中,必须严格按照相关标准和规定进行,确保输液成品的质量符合要求,从而保障患者的治疗效果和安全性。
氧氟沙星注射液(半成品)内控质量标准

GMP管理文件一、目的:制定甲氧氟沙星注射液(半成品)的内控标准,规范公司甲磺酸培氟沙星颗粒的生产。
二、适用范围:适用于氧氟沙星注射液的生产与检验。
三、责任者:生产部、检验员、仓库保管员四、正文:氧氟沙星注射液本品为氧氟沙星的灭菌水溶液,含氧氟沙星(C18H20FN3O4)应为标示量的91.0%~108.0%。
【性状】本品为淡黄色或淡黄绿色澄明液体一。
【鉴别】(1)取本品适量(约相当于氧氟沙星20mg),置水浴上蒸干,加丙二酸30mg,加醋酐约10滴,置沸水浴上加热3分钟,显红棕色。
(2)取本品适量,加0.1mol/l盐酸溶液制成每1ml中含氧氟沙星10mg 的溶液,作为供试品溶液;另取氧氟沙星对照品适量,加0.1mol/l盐酸溶液制成每1ml中含10mg的溶液,作为对照品溶液。
照薄层色谱法试验,吸取上述两种溶液各5ul,分别点于同一硅胶GF254薄层板上,以氯仿-甲醇-氨溶液(4→100)(10:5:1)为展开剂,展开后,晾干,置紫外光灯(254nm)下检视,供试品溶液所显主斑点的颜色和位置应与对照品溶液的主斑点相同。
(3)取含量测定项下的溶液,照分光光度法测定,在294nm波长处有最大吸收。
【检查】 PH值应为3.5~5.0。
颜色取本品,加水稀释成每1ml中含2mg的溶液,与黄色5号或黄绿色5号标准比色液比较,不得更深。
热原取本品,加灭菌注射用水制成每1ml中含氧氟沙星10mg的溶液,依法检查,剂量按家兔每1kg体重注射2ml,应符合规定。
其他应符合注射剂项下有关的各项规定。
【含量测定】精密量取本品适量(约相当于氧氟水沙星60mg),置200ml 量瓶中,加0.1mol/l盐溶液稀释至刻度,摇匀;精密量取2ml,置100ml 量瓶中,用0.1mol/l盐酸溶液稀释至刻度,摇匀,照分光光度法,在294nm 波长处测定吸收度;另取在105℃干燥至恒重的氧氟沙星对照品约60mg,同法测定;计算,即得。
064氧氟沙星注射液(成品)检验记录
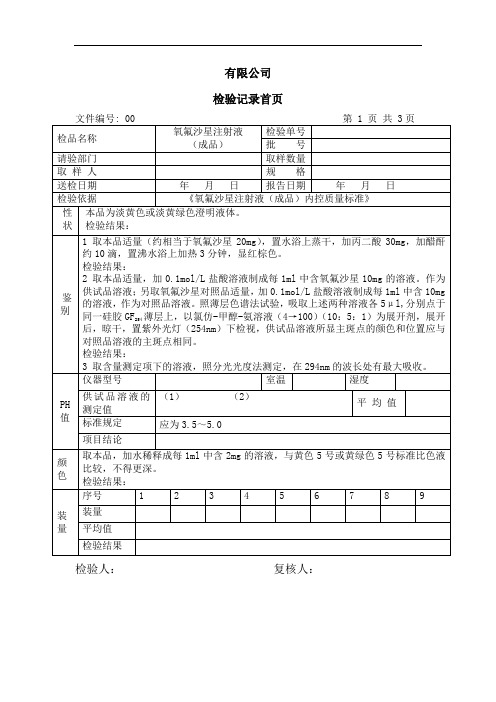
3 取含量测定项下的溶液,照分光光度法测定,在294nm的波长处有最大吸收。
PH
值
仪器型号
室温
湿度
供试品溶液的测定值
(1) (2)
平 均 值
标准规定
应为3.5~5.0
项目结论
颜色
取本品,加水稀释成每1ml中含2mg的溶液,与黄色5号或黄绿色5号标准比色液比较,不得更深。
检验结果:
装量
序号
1
有限公司
检验记录首页
文件编号: 00第 1 页 共 3页
检品名称
氧氟沙星注射液
(成品)
检验单号
批 号
请验部门
取样数量
取 样 人
规 格
送检日期
年 月 日
报告日期
年 月 日
检验依据
《氧氟沙星注射液(成品)内控质量标准》
性
状
本品为淡黄色或淡黄绿色澄明液体。
检验结果:
鉴
别
1 取本品适量(约相当于氧氟沙星20mg),置水浴上蒸干,加丙二酸30mg,加醋酐约10滴,置沸水浴上加热3分钟,显红棕色。
检验结论:本品按<<氧氟沙星注射液内控质量标准>>检验,结果规定
备注:
复核人:检验人:
有限公司
检验记录报告单
文件编号: 00 第 3 页 共 3页
检品名称
氧氟沙星注射液
检验单号
批 号
请验单位
取样数量
取 样 人
规 格
送检日期
年 月 日
报告日期
年 月 日
检验依据
<<氧氟沙星注射液(成品)内控质量标准>>
3、在294nm的波长处有最大吸收规定
甲磺酸左氧氟沙星质量标准

甲磺酸左氧氟沙星质量标准甲磺酸左氧氟沙星是一种广谱喹诺酮类抗生素,具有优良的抗菌活性,广泛用于临床治疗疾病。
为了确保甲磺酸左氧氟沙星在生产、储存和使用过程中的质量稳定性和安全性,制定了一系列的质量标准,以保证其合规生产和使用。
下面,我们将探讨甲磺酸左氧氟沙星的质量标准,包括物理性状、化学性质、纯度检测、微生物限度、残留溶剂等方面的要求和检测方法。
一、物理性状甲磺酸左氧氟沙星应为白色或类白色结晶性粉末,应具有良好的溶解性和稳定性。
在质量标准中通常包括粉末的外观、颗粒度、密度、溶解度等要求。
粉末的外观应均匀无结块,颗粒度应符合规定范围,密度应在一定的标准值范围内,溶解度应符合特定的溶剂中的要求。
二、化学性质甲磺酸左氧氟沙星在化学性质方面的质量标准一般包括化学结构、化学纯度和相关物质的要求。
化学结构应符合国际或行业标准,化学纯度一般包括杂质和同分异构体的限度要求,相关物质的含量应符合限定的范围。
三、纯度检测甲磺酸左氧氟沙星的纯度检测主要包括含量测定、杂质测定和同分异构体测定等。
含量测定可以采用高效液相色谱法、气相色谱法等进行,杂质测定通常包括有机杂质和无机杂质的检测,同分异构体测定一般采用质谱法或核磁共振法进行。
四、微生物限度甲磺酸左氧氟沙星作为药品,微生物限度是非常重要的指标。
其质量标准中通常包括细菌总数、大肠杆菌、霉菌和酵母菌等微生物的限度要求,检测方法包括菌落总数法、大肠埃希菌检测法等。
五、残留溶剂在生产过程中,甲磺酸左氧氟沙星可能会残留一些有机溶剂,因此在质量标准中通常包括残留溶剂的限度要求。
常见的残留溶剂包括丙酮、甲醇、乙酸乙酯等,限度要求根据药典标准进行限定,检测方法一般采用气相色谱法或液相色谱法。
甲磺酸左氧氟沙星的质量标准是保证药品质量安全、有效的重要保障。
生产企业应严格按照药典标准进行生产,并通过严格的质量控制体系保证产品的合格。
临床使用单位和药品监管部门也应加强对甲磺酸左氧氟沙星质量的监督检查,保障患者的用药安全。
乳酸左氧氟沙星氯化钠注射液质量标准

乳酸左氧氟沙星氯化钠注射液质量标准一、概述乳酸左氧氟沙星氯化钠注射液是一种广泛应用于临床的抗菌药物,具有广谱、高效、低毒副作用等特点,是临床上治疗严重感染症状的重要药物之一。
为了确保乳酸左氧氟沙星氯化钠注射液在临床使用中的安全性和有效性,有必要对其质量标准进行严格管理和监控,以保证药品质量符合要求。
二、质量标准内容1. 外观乳酸左氧氟沙星氯化钠注射液应为无色或微黄色透明液体,无悬浮物和沉淀。
2. pH值药液的pH值需符合规定范围,一般为5.0~8.0。
3. 水分乳酸左氧氟沙星氯化钠注射液的水分含量应符合国家药典规定,一般不超过5.0。
4. 含量测定乳酸左氧氟沙星氯化钠注射液中乳酸左氧氟沙星的含量应符合国家药典规定,一般不低于90.0。
5. 溶解度乳酸左氧氟沙星氯化钠注射液的溶解度应符合国家药典规定,可以通过适当的方法进行测定。
6. 细菌限度乳酸左氧氟沙星氯化钠注射液应符合微生物限度试验要求,无细菌产生。
7. 稳定性乳酸左氧氟沙星氯化钠注射液应在规定的储存条件下,其稳定性应符合国家药典规定。
三、质量标准的重要性严格管理乳酸左氧氟沙星氯化钠注射液的质量标准具有重要意义。
1. 保障临床用药安全乳酸左氧氟沙星氯化钠注射液作为用于治疗严重感染的药物,其质量直接关系到患者的安全和治疗效果。
对其质量标准的严格管理,可以保障临床用药的安全性。
2. 保证治疗效果药品质量差异可能影响其治疗效果,严格的质量标准管理可以确保药品的治疗效果符合临床需求,提高治疗成功率。
3. 维护制药企业声誉严格遵守质量标准可以有效维护制药企业的声誉,提升企业形象,增强患者对药品的信任度。
四、质量标准的监控对乳酸左氧氟沙星氯化钠注射液质量标准的监控需要从原材料采购、生产工艺控制、产品检验评定等环节进行严格管理。
1. 原材料采购选用符合GMP要求的优质原材料,保障产品质量源头。
2. 生产工艺控制建立并严格执行标准的生产工艺流程,确保产品的稳定性和一致性。
乳酸左氧氟沙星注射液质量标准

乳酸左氧氟沙星注射液质量标准乳酸左氧氟沙星注射液质量标准在医疗领域中,药物质量标准是极为重要的,它直接关系到病人的生命安全。
乳酸左氧氟沙星注射液作为一种抗菌药物,其质量标准更是需要严格把关。
在这篇文章中,我们将深入探讨乳酸左氧氟沙星注射液质量标准的相关知识,以及对其个人观点和理解。
1. 乳酸左氧氟沙星注射液的基本概念乳酸左氧氟沙星注射液是一种广谱抗菌药物,对革兰氏阳性菌和阴性菌均有良好的抑制作用。
它常用于严重感染的治疗,比如呼吸道感染、腹膜腔内感染等。
因其治疗效果显著,逐渐成为临床上的常用药物。
然而,药物的质量标准与否直接关系到其疗效和安全性,下面我们将就乳酸左氧氟沙星注射液的质量标准进行更深入的探讨。
2. 乳酸左氧氟沙星注射液质量标准的相关要求根据国家药典规定,乳酸左氧氟沙星注射液的质量标准应包括外观、溶解度、PH值、有关物质、细菌菌落总数、霉菌和酵母菌数量等多个方面。
这些方面的严格要求是确保药物质量的重要保障。
外观的清澈透明度直接关系到药物的纯净度;PH值的稳定性则关系到药物的稳定性和安全性。
这些标准的制定对于确保药物的质量至关重要。
药品生产企业也要严格按照这些标准进行生产,确保每一批药物都符合规定的质量标准。
3. 我的观点和理解在我看来,药物质量标准的制定和执行是至关重要的。
特别是对于像乳酸左氧氟沙星注射液这样的抗菌药物,其质量标准更应该得到严格的执行。
只有在确保药物质量的前提下,才能保证病人的用药安全和疗效。
相关部门应该加强对药物质量标准的监督和检查,确保其真正得到执行。
药品生产企业也应该加强自身的质量管理,确保生产的药物能够达到规定的质量标准,保障病人的用药安全。
4. 总结通过对乳酸左氧氟沙星注射液质量标准的探讨,我们可以看到,药物质量标准的重要性不言而喻。
只有通过严格的质量标准,才能保证药物的疗效和安全性。
我们也要高度重视药品生产企业自身的质量管理,确保药物质量标准得到有效执行。
希望在未来的医疗领域中,相关部门和企业能够更加重视药物质量标准,共同为病人的用药安全保驾护航。
左氧氟沙星质量标准

左氧氟沙星质量标准左氧氟沙星是一种广谱抗生素,常用于治疗呼吸道、泌尿道、肠道和皮肤软组织感染。
作为一种重要的药物,左氧氟沙星的质量标准显得尤为重要。
质量标准是评价药物质量优劣的重要标准,合理的质量标准可以保证药物的疗效和安全性,因此,左氧氟沙星的质量标准应受到重视。
首先,左氧氟沙星的理化性质是确定其质量标准的重要依据。
理化性质包括外观、溶解性、熔点、纯度等指标,这些指标直接关系到药物的质量。
例如,左氧氟沙星的外观应为白色或类白色结晶性粉末,溶于水,几乎不溶于乙醇。
此外,左氧氟沙星的熔点、纯度也是质量标准的重要指标。
只有合格的理化性质,才能保证药物的质量。
其次,左氧氟沙星的药效和安全性是质量标准的核心内容。
药效和安全性是药物的基本属性,直接关系到患者的治疗效果和用药安全。
因此,左氧氟沙星的质量标准应包括对药效和安全性的要求。
药效方面,左氧氟沙星应具有较强的抗菌活性,对感染病原体有较好的杀菌作用。
安全性方面,左氧氟沙星应具有较低的毒副作用,对人体的损害较小。
只有具备良好的药效和安全性,才能保证左氧氟沙星的质量标准。
最后,左氧氟沙星的生产工艺和质量控制是保证质量标准的重要保障。
生产工艺直接关系到药物的质量,合理的生产工艺可以保证药物的稳定性和纯度。
质量控制是对生产过程中各个环节的监控,包括原料药的采购、生产工艺的控制、成品药的检验等。
只有严格执行生产工艺和质量控制要求,才能保证左氧氟沙星的质量标准。
综上所述,左氧氟沙星的质量标准是一个综合性的评价体系,包括理化性质、药效和安全性、生产工艺和质量控制等多个方面。
只有全面考虑,合理确定质量标准,才能保证左氧氟沙星的质量,为患者的治疗提供有效的保障。
希望生产企业和监管部门能够加强对左氧氟沙星质量标准的管理,共同维护药物市场的良好秩序,保障患者的用药安全和疗效。
氧氟沙星注射液质量标准

氧氟沙星注射液质量标准氧氟沙星注射液是一种广泛应用于临床的抗菌药物,具有广谱、强效、耐受性好等特点。
为了确保氧氟沙星注射液的质量安全,保障患者用药的有效性和安全性,制定了相应的质量标准。
一、外观和性状。
氧氟沙星注射液应为无色或微黄色透明液体,无异物悬浮物和沉淀物,有特有的氟味。
在光线下应无色淡黄色沉淀。
二、主要成分。
氧氟沙星注射液的主要成分是氧氟沙星,其化学名称为(6S)-6-氟-1-[(2S)-2-环丙基]-7-(3-氨基-1-环丙基)-1,4-二氢喹啉-4-酮。
每支注射液含有氧氟沙星200mg。
三、规格。
氧氟沙星注射液的规格为每支2ml,每盒10支。
四、质量控制。
1. 氧氟沙星注射液的生产应符合《药品生产质量管理规范》中有关注射剂的相关要求。
2. 原料药应符合国家药典规定的质量标准,严格把关原料药的采购和质量控制。
3. 生产过程中应严格按照标准操作规程进行,确保生产过程的严谨和规范。
4. 对成品进行严格的质量检验,确保每批产品符合国家药典规定的质量标准。
五、贮存。
氧氟沙星注射液应存放在阴凉干燥处,避免阳光直射。
贮存期内,应避免冻结和高温,保持温度在15-25摄氏度之间。
六、包装。
氧氟沙星注射液应采用无菌玻璃制品包装,每支注射液应独立包装,包装完好,无破损。
七、使用。
使用氧氟沙星注射液前应先检查包装是否完好,观察外观和性状是否符合要求。
使用时应严格按照医嘱用药,避免过量使用或长期使用。
八、注意事项。
1. 使用氧氟沙星注射液时,应注意过敏史和禁忌症,避免不必要的风险。
2. 使用过程中如出现不良反应,应及时就医并停止使用氧氟沙星注射液。
总结,氧氟沙星注射液作为一种重要的抗菌药物,在临床应用中具有重要意义。
为了确保其质量安全和有效性,制定了相应的质量标准,包括外观和性状、主要成分、规格、质量控制、贮存、包装、使用和注意事项等方面。
只有严格按照这些标准要求进行生产、贮存和使用,才能保证患者用药的安全有效。
氧氟沙星 USP32

氧氟沙星OfloxacinC18H20FN3O4 361.38(±)-9-氟-2,3-二氢-3-甲基-10-(4-甲基-哌嗪)-7-氧-7H-吡哆[1,2,3- 去]-1,4-苯并恶嗪-6-羧酸 [82419-36-1]氧氟沙星按干燥品计算,C18H20FN3O4含量应为98.5% ~101.5%。
包装与贮藏:密封避光25℃保存;允许温度偏差15℃~30℃。
美国药典参比标准品<11>_——USP氧氟沙星参比标准品。
USP氧氟沙星有关物质A参比标准品鉴别——A: 红外吸收 <197K>。
B:紫外吸收 <197U> -溶液:6.7µg /mL。
介质:0.1N盐酸。
比旋度<781S>:+1°至 -1°之间。
供试溶液:10 mg/ mL,氯仿溶液。
干燥失重<731> ——在105°下干燥4小时:减失的重量不大于0.2%。
炽灼残渣<281> :不得超过0.1%。
砷,方法Ⅱ <211> :1 µg/g。
重金属,方法Ⅱ <231>: 0.001%。
色谱纯度——稀释液—水和乙腈(6:1)的混合液流动相——将4.0g醋酸铵和7.0g高氯酸钠溶解于1300ml水中,用磷酸调节pH值至2.2,混合均匀。
准备过滤,脱气过的此混合液和240ml乙腈。
可根据需要调整(见色谱<621> 中系统适应性)。
系统适应性标准溶液——取10.0mg USP氧氟沙星有关物质A参比标准品和10.0mg USP氧氟沙星对照品到100ml容量瓶, 稀释液溶解稀释,用稀释液稀释10.0ml此溶液到50.0ml,用稀释液稀释1.0ml此溶液到50.0ml。
标准溶液——精确称量USP氧氟沙星对照品,溶解于稀释液中,配制成约0.0004 mg/ ml的溶液。
供试溶液——精确称量本品,溶解于稀释液中,配制成约0.2 mg/ ml的溶液。
氧氟沙星检验记录
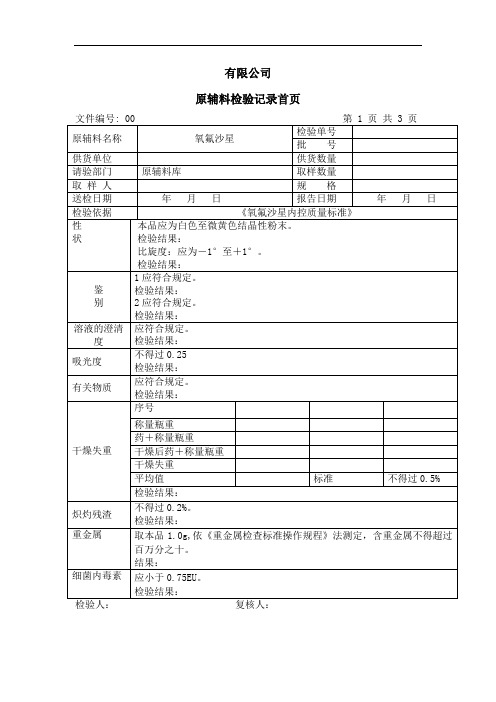
1、溶液的澄清度 应符合规定规定
2、 吸光度 不得过0.25规定
3、有关物质 应符合规定规定
4、干燥失重 不得过0.5%规定
5、炽灼残渣 不得过0.2%规定
6、重金属 应符合规定规定
7、细菌内毒素 应小于0.75EU规定
(4)含量测定:
按干燥品计,含氧氟沙星
不得少于98.5%。规定
检验结论: 本品按<<氧氟沙星内控质量标准>>检验,结果
结果:
细菌内毒素
应小于0.75EU。
检验结果:
检验人: 复核人:
有限公司
原辅料检验记录附页
文件编号: 00 第 2 页 共 3 页
含量测定: 氧氟沙星 室温 ℃ 湿度 %
滴定液名称:高氯酸滴定液 标示浓度 mol/L 实际浓度 mol/L
主要
仪器
名 称
型 号
精 度
狭缝宽度
测定用波长
编 号
分 析 天 平
按干燥品计,样品的含量X(%)
含 量 平 均 值(%)பைடு நூலகம்
A-B
相对偏差×100%
A+B
标准规定:按干燥品计算,含氧氟沙星不得少于98.5%.
项目结论:
检验结论:本品按《氧氟沙星内控质量标准》检验,结果规定。
备注
复核人: 检验人:
有限公司
原辅料检验记录报告单
文件编号: 00 第 3 页 共 3 页
原辅料名称
有限公司
原辅料检验记录首页
文件编号: 00第 1 页 共 3 页
原辅料名称
氧氟沙星
检验单号
批 号
供货单位
供货数量
请验部门
原辅料库
氧氟沙星溶液工艺规程

氧氟沙星溶液工艺规程一、目的:规定了氧氟沙星溶液(酸性)的生产操作全过程。
二、范围:适用于氧氟沙星溶液(酸性)生产操作。
三、责任人:生产部负责人、质管部负责人、工艺员、QA监督员、操作工人。
四、内容:目录1.产品概述 (3)2.处方和依据 (3)3.生产工艺流程 (4)4.工艺过程及条件 (6)5.设备一览表及主要设备生产能力 (12)6.技术安全、工艺卫生及劳动保护 (12)7.技术经济指标计算及消耗定额 (14)8.原辅材料质量标准与检验操作规程 (15)9.成品、半成品的质量标准与检验操作规程 (15)10.质量控制要点 (16)11.附页(供修改时登记批准日期、文号和内容用) (16)一、产品概述氧氟沙星溶液(酸性),是喹诺酮类抗菌消炎药,辅以特定的增效剂和延效剂,可直接进入病原菌细胞内,干扰细菌DNA的合成,同时破坏细胞膜,导致细胞内容物外溢,使细菌迅速死亡。
它对支原体、革兰氏阴性菌和革兰氏阳性菌均有强大的杀灭作用。
适用于禽大肠杆菌病、急慢性呼吸道病、传染性鼻炎、霍乱、葡萄球菌病,蛋鸡腹膜炎、卵管炎及家畜肺炎、菌痢、萎缩性鼻炎、喘气病等的治疗。
(详情见表1)表1:氧氟沙星溶液(酸性)概况二、处方和依据1、处方氧氟沙星8kg冰醋酸适量纯化水加至200L2、依据氧氟沙星溶液(酸性)内控质量标准(文件编码:GM-ZG-N07-004-01)三、生产工艺流程1、工艺简介将氧氟沙星溶解在适宜溶媒中,经配液罐搅拌均匀,检验含量、pH值合格后,钛棒过滤器过滤,过滤后药液从管道打入灌封室进行灌装、上塞,经旋盖、灭菌、灯检、贴签、包装后入库待验区存放,检验合格后移入合格区。
2、工艺流程图及环境区域划分(见图1、图2)四、工艺过程及条件1、领料工序1.1工艺控制点1.1.1 只有质管部门批准放行的原料方可领料使用。
1.1.2 称量所用衡器使用前应校正。
1.1.3领料时应根据氧氟沙星的实际含量进行换算,按处方量的100%领料,且一个称量,一个复核,并签名。
氧氟沙星质量控制

【关键词】氧氟沙星;耳用滴丸;正交实验;一阶导数光谱法;聚乙二醇(PEG) [摘要]目的:制备氧氟沙星耳用滴丸。
方法:以成型率及重量合格率作为评价指标,对滴头及冷凝液的温度、贮药槽药液高度、滴距4因素进行正交试验并确定其最佳成型工艺。
一阶导数光谱法测定氧氟沙星主要的含量。
结果:最佳成型工艺为贮药槽药液高度3 cm、滴头温度80 ℃、滴距5 cm、冷凝液温度15 ℃。
氧氟沙星溶液在302 nm波长处紫外吸收一阶导数光谱,振幅值(H)和氧氟沙星浓度(C)有线性关系:C=229.398 1H-0.120 8,r=0.999 8(n=6);平均回收率为100.73%,RSD=0.80%(n=3)。
结论:该制剂制备工艺简单、稳定性好,质量控制方法简易、快速、可行。
[关键词]氧氟沙星;耳用滴丸;正交实验;一阶导数光谱法;聚乙二醇(PEG)The Preparation of Ofloxacin Ear Drop PillsW ANG Rongjun,An Yiguo(Anhui Provincial Friendship Hospital,Hefei, Anhui 230011,China)Abstract:Objective The preparation of ofloxacin ear drop pills.Methods Parallel tests were conducted on the rate of qualified shape and the rate of qualified weight as the index of evaluation,the orthogonal test was conducted on the 4 factors,including the temperature of drops and the liquor condensate,the drug height in the drug storage tank and the dropping distance,accordingly the optimum forming technics were selected.The content of ofloxacin of main drug was determined with the first order derivative spectrophotometry.Results The optimum forming technics could be seen as follows,the height of the drug storage tank was 3 cm,the temperature of drops was 80 ℃,the dropping distance was 5 cm and the temperature of the liquor condensate was 15 ℃.The concentration (C) of ofloxacin had a linear relationship with the first order derivative UVabsorbance spectorphotometry high (H) in 302 nm:C=229.398 1H0.120 8,r=0.999 8(n=6);The average rate of recovery was 100.73% and RSD was 0.80%(n=3).Conclusion The preparation is simple in preparation,good in stability;and the quality control method is simple and easy,rapid,accurate and feasible.Key words:Ofloxacin;Ear drop pills;Orthogonal test;The first order derivative spectorphotometry;Polyglycol(PEG)氧氟沙星是第3代喹诺酮类药物,具有抗菌谱广、高效、低毒等优点。
甲磺酸左氧氟沙星质量标准

甲磺酸左氧氟沙星质量标准甲磺酸左氧氟沙星是一种广谱抗生素,常用于治疗感染疾病。
为了确保药物质量的稳定和安全性,制定和遵守质量标准是至关重要的。
本文将介绍甲磺酸左氧氟沙星的质量标准,并阐述其相关要求。
1. 总述甲磺酸左氧氟沙星的质量标准是根据国家法规和药品标准制定的。
质量标准规定了药物的理化性质、纯度、微生物限度、残留溶剂、重金属含量等指标,以确保药物的质量稳定和安全性。
2. 外观性状甲磺酸左氧氟沙星应当为白色或类白色结晶性粉末,无异味。
在质量标准中规定了药物外观的要求,例如颜色、形状、气味等,以保证其可辨识性和一致性。
3. 理化性质甲磺酸左氧氟沙星的质量标准对其理化性质进行了详细规定。
其中包括药物的溶解性、比旋光度、熔点、红外光谱等指标。
这些性质的测定有助于确保药物的纯度和稳定性。
4. 纯度甲磺酸左氧氟沙星的质量标准要求药物纯度达到一定的要求。
常规的纯度检测方法包括高效液相色谱法、气相色谱法和红外光谱法等。
这些方法可以检测杂质的存在和含量,确保药物的纯度满足相关要求。
5. 微生物限度药物的微生物限度是衡量其是否符合规定标准的重要指标之一。
甲磺酸左氧氟沙星的质量标准规定了其细菌总数、大肠杆菌、黄金色葡萄球菌等微生物的限度要求。
这些限度值的设定有助于确保药物在使用过程中不引起细菌感染。
6. 残留溶剂甲磺酸左氧氟沙星的质量标准还规定了药物中残留有机溶剂的限度。
相关的溶剂包括甲苯、二氯甲烷、乙醇等。
质量标准对这些溶剂的含量做出了严格的规定,以确保药物的安全性和无毒性。
7. 重金属含量质量标准还要求测定药物中重金属的含量,如铅、砷、汞等。
重金属是一类有毒物质,其超标可能对人体健康造成严重危害。
因此,质量标准针对这些重金属设定了限度值,以确保药物的安全性。
8. 不合格品处理质量标准中也规定了对不合规药物的处理办法。
如果甲磺酸左氧氟沙星的理化性质、纯度、微生物限度等指标超出质量标准规定的范围,该批次药物视为不合格品,需要根据相关法规和标准进行处理,以保障患者用药安全。
氧氟沙星注射液质量
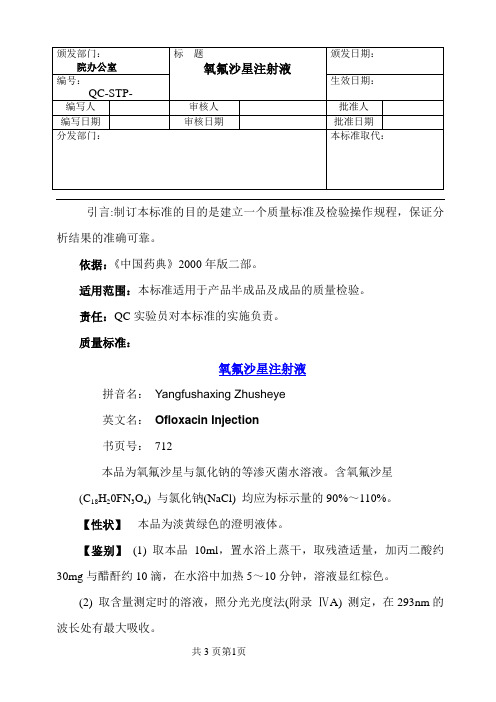
引言:制订本标准的目的是建立一个质量标准及检验操作规程,保证分析结果的准确可靠。
依据:《中国药典》2000年版二部。
适用范围:本标准适用于产品半成品及成品的质量检验。
责任:QC实验员对本标准的实施负责。
质量标准:氧氟沙星注射液拼音名:Yangfushaxing Zhusheye英文名:Ofloxacin Injection书页号:712本品为氧氟沙星与氯化钠的等渗灭菌水溶液。
含氧氟沙星(C18H20FN3O4) 与氯化钠(NaCl) 均应为标示量的90%~110%。
【性状】本品为淡黄绿色的澄明液体。
【鉴别】(1) 取本品10ml,置水浴上蒸干,取残渣适量,加丙二酸约30mg与醋酐约10滴,在水浴中加热5~10分钟,溶液显红棕色。
(2) 取含量测定时的溶液,照分光光度法(附录ⅣA) 测定,在293nm的波长处有最大吸收。
(3) 鉴别(1) 项下遗留的残渣显有机氟化物的鉴别反应(附录Ⅲ)。
(4)本品显钠盐与氯化物的鉴别反应(附录Ⅲ)。
【检查】pH值应为4.5~6.0(附录ⅥH)。
颜色取本品,照分光光度法(附录ⅣA),在450nm的波长处测定吸收度,不得过0.03。
有关物质重金属取本品20ml,置水浴上蒸干,残渣依法检查(附录ⅦH第二法),含重金属不得过千万分之十。
不溶性微粒取本品1瓶,依法检查(附录ⅨC),应符合规定。
热原取本品,依法检查(附录ⅪD),剂量按家兔体重每1kg注射10ml (相当于每1kg20mg),应符合规定。
无菌取本品,用薄膜过滤法处理后,依法检查(附录ⅪH),应符合规定。
其它应符合注射剂项下有关的各项规定(附录ⅠB)。
【含量测定】氯化钠精密量取本品2ml,加铬酸钾指示液1滴,用0.1mol/L的硝酸银滴定液滴至淡砖红色,应耗3.18ml。
氧氟沙星精密量取本品2ml,于50ml容量瓶中,加盐酸(9→1000ml)至刻度,摇匀,精密量取5ml,于50ml容量瓶中,加盐酸(9→1000ml)至刻度,摇匀,照分光光度法(附录ⅣA),在293nm的波长处测定吸收度,应为0.734。
氧氟沙星质量标准

氧氟沙星YangfushaxingOfloxacinC18H20FN3O4 361.38本品为(±)-9-氟-2,3-二氢-3-甲基-10-(4-甲基-1-哌嗪基)-7-氧代-7H-吡啶并[ 1,2,3-de]-[1,4]苯并噁嗪-6-羧酸。
按干燥品计算,含C18H20FN3O4不得少于98.5%。
【性状】本品为白色或微黄色结晶性粉末;无臭、味苦;遇光渐变色。
本品在氯仿中略溶,在甲醇中微溶,在冰醋酸中易溶,在稀酸及0.1mol/L 氢氧化钠溶液中略溶。
比旋度取本品,精密称定,加三氯甲烷溶解并定量制成每1ml中约含10mg 的溶液,依法测定(附录ⅥE),比旋度为-1°至+1°。
【鉴别】(1)取本品适量,加0.1mol/L盐酸溶液制成每1ml中约含0.12mg的溶液,作为供试品溶液,另取氧氟沙星对照品适量,同法制备,作为对照品溶液。
照有关物质项下的色谱条件,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)本品的红外光吸收图谱应与对照的图谱(光谱集1003图)一致。
【检查】溶液的澄清度取本品5份,各0.5g,加氢氧化钠试液10ml溶解后,溶液应澄清;如显浑浊,与2号浊度标准液(附录Ⅸ B)比较,不得更浓。
吸光度取本品0.1g,加氢氧化钠试液10ml溶解后,照紫外-可见分光光度法(附录Ⅳ A),在450nm的波长处测定吸收度,不得过0.25。
有关物质取本品适量,精密称定,加0.1mol/L盐酸溶液溶解并制成每1ml 中含1.2mg的溶液,作为供试品溶液;精密量取适量,加0.1mol/L盐酸溶液稀释成每1ml中含2.4μg的溶液,作为对照溶液。
照高效液相色谱法(附录Ⅴ D)测定,用十八烷基硅烷键合硅胶为填充剂;以醋酸铵高氯酸钠溶液(取醋酸铵4.0g和高氯酸钠7.0g,加水1300ml使溶解,用磷酸调节PH值至2.2)-乙腈(85:15)为流动相;检测波长为294nm。
诺氟沙星注射液标准

诺氟沙星注射液标准一、范围本标准适用于诺氟沙星注射液的质量控制。
二、参考文献1. 中国药典(年份)二部2. 国家药品注册标准三、质量要求1. 外观:注射液应为无色或微黄色透明液体。
2. PH值:应在4.0~6.0之间。
3. 注射液的含量:每支注射液的诺氟沙星含量应在标签上标明,并符合药品注册标准的要求。
4. 储存稳定性:注射液在15-30°C的条件下应保持稳定,不出现明显的析出、变色等现象。
四、检测方法1. 外观检查:通过肉眼观察注射液的外观以判断其是否满足要求。
2. PH值测定:使用适当的仪器或试剂,按照中国药典或相关国家标准中的方法进行测定。
3. 含量测定:使用高效液相色谱法(HPLC)或紫外分光光度法,按照中国药典或相关国家标准中的方法进行测定。
4. 储存稳定性测试:将注射液在15-30°C的条件下保存一定时间,观察是否出现明显的析出、变色等现象。
五、批准文件1. 生产批记录:包括生产工艺和操作记录,确保生产过程符合标准要求。
2. 质量控制记录:包括外观检查、PH值测定、含量测定和储存稳定性测试结果,确保产品符合质量要求。
六、灭菌和包装1. 注射液应经过有效的灭菌处理,并采用符合相关国家标准的无菌包装材料进行包装。
七、存储和运输1. 注射液应存放在干燥、通风、避光的环境中,远离有害气体和火源。
2. 注射液在运输过程中应避免受到明显的震动和温度变化。
八、保质期1. 注射液的保质期应在标签上标明,并符合药品注册标准的要求。
九、备注1. 本标准中的相关检测方法和要求应根据具体情况进行调整和加强,以确保产品质量的稳定性和安全性。
以上内容仅为参考,具体的诺氟沙星注射液标准应根据实际情况进行制定和调整。
氧氟沙星检验操作规程

GMP管理文件一.目的:为规定氧氟沙星的检查方法和操作要求,特制定此标准。
二.适用范围:适用于本公司氧氟沙星的质量检测。
三.责任者:检验员四.正文【检品名称】氧氟沙星【引用标准】氧氟沙星内控质量标准【使用仪器】电位滴定仪高效液相色谱仪【操作内容】【性状】本品为白色至微黄色结晶性粉末;无臭、味苦;遇光渐变色。
本品在三氯甲烷中略溶,在甲醇中微溶,在冰醋酸中易溶,在稀盐酸或0.1mol/L氢氧化钠溶液中略溶。
比旋度取本品,精密称定,加三氯甲烷溶解并定量制成每1ml含10mg的溶液,依法测定,比旋度应为-1°至+1°。
【鉴别】(1)取本品适量,加0.1mol/L盐酸溶液制成每1ml中约含0.12mg的溶液,作为供试品溶液。
照有关物质项下的色谱条件,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)本品的红外光吸收图谱应与对照的图谱一致。
【检查】溶液的澄清度取本品5份,各0.5g,加氢氧化钠试液10ml溶解后,溶液应澄清;如显浑浊,与2号浊度标准液比较,均不得更深。
吸光度取本品0.1g,加氢氧化钠试液10ml溶解后,照紫外-可见分光光度法,在450nm的波长处测定吸光度,不得过0.25。
有关物质取本品适量,精密称定,加0.1mol/L盐酸溶液溶解并制成每1ml中含1.2mg的溶液,作为供试品溶液;精密量取适量,加0.1mol/L盐酸溶液稀释制成每1ml中含2.4ug的溶液,作为对照品溶液,照高效液相色谱法测定,用十八烷基硅烷键合硅胶为填充剂;以醋酸铵高氯酸钠溶液-乙腈(85:15)为流动相,检测波长为294nm。
取氧氟沙星适量,用0.1mol/L 盐酸溶液溶解并稀释制成,每1ml中约含1mg的溶液,置紫外光灯下照射4小时以上,取10ul注入液相色谱仪,理论板数按氧氟沙星峰计算不低于5000,紧邻氧氟沙星峰前的杂质峰与氧氟沙星的分离度应符合要求,取对照溶液10ul注入液相色谱仪,调节测试灵敏度,使主成分色谱峰的峰高为满量程的20%~25%,精密量取供试品溶液与对照品溶液个10ul,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的2.5倍。
氧氟沙星注射液(成品)检验操作规程

GMP管理文件一、目的:为规定氧氟沙星注射液生产过程中的质量控制和检验操作要求,特制定此操作规程。
二、适用范围:适用于氧氟沙星注射液成品的检验。
三、责任者:生产部经理、检验员、生产人员四、正文:质量标准:见氧氟沙星注射液(成品)内控质量标准操作内容:【性状】本品为淡黄色或淡黄绿色澄明液体一。
【鉴别】(1)取本品适量(约相当于氧氟沙星20mg),置水浴上蒸干,加丙二酸30mg,加醋酐约10滴,置沸水浴上加热3分钟,显红棕色。
(2)取本品适量,加0.1mol/l盐酸溶液制成每1ml中含氧氟沙星10mg的溶液,作为供试品溶液;另取氧氟沙星对照品适量,加0.1mol/l盐酸溶液制成每1ml中含10mg的溶液,作为对照品溶液。
照薄层色谱法试验,吸取上述两种溶液各5ul,分别点于同一硅胶GF254薄层板上,以氯仿-甲醇-氨溶液(4→100)(10:5:1)为展开剂,展开后,晾干,置紫外光灯(254nm)下检视,供试品溶液所显主斑点的颜色和位置应与对照品溶液的主斑点相同。
(3)取含量测定项下的溶液,照分光光度法测定,在294nm波长处有最大吸收。
【检查】 PH值应为3.6~4.9。
颜色取本品,加水稀释成每1ml中含2mg的溶液,与黄色5号或黄绿色5号标准比色液比较,不得更深。
热原取本品,加灭菌注射用水制成每1ml中含氧氟沙星10mg的溶液,依法检查,剂量按家兔每1kg体重注射2ml,应符合规定。
其他应符合注射剂项下有关的各项规定。
【含量测定】精密量取本品适量(约相当于氧氟水沙星60mg),置200ml量瓶中,加0.1mol/l盐溶液稀释至刻度,摇匀;精密量取2ml,置100ml量瓶中,用0.1mol/l盐酸溶液稀释至刻度,摇匀,照分光光度法,在294nm波长处测定吸收度;另取在105℃干燥至恒重的氧氟沙星对照品约60mg,同法测定;计算,即得。
氧氟沙星溶液(碱性)成品质量标准
双峰动物药业有限公司质量标准2.适用范围:氧氟沙星可溶性的质量验收3.有关责任:质量部4.正文:本品为氧氟沙星的水溶液。
含氧氟沙星(C18H20FN3O4)应为标示量的90.0%~110.0%。
【性状】本品为淡黄色澄明液体。
【鉴别】(1)取本品1ml,置分液漏斗中,加氯仿10mL,充分振摇,静置,取氯仿层置水浴上蒸干,加丙二酸约30mg与醋酐0.5ml,在80~90℃置水浴中加热5~10分钟,显红棕色。
(2)取本品适量(约相当于氧氟沙星40mg),置分液漏斗中,加氯仿10mL,充分振摇,静置,分取氯仿层,作为供试品溶液;另取氧氟沙星对照品,加氯仿制成每1mL中含4mg的溶液,作为对照品溶液。
照薄层色谱法(附录23页)测定,吸取上述两种溶液各5µL,分别点于同一硅胶GF254薄层板上,以氯仿-甲醇-氨溶液(4-100)(10:5:1)为展开剂,展开后,晾干,置紫外光灯(254nm)下检视,供试品溶液所显主斑点的颜色和位置应与对照品溶液的主斑点一致。
(3)取含量测定项下的溶液,照分光光度法(附录17页)测定,在293nm波长处有最大吸收。
【检查】pH值应为9.0~11.0(附录40页)。
装量按最低装量检查法(附录67页)检查,应符合规定。
【含量测定】精密量取本品质量(约相当于氧氟沙星50mg),置250ml量瓶中,加0.1mol/L 盐酸溶液稀释至刻度,摇匀;精密量取2mL,置100mL量瓶中,加0.1mol/L盐酸溶液稀释至刻度,摇匀,分光光度法(附录17页),在293nm波长处测定吸收度;另取氧氟水星对照品约80mg,同法测定;计算,即得。
【作用与用途】同氧氟沙星片【用法与用量】混饮每1L水鸡1025~2.5mL 每日2次连用3~5天【停药期】28日,产蛋鸡禁用【规格】100mL:4g【贮藏】遮光,密闭保存。
5.依据:2003版《中华人民共和国兽药典》一部。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
双峰动物药业有限公司
质量标准
2.适用范围:氧氟沙星可溶性的质量验收
3.有关责任:质量部
4.正文:
本品为氧氟沙星的水溶液。
含氧氟沙星(C18H20FN3O4)应为标示量的90.0%~110.0%。
【性状】本品为淡黄色澄明液体。
【鉴别】(1)取本品1ml,置分液漏斗中,加氯仿10mL,充分振摇,静置,取氯仿层置水浴上蒸干,加丙二酸约30mg与醋酐0.5ml,在80~90℃置水浴中加热5~10分钟,显红棕色。
(2)取本品适量(约相当于氧氟沙星40mg),置分液漏斗中,加氯仿10mL,充分振摇,静置,分取氯仿层,作为供试品溶液;另取氧氟沙星对照品,加氯仿制成每1mL中含4mg的溶液,作为对照品溶液。
照薄层色谱法(附录23页)测定,吸取上述两种溶液各5µL,分别点于同一硅胶GF254薄层板上,以氯仿-甲醇-氨溶液(4-100)(10:5:1)为展开剂,展开后,晾干,置紫外光灯(254nm)下检视,供试品溶液所显主斑点的颜色和位置应与对照品溶液的主斑点一致。
(3)取含量测定项下的溶液,照分光光度法(附录17页)测定,在293nm波长处有最大吸收。
【检查】pH值应为9.0~11.0(附录40页)。
装量按最低装量检查法(附录67页)检查,应符合规定。
【含量测定】精密量取本品质量(约相当于氧氟沙星50mg),置250ml量瓶中,加0.1mol/L 盐酸溶液稀释至刻度,摇匀;精密量取2mL,置100mL量瓶中,加0.1mol/L盐酸溶液稀释至刻度,摇匀,分光光度法(附录17页),在293nm波长处测定吸收度;另取氧氟水星对照品约80mg,同法测定;计算,即得。
【作用与用途】同氧氟沙星片
【用法与用量】混饮每1L水鸡1025~2.5mL 每日2次连用3~5天
【停药期】28日,产蛋鸡禁用
【规格】100mL:4g
【贮藏】遮光,密闭保存。
5.依据:2003版《中华人民共和国兽药典》一部。
