imagej对SDSPAGE灰度分析定量蛋白浓度
磷酸化wb灰度值 -回复

磷酸化wb灰度值-回复磷酸化(wb)是一种重要的细胞蛋白质修饰形式。
它在信号转导通路中起着关键作用,调控细胞的生长、分化、凋亡以及代谢等多个生物学过程。
磷酸化的水平可以通过测定蛋白质的灰度值来评估,该方法被广泛应用于研究领域。
本文将一步步解释磷酸化wb灰度值的原理、操作步骤以及数据分析等方面,希望能帮助读者全面了解这一技术的基本知识和应用。
一、磷酸化wb灰度值的原理在细胞内,蛋白质的活性和功能往往受到磷酸化修饰的影响。
磷酸化可以改变蛋白质的电荷、构象和结合能力,进而影响其相互作用和进入信号通路的能力。
为了研究蛋白质的磷酸化水平,磷酸化wb实验是常用的方法之一。
该实验通过免疫印迹技术检测目标蛋白质的磷酸化状态,并利用灰度值反映其相对表达水平。
二、磷酸化wb灰度值的操作步骤1. 样本处理:根据实验需求,选择适当的细胞系或动物模型,并进行特定刺激或处理。
例如,可以在细胞培养基中添加某种激素或药物,或者通过基因敲除或过表达等方法改变目标蛋白的磷酸化水平。
2. 蛋白质提取:采用适当的溶解缓冲液(如RIPA缓冲液)释放细胞内的蛋白质。
加入蛋白酶抑制剂和磷酸酶抑制剂,防止蛋白质的降解和磷酸化的去除。
3. 蛋白质定量:使用BCA或Bradford等方法测定蛋白质的浓度,以确保在相同负荷量的情况下进行免疫印迹。
4. SDS-PAGE电泳:将样品加入SDS-PAGE胶,经过电泳分离蛋白质。
根据目标蛋白质的大小选择相应的胶浓度和电泳时间。
5. 转膜:将分离的蛋白质转移到聚丙烯酰胺(PVDF)或硝酸纤维素(NC)膜上,选择适当的电压和时间进行转膜。
6. 蛋白质检测:使用目标蛋白质和相应的磷酸修饰抗体进行免疫印迹。
根据需要,可以同时检测非磷酸化形式的蛋白质及其它细胞信号通路的分子标记物。
7. 显色和成像:使用HRP(辣根过氧化物酶)或AP(碱性磷酸酶)标记的二抗与目标蛋白质和抗体结合后,添加相应的显色底物。
使用分子成像系统拍摄图片。
雷帕霉素增强RSL3对睾丸癌细胞I-10的增殖、侵袭与迁移的抑制作用

睾丸癌是青年人群中最常见的恶性肿瘤[1]。
西方国家发病率在过去20年中上升,手术和以顺铂为基础的化学疗法的结合使得睾丸癌患者的治愈率大于90%[2]。
尽管如此,10%~20%患有转移性疾病的睾丸癌患者不能通过基于顺铂的化疗治愈[3]。
因此,探索治疗睾丸肿瘤的新方法具有研究价值。
铁死亡是一种铁依赖形式的非凋亡细胞死亡,其特征是脂质ROS 的积累[4]。
在细胞和小鼠中进行的遗传学研究确定硒酶谷胱甘肽过氧化物酶(GPX4)是这种形式的细胞死亡的关键调节因子。
GPX4将脂质氢过氧化物转化为脂质醇,这一过程阻止了铁(Fe 2+)依赖的有毒脂质活性氧(ROS )的形成。
GPX4功能的抑制导致脂质过氧化,并可诱导铁死亡[5,6]。
近年来,人们在设计和开发基于铁死亡诱导的抗癌药物方面做了大量工作,在癌症治疗中引入铁死亡具有很好的治疗潜力[7]。
RSL3是一种常用的铁死亡诱导剂,通过抑制谷胱甘肽Rapamycin enhances inhibitory effect of RSL3on proliferation,invasion and migration of testicular cancer I-10cells in vitroLI Bin,WANG Yue,HOU Fengwei,DU Jiaru,TONG XuhuiSchool of Pharmacy,Bengbu Medical College,Anhui Provincial Engineering Research Center for Biochemical Pharmaceuticals,Bengbu 233030,China摘要:目的探究雷帕霉素增强RSL3对睾丸癌细胞I-10的增殖、侵袭与迁移能力的抑制作用。
方法MTT 法检测RSL3(Type II )及合用雷帕霉素(RAPA )作用后I-10细胞的存活率。
将RSL3(0~16μmol/L )分别以及联合16μmol/L 雷帕霉素作用于睾丸癌细胞I-10,采用MTT 法检测I-10细胞增殖抑制情况,利用集落克隆形成实验检测细胞增殖能力,采用划痕实验和Transwell 小室检测I-10细胞的迁移与侵袭能力,采用流式细胞术检测I-10细胞的脂质活性氧水平,采用GSH 和MDA 检测试剂盒检测细胞中GSH 和MDA 含量,利用Western blot 检测细胞GPX4蛋白表达。
用imagej进行WB定量分析

ImagJ是一款简单的图像处理与分析软件,可以用来进行WB定量分析。
一、利用ImagJ对WB条带进行灰度分析1、File——》open 打开WB片子2、把图片转化成灰度图片image——》type——》8-bit3、消除背景影响process——》subtract background 选择50基本可以4、设置定量参数analyze——》set measurements,点击面积,平均密度和灰度值及Integrated Density 5、设置单位analyze——》set scale ,在“unit of length”的方框里输入“pixels”6、把图片转换成亮带,Edit——》invert7、选择FreehandSelection,尽量把条带圈起来,点击键盘m,出来IntDen灰度值当测定完所有条带,选结果中的“Edit ”的“SelectAll”,然后复制数据“IntDen”到Excel表即可进行分析8、复制数据IntDen进行分析二、利用ImagJ对WB条带进行密度分析1、File——》open 打开WB片子2、如条带不正,需修正image——》transform——》rotate调节angle值,直到条带水平为止3、选中矩形选项,圈中第一个条带,然后 analyze——》gels——》select firstlane(快捷键ctrl+1),然后移动第一个条带上的矩形到第二个条带上,analyze——》gels——》select secondlane(快捷键 ctrl+2),最后analyze——》gels——》plotlanes4、选中直线工具,将开口的波峰关闭5、选中魔棒工具,点击波峰可以显示波峰下面积,即条带的密度值6、以第一个数值为基数,其他数值与第一个数值的比值为相对密度The protocol of imageJ for quantitative analysis of Western blotting:- open an image- transfer the image to 8-bitsimage → type: 8 bits- Process → substract background 50- analyze → set measurements: pick area, mean gray value, inte grated density. - analyze → set scale, fill “unit of length” with “pixels”- switch the image to bright bandsedit → invert- freehand selection, choose the target area on the image . a band), type a “m” for measurement, then we get the result from a new window.- after measuring all of the bands, pick the “edit” of the result window. “select all”, copy the integrated density values to excel to analyze.The integrated density means that the area value multiplies the mean gray value. For Western blotting analysis the integrated density is very important, because the area and gray value both of them have meaning for Western blotting bands.。
ImagJWB定量分析

一、利用ImagJ对WB条带进行灰度分析1、File——》open 打开WB片子2、把图片转化成灰度图片image——》type——》8-bit3、消除背景影响process——》subtract background 选择50基本可以4、设置定量参数analyze——》set measurements,点击面积,平均密度和灰度值及Integrated Density5、设置单位analyze——》set scale ,在“unit of length”的方框里输入“pixels”6、把图片转换成亮带,Edit——》invert7、选择FreehandSelection,尽量把条带圈起来,点击键盘m(小写),出来IntDen灰度值8、复制数据IntDen进行分析二、利用ImagJ对WB条带进行密度分析1、File——》open 打开WB片子2、如条带不正,需修正image——》transform——》rotate调节angle值,直到条带水平为止3、选中矩形选项,圈中第一个条带,然后analyze——》gels——》select firstlane(快捷键ctrl+1),然后移动第一个条带上的矩形到第二个条带上,analyze——》gels——》select second lane(快捷键ctrl+2),最后analyze——》gels——》plotlanes4、选中直线工具,将开口的波峰关闭5、选中魔棒工具,点击波峰可以显示波峰下面积,即条带的密度值6、以第一个数值为基数,其他数值与第一个数值的比值为相对密度*/link?url=iFFzpXWQu3ULvbjcoe0ME-Oi1oVTR3ANKR6xYvQXfMPUjK3Re5lnNI2kRpSadvUdXUPUr9 zJvJau9y3P4ZyoMxZR8ghHwpvUJeqRj1vn5Ty*如果有数据产生,一般是批量多次western blot结果的一个统计数据一般采取方差分析或者t检验分析就可以了*纵坐标我看文献上是用的检测蛋白的灰度值比上内参的灰度值。
SDS-PAGE法测定蛋白质分子量实验

SDS-PAGE电泳测定蛋白质相对分子质量实验目的:1. 了解SDS-PAGE垂直板型电泳法的基本原理及操作技术。
2. 学习并掌握SDS-PAGE法测定蛋白质相对分子量的技术。
实验原理SDS-PAGE电泳法,即十二烷基硫酸钠—聚丙烯酰胺凝胶电泳法。
1.在蛋白质混合样品中各蛋白质组分的迁移率主要取决于分子大小和形状以及所带电荷多少。
在聚丙烯酰胺凝胶系统中,SDS(十二烷基硫酸钠,sodium dodecyl sulfatc)是一种很强的阴离子表面活性剂,它以其疏水基和蛋白质分子的疏水区相结合,形成牢固的带负电荷的SDS一蛋白质复合物。
SDS和蛋白质的结合是高密度的,其重量比通常为1.4:1, 由于这种高密度的结合,新引入的净电荷远远超过蛋白质分子原有的净电荷,从而消除或极大地降低了不同蛋白质分子之间原有净电荷的差异即消除了由于各种蛋白质所带净电荷的不同对电泳迁移率的影响;SDS-蛋白质复合物具有均一的电荷密度、相同的荷质比。
据流体力学等方面的研究推测,SDS-蛋白质复合物呈紧密的椭圆形或棒状结构,棒的短轴恒定,与蛋白质种类无关,棒长轴变化,与蛋白质分子量成正比。
SDS和蛋白质结合后所形成的SDS-蛋白质复合物,消除了由于天然蛋白质分子形状的不同对电泳迁移率的影响。
根据上面的分析,SDS和蛋白质结合后使其电泳迁移率仅取决于蛋白质分子量的大小,因而可以通过比较未知分子量的蛋白质和已知分子量的蛋白质分子的迁移率,测定出未知蛋白质的分子量。
12. 当蛋白质的分子量在15kb~200kb之间时,电泳迁移率与分子量的对数值呈直线关系,符合下列方程:log Mr = K ― b*mR式中:Mr为蛋白质的分子量;K为常数;b为斜率;m为相对迁移率。
在条件一R定时,b和K均为常数。
若将已知分子量的标准蛋白质的迁移率对分子量的对数作图,可获得一条标准曲线。
未知蛋白质在相同条件下进行电泳,根据它的电泳迁移率即可在标准曲线上求得分子量。
SDS-PAGE检测蛋白质含量

百泰派克生物科技
SDS-PAGE检测蛋白质含量
蛋白质含量鉴定是蛋白质组学研究中的重要内容,也是进行某些后续分析的前提,如进行差异蛋白的筛选前就必须对蛋白的含量进行精确的鉴定。
目前鉴定蛋白质含量的方法主要有经典的凯氏定氮法、考马斯亮蓝法、双缩脲法、紫外吸收法以及新发展起来的基于质谱的方法等。
SDS-PAGE十二烷基磺酸钠聚丙烯酰胺凝胶电泳是基于蛋白质分子质量进行蛋白分离的分析技术。
根据蛋白质的分子质量将其分离为不同的蛋白条带,常用于蛋白质的分子质量和纯度鉴定。
另外,基于蛋白质电泳条带的宽度可以对蛋白质的含量多少进行粗略的估计,若蛋白条带较宽、颜色较深,则说明该蛋白的量较多;反之,则说明其含量较少。
SDS-PAGE只能对蛋白含量的多少进行粗略的估计,不能计算出其准确的值,若要精确计算某个蛋白质的含量,需要将蛋白胶条中包含的蛋白质回收,利用其它技术如质谱技术进行后续精确鉴定。
百泰派克生物科技使用Bio-Rad Mini-PROTEAN® Tetra凝胶系统以及Thermo公司最新推出的Obitrap Fusion Lumos质谱仪,结合nanoLC-MS/MS纳升色谱,提供基于SDS-PAGE和质谱的蛋白质定量分析服务技术包裹,可对各种蛋白样品进行高分辨率和高质量精准度的含量鉴定,欢迎免费咨询。
2021年SDSPAGE测定蛋白质相对分子质量实验报告

SDS-PAGE测定蛋白质相对分子质量一、序言聚丙烯酰胺凝胶电泳聚丙烯酰胺凝胶电泳, 简称PAGE, 是以聚丙烯酰胺凝胶作为支持介质一个常见电泳技术。
聚丙烯酰胺凝胶由单体丙烯酰胺和甲叉双丙烯酰胺聚合而成, 聚合过程由自由基催化完成。
催化聚合常见方法有两种:化学聚正当和光聚正当。
化学聚合以过硫酸铵(APS)为催化剂, 以四甲基乙二胺(TEMED)为加速剂。
在聚合过程中, TEMED催化过硫酸铵产生自由基, 后者引发丙烯酰胺单体聚合, 同时甲叉双丙烯酰胺与丙烯酰胺链间产生甲叉键交联, 从而形成三维网状结构。
PAGE依据其有没有浓缩效应, 分为连续系统和不连续系统两大类, 连续系统电泳体系中缓冲液pH值及凝胶浓度相同, 带电颗粒在电场作用下, 关键靠电荷和分子筛效应。
不连续系统中因为缓冲液离子成份, pH, 凝胶浓度及电位梯度不连续性, 带电颗粒在电场中泳动不仅有电荷效应, 分子筛效应, 还含有浓缩效应, 所以其分离条带清楚度及分辨率均较前者佳。
不连续体系由电极缓冲液、浓缩胶及分离胶所组成。
浓缩胶是由AP催化聚合而成大孔胶, 凝胶缓冲液为pH6.7Tris-HCl。
分离胶是由AP催化聚合而成小孔胶, 凝胶缓冲液为pH8.9 Tris-HCl。
电极缓冲液是pH8.3 Tris-甘氨酸缓冲液。
2种孔径凝胶、2种缓冲体系、3种pH值使不连续体系形成了凝胶孔径、pH 值、缓冲液离子成份不连续性, 这是样品浓缩关键原因。
SDS是阴离子去污剂, 作为变性剂和助溶试剂, 它能断裂分子内和分子间氢键, 使分子去折叠, 破坏蛋白分子二、三级结构。
而强还原剂如巯基乙醇, 二硫苏糖醇能使半胱氨酸残基间二硫键断裂。
在样品和凝胶中加入还原剂和SDS后, 分子被解聚成多肽链, 解聚后氨基酸侧链和SDS结合成蛋白- SDS胶束, 所带负电荷大大超出了蛋白原有电荷量, 这么就消除了不一样分子间电荷差异和结构差异。
SDS-PAGE通常采取是不连续缓冲系统, 与连续缓冲系统相比, 能够有较高分辨率。
蛋白灰度分析软件使用精品课件

•
15、一个人炫耀什么,说明他内心缺 少什么 。。202 0年9月 上午9 时58分2 0.9.220 9:58Se ptembe r 22, 2020
•
16、业余生活要有意义,不要越轨。2 020年9 月22日 星期二 9时58 分43秒0 9:58:43 22 September 2020
图),保存为TIFF 格式文件。
最新 PPT
5
2. Image-Pro Plus 打开文件,剔除背景:
(1) 放大镜放大目的区域
最新 PPT
6
(2) Measure---calibration---intensity---options----image,选择 背景最大value 值------ok-------ok----system----close
•
17、一个人即使已登上顶峰,也仍要 自强不 息。上 午9时58 分43秒 上午9 时58分0 9:58:43 20.9.22
谢谢大家
最新 PPT
14
最新 PPT
7
最新 PPT
8
(3)Measure---count/size---measure---select measurements,选择IOD 为测量值, 调整结果显示方式:Options-label style 改为mesurement,选择IOD 为显示值。
最新 PPT
9
(4)接下来有2 种方法选择目的蛋白区域(即找出AOI, area of interest, IPP 核心元件):魔棒和手绘轨迹法。
• ⅱ.等高线-手绘选取目的区域测定法:通过等高线或手绘选取目 的蛋白区域,最简便,但重复性不太好。
SDSPAGE测量蛋白质分子量解析

20-30 15-20 10-15 5-10
2-5
10-20 5-10 2-2.5
5%
10%
15%
200
200
200
97
97
66
97
66
66
45
45
29 29
45
29
迁 移
A
率
B
5 7 9 11 13 15 T%
凝胶浓度T对样品迁移率的影响
例:混合蛋白质A,B,A分子量较小,B分子带电荷较多,T=5% 时,电泳行为主要以电荷起作用,B 迁移速度快。当 T 增加,分 子筛效应增加,B的迁移速度减慢;T= 9 %时,A,B的迁移率 相同,不能分开,T 再增加,凝胶孔径更小,A分子比B分子小, 表现较高的迁移率。并且说明电泳只获得单一的带时,并不能证 明是单一的均一成分。
支持介质-聚丙烯酰胺凝胶
聚合原理:
单体丙烯酰胺Acr
交联剂N,N-甲叉双丙烯酰胺Bis
化学聚合
光聚合
引发剂 加速剂
(NH4)2S2O8 TEMED
(NH4)2S2O8 DMAPN
核黄素 TEMED
注: (NH4)2S2O8
TEMED
过硫酸胺在凝胶形成中提供始自由基,通过自由基的传递, 使丙烯酰胺 成为自由基,发动聚合反应 N,N,N,N-四甲基乙二胺
4.上样。 15μl/孔
5.电泳
上槽接负极,下槽接正极,打开电泳仪开关,开始时 将电流调至10mA,待样品进入分离胶时,将电流调 至20-30mA。待指示剂染料靠迁移至下沿1~1.5cm 处停止电泳,需2~3h。
6.凝胶板剥离与染色:电泳结束后,撬开玻璃板,将凝 胶板做好标记后放在大培养皿内,将凝胶放入0.05% 考马斯亮蓝R250(内含20%磺基水杨酸)染色液中,
磷酸化wb灰度值 -回复

磷酸化wb灰度值-回复磷酸化(Phosphorylation) 是生物体内一种常见的化学修饰过程,通过在蛋白质、酶和其他细胞内分子上添加磷酸基团,以控制它们的活性、功能和相互作用。
在细胞信号转导、代谢调节、细胞周期调控以及细胞凋亡等过程中,磷酸化都发挥着关键的作用。
WB (Western Blot) 是一种常用的免疫学技术,用于检测特定蛋白质的存在、表达量和化学修饰状态。
灰度值是指在数字图像处理中,表示像素亮度级别的数值。
本文将详细介绍磷酸化在WB 实验中灰度值的解读方法和意义。
步骤一:WB 实验WB 实验是一种常用的蛋白质定性和定量分析方法。
首先,将要研究的细胞或组织样本进行蛋白质提取,并用SDS-PAGE (聚丙烯酰胺凝胶电泳) 将蛋白质按分子量分离。
然后,将分离得到的蛋白质迁移至氮化纤维膜,形成蛋白质点斑。
接下来,通过特定的抗体标记物结合到目标蛋白质上,并用化学荧光或酶的催化作用产生信号。
最后,使用显影方法获取图像,观察和分析蛋白质的表达和化学修饰状态。
步骤二:灰度值测定在WB 实验中,获取到的图像通常是黑白的,像素的亮度级别通过灰度值来表示。
灰度值一般在0-255范围内,0表示黑色,255表示白色。
要测定特定蛋白质的磷酸化程度,通常需要用特定的抗体来探测该蛋白质及其磷酸化状态。
抗体结合的位置会在图像上产生一个明显的点斑。
使用图像分析软件,比如ImageJ,可以对图像进行灰度值的测定和分析。
首先,在软件中打开WB图像,通过调整对比度和亮度来使图像清晰,并将尺寸标定为已知的像素距离。
然后,使用者可以用光标选择感兴趣的区域(ROI),通常是蛋白质点斑的位置。
在软件上,将鼠标点击的点斑区域标记,并获取该区域的灰度值。
步骤三:磷酸化的灰度值解读磷酸化的程度可以通过磷酸化蛋白质的灰度值来表示。
灰度值越高,表明磷酸化程度越高,蛋白质的活性可能受到更强的调控。
比较不同样本之间的磷酸化程度时,可以计算相对灰度值(Normalized Gray Value),通过除以一个对照样本的灰度值来纠正可能的变异性。
如何测定图像的灰度信息

如何测定(cèdìng)图像的灰度信息ImageJ是一款小巧(xiǎoqiǎo)开放的图像分析软件,可以从其官方网站上免费下载。
下面就对如何利用ImageJ进行图像测量作一简单(jiǎndān)介绍:1、从文件菜单(cài dān)打开你要测量的图像。
2、从工具菜单选择(xuǎnzé)选择矩形工具(rectangular)、椭圆工具(ellipitcal)、多边形工具(polygon)或自定义形状(freehand)等工具。
3、选择(xu ǎnz é)矩形(j ǔx íng)工具时,移动鼠标至需要测量的位置(w èi zhi)1,按下左键不放,拖动至测量位置2松开鼠标。
在分析(analyze )菜单下,选择测量命令(measure )或按ctrl+M 完成测量,长度单位是像素(xi àn ɡ s ù),常用的参数是面积、周长、直径、积分光密度等(下同(xi àt óng))。
rectangularpolygonal freehandelliptical位置1位置24、如果(rúguǒ)选择的是椭圆(tuǒyuán)工具(gōngjù)时,在位置1按下鼠标移动至合适(héshì)的位置(wèi zhi)松开鼠标即可,按上面的步骤测量,操作见下图。
位置5、如果(rúguǒ)选择的是多边形工具时,在位置(wèi zhi)1按下鼠标沿轨迹(guǐjì)移动至要改变方向的位置2,点击(diǎn jī)鼠标,再移至位置3,点击(diǎn jī)鼠标,……,至终点位置1,单击鼠标完成选定,按步骤3方法进行测量。
6、如果(rúguǒ)选择的是手写工具则,在位置1点鼠标不松开,然后按希望的轨迹移动,然后回到目标位置1与初始(chū shǐ)点闭合松开鼠标即可,然后按3方法进行测量。
干货▎ImageJ分析WesternBlot蛋白条带灰度值

干货▎ImageJ分析WesternBlot蛋白条带灰度值聊点学术,一键关注“你已经是个成熟的条带了,要学会自己分析!”“连Western blot都没学好,又让我学Image J,我......”This is the dividing line.Image J分析蛋白条带灰度值首先解释一下,为什么要分析灰度值?灰度的概念是使用黑色调表示物体,即用黑色为基准色,不同的饱和度的黑色来显示图像。
采用ECL发光时,蛋白条带发出的荧光会曝光在胶片上,留下的黑色条带。
然而胶片扫描后为蓝色背景、黑色条带,这并不是单纯的黑灰白颜色。
因此,我们首先得在Photoshop 中将整张图片去色,使彩色图片变成黑白图片,形成近灰色背景、黑色条带的图片类型。
此时,条带的深浅和面积综合代表着蛋白的量。
灰度值分析自然就成为我们的首选。
延伸说一下,免疫组织化学染色(IHC)结果本身为近白色背景、棕黄色阳性表达,这时我们就不能直接用灰度反映阳性表达强弱了,而是积分吸光度,也就是咱们常说的平均光密度(IOD)。
如果你真的想用灰度计算IHC结果,显然你需要将图片转为灰度图再计算。
此处不表。
分析图文步骤如下:Image J软件界面↓1. 图片转换为黑白图:首先使用Photoshop打开胶片扫描图片,点击“图像>调整>去色”,将彩色图片转化为黑白图片,并使用裁剪工具将目标条带裁剪至合适大小后另存图片。
2.打开Image J软件:2.1.打开图片文件:File>Open;将图片转化为8bit类型:Image>Type>8-bit。
(此步骤的目的是为了将图片的每个像素用8bit表示,这样的话,整个图片的灰度将分为256个级别,即黑、灰、白的像素模式;若保留原始的16bit格式或RGB格式,图片灰度级别会呈指数增长,并有其它颜色混入,造成计算误差。
)2.2.将整张图片背景灰度均一化,消除图片背景影响:Process>Subtract Background,默认数值为50即可。
你真的用ImageJ测到了WB条带灰度值吗?

你真的用ImageJ测到了WB条带灰度值吗?关于用Image J量化westernblot条带灰度值,在网上一直盛传着两种操作方法,然鹅~小伙伴们却一直不确定到底哪种才是正确的测量灰度方法,甚至将灰度与光密度弄混淆。
今天咱们一起就这个机会学习下,请先看看你是用以下那种方法测量灰度值?以下是两种方法的具体操作。
方法一1、打开Image J软件→左上角file→Open 选择自己的条带图片(事先把条带摆正)2、把图片转化成灰度图片:Image→type→8-bit3、第一个矩形工具→选上所有条带4、analyze→Gels→select first lane→Gels→plot lanes(在这第四步也可以分开选取,如:框选第一个条带→analyze→Gels→select firstlane→将第一个框拖移到余下条带→Gels→select nextlane)5、选中直线工具,将开口波峰关闭6、选中魔棒工具(正数第七个),点击波峰,就得出所有area 值。
方法二1、打开Image J软件→左上角file→Open 选择自己的条带图片(事先把条带弄正)2、把图片转化成灰度图片:Image→type→8-bit3、扣除背景:Process→Subtract Background→50pixels 并勾选Light Background5、设定参数:Analyze→set measurement→勾选Area、Mean gray value、Min & max gray value、Integrated density6、Analyze→set scale→unit of length选项里改为pixels,确定6、图像分割。
Edit→Invert→选中椭圆圈(手残党首选)/不规则圆圈(心灵手巧党义无反顾),手动圈上单个条带7、Analyze→Measurement即得到Intden,重复6、7步就得到所有Intden值小伙伴们,你们是哪种方法呢?首先先把结论说出来,其实两者得出的area和Intden严格来说都不是灰度值,前者是面积而后者是光密度值,但用来量化WB条带都是OK的。
(完整版)SDS-PAGE检测蛋白质纯度

SDS-PAGE检测蛋白质纯度1.电泳的基本原理许多生物分子都带有电荷,其电荷的多少取决于分子性质及其所在介质的pH及其组成。
由于混合物中各组分所带电荷性质、电荷数量以及分子量的不同,在同一电场的作用下,各组分泳动的方向和速度也各异,因此,在一定时间内,由于各组分移动距离的不同,而达到分离鉴定各组分的目的。
2.影响电泳的主要因素2.1 电泳介质的pH当介质的pH等于某种两性物质的等电点时,该物质处于等电状态,即不向正极或负极移动。
当介质pH小于其等电点时,则呈正离子状态,移向负极;反之,介质pH大于其等电点时,则呈负离子状态,移向正极。
因此,任何一种两性物质的混合物电泳均受介质pH的影响,即决定两性物质的带电状态及其量,为了保持介质pH的稳定性,常用一定pH的缓冲液,如分离血清蛋白质常用pH8.6的巴比妥或三羟甲基氨基甲烷(Tris)缓冲液。
2.2 缓冲液的离子强度离子强度对电泳的影响是:离子强度低,电泳速度快,分离区带不易清晰;离子强度高,电泳速度慢,但区带分离清晰。
如离子强度过低,缓冲液的缓冲量小,不易维持pH的恒定;离子强度过高,则降低蛋白质的带电量(压缩双电层)使电脉速度减慢。
所以常用离子强度为0.02-0.2之间。
2.3 电场强度电场强度和电泳速度成正比关系。
电场强度以每厘米的电势差计算,也称电势梯度。
如纸电泳的滤纸长15cm,两端电压(电势差)为150V,则电场强度为150/15=10V/cm,电场强度愈高,则带电粒子的移动愈快。
电压增加,相应电流也增大,电流过大时易产生热效应可使蛋白质变性而不能分离。
2.4 电渗作用在电场中,液体对固体的相对移动,称为电渗。
如滤纸中含有表面带负电荷的羧基,溶液则向负极移动。
由于电渗现象与电泳同时存在,所以电泳的粒子移动距离也受电渗影响,如纸上电泳蛋白质移动的方向与电渗现象相反,则实际上蛋白质泳动的距离,等于电泳移动距离减去电渗距离。
如电泳方向和电渗方向一致,其蛋白质移动距离,等于二者相加。
image j对SDS-PAGE灰度分析定量蛋白浓度

朱伟伟 20180319
SDS-PAGE图像,可以用相机或光密度扫描仪成像,作为标准样品的蛋 白最好和待测蛋白的条带大小一致,用Bradford的方法测得标样的浓 度,然后把标样的浓度调成300μg/ml。
每个泳道对应的数值为点样体积( μl ),制备所有样品的时候蛋白 溶液和2*loading buffer的体积比均为1:1
5、单击anቤተ መጻሕፍቲ ባይዱlyze—set measurements出现 下图界面,勾选Area和mean gray value单 击OK。
7、选好条带以后按住Ctrl+m出 现一个文本,如上图所示;然后 把鼠标移到黄色方框的中心,按 住鼠标,把方框拖到下一个条带, 然后按Ctrl+m,文本中出现第二 条带的面积和平均灰度值;以此 类推。
8、新建一个Excel,把文 本框内的数据复制到表格, 计算绝对灰度=255-灰度 平均值,同时标出点样体 积。理论上,标样的绝对 灰度值的比值和点样体积 比值是相等的,我们可以 选择绝对灰度比值和体积 比最接近的一对数据,如 红色框内数据。
4、方框工具选择并 画出第一条永道,单 击analyze—gels— select first lane也可以 用快捷键(Ctrl+1)
4、方框工具选择并 画出第一条永道。单 击analyze—gels— select first lane也可以 用快捷键(Ctrl+1), 会出现左图界面,点 击OK,并在图上画出 第一条条带。
注意事项: 一般用SDS-PAGE灰度分析的方法检测蛋白浓度,其上样量不宜过大,条 带太黑容易过曝,导致定量结果不准确,检测结果会小于实际的蛋白浓 度。
内质网应激观察实验报告

一、实验背景内质网是真核生物细胞内的重要细胞器,负责蛋白质的合成、折叠、修饰和运输等功能。
在正常生理条件下,内质网能够有效处理和折叠蛋白质,维持细胞内环境的稳定。
然而,在特定条件下,如蛋白质合成过多、蛋白质折叠错误或内质网功能异常等,会导致内质网内未折叠或错误折叠蛋白质的积累,从而引发内质网应激(endoplasmic reticulum stress,ERS)。
本研究旨在通过观察内质网应激现象,探讨其与细胞损伤、疾病发生的关系。
二、实验材料与方法1. 实验材料细胞系:HEK293细胞试剂:内质网应激相关抗体(如GRP78、IRE1α、PERK等)、细胞裂解液、Western blot试剂盒等2. 实验方法(1)细胞培养:将HEK293细胞接种于培养瓶中,在37℃、5%CO2的细胞培养箱中培养至对数生长期。
(2)处理细胞:将细胞分为正常对照组和内质网应激组。
内质网应激组采用化学诱导剂(如氧化剂、糖基化剂等)或基因沉默等方法诱导内质网应激。
(3)细胞裂解:收集细胞,用细胞裂解液裂解细胞,提取细胞总蛋白。
(4)Western blot检测:将提取的细胞总蛋白进行SDS-PAGE电泳,转膜后用内质网应激相关抗体进行免疫印迹检测。
(5)数据分析:采用ImageJ软件对Western blot结果进行分析,计算目的蛋白与内参蛋白的灰度值比值,进行定量分析。
三、实验结果1. 内质网应激诱导蛋白表达变化Western blot结果显示,内质网应激组细胞中GRP78、IRE1α、PERK等内质网应激相关蛋白的表达水平显著高于正常对照组(P<0.05)。
2. 内质网应激与细胞损伤通过观察细胞形态变化,发现内质网应激组细胞出现细胞膜皱缩、细胞核变形等损伤现象,提示内质网应激可导致细胞损伤。
3. 内质网应激与疾病发生进一步研究发现,内质网应激与多种疾病的发生密切相关。
如糖尿病、心血管疾病、神经退行性疾病等。
在疾病模型中,内质网应激现象普遍存在,提示内质网应激可能成为疾病治疗的新靶点。
使用image J软件测定westernblot 结果的操作方法
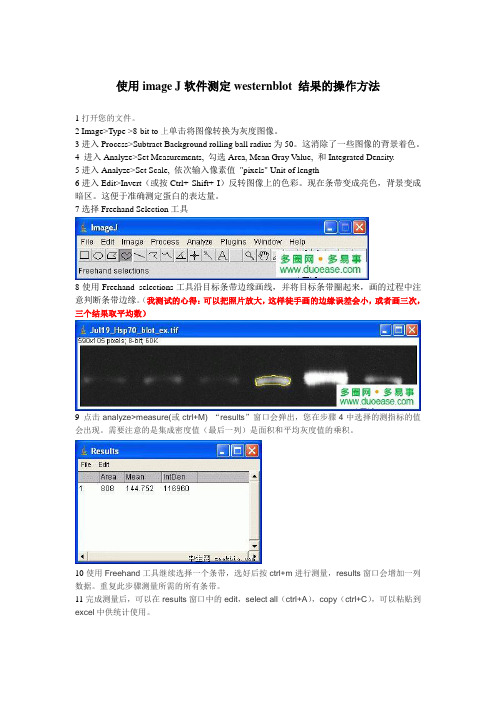
使用image J软件测定westernblot 结果的操作方法1打开您的文件。
2 Image>Type >8-bit to上单击将图像转换为灰度图像。
3进入Process>Subtract Background rolling ball radius为50。
这消除了一些图像的背景着色。
4 进入Analyze>Set Measurements, 勾选Area, Mean Gray V alue, 和Integrated Density.5进入Analyze>Set Scale, 依次输入像素值"pixels" Unit of length6进入Edit>Invert(或按Ctrl+ Shift+ I)反转图像上的色彩。
现在条带变成亮色,背景变成暗区。
这便于准确测定蛋白的表达量。
7选择Freehand Selection工具8使用Freehand selections工具沿目标条带边缘画线,并将目标条带圈起来,画的过程中注意判断条带边缘。
(我测试的心得:可以把照片放大,这样徒手画的边缘误差会小,或者画三次,三个结果取平均数)9点击analyze>measure(或ctrl+M) “results”窗口会弹出,您在步骤4中选择的测指标的值会出现。
需要注意的是集成密度值(最后一列)是面积和平均灰度值的乘积。
10使用Freehand工具继续选择一个条带,选好后按ctrl+m进行测量,results窗口会增加一列数据。
重复此步骤测量所需的所有条带。
11完成测量后,可以在results窗口中的edit,select all(ctrl+A),copy(ctrl+C),可以粘贴到excel中供统计使用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4、方框工具选择并
画出第一条永道,单 击analyze—gels— select first lane也可以 用快捷键(Ctrl+1)
4、方框工具选择并
画出第一永道。单 击analyze—gels— select first lane也可以 用快捷键(Ctrl+1),
会出现左图界面,点 击OK,并在图上画出 第一条条带。
Image j对SDS-PAGE灰度分析定 量蛋白浓度
朱伟伟 20180319
SDS-PAGE图像,可以用相机或光密度扫描仪成像,作为标准样品的蛋 白最好和待测蛋白的条带大小一致,用Bradford的方法测得标样的浓 度,然后把标样的浓度调成300μg/ml。
每个泳道对应的数值为点样体积( μl ),制备所有样品的时候蛋白 溶液和2*loading buffer的体积比均为1:1
5、单击analyze—set measurements出现 下图界面,勾选Area和mean gray value单 击OK。
7、选好条带以后按住Ctrl+m出 现一个文本,如上图所示;然后 把鼠标移到黄色方框的中心,按 住鼠标,把方框拖到下一个条带, 然后按Ctrl+m,文本中出现第二 条带的面积和平均灰度值;以此 类推。
注意事项: 一般用SDS-PAGE灰度分析的方法检测蛋白浓度,其上样量不宜过大,条 带太黑容易过曝,导致定量结果不准确,检测结果会小于实际的蛋白浓 度。
1、打开image j 把SDSPAGE图片拖到红色箭头 所指区域。
2、单击image—Type— 8-bit转换成灰度图像。
3、单击process—subtract background会出现左图的界 面,勾选light background和 preview,选择合适的像素 值,在此一30.0pixels为例, 单击OK。
8、新建一个Excel,把文 本框内的数据复制到表格, 计算绝对灰度=255-灰度 平均值,同时标出点样体 积。理论上,标样的绝对 灰度值的比值和点样体积 比值是相等的,我们可以 选择绝对灰度比值和体积 比最接近的一对数据,如 红色框内数据。
