三草酸合铁酸钾的制备讲义
三草酸合铁酸钾的制备及组成

2滴0.5mol/L CaCl2
③检定Fe3+: 少量0.2mol/L FeCl3于试管中 少量产品溶液于试管中
1滴1mol/L KSCN
3 定量分析
3.1高锰酸钾溶液的配制(0.02mol/L 400mL)
KMnO4
烧杯 盖表面皿
加热至沸并保持30min 保持水量
冷却
棕色瓶
暗处放置7天
3.1.2配制0.02mol/L Na2C2O4 溶液250.0mL 3.1.3 KMnO4溶液的标定
C2O42
m :m Fe3
C2O24
55.8 88.0
: Fe3
C2O24
55.8 88.0
四、实验步骤
1 合成
莫尔盐 5.0g
烧杯内 100mL H2O
加热溶液
10mL 氨水 6mol/L
滴加15mL 6% H2O2 约20分钟
取5滴上清液至试管中,滴加 K3[Fe(CN)6]检验是否氧化完全
25.00mL Na2C2O4
40mL 水 锥形瓶
10mL 3mol/L H2SO4
加热至75-85 ℃ (瓶口开始冒热气)
KMnO4滴定 平行3次
计算KMnO4浓度
温 度:75~850C
标定条件
酸 度:cH+:0.5-0.1mol.L-1
滴定速度:慢
快
慢
滴定终点:自身指示,30s不退色
(2) 组分含量的测定
搅拌 40 ℃ 水浴加热
红棕色
煮沸并搅拌 10分钟以上
静置
倾去上清液
沉淀中加入100mL水 搅拌、加热、洗涤沉淀
50mL热水洗沉淀
抽滤
Fe(OH)3沉淀
三草酸合铁III酸钾制备及组成分析

03
三草酸合铁(III)酸钾的性 质研究
物理性质
晶体结构
三草酸合铁(III)酸钾具有特定的晶体结构,由铁 离子、草酸根离子和钾离子组成。
溶解性
三草酸合铁(III)酸钾易溶于水,也溶于乙醇,不 溶于乙醚。
颜色与外观
三草酸合铁(III)酸钾呈现深绿色粉末或晶体。
化学性质
稳定性
三草酸合铁(III)酸钾在常温 下稳定,但在高温或光照 条件下易分解。
污水处理
三草酸合铁(III)酸钾可以用于污水处理,通过化学沉淀等 方法去除水中的有害物质。
THANKS FOR WATCHING
感谢您的观看
制备方法
沉淀法
将铁(III)盐和草酸盐按照一定比例混合,加入氧化剂,加热搅拌至溶解,再加 入沉淀剂(如乙醇)使铁(III)草酸盐沉淀析出。
溶剂萃取法
利用不同溶剂对铁(III)草酸盐的溶解度不同,通过萃取分离得到纯度较高的三草 酸合铁(III)酸钾。
实验步骤
配料与溶解
按照配方比例称取铁(III)盐和草酸盐, 加入适量的水溶解。
05
三草酸合铁(III)酸钾的合 成产物表征
产物形貌
产物形貌分析
通过扫描电子显微镜(SEM)观察三 草酸合铁(III)酸钾的微观形貌,可以发 现其呈现出规则的晶体结构,表面光 滑,无明显缺陷。
产物的粒径分布
采用激光粒度仪测定三草酸合铁(III)酸 钾的粒径分布,结果显示产物粒径均 匀,主要分布在几十纳米至几百纳米 之间。
01
三草酸合铁(III)酸钾的制 备
原料选择
01
02
03
铁(III)盐
选择纯度高、杂质少的铁 (III)盐作为原料,如硫酸 铁、硝酸铁等。
无机化学实验3三草酸合铁酸钾的制备和性质
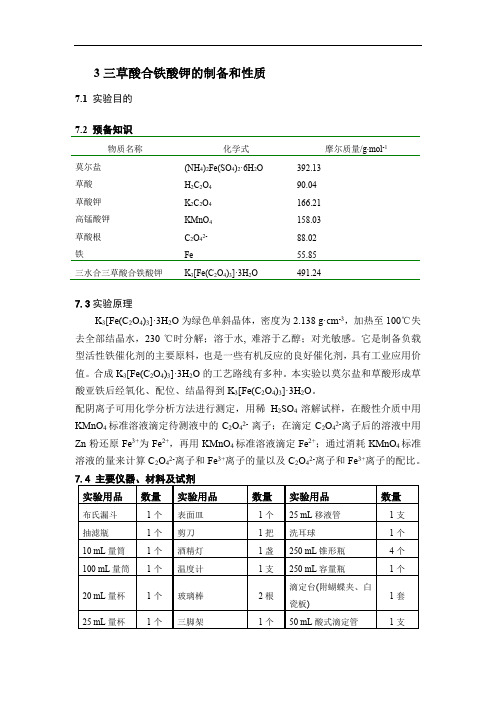
3三草酸合铁酸钾的制备和性质7.1 实验目的7.2 预备知识物质名称化学式摩尔质量/g∙mol-1莫尔盐(NH4)2Fe(SO4)2·6H2O392.13草酸H2C2O490.04草酸钾K2C2O4166.21高锰酸钾KMnO4158.03草酸根C2O42- 88.02铁Fe55.85三水合三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O491.247.3实验原理K3[Fe(C2O4)3]·3H2O为绿色单斜晶体,密度为2.138 g·cm-3,加热至100℃失去全部结晶水,230 ℃时分解;溶于水, 难溶于乙醇;对光敏感。
它是制备负载型活性铁催化剂的主要原料,也是一些有机反应的良好催化剂,具有工业应用价值。
合成K3[Fe(C2O4)3]·3H2O的工艺路线有多种。
本实验以莫尔盐和草酸形成草酸亚铁后经氧化、配位、结晶得到K3[Fe(C2O4)3]·3H2O。
配阴离子可用化学分析方法进行测定,用稀H2SO4溶解试样,在酸性介质中用KMnO4标准溶液滴定待测液中的C2O42-离子;在滴定C2O42-离子后的溶液中用Zn粉还原Fe3+为Fe2+,再用KMnO4标准溶液滴定Fe2+;通过消耗KMnO4标准溶液的量来计算C2O42-离子和Fe3+离子的量以及C2O42-离子和Fe3+离子的配比。
公用仪器、材料、试剂试剂名称位置试剂名称位置(NH4)2Fe(SO4)2·6H2O本实验桌Zn粉(A.R)本实验桌饱和草酸钾溶液本实验桌去离子水中间实验桌饱和草酸溶液本实验桌无水乙醇本实验桌标准浓度KMnO4溶液中间实验桌灯用酒精中间实验桌小纸条本实验桌及分析天平室真空系统实验桌正前上方冰块实验室临时提供称量纸本实验桌电子台秤(0.01g)本实验桌乙醇-丙酮1:1本实验桌H2O2 (w=5%)本实验桌水浴锅(用于分析)两人共用1套(本实验桌)注:实验结束后多余的产品回收到实验室指定的容器中。
实验三 合成三草酸合铁酸钾优选PPT文档

合成三草酸合铁(III)酸钾的工艺路线有多种。 1. 以铁为原料制得硫酸亚铁铵,加草酸钾制得草酸亚
铁后经氧化制得三草酸合铁(III)酸钾。
2. 以硫酸铁与草酸钾为原料直接合成三草酸合铁(III) 酸钾。
3. 以三氯化铁与草酸钾直接合成三草酸合铁(III)酸钾。
三、实验内容
1.溶解 在上述溶液中加入1mol L-1H2C2O420mL,搅拌并加热煮沸,使形成FeC2O4 2H2O黄色沉淀,。 在托盘天平上称取一定量的自制硫酸亚铁铵,置于250mL烧 实验三 合成三草酸合铁(III)酸钾
2 4 2 综合训练无机合成、滴定分析的基本操作,掌握确定化合物组成的原理和方法。
在上述溶液中加入1mol L-1H2C2O420mL,搅拌并加热煮沸,使形成FeC2O4 2H2O黄色沉淀,。 在上述沉淀中加入饱和K2C2O4溶液,水浴加热至40oC,滴加3% H2O2溶液,使Fe(II)充分氧化为Fe(III)。
的pH值保持在4~5,此时溶液呈翠绿色,趁热过滤 在以滤铁液 为中原加料入制乙得醇硫,酸放亚置铁(铵过,夜加)草、酸结钾晶制、得抽草滤酸至亚干铁即后得经三氧草化酸制合得铁三草(III酸)酸合钾铁晶(I体II)。酸钾。
该110配ºC合下物失对去光三敏分感子,结光晶照水下而即成发为生K分3[解Fe(。C2O4)3] ,230ºC时分解。 保通持过上 学述习沉三淀草近酸沸合状铁态(III,)酸先钾加的入合H成2C方2O法4溶,液掌,握溶无液机的制p备H的值一保般持方在法4~。5,此时溶液呈翠绿色,趁热过滤到一个150mL烧杯中ቤተ መጻሕፍቲ ባይዱ。
保持上述沉淀近沸状态,先加入H C O 溶液,溶液 2 2 4 加在入上乙 述醇溶的液作中用加是入什1m么ol?L-1H2C2O420mL,搅拌并加热煮沸,使形成FeC2O4 2H2O黄色沉淀,。
三草酸合铁(iii)酸钾的制备

三草酸合铁(iii)酸钾的制备
三草酸合铁(III)酸钾是一种无机化合物,分子式为Fe(C3H5O3)3K。
它是通过将三草酸铁(III)和钾碱在水溶液中反应得到的。
具体的合成方法如下:
1.预处理:准备好所需的三草酸铁(III)和钾碱。
2.反应:将三草酸铁(III)溶液和钾碱溶液在烧杯中混合,加热至70-80℃,调
节pH值至3-4,保持反应2-4小时。
3.离心:将反应液离心至清晰,得到的比较浓的溶液就是三草酸合铁(III)酸钾溶
液。
4.过滤:将三草酸合铁(III)酸钾溶液过滤,得到清晰的溶液。
5.结晶:将清晰的溶液加热至60-70℃,通过蒸发水分来获得三草酸合铁(III)酸
钾结晶。
6.洗涤:将三草酸合铁(III)酸钾结晶用净水洗涤干净,即可得到纯净的三草酸合
铁(III)酸钾。
注意:在合成过程中,应注意安全防护措施,并避免接触皮肤和眼睛。
三草酸合铁(III)酸钾的制备

三草酸合铁酸钾的制备[实验目的]1.掌握三草酸合铁(III)酸钾的制备方法。
2. 练习倾析法、水浴加热、常压过滤、减压过滤等基本操作。
2.加深3价铁和2价铁的化合物重要性质的了解。
[实验原理]三草酸合铁(Ⅲ)酸钾K3[Fe(C2O4)3]·3H2O是一种翠绿色的单斜晶体,溶于水而不溶于乙醇等有机溶剂,光照易分解。
是一些有机反应很好的催化剂,也是制备负载型活性铁催化剂的主要原料,因而在工业生产中具有应用价值。
沉淀(NH4)2Fe(SO4)2·6H2O+H2C2O4=== FeC2O4·2H2O↓+(NH4)2 SO4+ H2SO4+4H2O氧化配位6FeC2O4 + 3H2O2 + 6K2C2O4 (过量)=== 4K3[Fe(C2O4)3] + 2Fe(OH)3(s)酸溶配位2Fe(OH)3 + 3H2C2O4 + 3K2C2O4 === 2K3[Fe(C2O4)3] + 6H2O后两步总反应式为2FeC2O4·2H2O+ H2O2+3K2C2O4+ H2C2O4===2K3[Fe(C2O4)3]·3H2O[实验步骤]1.草酸亚铁的制备将 5 g (NH4)2Fe(SO4)2·6H2O (s)溶于20 mL 经6 mol/LH2SO4(5 滴)酸化的水中,加热使其溶解在不断搅拌下加入25 mL 饱和H2C2O4溶液,然后将其加热至沸30 s后静置。
黄色沉淀完全沉降后,倾去上层清夜,用热水(400C以上)洗涤沉淀3 次(每次约25 mL)至溶液呈中性(用pH 试纸检验)。
2.三草酸合铁(III)酸钾的制备在上述沉淀中加入10mL饱和K2C2O4溶液,水浴恒温维持40 0C 左右,(或恒温磁力搅拌器),缓慢滴加12 mL H2O2(质量分数为0.05)溶液(气泡未出现前保持1 d/s,出现气泡后,每加一滴H2O2搅拌至无气泡后再滴加),此时溶液有棕色的Fe(OH)3沉淀生成。
三草酸合铁(Ⅲ)酸钾的制备及性质

三草酸合铁(Ⅲ)酸钾的制备及性质一、实验目的1.了解三草酸合铁(Ⅲ)酸钾的制备方法;2.巩固无机制备实验的基本操作技能;3.了解三草酸合铁(Ⅲ)酸钾的性质二、实验原理三草酸合铁(Ⅲ)酸钾K3[Fe(C2O4)3·3H2O]为翠绿色单斜晶体,易溶于水,难溶于乙醇,110℃可失去全部结晶水,230℃时分解。
它是一种光敏物质,光照时会分解变色,常用作化学光量计。
另外,它是制备负载型活性铁催化剂的主要原料,也是一些有机反应的良好催化剂,在工业上具有一定的应用价值。
三草酸合铁(Ⅲ)酸钾的制备方法有多种,本实验采用的方法是首先由硫酸亚铁铵与草酸反应制备草酸亚铁:(NH4)2Fe(SO4)2·6H2O + H2C2O4 →FeC2O4·2H2O↓+ (NH4)2SO4 + H2SO4 + 4H2O然后在过量草酸根的存在下,用过氧化氢氧化草酸亚铁,即可得到三草酸合铁(Ⅲ)酸钾,同时有氢氧化铁产生:6FeC2O4·2H2O + 3H2O2 + 6K2C2O4 →4K3[Fe(C2O4)3] + 2Fe(OH)3↓+ 12H2O 加入适量的草酸可使氢氧化铁转化为三草酸合铁(Ⅲ)酸钾:2Fe(OH)3 + 3H2C2O4 + 3K2C2O4 →2K3[Fe(C2O4)3] + 6H2O 再加入乙醇,放置即可得到三草酸合铁(Ⅲ)酸钾晶体。
三、实验仪器及试剂烧杯(250 mL、100 mL)、量筒、试管、电子天平、恒温水浴锅、真空泵、抽滤瓶、漏斗(NH4)2Fe(SO4)2·6H2O (s)、H2SO4 (3 mol⋅L–1)、H2C2O4·2H2O (s)、H2O2 (6%)、K2C2O4 (饱和)、乙醇(95%)四、实验内容1. 三草酸合铁(Ⅲ)酸钾K3[Fe(C2O4)3·3H2O]的制备(1)制备FeC2O4·2H2O称取6.0 g自制的(NH4)2Fe(SO4)2·6H2O固体于250 mL烧杯中,加1 mL3 mol⋅L–1 H2SO4、20 mL去离子水,加热使之溶解。
实验十五 三草酸合铁(Ⅲ)酸钾的制备与性质

实验十五三草酸合铁(Ⅲ)酸钾的制备与性质一、实验目的了解铁的化学性质,掌握三草酸合铁(Ⅲ)酸钾的制备方法,并掌握其性质。
二、实验原理三草酸合铁(Ⅲ)酸钾,分子式为KFe(CN)6。
是一种无色晶体,易溶于水。
可作为显色剂、脚气病药、饲料添加剂和电镀助剂等。
三、实验仪器及试剂仪器:电子天平、四分子筛试剂:三草酸钾(K3[Fe(CN)6])、硫酸铁(FeSO4)、硫酸钾(K2SO4)、酒精等。
四、实验步骤(1)将25g三草酸钾放入烧杯中,加入50mL去离子水中搅拌溶解,然后放入40g四分子筛中,搅拌使其充分吸收。
(3)将混合溶液过滤,在常温下静置结晶。
将溶液倒掉,将晶体洗涤,并用吸滤装置除去水分。
(4)将三草酸合铁(Ⅲ)酸钾粉末转移到烧杯中,使用酒精反复洗涤,去除杂质,然后在加热板上干燥至恒定重。
(1)溶解性:取少量三草酸合铁(Ⅲ)酸钾放入试管中,加入几滴酒精,搅拌至溶解。
(2)还原性:将少量三草酸合铁(Ⅲ)酸钾加入硝酸银溶液中,观察是否生成沉淀。
五、实验注意事项1、钾铁氰化物对皮肤有刺激性,操作时应戴细手套。
2、溶液中用的硫酸铁和硫酸钾都需要去离子水预先进行溶解。
3、制备晶体过程中需保持无尘状态,避免杂质混入。
4、加酸氧化反应过程中,操作需要围裙和防护镜。
六、实验结果及分析1、三草酸合铁(Ⅲ)酸钾制备的银白色晶体结晶,溶于水。
2、三草酸合铁(Ⅲ)酸钾在氧化条件下可被氧化剂氧化,失去[Fe(CN)6]3-配体。
3、三草酸合铁(Ⅲ)酸钾可被还原为氰化物,其原因是由于三草酸钾具有还原性。
七、实验总结通过实验,我们成功地制备了三草酸合铁(Ⅲ)酸钾,了解了其性质。
在操作过程中,需要注意安全措施,避免钾铁氰化物对人体造成危害。
在实验中,通过检测其溶解性、氧化性、还原性和盐酸性等性质,进一步了解了三草酸合铁(Ⅲ)酸钾的化学性质。
三草酸合铁酸钾的制备涉及的化学反应类型

一、概述三草酸合铁酸钾是一种重要的化学物质,具有多种用途,例如用作染料、化肥和磨料等。
其制备方法涉及一系列化学反应,本文将对三草酸合铁酸钾的制备涉及的化学反应类型进行详细介绍。
二、三草酸合铁酸钾的化学性质三草酸合铁酸钾又称为铁氰化钾,化学式为K3[Fe(CN)6]。
它是一种无色晶体或白色结晶粉末,能溶于水,具有一定的毒性。
在化学应用中,三草酸合铁酸钾可作为氰基的源头,产生稳定的亚氨基自由基。
三、三草酸合铁酸钾的制备1. 制备亚硝酸钾:首先需要制备亚硝酸钾,化学式为KNO2。
制备亚硝酸钾的化学反应如下:2KNO3 + S + H2SO4 → 2KHSO4 + 2NO2 + H2O2. 制备氰化钠:接下来需要制备氰化钠,化学式为NaCN。
制备氰化钠的化学反应如下:Na2CO3 + 2C + N2 → 2NaCN + 3CO3. 合成三草酸合铁酸钾:将亚硝酸钾和氰化钠以一定的摩尔比混合,加入适量铁盐溶液并搅拌,即可得到三草酸合铁酸钾的沉淀,化学反应如下:6KNO2 + 6NaCN + FeSO4 + 2FeCl3 → K3[Fe(CN)6] +3K2SO4 + 6NaNO2 + 2FeCl2四、三草酸合铁酸钾制备涉及的化学反应类型三草酸合铁酸钾的制备涉及了多种化学反应类型,主要包括氧化还原反应、置换反应和双替换反应。
1. 氧化还原反应:亚硝酸钾在与硫磺和硫酸的反应中发生了氧化还原反应,其中亚硝酸钾被氧化成了NO2。
铁盐在合成三草酸合铁酸钾的过程中也参与了氧化还原反应。
2. 置换反应:制备氰化钠和三草酸合铁酸钾的过程中均发生了置换反应,其中碳原子置换了氧原子,形成了相应的化合物。
3. 双替换反应:在合成三草酸合铁酸钾的过程中,亚硝酸钾和氰化钠发生了双替换反应,生成了三草酸合铁酸钾并产生了相应的溶剂。
五、结论通过本文的介绍,我们了解了三草酸合铁酸钾的制备方法以及涉及的化学反应类型。
在制备过程中,多种化学反应相互作用,最终得到了所需的产品。
三草酸合铁酸钾的合成及分析

实验三三草酸合铁(III)酸钾的合成及组成分析一、实验目的1、掌握三草酸合铁(III)酸钾的合成方法;2、掌握确定化合物化学式的基本原理和方法;3、综合训练无机合成、滴定分析和重量分析的基本操作。
二、实验原理三草酸合铁(III)酸钾K3[Fe(C2O4)3]•3H2O为亮绿色单斜晶体,易溶于水而难溶于乙醇、丙酮等有机溶剂,受热时,在110℃下可失去结晶水,到230℃即分解。
该配合物为光敏物质,光照下易分解。
它是一些有机反应很好的催化剂,也是制备负载型活性铁催化剂的主要原料,因而具有工业生产价值。
目前制备三草酸合铁(III)酸钾的工艺路线有多种。
本实验首先利用(NH4)2Fe(SO4)2与H2C2O4反应制取FeC2O4,反应方程式为:(NH4)2Fe(SO4)2+H2C2O4=FeC2O4(s)+(NH4)2 SO4+H2 SO4在过量K2C2O4存在下,用H2 O2氧化FeC2O4,即可制得产物:6 FeC2O4+3 H2 O2+6 K2C2O4=4 K3[Fe(C2O4)3]+2Fe(OH)3(s)反应中产生的Fe(OH)3可加入适量的H2C2O4也将其转化为产物:2 Fe(OH)3+3 H2C2O4+3 K2C2O4=2 K3[Fe(C2O4)3]+6H2O该配合物的组成可通过重量分析法和滴定方法确定。
(1)用重量分析法测定结晶水含量将一定量产物在110℃下干燥,根据失重的情况便可计算出结晶水的含量。
(2)用高锰酸钾法测定草酸根含量C2O42-在酸性介质中可被MnO4-定量氧化,反应式为:5 C2O42-+2 MnO4-+16H+=2Mn2++10 CO2+8H2O用已知浓度的KMnO4标准溶液滴定C2O42-,由消耗KMnO4的量,便可计算出C2O42-的含量。
(3)用高锰酸钾法测定铁含量先用过量的Zn粉将Fe3+还原为Fe2+,然后用KMnO4标准溶液滴定Fe2+:Zn+2 Fe3+=2 Fe2++Zn2+5 Fe2++MnO4-+8 H+=5 Fe3++Mn2++4 H2O由消耗KMnO4的量,便可计算出Fe3+的含量。
实验十一 三草酸合铁(III)酸钾的制备及组成分析

三草酸合铁(III)酸 钾的制备及组成分析
一、实验目的
掌握无机制备的一般方法。
了解三草酸合铁(III)酸钾的性质和制备方法。
三草酸合铁(III)酸钾的性质
• 1 、 性 质 : 三 草 酸 合 铁 ( III ) 酸 钾
K3[Fe(C2O4)3]· 3H2O 为翠绿色单斜晶体,溶 于水,难溶于乙醇。 110℃失去三分子结晶 水, 230℃分解。该化合物对光敏感,光照 即发生分解。
在实验报告中给出产率、配合 物的内外界
①
检定K+:
③检定Fe3+: 少量0.2mol/L FeCl3于试管中
少量产品溶液于试管中
1滴1mol/L KSCN
实验记录
1、三草酸合铁酸钾的合成
m(莫尔盐)= 产品外观: 2、定性分析
① 检定K+: 少量1mol/L K2C2O4于试管中 少量产品溶液于试管中 少量1mol/L K2C2O4于试管中 少量产品溶液于试管中 1滴1mol/L KSCN 滴加饱和酒石酸氢钠
三草酸合铁(III)酸钾的理论产量: mH 2C2O4 2H 2O mK 3 [Fe(C2O4 )3 ] 3H2O = M K 3 [Fe(C2O4 )3 ] 3H 2O 3M H2C2O4 2H 2O 实际产量 产率= 100% 理论产量
四、实验步骤
1 合成
(1 )
莫尔盐 5.0g 大烧杯内
100mL H2O 加热溶解 10mL 氨水 6mol/L
40 ℃
搅拌 滴加15mL 6% H2O2
如果沉淀呈棕黑色,说明温度高有四氧化三铁生成,重做
煮沸并搅拌
沉淀中加入100mL水 搅拌、加热、洗涤沉淀
红棕色
三草酸合铁酸钾合成1

ቤተ መጻሕፍቲ ባይዱ
试 剂 : (NH4)2Fe(SO4)2·6H2O , H2SO4 (1mol·L-1) , H2C2O4 ( 饱 和 ) , K2C2O4(饱和),KCl (A. R),KNO3 (300g·L-1),乙醇(95%),乙醇—丙 酮混合液(1 : 1),K3[Fe(CN)6] (5%), H2O2 (3%)。
液保留待用。
③铁含量测定:
在上述滴定过草酸根的保留液中加锌粉还原,
至黄色消失。加热3 min,使Fe3+ 完全转变为Fe2+,
抽滤,用温水洗涤沉淀。滤液转入250 mL锥形瓶
中 , 再 利 用 KMnO4 溶 液 滴 定 至 微 红 色 , 计 算 K3Fe[(C2O4)3]中铁的质量分数 ,并换算成物质的 量。
2.根据三草酸合铁(Ⅲ)酸钾的合成过程及它的TG 曲线,你认为该化合物应如何保存?
3.在三草酸合铁(Ⅲ)酸钾的制备过程中,加入15 mL 饱和草酸溶液后,沉淀溶解,溶液转为绿色。若往 此溶液中加入25 mL 95%乙醇或将此溶液过滤后往 滤液中加入25 mL 95%的乙醇,现象有何不同?为 什么?并说明对产品质量有何影响?
mL蒸馏水和1.5ml 2mol·L-1 H2SO4,加热溶解后。另称取 3.0g草酸放入到100ml烧杯中,加30ml去离子水微热,溶解 后取出22mL倒入上述250ml烧杯中,加热搅拌至沸,并维 持微沸5min。静置,待黄色晶体FeC2O4·2H2O沉淀后倾析, 弃去上层清液,加入10mL蒸馏水洗涤晶体,搅拌并温热, 静置,弃去上层清液,即得黄色晶体草酸亚铁。
三草酸合铁酸钾的制备讲义

三草酸合铁酸钾的制备一、实验目的1.掌握用自制(NH4)2Fe(SO4)2合成K3Fe[(C2O4)3]·3H2O的基本原理和操作技术;2.加深对Fe(Ⅲ)和Fe(Ⅱ)化合物性质的了解。
3. 掌握确定化合物化学式的基本原理及方法;4. 学习热重、差热分析、磁化率测定、红外光谱分析的操作技术;5. 通过综合性实验的基本训练,培养学生分析与解决复杂问题的能力。
二、实验原理1.三草酸合铁(III)酸钾的性质与制备(1)性质:三草酸合铁(III)酸钾(含三个结晶水)为翠绿色的单斜晶体,易溶于水(溶解度0℃,4.7g/100g;100℃,117.7g/100g),难溶于乙醇。
110℃下可失去全部结晶水,230℃时分解。
此配合物对光敏感,受光照射分解变为黄色。
因其具有光敏性,所以常用来作为化学光量计。
另外它是制备某些活性铁催化剂的主要原料,也是一些有机反应良好的催化剂,在工业上具有一定的应用价值。
(2)制备:本实验以硫酸亚铁铵为原料,与草酸在酸性溶液中先制得草酸亚铁沉淀,然后再用草酸亚铁在草酸钾和草酸的存在下,以过氧化氢为氧化剂,得到铁(Ⅲ)草酸配合物。
主要反应为:(NH4)2Fe(SO4)2 + H2C2O4 + 2H2O = FeC2O4·2H2O↓+ (NH4)2SO4 + H2SO42FeC2O4·2H2O + H2O2 + 3K2C2O4 + H2C2O4 ===2K3[Fe(C2O4)3]·3H2O2.产物的定性分析(1)化学分析鉴定:K +离子与酒石酸氢钠溶液产生白色沉淀;Fe 3+与KSCN 溶液混合,生成[Fe (NCS )n ]3-n 配离子,呈血红色,而[Fe(C 2O 4)3]与KSN 溶液无现象。
(2)红外光谱鉴定:C 2O 42-及结晶水通过红外光谱分析。
结晶水的吸收带在3550—3220/ cm -1之间,一般在3450/ cm -1附近。
无机化学实验3三草酸合铁酸钾的制备和性质

3三草酸合铁酸钾的制备和性质7.1 实验目的7.2 预备知识物质名称化学式摩尔质量/g∙mol-1莫尔盐(NH4)2Fe(SO4)2·6H2O392.13草酸H2C2O490.04草酸钾K2C2O4166.21高锰酸钾KMnO4158.03草酸根C2O42- 88.02铁Fe55.85三水合三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O491.247.3实验原理K3[Fe(C2O4)3]·3H2O为绿色单斜晶体,密度为2.138 g·cm-3,加热至100℃失去全部结晶水,230 ℃时分解;溶于水, 难溶于乙醇;对光敏感。
它是制备负载型活性铁催化剂的主要原料,也是一些有机反应的良好催化剂,具有工业应用价值。
合成K3[Fe(C2O4)3]·3H2O的工艺路线有多种。
本实验以莫尔盐和草酸形成草酸亚铁后经氧化、配位、结晶得到K3[Fe(C2O4)3]·3H2O。
配阴离子可用化学分析方法进行测定,用稀H2SO4溶解试样,在酸性介质中用KMnO4标准溶液滴定待测液中的C2O42-离子;在滴定C2O42-离子后的溶液中用Zn粉还原Fe3+为Fe2+,再用KMnO4标准溶液滴定Fe2+;通过消耗KMnO4标准溶液的量来计算C2O42-离子和Fe3+离子的量以及C2O42-离子和Fe3+离子的配比。
公用仪器、材料、试剂试剂名称位置试剂名称位置(NH4)2Fe(SO4)2·6H2O本实验桌Zn粉(A.R)本实验桌饱和草酸钾溶液本实验桌去离子水中间实验桌饱和草酸溶液本实验桌无水乙醇本实验桌标准浓度KMnO4溶液中间实验桌灯用酒精中间实验桌小纸条本实验桌及分析天平室真空系统实验桌正前上方冰块实验室临时提供称量纸本实验桌电子台秤(0.01g)本实验桌乙醇-丙酮1:1本实验桌H2O2 (w=5%)本实验桌水浴锅(用于分析)两人共用1套(本实验桌)注:实验结束后多余的产品回收到实验室指定的容器中。
三草酸合铁酸钾的制备讲义

三草酸合铁酸钾的制备一、实验目的1.掌握用自制(NH4)2Fe(SO4)2合成K3Fe[(C2O4)3]·3H2O的基本原理和操作技术;2.加深对Fe(Ⅲ)和Fe(Ⅱ)化合物性质的了解。
3. 掌握确定化合物化学式的基本原理及方法;4. 学习热重、差热分析、磁化率测定、红外光谱分析的操作技术;5. 通过综合性实验的基本训练,培养学生分析与解决复杂问题的能力。
二、实验原理1.三草酸合铁(III)酸钾的性质与制备(1)性质:三草酸合铁(III)酸钾(含三个结晶水)为翠绿色的单斜晶体,易溶于水(溶解度0℃,4.7g/100g;100℃,117.7g/100g),难溶于乙醇。
110℃下可失去全部结晶水,230℃时分解。
此配合物对光敏感,受光照射分解变为黄色。
因其具有光敏性,所以常用来作为化学光量计。
另外它是制备某些活性铁催化剂的主要原料,也是一些有机反应良好的催化剂,在工业上具有一定的应用价值。
(2)制备:本实验以硫酸亚铁铵为原料,与草酸在酸性溶液中先制得草酸亚铁沉淀,然后再用草酸亚铁在草酸钾和草酸的存在下,以过氧化氢为氧化剂,得到铁(Ⅲ)草酸配合物。
主要反应为:(NH4)2Fe(SO4)2+ H2C2O4+ 2H2O = FeC2O4·2H2O↓+ (NH4)2SO4+ H2SO42FeC2O4·2H2O + H2O2 + 3K2C2O4 + H2C2O4 ===2K3[Fe(C2O4)3]·3H2O 2.产物的定性分析(1)化学分析鉴定:K+离子与酒石酸氢钠溶液产生白色沉淀;Fe 3+与KSCN 溶液混合,生成[Fe (NCS )n ]3-n配离子,呈血红色,而[Fe(C 2O 4)3]与KSN溶液无现象。
(2)红外光谱鉴定: C 2O 42-及结晶水通过红外光谱分析。
结晶水的吸收带在3550—3220/ cm -1之间,一般在3450/ cm -1附近。
C 2O 42-最常见的为双齿配位形成的螯合物。
三草酸合铁(III)酸钾的制备讲义

K3[Fe(C2O4)3]·3H2O的制备实验目的1. 巩固配合物的制备的基本操作。
2. 通过基本训练,培养学生分析与解决问题的能力。
实验原理K3[Fe(C2O4)3]·3H2O为翠绿色的单斜晶体,易溶于水(溶解度0℃ 4.7g/100g 100℃ 117.7g/100g),难溶于乙醇。
110℃下可失去全部结晶水,230℃时分解。
此配合物对光敏感,受光照射分解变为黄色:光2K3[Fe(C2O4)3]⎯⎯⎯→ 3K2C2O4 + 2FeC2O4 +2CO2因其具有光敏性,所以常用来作为化学光量计。
另外它是制备某些活性铁催化剂的主要原料,也是一些有机反应良好的催化剂,在工业上具有一定的应用价值。
其合成工艺路线有多种,本实验采用的方法是首先由硫酸亚铁铵与草酸反应制备草酸亚铁:(NH4)2Fe(SO4)2·6H2O + H2C2O4⎯⎯→FeC2O4·2H2O↓+(NH4)2SO4+H2SO4+4H2O 然后在过量草酸根存在下,用过氧化氢氧化草酸亚铁即可得到三草酸合铁(Ⅲ)酸钾,同时有氢氧化铁生成:6FeC2O4·2H2O + 3H2O2 + 6K2C2O4 ⎯⎯→ 4K3[Fe(C2O4)3] + 2Fe(OH)3↓ +12H2O加入适量草酸可使Fe(OH)3转化为三草酸合铁(Ⅲ)酸钾配合物:2Fe(OH)3 + 3H2C2O4 + 3 K2C2O4⎯⎯→ 2 K3[Fe(C2O4)3] + 6 H2O再加入乙醇,放置即可析出产品的结晶。
其后几步总反应式为:2FeC2O4·2H2O + H2O2 +3K2C2O4 + H2C2O4⎯⎯→ 2K3[Fe(C2O4)3]·3H2O 草酸根能以单齿、双齿形式与金属离子配位形成配合物,但最常见的是以双齿配位形成螯合结构的配合物。
仪器和药品仪器:电子天平、电加热器、恒温水浴、真空泵、吸滤瓶及漏斗、滴定管等。
三草酸合铁III酸钾的制备和性质PPT课件

• 进一步锻炼设计实验的能力 • 了解钒(V)的性质 • 练习分离、沉淀、过滤等基本操作
第1页/共11页
返回
实验原理
•
ClO3-
+
6VO2+
+
3H2O
=
6
V
O
+ 2
+
Cl-
+
6H+
•
2
VOBiblioteka + 2+H2O=V2O5
+
2H+
第2页/共11页
返回
实验用品
• 仪器:研钵、抽滤瓶、布氏漏斗、蒸发皿、烧杯、量筒 • 药品:废钒催 化 剂 、 H 2S O4溶 液 ( 1mo l ·d m-3,2 mo l ·dm-3) 、 KC lO3
返回
水解
• 将上述黄色溶液加热至近沸。在维持近沸的温度(90~95°C)下,逐滴加 入6mo l·dm-3 Na OH 溶液,不断搅拌,并随时用 pH 试纸检验溶液的酸度, 要求水解反应在pH=1~2下进行,直至有砖红色沉淀析出,保持90~95°C 0.5h,停止加热。
第8页/共11页
返回
分离
• 将所得砖红色沉淀抽滤,用少量蒸馏水洗涤,抽干,称重。
第9页/共11页
返回
思考题
• 写出各步实验现象和反应的化学方程式。
第10页/共11页
返回
感谢您的观看。
第11页/共11页
(晶体)、Na OH 溶 液( 6mol·dm-3 ) • 材料:pH试纸
第3页/共11页
返回
实验步骤
• 浸出 • 过滤 • 氧化 • 水解 • 分离
第4页/共11页
实验三 合成三草酸合铁(III)酸钾

2.沉淀 以铁为原料制得硫酸亚铁铵,加草酸钾制得草酸亚铁后经氧化制得三草酸合铁(III)酸钾。
该配合物对光敏感,光照下即发生分解。 在上述沉淀中加入饱和K2C2O4溶液,水浴加热至40oC,滴加3% H2O2溶液,使Fe(II)充分氧化为Fe(III)。
在上述溶液中加入1molL H C O 20mL,搅拌并加热煮沸, 实验三 合成三草酸合铁(III)酸钾
-1 以铁为原料制得硫酸亚铁铵,加草酸钾制得草酸亚铁后经氧化制得三草酸合铁(III)酸钾。
该配合物对光敏感,光照下即发生分解。
22 4
使形成FeC O 2H O黄色沉淀,。 加入乙醇的作用是什么?
2 4 2 以三氯化铁与草酸钾直接合成三草酸合铁(III)酸钾。
以三氯化铁与草酸钾直接合成三草酸合铁(III)酸钾。
1.溶解 如何提高产率?能否用蒸干溶液来提高产率?
以硫酸铁与草酸钾为原料直接合成三草酸合铁(III)酸钾。 110ºC下失去三分子结晶水而成为K3[Fe(C2O4)3] ,230ºC时分解。
在托盘天平上称取一定量的自制硫酸亚铁铵,置于250mL烧 以铁为原料制得硫酸亚铁铵,加草酸钾制得草酸亚铁后经氧化制得三草酸合铁(III)酸钾。
无机化学设计实验
实验三 合成三草酸合铁(III)酸钾
一、实验目的
1.通过学习三草酸合铁(III)酸钾的合成方法, 掌握无机制备的一般方法。
2.学习用高锰酸钾法测定C2O42-与Fe3+的原理 和方法。
3.综合训练无机合成、滴定分析的基本操作, 掌握确定化合物组成的原理和方法。
二、实验原理
三草酸合铁(III)酸钾,即K3[Fe(C2O4)3]3H2O,为绿 色单斜晶体,溶于水,难溶于乙醇。110ºC下失去三 分子结晶水而成为K3[Fe(C2O4)3] ,230ºC时分解。该 配合物对光敏感,光照下即发生分解。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
三草酸合铁酸钾的制备一、实验目的1.掌握用自制(NH4)2Fe(SO4)2合成K3Fe[(C2O4)3]·3H2O的基本原理和操作技术;2.加深对Fe(Ⅲ)和Fe(Ⅱ)化合物性质的了解。
3. 掌握确定化合物化学式的基本原理及方法;4. 学习热重、差热分析、磁化率测定、红外光谱分析的操作技术;5. 通过综合性实验的基本训练,培养学生分析与解决复杂问题的能力。
二、实验原理1.三草酸合铁(III)酸钾的性质与制备(1)性质:三草酸合铁(III)酸钾(含三个结晶水)为翠绿色的单斜晶体,易溶于水(溶解度0℃,4.7g/100g;100℃,117.7g/100g),难溶于乙醇。
110℃下可失去全部结晶水,230℃时分解。
此配合物对光敏感,受光照射分解变为黄色。
因其具有光敏性,所以常用来作为化学光量计。
另外它是制备某些活性铁催化剂的主要原料,也是一些有机反应良好的催化剂,在工业上具有一定的应用价值。
(2)制备:本实验以硫酸亚铁铵为原料,与草酸在酸性溶液中先制得草酸亚铁沉淀,然后再用草酸亚铁在草酸钾和草酸的存在下,以过氧化氢为氧化剂,得到铁(Ⅲ)草酸配合物。
主要反应为:(NH4)2Fe(SO4)2+ H2C2O4+ 2H2O = FeC2O4·2H2O↓+ (NH4)2SO4+ H2SO42FeC2O4·2H2O + H2O2 + 3K2C2O4 + H2C2O4 ===2K3[Fe(C2O4)3]·3H2O 2.产物的定性分析(1)化学分析鉴定:K+离子与酒石酸氢钠溶液产生白色沉淀;Fe 3+与KSCN 溶液混合,生成[Fe (NCS )n ]3-n 配离子,呈血红色,而[Fe(C 2O 4)3]与KSN 溶液无现象。
(2)红外光谱鉴定:C 2O 42-及结晶水通过红外光谱分析。
结晶水的吸收带在3550—3220/ cm -1之间,一般在3450/ cm -1附近。
C 2O 42-最常见的为双齿配位形成的螯合物。
3、产物的定量分析目的:通过定量分析可以测定各组分的质量分数,各离子、基团的个数比,再根据定性实验得到的对配合物内外界的判断,从而可推断出产物的化学式。
(1) 结晶水的含量(重量分析法)已知质量的产品110℃下干燥脱水脱水后再称量 计算结晶水的含量(2) 草酸根的含量(氧化还原滴定法)2245C O -+42MnO -+16H + →10CO 2↑+2Mn 2+ + 8H 2O(3) 铁的含量(氧化还原滴定法)2Fe 3++Zn →2Fe 2++Zn 2+5Fe 2+ +4MnO -+8H + →5Fe 3+ + Mn 2+ + 4H 2O (4) 钾的含量(差量法)1-(结晶水)%-Fe%- C 2O 42-%4、产物的表征(1) 配合物中心离子的外层电子结构通过对配合物磁化率的测定,可以推算出未成对的电子数,推断出中心离子外层电子的结构、配键类型、立体化学结构。
(2) 热重、差热分析通过对TG曲线的分析,了解物质在升温过程中质量的变化情况;通过对DTA 曲线的分析,可了解物质在升温过程中热量变化的情况。
对产品进行TG、DTA分析可测量出失去结晶水的温度、热分解温度及脱水分解热量变化情况等,各步始终的数量结晶水的个数。
三、仪器和药品仪器:数显恒温水浴锅(HH—1型)、循环水式多用真空汞(SHBⅢ—A型)、MB—1A型磁天平、美国尼高力傅立叶变幻红外光谱仪等。
药品:(NH4)2Fe(SO4) 2·6H20、H2SO4(3mol/L)、H2C2O4·2H20、K2C2O4(饱和)、H2O2(6%)、乙醇(95%)、KSCN(0.1 mol/L)、CaCl2(0.5 mol/L)、饱和酒石酸氢钠溶液、FeCl3(0.1 mol/L)、KMnO4(0.0211 mol/L)等。
四、实验步骤1.K3[Fe(C2O4)3]·3H2O的制备(1)FeC2O4·2H2O的制备①250ml烧杯中,加入20ml蒸馏水和1ml 3mol/LH2SO4(加酸的目的?),称取6.0g自制(NH4)2Fe(SO4)2·6H2O固体倒入烧杯中,加热使之溶解。
②另称取H2C2O4·2H2O3.5g于100ml烧杯中,加入35ml蒸馏水微热、搅拌溶解。
③取②中配制的H2C2O4溶液20ml加入250ml烧杯中,不断搅拌,加热至沸后,微热5min,室温下静置,待黄色FeC2O4·2H2O晶体沉淀后用倾析法弃去上层清液。
再向沉淀中加入20ml 水(目的?),搅拌,并温热,静置后再弃去清液(尽可能把清液倾倒干净)。
(2)K3[Fe(C2O4)3]·3H2O的制备①在上述(3)的沉淀中加入15 ml饱和K2C2O4溶液于,水浴加热至约40℃,用滴管慢慢(为什么?)滴加12 ml 6%H2O2(现象?),并不断搅拌保持温度在40℃左右。
②将水浴加热至沸除去H2O2,再加入1.(2)中H2C2O4至溶液完全变为透明翠绿色(pH为3.0—3.5),滴加过程中保持水浴沸腾。
③冷却,向烧杯中加入15ml 95%乙醇,置于暗处(为什么?)冷却结晶,减压过滤。
(3)产品的重结晶称量产品质量,按100℃ 溶解度计算,加入蒸馏水置于热水浴中溶解,放暗处冷却结晶,减压过滤(用95%的乙醇洗涤),将重结晶后的产品放入提前称量好质量的50ml 干燥的空烧杯中,贴上标签后壁光保存。
2.产物的定性分析(1)K +的检定:取少量样品加入少量蒸馏水溶解加入饱和酒石酸氢钠溶液1ml充分摇匀→现象?(2)Fe 3+的检定:1号试管取样品加水溶解 2滴0.1mol/L 的KSCN无现象加2滴稀硫酸 现象?2号试管取少量FeCl 3 溶液2滴0.1mol/L 的KSCN现象?(3)C 2O 42-的检定:1号试管取样品加水溶解加2滴0.5mol/L 氯化钙溶液 现象? 2号试管加少量K 2C 2O 4溶液加2滴0.5mol/L 氯化钙溶液现象? (4)利用红外光谱仪确定结晶水及C 2O 42-制样置于红外光谱仪测定红外吸收光谱与标准图对比确定是否含有结晶水及C 2O 42-结论:说明产品中含有那些离子?以什么形式存在?3.产物的定量分析(1) 结晶水含量的测定:两个洁净的称量瓶编号110℃电热箱中干燥1小时置于干燥器中冷却称量重复操作至恒重准确称量两份样品0.5—0.6g分别放入上述两个称量瓶中110℃下干燥1小时冷却称量重复操作至恒重(2) C 2O 42-含量的测定:准确称量样品0.1000—0.1300g加入10m 3mol/L 硫酸、20ml 蒸馏水微热、溶解85℃水浴中保持5-8min用0.0211mol/L KMnO 4标准溶液滴定直至溶液呈浅粉色记录消耗的标准溶液体积。
(3) F e 3+含量的测定:上述保留液中加入Zn 粉煮沸至黄色消失趁热过滤收集滤液蒸馏水洗涤用0.0211mol/LKMnO 4标准溶液滴定直至溶液呈浅粉色记录消耗的标准溶液体积。
(见表1)(4) K +含量的测定:1-(结晶水)%-Fe%- C 2O 42-%。
表1 C 2O 42-、Fe 2+含量的定量分析数据表标结论:在1mol 产品中含224C Omol ,Fe 3+ mol ,K + mol ,结晶水 mol ,该物质的化学式为 。
4. 配合物磁化率的测定结论:5. 配合物的热分析仪器各量程及参数选择:热重(TG )量程:4.5mg 差热分析(DTA )量程:50uV微分热重量程:100mV/min 升温速率:10℃/min结论:6. 配合物的红外光谱分析结论:五、数据分析 1.计算产率:2.产物的定量分析(计算过程)C 2O 42-、Fe 2+含量的测定分析标3+2+解析:以第一组数据为例写出计算过程3.磁化率的测定表2 三草酸合铁(Ⅲ)酸钾磁化率测定数据记录表解析:以第一组数据为例写出计算过程4.配合物热分析数据注意事项1.水浴40℃下加热,慢慢滴加H2O2。
以防止H2O2分解。
2.在抽滤过程中,勿用水冲洗粘附在烧杯和布氏滤斗上的绿色产品。
思考题1.能否用FeSO4代替硫酸亚铁铵来合成K3Fe[(C2O4)3]?这时可用HNO3代替H2O2作氧化剂,写出用HNO3作氧化剂的主要反应式。
你认为用哪个作氧化剂较好?为什么?2.根据三草酸合铁(Ⅲ)酸钾的合成过程及它的TG曲线,你认为该化合物应如何保存?3.在三草酸合铁(Ⅲ)酸钾的制备过程中,加入15 mL饱和草酸溶液后,沉淀溶解,溶液转为绿色。
若往此溶液中加入25mL 95%乙醇或将此溶液过滤后往滤液中加入25mL 95%的乙醇,现象有何不同?为什么?并说明对产品质量有何影响?。
