三草酸合铁(III)酸钾的制备和性质复习过程
三草酸合铁(Ⅲ)酸钾的制备、组成测定及表征 预习

4和15mL去离子水,微热溶解,加热至75-85℃(即液面冒水蒸气),趁热用0.0200 mol•L-1 KMnO
4标准溶液滴定至粉红色为终点(保留溶液待下一步分析使用)。根据消耗KMnO
4溶液的体积,计算产物xxC
2O
42-的质量分数。
(3)铁质量分数的测量在上述保留的溶液中加入一小匙锌粉,加热近沸,直到黄色消失,将Fe3+还原为Fe2+即可。趁热过滤除去多余的锌粉,滤液收集到另一锥形瓶中。继续用0.0200mol•L-1 KMnO
实验预习八三草酸合铁(Ⅲ)酸钾的制备、组成测定及表征
一、实验目的
1、初步了解配合物制备的一般方法。
2、掌握用KMnO
4法测定C
2O
42-与Fe3+的原理和方法。
3、培养综合应用基础知识的能力。
4、了解表征配合物结构的方法。
二、实验原理
1、三草酸合铁(Ⅲ)酸钾性质
三草酸合铁(Ⅲ)酸钾K
3[Fe(C
2O
铁质量分数计算过程:
配合物的化学式
六、思考题
1、氧化FeC
2O
4·2H
2O时,氧化温度控制在40℃,不能太高。为什么?
2、KMnO
4滴定C
2O
42-时要加热,又不能使温度太高(75-85℃),为什么?
预习
1、查阅资料,三草酸合铁(Ⅲ)酸钾的制备及组成测定方法还有什么?
2、KMnO
4标准溶液的配制和标定。
仪器:
托盘天平,电子分析天平,烧杯(100mL,250mL),量筒(10mL ,100mL),玻璃棒,布氏漏斗,吸滤瓶,真空泵,表面皿,称量瓶,干燥器,烘箱,锥形瓶(250 mL),酸式滴定管(50mL)
三草酸合铁酸钾的合成

➢反应方程式:
(1)
(NH4)2Fe(SO4)2 + H2C2O4 + 2H2O
===FeC2O4·2H2O↓+ (NH4)2SO4 + H2SO4
(2) 2FeC2O4·2H2O + H2O2 + 3K2C2O4 + H2C2O4
===2K3[Fe(C2O4)3]·3H2O
精品课件
实验试剂
(NH4)2Fe(SO4)2·6H2O, H2SO4 (1mol·L-1), H2C2O4(饱和), K2C2O4(饱和),
精品课件
② 三草酸合铁(III)酸钾的制备: a: 氧化
向草酸亚铁沉淀中,加入10mL饱和K2C2O4溶液,水浴 加热至40℃,恒温下慢慢滴加3%的H2O220mL,沉淀转为深棕 色。边加边搅拌,加完后将溶液加热至沸(注意:防止爆 沸), b: 生成配合物
逐滴加入7-10mL饱和草酸溶液至沉淀完全溶解,此时, 溶液转为黄绿色。继续滴加饱和草酸溶液2-3mL,溶液变为 翠绿色。然后加入95%的乙醇15 mL,混匀后冷却,可以看 到烧杯底部有晶体析出。完全析出后,抽滤。晶体用 10mL95%的乙醇分两次洗涤,得K3[Fe(C2O4)3].3H2O晶体。称 重,计算产率。
乙醇(95%), H2O2 (3%)。
精品课件
实验步骤
1.三草酸合铁(III)酸钾的制备
硫酸亚铁 铵溶液
+ 饱和草酸 溶液。
草酸 亚铁 沉淀
+
饱和草酸 钾溶液
+
3% 双氧 水溶液
深棕 色沉 淀
&
精品课件
三草酸合 铁(Ⅲ) 酸钾晶体
1.三草酸合铁(III)酸钾的制备
三草酸合铁酸钾的合成及分析

三草酸合铁酸钾的合成及分析一、三草酸合铁酸钾的合成方法:1.合成三草酸铁:将适量的氢氧化铁固体加入到约100mL的蒸馏水中,加热至沸腾溶解。
然后,将草酸二钠固体溶解在50mL蒸馏水中,加入到氢氧化铁溶液中。
搅拌反应物溶液,直到得到澄清的混合溶液。
将澄清溶液过滤并冷却,最后得到三草酸铁晶体。
2.合成三草酸合铁酸钾:将约2g的三草酸铁溶解在20mL的蒸馏水中,加入适量的氢氧化钾固体,直到溶液中不再产生气泡。
继续加热溶液,直至溶液变得澄清。
最后,对溶液进行冷却、过滤和干燥,得到三草酸合铁酸钾晶体。
二、三草酸合铁酸钾的分析方法:1.紫外可见光谱法:利用紫外可见光谱仪测量三草酸合铁酸钾在不同波长下的吸光度,并画出吸收光谱图。
通过比较吸收峰位置和强度,可以确定样品的组成和浓度。
2.X射线衍射分析法:将样品放入X射线衍射仪中,通过测量样品对X射线的衍射情况,分析样品的晶体结构和组成。
3.火焰原子吸收光谱法:将样品溶解在适当的溶剂中,使用火焰原子吸收光谱仪测量溶液的吸光度。
根据吸光度与样品浓度的关系,确定三草酸合铁酸钾的浓度。
4.离子色谱法:通过离子色谱仪测量样品中铁离子和钾离子的浓度。
根据测量结果,计算三草酸合铁酸钾中铁和钾的含量。
总结:三草酸合铁酸钾是一种重要的无机化合物,通过合成和分析方法可以得到该化合物的纯品以及对其进行质量控制。
其中,紫外可见光谱法、X 射线衍射分析法、火焰原子吸收光谱法和离子色谱法是常用的分析方法。
通过这些方法,可以得到三草酸合铁酸钾的结构、浓度以及含量等重要信息。
实验八 三草酸合铁(Ⅲ)酸钾的合成和组成分析

实验二十五、三草酸合铁(Ⅲ)酸钾的合成和组成分析[实验目的]1. 了解三草酸合铁(III )酸钾的合成方法。
2. 掌握确定化合物化学式的基本原理和方法。
3. 巩固无机合成、滴定分析和重量分析的基本操作[实验原理]制备:(1) (NH 4)2Fe(SO 4)2+H 2C 2O 4=FeC 2O 4(S)+(NH 4)2SO 4+H 2SO 4(2) 过量K 2C 2O 4情况下,用H 2O 2氧化FeC 2O 46FeC 2O 4+ 6H 2O 2 +6K 2C 2O 4=4K 3[Fe(C 2O 4)3]+2Fe(OH)3(s)(3) 反应过程中生成的Fe(OH)3可加入适量的H 2C 2O 4将其转化为产物Fe(OH)3+3H 2C 2O 4+3K 2C 2O 4=K 3[Fe(C 2O 4)3]+6H 2O 2组成分析:(1)用重量分子法测定结晶水含量将一定量产物在110℃下干燥,根据失重可以计算结晶水含量。
(2)用高锰酸钾法测定草酸根含量5C 2O 42-+2MnO 4-+16H +=2Mn 2++10CO 2+8H 2O (3)用高锰酸钾法测定铁含量Zn 粉还原Fe 3+为Fe 2+,然后用KMnO 4标准溶液滴定Fe 2+MnO 4-+5Fe 2++8H+=5Fe 3++Mn 2++4H 2O (4)确定钾含量配合物减结晶水、C 2O 42- ,Fe 3+含量即为K +含量 [实验内容与步骤](一)三草酸合铁(III )酸钾的合成(1)Fe C 2O 4的合成 (NH 4)2Fe(SO 4)2.6H 2O (5g) 溶液静置 FeC 2O 4(二) K 3[Fe(C 2O 4)3].3H 2O 的合成20ml H 2O 5d H 2SO4酸化,△ 25ml 饱和K 2C 2O 4, 搅拌 △至沸倾去清液 洗涤沉淀FeC 2O 410ml 饱和K 2C 2O 4 水浴△ 40℃滴加12ml H 2O 2 搅拌棕色Fe (OH )3沉淀水浴△ 75℃-85℃ 8ml H 2C 2O 4 亮绿色透明溶液(2)组成分析1.结晶水称量产物在110℃下干燥,根据失重可以计算结晶水含量。
实验十一 三草酸合铁(III)酸钾的制备及组成分析

三草酸合铁(III)酸钾的制备方法
• 1、以铁为原料制备硫酸亚铁铵,加草酸钾 制备草酸亚铁后经氧化制得。 • 2、以硫酸亚铁为起始原料,与草酸钾直接 合成。 • 3、以三氯化铁为起始原料,与草酸钾直接 合成。 • 4、以硫酸亚铁铵为起始原料,经氧化、水 解制备氢氧化铁,再与草酸氢钾配位制得。
二、实验原理
2FeSO 4 ( NH 4 ) 2 SO 4 6H 2 O 4NH 3 H 2 O H 2 O 2 2Fe(OH ) 3 4( NH 4 ) 2 SO 4 12H 2 O
KOH H2C2O4 KHC2O4
Fe(OH)3 3KHC2O4 K3[Fe(C2O4 )3 ] 3H2O
g; m(KOH)= g; m(草酸)= ; 产品质量=
g g;
②检定C2O42-:
2滴0.5mol/L 少量0.2mol/L FeCl3于试管中 少量产品溶液于试管中
六、注意事项
• ①严格控制制备反应的温度低于40℃。 • ② 氢氧化铁的沉淀要完全,加热煮沸的目的在于 使胶体状沉淀转化为易于过滤、洗涤的沉淀。 • ③ 减压过滤要规范。尤其注意在抽滤过程中,勿 用水冲洗粘附在烧杯和布氏滤斗上的少量绿色产 品,否则,将大大影响产量。
实验十一
三草酸合铁(III)酸 钾的制备及组成分析
一、实验目的
掌握无机制备的一般方法。
了解三草酸合铁(III)酸钾的性质和制备方法。
三草酸合铁(III)酸钾的性质
• 1 、 性 质 : 三 草 酸 合 铁 ( III ) 酸 钾
K3[Fe(C2O4)3]· 3H2O 为翠绿色单斜晶体,溶 于水,难溶于乙醇。 110℃失去三分子结晶 水, 230℃分解。该化合物对光敏感,光照 即发生分解。
三草酸合铁酸钾的制备与分析

三草酸合铁酸钾的制备与分析
一、三草酸合铁酸钾的制备方法:
1.氢氰酸法:
将氢氰酸加入到含铁离子的溶液中,然后加入过量的氢氧化钾溶液,
搅拌均匀并加热,得到三草酸合铁酸钾的沉淀。
反应方程式如下:6KOH+6HCN+FeCl3→K4[Fe(CN)6]+3KCl+6H2O
反应的温度和反应时间会影响产率和纯度。
2.氯化铁法:
将氯化铁溶液加入过量的氰化钾溶液中,搅拌均匀并加热,得到三草
酸合铁酸钾的沉淀。
反应方程式如下:
6KCN+FeCl3→K4[Fe(CN)6]+3KCl
该方法操作简单,但是氯化铁的溶液对皮肤有刺激性,需要注意安全。
二、三草酸合铁酸钾的分析方法:
1.离子交换色谱法:
离子交换色谱法可以用于分离和测定三草酸合铁酸钾。
将样品溶解在
适当的溶剂中,通过离子交换柱分离出三草酸合铁酸钾,并用紫外光谱仪
测定其吸收峰。
2.原子吸收光谱法:
原子吸收光谱法可以用于测定三草酸合铁酸钾中的铁离子含量。
将样品溶解在适当的溶剂中,然后经过适当的稀释,用原子吸收光谱仪测定其吸收峰。
3.毛细管电泳法:
毛细管电泳法可以用于分离和测定三草酸合铁酸钾。
将样品溶解在适当的溶剂中,通过毛细管电泳仪分离出三草酸合铁酸钾,并用紫外光谱仪测定其吸收峰。
无机化学实验3三草酸合铁酸钾的制备和性质
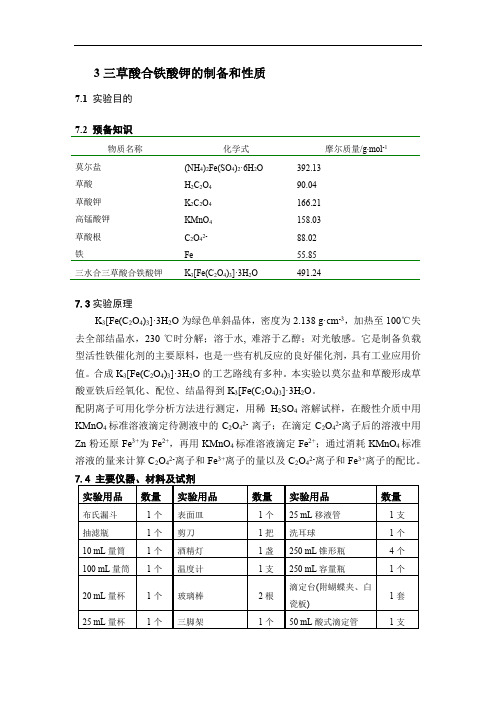
3三草酸合铁酸钾的制备和性质7.1 实验目的7.2 预备知识物质名称化学式摩尔质量/g∙mol-1莫尔盐(NH4)2Fe(SO4)2·6H2O392.13草酸H2C2O490.04草酸钾K2C2O4166.21高锰酸钾KMnO4158.03草酸根C2O42- 88.02铁Fe55.85三水合三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O491.247.3实验原理K3[Fe(C2O4)3]·3H2O为绿色单斜晶体,密度为2.138 g·cm-3,加热至100℃失去全部结晶水,230 ℃时分解;溶于水, 难溶于乙醇;对光敏感。
它是制备负载型活性铁催化剂的主要原料,也是一些有机反应的良好催化剂,具有工业应用价值。
合成K3[Fe(C2O4)3]·3H2O的工艺路线有多种。
本实验以莫尔盐和草酸形成草酸亚铁后经氧化、配位、结晶得到K3[Fe(C2O4)3]·3H2O。
配阴离子可用化学分析方法进行测定,用稀H2SO4溶解试样,在酸性介质中用KMnO4标准溶液滴定待测液中的C2O42-离子;在滴定C2O42-离子后的溶液中用Zn粉还原Fe3+为Fe2+,再用KMnO4标准溶液滴定Fe2+;通过消耗KMnO4标准溶液的量来计算C2O42-离子和Fe3+离子的量以及C2O42-离子和Fe3+离子的配比。
公用仪器、材料、试剂试剂名称位置试剂名称位置(NH4)2Fe(SO4)2·6H2O本实验桌Zn粉(A.R)本实验桌饱和草酸钾溶液本实验桌去离子水中间实验桌饱和草酸溶液本实验桌无水乙醇本实验桌标准浓度KMnO4溶液中间实验桌灯用酒精中间实验桌小纸条本实验桌及分析天平室真空系统实验桌正前上方冰块实验室临时提供称量纸本实验桌电子台秤(0.01g)本实验桌乙醇-丙酮1:1本实验桌H2O2 (w=5%)本实验桌水浴锅(用于分析)两人共用1套(本实验桌)注:实验结束后多余的产品回收到实验室指定的容器中。
三草酸根合铁(Ⅲ)酸钾的制备与分析

配合物的纯度可用氧化还原滴定法测定草酸根的含量或Fe 3+ 的含量来确定。
草酸根含量的测定可用高锰酸钾法,铁含量的测定可用重铬酸钾法。
重铬酸钾测定铁的含量,先用还原剂TiCl3将Fe 3+ 还原为Fe 2+,稍微过量的 TiCl3溶液将六价钨部分还原为五价钨(俗称钨蓝),使溶液呈蓝色。当钨蓝 刚好褪色时,于硫—磷混合酸介质中用 K2Cr2O7 标准溶液测定 Fe 2+ 含量, 主要反应如下: Fe 3+ + Ti 3+ + H2O == Fe 2+ + TiO 2+ + 2 H+ Cr2O7 2- + 6Fe 2+ + 14H+ == 2Cr 3+ + 6 Fe 3+ + 7H2O 根据滴定所用 K2Cr2O7 的浓度和体积,可计算 Fe 3+ 的含量。
学习动物精神
• 11、机智应变的猴子:工作的流程有时往往是一成不变的, 新人的优势在于不了解既有的做法,而能创造出新的创意 与点子。一味 地接受工作的交付, 只能学到工作方法 的皮毛,能思考应 变的人,才会学到 方法的精髓。
学习动物精神
• 12、善解人意的海豚:常常问自己:我是 主管该怎么办才能有助于更好的处理事情 的方法。在工作上善解人意, 会减轻主管、共 事者的负担,也 让你更具人缘。
2 O7
溶液至钨蓝刚好消失。加入硫磷混合酸溶液(附注3)10ml、
二苯胺磺酸钠指示剂5滴,立即用K2Cr 2O7 标准溶液滴定至出现紫色,
即为终点。计算Fe 3+含量。
思 考 题
1.在合成过程中加入3%H2O2后,为什么要加热煮沸溶液? 2.最后在溶液中加入10ml乙醇的作用是什么? 3.为什么K2Cr2O7可以直接配成标准溶液?KMnO4溶液也能直接配制吗?
三草酸合铁(Ⅲ)酸钾的制备、表征及性质研究

化学基础实验教学资料综合化学实验三草酸合铁(Ⅲ)酸钾的制备、表征 及性质研究【实验目的】 1.学习三草酸合铁(Ⅲ)酸钾的制备及表征方法。
2.学习配合物的制备、表征到性质研究的全过程。
【知识介绍】 三草酸合铁(Ⅲ)酸钾 K3[Fe(C2O4)3]·3H2O (分子量 491.2)为翠绿 色单斜晶系晶体,易溶于水( 0 ℃时, 4.7g/100g 水; 100 ℃时, 117.7g/100g 水) ,难溶于乙醇等有机溶剂。
110℃下可失去全部结晶 水,230℃时分解,550℃时的分解产物为 Fe2O3 和 K2CO3。
三草酸合铁(Ⅲ)酸钾的制备方法较多,常用硫酸亚铁铵与草酸反 应制得草酸亚铁, 然后在草酸钾溶液中用双氧水氧化草酸亚铁, 得到 三草酸合铁(Ⅲ)酸钾, 这个路线制备的产品质量较好, 但实验步骤多。
本实验以三氯化铁为起始原料, 在一定条件下直接与草酸钾反应 制备三草酸合铁(Ⅲ)酸钾,过程比较简单,易操作,产品经过重结晶 后,纯度较高。
主要反应式如下: FeCl3 + 3K2C2O4 + 3H2O = K3[Fe(C2O4)3] ·3H2O + 3KCl 测定三草酸合铁(Ⅲ)酸钾的各组分含量时,铁含量可选用磺基水 杨酸比色法、 高锰酸钾滴定法以及原子吸收分光光度法来确定; 钾含 量可采用原子吸收分光光度法、 离子选择电极法及四苯硼钠重量分析东 北 师 范 大 学 化 学 实 验 中 心1化学基础实验教学资料综合化学实验来测定, 本实验选用四苯硼钠法; 草酸根含量由高锰酸钾氧化还原滴 定法测定;结晶水含量由热重分析法确定。
通过电导法可确定配离子的电荷数, 进一步确定配合物的组成及 在溶液中的状态。
三草酸合铁(Ⅲ)酸钾对光敏感,易发生光化学反应,见光分解变 为黄色: 2K3[Fe(C2O4)3]= 2FeC2O4(淡黄色)+3K2C2O4+2CO2 光化学反应是指在紫外光、 可见光作用下发生的化学反应, 也就 是说光化学反应是由物质分子吸收光子后所引发的化学反应。
三草酸合铁(iii)酸钾的制备

三草酸合铁(iii)酸钾的制备
三草酸合铁(III)酸钾是一种无机化合物,分子式为Fe(C3H5O3)3K。
它是通过将三草酸铁(III)和钾碱在水溶液中反应得到的。
具体的合成方法如下:
1.预处理:准备好所需的三草酸铁(III)和钾碱。
2.反应:将三草酸铁(III)溶液和钾碱溶液在烧杯中混合,加热至70-80℃,调
节pH值至3-4,保持反应2-4小时。
3.离心:将反应液离心至清晰,得到的比较浓的溶液就是三草酸合铁(III)酸钾溶
液。
4.过滤:将三草酸合铁(III)酸钾溶液过滤,得到清晰的溶液。
5.结晶:将清晰的溶液加热至60-70℃,通过蒸发水分来获得三草酸合铁(III)酸
钾结晶。
6.洗涤:将三草酸合铁(III)酸钾结晶用净水洗涤干净,即可得到纯净的三草酸合
铁(III)酸钾。
注意:在合成过程中,应注意安全防护措施,并避免接触皮肤和眼睛。
三草酸根合铁(III)酸钾的制备、性质和组成分析

三草酸根合铁(III)酸钾的制备、性质和组成分析引言:三草酸根合铁(III)酸合成工艺有多种,例如,可采用氢氧化铁和草酸氢钾反应;也可用硫酸亚铁铵与草酸反应得到草酸亚铁,再在过量草酸根存在下用过氧化氢。
K3[Fe(C2O4)3]·3H2O为亮绿色晶体,溶于水(0℃时4.7g/100g水,100℃时117.7g/100g水),难溶于乙醇、丙酮等有机溶剂。
110℃失去结晶水,230℃分解。
该配合物对光敏感;可进行下列光反应:2 K3[Fe(C2O4)3] 2FeC2O4+3K2C2O4+2CO2因此,在实验室中可用碱草酸根含铁(III)酸钾作成感光纸;进行感光实验。
另外,由于它具有光的化学性质,能定量进行化学反应,常用作化学光量计材料。
一、实验目的1.掌握三草酸根合铁(III)酸钾的制备方法。
2.加深对铁(Ⅲ)和铁(Ⅱ)化合物性质的了解;3.掌握容量分析等基本操作。
4.学习用高锰酸钾法测定C2O2-4与Fe3+的原理和方法。
二、实验原理本实验采用三氯化铁和草酸钾直接反应制备。
Fecl3 +3K2C2O4== K3[Fe(C2O4)3] +3Kcl用稀H2SO4可使三草酸根合铁﹝III﹞酸钾分解产生Fe3+和C2O2-4,用高锰酸钾标准溶液滴定试样中的C2O2-4,此时Fe3+不干扰测定,滴定后的溶液用锌粉还原。
2Fe3+ +Zn==Zn2+ +2Fe2+过滤除去过量的锌粉,使用高锰酸钾标准溶液滴定Fe2+通过消耗高锰酸钾标准溶液的体积及浓液计算得到C2o2-4 和Fe3+的含量。
5Fe2+ + MnO4- + 8H+==5Fe3+ +Mn2+ +4H2O三、主要仪器和试剂台秤,抽滤瓶,布氏漏斗循环水泵,棕色容量瓶,烧杯,量筒,草酸钾(K2C2 O4 H2O,化学纯),三绿化铁(FeCl3 6H2O,化学纯),H2SO4(2mol/L,0.2mol/L) ,KMnO4标准溶液(0.0200mol/L),锌粉(分析纯),丙酮。
三草酸合铁(Ⅲ)酸钾的制备及性质

三草酸合铁(Ⅲ)酸钾的制备及性质一、实验目的1.了解三草酸合铁(Ⅲ)酸钾的制备方法;2.巩固无机制备实验的基本操作技能;3.了解三草酸合铁(Ⅲ)酸钾的性质二、实验原理三草酸合铁(Ⅲ)酸钾K3[Fe(C2O4)3·3H2O]为翠绿色单斜晶体,易溶于水,难溶于乙醇,110℃可失去全部结晶水,230℃时分解。
它是一种光敏物质,光照时会分解变色,常用作化学光量计。
另外,它是制备负载型活性铁催化剂的主要原料,也是一些有机反应的良好催化剂,在工业上具有一定的应用价值。
三草酸合铁(Ⅲ)酸钾的制备方法有多种,本实验采用的方法是首先由硫酸亚铁铵与草酸反应制备草酸亚铁:(NH4)2Fe(SO4)2·6H2O + H2C2O4 →FeC2O4·2H2O↓+ (NH4)2SO4 + H2SO4 + 4H2O然后在过量草酸根的存在下,用过氧化氢氧化草酸亚铁,即可得到三草酸合铁(Ⅲ)酸钾,同时有氢氧化铁产生:6FeC2O4·2H2O + 3H2O2 + 6K2C2O4 →4K3[Fe(C2O4)3] + 2Fe(OH)3↓+ 12H2O 加入适量的草酸可使氢氧化铁转化为三草酸合铁(Ⅲ)酸钾:2Fe(OH)3 + 3H2C2O4 + 3K2C2O4 →2K3[Fe(C2O4)3] + 6H2O 再加入乙醇,放置即可得到三草酸合铁(Ⅲ)酸钾晶体。
三、实验仪器及试剂烧杯(250 mL、100 mL)、量筒、试管、电子天平、恒温水浴锅、真空泵、抽滤瓶、漏斗(NH4)2Fe(SO4)2·6H2O (s)、H2SO4 (3 mol⋅L–1)、H2C2O4·2H2O (s)、H2O2 (6%)、K2C2O4 (饱和)、乙醇(95%)四、实验内容1. 三草酸合铁(Ⅲ)酸钾K3[Fe(C2O4)3·3H2O]的制备(1)制备FeC2O4·2H2O称取6.0 g自制的(NH4)2Fe(SO4)2·6H2O固体于250 mL烧杯中,加1 mL3 mol⋅L–1 H2SO4、20 mL去离子水,加热使之溶解。
三草酸合铁(III)酸钾的制备及组成测定

实验一三草酸合铁(III)酸钾的制备及组成测定一、实验目的1. 了解三草酸合铁(Ⅲ)酸钾的制备方法。
2. 掌握确定化合物化学式的基本原理和方法。
3. 巩固减压抽滤等的基本操作。
4. 掌握三草酸合铁(Ⅲ)酸钾各组成测定的原理和方法。
二、实验原理1. 三草酸合铁(III)酸钾的制备三草酸合铁(Ⅲ)酸钾为亮绿色单斜晶体,易溶于水而难溶于乙醇、丙酮等有机溶剂。
受热时,在110︒C下可失去结晶水,到230︒C即分解。
该配合物为光敏物质,光照下易分解。
利用(NH4)2Fe(SO4)2和H2C2O4反应制取FeC2O4:(NH4)2Fe(SO4)2 + H2C2O4 = FeC2O4↓ + (NH4)2SO4 + H2SO4在过量K2C2O4存在下,用H2O2氧化FeC2O4即可制得产物:6FeC2O4 + 3H2O2 + 6K2C2O4 = 2Fe(OH)3↓ + 4K3[Fe(C2O4)3]反应中产生的Fe(OH)3可加入适量的H2C2O4也将其转化为产物:2Fe(OH)3 + 3H2C2O4 + 3K2C2O4 = 2K3[Fe(C2O4)3] + 6H2O2. 三草酸合铁(III)酸钾组成分析(1) 用重量分析法测定结晶水含量将一定量K3[Fe(C2O4)3]产物在110︒C下干燥,根据失重情况可计算出结晶水的含量。
(2) 用高锰酸钾法测定草酸根含量5C2O42- + 2MnO4- + 16H+ = 2Mn2+ + 10CO2 + 6H2O 用已知浓度的KMnO4标准溶液滴定C2O42-,由所消耗的KMnO4的量计算出C2O42-的含量。
(3) 用高锰酸钾法测定铁含量Zn + Fe3+ = Zn2+ + Fe2+5Fe2+ + MnO4- + 8H+ = Mn2+ + 5Fe3+ + 4H2O由消耗的的KMnO4的量计算出Fe3+的含量。
(4) 确定钾含量钾含量由配合物总量减去结晶水、C2O42-和Fe3+的含量得到的。
三草酸合铁(III)酸钾制备及其光化学性质

10cm3乙醇,冰水冷却,观察晶体析出( 若无 晶体出现,可滴加几滴KNO3溶液)
抽滤,乙醇10cm3淋洗 晾干,称重,计算产率
实验要点
3. 配合物光化学活性试验
取少量产品(~0.3g),配成1%的溶液 用玻璃棒蘸取少量溶液,在一张纸上描画一些
抽滤 洗涤 三草酸合 铁(III)酸钾
比实验步骤少H2O2的氧化 Fe2(C2O4)3∙5H2O溶解度较大,分离提纯较为复
杂;FeCl3纯度也较低
问题与讨论
K体NKON3O溶3液 可的以加吗快?结晶速度的原理是什么?固 原理:盐析现象
某些物质易形成胶体或过饱和溶液,此时加入 少量无机盐,会发生胶体凝聚,从而以固体形 式析出
光化学反应是由 光子供给能量来 进行的化学反应
三草酸合铁(III)配离子对于光量子的作用存在 较为直观的定量关系,在光化学研究上常作为 测定光量子效率的试剂
在紫外光作用下,配离子吸收一个光量子后活 化,并进一步发生离子的电子转移
2[Fe(C2O4)3]3- 2h 2[Fe(C2O4)3]3-* = 2Fe2+ + 2CO2 + 5C2O42-
三草酸合铁(III)酸钾制 备及其光化学性质
1. 实验目的
制备标题配合物,加深对铁(II)和铁(III)化合物 性质的了解
了解光化学反应的原理
2. 基本原理
三草酸合铁(III)酸钾为绿色单斜晶体,水中溶 解度4.7g,难溶于有机溶剂。具有光敏活性, 为早期工程晒图材料
本实验首先用硫酸亚铁铵与草酸作用
晾干后就成为蓝底白线的蓝图
实验流程图
草酸
倾析洗涤
实验三草酸合铁酸钾的制备

实验三草酸合铁酸钾的制备、组成测定及性质一、实验目的1. 了解利用沉淀、氧化还原、配位等反应制取K3Fe[(C2O4)3]·3H2O方法。
2. 加深对铁(Ⅲ)和铁(Ⅱ)化合物性质的了解3. 掌握容量分析等基本操作二、实验原理三草酸合铁(Ⅲ)酸钾,即K3Fe[(C2O4)3]·3H2O,为翠绿色单斜晶体,溶于水,难溶于乙醇。
110℃下失去三分子结晶水而成为K3Fe[(C2O4)3],230℃时分解。
该配合物对光敏感,光照下即发生分解。
三草酸合铁(Ⅲ)酸钾是制备负载型活性铁催化剂的主要原料,也是一些有机反应很好的催化剂,因而具有工业生产价值。
目前,合成三草酸合铁(Ⅲ)酸钾的工艺路线有多种。
例如,可以铁为原料制得硫酸亚铁胺,加草酸钾制得草酸亚铁后经氧化制得三草酸合铁(Ⅲ)酸钾;或以硫酸亚铁加草酸钾形成草酸亚铁经氧化结晶得三草酸合铁(Ⅲ)酸钾,亦可以三氯化铁、硫酸铁或硝酸铁与草酸钾直接合成三草酸合铁(Ⅲ)酸钾。
本实验以硫酸亚铁铵为原料,与草酸在酸性溶液中先制得草酸亚铁沉淀,然后再用草酸亚铁在草酸钾和草酸的存在下,以过氧化氢为氧化剂,得到铁(Ⅲ)草酸配合物。
改变溶剂极性并加少量盐析剂,可析出绿色单斜晶体纯的三草酸合铁(Ⅲ)酸钾。
用KMnO4标准溶液在酸性介质中滴定测得草酸根的含量,可以确定配离子的组成。
先用过量锌粉将Fe3+还原为Fe2+,然后再用KMnO4标准溶液滴定。
反应式为:5C2O42- + 2MnO4- + 16H+ = 10CO2↑ + 2Mn2+ + 8H2O5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O(NH4)2Fe(SO4)2 + H2C2O4 + 2H2O = FeC2O4·2H2O↓ + (NH4)2SO4 + H2SO42 FeC2O4·2H2O + H2O2 + 3K2C2O4 + H2C2O4 = 2K3[Fe(C2O4)3]·3H2O三、仪器和药品普通电子天平,精密电子天平,抽滤装置,烧杯(100 mL),电炉,3个锥形瓶(250 mL),酸式滴定管(50mL),表面皿,称量瓶,温度计,量筒(50 mL,100 mL)。
三草酸合铁酸钾制备

冰水浴
将晶体用少量乙醇洗涤, 用滤纸吸干。
称重
黄色
产率计算
理论产量:5g (NH4)2Fe(SO4)26H2O 物 质的量0.0128mol、2gKOH物质的量
0.0357mol、4g H2C2O42H2O 物质的量 0.0317 mol,计算理论产量以哪个为基准?
产率=
实际产量 理论产量
100%
1)总结制备实验成功的关键点 2)P203,问题与讨论(2)(3)
下次实验
铜碘化物的制备及其实验式的确定 5月7日7:30 11J3202
(翠绿色晶体、鲜艳粗大)
二、实验原理
(二)三草酸合铁(Ⅲ)酸钾的感光性质
1、极易感光:
2[Fe(C2O4 )3 ]3
.. .hv... 室温
2FeC2O4
黄色
3C2O4 2
2CO2
2、日光直射或强光下:
3FeC2O4
2K3[Fe(CN
)6
]
...hv... 强光
Fe3[Fe(CN
)6
]2
(NH4)2SO4·FeSO4·6H2O的摩尔质量:392.13g/mol
三、实验步骤
② 三草酸合铁(Ⅲ)酸钾的制备 :
2g氢氧化钾和4g草酸溶解在 50ml水中,加热使其完全溶解
在搅动下,将氢氧化铁沉淀加入。加热, 使氢氧化铁溶解。
常压过滤,除去不溶物, 将滤液收集在蒸发皿中
在水浴上浓缩至10ml
Fe(OH)2
Fe(OH)3
(NH4)2SO4·FeSO4·6H2O Fe2++2NH3·H2O===Fe(OH)2↓+2NH4+
KOH +
三草酸合铁酸钾的制备讲义

三草酸合铁酸钾的制备一、实验目的1.掌握用自制(NH4)2Fe(SO4)2合成K3Fe[(C2O4)3]·3H2O的基本原理和操作技术;2.加深对Fe(Ⅲ)和Fe(Ⅱ)化合物性质的了解。
3. 掌握确定化合物化学式的基本原理及方法;4. 学习热重、差热分析、磁化率测定、红外光谱分析的操作技术;5. 通过综合性实验的基本训练,培养学生分析与解决复杂问题的能力。
二、实验原理1.三草酸合铁(III)酸钾的性质与制备(1)性质:三草酸合铁(III)酸钾(含三个结晶水)为翠绿色的单斜晶体,易溶于水(溶解度0℃,4.7g/100g;100℃,117.7g/100g),难溶于乙醇。
110℃下可失去全部结晶水,230℃时分解。
此配合物对光敏感,受光照射分解变为黄色。
因其具有光敏性,所以常用来作为化学光量计。
另外它是制备某些活性铁催化剂的主要原料,也是一些有机反应良好的催化剂,在工业上具有一定的应用价值。
(2)制备:本实验以硫酸亚铁铵为原料,与草酸在酸性溶液中先制得草酸亚铁沉淀,然后再用草酸亚铁在草酸钾和草酸的存在下,以过氧化氢为氧化剂,得到铁(Ⅲ)草酸配合物。
主要反应为:(NH4)2Fe(SO4)2 + H2C2O4 + 2H2O = FeC2O4·2H2O↓+ (NH4)2SO4 + H2SO42FeC2O4·2H2O + H2O2 + 3K2C2O4 + H2C2O4 ===2K3[Fe(C2O4)3]·3H2O2.产物的定性分析(1)化学分析鉴定:K +离子与酒石酸氢钠溶液产生白色沉淀;Fe 3+与KSCN 溶液混合,生成[Fe (NCS )n ]3-n 配离子,呈血红色,而[Fe(C 2O 4)3]与KSN 溶液无现象。
(2)红外光谱鉴定:C 2O 42-及结晶水通过红外光谱分析。
结晶水的吸收带在3550—3220/ cm -1之间,一般在3450/ cm -1附近。
三草酸合铁(Ⅲ)酸钾的制备

2.三草酸合铁酸钾的制备
(1)沉淀 上述溶液中加20 mL饱和H2C2O4,搅拌并加
热煮沸,形成黄色FeC2O4·2H2O沉淀。倾析法弃去上 层清夜(静置分层,倒去上层清液)。用去离子水 洗涤该沉淀2次,每次加入25 mL去离子水,搅拌并 在沸水浴中温热(用250 mL的烧杯做水浴),静 置,弃去上清液,除去可溶性杂质。
(2)氧化 在上述沉淀中加入10 mL饱和K2C2O4溶液,水浴 加热至40℃,慢慢滴加20 mL 3% H2O2溶液,搅拌并 维持温度在40℃左右,使Fe(II)充分氧化为Fe(III) (5分钟左右)。滴加完毕后,加热至沸以除去过量 的H2O2(最终体积控制在20 mL左右)
(3)生成配合物 • 保持上述沉淀近沸状态,先加入饱和H2C2O4 7 mL,继续 加热,溶液会渐渐的变清,然后趁热再滴加饱和 H2C2O4 2-3 mL 使沉淀溶解。此时溶液为翠绿色,如有浑浊可趁热过滤。 滤液中加入15 mL 95%乙醇。用表面皿将烧杯盖好,冷却、 结晶、抽滤,用10 mL 95%乙醇洗涤2次。得三草酸合铁 (III)酸钾K3[Fe(C2O4)3]3H2O晶体。称重、计算产率。
三草酸合铁(Ⅲ)酸钾的制备
实验目的:
1.了解利用沉淀、氧化还原、 配位反应 等制取三草酸合铁 (Ⅲ)酸钾的方法; 2.进一步掌握无机制备实验的基本操作技能。
实验原理
• K3[Fe(C2O4)3]·3H2O:绿色单斜晶体,溶于水,难溶于 乙醇。110℃失去结晶水,230℃时分解。具有光敏性, 光照分解,应避光保存。 • 本实验以FeSO4·7H2O为原料,通过沉淀、氧化还原、配 位等多步反应,最后制得K3[Fe(C2O4)3].3H2O。
主要反应为: Fe+H2SO4 FeSO4+H2 FeC2O4.2H2O+H2SO4
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
过滤
用倾析法将上层清液倾出,抽滤,滤渣 用20cm3 1mol·dm-3 H2SO4浸洗抽滤,弃 去滤渣,将溶液倒在一起。
返回
氧化
将翠绿色滤液加热至近沸,向热滤液中 慢慢加入1g KClO3晶体,并不断搅拌, 至滤液变为黄近沸。在维持近 沸的温度(90~95°C)下,逐滴加入 6mol·dm-3 NaOH溶液,不断搅拌,并随 时用pH试纸检验溶液的酸度,要求水解 反应在pH=1~2下进行,直至有砖红色沉 淀析出,保持90~95°C 0.5h,停止加热。
从废钒催化剂中回收五氧化二 钒
目的要求 实验原理 实验用品 实验步骤 思考题
目的要求
进一步锻炼设计实验的能力 了解钒(V)的性质 练习分离、沉淀、过滤等基本操作
返回
实验原理
ClO3- + 6VO2+ + 3H2O = 6VO2+ + Cl- + 6H+ 2VO2+ +H2O=V2O5 + 2H+
返回
实验用品
仪器:研钵、抽滤瓶、布氏漏斗、蒸发 皿、烧杯、量筒
药品:废钒催化剂、H2SO4溶液 (1mol·dm-3,2mol·dm-3)、KClO3(晶 体)、NaOH溶液( 6mol·dm-3 )
材料:pH试纸
返回
实验步骤
浸出 过滤 氧化 水解 分离
返回
浸出
称取50g研细的废钒催化剂,加入 120cm3 2mol·dm-3 H2SO4溶液,充分搅 动1h。
返回
分离
将所得砖红色沉淀抽滤,用少量蒸馏水 洗涤,抽干,称重。
返回
思考题
写出各步实验现象和反应的化学方程式。
返回
